Method Article
Istituzione di un modello di embolia polmonare minimamente invasivo per ratti utilizzando coaguli di sangue autologhi
In questo articolo
Riepilogo
Viene descritta una metodologia dettagliata per stabilire un modello minimamente invasivo di embolia polmonare nel ratto utilizzando coaguli di sangue autologhi. Vengono inoltre forniti ulteriori metodi per quantificare l'area infartuata e visualizzare l'albero arterioso polmonare.
Abstract
L'embolia polmonare (EP) è una delle principali cause di morte cardiovascolare, con conseguente onere socioeconomico significativo. Sebbene i trattamenti attuali si concentrino principalmente sull'anticoagulazione e sulla trombolisi, vi è un urgente bisogno di una migliore comprensione della sua fisiopatologia e dello sviluppo di nuove strategie di trattamento. I modelli animali svolgono un ruolo cruciale nella comprensione dell'EP e nello sviluppo di nuove terapie per la malattia, con i roditori comunemente utilizzati per considerazioni etiche e di costo. Tuttavia, i modelli esistenti di roditori per l'EP sono limitati dalla mancanza di procedure standardizzate, che ostacolano la riproducibilità e i confronti tra studi. Questo studio mira a stabilire un modello di ratto minimamente invasivo di EP utilizzando coaguli di sangue autologhi. Il modello presenta una tecnica di prelievo di sangue minimamente invasiva, una procedura standardizzata di generazione di trombi e un accesso venoso minimamente invasivo. Inoltre, vengono forniti protocolli per la quantificazione delle aree infartuate e la visualizzazione dell'albero arterioso polmonare. Queste procedure mirano a migliorare l'affidabilità dei modelli di roditori per lo studio della progressione dell'EP e a facilitare lo sviluppo di nuovi trattamenti.
Introduzione
L'embolia polmonare (EP) è una delle principali cause di morte intraospedaliera e la terza causa più frequente di morte cardiovascolare. Nonostante la sua elevata incidenza, la prevenzione e la diagnosi tempestiva rimangono impegnative 1,2. Le terapie anticoagulanti e trombolitiche sono fondamentali nel trattamento dell'EP, ma una comprensione più profonda della progressione della malattia e nuovi approcci terapeutici è essenziale per migliorare la gestione della malattia3.
Nella moderna ricerca biomedica, i modelli animali svolgono un ruolo fondamentale nel chiarire i meccanismi delle malattie umane e nello sviluppo di nuove terapie 4,5. Topi, ratti, criceti e conigli sono spesso utilizzati nella modellazione PE a causa di considerazioni etiche e di economicità 6,7,8,9,10. Gli approcci di modellazione PE generalmente si dividono in tre categorie: formazione di trombi in vivo, iniezione di coaguli di sangue in vitro e somministrazione di particelle non trombotiche. La scelta delle specie animali e della tecnica di modellazione è determinata dagli obiettivi specifici della ricerca, poiché nessun singolo modello è adatto a tutti gli scopi. Ad esempio, gli studi incentrati sull'esplorazione di nuove terapie trombolitiche spesso impiegano modelli che coinvolgono coaguli di sangue autologhi invece di particelle non trombotiche.
Gli attuali metodi per la modellazione dell'EP nei roditori affrontano sfide a causa della mancanza di metodologie dettagliate e standardizzate. Ciò influisce su processi chiave come il prelievo di sangue, la formazione di coaguli di sangue e la successiva embolizzazione, tutti fondamentali per garantire risultati riproducibili in tutti gli studi. Inoltre, c'è una lacuna significativa nella capacità di quantificare l'area embolizzata e mappare accuratamente la distribuzione degli emboli dopo l'embolizzazione. Affrontare queste carenze è essenziale per migliorare l'affidabilità e l'utilità dei modelli di roditori nella ricerca sull'EP.
In questo studio, vengono descritti protocolli dettagliati per stabilire un modello di PE nel ratto utilizzando coaguli di sangue autologhi. Questo modello presenta una tecnica di prelievo del sangue minimamente invasiva, una procedura standardizzata di generazione di trombi e un accesso venoso minimamente invasivo. Inoltre, vengono forniti protocolli per quantificare le aree infartuate nei polmoni e visualizzare l'albero arterioso polmonare, che possono facilitare ulteriori scoperte di ricerca.
Protocollo
Tutti gli esperimenti sugli animali sono stati condotti con l'approvazione del Comitato per la cura e l'uso degli animali dell'Accademia cinese delle scienze mediche e del Peking Union Medical College (numero di approvazione: IRM/2-1ACUC-2311-015). In questo studio sono stati utilizzati ratti maschi di Sprague-Dawley, di 6 settimane di età e del peso di circa 250 g. Gli animali sono stati alloggiati in un ambiente specifico privo di agenti patogeni con accesso ad libitum a una dieta equilibrata e acqua. Sono stati mantenuti sotto un ciclo luce/buio di 12 ore a una temperatura ambiente di 22 °C ± 2 °C. Gli animali sono stati lasciati adattare all'ambiente per 1 settimana prima di sottoporsi a qualsiasi procedura chirurgica. I dettagli dei reagenti e delle attrezzature utilizzate in questo studio sono elencati nella Tabella dei materiali.
1. Attrezzature e materiali
- Attrezzatura per anestesia: utilizzare una macchina per anestesia gassosa per piccoli animali e isoflurano.
- Materiale chirurgico: Preparare tamponi di cotone, disinfettante iodoforico, uno stereomicroscopio, un rasoio, nastro medico, una siringa da 1 ml con ago da 27 G, una siringa da 5 ml, una siringa da 10 ml, soluzione fisiologica normale, una garza, 8-0 fili di nylon, filo di nylon 6-0 con ago da sutura, micro pinze emostatiche, micro pinzette e forbici fini.
- Altri materiali: Procurarsi aghi da dispensazione da 19 G e 18 G compatibili con siringhe mediche, un tubo in silicone con diametro interno di 1,2 mm e lunghezza di 10 cm, un tubo per infusione con diametro interno di 3,0 mm e lunghezza di 20 cm, una provetta da centrifuga da 1,5 ml, una pipetta e puntali per pipette.
- Generatore di trombi autocostruito e iniettore di coaguli di sangue (Figura 1): collegare il tubo di silicone all'ago di erogazione da 19 G collegato a una siringa da 1 ml per creare il generatore di trombi. Collegare un'estremità della provetta per infusione all'ago da 18 G e collegare l'altra estremità a una siringa da 5 ml per creare l'iniettore di coagulo.
2. Preparazione di coaguli di sangue autologhi
- Anestesia
- Posizionare l'animale all'interno della camera di induzione dell'anestesia e somministrare una miscela di isoflurano al 4% con aria ambiente a una portata di 2 L/min per 2-3 minuti (seguendo protocolli istituzionalmente approvati).
- Posizionare l'animale sulla piattaforma operativa in posizione supina. Mantenere l'anestesia somministrando isoflurano al 2,5% a una velocità di flusso di 0,4 L/min. Testare il riflesso del pedale per assicurarsi che si ottenga un'anestesia adeguata.
- Estendi entrambi gli arti anteriori orizzontalmente dal corpo ed estendi gli arti posteriori per esporre adeguatamente la zona inguinale. Fissare l'animale in questa posizione utilizzando del nastro adesivo (Figura 2A).
- Prelievo di sangue attraverso la vena cava cranica (CVC)
- Rimuovere i peli intorno al manubrio usando un rasoio e una crema depilatoria. Disinfettare la pelle con iodofor.
- Inserire verticalmente l'ago da 27 G collegato alla siringa da 1 ml a una profondità di 8 mm per perforare il CVC sinistro o destro, come mostrato nella Figura 2A.
NOTA: La sporgenza della superficie corporea del CVC è di 5 mm lateralmente al manubrio. È possibile utilizzare entrambi i lati e la scelta non influisce sui passaggi successivi. - Tenere la siringa e tirare delicatamente indietro lo stantuffo per creare una pressione negativa all'interno del cilindro. Estrarre gradualmente l'ago fino a quando il sangue non entra, quindi mantenere tale posizione fino a quando non vengono raccolti 0,3 ml di sangue (Figura 2B).
- Preparazione del coagulo di sangue
- Spingere il sangue raccolto in una provetta da centrifuga da 1,5 mL, facendo attenzione a non produrre bolle.
- Aspirare il sangue nel tubo di silicone del generatore di trombi autocostruito fino a quando la colonna sanguigno non raggiunge i 10 cm di lunghezza.
NOTA: Eseguire rapidamente questi due passaggi, poiché la coagulazione inizierà e si propagherà nella provetta da centrifuga, riducendo la qualità dei coaguli di sangue raccolti. - Attendere 30 minuti fino a quando il sangue non è completamente trombizzato. Durante questo periodo, prepara le colonne di sangue per altri animali allo stesso modo.
- Sciacquare la colonna di sangue trombizzata in una piastra di Petri contenente soluzione fisiologica normale e lavare la colonna tromboidale con soluzione fisiologica normale tre volte (Figura 2C).
- Utilizzare le forbici sottili per tagliare la colonna trombica in coaguli di sangue uniformi, ciascuno di 4 mm di lunghezza (Figura 2D). Aspirare 10-20 coaguli nell'iniettore autocostruito pre-riempito con 2 mL di soluzione fisiologica.
NOTA: La lunghezza dei coaguli di sangue non deve superare 1 cm, altrimenti rimarranno intrappolati nel ventricolo destro.
3. Preparazione dell'accesso alle vene
- Esposizione dei vasi epigastrici superficiali
- Anestetizzare e fissare l'animale come descritto al punto 2.1.
- Radere i peli che circondano la zona inguinale sinistra. Applicare la crema depilatoria su queste aree, attendere 1 minuto, quindi rimuovere la crema con una garza. Disinfettare la pelle con iodofor.
- Praticare un'incisione cutanea di 5 mm sopra l'origine dei vasi epigastrici superficiali nella zona inguinale. Di solito, l'origine dei vasi epigastrici superficiali può essere tracciata osservando una piccola pulsazione nella zona inguinale.
- Utilizzando uno stereomicroscopio con ingrandimento 10x, separare un sottile strato di grasso sottocutaneo per esporre i vasi epigastrici superficiali (Figura 3A).
- Isolare la vena epigastrica superficiale
- Isolare attentamente la vena epigastrica superficiale dall'arteria, dal nervo e dal tessuto adiposo. Esegui questa operazione sia prossimalmente, fino al punto in cui drena nella vena femorale, sia distalmente, fino alla prima biforcazione venosa.
- Legare il lato distale con 8-0 infilare e bloccare il filo con un micro-morsetto. Controlla il lato prossimale con un 8-0 anello del filo attaccato a un altro micro-clamp (Figura 3B).
- Praticare una piccola incisione trasversale sul lato distale della vena isolata. Controllare il lato prossimale per evitare sanguinamenti. Sciacquare il sangue rimanente nel lume venoso con soluzione fisiologica. Una volta che la vena è chiara, utilizzare delle micro pinzette per allargare l'incisione venosa.
4. Embolizzazione
- Incannulamento venoso
- Inserire delicatamente l'ago dell'iniettore autocostruito nella vena attraverso l'incisione venosa. Fissare l'ago con un terzo morsetto per evitare che scivoli fuori dalla vena.
- Procedura di embolizzazione
- Spingere lentamente lo stantuffo per somministrare una piccola quantità di soluzione fisiologica. La pienezza della vena senza resistenza indica un accesso non ostruito alla vena (Figura 3D).
- Continuare a spingere lo stantuffo per somministrare coaguli nella vena femorale attraverso l'accesso superficiale della vena epigastrica. Controllare la velocità di embolizzazione a 5 emboli al minuto. Monitorare la respirazione dell'animale; La dispnea emergente ed esacerbante indica il successo dell'embolizzazione.
- Dopo aver iniettato la quantità predefinita di coaguli di sangue, ritirare l'ago e legare il lato prossimale della vena epigastrica superficiale.
- Sutura l'incisione e metti l'animale in una scatola calda. Trasferisci l'animale nella sua gabbia una volta che si è svegliato.
5. Quantificazione dell'area infartuata
- Eutanasia e perfusione cardiaca
- Aggiungere 25.000 U di eparina sodica a 250 ml di soluzione fisiologica normale e mescolare accuratamente. Collegare il flacone a un dispositivo di infusione e appendere il flacone capovolto a un'altezza di 80 cm. Chiudere la valvola del dispositivo di infusione.
- Eutanasia degli animali con un sovradosaggio di isoflurano (seguendo protocolli istituzionalmente approvati).
- Taglia le costole con grandi forbici e apri il torace, evitando danni ai polmoni e ai vasi grandi.
- Inserire l'ago del dispositivo di infusione nel ventricolo sinistro. Aprire la valvola del dispositivo di infusione per consentire l'infusione di soluzione salina eparinizzata. Usa le forbici per tagliare la vena cava inferiore e l'appendice sinistra per consentire il drenaggio. Controllare la velocità di perfusione a 50 mL/min.
NOTA: Durante questa procedura, il tessuto polmonare normale diventerà bianco, mentre la zona embolizzata rimarrà arrugginita. - Dopo aver completato la perfusione con soluzione fisiologica eparinizzato, perforare il tronco dell'arteria polmonare attraverso il ventricolo destro utilizzando una siringa da 10 ml riempita con una soluzione di paraformaldeide al 4%. Fissare il tessuto polmonare eseguendo la perfusione di paraformaldeide al 4% attraverso i polmoni per un volume totale di 30 ml.
- Introduzione di un indice chiamato Rapporto di infarto
- Dopo la fissazione, asportare i polmoni, il cuore, la trachea, l'esofago, il timo e i grandi vasi nel loro insieme dalla colonna vertebrale e dal diaframma11.
- Rimuovere con cura l'esofago, il timo e il tessuto adiposo dalla massa iniziale, lasciando solo il cuore, i polmoni e i grandi vasi.
- Immergere la parte rimanente in un volume adeguato di soluzione di paraformaldeide al 4% per almeno 48 ore.
- Utilizzare una bilancia analitica per pesare l'intero polmone. Usa le forbici sottili per separare la parte infartuata dei polmoni e pesa il tessuto infartuato con la stessa bilancia. Calcola il rapporto di infarto utilizzando la seguente equazione:
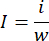
i è il peso del tessuto infartuato, w è il peso dell'intero polmone, I rappresenta il rapporto di infarto. - Dopo aver quantificato l'area infartuata, tagliare il tessuto polmonare fissato con paraformaldeide per l'inclusione di paraffina11.
6. Visualizzazione dell'albero arterioso polmonare
- Fusione dell'arteria polmonare
- Sopprimere l'animale ed eseguire la perfusione cardiaca come descritto al punto 5.1.
- Aggiungere una quantità uguale (in peso) di diluente al composto di colata in silicone, frullare la miscela e quindi aggiungere il 5% (in peso o volume) dell'agente indurente. Frullare nuovamente il composto.
- Aspirare 1 mL di miscela in una siringa da 1 mL, scaricare l'aria e inserire l'ago nel tronco dell'arteria polmonare attraverso il ventricolo destro. Fissare l'ago all'arteria polmonare per evitare lo scivolamento e il riflusso.
- Premere delicatamente lo stantuffo per consentire alla miscela di colata di silicone di riempire l'albero arterioso polmonare. Le aree polmonari normali saranno colorate dalla miscela di colata, mentre le aree infartuate rimarranno rosso ruggine.
NOTA: Il calco dell'arteria polmonare deve essere applicato solo al tessuto polmonare intatto. In genere, 0,6-0,8 ml della miscela di colata sono sufficienti per riempire l'albero arterioso polmonare. L'iniezione eccessiva della miscela di colata può portare al calco della vena polmonare, che influisce sulla visualizzazione dell'albero arterioso polmonare. La miscela di colata deve essere utilizzata entro 20 minuti dall'aggiunta dell'agente indurente, poiché cristallizzerà oltre questo tempo. - Estrarre la siringa dopo aver colato la perfusione, legare il tronco dell'arteria polmonare e prelevare i polmoni, il cuore e i grandi vasi sanguigni come descritto al punto 5.2. Mettere l'intera massa in una capsula di Petri e conservarla in frigorifero a 4 °C per una notte per consentire alla miscela di colata di cristallizzare.
- Pulizia e visualizzazione
- Rimuovere il cuore e i vasi sanguigni grandi dai polmoni con le forbici, quindi pulire i detriti della miscela di polimerizzazione dalla superficie polmonare.
- Immergere i polmoni in sequenza in soluzioni di alcol etilico al 25%, 50%, 75%, 95% e 100%, ciascuna per 24 ore. Questa procedura disidraterà completamente i polmoni.
- Immergere i polmoni disidratati nel salicilato di metile per 24 ore. Dopo questo processo di pulizia, l'albero arterioso polmonare sarà visibile e si potranno vedere anche gli emboli, poiché il salicilato di metile non elimina l'emoglobina (Figura 4B, D).
Risultati
Sintomi e patologia del modello di PE
Durante l'embolizzazione, i ratti hanno sperimentato mancanza di respiro e il torace ha mostrato fluttuazioni ampliate. Quasi tutti gli animali sono sopravvissuti all'episodio di embolia polmonare quando sono stati somministrati meno di 10 cm di coaguli di sangue (14 su 15 animali modellati). Dopo essere stati riportati nelle loro gabbie, gli animali si sono raggomitolati negli angoli e hanno mostrato un ridotto interesse per il cibo e l'acqua. Tuttavia, questi sintomi si sono risolti rapidamente e nel giro di poche ore gli animali si sono comportati normalmente. Non c'è stata alcuna differenza significativa di peso tra il basale e 24 ore dopo l'embolizzazione (341,8 ± 10,4 vs. 343,3 ± 8,5, p = 0,25).
La patologia macroscopica ha rivelato che le aree embolizzate (infartuate) erano a forma di cuneo, per lo più situate nella parte inferiore dei polmoni, con bordi chiari. Gli emboli sono stati trovati all'apice delle aree infartuate, bloccando il primo e il ramo secondario dell'arteria polmonare. La patologia microscopica con colorazione ematossilina-eosina ha confermato l'embolizzazione di un ramo dell'arteria polmonare (Figura 4F).
Carico di coaguli di sangue e area infartuata
In un'indagine preliminare sull'impatto del carico di coaguli di sangue sull'infarto polmonare, abbiamo testato sia un basso carico di coaguli di sangue (6 cm di colonna trombale, 15 coaguli) che un carico di coaguli di sangue elevato (10 cm di colonna trombale, 25 coaguli). Come previsto, un carico più elevato di emboli ha provocato un'area più ampia di infarto polmonare (Figura 5A-C).
Fibrinolisi intrinseca entro 24 ore
Rispetto ai campioni polmonari prelevati immediatamente dopo l'embolizzazione, i campioni polmonari raccolti 24 ore dopo l'embolizzazione hanno mostrato aree infartuate marcatamente ridotte, indicando un forte potenziale intrinseco di fibrinolisi nei ratti (Figura 5D).
Figura 1: Costruzione del generatore di trombi e dell'iniettore di coaguli di sangue. (A) Il generatore di trombi è stato assemblato collegando un tubo di silicone a un ago di dispensazione da 18 G (diametro esterno 12 mm) e una siringa da 1 mL pre-riempita con 0,5 mL di soluzione fisiologica normale. (B) L'iniettore di coaguli di sangue è stato costruito collegando un ago di dispensazione da 19 G (diametro interno 0,84 mm, diametro esterno 1,08 mm) a una provetta per infusione (contenitore per coaguli) e una siringa da 5 ml preriempita con 2 ml di soluzione fisiologica normale. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2: Prelievo di sangue e preparazione del coagulo. (A) Il ratto è stato anestetizzato e fissato in posizione supina. Il cerchio bianco con una linea tratteggiata indica il manubrio, che funge da marcatore della superficie del corpo. I punti rossi accanto al cerchio bianco indicano i siti di puntura per l'accesso alle vene cave craniche bilaterali (CVC). La parte inferiore della figura mostra un'illustrazione autoptica delle posizioni relative del manubrio, dei CVC e dei siti di puntura. (B) Campionamento di sangue riuscito attraverso il CVC destro. (C) Colonna di sangue trombizzata che viene espulsa dal generatore di trombi autocostruito. (D) Coaguli di sangue derivati dalla colonna di sangue trombizzata. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 3: Accesso alle vene ed embolizzazione. (A) Esposizione dei vasi epigastrici superficiali attraverso un'incisione cutanea di 5 mm, con la freccia blu che indica la vena epigastrica superficiale e la freccia rossa che indica l'arteria epigastrica superficiale. (B) Isolamento della vena epigastrica superficiale dal tessuto circostante e controllo della vena con fili di nylon. (C) L'iniettore autocostruito contenente coaguli di sangue. (D) Incannulamento della vena con l'ago di erogazione dell'iniettore autocostruito e somministrazione di coaguli di sangue attraverso l'accesso venoso. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 4: Patologia dell'embolia polmonare. (A) Polmoni normali dopo perfusione salina cardiaca e fissazione con paraformaldeide al 4%. (B) Polmoni normali visualizzati mediante miscela di colata di silicone e chiarificazione di salicilato di metile, che mostrano un albero dell'arteria polmonare pervio e una microvascolarizzazione. (C) Polmoni subito dopo l'embolizzazione con coaguli di sangue autologhi, con aree marcate che indicano un infarto polmonare dovuto all'embolizzazione. (D) Polmoni malati visualizzati mediante colata di miscela di silicone e pulizia del salicilato di metile, con frecce nere che indicano emboli che ostruiscono i rami dell'arteria polmonare e cerchi tratteggiati bianchi che indicano le aree colpite, che sono infartuate. (E) Dissezione del lobo polmonare sinistro che mostra emboli (frecce rosse) nei rami dell'arteria polmonare. (F) Immagini microscopiche dell'embolizzazione del coagulo di sangue in un ramo dell'arteria polmonare utilizzando la colorazione con ematossilina ed eosina. Barra della scala: 200 μm. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 5: Quantificazione del rapporto di infarto polmonare. (A) Polmoni prelevati immediatamente da un ratto dopo embolizzazione con 10 cm di coaguli di sangue (lunghezza totale). (B) Polmoni prelevati immediatamente da un ratto dopo embolizzazione con 6 cm di trombo. (C) Polmoni prelevati immediatamente da un ratto dopo l'embolizzazione con 8 cm di coaguli di sangue. (D) Polmoni prelevati da un ratto 24 ore dopo l'embolizzazione con 8 cm di coaguli di sangue. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
In questo studio, è stato stabilito con successo un modello di ratto minimamente invasivo di EP utilizzando coaguli di sangue autologhi. Una volta padroneggiata, questa procedura di modellazione può essere completata entro 30 minuti. Il modello cattura efficacemente le caratteristiche chiave dell'EP clinica, come confermato dagli esami patologici. Di conseguenza, offre uno strumento prezioso per chiarire i cambiamenti emodinamici e la patogenesi delle complicanze a seguito di EP, sviluppare nuovi biomarcatori diagnostici e bersagli terapeutici e testare nuovi trattamenti antitrombotici.
Nel corso di diversi decenni sono stati compiuti sforzi significativi per sviluppare un modello animale di PE, ma nessun singolo metodo è stato identificato come ottimale per modellare PE12. In questo articolo, il modello di PE modificato presenta diverse caratteristiche distinte: (1) Prelievo di sangue dal catetere venoso centrale (CVC): nei roditori, il CVC si collega con la confluenza delle vene succlavia e giugulare interne e si estende caudalmente nella cavità toracica13. I CVC sinistro e destro sono quasi simmetrici. Il CVC ha un lume più grande delle vene giugulari, si trova vicino al manubrio e si trova sotto il grande pettorale. Queste caratteristiche anatomiche consentono una puntura precisa delle vene, volumi di prelievo del sangue maggiori e un'emostasi rapida, con conseguente alto tasso di successo. Inoltre, il prelievo di sangue dal CVC è meno suscettibile alla contaminazione rispetto ad altre vie di prelievo del sangue e sono meno probabili complicazioni come ematoma, trombosi e pneumotorace. L'emostasi viene in genere raggiunta automaticamente o rapidamente con la pressione. (2) Iniezione attraverso la vena epigastrica superficiale: in genere, le vene giugulari esterne vengono utilizzate per l'iniezione di coaguli di sangue per indurre EP 6,8,9 e l'incisione cutanea per l'esposizione può essere minima. Tuttavia, l'incannulamento della vena giugulare esterna spesso porta all'occlusione venosa, che può avere un impatto negativo sugli esperimenti successivi perché la vena giugulare esterna è il principale deflusso cranico nei ratti dopo la nascita14 e l'incannulamento dell'altra vena giugulare esterna è necessaria per la misurazione della pressione del ventricolo destro 6,8,10. In questo modello modificato, il sacrificio della vena epigastrica superficiale ha un impatto minimo sul corpo. Inoltre, questa via per l'iniezione di coaguli di sangue imita l'EP clinica, in cui la maggior parte degli emboli proviene dalle vene degli arti inferiori. La posizione precisa dell'arteria epigastrica superficiale è fondamentale per una piccola incisione. La pulsazione dell'arteria epigastrica superficiale può essere solitamente notata sulla superficie della pelle dell'inguine, facilitando l'identificazione dei vasi. (3) Carico di embolo personalizzato: il carico di embolo è determinato dal diametro e dalla lunghezza totale della colonna di sangue. Il generatore di trombi utilizzato in questo studio consente la preparazione del carico dell'embolo standard e personalizzato. I ricercatori possono regolare questi parametri in base alle loro esigenze di ricerca. In questo caso, il carico di embolia induce sintomi e segni evidenti, ma è meno probabile che provochi la morte. È generalmente sicuro se vengono iniettati meno di 10 cm di coaguli di sangue. Se si verifica apnea, l'iniezione deve essere interrotta immediatamente. Lo sperimentatore dovrebbe quindi tenere il torace dell'animale con le dita posizionate sulla parete toracica laterale e anteriore ed eseguire compressioni toraciche ritmiche; La respirazione dell'animale può riprendersi dopo queste manovre. (4) Perfusione polmonare e quantificazione delle aree infartuate: questo studio introduce tecniche dettagliate di perfusione polmonare per una migliore visualizzazione dell'infarto polmonare dopo l'induzione di EP. Sulla base di ciò, è stato sviluppato un indice per quantificare l'area infartuata, chiamato rapporto di infarto. I risultati attuali indicano che questo indice può rispondere al carico di embolia e alla trombolisi intrinseca, suggerendo la sua potenziale utilità per confronti tra gruppi in studi che indagano nuove terapie antitrombotiche.
Rispetto alla modellazione dell'EP, la modellazione dell'ipertensione polmonare tromboembolica cronica (CTEPH), una grave complicanza a lungo termine dell'EP, è più impegnativa a causa dell'elevata attività fibrinolitica nei roditori. Le possibili soluzioni includono l'embolizzazione ripetuta e la somministrazione di acido tranexamico (TXA), un inibitore della fibrinolisi 7,10,12,15. Tuttavia, il danno all'accesso venoso e la rapida clearance plasmatica del TXA continuano a rendere difficile la modellazione di CTEPH. Il modello e i protocolli di visualizzazione di accompagnamento qui presentati possono fornire informazioni sulla creazione di un modello CTEPH affidabile.
Dovrebbero essere affrontati anche i limiti di questo manoscritto. In primo luogo, c'è una mancanza di misurazioni emodinamiche per questo modello, come la pressione del ventricolo destro e l'ecocardiografia. Tuttavia, ciò non nega la validità del modello, in quanto è stato convalidato patologicamente. I ricercatori possono fare riferimento ad altra letteratura per metodologie dettagliate sulle misurazioni emodinamiche16. In secondo luogo, non è stato incluso un gruppo di trattamento per valutare le risposte ai farmaci in questo modello di EP, come la somministrazione di warfarin e urochinasi, che avrebbe potuto dimostrare ulteriormente l'utilità del modello.
In conclusione, è stato stabilito con successo un modello modificato di EP di roditore caratterizzato dal suo approccio minimamente invasivo. Sono stati forniti anche metodi per quantificare le aree infartuate e visualizzare l'albero arterioso polmonare. Questo modello è promettente per affrontare questioni critiche riguardanti la prevenzione e il trattamento delle complicanze dell'EP.
Divulgazioni
Gli autori dichiarano di non avere conflitti di interesse.
Riconoscimenti
Questo studio è supportato da una sovvenzione della Wu Jieping Medical Foundation (320.6750.19089-36).
Materiali
| Name | Company | Catalog Number | Comments |
| Analytical balance | METTLER TOLEDO | MA55/A | None |
| Dispensing needle | Jinrong electronics | None | 19 G and 18 G |
| Fine scissors | Stronger | XGJ1300 | None |
| Heparin sodium salt | Solarbio | 01-08-9041 | 140U/mg |
| Isoflurane | RWD | R510-22-10 | None |
| Methyl salicylate | Macklin | M813577 | AR, 99% |
| Micro clamp | JZ | W40160 | None |
| Micro tweezers | Stronger | XGN1310 | None |
| Silicone casting compound | Flow Tech | MV-130 | None |
| Sprague-Dawley rats | Vital River | SD-IGS | None |
| Stereo microscope | Murzider | MSD204 | None |
Riferimenti
- Götzinger, F., et al. Interventional therapies for pulmonary embolism. Nat Rev Cardiol. 20 (10), 670-684 (2023).
- Falster, C., et al. Comparison of international guideline recommendations for the diagnosis of pulmonary embolism. Lancet Haematol. 10 (11), e922-e935 (2023).
- Konstantinides, S. V., et al. ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 41 (4), 543-603 (2020).
- Domínguez-Oliva, A., et al. The importance of animal models in biomedical research: Current insights and applications. Animals (Basel). 13 (7), 1223 (2023).
- Mukherjee, P., Roy, S., Ghosh, D., Nandi, S. K. Role of animal models in biomedical research: A review. Lab Anim Res. 38 (1), 18 (2022).
- Tang, Z., et al. Gene expression profiling of pulmonary artery in a rabbit model of pulmonary thromboembolism. PLoS One. 11 (10), e0164530 (2016).
- Deng, C., et al. Expression of tissue factor and forkhead box transcription factor o-1 in a rat model for chronic thromboembolic pulmonary hypertension. J Thromb Thrombolysis. 42 (4), 520-528 (2016).
- Runyon, M. S., Gellar, M. A., Sanapareddy, N., Kline, J. A., Watts, J. A. Development and comparison of a minimally-invasive model of autologous clot pulmonary embolism in Sprague-Dawley and Copenhagen rats. Thromb J. 8, 3 (2010).
- Li, S. Q., et al. Comparative proteomic study of acute pulmonary embolism in a rat model. Proteomics. 7 (13), 2287-2299 (2007).
- Deng, C., et al. Role of FOXO1 and apoptosis in pulmonary vascular remolding in a rat model of chronic thromboembolic pulmonary hypertension. Sci Rep. 7 (1), 2270 (2017).
- Morton, J., Snider, T. A. Guidelines for collection and processing of lungs from aged mice for histological studies. Pathobiol Aging Age Relat Dis. 7 (1), 1313676 (2017).
- Karpov, A. A., Vaulina, D. D., Smirnov, S. S., Moiseeva, O. M., Galagudza, M. M. Rodent models of pulmonary embolism and chronic thromboembolic pulmonary hypertension. Heliyon. 8 (3), e09014 (2022).
- Picazo, M. G., Benito, P. J., García-Olmo, D. C. Efficiency and safety of a technique for drawing blood from the hamster cranial vena cava. Lab Anim (NY). 38 (6), 211-216 (2009).
- Szabó, K. The cranial venous system in the rat: Anatomical pattern and ontogenetic development. Ii. Dorsal drainage. Ann Anat. 177 (4), 313-322 (1995).
- Li, C. Y., et al. The effects and mechanism of ginsenoside rg1 on myocardial remodeling in an animal model of chronic thromboembolic pulmonary hypertension. Eur J Med Res. 18 (1), 16 (2013).
- Sullivan, D. M., Watts, J. A., Kline, J. A. Biventricular cardiac dysfunction after acute massive pulmonary embolism in the rat. J Appl Physiol (1985). 90 (5), 1648-1656 (2001).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon