Method Article
使用自体血凝块建立肺栓塞的微创大鼠模型
摘要
描述了使用自体血凝块建立肺栓塞微创大鼠模型的详细方法。还提供了量化梗死区域和可视化肺动脉树的其他方法。
摘要
肺栓塞 (PE) 是心血管死亡的主要原因之一,导致沉重的社会经济负担。尽管目前的治疗主要集中在抗凝和溶栓上,但迫切需要更好地了解其病理生理学并开发新的治疗策略。动物模型在了解 PE 和开发针对该疾病的新疗法方面发挥着至关重要的作用,出于道德和成本考虑,通常使用啮齿动物。然而,现有的 PE 啮齿动物模型受到缺乏标准化程序的限制,这阻碍了可重复性和交叉研究比较。本研究旨在建立使用自体血栓的微创大鼠 PE 模型。该模型采用微创采血技术、标准化血栓生成程序和微创静脉通路。此外,还提供了量化梗死区域和可视化肺动脉树的方案。这些程序旨在提高用于研究 PE 进展的啮齿动物模型的可靠性,并促进新疗法的开发。
引言
肺栓塞 (PE) 是院内死亡的主要原因,也是心血管死亡的第三大常见原因。尽管发病率高,但预防和及时诊断仍然具有挑战性 1,2。抗凝和溶栓疗法对于治疗 PE 至关重要,但更深入地了解疾病进展和新的治疗方法对于改善疾病管理至关重要3。
在现代生物医学研究中,动物模型在阐明人类疾病机制和开发新疗法方面发挥着关键作用 4,5。出于道德考虑和成本效益,小鼠、大鼠、仓鼠和兔子经常用于 PE 建模 6,7,8,9,10。PE 建模方法通常分为三类:体内血栓形成、体外血凝块注射和非血栓形成颗粒的给药。动物物种和建模技术的选择取决于具体的研究目标,因为没有一个模型适合所有目的。例如,专注于探索新的溶栓疗法的研究通常采用涉及自体血栓而不是非血栓颗粒的模型。
由于缺乏详细的标准化方法,当前对啮齿动物 PE 进行建模的方法面临挑战。这会影响关键过程,例如血液采样、血凝块形成和随后的栓塞,所有这些都对于确保研究结果的可重复性至关重要。此外,在量化栓塞面积和准确绘制栓塞后栓子分布的能力方面存在很大差距。解决这些缺点对于提高啮齿动物模型在 PE 研究中的可靠性和实用性至关重要。
在这项研究中,描述了使用自体血凝块建立大鼠 PE 模型的详细方案。该模型采用微创采血技术、标准化血栓生成程序和微创静脉通路。此外,还提供了量化肺部梗塞区域和可视化肺动脉树的方案,这可能有助于进一步的研究发现。
研究方案
所有动物实验均经中国医学科学院和北京协和医学院动物护理和使用委员会批准进行(批准编号:IRM/2-1ACUC-2311-015)。本研究使用雄性 Sprague-Dawley 大鼠,6 周龄,体重约 250 g。这些动物被安置在特定的无病原体环境中,可以随意获得均衡的食物饮食和水。将它们在 22 °C ± 2 °C 的室温下保持 12 小时的光照/黑暗循环。 在接受任何外科手术之前,让动物适应环境 1 周。本研究中使用的试剂和设备的详细信息列在 材料表中。
1. 设备和材料
- 麻醉设备:使用小动物气体麻醉机和异氟醚。
- 手术材料:准备棉签、碘伏消毒剂、体视显微镜、剃须刀、医用胶带、带 27 G 针头的 1 mL 注射器、5 mL 注射器、10 mL 注射器、生理盐水、纱布、8-0尼龙线、带缝合针的 6-0 尼龙线、微型止血夹、微型镊子和细剪刀。
- 其他材料:获得与医用注射器兼容的 19 G 和 18 G 分配针头、内径为 1.2 mm 且长度为 10 cm 的硅胶管、内径为 3.0 mm、长度为 20 cm 的输液管、1.5 mL 离心管、移液器和移液器吸头。
- 自制血栓发生器和血栓注射器(图 1):将硅胶管连接到连接到 1 mL 注射器的 19 G 分配针头,以创建血栓发生器。将输液管的一端连接到 18 G 分配针头,并将另一端连接到 5 mL 注射器以创建凝块注射器。
2. 自体血凝块制备
- 麻醉
- 将动物置于麻醉诱导室内,以 2 L/min 的流速施用 4% 异氟醚与室内空气的混合物 2-3 分钟(遵循机构批准的方案)。
- 将动物仰卧放在手术平台上。通过以 0.4 L/min 的流速施用 2.5% 异氟醚来维持麻醉。测试踏板反射以确保获得足够的麻醉。
- 从身体水平伸展双前肢,并伸展后肢以充分露出腹股沟区域。使用医用胶带将动物固定在该位置(图 2A)。
- 通过颅腔静脉 (CVC) 采血
- 使用剃须刀和脱毛霜去除柄周围的毛发。用碘伏对皮肤进行消毒。
- 将连接到 27 mL 注射器的 1 G 针头垂直插入 8 毫米深度,以刺穿左侧或右侧 CVC,如图 2A 所示。
注意:CVC 的体表投影位于柄外侧 5 毫米处。两边都可以用,选择不影响接下来的步骤。 - 握住注射器并轻轻拉回柱塞,在桶内产生负压。逐渐拔出针头直到血液流入,然后保持该位置直到收集到 0.3 mL 血液(图 2B)。
- 血凝块制备
- 将收集的血液推入 1.5 mL 离心管中,注意不要产生气泡。
- 将血液吸入自制血栓发生器的硅胶管中,直到血柱长度达到 10 厘米。
注意:快速执行这两个步骤,因为凝血将在离心管中开始并传播,从而降低收获的血凝块的质量。 - 等待 30 分钟,直到血液完全血栓形成。在此期间,以相同的方式为其他动物准备血柱。
- 将血栓形成的血柱冲洗到含有生理盐水的培养皿中,并用生理盐水洗涤血栓柱 3 次(图 2C)。
- 用细剪刀将血栓柱切成均匀的血凝块,每个血凝块长 4 毫米(图 2D)。将 10-20 个凝块吸入预装有 2 mL 生理盐水的自制注射器中。
注意:血凝块的长度不应超过 1 厘米,否则它们会被困在右心室中。
3. 静脉通路准备
- 暴露浅表上腹血管
- 按照步骤 2.1 中的说明麻醉并固定动物。
- 剃掉左侧腹股沟区域周围的毛发。在这些区域涂抹脱毛霜,等待 1 分钟,然后用纱布擦去霜。用碘伏对皮肤进行消毒。
- 在腹股沟区域的上腹浅血管起点上方做一个 5 毫米的皮肤切口。通常,可以通过观察腹股沟区域的微小搏动来追踪上浅上腔血管的起源。
- 使用 10 倍放大的立体显微镜,分离一层薄薄的皮下脂肪以暴露浅表上腹血管(图 3A)。
- 隔离上腹浅静脉
- 小心地将上腹浅静脉与动脉、神经和脂肪组织隔离开来。在近端进行此作,直到它流入股静脉,并在远端向下直到第一静脉分叉处。
- 用 8-0 结扎远端用微型夹子拧入螺纹并夹紧螺纹。用 8-0 控制近端螺纹环连接到另一个微型夹具(图 3B)。
- 在离体静脉的远端做一个小的横向切口。控制近端以避免出血。用生理盐水冲洗静脉腔中剩余的血液。静脉畅通后,使用微型镊子扩大静脉切口。
4. 栓塞
- 静脉插管
- 将自制注射器的针头通过静脉切口轻轻插入静脉。用第三个夹子固定针头,以防止其从静脉中滑出。
- 栓塞手术
- 慢慢推动柱塞以注入少量生理盐水。没有阻力的静脉充盈表明静脉通路畅通(图 3D)。
- 继续推动柱塞,通过浅表上腹静脉通路将凝块注入股静脉。将栓塞速度控制在每分钟 5 个栓子。监测动物的呼吸;出现和加重的呼吸困难提示栓塞成功。
- 注射预定量的血凝块后,拔出针头并结扎上浅上腹静脉的近端。
- 缝合切口,将动物放入温暖的盒子中。一旦动物醒来,就将它转移到笼子里。
5. 梗死面积的定量
- 安乐死和心脏灌注
- 将 25,000 U 肝素钠加入 250 mL 生理盐水中并充分混合。将瓶子连接到输液装置上,并将瓶子倒挂在 80 厘米的高度。关闭输液装置的阀门。
- 用过量的异氟醚对动物实施安乐死(遵循机构批准的方案)。
- 用大剪刀剪断肋骨并打开胸部,避免损伤肺部和大血管。
- 将输液装置的针头插入左心室。打开输注装置的阀门,让肝素盐水输注。用剪刀剪断下腔静脉和左附件以允许引流。将灌注速度控制在 50 mL/min。
注意:在此过程中,正常的肺组织会变成白色,而栓塞区仍然生锈。 - 用肝素化盐水完成灌注后,使用装有 4% 多聚甲醛溶液的 10 mL 注射器穿过右心室穿刺肺动脉干。通过肺部进行 4% 多聚甲醛灌注,总体积为 30 mL,从而固定肺组织。
- 介绍称为 Infarction Ratio 的指标
- 固定后,从脊柱和横膈膜11 切除肺、心脏、气管、食道、胸腺和大血管作为一个整体。
- 小心地从初始肿块中取出食道、胸腺和脂肪组织,只留下心脏、肺和大血管。
- 将剩余部分浸入足够体积的 4% 多聚甲醛溶液中至少 48 小时。
- 使用分析天平称量整个肺部。用细剪刀分离肺部的梗塞部分,并用相同的天平称量梗塞组织。使用以下公式计算梗死比率:
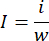
i 是梗塞组织的重量, w 是整个肺的重量, I 代表梗塞比率。 - 量化梗死区域后,修剪多聚甲醛固定的肺组织以进行石蜡包埋11。
6. 肺动脉树的可视化
- 肺动脉管型
- 对动物实施安乐死并按照步骤 5.1 中的说明进行心脏灌注。
- 向有机硅灌封胶中加入等量(按重量计)的稀释剂,混合混合物,然后加入 5%(按重量或体积计)的固化剂。再次混合混合物。
- 将 1 mL 混合物吸入 1 mL 注射器中,抽出空气,然后将针头通过右心室插入肺动脉干。将针头固定到肺动脉上,以防止滑脱和回流。
- 轻轻按压柱塞,让硅胶管型混合物充满肺动脉树。正常的肺部区域会被石膏混合物染成,而梗塞区域保持锈红色。
注意:肺动脉管型只能应用于完整的肺组织。通常,0.6-0.8 mL 的石膏混合物足以填充肺动脉树。过量注射石膏管型混合物会导致肺静脉管型,从而影响肺动脉树的可视化。浇注混合物应在添加固化剂后 20 分钟内使用,因为超过此时间后会结晶。 - 石膏灌注后拔出注射器,结扎肺动脉干,并按照步骤 5.2 中的说明收获肺、心脏和大血管。将整个团块放入培养皿中,并在 4 °C 冰箱中储存过夜,以使铸型混合物结晶。
- 清除和可视化
- 用剪刀从肺部去除心脏和大血管,然后清除肺表面的固化混合物碎屑。
- 依次将肺浸入 25%,50%,75%,95% 和 100% 乙醇溶液中,各浸泡 24 小时。这个过程会使肺部完全脱水。
- 将脱水的肺浸入水杨酸甲酯中 24 小时。在这个清除过程之后,肺动脉树将可见,也可以看到栓子,因为水杨酸甲酯不能清除血红蛋白(图 4B、D)。
结果
PE 模型的症状和病理
栓塞过程中,大鼠出现呼吸急促,胸部波动扩大。当注射少于 10 cm 的血凝块时,几乎所有动物都在肺栓塞发作中幸存下来(15 只建模动物中有 14 只)。被送回笼子后,这些动物蜷缩在角落里,对食物和水的兴趣降低。然而,这些症状很快就消退了,几个小时内,动物的行为就恢复正常了。基线和栓塞后 24 小时的体重没有显着差异 (341.8 ± 10.4 vs. 343.3 ± 8.5,p = 0.25)。
大体病理显示栓塞(梗死)区域呈楔形,主要位于肺下部,边界清晰。栓子位于梗死区域的顶点,阻塞了肺动脉的第一和第二分支。使用苏木精-伊红染色的显微镜病理学证实了肺动脉分支的栓塞(图 4F)。
血凝块负荷和梗死区域
在对血凝块负荷对肺梗死影响的初步调查中,我们测试了低血凝块负荷 (6 cm 血栓柱,15 个凝块) 和高血凝块负荷 (10 cm 血栓柱,25 个凝块)。正如预期的那样,较高的栓子负荷导致更大的肺梗死面积(图 5A-C)。
24 小时内内发生内源性纤维蛋白溶解
与栓塞后立即采集的肺样本相比,栓塞后 24 小时采集的肺样本显示梗死区域明显减少,表明大鼠具有很强的内在纤维蛋白溶解电位(图 5D)。
图 1:血栓发生器和血凝块注射器的结构。 (A) 通过将硅管连接到 18 G 分配针(12 mm 外径)和 1 mL 预装 0.5 mL 生理盐水的注射器来组装血栓发生器。(B) 通过将 19 G 分配针(内径 0.84 mm,外径 1.08 mm)连接到输液管(凝块容器)和预装 5 mL 生理盐水的 2 mL 注射器来构建血栓注射器。 请单击此处查看此图的较大版本。

图 2:血液采样和凝块制备。 (A) 对大鼠进行麻醉并固定在仰卧位。带有虚线的白色圆圈表示柄,用作体表标记。白色圆圈旁边的红点表示进入双侧颅腔静脉 (CVC) 的穿刺部位。图的下半部分显示了柄、CVC 和穿刺部位的相对位置的尸检图。(B) 通过正确的 CVC 成功采血。(C) 从自制血栓发生器中冲洗出血栓形成的血柱。(D) 血栓形成的血柱衍生的血凝块。 请单击此处查看此图的较大版本。

图 3:静脉通路和栓塞。 (A) 通过 5 mm 皮肤切口暴露上腹浅血管,蓝色箭头表示上腹浅静脉,红色箭头表示上腹浅动脉。(B) 从周围组织中隔离上腹浅静脉并用尼龙线控制静脉。(C) 含血栓的自制注射器。(D) 用自制注射器的分配针对静脉进行插管,并通过静脉通路施用血栓。 请单击此处查看此图的较大版本。

图 4:肺栓塞的病理学。 (A) 心脏盐水灌注和 4% 多聚甲醛固定后的正常肺。(B) 通过硅胶铸型混合物和水杨酸甲酯清除观察到正常肺,显示肺动脉树和微血管系统通畅。(C) 栓塞后立即出现自体血栓的肺部,有标记区域表明栓塞引起的肺梗塞。(D) 通过硅树脂混合物铸造和水杨酸甲酯清除观察到患病肺,黑色箭头表示栓子阻塞肺动脉分支,白色虚线圆圈表示其梗塞的受影响区域。(E) 左肺叶解剖显示肺动脉分支中的栓子(红色箭头)。(F) 使用苏木精和伊红染色在肺动脉分支中血凝块栓塞的显微图像。比例尺:200 μm。 请点击此处查看此图的较大版本。

图 5:肺梗死比率的量化。 (A) 栓塞后立即从大鼠身上取出肺,栓塞 10 cm 血凝块(总长度)。(B) 用 6 cm 血栓栓塞后立即从大鼠身上取出肺。(C) 栓塞 8 cm 血凝块后立即从大鼠身上取出肺。(D) 栓塞 24 小时后用 8 cm 血凝块从大鼠身上取出的肺。 请单击此处查看此图的较大版本。
讨论
在这项研究中,成功建立了使用自体血凝块的 PE 微创大鼠模型。掌握后,此建模过程可在 30 分钟内完成。该模型有效地捕捉了临床 PE 的关键特征,经病理检查证实。因此,它为阐明 PE 后并发症的血流动力学变化和发病机制、开发新的诊断生物标志物和治疗靶点以及测试新的抗血栓治疗提供了有价值的工具。
几十年来,人们为开发 PE 动物模型做出了重大努力,但没有一种方法被确定为模拟 PE12 的最佳方法。在本文中,改良的 PE 模型表现出几个明显的特征:(1) 从中心静脉导管 (CVC) 抽血:在啮齿动物中,CVC 与锁骨下静脉和颈内静脉的汇合处相连,并向尾部延伸到胸腔13。左侧和右侧 CVC 几乎对称。CVC 的管腔比颈静脉大,靠近柄,位于胸大肌下方。这些解剖特性允许精确的静脉穿刺、更大的采血量和快速止血,从而实现高成功率。此外,与其他血液采样途径相比,从 CVC 抽血不易受到污染,并且血肿、血栓形成和气胸等并发症的可能性较小。止血通常是通过压力自动或快速实现的。(2) 经上腹浅静脉注射:通常使用颈外静脉进行血凝块注射以诱导 PE 6,8,9,暴露的皮肤切口可以很小。然而,颈外静脉插管通常会导致静脉阻塞,这会对后续实验产生负面影响,因为颈外静脉是大鼠出生后的主要颅骨流出14,并且右心室压力测量需要另一条颈外静脉插管 6,8,10.在这种改良的模型中,牺牲浅表上腹静脉对身体的影响最小。此外,这种血栓注射途径类似于临床 PE,其中大多数栓子起源于下肢静脉。上腹浅动脉的精确位置对于小切口至关重要。腹股沟皮肤表面通常可以观察到上腹浅动脉的搏动,有助于血管识别。(3) 定制栓子负荷:栓子负荷由血柱的直径和总长度决定。本研究中使用的血栓发生器允许标准和定制的栓子负荷准备。研究人员可以根据他们的研究需求调整这些参数。在这种情况下,栓子负荷会引起明显的症状和体征,但不太可能导致死亡。如果注射的血凝块小于 10 厘米,通常是安全的。如果发生呼吸暂停,应立即停止注射。然后,实验者应将手指放在外侧和前胸壁上,握住动物的胸部,并有节奏地进行胸外按压;这些作后,动物的呼吸可能会恢复。(4) 肺灌注和梗死区域的量化:本研究介绍了详细的肺灌注技术,以更好地可视化 PE 诱导后的肺梗死。基于此,开发了一个量化梗死面积的指数,称为梗死比率。目前的结果表明,该指数可能对栓子负荷和内源性溶栓有反应,表明它在调查新的抗血栓疗法的研究中对跨组比较具有潜在用处。
与 PE 建模相比,慢性血栓栓塞性肺动脉高压 (CTEPH) 是 PE 的一种严重的长期并发症,由于啮齿动物的高溶纤维蛋白活性,建模更具挑战性。可能的解决方案包括反复栓塞和氨甲环酸 (TXA),一种纤维蛋白溶解抑制剂 7,10,12,15。然而,静脉通路损伤和 TXA 的快速血浆清除继续使 CTEPH 建模变得困难。此处介绍的模型和随附的可视化协议可能为建立可靠的 CTEPH 模型提供见解。
还应解决这份手稿的局限性。首先,该模型缺乏血流动力学测量,例如右心室压力和超声心动图。然而,这并不能否定该模型的有效性,因为它已经得到了病理验证。研究人员可以参考其他文献以了解血流动力学测量的详细方法16。其次,不包括评估该 PE 模型中药物反应的治疗组,例如华法林和尿激酶的给药,这可以进一步证明该模型的实用性。
总之,已成功建立了一种以微创入路为特征的改良啮齿动物模型。还提供了量化梗死区域和可视化肺动脉树的方法。该模型有望解决有关预防和治疗 PE 并发症的关键问题。
披露声明
作者声明没有利益冲突。
致谢
这项研究得到了吴阶平医学基金会 (320.6750.19089-36) 的资助。
材料
| Name | Company | Catalog Number | Comments |
| Analytical balance | METTLER TOLEDO | MA55/A | None |
| Dispensing needle | Jinrong electronics | None | 19 G and 18 G |
| Fine scissors | Stronger | XGJ1300 | None |
| Heparin sodium salt | Solarbio | 01-08-9041 | 140U/mg |
| Isoflurane | RWD | R510-22-10 | None |
| Methyl salicylate | Macklin | M813577 | AR, 99% |
| Micro clamp | JZ | W40160 | None |
| Micro tweezers | Stronger | XGN1310 | None |
| Silicone casting compound | Flow Tech | MV-130 | None |
| Sprague-Dawley rats | Vital River | SD-IGS | None |
| Stereo microscope | Murzider | MSD204 | None |
参考文献
- Götzinger, F., et al. Interventional therapies for pulmonary embolism. Nat Rev Cardiol. 20 (10), 670-684 (2023).
- Falster, C., et al. Comparison of international guideline recommendations for the diagnosis of pulmonary embolism. Lancet Haematol. 10 (11), e922-e935 (2023).
- Konstantinides, S. V., et al. ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 41 (4), 543-603 (2020).
- Domínguez-Oliva, A., et al. The importance of animal models in biomedical research: Current insights and applications. Animals (Basel). 13 (7), 1223 (2023).
- Mukherjee, P., Roy, S., Ghosh, D., Nandi, S. K. Role of animal models in biomedical research: A review. Lab Anim Res. 38 (1), 18 (2022).
- Tang, Z., et al. Gene expression profiling of pulmonary artery in a rabbit model of pulmonary thromboembolism. PLoS One. 11 (10), e0164530 (2016).
- Deng, C., et al. Expression of tissue factor and forkhead box transcription factor o-1 in a rat model for chronic thromboembolic pulmonary hypertension. J Thromb Thrombolysis. 42 (4), 520-528 (2016).
- Runyon, M. S., Gellar, M. A., Sanapareddy, N., Kline, J. A., Watts, J. A. Development and comparison of a minimally-invasive model of autologous clot pulmonary embolism in Sprague-Dawley and Copenhagen rats. Thromb J. 8, 3 (2010).
- Li, S. Q., et al. Comparative proteomic study of acute pulmonary embolism in a rat model. Proteomics. 7 (13), 2287-2299 (2007).
- Deng, C., et al. Role of FOXO1 and apoptosis in pulmonary vascular remolding in a rat model of chronic thromboembolic pulmonary hypertension. Sci Rep. 7 (1), 2270 (2017).
- Morton, J., Snider, T. A. Guidelines for collection and processing of lungs from aged mice for histological studies. Pathobiol Aging Age Relat Dis. 7 (1), 1313676 (2017).
- Karpov, A. A., Vaulina, D. D., Smirnov, S. S., Moiseeva, O. M., Galagudza, M. M. Rodent models of pulmonary embolism and chronic thromboembolic pulmonary hypertension. Heliyon. 8 (3), e09014 (2022).
- Picazo, M. G., Benito, P. J., García-Olmo, D. C. Efficiency and safety of a technique for drawing blood from the hamster cranial vena cava. Lab Anim (NY). 38 (6), 211-216 (2009).
- Szabó, K. The cranial venous system in the rat: Anatomical pattern and ontogenetic development. Ii. Dorsal drainage. Ann Anat. 177 (4), 313-322 (1995).
- Li, C. Y., et al. The effects and mechanism of ginsenoside rg1 on myocardial remodeling in an animal model of chronic thromboembolic pulmonary hypertension. Eur J Med Res. 18 (1), 16 (2013).
- Sullivan, D. M., Watts, J. A., Kline, J. A. Biventricular cardiac dysfunction after acute massive pulmonary embolism in the rat. J Appl Physiol (1985). 90 (5), 1648-1656 (2001).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。