Method Article
蚊の機能解析のためのカルシウムの生物発光アッセイ(ネッタイシマカ)とダニ( Rhipicephalus microplus)Gタンパク質共役受容体
要約
このプロトコルは、クローン細胞ラインの選択とその同族のGPCRで合成された節足動物の神経ペプチドの構造活性相関を分析するためにカルシウムの生物発光アッセイの手順について説明します。このアッセイは、受容体のdeorphanizationと合成アナログ設計およびペプチド/薬物リード発見のための構造活性相関の研究にも使用できます。
要約
彼らは多くの重要な生理学的および行動のプロセスを調節すると節足動物のホルモン受容体は、新規農薬の潜在的なターゲットです。それらの大半は、Gタンパク質共役受容体(GPCR)のスーパーファミリーに属する。我々は、ダニや蚊から節足動物キニン受容体を特徴付けるに焦点を当てている。節足動物のキニンはmyotropic、利尿、および神経伝達物質の機能を備えた多機能神経ペプチドである。ここでは、二つの異種キニン受容体を発現しているシステム上の昆虫キニンの構造活性相関の系統的分析のための方法が記載されている。我々は、利尿、myotropic、および/またはダニや蚊の消化過程を妨害する可能性のある生体安定キニン類似の開発に関連する重要な情報を提供しています。
南部牛のダニ、 ウシマダニ属microplus(Canestrini)、及び蚊ネッタイシマカ (リンネ)、からキニン受容体を安定に哺乳類細胞株CHO - K1で発現させた。これらの受容体の機能解析は、これらの組換え体細胞にペプチドアプリケーションによって細胞質カルシウム濃度を決定するために細胞内の生物発光を測定するカルシウムの生物発光プレートアッセイを用いて完成した。このメソッドは、イクオリンの蛋白質、発光クラゲから単離された発光タンパク質を利用しています。我々は、一時的に安定してキニン受容体を発現する細胞株で(mtAEQ/pcDNA1)エクオリンプラスミドをトランスフェクション。これらの細胞は、どの細胞イクオリンと複合体因子のセレンテラジン、で処理した。この結合はカルシウム濃度を示す発光レベルを放出、カルシウムの存在下で分解。キニン受容体が細胞内カルシウムの放出を介して信号として、信号の強度は、ペプチドの効力に関連しています。
このプロトコルは、変更といくつかの以前に記載されているプロトコルの合成であり、。。、それは機能的なプレートアッセイ(Staubly ら 、2002年と厩舎ら 、1997年まで哺乳類細胞株におけるGPCRの安定した発現のためのステップバイステップの手順を説明)。この手法を用いて、我々は蚊やダニのキニン受容体を発現する安定細胞株を樹立することができた、三蚊のkininsの効力を比較し、リガンドとレセプターの相互作用に重要なアミノ酸位置を特定し、ペプチドの半スループットスクリーニングを行うライブラリ。昆虫キニンは内因性ペプチダーゼによる高速酵素分解を受けやすいので、それらは深刻な害虫駆除や内分泌学的研究のためのツールとして使用が制限されています。したがって、我々はまた彼らの効力とbiostabilityを強化するアミノ酸イソ酪酸(AIB)を含むキニン類似をテストした。このペプチダーゼ抵抗性アナログは、生体安定昆虫キニン類似体の開発において重要なリードを表し、神経ペプチドベースの節足動物の制御戦略の開発を支援することがあります。
プロトコル
1。安定細胞株の確立
- 興味のあるGPCRのクローンを作成し、哺乳類のシステムで最適なリボソーム結合(コザック、1986)の開始コドンの周囲に5'Kozakコンセンサス配列(GCCA / GCCATGG)を組み込んだ発現ベクターに挿入します。ここでは、蚊キニン受容体(。; Pietrantonio ら 、2005。ホームズら 、2003)の目盛キニン受容体のプラスミドpcDNA3.1/Bm-KR、およびプラスミドpcDNA3.1/Aedae-KRを使用してください。であるpcDNA3.1( - )ベクターは、哺乳動物細胞での選択のための細菌とネオマイシン(G418)耐性で選択のためにアンピシリン耐性をコードしている。
- CHO - K1、空のセル(プラスミドなし)(ATCC、マナッサス、バージニア州、米国)または37 T - 25フラスコ内の他の所望の細胞株(BDファルコン)℃、5%CO 2の加湿インキュベーターにおいてC(ホームズらを成長させる、2003)。特記のない限り、すべてのさらなるインキュベーションは、これらの条件下で行う必要があります。 1X抗生物質 - 抗真菌(Invitrogen社、カリフォルニア州)で増殖培地中で空のセルを(10%ウシ胎児血清を含むF12K培地)を維持する。
- セルを分割するには、37℃にすべてのソリューションをウォームアップT - 25フラスコで古い培地を除去し、5mlのPBSでリンスし、PBSを取り外します。細胞をトリプシン処理するために、2分2 mlのPBS -トリプシン- EDTA(34 mlのPBS、2 mlの7.5%炭酸水素ナトリウム、トリプシン- EDTA 10X 4 ml)を加える。 3 mlの培地を加え、細胞を混合し、上下の培地を吸引除去する。円錐管と〜200〜300グラム(1,000 rpm)で2分間遠に細胞と培地を転送する。上清を捨て、5 mlの培地に再サスペンド細胞。新鮮な培地1:5または1:10の濃度に再懸濁した細胞を希釈し、新しいT - 25フラスコに5 mlを転送する。
- 細胞は抗生物質なしで、(2〜3日程度)健やかに成長している種CHO - K1細胞を、T - 25組織培養フラスコに、成長培地中で、それらが一晩増殖された後、彼らは約30%コンフルエント(約18時間)ですまで。コンフルエントの程度は、倒立蛍光顕微鏡下で細胞を観察することによって決定することができます。
- 各サンプルに対して、以下の混合物を準備します。
- 血清培地(Invitrogen)を削減100μlののOpti - MEM Iで:1-2μgのDNA(265μg/μlpcDNA3.1/Aedae-KRの使用4μl例)が結合する。
- DNAにリポフェクチンの1:1の比率を作り、100μlのF12K無血清培地に6μlのリポフェクチン試薬(InvitrogenTM)を混ぜる。 30〜45分間室温でインキュベートする。
- 細胞から古い培地を削除して、5mlのF12K無血清培地で細胞を洗浄し、F12K無血清培地を取り除く。 15 mlのチューブに、静かに滴下方式で新鮮F12K培地1.8 mlのトランスフェクション混合物を混ぜる。その後、PBSでステップ1.5から細胞を洗浄し、細胞にこの新しいトランスフェクション溶液を加える。 18時間インキュベートする。
- 抗生物質を含まない培地を加えた10%ウシ胎児血清をF12Kと一晩インキュベートして培養液を交換する。別の18時間のための抗生物質なしのF12K培地を加えた10%ウシ胎児血清(分割セルのためのステップ1.3を参照してください)を持つ2つのT - 25フラスコに細胞を分割する。
- 選択培地(F12K培地に加え、800μg/mlGENETICIN、インビトロジェンで10%ウシ胎児血清)で培地を交換してください。 3-4週間のための選択培地を用いて細胞培養。時間が経つにつれて、これは安定的にそれらのゲノムDNA中にプラスミドを取り込んだ細胞のために選択されます。維持培地(F12K培地に加え、400μg/mlGENETICINと10%ウシ胎児血清)を用いて細胞を維持し続ける。定期的に予想外の汚染の場合に失うのを防ぐために凍結メディアの1:1の比率(20%DMSOと選択培地)で細胞株を凍結する。
- クローン細胞株を選択する:最初のステップとして、ステップ1.3のように維持培地でステップ1.8から細胞をトリプシン処理し、遠心。 5 mlの維持培地で細胞をサスペンドを再度、細胞を0.5mlの10倍希釈を作るために新鮮な維持培地4.5 mlを一時停止して追加してください。単一のセルを選択するために各ウェルに100μLを加え、96ウェルプレートの12ウェルに10倍希釈を転送する。
- 100μlのあたり一つの細胞の理論的な最終懸濁液のためにこれらの細胞の10倍希釈系列を作り続ける(通常は最終の希釈は、10 -11〜10 -19の範囲になり、10倍希釈系列の総数は、〜19です) 。すぐに各希釈に続く、96ウェルプレートの12ウェルに希釈液100μlを移す。 18時間のインキュベーションの後、倒立光やたった一つのセルが含まれているか明らかに単一の細胞から分かれて二つの細胞が含まれているように見える蛍光顕微鏡とマークの井戸の下に96ウェルプレートを観察。毎日観察しておくと、3日ごとに培地を変更してください。
- 井戸は80%confluされている場合ENT(週約)、200μlのPBSでマークされた井戸を洗浄し、PBS -トリプシン- EDTA溶液を100μlでそれらをトリプシン処理。よく1 mlの維持培地で6ウェルプレートの1つのウェルにマークされた各からセルを転送する。 3日間、これらの細胞を成長させるには、その後、個々のT25フラスコに細胞を移す。アゴニストペプチド(セクション2を参照してください)とカルシウムの生物発光アッセイを使用してこれらのセルをテストします。
- カルシウムの生物発光プレートアッセイで最高のレスポンスとステップ1.11から1細胞株を選択して、ステップ1.9から1.11に続く二度目の単一のセルの選択を行います。定期的に細胞株を凍結する。
- ステップ1.12で説明されている二次セレクションから、カルシウムの生物発光プレートアッセイで最高のレスポンスを2〜3細胞株を選択し、さらにカルシウムの生物発光プレートアッセイのために文化の中でそれらを維持する。通路番号を追跡します。より多くの通路との細胞株は一貫して実行を停止した場合には常にそれらに戻ってできるように、時々、早いパッセージから細胞株を凍結する。
2。カルシウムの生物発光プレートアッセイ
- 発現ベクターに目的のレポーター遺伝子をライゲーションする。ここでは、エクオリンプラスミドmtAEQ/pcDNA1を(博士。CJP Grimmelikhuijzenとマイケルウィリアムソン、コペンハーゲン大学、デンマークからの贈り物)を使用。 E.のプラスミドをトランスフォーム大腸菌細胞のMC1061/PS(Invitrogen社)とQIAprep Spin Miniprepキット(キアゲン社)を用いて、それらを精製する。最後のステップではEDTAを含まないトリス緩衝液ではなく、水でプラスミドを溶出させる。
- 維持培地で目的の受容体を発現しているステップ1.13から細胞株を成長する。細胞が90%コンフルエントのときに、、トリプシン遠心し、ステップ1.3のように5 mlの維持培地で細胞を再懸濁する。細胞を(維持培地で約10倍)で希釈し、顕微鏡下で細胞のカウンター(ブライトライン血球計)で細胞数を数える。約2 × 10 5細胞/ mlに細胞数を調整(9の正方形のいずれかで、平均20細胞は、血球計算盤で示した)。シックスウェルプレートの各ウェルにメディアでシード2ミリリットル希釈細胞。 24時間(細胞はインキュベーション後の約60%コンフルエントに達するはず)インキュベートする。
- OPTI - MEM培地に6ウェルプレート内のメディアを変更します。各ウェルについて、マイクロチューブに4μlのFuGENE 6トランスフェクション試薬(ロシュ生化学)を96μlのOPTI - MEMをミックスし、5分間室温で放置します。各チューブにエクオリン/ pcDNA 1プラスミド1μgのDNAを追加してから、ゆっくりと15〜20分室温でインキュベート、1分間のサンプルを振る。優しくウェルプレートを振とうしながら滴下方式で各ウェルに各混合物を追加。 6時間プレートをインキュベートし、抗生物質なしで10%ウシ胎児血清を含む培地をF12Kに培地を変更してください。
- 24時間のための6つのウェルプレートで細胞をインキュベートした後、トリプシン、ステップ1.3のように細胞を遠心分離し、再度中断。ステップ2.1と40万細胞/ mlに細胞数をカウントし、96ウェル白色薄底マイクロタイタープレート(コスター3610)の各ウェルに100μl(合計4万cells/100μl)を移す。約80%の細胞がコンフルエントになるまでさらに24時間インキュベートする。これは、生物発光アッセイ用細胞の最適な濃度である。
- 暗闇の中で5μMのセレンテラジンを(Invitrogen社)(セレンテラジンは光に敏感である)を含むカルシウム不含DMEM培地(Invitrogen社)の90μl/wellを準備します。 2.4からプレートを取る、古いメディアを削除し、各ウェルにこの90μlを加える。プレート内の細胞がテストする準備が整ったら℃、5%CO 2、そのあと37℃の暗所で3時間培養する。
3。計器操作およびデータ解析
- 各生物発光プレートリーダーは異なっている。我々はbioluminensenceモードでNOVOstar(BMGのLabtechnologies)プレートリーダーを使用して私たちのアッセイを行う。あなたが別の楽器を使用する場合は、プロトコルを適合させる必要があります。
- 使用前にプレートリーダーポンプを(またはPRIME PUMPS)パージ。プレートホルダーにプレートを入れる前に部屋のライトをオフにします。プレートホルダーが閉じていると、上のライトをオンにします。
- カルシウム不含DMEM培地中でペプチドを(1.5mlのエッペンドルフチューブに)可溶。 "吸引深さ"と、使用前にペプチド溶液の"位置決定"を設定します。ペプチドの濃度を変化さ10μlの(10倍)(FFFSWG - NH2、ヤブカ- K1 - 3、または他の所望のペプチド)を細胞に挑戦し、直ちに発光の録音を開始します。我々は、50秒の合計時間を各ウェルごとに2秒間の発光(465 nm)を記録する機器を設定している。
- このようなアクティブなアナログ(アナログFFFSWGaがタネジャ-バゲスワルら 、2009、使用されている)とそのようなベクターのみ トランスフェクションした細胞のようなネガティブコントロールとして、ポジティブコントロールを含めるようにしてください。ネガティブコントロールは、(代表的な結果を参照)ベースラインのしきい値を設定するには、データ分析時に必要になります。関係のない、不活性ペプチドはまた、ネガティブコントロールとして追加することができます。
- 実行が完了した後、計器のポンプ(またはPRIME PUMPS)してから、次のペプチド試料を配置して洗う。あなたのデータを保存し、再びポンプを洗浄する。
- データ処理:Microsoft Excelのデータシートに各ウェルからの光放射のデータを転送。
- Excelからグラフパッドソフトウェア社(サンディエゴ、CA、米国)からプリズムソフトウェア4.0へのデータを貼り付けます。様々なペプチド濃度は、X -軸であり、生物発光ユニットはY軸です。データを正規化するには、ログ - 応答曲線をプロットします。各ペプチドの濃度 - 応答曲線を取得するために非線形回帰曲線のフィットの分析(変数のスロープを持つシグモイド用量反応式)を選択します。プログラムの最後のプロット値とEC 50を与える。
- それぞれの実験はデータ分析を3回繰り返す必要があります。
4。代表的な結果:
CHO - K1細胞で発現させた場合、蚊ネッタイシマカキニンの受容体は、multiligand受容体として挙動と機能的にthree endogenoursヒトスジシマカキニン、Aedaeキニン1-3の1 nMの程度の低い濃度に対応し、単独でカルシウムの生物発光プレートアッセイを用いてテスト。 Aedae - K -、得られる効力の順位はAedae - K - 3、16.04 nMのそれぞれのEC 50値に基づいてAedae - K - 3> Aedae - K - 2> Aedae - K - 1、であることを図1に示し2、26.6 nMおよびAedae - K - 1、統計的に有意に異なっていた48.85 nMの、(P <0.05)(Pietrantonio ら 、2005)。
我々はまた、キニンの残基はキニンペプチド - 受容体相互作用にとって重要であるかを判断するために、このアッセイを使用していました。昆虫キニンペプチドはまた、コアと呼ばれる生物学的活性に必要な最小限のシーケンスを表すC末端ペンタペプチドを共有します。表1に、キニンペプチドのコアの類似体は、コアキニンペンタペプチドFFSWGaのアラニン置換シリーズとして合成し、カルシウムの生物発光プレートアッセイ(タネジャ-バゲスワルら 、2006)によってテストされています。我々は、アミノ酸Pheを1とTrpを4両受容体のための昆虫キニンの活性に必須であることがわかった。
アッセイはまた、強化されたbiostabilityのために設計されたペプチドをテストするために使用することができます。表2は、ダニ換えキニン受容体及び図2でテストアミノ酪酸(AIB)を含むように設計キニンの類似を示してカルシウムによるCHO - K1細胞株を表す目盛りキニン受容体上の6つのα-アミノイソ酪酸の類縁体の活性比較を示しています。生物発光プレートアッセイ(タネジャ-バゲスワルら 、2009)。ヘキサペプチドアナログFFFSWGaは、受容体活性の陽性コントロールに追加されます。アナログFF [AIB] WGAは、このヘキサペプチド制御アナログよりも活性なりました。 two酪酸の置換、[AIB] FF [AIB] WGA、とアナログは(表2および図2)テストのダブル置換類似体の最も強力であった。
このアッセイがされているとNachmanとPietantonio(2010)、Nachman らを参照して適用する方法の例について。 (2009)、タネジャ-バゲスワルら 。 (2008A)、およびタネジャ-バゲスワルら 。 (2008bの)。
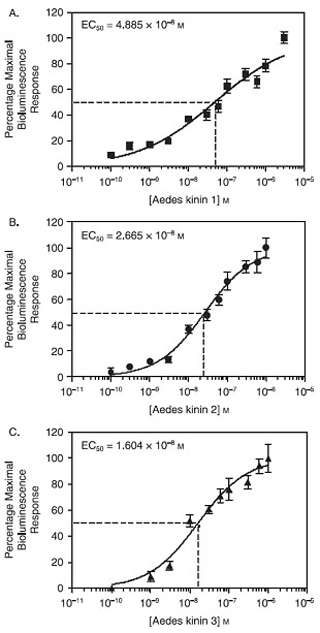
図1。 ネッタイシマカの推定は、カルシウム-生物発光プレートアッセイによるCHO - K1セルE10に有効濃度(EC 50)キニン。濃度-反応曲線のy軸がそれぞれのために観察された最大応答の割合として表される生物発光ユニットから得られたペプチド。データポイントは3つの独立した実験の間に得られたsix複製の平均を表しています。バーは標準誤差を表す。 Aedae - K1 EC 50 = 48 nMの(A)の推定。 (B)Aedae - K2 EC 50の推定= 26 nMの。 Aedae - K3 EC 50 = 16 nMの(C)の推定。 EC 50 Aedae - K3 50 Aedae - K2 50 Aedae - K1、P <0.05。統計分析とグラフは、グラフパッドプリズム4.0ソフトウェアを使用していた。
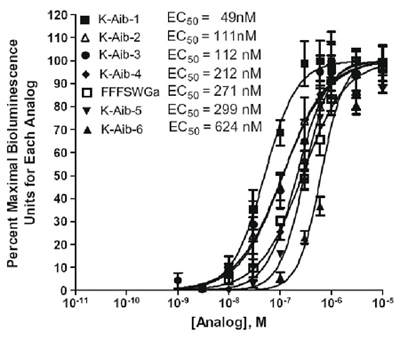
図2。カルシウムの生物発光プレートアッセイによるCHO - K1細胞株を表す目盛りキニン受容体上の6つのα-アミノイソ酪酸の類縁体の活性比較は。y軸は濃度で観察された生物発光の割合として表される各アナログに対してパーセント最大の生物発光ユニットを表します。各アナログ用に試験されたすべての濃度の間で観察された最大応答対。統計分析とグラフは、GraphPad Prism 4.0ソフトウェアを用いて行った。
| 受容体の細胞株ティック | 蚊の受容体の細胞株 | |||
| ペプチド | EC 50(nM)を | を1 mmに最大発光の応答 | EC 50(nM)を | を1 mmに最大発光の応答 |
| AFSWGa | I | I | I | I |
| FASWGa | 586 | 5600 | ND | 400 |
| FFAWGa | 64 | 12800 | 621 | 3050 |
| FFSAGa | I | I | I | I |
| FFSWAa | 417 | 10600 | 2800 | 1830 |
| FFSWGa | 590 | 10800 | ND | 525 |
| FSWGa | I | I | I | I |
| FFSWa | I | I | I | I |
| FFSWG - OH | I | I | I | I |
| FFFSWGa | 259 | 13000 | 562 | 万 |
| FF [AIB] WGA | 29 | 12700 | 445 | 9300 |
表1。推定効力(EC 50)およびダニや蚊の受容体トランスフェクト細胞株で試験したすべてのペプチドの最大の生物発光反応*.
* EC 50は最大値の半分の応答を誘導するために必要な濃度を推定する。 I:生物発光の応答が300未満の単位(ベクトルのみのトランスフェクトされた細胞のレベル)の場合は非アクティブ。 :ペプチドFFSWGaのそれぞれの残基がアラニンで置換されている位置。 ND:アナログのテストを行っていませんが、どちらかの非常に活発ではなかったか低いmolaritiesでアクティブではなかった、従ってEC50を決定することができませんでしたした。
| K - AIB - 1 | [AIB] FF [AIB] WGA |
| K - AIB - 2 | [αMEF] FF [AIB] WGA |
| K - AIB - 3 | AC - R [AIB] FF [AIB] WGA |
| K - AIB - 4 | AC - R [β3F] FF [AIB] WGA |
| K - AIB - 5 | [AIB] RFF [AIB] WGA |
| K - AIB - 6 | [AIB - AIB - AIB - AIB] RFF [AIB] WGA |
ダニ組換えキニン受容体上でテストアミノ酪酸(AIB)を含有する表2。キニン類似体(K)。 AC:アセチル、αミー:αメチル-フェニルアラニン;β3F:β3-フェニルアラニン;:アミド。
ディスカッション
我々は、このプロトコルを使用して、クモ(ダニ、ダニやクモ)、ダニのキニンの受容体から最初に検出された神経ペプチド受容体の機能解析を行うことができた。このメソッドは、主に次の3つのアプリケーションを持っています。最初に、技術はリガンド活性の測定によって受容体のdeorphanizationに適用することができます。第二に、アッセイは、リガンド - 受容体の構造活性相関(SAR)を解決することができます。第三に、メソッドは、創薬に使用することができます。さらに、このプロトコルは、ほとんどすべてのGPCRに関するアゴニストまたはアンタゴニストの活性を研究するために使用することができます。私たちは、小さなライブラリーのスクリーニングのためにこのプロトコルを適応し始めている。我々が利用細胞株では、ユビキタスGタンパク質G 16を発現しない。我々は、Gqをタンパク質と細胞内カルシウムのカスケードを通して節足動物キニン受容体のシグナルので、それを必要としなかったし、ここに示すように、彼らは、哺乳動物細胞でこのシグナル伝達特性を節約。
開示事項
謝辞
博士。コペンハーゲン大学(デンマーク)からCJP Grimmelikhuijzenとマイケルウィリアムソンは、イクオリンはプラスミドの提供のために高く評価されています。私達の協力者、ARS - USDA(米国テキサス州)からのロナルドJ. Nachmanは、ペプチド合成のためとNOVOstarプレートリーダーを提供するための知られています。
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名前 | 会社 | カタログ番号 | コメント(省略可能) |
|---|---|---|---|
| DMEM | インビトロジェン | ABCD1234 | |
| CHO - K1細胞 | ATCC | CCL - 61 | マナッサス、VA、アメリカ合衆国 |
| F12K培地 | インビトロジェン | 21127 | |
| ウシ胎仔血清 | シグマアルドリッチ | F0643 | |
| トリプシン- EDTA(10倍) | インビトロジェン | 15400 | |
| 抗生物質、抗真菌 | インビトロジェン | 15240 | |
| のOpti - MEM Iは、血清培地を削減 | インビトロジェン | 31985 | |
| リポフェクチン試薬 | インビトロジェン | 18292-011 | |
| GENETICIN | インビトロジェン | 10131035 | |
| MC1061/P3 Ultracomp | インビトロジェン | C663 - 03 | |
| QIAprep Spin Miniprepキット | キアゲン社 | 19064 | |
| FuGENE 6トランスフェクション試薬 | ロッシュ | 11 814 443 001 | |
| 96ウェル白色の薄い底のmicrotitereプレート | 共演スター | 3610 | |
| カルシウム不含DMEM培地 | インビトロジェン | 21068 | |
| セレンテラジン | インビトロジェン | C - 2944 | |
| ブライトライン血球計 | Hausserサイエンティフィック | ホーシャム、ペンシルバニア州 | |
| NOVOstar | BMGのLabtechnologies | ||
| プリズムソフトウェア4.0 | グラフパッドソフトウェア株式会社 | サンディエゴ、カリフォルニア州、米国 | |
| T - 25およびT - 75フラスコ | BDファルコン | 353014と353135 |
参考文献
- Kozak, M. An analysis of 5'-noncoding sequences from 699 vertebrate messenger RNAs. Nucleic Acids Research. 15, 8125-8148 (1987).
- Nachman, R., Pietrantonio, P. V., Geary, T. Interaction of mimetic analogs of insect kinin neuropeptides with arthropod receptors. Neuropeptide systems as Targets for Parasite and Pest Control. , (2010).
- Nachman, R. J., Pietrantonio, P. V., Coast, G. M. Towards the development of novel pest management agents based upon insect kinin neuropeptide analogs. Annals of the New York Academy of Sciences. , 1163-11251 (2009).
- Taneja-Bageshwar, S., Strey, A., Isaac, R. E., Coast, G. M., Zubrzak, P., Pietrantonio, P. V., Nachman, R. J. Biostable agonists that match and/or exceed the activity of insect kinins on recombinant arthropod GPCRs. General and Comparative Endocrinology. 162, 122-128 (2009).
- Taneja-Bageshwar, S., Strey, A., Kaczmarek, K., Zabrocki, J., Pietrantonio, P. V., Nachman, R. J. Comparison of insect kinin analogs with cis-peptide bond, type VI-turn motifs identifies optimal stereochemistry for interaction with a recombinant arthropod kinin receptor from the southern cattle tick Boophilus microplus. Peptides. 29, 295-301 .
- Taneja-Bageshwar, S., Strey, A., Zubrzak, P., Williams, H., Reyes-Rangel, G., Juaristi, E., Pietrantonio, P. V., Nachman, R. J. Identification of selective and non-selective, biostable beta-amino acid agonists of recombinant insect kinin receptors from the southern cattle tick Boophilus microplus and mosquito Aedes aegypti. Peptides. 29, 302-309 .
- Taneja-Bageshwar, S., Strey, A., Zubrzak, P., Pietrantonio, P. V., Nachman, R. J. Comparative structure-activity analysis of insect kinin core analogs on recombinant kinin receptors drom southern cattle tick Boophilus microplus (Acari: Ixodidae) and mosquito Aedes aegypti (Diptera: Culicidae). Archives of Insect Biochemistry and Physiology. 62, 128-140 (2006).
- Pietrantonio, P. V., Jagge, C., Taneja-Bageshwar, S., Nachman, R. J., Barhoumi, R. The mosquito Aedes aegypti (L.) leucokinin receptor is a multiligand receptor for the three Aedes kinins. Insect Molecular Biology. 14, 55-67 (2005).
- Holmes, S. P., Barhoumi, R., Nachman, R. J., Pietrantonio, P. V. Functional analysis of a G protein-coupled receptor from the Southern cattle tick Boophilus microplus (Acari: Ixodidae) identifies it as the first arthropod myokinin receptor. Insect Molecular Biology. 12, 27-38 (2003).
- Staubli, F., Jorgensen, T. J. D., Cazzamali, G., Williamson, M., Lenz, C., Sondergaard, L., Roepstorff, P., Grimmelikhuijzen, C. J. P. Molecular identification of the insect adipokinetic hormone receptors. Proceedings of the National Academy of Sciences USA. 99, 3446-3451 (2002).
- Stables, J., Green, A., Marshall, F., Fraser, N., Knight, E., Sautel, M., Milligan, G., Lee, M., Rees, S. A bioluminescent assay for agonist activity at potentially any G-protein coupled receptor. Analytical Biochemistry. 252, 115-126 (1997).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved