Method Article
Un test de bioluminescence calcium pour l'analyse fonctionnelle des moustiques ( Aedes aegypti) Et cochez ( microplus) G récepteurs couplés aux protéines
Dans cet article
Résumé
Ce protocole fournit des instructions pour la sélection de la lignée clonale de cellules et un dosage du calcium bioluminescence d'analyser les relations structure-activité des neuropeptides synthétisés arthropodes sur leur apparenté RCPG. Ce test peut être utilisé pour deorphanization récepteurs et des études de relation structure-activité pour la conception et le peptide analogue synthétique / drogue mènent la découverte.
Résumé
Récepteurs hormonaux arthropodes sont des cibles potentielles pour les pesticides roman comme ils régulent de nombreux processus essentiels physiologiques et comportementaux. La majorité d'entre eux appartiennent à la superfamille des G récepteurs couplés aux protéines (RCPG). Nous nous sommes concentrés sur la caractérisation des récepteurs des kinines arthropodes de la tique et de moustiques. Kinines arthropodes sont des neuropeptides multifonctionnel avec myotropes, diurétique, et la fonction des neurotransmetteurs. Ici, une méthode pour l'analyse systématique des relations structure-activité des kinines insectes sur deux hétérologue kinine exprimant le récepteur des systèmes est décrite. Nous fournissons des informations importantes relatives au développement des analogues des kinines biostable avec le potentiel de perturber le diurétique, myotropes, et / ou processus digestifs chez les tiques et les moustiques.
Les récepteurs des kinines par la tique du bétail sud, Boophilus microplus (Canestrini), et le moustique Aedes aegypti (Linné), ont été exprimés de manière stable dans la lignée cellulaire de mammifère CHO-K1. Les analyses fonctionnelles de ces récepteurs ont été réalisées en utilisant un dosage du calcium plaque de bioluminescence que les mesures de bioluminescence intracellulaire afin de déterminer les niveaux de calcium cytoplasmique lors de l'application de peptides à ces cellules recombinantes. Cette méthode tire parti de la protéine aequorine, une photoprotéine isolé luminescente méduses. Nous transfectées transitoirement l'aequorine plasmide (mtAEQ/pcDNA1) dans des lignées cellulaires qui ont exprimé de façon stable les récepteurs des kinines. Ces cellules ont ensuite été traitées avec le cofacteur coelentérazine, qui se complexe avec l'aequorine intracellulaire. Ce lien ruptures dans la présence de calcium, en émettant des niveaux de luminescence indique la concentration de calcium. Comme le récepteur de signaux kinine par la libération de calcium intracellulaire, l'intensité du signal est liée à la puissance du peptide.
Ce protocole est une synthèse de plusieurs protocoles décrits précédemment avec des modifications, il présente, étape par étape les instructions pour l'expression stable des RCPG dans une lignée cellulaire de mammifère par le biais des tests fonctionnels plaque (Staubly et al, 2002 et Stables et al, 1997.. ). En utilisant cette méthodologie, nous avons été en mesure d'établir des lignées cellulaires stables exprimant les moustiques et les récepteurs des kinines tique, comparer la puissance de trois kinines moustiques, d'identifier les positions des acides aminés essentiels pour l'interaction ligand-récepteur, et d'effectuer de semi-criblage d'un peptide bibliothèque. Parce que les kinines insectes sont sensibles à la dégradation enzymatique rapide par les peptidases endogènes, ils sont sévèrement limités dans l'utilisation comme outils de lutte contre les ravageurs ou les études endocrinologiques. Par conséquent, nous avons également testé les analogues des kinines contenant de l'acide aminé isobutyrique (AIB) afin d'améliorer leur efficacité et biostabilité. Cet analogue peptidase-résistante représente une avance importante dans le développement de biostable analogues des kinines insectes et peut aider au développement du neuropeptide basé stratégies de contrôle des arthropodes.
Protocole
1. Création de lignées cellulaires stables
- Cloner votre GPCR d'intérêt et de l'insérer dans un vecteur d'expression comprenant une séquence 5 'consensus de Kozak (AMCC / GCCATGG) autour du codon d'initiation pour la liaison du ribosome optimale dans un système de mammifères (Kozak, 1986). Ici, nous utilisons l'pcDNA3.1/Bm-KR plasmidique pour le récepteur coche kinine, et le plasmide pcDNA3.1/Aedae-KR pour le récepteur de moustique kinine (Holmes et al, 2003;. Pietrantonio et al, 2005).. Le pcDNA3.1 (-) vecteur code pour la résistance à l'ampicilline pour la sélection de bactéries et de néomycine (G418) pour la sélection de la résistance dans les cellules de mammifères.
- Cultivez cellules CHO-K1 vide (sans plasmides) (ATCC, Manassas, VA, USA) ou d'autres lignées cellulaires souhaité dans un flacon T-25 (BD Falcon) à 37 ° C dans un 5% de CO 2 incubateur humidifié (Holmes et al ., 2003). Toutes les incubations doivent être réalisées dans ces conditions, sauf indication contraire. Maintenir les cellules vides dans un milieu de croissance (milieu F12K avec 10% de sérum de veau foetal) avec 1X antibiotiques antimycotique (Invitrogen, CA).
- Pour diviser des cellules, réchauffer toutes les solutions à 37 ° C. Retirer ancien milieu dans le flacon T-25 et rincer avec 5 ml de PBS, puis retirez du PBS. Pour trypsiniser cellules, ajouter 2 ml de PBS-trypsine-EDTA (34 ml de PBS, 2 ml de bicarbonate de sodium à 7,5%, 4 ml 10X trypsine-EDTA) pendant 2 min. Ajouter 3 ml de milieu et aspirer moyennes de haut en bas pour mélanger les cellules. Transfert moyenne avec des cellules dans un tube conique et centrifuger pendant 2 min à ~ 200-300 g (1000 rpm). Rejeter le surnageant et remettre en suspension les cellules dans 5 ml de milieu. Diluer les cellules resuspendues à une concentration de 1:05 ou 1:10 du milieu frais et le transfert de 5 ml dans un nouveau flacon T-25.
- Après que les cellules se développent sainement (environ 2-3 jours), les graines les cellules CHO-K1 dans T-25 flacons de culture tissulaire et de les cultiver pendant la nuit dans un milieu de croissance sans antibiotiques jusqu'à ce qu'elles soient confluentes à environ 30% (environ 18 heures). Le degré de confluence peut être déterminé par les cellules observant sous microscope à fluorescence inversé.
- Préparer les mélanges suivants pour chaque échantillon:
- Combinez 1-2 ug d'ADN (par exemple: utilisation de 4μl 265μg/μl pcDNA3.1/Aedae-KR) avec 100 ul d'Opti-MEM I Réduction milieu sans sérum (Invitrogen).
- Mélangez 6 réactif Lipofectin ul (InvitrogenTM) en 100 pl de milieu sérique F12K libre, faire un rapport de 1:1 de Lipofectin à l'ADN. Incuber à température ambiante pendant 30-45 min.
- Enlever le milieu de croissance ancienne à partir des cellules et laver les cellules avec 5 ml de milieu sérique F12K libre et puis retirez le milieu sans sérum F12K libre. Dans un tube de 15 ml, mélanger délicatement le mélange de transfection dans 1,8 ml de milieu F12K frais dans un mode goutte à goutte. Ensuite, laver les cellules de l'étape 1.5 avec du PBS et ajouter cette solution de transfection de nouvelles cellules. Incuber pendant 18 heures.
- Changer le support d'F12K moyenne majoré de 10% de sérum fœtal bovin sans antibiotiques et incuber pendant la nuit. Fractionner les cellules en deux T-25 flacons avec milieu F12K majoré de 10% de sérum foetal bovin sans antibiotiques pendant 18 heures (pour séparer les cellules s'il vous plaît voir étape 1.3).
- Remplacer le milieu avec un milieu sélectif (milieu F12K majoré de 10% de sérum fœtal bovin avec 800μg/ml généticine, Invitrogen). Culture des cellules en utilisant le milieu sélectif pour les 3-4 semaines. Au fil du temps cela va sélectionner les cellules qui ont incorporé de façon stable le plasmide dans leur ADN génomique. Continuer à maintenir les cellules en utilisant un milieu d'entretien (milieu F12K majoré de 10% de sérum fœtal bovin avec 400μg/ml généticine). Périodiquement gel des lignées cellulaires avec un rapport 1:1 des milieux de congélation (milieu sélectif avec 20% de DMSO) pour empêcher perd en cas de contamination inattendue.
- Sélection des lignées de cellules clonales: dans un premier temps, trypsiniser et centrifuger les cellules de l'étape 1.8 avec support de maintenance que dans l'étape 1.3. Re-suspendre les cellules dans 5 ml milieu d'entretien, de prendre 0,5 ml de la cellule de veille et ajoutez 4,5 ml de milieu d'entretien frais pour faire une dilution 10x. Transfert de la dilution 10x en 12 puits d'une plaque à 96 puits, l'ajout de 100 ul à chaque puits pour sélectionner des cellules individuelles.
- Continuer à faire 10x dilutions en série de ces cellules pour une suspension final théorique d'une cellule par 100 ul (normalement la dilution finale sera de l'ordre de 10 -11 à 10 -19; le nombre total de 10x dilutions en série est ~ 19) . Immédiatement après chaque dilution, transfert 100 pi de la dilution dans 12 puits de la plaque de 96 puits. Après 18 heures d'incubation, observer des plaques 96 puits sous une lumière de fluorescence inversé ou puits microscope et marque qui semblent contenir une seule cellule unique ou contenir deux cellules qui manifestement divisée par une seule cellule. Gardez en observant chaque jour et moyennes changent tous les trois jours.
- Lorsque les puits sont confluence de 80%ent (environ une semaine), rincer les puits marqués avec 200 ul de PBS et les trypsiniser avec 100 ul de PBS-trypsine-EDTA. Cellules de transfert de chaque bien marqué dans un puits d'une plaque à 6 puits avec 1 ml milieu d'entretien. Cultivez ces cellules pendant 3 jours puis transfert des cellules dans chaque flacon T25. Test de ces cellules en utilisant le test de bioluminescence de calcium avec des peptides agonistes (s'il vous plaît voir la section 2).
- Sélectionnez une lignée cellulaire de l'étape 1.11 avec le plus de réponse dans le test de la plaque de calcium bioluminescence et d'effectuer une deuxième fois les étapes simples cellule de sélection suivants 1.9 à 1.11. Périodiquement gel des lignées cellulaires.
- De la sélection secondaire décrite à l'étape 1.12, choisissez 2-3 lignes de cellules avec le plus de réponse dans le test de la plaque de calcium bioluminescence et les maintenir dans la culture pour les dosages de calcium supplémentaires plaque de bioluminescence. Gardez une trace des numéros de passage. De temps en temps, le gel des lignées cellulaires à partir des passages tôt afin que vous pouvez toujours y revenir si les lignées cellulaires avec des passages plus cesser de pratiquer régulièrement.
2. Le dosage de la plaque de calcium bioluminescence
- Ligaturer le gène rapporteur de l'intérêt dans un vecteur d'expression. Ici nous avons utilisé l'aequorine mtAEQ/pcDNA1 plasmide (un cadeau de MM. PJC Grimmelikhuijzen et Michael Williamson, Université de Copenhague, Danemark). Transformer le plasmide dans E. cellules coli MC1061/PS (Invitrogen) et les purifier en utilisant un QIAprep Spin Miniprep Kit (Qiagen Inc.) Dans la dernière étape éluer le plasmide avec un tampon Tris sans EDTA, sans eau.
- Cultivez des lignées cellulaires de l'étape 1.13 exprimant le récepteur désirée dans le milieu de l'entretien. Lorsque les cellules sont confluentes à 90%, trypsiniser, centrifugeuse et puis re-suspendre les cellules dans 5 ml milieu d'entretien comme à l'étape 1.3. Diluer les cellules (environ 10x avec support de maintenance) et de compter le nombre de cellules avec des cellules contre (Bright-Line hémacytomètre) en microscopie. Ajustez le nombre de cellules d'environ 2 x 10 5 cellules / ml (moyenne de 20 cellules dans l'un des 9 carrés a montré dans le hémacytomètre). Graine 2 cellules ml dilué dans les médias dans chaque puits d'une plaque de six puits. Incuber pendant 24 heures (les cellules devrait atteindre environ 60% de confluence après incubation).
- Changement des médias dans la plaque de 6 puits d'OPTI-MEM. Pour chaque puits, mélanger 96 ul OPTI-MEM avec 4 réactifs de transfection FuGENE ul 6 (Roche Biochemicals) dans un tube de centrifugeuse et laisser reposer à température ambiante pendant 5 min. Ajouter 1 ug d'aequorine / pcDNA 1 ADN plasmidique dans chaque tube puis secouez doucement l'échantillon pendant 1 min, incuber à température ambiante pendant 15-20 min. Ajouter chaque mélange dans chaque puits dans un goutte à goutte tout en agitant la plaque bien. Incuber les plaques pendant 6 heures et le changement à moyen et à F12K milieu contenant 10% de sérum fœtal bovin sans antibiotique.
- Après incubation des cellules dans six plaques bien pour 24 heures, trypsiniser, centrifugeuse et remettre en suspension les cellules que l'étape 1.3. Comptez le nombre de cellules à 400.000 cellules / ml, comme l'étape 2.1 et de transfert de 100 ul (total 40 000 cellules/100 ul) dans chaque puits d'une plaque de 96 puits minces fond blanc microtitration (Costar 3610). Incuber pendant 24 heures jusqu'à environ 80% de confluence des cellules. Ceci est la concentration optimale de cellules pour le dosage de bioluminescence.
- Préparer 90μl/well d'un média sans calcium DMEM (Invitrogen) contenant 5 coelentérazine uM (Invitrogen) dans l'obscurité (coelentérazine est sensible à la lumière). Prenez la plaque de 2,4, enlever les vieux médias et ajoutez cette 90μl dans chaque puits. Incuber les plaques pendant 3 heures dans l'obscurité à 37 ° C et 5% de CO 2, après quoi les cellules de la plaque sont prêts à être testés.
3. Fonctionnement de l'instrument et l'analyse des données
- Chaque lecteur de plaque bioluminescence est différent. Nous effectuons notre analyse en utilisant un lecteur de plaque de Novostar (Labtechnologies BMG) en mode bioluminensence. Si vous utilisez un instrument différent, vous devez adapter le protocole.
- Purger les pompes lecteur de plaque (ou POMPES PRIME) avant utilisation. Eteignez la lumière dans la salle avant de mettre la plaque sur le support de plaque. Une fois le support de plaque a été fermé, allumer les lumières.
- Solubiliser peptides (dans un tube Eppendorf de 1,5 ml) dans les médias DMEM sans calcium. Réglez le "Profondeur Aspirer» et «Détermination de position" de la solution de peptide avant utilisation. Défiez les cellules avec 10 ul (10x) de concentrations variables de peptides (FFFSWG-NH2, Aedes-K1-3, ou d'autres peptides désiré) et commencer immédiatement l'enregistrement de l'émission de lumière. Nous avons mis l'instrument à enregistrer l'émission de lumière (465 nm) pour chaque puits toutes les 2 secondes pour un temps total de 50 secondes.
- Assurez-vous d'inclure un contrôle positif, comme une activité analogique (analogique FFFSWGa a été utilisé, Taneja-Bageshwar et al., 2009) et un contrôle négatif telles que les cellules transfectées seul vecteur. Le contrôle négatif sera nécessaire lors de l'analyse de données pour définir le seuil de référence (voir les résultats représentatifs).Un non reliés, peptide inactif peut également être ajouté en tant que contrôle négatif.
- Après la course est terminée, laver la pompe instrument (ou POMPES PRIME) puis placez votre échantillon peptide prochaine. Sauvegardez vos données et laver les pompes à nouveau.
- La manipulation des données: Transfert des données d'émission de lumière de chaque puits dans une feuille de données Microsoft Excel.
- Collez les données d'Excel à partir de Prism 4.0 du logiciel GraphPad Software Inc (San Diego, Californie, USA). Les concentrations de peptides différents est l'axe des X et des unités de bioluminescence est l'axe Y. Pour normaliser les données, tracer une courbe log-réponse. Sélectionnez une analyse de régression non linéaire courbe d'ajustement (sigmoïde dose-réponse équation avec pente variable) pour obtenir courbes concentration-réponse pour chaque peptide. Les parcelles programmer les valeurs à la fin et donne à la CE 50.
- Chaque expérience doit être répétée trois fois pour l'analyse des données.
4. Les résultats représentatifs:
Lorsqu'elle est exprimée en cellules CHO-K1, le moustique Aedes aegypti kinine récepteurs comporté comme un récepteur multiligand et fonctionnellement répondu à des concentrations aussi faibles que 1 nM de l'kinines trois endogenours Aedes, Aedae kinines 1-3, testés individuellement en utilisant le dosage du calcium plaque de bioluminescence . La figure 1 montre que le classement par ordre de puissance a été obtenue Aedae-K-3> Aedae-K-2> Aedae-K-1, sur la base des valeurs de CE 50 respectives des Aedae-K-3, 16,04 nM; Aedae-K- 2, 26,6 nM et Aedae-K-1, 48,85 nM, qui ont été statistiquement significativement différentes (P <0,05) (Pietrantonio et al., 2005).
Nous avons également utilisé ce test pour déterminer quels résidus kinine sont critiques pour la kinine peptide-récepteur d'interaction. Insecte peptides kinine part un pentapeptide C-terminale qui représente la séquence minimale requise pour l'activité biologique, aussi connu comme noyau. Dans le tableau 1, les analogues des kinines noyau peptidique ont été synthétisés comme une série de remplacement de l'alanine FFSWGa coeur kinine pentapeptide et testé par un test sur plaque de calcium bioluminescence (Taneja-Bageshwar et al., 2006). Nous avons constaté que les acides aminés Phe et Trp 1 4 ont été essentiels pour l'activité de l'insecte pour kinines deux récepteurs.
Le test peut également être utilisé pour tester des peptides conçu pour biostabilité améliorée. Le tableau 2 montre les analogues conçus kinine aminés contenant l'acide isobutyrique (AIB) testé sur la tique des récepteurs des kinines recombinant et la figure 2 montre la comparaison d'activité de six alpha-amino acide isobutyrique analogues sur les récepteurs des kinines tic CHO-K1 exprimant la lignée cellulaire du calcium par un test sur plaque de bioluminescence (Taneja-Bageshwar et al., 2009). L'hexapeptide analogiques FFFSWGa est ajouté pour un contrôle positif pour l'activité du récepteur. L'analogue FF [Aib] WGA a entraîné plus actif que cette commande analogique hexapeptide. L'analogue avec deux changements d'acides aminoisobutyrique, [Aib] FF [Aib] WGA, a été le plus puissant des analogues de double de remplacement testées (tableau 2 et graphique 2).
Pour plus d'exemples de la façon dont cet essai a été et peut être appliquée, voir Nachman et Pietantonio (2010), Nachman et al. (2009), Taneja-Bageshwar et al. (2008a), et Taneja-Bageshwar et al. (2008b).
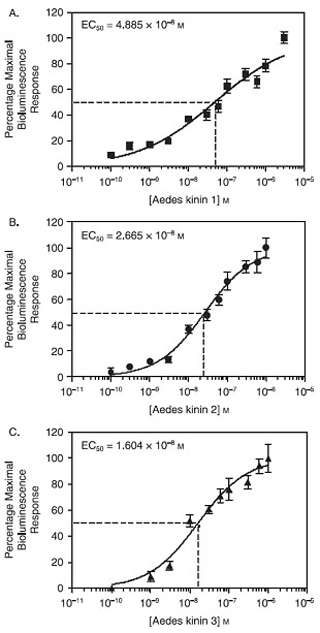
Figure 1. Estimation de l'Aedes kinines concentration efficace (CE 50) sur cellules CHO-K1 E10 par un dosage de la plaque de calcium-bioluminescence. L'axe Y dans les courbes concentration-réponse a été obtenue à partir d'unités de bioluminescence, exprimée en pourcentage de la réponse maximale observée pour chaque peptide. Les points de données représentent la moyenne des six répétitions obtenues au cours de trois expériences indépendantes. Les barres représentent l'erreur standard. (A) Estimation des Aedae-K1 CE 50 = 48 nM. (B) Estimation des Aedae-K2 CE 50 = 26 nM. (C) Estimation de Aedae-K3 CE 50 = 16 nM. CE 50 Aedae-K3 50 Aedae-K2 50 Aedae-K1; P <0,05. L'analyse statistique et les graphiques ont été avec le logiciel GraphPad Prism 4.0.
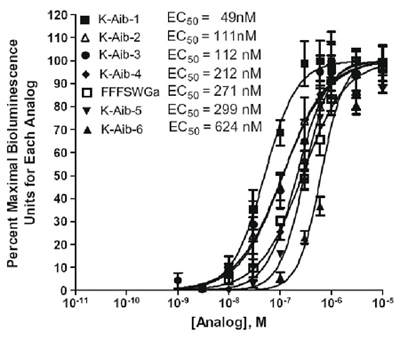
Figure 2. Activité de comparaison de six alpha-amino acide isobutyrique analogues sur les récepteurs des kinines tic CHO-K1 exprimant lignée cellulaire par un dosage du calcium plaque de bioluminescence. L'axe y représente les unités pour cent bioluminescence maximale pour chaque analogiques, exprimée en pourcentage de la bioluminescence observée à une concentration par rapport à la réponse maximale observée parmi toutes les concentrations testées pour chaque analogique. L'analyse statistique et les graphiques ont été réalisés avec le logiciel GraphPad Prism 4.0.
| Cochez la lignée cellulaire des récepteurs | Ligne de Mosquito récepteurs des cellules | |||
| Peptides | CE 50 (nM) | Réponse bioluminescence maximale à 1 mM | CE 50 (nM) | Réponse bioluminescence maximale à 1 mM |
| AFSWGa | J'ai | J'ai | J'ai | J'ai |
| FASWGa | 586 | 5600 | ND | 400 |
| FFAWGa | 64 | 12800 | 621 | 3050 |
| FFSAGa | J'ai | J'ai | J'ai | J'ai |
| FFSWAa | 417 | 10600 | 2800 | 1830 |
| FFSWGa | 590 | 10800 | ND | 525 |
| FSWGa | J'ai | J'ai | J'ai | J'ai |
| FFSWa | J'ai | J'ai | J'ai | J'ai |
| FFSWG-OH | J'ai | J'ai | J'ai | J'ai |
| FFFSWGa | 259 | 13000 | 562 | 10000 |
| FF [Aib] WGA | 29 | 12700 | 445 | 9300 |
Tableau 1. Puissances estimées (CE 50) et la réponse bioluminescence maximale de toutes les peptides testés sur les tiques et les moustiques lignes récepteurs de cellules transfectées *.
* La CE 50 estime la concentration nécessaire pour induire une réponse semi-maximale. I: Inactif si la réponse bioluminescence est inférieur à 300 unités (niveau de vecteur que les cellules transfectées). R: La position où le résidu respectives dans le FFSWGa peptide a été remplacé par l'alanine. ND: L'analogique a été testé, mais a été soit pas très actifs ou non actifs à moindre molarités, donc une CE50 n'a pu être déterminée.
| K-Aib-1 | [Aib] FF [Aib] WGA |
| K-Aib-2 | [Α MeF] FF [Aib] WGA |
| K-Aib-3 | AC-R [Aib] FF [Aib] WGA |
| K-Aib-4 | AC-R [β3F] FF [Aib] WGA |
| K-Aib-5 | [Aib] RFF [Aib] WGA |
| K-Aib-6 | [Aib-Aib-Aib-Aib] RFF [Aib] WGA |
Tableau 2. Kinine analogues (K) contenant des groupes amino acide isobutyrique (AIB) testé sur la tique des récepteurs des kinines recombinantes. Ac: acétyle; α-moi: α méthyl-phénylalanine; β3F: β3-phénylalanine; une: amide.
Discussion
Nous avons été en mesure d'effectuer la caractérisation fonctionnelle du récepteur neuropeptide découvert des arachnides (tiques, acariens et araignées), le récepteur kinine tique, en utilisant ce protocole. Cette méthode a trois applications principales. Tout d'abord, la technique peut être appliquée pour deorphanization récepteurs grâce à des mesures d'activité ligand. Deuxièmement, le dosage peut résoudre ligand-récepteur relations structure-activité (SAR). Troisièmement, les méthodes peuvent être utilisées dans la découverte de médicaments. Par ailleurs, ce protocole peut être utilisé pour étudier l'activité des agonistes ou antagonistes sur presque n'importe quelle RCPG. Nous commençons à adapter ce protocole pour le dépistage des petites bibliothèques. La lignée cellulaire nous avons utilisé n'exprime pas la protéine ubiquitaire G G 16. Nous n'avons pas besoin, car arthropodes récepteurs des kinines signal par la protéine Gq et la cascade intracellulaire de calcium et ils conserver cette propriétés de signalisation dans les cellules de mammifères, comme indiqué ici.
Déclarations de divulgation
Remerciements
Drs. PJC Grimmelikhuijzen et Michael Williamson de l'Université de Copenhague (Danemark) sont appréciés pour fournir l'aequorine plasmide. Notre collaborateur, le Dr Ronald J. Nachman de ARS-USDA (TX, USA), est reconnu pour la synthèse peptidique et de fournir au lecteur de plaque Novostar.
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif | Société | Numéro de catalogue | Commentaires (optionnel) |
|---|---|---|---|
| DMEM | Invitrogen | ABCD1234 | |
| Cellules CHO-K1 | ATCC | CCL-61 | Manassas, VA, USA |
| F12K moyennes | Invitrogen | 21127 | |
| Sérum de veau fœtal | Sigma-Aldrich | F0643 | |
| Trypsine-EDTA (10x) | Invitrogen | 15400 | |
| Antibiotiques Antimycosique | Invitrogen | 15240 | |
| Opti-MEM I Réduction milieu sans sérum | Invitrogen | 31985 | |
| Réactif Lipofectin | Invitrogen | 18292-011 | |
| Généticine | Invitrogen | 10131035 | |
| MC1061/P3 Ultracomp | Invitrogen | C663-03 | |
| QIAprep Spin Miniprep Kit | Qiagen Inc | 19064 | |
| Réactifs de transfection FuGENE 6 | Roche | 11 814 443 001 | |
| 96 puits blanche fine plaque inférieure microtitere | Costar | 3610 | |
| sans calcium milieu DMEM | Invitrogen | 21068 | |
| Coelentérazine | Invitrogen | C-2944 | |
| Bright-Ligne hémacytomètre | Hausser scientifique | Horsham, Pennsylvanie | |
| Novostar | Labtechnologies BMG | ||
| Prism Software 4.0 | GraphPad Software Inc | San Diego, Californie, USA | |
| T-25 et T-75 Flacons | BD Falcon | 353014 353135 et le |
Références
- Kozak, M. An analysis of 5'-noncoding sequences from 699 vertebrate messenger RNAs. Nucleic Acids Research. 15, 8125-8148 (1987).
- Nachman, R., Pietrantonio, P. V., Geary, T. Interaction of mimetic analogs of insect kinin neuropeptides with arthropod receptors. Neuropeptide systems as Targets for Parasite and Pest Control. , (2010).
- Nachman, R. J., Pietrantonio, P. V., Coast, G. M. Towards the development of novel pest management agents based upon insect kinin neuropeptide analogs. Annals of the New York Academy of Sciences. , 1163-11251 (2009).
- Taneja-Bageshwar, S., Strey, A., Isaac, R. E., Coast, G. M., Zubrzak, P., Pietrantonio, P. V., Nachman, R. J. Biostable agonists that match and/or exceed the activity of insect kinins on recombinant arthropod GPCRs. General and Comparative Endocrinology. 162, 122-128 (2009).
- Taneja-Bageshwar, S., Strey, A., Kaczmarek, K., Zabrocki, J., Pietrantonio, P. V., Nachman, R. J. Comparison of insect kinin analogs with cis-peptide bond, type VI-turn motifs identifies optimal stereochemistry for interaction with a recombinant arthropod kinin receptor from the southern cattle tick Boophilus microplus. Peptides. 29, 295-301 .
- Taneja-Bageshwar, S., Strey, A., Zubrzak, P., Williams, H., Reyes-Rangel, G., Juaristi, E., Pietrantonio, P. V., Nachman, R. J. Identification of selective and non-selective, biostable beta-amino acid agonists of recombinant insect kinin receptors from the southern cattle tick Boophilus microplus and mosquito Aedes aegypti. Peptides. 29, 302-309 .
- Taneja-Bageshwar, S., Strey, A., Zubrzak, P., Pietrantonio, P. V., Nachman, R. J. Comparative structure-activity analysis of insect kinin core analogs on recombinant kinin receptors drom southern cattle tick Boophilus microplus (Acari: Ixodidae) and mosquito Aedes aegypti (Diptera: Culicidae). Archives of Insect Biochemistry and Physiology. 62, 128-140 (2006).
- Pietrantonio, P. V., Jagge, C., Taneja-Bageshwar, S., Nachman, R. J., Barhoumi, R. The mosquito Aedes aegypti (L.) leucokinin receptor is a multiligand receptor for the three Aedes kinins. Insect Molecular Biology. 14, 55-67 (2005).
- Holmes, S. P., Barhoumi, R., Nachman, R. J., Pietrantonio, P. V. Functional analysis of a G protein-coupled receptor from the Southern cattle tick Boophilus microplus (Acari: Ixodidae) identifies it as the first arthropod myokinin receptor. Insect Molecular Biology. 12, 27-38 (2003).
- Staubli, F., Jorgensen, T. J. D., Cazzamali, G., Williamson, M., Lenz, C., Sondergaard, L., Roepstorff, P., Grimmelikhuijzen, C. J. P. Molecular identification of the insect adipokinetic hormone receptors. Proceedings of the National Academy of Sciences USA. 99, 3446-3451 (2002).
- Stables, J., Green, A., Marshall, F., Fraser, N., Knight, E., Sautel, M., Milligan, G., Lee, M., Rees, S. A bioluminescent assay for agonist activity at potentially any G-protein coupled receptor. Analytical Biochemistry. 252, 115-126 (1997).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon