Method Article
Un ensayo de bioluminiscencia de calcio para el análisis funcional de los Mosquitos ( Aedes aegypti) Y Tick ( Rhipicephalus microplus) G receptores acoplados a proteínas
En este artículo
Resumen
Este protocolo proporciona instrucciones para la selección clonal de las células de línea y un ensayo de bioluminiscencia de calcio para analizar las relaciones estructura-actividad de los neuropéptidos sintetizados por artrópodos en su cognado GPCRs. Este ensayo se puede utilizar para deorphanization receptor y la actividad de la estructura de los estudios de la relación para el diseño y el péptido sintético análogo / drogas provocar descubrimiento.
Resumen
Receptores de la hormona de artrópodos son objetivos potenciales de los plaguicidas novela ya que regulan muchos procesos fisiológicos y de comportamiento esencial. La mayoría de ellos pertenecen a la superfamilia de la proteína G-receptores (GPCR). Nos hemos centrado en la caracterización de los receptores de cininas artrópodos de la garrapata y el mosquito. Cininas artrópodos son neuropéptidos multifuncional con myotropic, diurético, y función de los neurotransmisores. En este caso, un método para el análisis sistemático de las relaciones estructura-actividad de las cininas insectos en dos heteróloga cinina receptor que expresan los sistemas se describe. Ofrecemos información importante y relevante para el desarrollo de análogos de bioestable quinina con el potencial de interrumpir el diurético, myotropic, y / o los procesos digestivos en las garrapatas y los mosquitos.
Los receptores de cininas de la garrapata del ganado del sur, Boophilus microplus (Canestrini), y el mosquito Aedes aegypti (Linnaeus), se expresan de forma estable en la línea de células de mamíferos CHO-K1. Análisis funcional de estos receptores se completaron con una placa de ensayo de bioluminiscencia de calcio que las medidas de bioluminiscencia intracelular para determinar los niveles citoplasmáticos de calcio en la aplicación de péptidos a las células recombinantes. Este método tiene la ventaja de la proteína aequorin, un photoprotein aislado de medusas luminiscentes. Estamos transfectadas transitoriamente la aequorin plásmido (mtAEQ/pcDNA1) en líneas celulares que expresan de forma estable los receptores de cininas. Estas células fueron tratadas con el coelenterazine cofactor, que los complejos con aequorin intracelular. Este vínculo se rompe en presencia de calcio, los niveles de emisión de luminiscencia indica la concentración de calcio. Como el receptor de señales de quinina a través de la liberación de calcio intracelular, la intensidad de la señal se relaciona con la potencia de los péptidos.
Este protocolo es una síntesis de varios protocolos descritos anteriormente, con modificaciones, se presenta paso a paso las instrucciones para la expresión estable de GPCRs en una línea celular de mamíferos a través de los ensayos de placa funcional (Staubly et al, 2002 y establos y otros, 1997.. ). Utilizando esta metodología, hemos sido capaces de establecer líneas estables de células que expresan el mosquito y la garrapata receptores de cininas, comparar la potencia de tres cininas mosquito, identificar las posiciones de los aminoácidos fundamentales para la interacción ligando-receptor, y realizar semi-rendimiento de procesamiento de un péptido de la biblioteca. Debido a que las cininas insectos son susceptibles a la degradación rápida enzimática por peptidasas endógenas, que son muy limitados en su uso como herramientas para el control de plagas o de estudios endocrinológicos. Por lo tanto, también a prueba análogos de quinina que contiene el ácido amino isobutírico (AIB) para aumentar su potencia y bioestabilidad. Este análogo peptidasa-resistentes representa una ventaja importante en el desarrollo de análogos de la quinina bioestable insectos y puede ayudar en el desarrollo de estrategias basadas en el neuropéptido artrópodos control.
Protocolo
1. Establecimiento de líneas celulares estables
- Clon de su GPCR de interés y la inserta en un vector de expresión que incorpora una secuencia 5 'consenso Kozak (AMCC / GCCATGG) alrededor del codón de inicio de la unión ribosomal óptimo en un sistema mamífero (Kozak, 1986). Aquí se utiliza el pcDNA3.1/Bm-KR plásmido para el receptor de garrapata quinina, y el pcDNA3.1/Aedae-KR plásmido para que el mosquito de los receptores de cininas (Holmes et al, 2003;. Pietrantonio et al, 2005).. El pcDNA3.1 (-) vector codifica resistencia a la ampicilina para la selección de bacterias y resistencia a la neomicina (G418) para la selección de células de mamíferos.
- Crecer células CHO-K1 vacío (sin plásmidos) (ATCC, Manassas, VA, EE.UU.) o de otro tipo de línea que desee de células en un frasco T-25 (BD Falcon) a 37 ° C en un 5% de CO 2 humidificado incubadora (Holmes et al ., 2003). Todas las incubaciones más se debe hacer bajo estas condiciones, a menos que se especifique lo contrario. Mantener las celdas vacías en medio de cultivo (medio F12K con suero fetal bovino al 10%) con 1X antibiótico-antimicótico (Invitrogen, CA).
- Para dividir celdas, todas las soluciones de calentamiento a 37 º C. Quitar viejo medio en el frasco T-25 y enjuague con 5 ml de PBS y luego retire PBS. Para trypsinize células, añadir 2 ml de PBS-tripsina-EDTA (34 ml de PBS, 2 ml de 7,5% de bicarbonato de sodio, 4 ml de tripsina-EDTA 10 veces) durante 2 min. Añadir 3 ml de medio y medio aspirado hacia arriba y hacia abajo para mezclar las células. Medio de transmisión con las células en un tubo cónico y centrifugar durante 2 minutos a ~ 200-300 g (1.000 rpm). Desechar el sobrenadante y resuspender las células en 5 ml de medio. Diluir las células se resuspendieron a una concentración de 1:05 o 1:10 con un nuevo medio y la transferencia de 5 ml en un nuevo frasco T-25.
- Después que las células están creciendo saludablemente (alrededor de 2-3 días), las semillas de las células CHO-K1 en T-25 frascos de cultivo de tejidos y crecer durante la noche en medio de cultivo sin antibióticos hasta que son cerca del 30% confluencia (aproximadamente 18 horas). El grado de confluencia puede ser determinada por la observación de las células bajo el microscopio fluorescente invertida.
- Prepare las siguientes mezclas para cada muestra:
- Combine 2.1 ug de ADN (por ejemplo: uso de 4μl 265μg/μl pcDNA3.1/Aedae-KR) con 100 l de Opti-MEM I Reducción de medio sin suero (Invitrogen).
- Mix 6 reactivo Lipofectina l (InvitrogenTM) en 100 l medio F12K libre de suero, por lo que una proporción de 1:1 de Lipofectina al ADN. Incubar a temperatura ambiente durante 30-45 min.
- Retire el medio de cultivo de edad de las células y se lavan las células con 5 ml de medio libre de suero y F12K retire el medio libre de suero F12K. En un tubo de 15 ml, mezclar suavemente la mezcla de transfección en 1,8 ml de medio F12K fresco en forma gota a gota. A continuación, se lavan las células a partir del paso 1.5 con PBS y añadir la solución de transfección a las células nuevas. Incubar durante 18 horas.
- Cambiar el medio a medio F12K más el 10% de suero fetal bovino sin antibióticos y se incuba durante la noche. Dividir las celdas en dos T-25 frascos con medio F12K más el 10% de suero fetal bovino sin antibióticos por 18 horas (para dividir celdas, por favor, consulte el paso 1.3).
- Sustituya el medio con un medio selectivo (medio F12K más el 10% de suero fetal bovino con 800μg/ml geneticina, Invitrogen). Cultivo de las células utilizando el medio selectivo para 3-4 semanas. Con el tiempo esto va a seleccionar las células que han incorporado de manera estable el plásmido en su ADN genómico. Siguen manteniendo a las células con medio de mantenimiento (medio F12K más el 10% de suero fetal bovino con 400μg/ml geneticina). Periódicamente congelar las líneas celulares con una proporción de 1:1 de los medios de congelación (medio selectivo con un 20% DMSO) para evitar pérdidas en caso de contaminación inesperado.
- Selección de líneas clonales de células: como un primer paso, trypsinize y centrifugar las células a partir del paso 1.8 con medio de mantenimiento como en el paso 1.3. Vuelva a suspender las células en 5 ml de medio de mantenimiento, tomar 0,5 ml de la suspensión celular y añadir 4,5 ml de medio de mantenimiento fresco para hacer una dilución de 10x. La transferencia de la dilución de 10 veces en 12 pozos de una placa de 96 pocillos, añadiendo 100 l de cada pozo para seleccionar las células individuales.
- Seguir haciendo 10x diluciones en serie de estas células de una suspensión teórico final de un celular por cada 100 l (normalmente la dilución final estará en el rango de 10 -11 a 10 -19, el número total de 10 veces diluciones en serie es de ~ 19) . Inmediatamente después de cada dilución, la transferencia de 100 l de la dilución en 12 pozos de la placa de 96 pocillos. Después de 18 horas de incubación, observar placas de 96 y bajo una luz invertida o pozos microscopio de fluorescencia y la marca que parece que sólo contienen una sola célula o células que contienen dos, obviamente, dividido en una sola célula. Mantener la observación de todos los días y medio de cambiar cada tres días.
- Cuando los pozos son un 80% confluenciadiferentes (una semana), enjuague los pozos marcados con 200 l de PBS y trypsinize con 100 l de PBS-tripsina-EDTA. Células de transferencia de cada marca y en un pocillo de una placa de 6 pocillos con 1 ml de medio de mantenimiento. Crecer las células durante 3 días y luego la transferencia de células en cada frasco T25. Prueba de estas células utilizando el ensayo de bioluminiscencia de calcio con péptidos agonistas (ver sección 2).
- Seleccione una línea celular a partir del paso 1,11 con la mayor respuesta en el ensayo de placa de calcio bioluminiscencia y llevar a cabo por segunda vez la única célula siguientes pasos de selección 1.9 a 1.11. Periódicamente congelar las líneas celulares.
- Desde la selección secundaria describe en el paso 1.12, 02.03 elegir las líneas celulares con la mayor respuesta en el ensayo de placa de calcio bioluminiscencia y mantener en cultivo para los ensayos de más de calcio placa bioluminiscencia. Lleve un registro de números de pasaje. De vez en cuando, congelar las líneas celulares a partir de principios de los pasajes para que usted siempre puede volver a ellos si las líneas de células con más pasajes de dejar de realizar consistentemente.
2. La bioluminiscencia de calcio placa de ensayo
- Ligar el gen reportero de interés en un vector de expresión. Aquí usamos mtAEQ/pcDNA1 aequorin plásmido (un regalo de los Dres. CJP Grimmelikhuijzen y Michael Williamson de la Universidad de Copenhague, Dinamarca). Transformar el plásmido en E. células MC1061/PS coli (Invitrogen) y purificarlos con un giro QIAprep miniprep kit (Qiagen Inc.). En el paso final eluir el plásmido con tampón Tris sin EDTA, no agua.
- Crecen las líneas celulares a partir del paso 1,13 expresan el receptor deseado en medio de mantenimiento. Cuando las células son el 90% confluentes, trypsinize, centrifugación y luego volver a suspender las células en 5 ml de medio de mantenimiento como en el paso 1.3. Diluir las células (alrededor de 10 veces con medio de mantenimiento) y contar el número de células con el contador de células (línea brillante hemocitómetro) bajo el microscopio. Ajustar el número de células de aproximadamente 2 x 10 5 células / ml (media de 20 células en una de las nueve plazas mostró en el hemocitómetro). Semillas de 2 ml diluida en las células de los medios de comunicación en cada pocillo de una placa de seis también. Incubar durante 24 horas (las células deben llegar a un 60% de confluencia después de la incubación).
- Cambiar los medios de comunicación en la placa de 6 pozos de OPTI-MEM medio. Para cada bien, mezclar 96 l OPTI-MEM con 4 reactivo de transfección l FuGENE 6 (Roche bioquímicos) en un tubo de microcentrífuga y deje reposar a temperatura ambiente durante 5 min. Añadir 1 g de aequorin / pcDNA un plásmido de ADN en cada tubo y agite suavemente la muestra durante 1 minuto, se incuban a temperatura ambiente durante 15-20 minutos. Añadir cada mezcla en cada pozo en un gota a gota, mientras agitando suavemente la placa también. Las placas se incuban durante 6 horas y cambiar el medio a F12K medio que contiene 10% de suero fetal bovino sin antibiótico.
- Después de incubar las células en seis y placa durante 24 horas, trypsinize, centrifugar y resuspender las células en el paso 1.3. Cuente el número de células a 400.000 células / ml en el paso 2.1 y la transferencia de 100 l (total 40.000 células/100 l) en cada pocillo de un 96-well inferior delgada placa de microtitulación (Costar 3610). Incubar durante 24 horas más hasta el 80% de confluencia celular. Esta es la concentración óptima de células para el ensayo de bioluminiscencia.
- Prepare 90μl/well de un medio libre de calcio DMEM (Invitrogen) que contiene 5 coelenterazine M (Invitrogen) en la oscuridad (coelenterazine es sensible a la luz). Tome la placa de 2,4, retire el material antiguo y añadir este 90μl en cada pozo. Incubar las placas durante 3 horas en la oscuridad a 37 ° C y 5% de CO 2, después de que las células de la placa está listo para ser probado.
3. Operación del instrumento y análisis de datos
- Cada lector de placas de bioluminiscencia es diferente. Llevamos a cabo nuestro ensayo con un Novostar (Labtechnologies BMG) lector de placas en el modo de bioluminensence. Si se utiliza un instrumento diferente, debe adaptar el protocolo.
- Purgar las bombas lector de placas (o bombas de PRIME) antes de su uso. Apaga la luz en la sala antes de poner la placa en el soporte de la placa. Una vez que el soporte de la placa se ha cerrado, encender las luces.
- Solubilizar péptidos (en un tubo de 1,5 ml Eppendorf) en los medios de comunicación libres de calcio DMEM. Establecer la "profundidad Aspirar" y "Determinación de la posición" de la solución de péptido antes de su uso. Desafío de las células con 10 l (10 veces) de diferentes concentraciones de los péptidos (FFFSWG-NH2, Aedes-K1-3, o otros péptidos se desea) y de inmediato comenzar a grabar la emisión de luz. Hemos establecido el instrumento para registrar la emisión de luz (465 nm) para cada pozo cada 2 segundos durante un tiempo total de 50 segundos.
- Asegúrese de incluir un control positivo, como un activo análogo (analógico FFFSWGa se ha utilizado, Taneja-Bageshwar et al., 2009) y un control negativo, como las células transfectadas único vector. El control negativo, será necesario durante el análisis de datos para establecer el umbral de referencia (ver resultados representativos).Un péptido no relacionado, inactivos también puede ser añadido como control negativo.
- Después de la carrera está completo, lavar la bomba de instrumento (o bombas de PRIME) y coloque la muestra de péptido siguiente. Guarde sus datos y lavar las bombas de nuevo.
- El manejo de datos: Transferencia de los datos de emisión de luz de cada pocillo en una hoja de datos de Microsoft Excel.
- Pegue los datos de Excel a Prisma 4.0 del software de GraphPad Software Inc. (San Diego, CA, EE.UU.). Las concentraciones de péptido diversos es el eje X y las unidades de la bioluminiscencia es el eje. Para normalizar los datos, trazar una curva log-respuesta. Seleccione una curva de regresión no lineal de análisis en forma (sigmoidal dosis-respuesta ecuación con pendiente variable) para obtener curvas concentración-respuesta para cada péptido. El programa dibuja los valores de la final y le da la CE 50.
- Cada experimento debe ser repetido tres veces para el análisis de datos.
4. Los resultados representativos:
Cuando se expresa en células CHO-K1, el mosquito Aedes aegypti receptor de quinina se comportó como un receptor multiligand y funcionalmente respondió a concentraciones tan bajas como 1 nM de los tres cininas endogenours Aedes, Aedae cininas 1-3, probado por separado utilizando la bioluminiscencia de calcio ensayo de placa . La figura 1 muestra que el orden de potencia se obtuvo Aedae-K-3> Aedae-K-2> Aedae-K-1, sobre la base de los respectivos valores de EC50 de Aedae-K-3, 16,04 nM; Aedae-K- 2, 26,6 nM y Aedae-K-1, 48,85 nM, que presentaban diferencias estadísticamente significativas (P <0,05) (Pietrantonio et al., 2005).
También utilizó este ensayo para determinar que los residuos de quinina son críticos para la quinina péptido-receptor de la interacción. Insectos péptidos de cininas compartir un pentapéptido C-terminal que representa la secuencia mínima necesaria para la actividad biológica, también conocida como núcleo. En la Tabla 1, los análogos de péptidos de cininas fundamentales se sintetizan como una serie de sustitución de alanina del núcleo cinina pentapéptido FFSWGa y probados por un ensayo de placa de calcio bioluminiscencia (Taneja-Bageshwar et al., 2006). Se encontró que los aminoácidos Phe y Trp un 4 fueron esenciales para la actividad de las cininas insectos para ambos receptores.
El ensayo también puede ser utilizado para probar péptidos diseñados para bioestabilidad mejorada. La Tabla 2 muestra los análogos diseñados quinina que contiene aminoácidos isobutírico (AIB) a prueba en la marca recombinante del receptor de quinina y la figura 2 se muestra la comparación de la actividad de seis aminoácidos alfa-análogos del ácido isobutírico sobre los receptores de cininas garrapata expresar CHO-K1 línea celular por calcio bioluminiscencia ensayo de placa (Taneja-Bageshwar et al., 2009). El hexapéptido FFFSWGa analógica se agrega un control positivo de la actividad del receptor. El análogo FF [Aib] WGA resultó más activo que el control analógico hexapéptido. El análogo con dos reemplazos de ácido aminoisobutírico, [Aib] FF [Aib] Ventajas de Windows Original, fue el más potente de los análogos de doble reemplazo de prueba (Cuadro 2 y Gráfico 2).
Para más ejemplos de cómo este ensayo ha sido y puede ser aplicado ver Nachman y Pietantonio (2010), Nachman et al. (2009), Taneja-Bageshwar et al. (2008a), y Taneja-Bageshwar et al. (2008b).
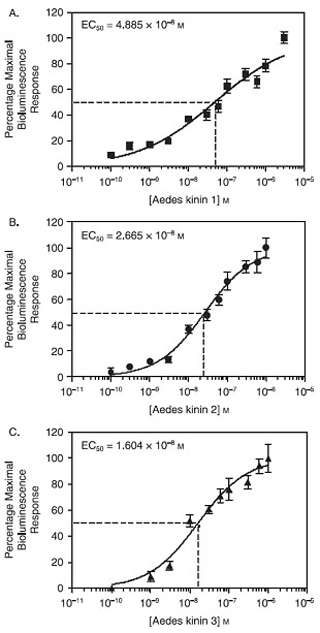
Figura 1. Estimación de Aedes cininas concentración efectiva (CE 50) en células CHO-K1 E10 por un ensayo de placa de calcio bioluminiscencia. El eje de las curvas de concentración-respuesta se obtuvo de las unidades de bioluminiscencia expresado como porcentaje de la respuesta máxima observada para cada péptido. Los puntos de datos representan el promedio de seis repeticiones obtenidas en tres experimentos independientes. Las barras representan el error estándar. (A) Estimación de Aedae-K1 EC 50 = 48 nM. (B) Estimación de Aedae K2-EC 50 = 26 nM. (C) Estimación de Aedae-K3 CE 50 = 16 nM. EC 50-K3 Aedae <50 CE Aedae-K2 <50 CE Aedae-K1, p <0,05. El análisis estadístico y gráficos fueron con el software GraphPad Prisma 4.0.
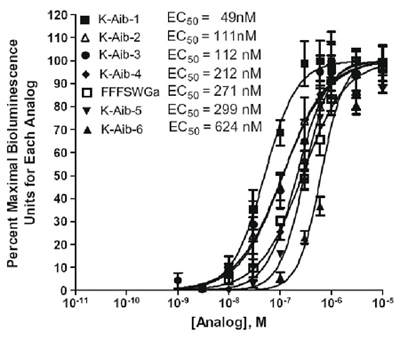
Figura 2. Comparación de la actividad de seis alfa-amino análogos del ácido isobutírico en el receptor de garrapata cinina expresar CHO-K1 línea celular mediante un ensayo de placa de calcio bioluminiscencia. El eje y representa unidades por ciento máximo de bioluminiscencia para cada análogo expresado como porcentaje de la bioluminiscencia observó a una concentración frente a la respuesta máxima observada entre todas las concentraciones ensayadas para cada análogo. El análisis estadístico y gráficos se realizaron con el software GraphPad Prisma 4.0.
| Marque la línea del receptor de la célula | Receptor de la línea celular de mosquitos | |||
| Péptidos | CE 50 (nm) | Bioluminiscencia respuesta máxima a 1 mM | CE 50 (nm) | Bioluminiscencia respuesta máxima a 1 mM |
| AFSWGa | Yo | Yo | Yo | Yo |
| FASWGa | 586 | 5600 | ND | 400 |
| FFAWGa | 64 | 12800 | 621 | 3050 |
| FFSAGa | Yo | Yo | Yo | Yo |
| FFSWAa | 417 | 10600 | 2800 | 1830 |
| FFSWGa | 590 | 10800 | ND | 525 |
| FSWGa | Yo | Yo | Yo | Yo |
| FFSWa | Yo | Yo | Yo | Yo |
| FFSWG-OH | Yo | Yo | Yo | Yo |
| FFFSWGa | 259 | 13000 | 562 | 10000 |
| FF [Aib] Ventajas de Windows Original | 29 | 12700 | 445 | 9300 |
Tabla 1. Potencias estimado (CE 50) y la respuesta de la bioluminiscencia máximo de todos los péptidos probados en garrapatas y mosquitos receptor líneas celulares transfectadas *.
* La CE 50 estimaciones de la concentración necesaria para inducir una respuesta mitad de la máxima. I: Inactivo si la respuesta de la bioluminiscencia es menos de 300 unidades (nivel de vectores, sólo las células transfectadas). R: La posición en la que ha sido el residuo correspondiente en el FFSWGa péptido reemplazado por alanina. ND: El análogo se puso a prueba, pero era o no muy activos o no activos a bajas molaridades, por tanto, un EC50 no se pudo determinar.
| K-AIB-1 | [Aib] FF [Aib] Ventajas de Windows Original |
| K-AIB-2 | [Α MEF] FF [Aib] Ventajas de Windows Original |
| K-AIB-3 | Ac-R [Aib] FF [Aib] Ventajas de Windows Original |
| K-AIB-4 | Ac-R [β3F] FF [Aib] Ventajas de Windows Original |
| K-AIB-5 | [Aib] RFF [Aib] Ventajas de Windows Original |
| K-AIB-6 | [AIB-AIB-AIB-Aib] RFF [Aib] Ventajas de Windows Original |
Tabla 2. Quinina análogos (K), que contiene aminoácidos isobutírico (AIB) a prueba en la marca cinina receptor recombinante. Ac: acetilo; α Me: α metil-fenilalanina, β3F: β3-fenilalanina, un: amida.
Discusión
Hemos sido capaces de llevar a cabo la caracterización funcional del receptor del neuropéptido descubrió por primera vez a partir de los arácnidos (garrapatas, ácaros y arañas), los receptores de cininas garrapata, usando este protocolo. Este método tiene tres aplicaciones principales. En primer lugar, la técnica se puede aplicar para deorphanization receptor a través de mediciones de la actividad del ligando. En segundo lugar, el ensayo puede resolver ligando-receptor relaciones estructura-actividad (SAR). En tercer lugar, los métodos pueden ser utilizados en el descubrimiento de fármacos. Además, este protocolo puede ser usado para estudiar la actividad de los agonistas o antagonistas en casi cualquier GPCR. Estamos comenzando a adaptar el protocolo para la detección de pequeñas bibliotecas. La línea celular se utilizó no expresa la proteína ubicua G G 16. Nosotros no lo necesitamos porque artrópodos receptores de cininas señal a través de la proteína Gq y la cascada de calcio intracelular y la conservación de las propiedades de esta señalización en células de mamíferos, como se muestra aquí.
Divulgaciones
Agradecimientos
Los Dres. CJP Grimmelikhuijzen y Michael Williamson de la Universidad de Copenhague (Dinamarca) son apreciados para la prestación del aequorin plásmido. Nuestro colaborador, el Dr. Ronald J. Nachman del ARS-USDA (Texas, EE.UU.), es reconocido por la síntesis de péptidos y de proporcionar al lector de placas Novostar.
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Número de catálogo | Comentarios (opcional) |
|---|---|---|---|
| DMEM | Invitrogen | ABCD1234 | |
| Células CHO-K1 | ATCC | CCL-61 | Manassas, VA, EE.UU. |
| F12K medio | Invitrogen | 21127 | |
| De suero fetal bovino | Sigma-Aldrich | F0643 | |
| Tripsina-EDTA (10 veces) | Invitrogen | 15400 | |
| Antibiótico-antimicótico | Invitrogen | 15240 | |
| Opti-MEM I Reducción de medio sin suero | Invitrogen | 31985 | |
| Reactivo lipofectina | Invitrogen | 18292-011 | |
| Geneticina | Invitrogen | 10131035 | |
| MC1061/P3 Ultracomp | Invitrogen | C663-03 | |
| QIAprep giro miniprep kit | Qiagen Inc. | 19064 | |
| FuGENE 6 Transfección reactivo | Roche | 11 814 443 001 | |
| De 96 pozos fondo blanco delgada placa microtitere | Costar | 3610 | |
| libre de calcio DMEM los medios de comunicación | Invitrogen | 21068 | |
| Coelenterazine | Invitrogen | C-2944 | |
| Brillante-Line hemocitómetro | Hausser Científico | Horsham, PA | |
| Novostar | BMG Labtechnologies | ||
| Prism 4.0 | GraphPad Software Inc. | San Diego, California, EE.UU. | |
| T-25 y T-75 Frascos | BD Falcon | 353014 y 353135 |
Referencias
- Kozak, M. An analysis of 5'-noncoding sequences from 699 vertebrate messenger RNAs. Nucleic Acids Research. 15, 8125-8148 (1987).
- Nachman, R., Pietrantonio, P. V., Geary, T. Interaction of mimetic analogs of insect kinin neuropeptides with arthropod receptors. Neuropeptide systems as Targets for Parasite and Pest Control. , (2010).
- Nachman, R. J., Pietrantonio, P. V., Coast, G. M. Towards the development of novel pest management agents based upon insect kinin neuropeptide analogs. Annals of the New York Academy of Sciences. , 1163-11251 (2009).
- Taneja-Bageshwar, S., Strey, A., Isaac, R. E., Coast, G. M., Zubrzak, P., Pietrantonio, P. V., Nachman, R. J. Biostable agonists that match and/or exceed the activity of insect kinins on recombinant arthropod GPCRs. General and Comparative Endocrinology. 162, 122-128 (2009).
- Taneja-Bageshwar, S., Strey, A., Kaczmarek, K., Zabrocki, J., Pietrantonio, P. V., Nachman, R. J. Comparison of insect kinin analogs with cis-peptide bond, type VI-turn motifs identifies optimal stereochemistry for interaction with a recombinant arthropod kinin receptor from the southern cattle tick Boophilus microplus. Peptides. 29, 295-301 .
- Taneja-Bageshwar, S., Strey, A., Zubrzak, P., Williams, H., Reyes-Rangel, G., Juaristi, E., Pietrantonio, P. V., Nachman, R. J. Identification of selective and non-selective, biostable beta-amino acid agonists of recombinant insect kinin receptors from the southern cattle tick Boophilus microplus and mosquito Aedes aegypti. Peptides. 29, 302-309 .
- Taneja-Bageshwar, S., Strey, A., Zubrzak, P., Pietrantonio, P. V., Nachman, R. J. Comparative structure-activity analysis of insect kinin core analogs on recombinant kinin receptors drom southern cattle tick Boophilus microplus (Acari: Ixodidae) and mosquito Aedes aegypti (Diptera: Culicidae). Archives of Insect Biochemistry and Physiology. 62, 128-140 (2006).
- Pietrantonio, P. V., Jagge, C., Taneja-Bageshwar, S., Nachman, R. J., Barhoumi, R. The mosquito Aedes aegypti (L.) leucokinin receptor is a multiligand receptor for the three Aedes kinins. Insect Molecular Biology. 14, 55-67 (2005).
- Holmes, S. P., Barhoumi, R., Nachman, R. J., Pietrantonio, P. V. Functional analysis of a G protein-coupled receptor from the Southern cattle tick Boophilus microplus (Acari: Ixodidae) identifies it as the first arthropod myokinin receptor. Insect Molecular Biology. 12, 27-38 (2003).
- Staubli, F., Jorgensen, T. J. D., Cazzamali, G., Williamson, M., Lenz, C., Sondergaard, L., Roepstorff, P., Grimmelikhuijzen, C. J. P. Molecular identification of the insect adipokinetic hormone receptors. Proceedings of the National Academy of Sciences USA. 99, 3446-3451 (2002).
- Stables, J., Green, A., Marshall, F., Fraser, N., Knight, E., Sautel, M., Milligan, G., Lee, M., Rees, S. A bioluminescent assay for agonist activity at potentially any G-protein coupled receptor. Analytical Biochemistry. 252, 115-126 (1997).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados