Method Article
ניתוח משופר בסיוע בית החזה לטיפול בגידולי חוליות בית החזה גרורתיים
In This Article
Summary
כאן, אנו מציגים פרוטוקול להדגמת ניתוח משופר בסיוע בית החזה לטיפול בגידולים גרורתיים בחוליות בית החזה.
Abstract
ההתקדמות המשמעותית שנעשתה באבחון ובטיפול בגידולים ממאירים הובילה לשיפור בשיעורי ההישרדות של החולים. עם זאת, ההתפשטות הגרורתית של גידולים אלה לחוליות בית החזה נותרה אתגר משמעותי, ולעתים קרובות גורמת לתופעות לוואי הקשורות לעצם, כגון שברים פתולוגיים וסיבוכים חמורים. כדי לטפל בבעיה זו, נחקרה גישה רב-תחומית מעודנת, המשתמשת בטכניקות תורסקופיות לכריתת גידול והתערבויות בעמוד השדרה. טכניקות תורסקופיות מציעות אלטרנטיבה זעיר פולשנית לשיטות כירורגיות פתוחות מסורתיות, במטרה להפחית את הטראומה הכוללת שחווים המטופלים. על ידי מינוף היתרונות של תורקוסקופיה, רופאים יכולים לכרות ביעילות גידולים גרורתיים בתוך חוליות בית החזה תוך מזעור ההשפעה על הרקמות והמבנים שמסביב. לגישה זו, בשילוב עם התערבויות ממוקדות בעמוד השדרה, יש פוטנציאל לשפר את תוצאות המטופלים ואת איכות החיים על ידי הפחתת ההשפעות המתישות של שברים פתולוגיים וסיבוכים אחרים הקשורים למחלת עצם גרורתית. יישום אסטרטגיה רב-תחומית זו, המשלבת כריתת גידול תורקוסקופית והתערבויות בעמוד השדרה, מייצג אפיק מבטיח לניהול גידולים גרורתיים בחוליות בית החזה. יש צורך במחקר נוסף והערכה קלינית כדי להבהיר באופן מלא את היתרונות ארוכי הטווח ולבסס את פרוטוקולי הטיפול האופטימליים עבור אוכלוסיית חולים זו, ובסופו של דבר לשפר את הטיפול והתוצאות עבור אנשים הסובלים ממצב מאתגר זה.
Introduction
ככל שההתקדמות באבחון ובטיפול בגידולים ממאירים נמשכת, שיעורי ההישרדות של חולים עם ממאירויות עלו משמעותית1. עם זאת, נצפתה עלייה מקבילה בשכיחות תופעות לוואי הקשורות לעצם הנגרמות על ידי גידולים ממאירים, במיוחד גרורות לחוליות בית החזה,2. חולים רבים עם גרורות נרחבות בעצמות, במיוחד אלה עם מעורבות של חוליות בית החזה, חווים שברים פתולוגיים המובילים לכאבים עזים ואף לשיתוק3.
הליכים פתוחים דורשים חתכים גדולים בעור ודיסקציה נרחבת של שרירים, מה שמוביל לטראומה כירורגית משמעותית ולזמני החלמה ממושכים של המטופל. ניתוחים פתוחים אלה קשורים גם לאובדן דם גדול יותר, מכיוון שהם כרוכים בנזק לכלי דם עיקריים, מה שמגדיל את הסיכונים הכירורגיים הכוללים4. בנוסף, הטראומה הנרחבת שנגרמה במהלך ניתוחים פתוחים מעלה את שיעורי הסיבוכים שלאחר הניתוח, כגון בעיות ריאה ופקקת ורידים עמוקים. תקופת ההחלמה הממושכת לאחר הליכים פתוחים מביאה גם לאשפוז ממושך בבית החולים, מה שמטיל נטל משמעותי הן על המטופלים והן על המטפלים שלהם. יתר על כן, שדה הראייה המוגבל המסופק על ידי ניתוחים פתוחים מקשה על מיקום וכריתה מדויקים של האזורים החולים, ובכך מגדיל את הקושי הטכני של הניתוח5.
בשנת 1993, הרופא הגרמני מאק דיווח לראשונה על ניתוח עמוד שדרה תורסקופי, ואחריו רוזנטל מארה"ב בשנת 1994, שדיווח על כריתת דיסק אנדוסקופי של חוליות בית החזה6. גישה זו משתמשת בטכניקות תורסקופיות מבוססות ליצירת ערוץ, המאפשר כריתת גידול, הפחתת לחץ של חוט השדרה, השתלת גוף חוליות מלאכותי וקיבוע עם ברגים של חוליות בית החזה. טכניקה זו מאופיינת בטראומה מינימלית, דימום מופחת ופחות כאבים לאחר הניתוח. ניתוח עמוד שדרה בסיוע בית החזה מקיף הליכים שונים, כולל שחרור קמור לרוחב עמוד השדרה, כריתת דיסק בין חולייתי, ביופסיה של גוף החוליות, ניקוז מורסה בחלל הדיסק הבין חולייתי וניתוח איחוי קדמי7. חלק מהחוקרים דיווחו על שימוש באנדוסקופים מיקרו-כירורגיים לשחזור חוליות החזה ובית החזה הקדמי ושחרור ואיחוי קדמי בטיפול בגידולים גרורתיים, שברים ועיוותים8.
הרציונל מאחורי הפיתוח והשימוש בטכניקה זו נובע מהשכיחות הגוברת של תופעות לוואי הקשורות לעצם, במיוחד שברים פתולוגיים, הנגרמות כתוצאה מהתפשטות גרורתית של גידולים ממאירים לחוליות בית החזה8. סיבוכים אלו עלולים להוביל לכאבים עזים, שיתוק וירידה משמעותית באיכות החיים של החולים המושפעים. בהשוואה לשיטות כירורגיות פתוחות מסורתיות, הגישה התורסקופית מציעה מספר יתרונות, כולל טראומה מינימלית, דימום מופחת ופחות כאב לאחר הניתוח9. טכניקה זו, הכוללת יצירת תעלה לכריתת גידול, הפחתת לחץ של חוט השדרה, השתלת גוף חוליה מלאכותי וקיבוע עם ברגי חוליות בית החזה, דווחה כיעילה בטיפול במצבי עמוד שדרה שונים, כגון גידולים גרורתיים, שברים ועיוותים10.
השימוש בטכניקות תורסקופיות לניהול גידולים גרורתיים בחוליות בית החזה ממוקם בהקשר הרחב יותר של התקדמות באבחון וטיפול בגידולים ממאירים, שהובילו לשיפור בשיעורי ההישרדות של החולים1. עם זאת, האתגר המתמשך של מחלת עצם גרורתית, במיוחד בעמוד השדרה החזי, הצריך חקירה של גישות חדשניות וזעיר פולשניות כדי לטפל בבעיה קלינית זו. מאמר זה מציג סדרת מקרים של 40 חולים שעברו ניתוח תורקוסקופי לגידולים גרורתיים בחוליות בית החזה, ומספק לרופאים תובנות חשובות לגבי היעילות והיישום הפוטנציאלי של טכניקה זו. המטרה הכוללת של מחקר זה היא לחקור את השימוש בגישה רב-תחומית מעודנת, המשלבת טכניקות תורסקופיות לכריתת גידולים והתערבויות בעמוד השדרה, בניהול גידולים גרורתיים בחוליות בית החזה.
Protocol
התקבלה הסכמה מדעת בכתב מהמטופלים לפרסום. פרוטוקול כירורגי זה עומד בסטנדרטים האתיים שנקבעו על ידי ועדת האתיקה של בית החולים המסונף הראשון, בית הספר לרפואה של אוניברסיטת ג'ג'יאנג (מספר מענק: IIT20240869A).
1. הערכה טרום ניתוחית
- השתמש בקריטריוני ההכללה הבאים: משתתפים מגיל 18 ומעלה; אבחנה מאושרת של גידולי חוליות חזה גרורתיים באמצעות הדמיה (MRI, סריקות CT) וביופסיה; הגידול חייב להיות ממוקם בתוך חוליות בית החזה, T1-T12; על המשתתפים להיות בעלי סטטוס ביצועים המעיד על כשירותם לניתוח; על המשתתפים לספק הסכמה מדעת לעבור ניתוח כחלק מהמחקר.
- השתמש בקריטריוני ההחרגה הבאים: משתתפים עם גרורות נרחבות מעבר לאזור האזורי של חוליות בית החזה; מצבים רפואיים חמורים במקביל כגון סוכרת בלתי מבוקרת, הפרעות לב וכלי דם ואי ספיקת כליות או כבד, העלולים להגביר את הסיכון לניתוח; בשל סיכונים פוטנציאליים לעובר, נשים בהריון לא יוחרגו; משתתפים קודמים בניתוחי עמוד שדרה שעברו בעבר ניתוח באותו אתר של הגידול הנוכחי בחוליות בית החזה; זיהומים מערכתיים פעילים או זיהומים מקומיים באתר הניתוח, מכיוון שהם עלולים לסבך את תוצאות הניתוח; חולים עם תוחלת חיים של פחות מ-3 חודשים, על סמך הערכת רופא, עשויים להישלל; משתתפים שעברו טיפולים קודמים כגון הקרנות או כימותרפיה; אלרגיות או תופעות לוואי לחומרים או לתרופות ששימשו במהלך האשפוז; חולים עם ניתוחי חזה קודמים, טראומות או זיהומים שעלולים לגרום להידבקויות פלאורליות.
- בצע הדמיה סטנדרטית של עמוד השדרה יחד עם צילומי חזה קדמיים ורוחביים כדי להעריך כל בעיה פוטנציאלית בפלאורל.
- עמוד השדרה הקדמי-אחורי (AP) view: בקש מהמטופל לעמוד מול מכונת הרנטגן, כשהזרועות באופן טבעי בצדדים. הרם מעט את הסנטר כדי להאריך את עמוד השדרה הצווארי. יישר את קו האמצע עם נקודת האמצע של עצם החזה. בקשו מהמטופל לעצור את נשימתו בסוף ההשראה.
- מבט לרוחב החזה: בקש מהמטופל לשכב כשהצד השמאלי פונה למכונת הרנטגן והזרועות מורמות מעל הראש. ודא שהגוף נשאר זקוף והכתפיים רגועות. יישר את קו המרכז בגובה חוליית בית החזה הרביעית. בקשו מהמטופל לעצור את נשימתו בסוף ההשראה
- התחל טיפול בסטרואידים לחולים עם דחיסה סימפטומטית של חוט השדרה: מינון התחלתי טיפוסי הוא 10-16 מ"ג. לאחר המינון הראשוני, יש ליטול מינון תחזוקה של 4-6 מ"ג כל 4-6 שעות. הפחיתו את המינון בהדרגה במשך מספר ימים עד שבועות, בהתאם לתגובת המטופל.
- להעריך חולים עם ציוני טוקוהאשי גבוהים וציוני טומיטה נמוכים אך ללא מעורבות של שורשי קשת החוליות והנספחים.
הערה: ציון טוקוהאשי הוא מערכת ניקוד פרוגנוסטית שנועדה לחזות הישרדות בחולים עם גידולים בעמוד השדרה גרורתי. ציון טוקוהאשי המתוקן מסווג את החולים לשלוש קבוצות פרוגנוסטיות: אלה עם ציונים של 0-8 (הישרדות של פחות מ-6 חודשים), 9-11 (הישרדות של 6-12 חודשים) ו-12-15 (הישרדות של יותר מ-12 חודשים)11. ציון טומיטה הוא כלי פרוגנוסטי המשמש להערכת חולים עם גרורות בעמוד השדרה, ומסייע בבחירת אסטרטגיות כירורגיות מתאימות. הוא מקצה ציונים על סמך גורמים כמו קצב הגדילה של הגידול הראשוני, נוכחות וכריתה של גרורות קרביות ומספר גרורות בעצמות. הציון הכולל מסייע לרופאים לסווג מטופלים לקבוצות פרוגנוסטיות שונות, ומנחה את ההחלטות אם להמשיך בניתוח רדיקלי, ניתוח פליאטיבי או טיפול שמרני12. - שקול אמבוליזציה טרום ניתוחית לחולים עם גידולים בעלי כלי דם גבוהים. זהה מטופלים עם ניתוחי חזה קודמים, טראומות או זיהומים שעלולים לגרום להידבקויות פלאורליות.
- לשלול ניתוח תורקוסקופי בחולים עם מצבים ריאתיים חמורים, כגון COPD או אסטמה, שעלולים לסבך את הנשמת הריאה היחידה.
2. הרדמה ומיקום המטופל
- התחל את השראת ההרדמה על ידי יצירת גישה תוך ורידית ומתן חמצן בריכוז גבוה דרך מסכת פנים כדי להגדיל את מאגרי החמצן. לאחר מכן, הזרקה תוך ורידית של חומרי אינדוקציה להרדמה (כגון פרופופול 20 מ"ג/מ"ל), משככי כאבים (כגון פנטניל 50 מיקרוגרם/מ"ל) ומרפי שרירים (כגון רוקורוניום 10 מ"ג/מ"ל).
- לאחר שהמטופל מאבד את הכרתו, בחר את הגודל והצד המתאימים (שמאל או ימין) של צינור אנדוטרכיאלי בעל לומן כפול (DLT) בהתבסס על ההליך. בצע לרינגוסקופיה ישירה או לרינגוסקופיה בווידאו כדי לדמיין את מיתרי הקול. הכנס את ה-DLT דרך מיתרי הקול כאשר לומן הסימפונות פונה קדימה. מקדמים את הצינור עד שמורגשת התנגדות קלה, בדרך כלל בגובה 28-30 ס"מ בשיניים. נפח את שרוול קנה הנשימה.
- מקם את המטופל לרוחב ואבטח אותו עם רצועות קיבוע לשולחן הניתוחים, כדי להבטיח שדרכי הנשימה של המטופל מאובטחות. תמכו בעדינות בראש ובצוואר של המטופל. סובב לאט את גופו של המטופל הצידה, החל מהכתפיים ולאחר מכן הירכיים. שמור על תנוחת דקוביטוס לרוחב כשבית החזה חשוף, רגליים מכופפות וגפיים עליונות מושטות קדימה (איור 1).
- שמור על עמוד השדרה מיושר והימנע מתנועות פיתול. הניחו כרית בין הברכיים לזרועות לתמיכה. בדוק את מדדי החיוניות ורמת הנוחות של המטופל כדי למנוע לחץ מיותר או חוסר יישור. חבר רצועות אבטחה סביב הכתפיים והירכיים של המטופל כדי למנוע תנועה.
- השתמש בפלואורוסקופיה בזרוע C כדי לאשר את יישור עמוד השדרה: מקם את הפלואורוסקופיה בזרוע C כדי לקבל AP ותצוגות רוחביות של עמוד השדרה. אשר את יישור עמוד השדרה על ידי בדיקה שתהליכים קוצניים מרוכזים בין הפדיקלים בתצוגת AP.
3. גישה ונראות כירורגית
- הכן את סכין העצם האולטראסונית ומכשירים כירורגיים אחרים לשימוש מאוחר יותר.
- הגדר מיקומי נמל אסטרטגיים סביב האתר המושפע כדי להבטיח מניפולציה ונסיגה אופטימלית של המכשירים. החתך למכשירים כירורגיים מבוצע בחללים הבין-צלעייםה-3,ה-5 וה-7 לאורך קו בית השחי הקדמי, כמו גם בחלל הבין-צלעי השביעי לאורך קו אמצע בית השחי (איור 2).
- הכן את דופן בית החזה למעבר פוטנציאלי לפתיחת בית החזה. לאחר אישור הצורך לעבור לגישה פתוחה, העבירו בזהירות את המטופל למצב דקוביטוס לרוחב אם נדרשת גישה לעמוד השדרה החזי הצדדי או הקדמי. אם יש צורך בגישה אחורית, שמור על תנוחת הנטייה אך ודא שהמטופל מיושר כהלכה. במידת הצורך, המשך בזהירות בעת יצירת הפורטלים כדי למנוע פציעה.
4. הליך כירורגי
- צור יציאות גישה: בצע חתך קטן עם אזמל (1-2 ס"מ) עבור יציאת המצלמה בחללהבין-צלעי השביעי ובקו אמצע בית השחי. הכנס את בית החזה דרך יציאה זו והבטיח תצוגה ברורה של חלל בית החזה. צור יציאות עבודה נוספות, בדרך כלל שתיים או שלוש, במרחבים הבין-צלעייםהשלישי והחמישי. התאם את המיקומים המדויקים על סמך מיקום הגידול והאנטומיה.
- לרוקן את הריאה: למוטט את הריאה בצד הניתוחי באמצעות הנשמה של ריאה אחת כדי לספק שדה ניתוחי ברור. אשר דפלציה ריאתית נאותה באמצעות בדיקה ויזואלית דרך בית החזה.
- חשוף את הגידול: נתח בזהירות את הצדר הקודקודי המכסה את גופי החוליות והגידול באמצעות מספריים אנדוסקופיים ותפסנים. זהה והגן על מבנים אנטומיים חשובים כגון אבי העורקים, הוושט, השרשרת הסימפתטית וכלי הדם הסגמנטליים.
- כריתת הגידול: ניתוחי הגידול מהרקמות הסובבות אותו באמצעות שילוב של טכניקות חיתוך קהות וחדות אם הגידול נצמד לדורה מאטר או לחוט השדרה, השתמש במכשירים עדינים ועדינים כדי לשחרר אותו בזהירות. היזהר לא לפגוע בחוט השדרה או במבנים העצביים שמסביב.
- הסר את הגידול: אחוז והסר את הגידול במקטעים (איור 3). בדוק באופן רציף את שולי הכריתה כדי להבטיח הסרה מלאה של הגידול. השג דגימות לפתולוגיה תוך ניתוחית.
- הכן את חלל הדיסק: השתמש בקורטים, רונג'ורים ויניקה כדי לנקות ולפרק את החלל הבין חולייתי, להסיר כל רקמת גידול שנותרה, חומר נמק או שאריות דיסק. הכן את לוחות הקצה של החוליות להצבת גוף חוליה מלאכותי. ודא שפני השטח של לוחות הקצה חלקים וללא אי סדרים. המטרה היא ליצור משטח אחיד ושטוח כדי לקדם מגע אופטימלי עם גוף החוליה המלאכותי. היזהר לא לפגוע בעצם התת-כונדרלית.
- מקם את גוף החוליה המלאכותי: בחר גוף חוליה מלאכותי בגודל מתאים התואם את מידות גוף החוליה שנכרת. הכנס את גוף החוליה המלאכותי לחלל הדיסק המוכן. ודא שהוא מתאים היטב ומשחזר את הגובה והיישור של עמוד השדרה.
- אבטח את השתל: אשר את המיקום והיישור הנכונים של גוף החוליה המלאכותי באמצעות הדמיה פלואורוסקופית.
- הנח ואבטח התקני איחוי עמוד השדרה: הכנס ברגים ומוטות פדיקלה מעל ומתחת לאתר הכריתה והשתל. אבטח את המכשירים הללו כדי לייצב את עמוד השדרה, ובדוק ידנית אם יש ניידות או חוסר יציבות במבנה. ודא יישור וקיבוע נכונים באמצעות הדמיה פלואורוסקופית, וודא שהברגים והמוטות של הפדיקל נמצאים היטב במקומם ועמוד השדרה מיוצב.
- השג המוסטזיס: שלוט בכל דימום ממיטת הגידול, החלל הבין חולייתי או הרקמות הסובבות באמצעות צריבה דו קוטבית, חומרים המוסטטיים או תפרים. ודא שהשדה הניתוחי נקי מדימום מוגזם לפני שתמשיך בסגירה.
- לנפח מחדש את הריאה ולסגור: לנפח מחדש את הריאה לאט תוך כדי בדיקת דליפות אוויר דרך בית החזה. הנח צינור חזה דרך אחד מאתרי היציאה כדי לאפשר ניקוז לאחר הניתוח והרחבה מחדש של הריאה. הסר את בית החזה ומכשירים אחרים וסגור את אתרי היציאה עם תפרים או סיכות בגודל 4-0.
5. ניהול לאחר הניתוח
- ניטור: העבר את המטופל לחדר התאוששות או ליחידה לטיפול נמרץ (ICU) לניטור צמוד של סימנים חיוניים, תפקוד נשימתי ומצב נוירולוגי. יש לעקוב אחר סיבוכים כגון דימום, זיהום או מצוקה נשימתית.
- ניהול כאב: יזום פרוטוקול לניהול כאב, הכולל אופיואידים תוך ורידיים, משככי כאבים שאינם אופיואידים ומשככי כאבים בשליטת המטופל (PCA).
- ניהול צינור חזה: עקוב אחר תפוקת צינור החזה, מעבר לאיטום מים עם ניפוח ריאות יציב, והתכונן להסרה כאשר התפוקה יורדת לפחות מ-100 מ"ל ליום, בדרך כלל ביוםהשני שלאחר הניתוח. קבל AP ותצוגת חזה לרוחב לפני ואחרי הסרת צינור החזה כדי לבדוק התרחבות מחדש של הריאות ולשלול פנאומוטורקס.
- ניידות ושיקום: עודדו התגייסות מוקדמת כאשר המטופל יציב המודינמי, עם סימנים חיוניים בגבולות הנורמליים. זה יכול לסייע במניעת סיבוכים כגון פקקת ורידים עמוקים (DVT) ותסחיף ריאתי (PE). עבוד עם פיזיותרפיסטים כדי לעצב תוכנית שיקום מותאמת הכוללת תרגילים עדינים לשיפור הניידות והכוח.
- תזונה: קדם תזונה מאוזנת עשירה בחלבונים, ויטמינים ומינרלים לתמיכה בריפוי ואיחוי עצמות. עודדו הידרציה ותזונה עשירה בסיבים כדי למנוע עצירות, במיוחד אם המטופל נוטל תרופות נגד כאבים אופיואידיות.
- פעילות ואורח חיים: ייעץ למטופל להימנע מתנועות הרמה כבדות, כיפוף או פיתול שעלולות לאמץ את עמוד השדרה. עודדו פעילות גופנית סדירה ועדינה כגון הליכה, שחייה או אירובי בעל השפעה נמוכה כדי לשמור על הבריאות הכללית ולתמוך בהתאוששות עמוד השדרה.
תוצאות
נתוני המטופלים כוללים ציון טוקוהאשי לפני הניתוח, ציון טומיטה לפני הניתוח, ציון סולם אנלוגי חזותי (VAS) לפני הניתוח וציון VAS לאחר הניתוח. הניתוח הסטטיסטי מוצג בטבלה 1. ציוני ה-VAS שלאחר הניתוח וציוני ה-VAS לפני הניתוח נותחו באמצעות מבחני t זוגיים. תוצאות הנתונים מצביעות על כך שאנשים שעוברים את ההליך המשופר בסיוע בית החזה מפגינים ירידה משמעותית בציון ה-VAS שלהם (איור 4). יש להעריך את מצב הכריתה והשחזור של גידול בעמוד השדרה באמצעות מעקב לאחר הניתוח (איור 5).
המחקר גייס עוקבה של 40 חולים בגילאי 63 עד 78 שנים. ציון טוקוהאשי לפני הניתוח, ציון טומיטה לפני הניתוח, ציון VAS לפני הניתוח וציון VAS לאחר הניתוח הראו טווח של 11.5 ±-2.8, 5.5 ±-1.2, 6.0 ±-1.4 ו-1.5 ±-1.2 בציוני ההערכה של המטופלים. ציון ה-VAS מציג פער מובהק סטטיסטית בין ההערכות לפני הניתוח ואחרי הניתוח.
ציון טוקוהאשי, עם ממוצע של 11.5 ± 2.8, הצביע על כך שרוב החולים היו במצב בריאותי בינוני עד טוב, כאשר 40% דורגו כבעלי בריאות טובה ו-60% כבינוניים. השליטה בגידול הייתה ברובה חלקית עד מלאה, כאשר 50% השיגו שליטה חלקית ו-30% השיגו שליטה מלאה. יציבות עמוד השדרה הייתה נפוצה, כאשר ל-80% מהחולים היה עמוד שדרה יציב. לכל החולים היה אתר גרורתי יחיד בשל האופי החד-מקטע של הגידולים שלהם, ול-70% היו סוגי סרטן ראשוניים חיוביים. ציון טומיטה, עם ממוצע של 5.5 ± 1.2, הראה חלוקה שווה בסטטוס הביצועים, כאשר 50% דורגו כטובים ו-50% כגרועים. מבחינה היסטולוגית, ל-65% מהחולים היו טיפוסים חיוביים. ממצאים אלה משקפים קבוצת מטופלים עם תנאים נוחים בדרך כלל להתערבות כירורגית, כולל מחלה ניתנת לניהול ובריאות כללית טובה.

איור 1: מיקום המטופלים העוברים את הניתוח. תצלום המציג את המיקום הנכון של המטופל לניתוח תורקוסקופיה, בדרך כלל בתנוחת דקוביטוס לרוחב, עם ריפוד ותומכים מתאימים לאבטחת המטופל. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 2: חתכים למכשירים כירורגיים. החתך למכשירים כירורגיים מבוצע בחללים הבין-צלעיים השלישי, החמישי והשביעי לאורך קו בית השחי הקדמי, כמו גם בחלל הבין-צלעי השביעי לאורך קו אמצע בית השחי. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
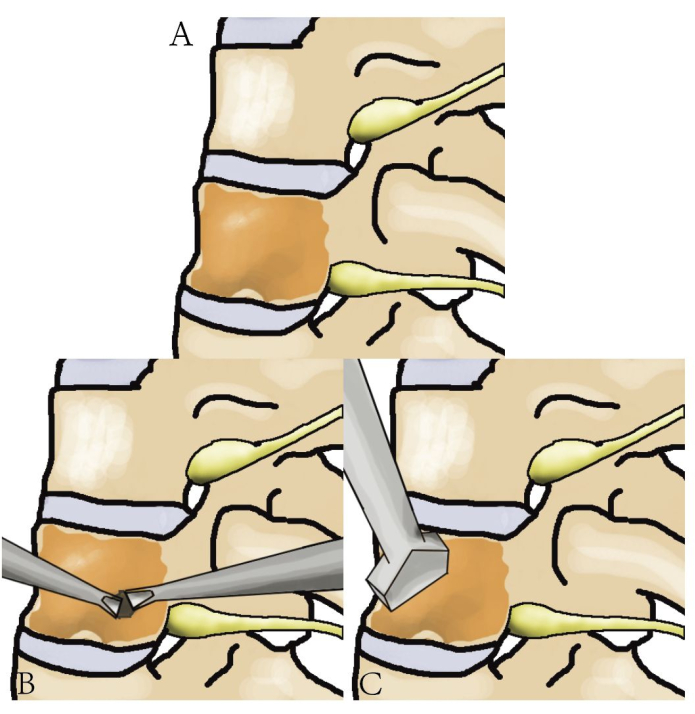
איור 3: תרשים של כריתת גידול בעמוד השדרה החזי. תרשים מפורט המציג את עמוד השדרה החזי, הגידול והשלבים הכרוכים בכריתת הגידול. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
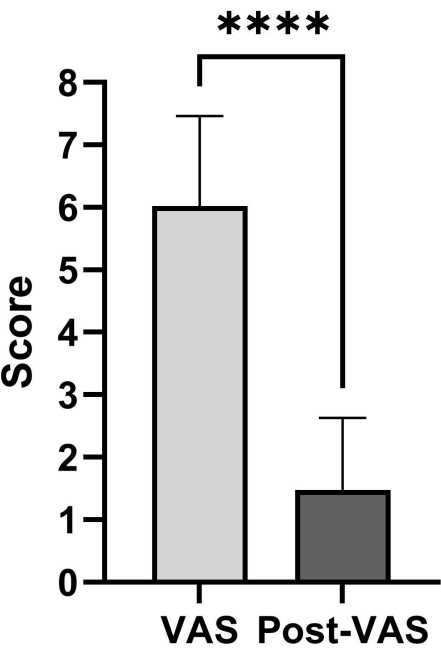
איור 4: השוואה בין ציוני VAS לאחר הניתוח ולפני הניתוח. קיים פער מובהק סטטיסטית בין הערכות ה-VAS לפני הניתוח ואחרי הניתוח. הנתונים מציגים ממוצע ± סטיית תקן; הציונים נותחו באמצעות מבחני t זוגיים. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
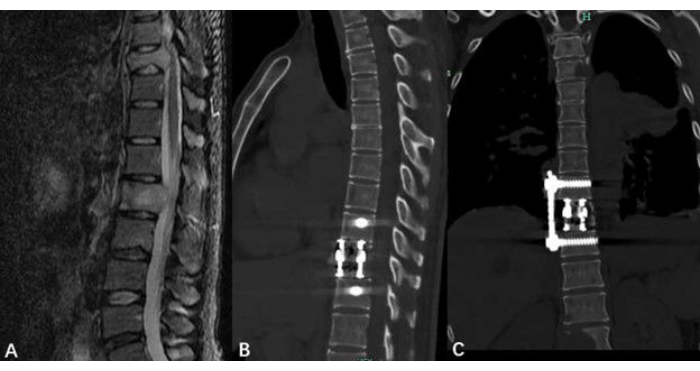
איור 5: הדמיה לגידולי חוליות בית החזה. (A) MR טרום ניתוחי הצביע על גידול בחוליות בית החזה. (ב, ג) תמונות של סריקת CT לאחר הניתוח המציגות את עמוד השדרה החזי לאחר כריתת הגידול וכל חומרה מושתלת. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
| קבוצה | ציון טוקוהאשי | ציון Tomita | ציון VAS לפני הניתוח | ציון VAS לאחר הניתוח | גיל (שנים) |
| TAS (n=40) | 11.5 ± 2.8 | 5.5 ± 1.2 | 6.0 ± 1.4 | 1.5 ± 1.2 | 70.8 ± 4.7 |
טבלה 1: ציוני הערכת המטופל. הנתונים המספריים הוצגו כממוצע ± סטיית תקן (ממוצע ± SD). קיצור: TAS = ניתוח בסיוע בית החזה.
Discussion
החסרונות של ניתוח פתוח כוללים חתכים גדולים יותר וצלקות ארוכות יותר, מה שמוביל להפרעה נרחבת יותר ברקמות ולכאבים גדולים יותר לאחר הניתוח13. גישה זו מביאה לרוב לאובדן דם גבוה יותר במהלך ההליך ומגבירה את הסיכון לזיהום וסיבוכים עקב חשיפה רחבה יותר. המטופלים חווים זמני החלמה ארוכים יותר, שהות ממושכת בבית החולים וחזרה מאוחרת לפעילות רגילה. בנוסף, לניתוח פתוח יש השפעה גדולה יותר על תפקוד הריאות, מה שמגדיל את הסיכון לסיבוכים נשימתיים לאחר הניתוח. בסך הכל, בעוד שניתוח פתוח מספק נראות ומרחב עבודה מצוינים, הוא מגיע עם עומסי טראומה והחלמה גבוהים יותר14.
הניתוח המשופר בסיוע בית החזה לניהול גידולי חוליות חזה גרורתיים מייצג התקדמות משמעותית בתחום ההליכים הכירורגיים הזעיר פולשניים.
היתרונות שלו כוללים הדמיה מצוינת של מבנים אנטומיים קריטיים, טראומה מינימלית לרקמות נורמליות, כאב מופחת לאחר הניתוח, אשפוז קצר יותר ושכיחות נמוכה יותר של סיבוכים. עם זאת, לטכניקה זו יש מגבלות מסוימות שיש להכיר בהן. זה מחייב רמה גבוהה של מיומנות טכנית, הדורשת מהמנתחים להיות בעלי מיומנויות מתקדמות הן בניתוחי חזה והן בפרוצדורות עמוד השדרה. בנוסף, בהשוואה לניתוח פתוח, הגישה בסיוע בית החזה עשויה להגביל הדמיה ישירה ומישוש של הגידול, מה שעלול להשפיע על אישור כריתה מלאה15. יתר על כן, היישום של שיטה זו מוגבל על ידי גודל הגידול ומיקומו; גידולים גדולים במיוחד או כאלה המשתרעים מעבר לגבולות אנטומיים ספציפיים עשויים שלא להיות מתאימים לטכניקה זו.
מרכיב קריטי בפרוטוקול הכירורגי בסיוע בית החזה הוא תכנון קפדני לפני הניתוח, כולל שימוש בטכניקות הדמיה כדי לתאר במדויק את מיקום הגידול והיקפו. השגת מיקום אופטימלי של המטופל כדי להבטיח נגישות מקסימלית לחוליות בית החזה היא קריטית להצלחת הניתוח. יתרה מכך, חיתוך ושימור קפדני של המבנים החיוניים הסובבים תוך הקפדה על כריתה מלאה של הגידול הוא איזון עדין הדורש מיומנויות כירורגיות מיוחדות.
לאורך יישום פרוטוקול זה, מנתחים עשויים להיתקל באתגרים שונים המחייבים שינוי של הטכניקה. לדוגמה, במקרים הכוללים מעורבות נרחבת של כלי הדם, ייתכן שתידרש תמיכה אנדווסקולרית נוספת כדי לנהל דימום פוטנציאלי. פתרון בעיות במהלך הניתוח יכול לכלול שימוש במכשירים מיוחדים או התאמת זווית הכניסה כדי לשפר את שדה הראייה. יכולת ההסתגלות הטמונה בפרוטוקול זה מאפשרת למנתחים להתאים את הגישות שלהם למקרים בודדים, ובכך לייעל את תוצאות המטופלים.
היישום של ניתוחים משופרים בסיוע בית החזה מייצג התקדמות משמעותית לעומת ניתוחים פתוחים מסורתיים וטכניקות זעיר פולשניות קודמות. בהשוואה לכריתת בית חזה פתוח, הגישה שלנו מציעה תחלואה מופחתת, הפחתה בכאבים לאחר הניתוח וזמני החלמה מקוצרים. גם בהשוואה לגישות זעיר פולשניות אחרות, השיטה המתוארת במחקר זה מספקת תנאים ארגונומיים מעולים למנתחים ופוטנציאל לדיוק גבוה יותר עקב הדמיה משופרת המאפשרת הגדלה תורקוסקופית15.
לטכניקה הכירורגית המשופרת בסיוע בית החזה יש משמעות משמעותית בתחום המחקר האונקולוגי, במיוחד עבור חקירות המתמקדות באונקולוגיה כירורגית וניהול גרורות בעמוד השדרה16. על ידי מתן אפשרות להסרה זעיר פולשנית של גידולים גרורתיים בחוליות בית החזה, פרוטוקול זה מספק פלטפורמה לחקור טיפולים משלימים כגון כימותרפיה תוך ניתוחית או הקרנות. בנוסף, הוא מקל על חקירה של תוצאות המטופלים הקשורות לאיכות החיים לאחר הניתוח, בהתחשב בטראומה מופחתת ופוטנציאל לחידוש מהיר יותר של פעילויות יומיומיות. לטכניקה זו יש פוטנציאל לשפר את גישות הרפואה המותאמת אישית על ידי מתן אפשרות לשינוי התוכנית הניתוחית על סמך האנטומיה הספציפית למטופל ומאפייני הגידול הנגזרים משיטות הדמיה מתקדמות.
Disclosures
המחברים מצהירים שאין ניגוד עניינים.
Acknowledgements
לא ישים.
Materials
| Name | Company | Catalog Number | Comments |
| Absorbable sutures | ETHICON | VCP739D | Johnson & Johnson 2-0 Absorbable Suture for suturing incisions |
| anesthesia drug | Anlibang Pharmaceuticals | propofol injectable emulsion | Sedation used in anesthesia procedures |
| anterior fixation system | Medtronic | VANTAGE | Medtronic's Vertebral Lateral Fixation System can be used to fixate the adjacent vertebral bodies to the implanted artificial vertebral body from the lateral side of the vertebrae, creating a stable overall structure. |
| Artificial vertebral body | Stryker | VLIFT | Stryker Artificial Vertebral Body is used for implanting an artificial vertebral body prosthesis after the removal of a diseased vertebra to support the spine. |
| C-arm | GE | OEC One CFD | Used for intraoperative fluoroscopic confirmation of the proper positioning of metal implants. |
| Thoracoscope System | stryker | Precision Ideal Eyes HD | Used for imaging of visceral organs within the thoracic cavity to facilitate the surgical manipulation of pathological structures. |
| Ultrasonic bone knife | SMTP | XD860A | Used for intraoperative cutting of bone tissue. |
References
- Rosmini, S., et al. Cardiac computed tomography in cardio-oncology: an update on recent clinical applications. Eur Heart J Cardiovas Imaging. 22 (4), 397-405 (2021).
- Li, Y., et al. Distinct metabolism of bone marrow adipocytes and their role in bone metastasis. Front Endocrinol. 13, 902033 (2022).
- Bianchi, G., Ghobrial, I. M. Does my patient with a serum monoclonal spike have multiple myeloma. Hematol/Oncol Clinics North Am. 26 (2), 383-393 (2012).
- Choi, J. Y., Park, S. M., Kim, H. J., Yeom, J. S. Recent updates on minimally invasive spine surgery: Techniques, technologies, and indications. Asian Spine J. 16 (6), 1013-1021 (2022).
- Zhu, X., et al. A comparative study between minimally invasive spine surgery and traditional open surgery for patients with spinal metastasis. Spine. 46 (1), 62-68 (2021).
- Kuklo, T. R., Lenke, L. G. Thoracoscopic spine surgery: current indications and techniques. Ortho Nurs. 19 (6), 15-22 (2000).
- Roque, D., Cabral, D., Rodrigues, C., Simas, N. Extradural thoracic nerve root hemangioblastoma approached by a combined posterior thoracic spine and video-assisted thoracoscopic surgery: A case report. Surg Neurol Int. 13 (10), (2022).
- Hanna, G., Kim, T. T., Uddin, S. A., Ross, L., Johnson, J. P. Video-assisted thoracoscopic image-guided spine surgery: evolution of 19 years of experience, from endoscopy to fully integrated 3D navigation. Neurosurg Focus. 50 (1), E8 (2021).
- Johnson, J. P., Drazin, D., King, W. A., Kim, T. T. Image-guided navigation and video-assisted thoracoscopic spine surgery: the second generation. Neurosurg Focus. 36 (3), E8 (2014).
- Ragel, B. T., Amini, A., Schmidt, M. H. Thoracoscopic vertebral body replacement with an expandable cage after ventral spinal canal decompression. Neurosurg. 61 (5 Suppl 2), 317-322 (2007).
- Tokuhashi, Y., Uei, H., Oshima, M., Ajiro, Y. Scoring system for prediction of metastatic spine tumor prognosis. World J Ortho. 5 (3), 262-271 (2014).
- Mezei, T., et al. A novel prognostication system for spinal metastasis patients based on network science and correlation analysis. Clin Oncol. 35 (1), e20-e29 (2023).
- Zhu, X., et al. A comparative study between minimally invasive spine surgery and traditional open surgery for patients with spinal metastasis. Spine. 46 (1), 62-68 (2021).
- Qiu, J., et al. Novel technique for endoscopic-assisted nipple-sparing mastectomy and immediate breast reconstruction with endoscopic-assisted latissimus dorsi muscle flap harvest through a single axillary incision: a retrospective cohort study of comparing endoscopic and open surgery. Gland Surg. 11 (8), 1383-1394 (2022).
- Haoran, E., et al. Perioperative outcomes comparison of robotic and video-assisted thoracoscopic thymectomy for thymic epithelial tumor: a single-center experience. Updates Surg. , (2023).
- Maki, R., et al. Minimally invasive robot-assisted thoracoscopic surgery for mediastinal tumor. Kyobu geka. Japan J Thoracic Surg. 76 (7), 506-509 (2023).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved