Method Article
Chirurgie thoracoscopique améliorée pour le traitement des tumeurs vertébrales thoraciques métastatiques
Dans cet article
Résumé
Ici, nous présentons un protocole pour démontrer une chirurgie assistée par thoracoscopie améliorée pour le traitement des tumeurs vertébrales thoraciques métastatiques.
Résumé
Les progrès significatifs réalisés dans le diagnostic et le traitement des tumeurs malignes ont permis d’améliorer les taux de survie des patients. Cependant, la propagation métastatique de ces tumeurs aux vertèbres thoraciques reste un défi important, entraînant souvent des événements indésirables liés aux os, tels que des fractures pathologiques et des complications graves. Pour résoudre ce problème, une approche multidisciplinaire raffinée a été explorée, qui utilise des techniques thoracoscopiques pour la résection tumorale et les interventions rachidiennes. Les techniques thoracoscopiques offrent une alternative peu invasive aux méthodes chirurgicales ouvertes traditionnelles, visant à réduire le traumatisme global subi par les patients. En tirant parti des avantages de la thoracoscopie, les cliniciens peuvent réséquer efficacement les tumeurs métastatiques dans les vertèbres thoraciques tout en minimisant l’impact sur les tissus et les structures environnantes. Cette approche, combinée à des interventions ciblées sur la colonne vertébrale, a le potentiel d’améliorer les résultats et la qualité de vie des patients en atténuant les effets débilitants des fractures pathologiques et d’autres complications associées aux maladies osseuses métastatiques. La mise en œuvre de cette stratégie multidisciplinaire, intégrant la résection tumorale thoracoscopique et les interventions rachidiennes, représente une piste prometteuse pour la prise en charge des tumeurs métastatiques au sein des vertèbres thoraciques. D’autres recherches et évaluations cliniques sont nécessaires pour élucider pleinement les avantages à long terme et établir les protocoles de traitement optimaux pour cette population de patients, améliorant ainsi les soins et les résultats pour les personnes atteintes de cette maladie difficile.
Introduction
Alors que les progrès dans le diagnostic et le traitement des tumeurs malignes se poursuivent, les taux de survie des patients atteints de tumeurs malignes ont considérablement augmenté1. Cependant, une augmentation concomitante de l’incidence des événements indésirables liés aux os causés par des tumeurs malignes, en particulier des métastases aux vertèbres thoraciques, a été observée2. De nombreux patients présentant des métastases osseuses généralisées, en particulier ceux présentant une atteinte vertébrale thoracique, présentent des fractures pathologiques entraînant des douleurs intenses et même une paralysie3.
Les procédures ouvertes nécessitent de grandes incisions cutanées et un curage musculaire étendu, entraînant des traumatismes chirurgicaux importants et des temps de récupération prolongés pour les patients. Ces opérations ouvertes sont également associées à une perte de sang plus importante, car elles impliquent des dommages aux principaux vaisseaux sanguins, ce qui augmente les risques chirurgicaux globaux4. De plus, les traumatismes étendus subis lors des chirurgies ouvertes augmentent les taux de complications postopératoires, telles que les problèmes pulmonaires et la thrombose veineuse profonde. La période de récupération prolongée qui suit des procédures ouvertes entraîne également des séjours prolongés à l’hôpital, ce qui impose un fardeau important aux patients et à leurs soignants. De plus, le champ visuel limité fourni par les chirurgies ouvertes rend difficile la localisation et la résection précises des zones malades, augmentant ainsi la difficulté technique de l’opération5.
En 1993, le médecin allemand Mack a signalé pour la première fois une chirurgie thoracoscopique de la colonne vertébrale, suivi par Rosenthal des États-Unis en 1994, qui a signalé une excision endoscopique du disque vertébral thoracique6. Cette approche utilise des techniques thoracoscopiques bien établies pour créer un canal, permettant la résection de la tumeur, la décompression de la moelle épinière, l’implantation de corps vertébraux artificiels et la fixation avec des vis vertébrales thoraciques. Cette technique se caractérise par un traumatisme minimal, une réduction des saignements et une diminution de la douleur postopératoire. La chirurgie thoracoscopique de la colonne vertébrale comprend diverses procédures, notamment la libération convexe latérale de la colonne vertébrale, l’excision du disque intervertébral, la biopsie du corps vertébral, le drainage de l’abcès de l’espace du disque intervertébral et la chirurgie de fusion antérieure7. Certains chercheurs ont signalé l’utilisation d’endoscopes microchirurgicaux pour la reconstruction vertébrale antérieure du thorax et du thoraco-lombaire et la libération et la fusion antérieures dans le traitement des tumeurs métastatiques, des fractures et des déformations8.
La raison d’être du développement et de l’utilisation de cette technique découle de l’incidence croissante d’événements indésirables liés aux os, en particulier les fractures pathologiques, causés par la propagation métastatique de tumeurs malignes aux vertèbres thoraciques8. Ces complications peuvent entraîner une douleur intense, une paralysie et une réduction significative de la qualité de vie des patients touchés. Par rapport aux méthodes chirurgicales ouvertes traditionnelles, l’approche thoracoscopique offre plusieurs avantages, notamment un traumatisme minimal, une réduction des saignements et une diminution de la douleur postopératoire9. Cette technique, qui implique la création d’un canal pour la résection tumorale, la décompression de la moelle épinière, l’implantation de corps vertébraux artificiels et la fixation avec des vis vertébrales thoraciques, s’est avérée efficace dans le traitement de diverses affections de la colonne vertébrale, telles que les tumeurs métastatiques, les fractures et les déformations10.
L’utilisation de techniques thoracoscopiques pour la prise en charge des tumeurs métastatiques dans les vertèbres thoraciques s’inscrit dans le contexte plus large des progrès dans le diagnostic et le traitement des tumeurs malignes, qui ont conduit à une amélioration des taux de survie des patients1. Cependant, le défi continu de la maladie osseuse métastatique, en particulier dans la colonne thoracique, a nécessité l’exploration d’approches novatrices et peu invasives pour résoudre ce problème clinique. Cet article présente une série de cas de 40 patients qui ont subi une chirurgie thoracoscopique pour des tumeurs métastatiques dans les vertèbres thoraciques, fournissant aux cliniciens des informations précieuses sur l’efficacité et l’applicabilité potentielle de cette technique. L’objectif global de cette étude est d’explorer l’utilisation d’une approche multidisciplinaire raffinée, intégrant des techniques thoracoscopiques pour la résection tumorale et les interventions rachidiennes, dans la gestion des tumeurs métastatiques au sein des vertèbres thoraciques.
Protocole
Le consentement éclairé écrit des patients a été obtenu pour publication. Ce protocole chirurgical respecte les normes éthiques établies par le comité d’éthique du premier hôpital affilié de la faculté de médecine de l’Université du Zhejiang (numéro de subvention : IIT20240869A).
1. Évaluation préopératoire
- Utilisez les critères d’inclusion suivants : Participants âgés de 18 ans et plus ; diagnostic confirmé de tumeurs vertébrales thoraciques métastatiques par imagerie (IRM, tomodensitométrie) et biopsie ; la tumeur doit être située dans les vertèbres thoraciques, T1-T12 ; Les participants doivent avoir un indice de performance indiquant qu’ils sont aptes à la chirurgie ; Les participants doivent fournir un consentement éclairé pour subir une intervention chirurgicale dans le cadre de l’étude.
- Utilisez les critères d’exclusion suivants : Participants présentant des métastases largement répandues au-delà de la zone régionale des vertèbres thoraciques ; des affections médicales concomitantes graves telles que le diabète non contrôlé, les troubles cardiovasculaires et l’insuffisance rénale ou hépatique, qui peuvent augmenter le risque de chirurgie ; en raison des risques potentiels pour le fœtus, les femmes enceintes seront exclues ; des participants à une chirurgie de la colonne vertébrale antérieure qui ont déjà subi une intervention chirurgicale au même endroit que la tumeur vertébrale thoracique actuelle ; infections systémiques actives ou infections locales au site de la chirurgie, car elles peuvent compliquer les résultats chirurgicaux ; les patients dont l’espérance de vie est inférieure à 3 mois, sur la base de l’évaluation d’un médecin, peuvent être exclus ; les participants qui ont déjà subi des traitements tels que la radiothérapie ou la chimiothérapie ; allergies ou réactions indésirables aux matériaux ou aux médicaments utilisés pendant l’hospitalisation ; patients ayant déjà subi des chirurgies thoraciques, des traumatismes ou des infections pouvant avoir provoqué des adhérences pleurales.
- Effectuez une imagerie standard de la colonne vertébrale ainsi que des radiographies thoraciques antéropostérieures et latérales pour évaluer tout problème pleural potentiel.
- Vue antéropostérieure de la colonne vertébrale (AP) : Demandez au patient de se tenir debout face à l’appareil à rayons X, les bras naturellement sur les côtés. Soulevez légèrement le menton pour étendre la colonne cervicale. Alignez la ligne centrale avec le point médian du sternum. Demandez au patient de retenir son souffle à la fin de l’inspiration.
- Vue latérale du thorax : Demandez au patient de s’allonger, le côté gauche face à l’appareil à rayons X et les bras levés au-dessus de la tête. Assurez-vous que le corps reste droit et que les épaules sont détendues. Alignez la ligne médiane au niveau de la 4ème vertèbre thoracique. Demandez au patient de retenir sa respiration à la fin de l’inspiration
- Commencer la corticothérapie pour les patients présentant une compression symptomatique de la moelle épinière : Une dose initiale typique est de 10 à 16 mg. Après la dose initiale, fournir une dose d’entretien de 4 à 6 mg toutes les 4 à 6 h. Diminuez progressivement la dose sur plusieurs jours à plusieurs semaines, en fonction de la réponse du patient.
- Évaluez les patients avec des scores de Tokuhashi élevés et des scores de Tomita faibles, mais sans implication des racines et des appendices de l’arc vertébral.
REMARQUE : Le score de Tokuhashi est un système de notation pronostique conçu pour prédire la survie des patients atteints de tumeurs métastatiques de la colonne vertébrale. Le score de Tokuhashi révisé classe les patients en trois groupes pronostiques : ceux avec des scores de 0 à 8 (survie inférieure à 6 mois), 9 à 11 (survie de 6 à 12 mois) et 12 à 15 (survie supérieure à 12 mois)11. Le score Tomita est un outil pronostique utilisé pour évaluer les patients atteints de métastases vertébrales, aidant à la sélection de stratégies chirurgicales appropriées. Il attribue des scores en fonction de facteurs tels que le taux de croissance de la tumeur primaire, la présence et la résécabilité des métastases viscérales et le nombre de métastases osseuses. Le score total aide les cliniciens à classer les patients dans différents groupes pronostiques, guidant les décisions sur la poursuite d’une chirurgie radicale, d’une chirurgie palliative ou d’un traitement conservateur12. - Envisagez une embolisation préopératoire pour les patients atteints de tumeurs hautement vasculaires. Identifiez les patients ayant déjà subi des chirurgies thoraciques, des traumatismes ou des maladies infectieuses qui pourraient avoir causé des adhérences pleurales.
- Exclure la chirurgie thoracoscopique chez les patients atteints d’affections pulmonaires graves, telles que la BPCO ou l’asthme, qui peuvent compliquer la ventilation monopulmonaire.
2. Anesthésie et positionnement du patient
- Commencez l’induction de l’anesthésie en établissant un accès intraveineux et en administrant de l’oxygène à haute concentration à travers un masque facial pour augmenter les réserves d’oxygène. Ensuite, injectez par voie intraveineuse des agents d’induction anesthésiques (tels que le propofol 20 mg/mL), des analgésiques (tels que le fentanyl 50 μg/mL) et des relaxants musculaires (tels que le rocuronium 10 mg/mL).
- Une fois que le patient a perdu connaissance, choisissez la taille et le côté appropriés (gauche ou droit) d’une sonde endotrachéale à double lumière (DLT) en fonction de la procédure. Effectuez une laryngoscopie directe ou une vidéolaryngoscopie pour visualiser les cordes vocales. Insérez le DLT à travers les cordes vocales avec la lumière bronchique tournée vers l’avant. Avancez le tube jusqu’à ce qu’une légère résistance se fasse sentir, généralement à 28-30 cm au niveau des dents. Gonflez le brassard trachéal.
- Positionnez le patient latéralement et fixez-le à l’aide de sangles de fixation à la table d’opération, en veillant à ce que les voies respiratoires du patient soient sécurisées. Soutenez doucement la tête et le cou du patient. Tournez lentement le corps du patient sur le côté, en commençant par les épaules puis les hanches. Gardez une position de décubitus latéral avec le thorax exposé, les jambes fléchies et les membres supérieurs étendus vers l’avant (Figure 1).
- Gardez la colonne vertébrale alignée et évitez tout mouvement de torsion. Placez un oreiller entre les genoux et les bras pour vous soutenir. Vérifiez les signes vitaux et le niveau de confort du patient pour éviter une pression excessive ou un désalignement. Fixez des sangles de sécurité autour des épaules et des hanches du patient pour l’empêcher de bouger.
- Utilisez la fluoroscopie de l’arceau pour confirmer l’alignement de la colonne vertébrale : Positionnez la fluoroscopie de l’arceau pour obtenir des vues AP et latérales de la colonne vertébrale. Confirmez l’alignement de la colonne vertébrale en vérifiant que les apophyses épineuses sont centrées entre les pédicules dans la vue AP.
3. Accès chirurgical et visibilité
- Préparez le couteau à os à ultrasons et les autres instruments chirurgicaux pour une utilisation ultérieure.
- Définissez des emplacements portuaires stratégiques autour du site affecté pour assurer une manipulation et une rétraction optimales des instruments. L’incision pour les instruments chirurgicaux est réalisée au niveau des 3e, 5e et 7eespaces intercostaux le long de la ligne axillaire antérieure, ainsi qu’au 7eespace intercostal le long de la ligne axillaire médiane (Figure 2).
- Préparez la paroi thoracique pour un éventuel basculement vers une thoracotomie ouverte. Après avoir confirmé la nécessité de passer à une approche ouverte, faites passer soigneusement le patient en position de décubitus latéral si un accès à la colonne thoracique latérale ou antérieure est nécessaire. Si un accès postérieur est nécessaire, maintenez la position couchée mais assurez-vous que le patient est correctement aligné. Si nécessaire, procédez avec prudence lors de la création des portails pour éviter les blessures.
4. Intervention chirurgicale
- Créez des ports d’accès : Faites une petite incision avec un scalpel (1-2 cm) pour le port de la caméra dans le 7e espace intercostal et la ligne axillaire médiane. Insérez le thoracoscope par ce port et assurez-vous d’avoir une vue dégagée de la cavité thoracique. Créez des ports de travail supplémentaires, généralement deux ou trois, dans les 3e et 5e espaces intercostaux. Ajustez les positions exactes en fonction de l’emplacement et de l’anatomie de la tumeur.
- Dégonfler le poumon : Affaissement du poumon du côté opératoire à l’aide d’une ventilation pulmonaire unique pour dégager le champ opératoire. Confirmez le dégonflement adéquat des poumons par une inspection visuelle à l’aide du thoracoscope.
- Exposer la tumeur : Disséquez soigneusement la plèvre pariétale recouvrant les corps vertébraux et la tumeur à l’aide de ciseaux et de pinces endoscopiques. Identifiez et protégez les structures anatomiques importantes telles que l’aorte, l’œsophage, la chaîne sympathique et les vaisseaux segmentaires.
- Réséquer la tumeur : Disséquez la tumeur des tissus environnants en utilisant une combinaison de techniques de dissection émoussées et tranchantes. Si la tumeur adhère à la dure-mère ou à la moelle épinière, utilisez des instruments fins et délicats pour la libérer soigneusement. Veillez à ne pas endommager la moelle épinière ou les structures neuronales environnantes.
- Retirer la tumeur : Saisissez et retirez la tumeur en segments (Figure 3). Inspectez en permanence les marges de résection pour assurer l’élimination complète de la tumeur. Obtenir des échantillons pour la pathologie peropératoire.
- Préparez l’espace discale : Utilisez des curettes, des rongeurs et une aspiration pour nettoyer et débrider l’espace intervertébral, en éliminant tout tissu tumoral résiduel, matériel nécrotique ou restes de disque. Préparez les plaques d’extrémité des vertèbres pour la mise en place d’un corps vertébral artificiel. Assurez-vous que la surface des plaques d’extrémité est lisse et exempte d’irrégularités. L’objectif est de créer une surface uniforme et plane pour favoriser un contact optimal avec le corps vertébral artificiel. Veillez à ne pas endommager l’os sous-chondral.
- Placez le corps vertébral artificiel : Choisissez un corps vertébral artificiel de taille appropriée qui correspond aux dimensions du corps vertébral réséqué. Insérez le corps vertébral artificiel dans l’espace du disque préparé. Assurez-vous qu’il est bien ajusté et qu’il rétablit la hauteur et l’alignement de la colonne vertébrale.
- Sécurisez l’implant : Confirmez la position et l’alignement corrects du corps vertébral artificiel à l’aide de l’imagerie fluoroscopique.
- Placez et fixez les dispositifs de fusion vertébrale : Insérez les vis et les tiges pédiculaires au-dessus et en dessous du site de résection et d’implantation. Fixez ces appareils pour stabiliser la colonne vertébrale, en vérifiant manuellement toute mobilité ou instabilité dans la construction. Confirmez l’alignement et la fixation corrects à l’aide de l’imagerie fluoroscopique, en vous assurant que les vis et les tiges pédiculaires sont bien en place et que la colonne vertébrale est stabilisée.
- Atteindre l’hémostase : Contrôlez tout saignement du lit tumoral, de l’espace intervertébral ou des tissus environnants à l’aide d’une cautérisation bipolaire, d’agents hémostatiques ou de sutures. Assurez-vous que le champ opératoire est exempt de saignement excessif avant de procéder à la fermeture.
- Regonflez le poumon et fermez-le : Regonflez le poumon lentement tout en vérifiant s’il n’y a pas de fuites d’air à travers le thoracoscope. Placez un drain thoracique dans l’un des sites de port pour permettre le drainage postopératoire et la réexpansion du poumon. Retirez le thoracoscope et les autres instruments et fermez les sites de port avec des sutures ou des agrafes de taille 4-0.
5. Prise en charge postopératoire
- Surveillance : Transférez le patient dans la salle de réveil ou l’unité de soins intensifs (USI) pour une surveillance étroite des signes vitaux, de la fonction respiratoire et de l’état neurologique. Surveillez les complications telles que les saignements, les infections ou la détresse respiratoire.
- Gestion de la douleur : Mettre en place un protocole de gestion de la douleur, qui comprend des opioïdes intraveineux, des analgésiques non opioïdes et des analgésiques contrôlés par le patient (ACP).
- Gestion du drain thoracique : Surveillez le débit du drain thoracique, passez à l’étanchéité à l’eau lorsque le gonflement stable des poumons est stable et préparez-vous à l’élimination lorsque le débit diminue à moins de 100 ml/jour, généralement au 2ejour postopératoire . Obtenez une AP et une vue latérale de la poitrine avant et après l’ablation du drain thoracique pour vérifier la réexpansion pulmonaire et exclure le pneumothorax.
- Mobilité et réadaptation : Encourager la mobilisation précoce lorsque le patient est stable sur le plan hémodynamique, avec des signes vitaux dans les limites normales. Cela peut aider à prévenir des complications telles que la thrombose veineuse profonde (TVP) et l’embolie pulmonaire (EP). Travaillez avec des physiothérapeutes pour concevoir un plan de réadaptation sur mesure qui comprend des exercices doux pour améliorer la mobilité et la force.
- Nutrition : Promouvoir une alimentation équilibrée riche en protéines, vitamines et minéraux pour favoriser la guérison et la fusion osseuse. Encouragez l’hydratation et un régime riche en fibres pour prévenir la constipation, surtout si le patient prend des analgésiques opioïdes.
- Activité et mode de vie : Conseillez au patient d’éviter de soulever des objets lourds, de se pencher ou de se tordre des mouvements qui pourraient fatiguer la colonne vertébrale. Encouragez l’exercice régulier et doux comme la marche, la natation ou l’aérobic à faible impact pour maintenir la santé globale et favoriser la récupération de la colonne vertébrale.
Résultats
Les données du patient comprennent le score de Tokuhashi préopératoire, le score de Tomita préopératoire, le score préopératoire de l’échelle visuelle analogique (EVA) et le score EVA postopératoire. L’analyse statistique est présentée dans le tableau 1. Les scores EVA postopératoires et préopératoires ont été analysés à l’aide de tests t appariés. Les résultats des données indiquent que les personnes qui subissent l’intervention assistée par thoracoscopie améliorée présentent une réduction significative de leur score EVA (figure 4). L’état de la résection et de la reconstruction de la tumeur vertébrale doit être évalué par le biais d’un suivi postopératoire (Figure 5).
L’étude a recruté une cohorte de 40 patients âgés de 63 à 78 ans. Le score de Tokuhashi préopératoire, le score de Tomita préopératoire, le score EVA préopératoire et le score EVA postopératoire ont montré une plage de 11,5 ± 2,8, 5,5 ± 1,2, 6,0 ± 1,4 et 1,5 ± 1,2 dans les scores d’évaluation des patients. Le score EVA présente une disparité statistiquement significative entre les évaluations préopératoires et postopératoires.
Le score de Tokahashi, avec une moyenne de 11,5 ± 2,8, a indiqué que la plupart des patients étaient en bonne santé, 40 % étant en bonne santé et 60 % passable. Le contrôle de la tumeur était principalement partiel à complet, 50 % atteignant un contrôle partiel et 30 % atteignant un contrôle complet. La stabilité de la colonne vertébrale était courante, 80 % des patients ayant des épines stables. Tous les patients avaient un seul site métastatique en raison de la nature à segment unique de leurs tumeurs, et 70 % avaient des types de cancer primaire favorables. Le score Tomita, avec une moyenne de 5,5 ± 1,2, a montré une répartition égale de l’état de performance, avec 50 % jugés bons et 50 % médiocres. Histologiquement, 65 % des patients avaient des types favorables. Ces résultats reflètent un groupe de patients présentant des conditions généralement favorables à l’intervention chirurgicale, y compris une maladie gérable et une bonne santé générale.

Figure 1 : Position des patients subissant l’opération. Une photographie montrant le positionnement correct du patient pour la chirurgie thoracoscopique, généralement en position de décubitus latéral, avec un rembourrage et des supports appropriés pour sécuriser le patient. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Incisions pour instruments chirurgicaux. L’incision pour les instruments chirurgicaux est réalisée au niveau des troisième, cinquième et septième espaces intercostaux le long de la ligne axillaire antérieure, ainsi qu’au septième espace intercostal le long de la ligne axillaire médiane. Veuillez cliquer ici pour voir une version agrandie de cette figure.
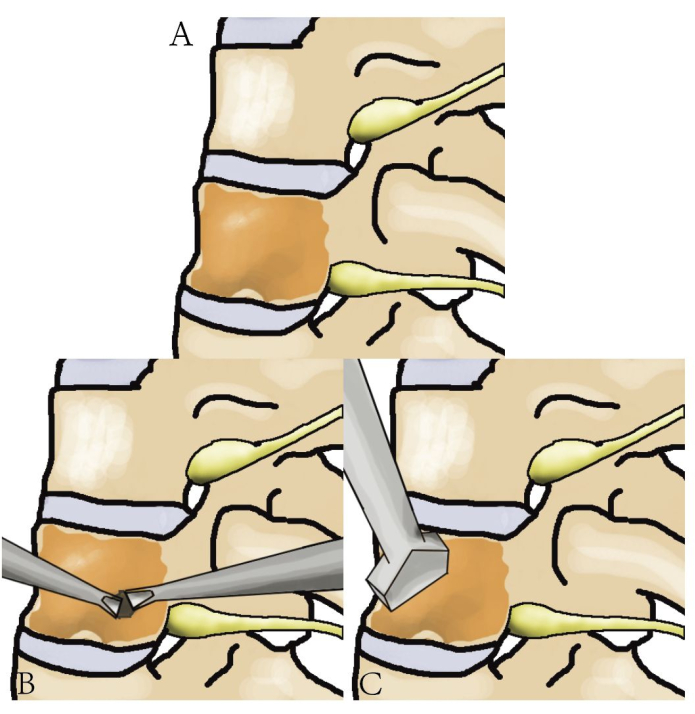
Figure 3 : Schéma de la résection d’une tumeur de la colonne thoracique. Un schéma détaillé montrant la colonne thoracique, la tumeur et les étapes impliquées dans la résection de la tumeur. Veuillez cliquer ici pour voir une version agrandie de cette figure.
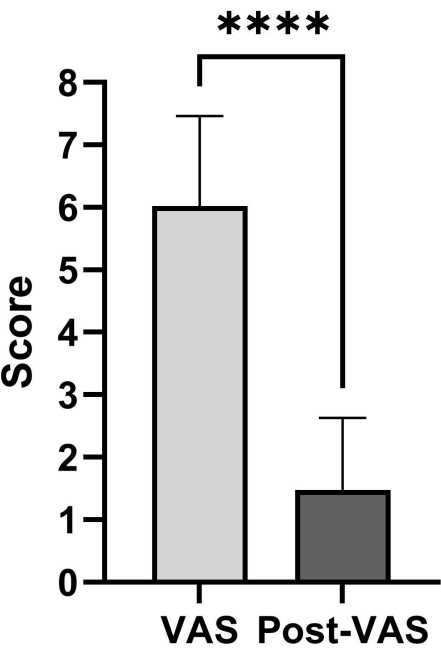
Figure 4 : Comparaison entre les scores EVA postopératoires et préopératoires. Il existe une disparité statistiquement significative entre les évaluations préopératoires et postopératoires de l’EVA. Les données présentent la moyenne ±écart-type ; Les scores ont été analysés à l’aide de tests T appariés. Veuillez cliquer ici pour voir une version agrandie de cette figure.
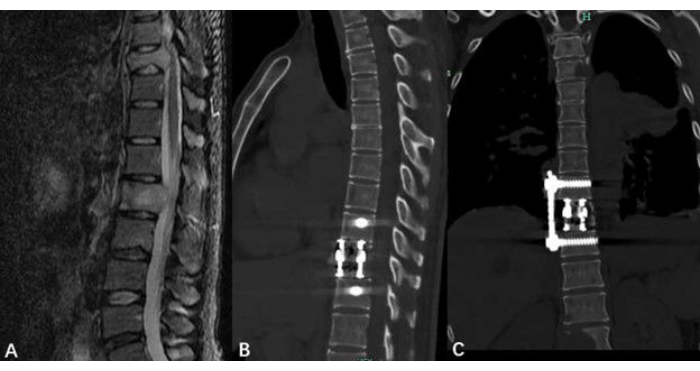
Figure 5 : Imagerie des tumeurs vertébrales thoraciques. (A) Une IRM préopératoire a indiqué la tumeur vertébrale thoracique. (B, C) Images d’une tomodensitométrie postopératoire montrant la colonne thoracique après la résection de la tumeur et tout matériel implanté. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Groupe | Score de Tokuhashi | Score de Tomita | Score EVA préopératoire | Score EVA postopératoire | Âge (années) |
| TAS (n = 40) | 11,5 ± 2,8 | 5,5 ± 1,2 | 6,0 ± 1,4 | 1,5 ± 1,2 | 70,8 ± 4,7 |
Tableau 1 : Notes d’évaluation du patient. Les données numériques ont été présentées sous forme de moyenne ± d’écart-type (moyenne ± écart-type). Abréviation : TAS = chirurgie assistée par thoracoscopie.
Discussion
Les inconvénients de la chirurgie ouverte comprennent des incisions plus grandes et des cicatrices plus longues, entraînant une perturbation tissulaire plus étendue et une douleur postopératoire plus importante13. Cette approche entraîne souvent une perte de sang plus élevée pendant la procédure et augmente le risque d’infection et de complications dues à une exposition plus large. Les patients connaissent des temps de récupération plus longs, des séjours prolongés à l’hôpital et un retour retardé aux activités normales. De plus, la chirurgie ouverte a un impact plus important sur la fonction pulmonaire, augmentant le risque de complications respiratoires postopératoires. Dans l’ensemble, bien que la chirurgie ouverte offre une excellente visibilité et un excellent espace de travail, elle s’accompagne d’un fardeau plus élevé en matière de traumatisme et de récupération14.
La chirurgie assistée par thoracoscope améliorée pour la gestion des tumeurs vertébrales thoraciques métastatiques représente une avancée significative dans le domaine des procédures chirurgicales mini-invasives.
Ses avantages comprennent une excellente visualisation des structures anatomiques critiques, un traumatisme minimal des tissus normaux, une réduction de la douleur postopératoire, une hospitalisation plus courte et une incidence plus faible de complications. Cependant, cette technique présente certaines limites qu’il convient de reconnaître. Cela nécessite un haut niveau de compétence technique, exigeant des chirurgiens qu’ils possèdent des compétences avancées à la fois en chirurgie thoracique et en procédures vertébrales. De plus, par rapport à la chirurgie ouverte, l’approche assistée par thoracoscope peut restreindre la visualisation directe et la palpation de la tumeur, affectant potentiellement la confirmation de la résection complète15. De plus, l’applicabilité de cette méthode est limitée par la taille et l’emplacement de la tumeur ; Les tumeurs exceptionnellement grandes ou celles qui s’étendent au-delà de limites anatomiques spécifiques peuvent ne pas se prêter à cette technique.
Un élément essentiel du protocole chirurgical assisté par thoracoscopie est une planification préopératoire méticuleuse, y compris l’utilisation de techniques d’imagerie pour délimiter avec précision l’emplacement et l’étendue de la tumeur. Le positionnement optimal du patient pour assurer une accessibilité maximale aux vertèbres thoraciques est crucial pour le succès de l’opération. De plus, la dissection et la préservation soigneuses des structures vitales environnantes tout en assurant une résection complète de la tumeur constituent un équilibre délicat qui exige des compétences chirurgicales spécialisées.
Tout au long de la mise en œuvre de ce protocole, les chirurgiens peuvent rencontrer divers défis qui nécessitent une modification de la technique. Par exemple, dans les cas impliquant une atteinte vasculaire étendue, un soutien endovasculaire supplémentaire peut être nécessaire pour gérer les saignements potentiels. Le dépannage pendant la chirurgie peut impliquer l’utilisation d’instruments spécialisés ou l’ajustement de l’angle d’entrée pour améliorer le champ visuel. L’adaptabilité inhérente à ce protocole permet aux chirurgiens d’adapter leurs approches à des cas individuels, optimisant ainsi les résultats pour les patients.
L’application de la chirurgie assistée par thoracocopie améliorée représente un progrès significatif par rapport aux chirurgies ouvertes traditionnelles et aux techniques mini-invasives précédentes. Par rapport à la thoracotomie ouverte, notre approche offre une morbidité réduite, une diminution de la douleur postopératoire et des temps de récupération raccourcis. Même comparée à d’autres approches mini-invasives, la méthode décrite dans cette étude offre des conditions ergonomiques supérieures pour les chirurgiens et potentiellement une précision plus élevée en raison de l’amélioration de la visualisation facilitée par le grossissement thoracoscopique15.
La technique chirurgicale assistée par thoracoscopie améliorée revêt une importance significative dans le domaine de la recherche oncologique, en particulier pour les investigations axées sur l’oncologie chirurgicale et la prise en charge des métastases vertébrales16. En permettant l’ablation mini-invasive des tumeurs vertébrales thoraciques métastatiques, ce protocole fournit une plate-forme pour explorer des thérapies d’appoint telles que la chimiothérapie peropératoire ou la radiothérapie. De plus, il facilite l’investigation des résultats des patients liés à la qualité de vie post-opératoire, en tenant compte de la réduction des traumatismes et d’une reprise potentiellement plus rapide des activités quotidiennes. Cette technique a le potentiel d’améliorer les approches de médecine personnalisée en permettant de modifier le plan chirurgical en fonction de l’anatomie spécifique au patient et des caractéristiques tumorales dérivées de modalités d’imagerie avancées.
Déclarations de divulgation
Les auteurs ne déclarent aucun conflit d’intérêts.
Remerciements
Sans objet.
matériels
| Name | Company | Catalog Number | Comments |
| Absorbable sutures | ETHICON | VCP739D | Johnson & Johnson 2-0 Absorbable Suture for suturing incisions |
| anesthesia drug | Anlibang Pharmaceuticals | propofol injectable emulsion | Sedation used in anesthesia procedures |
| anterior fixation system | Medtronic | VANTAGE | Medtronic's Vertebral Lateral Fixation System can be used to fixate the adjacent vertebral bodies to the implanted artificial vertebral body from the lateral side of the vertebrae, creating a stable overall structure. |
| Artificial vertebral body | Stryker | VLIFT | Stryker Artificial Vertebral Body is used for implanting an artificial vertebral body prosthesis after the removal of a diseased vertebra to support the spine. |
| C-arm | GE | OEC One CFD | Used for intraoperative fluoroscopic confirmation of the proper positioning of metal implants. |
| Thoracoscope System | stryker | Precision Ideal Eyes HD | Used for imaging of visceral organs within the thoracic cavity to facilitate the surgical manipulation of pathological structures. |
| Ultrasonic bone knife | SMTP | XD860A | Used for intraoperative cutting of bone tissue. |
Références
- Rosmini, S., et al. Cardiac computed tomography in cardio-oncology: an update on recent clinical applications. Eur Heart J Cardiovas Imaging. 22 (4), 397-405 (2021).
- Li, Y., et al. Distinct metabolism of bone marrow adipocytes and their role in bone metastasis. Front Endocrinol. 13, 902033 (2022).
- Bianchi, G., Ghobrial, I. M. Does my patient with a serum monoclonal spike have multiple myeloma. Hematol/Oncol Clinics North Am. 26 (2), 383-393 (2012).
- Choi, J. Y., Park, S. M., Kim, H. J., Yeom, J. S. Recent updates on minimally invasive spine surgery: Techniques, technologies, and indications. Asian Spine J. 16 (6), 1013-1021 (2022).
- Zhu, X., et al. A comparative study between minimally invasive spine surgery and traditional open surgery for patients with spinal metastasis. Spine. 46 (1), 62-68 (2021).
- Kuklo, T. R., Lenke, L. G. Thoracoscopic spine surgery: current indications and techniques. Ortho Nurs. 19 (6), 15-22 (2000).
- Roque, D., Cabral, D., Rodrigues, C., Simas, N. Extradural thoracic nerve root hemangioblastoma approached by a combined posterior thoracic spine and video-assisted thoracoscopic surgery: A case report. Surg Neurol Int. 13 (10), (2022).
- Hanna, G., Kim, T. T., Uddin, S. A., Ross, L., Johnson, J. P. Video-assisted thoracoscopic image-guided spine surgery: evolution of 19 years of experience, from endoscopy to fully integrated 3D navigation. Neurosurg Focus. 50 (1), E8 (2021).
- Johnson, J. P., Drazin, D., King, W. A., Kim, T. T. Image-guided navigation and video-assisted thoracoscopic spine surgery: the second generation. Neurosurg Focus. 36 (3), E8 (2014).
- Ragel, B. T., Amini, A., Schmidt, M. H. Thoracoscopic vertebral body replacement with an expandable cage after ventral spinal canal decompression. Neurosurg. 61 (5 Suppl 2), 317-322 (2007).
- Tokuhashi, Y., Uei, H., Oshima, M., Ajiro, Y. Scoring system for prediction of metastatic spine tumor prognosis. World J Ortho. 5 (3), 262-271 (2014).
- Mezei, T., et al. A novel prognostication system for spinal metastasis patients based on network science and correlation analysis. Clin Oncol. 35 (1), e20-e29 (2023).
- Zhu, X., et al. A comparative study between minimally invasive spine surgery and traditional open surgery for patients with spinal metastasis. Spine. 46 (1), 62-68 (2021).
- Qiu, J., et al. Novel technique for endoscopic-assisted nipple-sparing mastectomy and immediate breast reconstruction with endoscopic-assisted latissimus dorsi muscle flap harvest through a single axillary incision: a retrospective cohort study of comparing endoscopic and open surgery. Gland Surg. 11 (8), 1383-1394 (2022).
- Haoran, E., et al. Perioperative outcomes comparison of robotic and video-assisted thoracoscopic thymectomy for thymic epithelial tumor: a single-center experience. Updates Surg. , (2023).
- Maki, R., et al. Minimally invasive robot-assisted thoracoscopic surgery for mediastinal tumor. Kyobu geka. Japan J Thoracic Surg. 76 (7), 506-509 (2023).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon