Method Article
Verbesserte thorakoskopisch-assistierte Chirurgie zur Behandlung von metastasierten Thoraxwirbeltumoren
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
In dieser Arbeit stellen wir ein Protokoll vor, um eine verbesserte thorakoskopisch-assistierte Chirurgie zur Behandlung von metastasierten Thoraxwirbeltumoren zu demonstrieren.
Zusammenfassung
Die signifikanten Fortschritte bei der Diagnose und Behandlung von bösartigen Tumoren haben zu einer Verbesserung der Überlebensraten der Patienten geführt. Die metastasierende Ausbreitung dieser Tumoren auf die Brustwirbel bleibt jedoch eine große Herausforderung, die oft zu knochenbedingten unerwünschten Ereignissen wie pathologischen Frakturen und schweren Komplikationen führt. Um dieses Problem anzugehen, wurde ein verfeinerter multidisziplinärer Ansatz untersucht, der thorakoskopische Techniken für Tumorresektionen und Wirbelsäuleninterventionen verwendet. Thorakoskopische Techniken bieten eine minimalinvasive Alternative zu herkömmlichen offenen chirurgischen Methoden, die darauf abzielen, das Gesamttrauma der Patienten zu reduzieren. Durch die Nutzung der Vorteile der Thorakoskopie können Ärzte metastasierende Tumoren in den Brustwirbeln effektiv resezieren und gleichzeitig die Auswirkungen auf das umliegende Gewebe und die umliegenden Strukturen minimieren. Dieser Ansatz, kombiniert mit gezielten Eingriffen an der Wirbelsäule, hat das Potenzial, die Ergebnisse und die Lebensqualität der Patienten zu verbessern, indem die schwächenden Auswirkungen pathologischer Frakturen und anderer Komplikationen im Zusammenhang mit metastasierten Knochenerkrankungen gemildert werden. Die Umsetzung dieser multidisziplinären Strategie, die thorakoskopische Tumorresektion und spinale Eingriffe umfasst, stellt einen vielversprechenden Weg für die Behandlung von metastasierenden Tumoren in den Brustwirbeln dar. Weitere Forschung und klinische Bewertung sind notwendig, um die langfristigen Vorteile vollständig aufzuklären und die optimalen Behandlungsprotokolle für diese Patientenpopulation zu etablieren und letztendlich die Versorgung und die Ergebnisse für Personen zu verbessern, die von dieser schwierigen Erkrankung betroffen sind.
Einleitung
Mit den Fortschritten in der Diagnose und Behandlung von bösartigen Tumoren sind die Überlebensraten von Patienten mit bösartigen Tumoren signifikant gestiegen1. Gleichzeitig wurde jedoch ein Anstieg der Inzidenz von knochenbedingten unerwünschten Ereignissen beobachtet, die durch bösartige Tumoren, insbesondere Metastasen in den Brustwirbeln, verursacht wurden2. Viele Patienten mit ausgedehnten Knochenmetastasen, insbesondere solche mit Beteiligung der Brustwirbel, erleiden krankhafte Frakturen, die zu starken Schmerzen und sogar Lähmungen führen3.
Offene Eingriffe erfordern große Hautschnitte und umfangreiche Muskeldissektionen, was zu einem erheblichen chirurgischen Trauma und verlängerten Genesungszeiten des Patienten führt. Diese offenen Operationen sind auch mit einem größeren Blutverlust verbunden, da sie mit einer Schädigung der wichtigsten Blutgefäße verbunden sind, was das Gesamtoperationsrisiko erhöht4. Darüber hinaus erhöht das umfangreiche Trauma, das bei offenen Operationen auftritt, die Rate postoperativer Komplikationen wie Lungenprobleme und tiefe Venenthrombosen. Die langwierige Erholungsphase nach offenen Eingriffen führt auch zu längeren Krankenhausaufenthalten, die sowohl für die Patienten als auch für ihre Betreuer eine erhebliche Belastung darstellen. Darüber hinaus erschwert das eingeschränkte Gesichtsfeld bei offenen Operationen die genaue Lokalisierung und Resektion der erkrankten Areale, wodurch die technische Schwierigkeit der Operation erhöhtwird 5.
1993 berichtete der deutsche Arzt Mack erstmals über eine thorakoskopische Wirbelsäulenoperation, gefolgt von Rosenthal aus den USA im Jahr 1994, der über eine endoskopische Bandscheibenexzision des Brustwirbels berichtete6. Bei diesem Ansatz werden etablierte thorakoskopische Techniken verwendet, um einen Kanal zu schaffen, der eine Tumorresektion, eine Dekompression des Rückenmarks, die Implantation eines künstlichen Wirbelkörpers und die Fixierung mit Thoraxwirbelschrauben ermöglicht. Diese Technik zeichnet sich durch minimales Trauma, reduzierte Blutungen und weniger postoperative Schmerzen aus. Die thorakskopisch assistierte Wirbelsäulenchirurgie umfasst verschiedene Verfahren, darunter die laterale konvexe Freisetzung der Wirbelsäule, die Bandscheibenexzision, die Wirbelkörperbiopsie, die Drainage des Bandscheibenraumabszesses und die anteriore Fusionschirurgie7. Einige Forscher haben über den Einsatz von mikrochirurgischen Endoskopen für die Rekonstruktion der vorderen Brust- und thorakolumbalen Wirbel sowie die anteriore Freisetzung und Fusion bei der Behandlung von metastasierenden Tumoren, Frakturen und Deformitäten berichtet8.
Der Grund für die Entwicklung und Anwendung dieser Technik ergibt sich aus der zunehmenden Inzidenz knochenbedingter unerwünschter Ereignisse, insbesondere pathologischer Frakturen, die durch die metastasierende Ausbreitung von bösartigen Tumoren auf die Brustwirbel verursachtwerden 8. Diese Komplikationen können bei den betroffenen Patienten zu starken Schmerzen, Lähmungen und einer deutlichen Einschränkung der Lebensqualität führen. Im Vergleich zu herkömmlichen offenen chirurgischen Methoden bietet der thorakoskopische Ansatz mehrere Vorteile, darunter ein minimales Trauma, reduzierte Blutungen und weniger postoperative Schmerzen9. Diese Technik, die die Schaffung eines Kanals für die Tumorresektion, die Dekompression des Rückenmarks, die Implantation eines künstlichen Wirbelkörpers und die Fixierung mit Brustwirbelschrauben umfasst, hat sich bei der Behandlung verschiedener Wirbelsäulenerkrankungen wie metastasierenden Tumoren, Frakturen und Deformitäten als wirksam erwiesen10.
Der Einsatz thorakoskopischer Techniken zur Behandlung von metastasierenden Tumoren in den Brustwirbeln steht im breiteren Kontext der Fortschritte in der Diagnose und Behandlung bösartiger Tumoren, die zu verbesserten Überlebensraten der Patienten geführt haben1. Die anhaltende Herausforderung der metastasierten Knochenerkrankung, insbesondere der Brustwirbelsäule, hat jedoch die Erforschung innovativer, minimal-invasiver Ansätze zur Bewältigung dieses klinischen Problems erforderlich gemacht. Dieser Artikel stellt eine Fallserie von 40 Patienten vor, die sich einer thorakoskopischen Operation wegen metastasierender Tumoren in den Brustwirbeln unterzogen haben, und gibt Klinikern wertvolle Einblicke in die Wirksamkeit und potenzielle Anwendbarkeit dieser Technik. Das übergeordnete Ziel dieser Studie ist es, die Anwendung eines verfeinerten multidisziplinären Ansatzes zu untersuchen, der thorakoskopische Techniken zur Tumorresektion und spinale Eingriffe bei der Behandlung von metastasierenden Tumoren in den Brustwirbeln umfasst.
Protokoll
Die schriftliche Einverständniserklärung der Patienten wurde für die Veröffentlichung eingeholt. Dieses chirurgische Protokoll entspricht den ethischen Standards, die von der Ethikkommission des ersten angeschlossenen Krankenhauses der Zhejiang University School of Medicine (Fördernummer: IIT20240869A) festgelegt wurden.
1. Präoperative Beurteilung
- Verwenden Sie die folgenden Einschlusskriterien: Teilnehmer ab 18 Jahren; bestätigte Diagnose von metastasierten Thoraxwirbeltumoren mittels Bildgebung (MRT, CT) und Biopsie; der Tumor muss sich innerhalb der Brustwirbel T1-T12 befinden; Die Teilnehmer müssen einen Leistungsstatus haben, der darauf hinweist, dass sie für eine Operation fit sind; Die Teilnehmer müssen eine Einverständniserklärung abgeben, um sich im Rahmen der Studie einer Operation zu unterziehen.
- Verwenden Sie die folgenden Ausschlusskriterien: Teilnehmer mit weit verbreiteten Metastasen über den regionalen Bereich der Brustwirbel hinaus; schwere Begleiterkrankungen wie unkontrollierter Diabetes, Herz-Kreislauf-Erkrankungen und Nieren- oder Leberversagen, die das Risiko einer Operation erhöhen können; Aufgrund möglicher Risiken für den Fötus werden schwangere Frauen ausgeschlossen; frühere Teilnehmer an Wirbelsäulenoperationen, die zuvor an derselben Stelle wie der aktuelle Brustwirbeltumor operiert wurden; aktive systemische Infektionen oder lokale Infektionen an der Operationsstelle, da sie die chirurgischen Ergebnisse erschweren können; Patienten mit einer Lebenserwartung von weniger als 3 Monaten, die auf ärztlicher Beurteilung beruhen, können ausgeschlossen werden; Teilnehmer, die sich früheren Behandlungen wie Strahlentherapie oder Chemotherapie unterzogen haben; Allergien oder Nebenwirkungen auf Materialien oder Medikamente, die während des Krankenhausaufenthalts verwendet werden; Patienten mit früheren Brustoperationen, Traumata oder Infektionen, die möglicherweise Pleuraverwachsungen verursacht haben.
- Führen Sie eine Standardbildgebung der Wirbelsäule zusammen mit anteroposterioren und lateralen Röntgenaufnahmen des Brustkorbs durch, um mögliche Pleuraprobleme zu untersuchen.
- Ansicht der Wirbelsäule anteroposterior (AP): Bitten Sie den Patienten, mit dem Gesicht zum Röntgengerät zu stehen, wobei die Arme natürlich an den Seiten liegen. Hebe das Kinn leicht an, um die Halswirbelsäule zu strecken. Richten Sie die Mittellinie am Mittelpunkt des Brustbeins aus. Bitten Sie den Patienten, am Ende der Inspiration den Atem anzuhalten.
- Seitliche Ansicht des Brustkorbs: Bitten Sie den Patienten, sich mit der linken Seite zum Röntgengerät hin zu legen und die Arme über den Kopf zu heben. Achten Sie darauf, dass der Körper aufrecht und die Schultern entspannt bleiben. Richten Sie die Mittellinie auf Höhe des 4. Brustwirbels aus. Bitten Sie den Patienten, am Ende der Inspiration den Atem anzuhalten
- Beginn der Steroidtherapie bei Patienten mit symptomatischer Rückenmarkskompression: Eine typische Anfangsdosis beträgt 10-16 mg. Geben Sie nach der Anfangsdosis alle 4-6 Stunden eine Erhaltungsdosis von 4-6 mg. Verringern Sie die Dosis schrittweise über mehrere Tage bis Wochen, abhängig vom Ansprechen des Patienten.
- Untersuchen Sie Patienten mit hohen Tokuhashi-Scores und niedrigen Tomita-Scores, jedoch ohne Beteiligung der Wirbelbogenwurzeln und -gliedmaßen.
HINWEIS: Der Tokuhashi-Score ist ein prognostisches Bewertungssystem zur Vorhersage des Überlebens von Patienten mit metastasierten Wirbelsäulentumoren. Der überarbeitete Tokuhashi-Score kategorisiert die Patienten in drei prognostische Gruppen: Patienten mit Werten von 0-8 (Überleben von weniger als 6 Monaten), 9-11 (Überleben von 6-12 Monaten) und 12-15 (Überleben von mehr als 12 Monaten)11. Der Tomita-Score ist ein prognostisches Instrument zur Beurteilung von Patienten mit Wirbelsäulenmetastasen und hilft bei der Auswahl geeigneter Operationsstrategien. Es vergibt Bewertungen basierend auf Faktoren wie der Wachstumsrate des Primärtumors, dem Vorhandensein und der Resektabilität von viszeralen Metastasen und der Anzahl der Knochenmetastasen. Die Gesamtpunktzahl hilft den Ärzten, Patienten in verschiedene prognostische Gruppen einzuteilen, und leitet die Entscheidung, ob eine radikale Operation, eine palliative Operation oder eine konservative Behandlung durchgeführt werdensoll 12. - Erwägen Sie eine präoperative Embolisation bei Patienten mit Tumoren, die stark vaskulär sind. Identifizieren Sie Patienten mit früheren Brustoperationen, Traumata oder Infektionen, die möglicherweise Pleuraverwachsungen verursacht haben.
- Schließen Sie eine thorakoskopische Operation bei Patienten mit schweren Lungenerkrankungen wie COPD oder Asthma aus, die eine Einzellungenbeatmung erschweren können.
2. Anästhesierung und Lagerung des Patienten
- Beginnen Sie die Anästhesieeinleitung, indem Sie einen intravenösen Zugang herstellen und hochkonzentrierten Sauerstoff über eine Gesichtsmaske verabreichen, um die Sauerstoffreserven zu erhöhen. Als nächstes injizieren Sie intravenös Anästhetika (wie Propofol 20 mg/ml), Analgetika (wie Fentanyl 50 μg/ml) und Muskelrelaxantien (wie Rocuronium 10 mg/ml).
- Sobald der Patient das Bewusstsein verliert, wählen Sie je nach Verfahren die geeignete Größe und Seite (links oder rechts) eines doppellumigen Endotrachealtubus (DLT). Führen Sie eine direkte Laryngoskopie oder eine Videolaryngoskopie durch, um die Stimmbänder sichtbar zu machen. Führen Sie das DLT durch die Stimmbänder ein, wobei das Bronchiallumen nach vorne zeigt. Schieben Sie die Röhre vor, bis ein leichter Widerstand zu spüren ist, normalerweise bei 28-30 cm an den Zähnen. Blase die Trachealmanschette auf.
- Positionieren Sie den Patienten seitlich und befestigen Sie ihn mit Befestigungsgurten am Operationstisch, um sicherzustellen, dass die Atemwege des Patienten sicher sind. Stützen Sie sanft den Kopf und den Nacken des Patienten. Drehen Sie den Körper des Patienten langsam zur Seite, beginnend mit den Schultern und dann mit den Hüften. Halten Sie eine laterale Dekubitusposition mit freiliegendem Thorax, gebeugten Beinen und nach vorne gestreckten oberen Gliedmaßen (Abbildung 1).
- Halten Sie die Wirbelsäule ausgerichtet und vermeiden Sie Drehbewegungen. Lege ein Kissen zwischen die Knie und die Arme, um dich zu stützen. Überprüfen Sie die Vitalwerte und den Komfort des Patienten, um übermäßigen Druck oder Fehlausrichtungen zu vermeiden. Befestigen Sie Sicherungsgurte um die Schultern und Hüften des Patienten, um Bewegungen zu verhindern.
- Verwenden Sie die C-Bogen-Fluoroskopie, um die Ausrichtung der Wirbelsäule zu bestätigen: Positionieren Sie die C-Bogen-Durchleuchtung, um AP- und laterale Ansichten der Wirbelsäule zu erhalten. Bestätigen Sie die Ausrichtung der Wirbelsäule, indem Sie überprüfen, ob die Dornfortsätze zwischen den Pedikeln in der AP-Ansicht zentriert sind.
3. Chirurgischer Zugang und Sichtbarkeit
- Bereiten Sie das Ultraschall-Knochenmesser und andere chirurgische Instrumente für den späteren Gebrauch vor.
- Definieren Sie strategische Portstandorte rund um den betroffenen Standort, um eine optimale Instrumentenmanipulation und -einfuhr zu gewährleisten. Der Schnitt für chirurgische Instrumente wird am 3., 5. und 7. Interkostalraum entlang der vorderen Achsellinie sowie am 7. Interkostalraum entlang der Mittelachsellinie durchgeführt (Abbildung 2).
- Bereiten Sie die Brustwand auf einen möglichen Wechsel zur offenen Thorakotomie vor. Nachdem Sie bestätigt haben, dass eine Umstellung auf einen offenen Zugang erforderlich ist, bringen Sie den Patienten vorsichtig in die laterale Dekubitusposition, wenn ein Zugang zur lateralen oder vorderen Brustwirbelsäule erforderlich ist. Wenn ein posterischer Zugang erforderlich ist, halten Sie die Bauchlage, aber stellen Sie sicher, dass der Patient richtig ausgerichtet ist. Gehen Sie bei der Erstellung der Portale ggf. vorsichtig vor, um Verletzungen zu vermeiden.
4. Chirurgischer Eingriff
- Zugänge erstellen: Machen Sie mit einem Skalpell einen kleinen Schnitt (1-2 cm) für den Kameraport im 7. Interkostalraum und die Mittelachsellinie. Führen Sie das Thorakoskop durch diese Öffnung ein und sorgen Sie für eine freie Sicht auf die Brusthöhle. Erstellen Sie zusätzliche Arbeitsports, in der Regel zwei oder drei, im 3. und 5. Interkostalraum. Passen Sie die genauen Positionen basierend auf der Lage und Anatomie des Tumors an.
- Entleerung der Lunge: Kollapsieren Sie die Lunge auf der Operationsseite mit einer Einlungenbeatmung, um ein klares Operationsfeld zu schaffen. Bestätigen Sie eine ausreichende Lungendeflation durch eine visuelle Inspektion durch das Thorakoskop.
- Legen Sie den Tumor frei: Präparieren Sie die parietale Pleura, die über den Wirbelkörpern und dem Tumor liegt, vorsichtig mit einer endoskopischen Schere und einem Greifer. Identifizieren und schützen Sie wichtige anatomische Strukturen wie die Aorta, die Speiseröhre, die sympathische Kette und die segmentalen Gefäße.
- Den Tumor resezieren: Präparieren Sie den Tumor mit einer Kombination aus stumpfen und scharfen Dissektionstechniken vom umgebenden Gewebe. Wenn der Tumor an der Dura mater oder dem Rückenmark haftet, verwenden Sie feine, feine Instrumente, um ihn vorsichtig zu lösen. Seien Sie vorsichtig, um das Rückenmark oder die umliegenden Nervenstrukturen nicht zu beschädigen.
- Entfernen Sie den Tumor: Fassen Sie den Tumor und entfernen Sie ihn in Segmenten (Abbildung 3). Kontinuierliche Inspektion der Resektionsränder, um eine vollständige Entfernung des Tumors sicherzustellen. Entnahme von Proben für die intraoperative Pathologie.
- Bereiten Sie den Bandscheibenraum vor: Verwenden Sie Küretten, Rongeure und Absaugung, um den Zwischenwirbelraum zu reinigen und zu debridieren, indem Sie restliches Tumorgewebe, nekrotisches Material oder Bandscheibenreste entfernen. Bereiten Sie die Endplatten der Wirbel für die Platzierung eines künstlichen Wirbelkörpers vor. Stellen Sie sicher, dass die Oberfläche der Endplatten glatt und frei von Unregelmäßigkeiten ist. Ziel ist es, eine gleichmäßige, ebene Oberfläche zu schaffen, um einen optimalen Kontakt mit dem künstlichen Wirbelkörper zu fördern. Achten Sie darauf, den subchondralen Knochen nicht zu beschädigen.
- Platzieren Sie den künstlichen Wirbelkörper: Wählen Sie einen künstlichen Wirbelkörper in geeigneter Größe, der den Abmessungen des resezierten Wirbelkörpers entspricht. Führen Sie den künstlichen Wirbelkörper in den vorbereiteten Bandscheibenraum ein. Stellen Sie sicher, dass es sicher sitzt und die Höhe und Ausrichtung der Wirbelsäule wiederherstellt.
- Sichern Sie das Implantat: Bestätigen Sie die korrekte Position und Ausrichtung des künstlichen Wirbelkörpers mittels fluoroskopischer Bildgebung.
- Platzieren und sichern Sie Wirbelsäulenversteifungsgeräte: Setzen Sie Pedikelschrauben und -stäbe über und unter der Resektion und der Implantationsstelle ein. Sichern Sie diese Geräte, um die Wirbelsäule zu stabilisieren, und prüfen Sie manuell, ob das Konstrukt beweglich oder instabil ist. Bestätigen Sie die korrekte Ausrichtung und Fixierung mit fluoroskopischer Bildgebung und stellen Sie sicher, dass die Pedikelschrauben und -stäbe sicher an Ort und Stelle sind und die Wirbelsäule stabilisiert ist.
- Erreichen Sie eine Hämostase: Kontrollieren Sie Blutungen aus dem Tumorbett, dem Zwischenwirbelraum oder dem umgebenden Gewebe mit bipolaren Kautern, Blutstillungsmitteln oder Nähten. Stellen Sie sicher, dass das Operationsfeld frei von übermäßigen Blutungen ist, bevor Sie mit dem Verschluss fortfahren.
- Lunge wieder aufblasen und schließen: Blasen Sie die Lunge langsam wieder auf, während Sie durch das Thorakoskop auf Luftlecks prüfen. Legen Sie eine Thoraxdrainage durch eine der Portstellen, um eine postoperative Drainage und Wiederausdehnung der Lunge zu ermöglichen. Entfernen Sie das Thorakoskop und andere Instrumente und verschließen Sie die Portstellen mit Nähten oder Klammern der Größe 4-0.
5. Postoperatives Management
- Überwachung: Verlegen Sie den Patienten in den Aufwachraum oder auf die Intensivstation (ICU), um die Vitalfunktionen, die Atemfunktion und den neurologischen Status genau zu überwachen. Überwachen Sie auf Komplikationen wie Blutungen, Infektionen oder Atemnot.
- Schmerzbehandlung: Initiieren Sie ein Schmerzbehandlungsprotokoll, das intravenöse Opioide, nicht-opioide Analgetika und patientenkontrollierte Analgesie (PCA) umfasst.
- Management der Thoraxdrainage: Überwachen Sie die Ausscheidung der Thoraxdrainage, gehen Sie bei stabiler Lungeninflation zur Wasserdichtung über und bereiten Sie sich auf die Entfernung vor, wenn die Ausscheidung auf weniger als 100 ml/Tag abnimmt, in der Regel bis zum 2. postoperativen Tag. Erhalten Sie eine AP- und laterale Thoraxansicht vor und nach der Entfernung der Thoraxdrainage, um die Lungenreexpansion zu überprüfen und einen Pneumothorax auszuschließen.
- Mobilität und Rehabilitation: Fördern Sie die frühe Mobilisierung, wenn der Patient hämodynamisch stabil ist und die Vitalparameter innerhalb normaler Grenzen liegen. Dies kann helfen, Komplikationen wie tiefe Venenthrombosen (TVT) und Lungenembolien (LE) zu vermeiden. Arbeiten Sie mit Physiotherapeuten zusammen, um einen maßgeschneiderten Rehabilitationsplan zu erstellen, der sanfte Übungen zur Verbesserung von Beweglichkeit und Kraft enthält.
- Ernährung: Fördern Sie eine ausgewogene Ernährung, die reich an Proteinen, Vitaminen und Mineralien ist, um die Heilung und Knochenfusion zu unterstützen. Fördern Sie die Flüssigkeitszufuhr und eine ballaststoffreiche Ernährung, um Verstopfung vorzubeugen, insbesondere wenn der Patient Opioid-Schmerzmittel einnimmt.
- Aktivität und Lebensstil: Weisen Sie den Patienten an, schwere Hebe-, Biege- oder Drehbewegungen zu vermeiden, die die Wirbelsäule belasten könnten. Fördern Sie regelmäßige, sanfte Bewegung wie Gehen, Schwimmen oder Aerobic mit geringer Belastung, um die allgemeine Gesundheit zu erhalten und die Regeneration der Wirbelsäule zu unterstützen.
Ergebnisse
Die Patientendaten umfassen den präoperativen Tokuhashi-Score, den präoperativen Tomita-Score, den präoperativen VAS-Score (Visual Analog Scale) und den postoperativen VAS-Score. Die statistische Analyse ist in Tabelle 1 dargestellt. Die postoperativen VAS- und präoperativen VAS-Scores wurden mit Hilfe von gepaarten t-Tests analysiert. Die Ergebnisse der Daten deuten darauf hin, dass Personen, die sich dem verbesserten thorakoskopisch assistierten Verfahren unterziehen, eine signifikante Verringerung ihres VAS-Scores aufweisen (Abbildung 4). Der Status der Resektion und Rekonstruktion des spinalen Tumors muss durch die postoperative Nachsorge beurteilt werden (Abbildung 5).
An der Studie wurde eine Kohorte von 40 Patienten im Alter zwischen 63 und 78 Jahren teilgenommen. Der präoperative Tokuhashi-Score, der präoperative Tomita-Score, der präoperative VAS-Score und der postoperative VAS-Score wiesen eine Spanne von 11,5 ± 2,8, 5,5 ± 1,2, 6,0 ± 1,4 und 1,5 ± 1,2 in den Beurteilungswerten der Patienten auf. Der VAS-Score weist eine statistisch signifikante Diskrepanz zwischen der präoperativen und der postoperativen Beurteilung auf.
Der Tokuhashi-Score mit einem Mittelwert von 11,5 ± 2,8 zeigte, dass die meisten Patienten bei mittlerer bis guter Gesundheit waren, wobei 40 % als gesund und 60 % als mittelmäßig eingestuft wurden. Die Tumorkontrolle war überwiegend partiell bis vollständig, wobei 50 % eine partielle Kontrolle und 30 % eine vollständige Kontrolle erreichten. Die Stabilität der Wirbelsäule war weit verbreitet, wobei 80 % der Patienten eine stabile Wirbelsäule hatten. Alle Patienten hatten aufgrund der Einsegmentnatur ihrer Tumoren eine einzelne Metastasierung, und 70 % wiesen günstige primäre Krebsarten auf. Der Tomita-Score mit einem Mittelwert von 5,5 ± 1,2 zeigte eine gleichmäßige Aufteilung des Leistungsstatus, wobei 50 % als gut und 50 % als schlecht bewertet wurden. Histologisch hatten 65% der Patienten günstige Typen. Diese Ergebnisse spiegeln eine Patientengruppe mit allgemein günstigen Bedingungen für chirurgische Eingriffe wider, einschließlich einer beherrschbaren Erkrankung und eines insgesamt guten Gesundheitszustands.

Abbildung 1: Position der Patienten, die sich der Operation unterziehen. Ein Foto, das die korrekte Positionierung des Patienten für die thorakoskopische Operation zeigt, typischerweise in der lateralen Dekubitusposition, mit entsprechender Polsterung und Stützen zur Sicherung des Patienten. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Schnitte für chirurgische Instrumente. Der Schnitt für chirurgische Instrumente wird am dritten, fünften und siebten Interkostalraum entlang der vorderen Achsellinie sowie am siebten Interkostalraum entlang der mittleren Achsellinie durchgeführt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
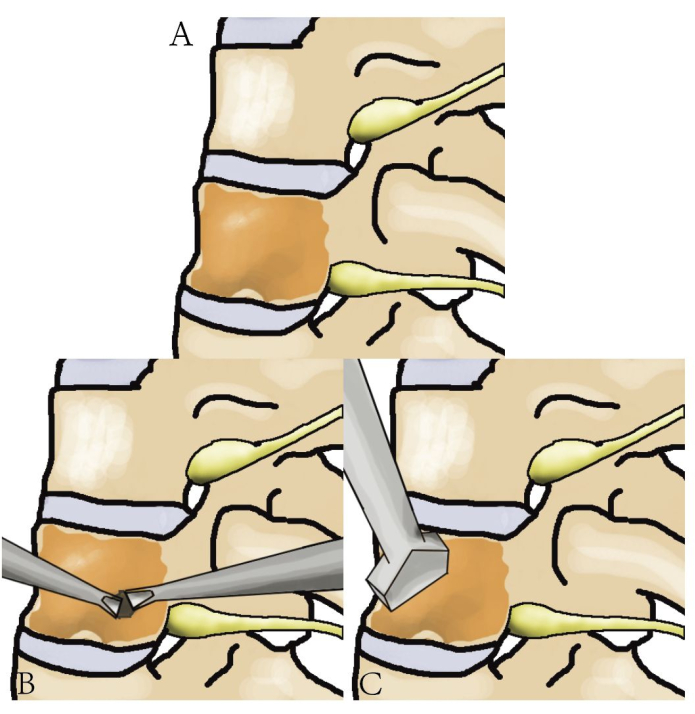
Abbildung 3: Diagramm der Tumorresektion der Brustwirbelsäule. Ein detailliertes Diagramm, das die Brustwirbelsäule, den Tumor und die Schritte zur Resektion des Tumors zeigt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
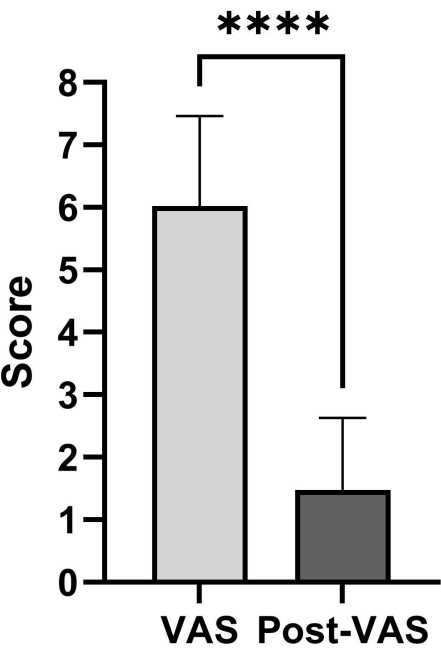
Abbildung 4: Vergleich zwischen postoperativen und präoperativen VAS-Scores. Es besteht eine statistisch signifikante Diskrepanz zwischen der präoperativen und der postoperativen VAS-Beurteilung. Die Daten stellen die mittlere ± Standardabweichung dar; Die Ergebnisse wurden mit Hilfe von gepaarten t-Tests analysiert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
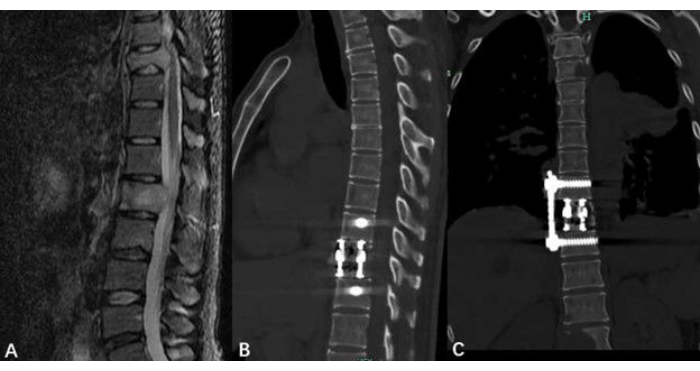
Abbildung 5: Bildgebung von Thoraxwirbeltumoren. (A) Ein präoperatives MRT zeigte den Thoraxwirbeltumor an. (B, C) Bilder eines postoperativen CT-Scans, der die Brustwirbelsäule nach der Tumorresektion und eventuell implantierte Hardware zeigt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Gruppe | Tokuhashi-Punktzahl | Tomita-Punktzahl | Präoperativer VAS-Score | Postoperativer VAS-Score | Alter (Jahre) |
| TAS (n=40) | 11,5 ± 2,8 | 5,5 ± 1,2 | 6,0 ± 1,4 | 1,5 ± 1,2 | 70,8 ± 4,7 |
Tabelle 1: Bewertungsergebnisse des Patienten. Die numerischen Daten wurden als Mittelwert ± Standardabweichung (Mittelwert ± SD) dargestellt. Abkürzung: TAS = thorakoskopisch-assistierte Chirurgie.
Diskussion
Zu den Nachteilen der offenen Operation gehören größere Schnitte und längere Narben, die zu einem umfangreicheren Gewebeaufschluss und größeren postoperativen Schmerzen führen13. Dieser Ansatz führt oft zu einem höheren Blutverlust während des Eingriffs und erhöht das Risiko von Infektionen und Komplikationen aufgrund einer breiteren Exposition. Die Patienten leiden unter längeren Genesungszeiten, längeren Krankenhausaufenthalten und einer verzögerten Rückkehr zu normalen Aktivitäten. Darüber hinaus hat die offene Operation einen größeren Einfluss auf die Lungenfunktion und erhöht das Risiko postoperativer Atemwegskomplikationen. Insgesamt bietet die offene Chirurgie zwar eine hervorragende Sicht und einen hervorragenden Arbeitsraum, ist aber mit einer höheren Trauma- und Genesungsbelastung verbunden14.
Die weiterentwickelte thorakoskopisch-assistierte Chirurgie zur Behandlung von metastasierten Thoraxwirbeltumoren stellt einen bedeutenden Fortschritt im Bereich der minimal-invasiven chirurgischen Eingriffe dar.
Zu den Vorteilen gehören eine hervorragende Visualisierung kritischer anatomischer Strukturen, ein minimales Trauma des normalen Gewebes, reduzierte postoperative Schmerzen, kürzere Krankenhausaufenthalte und eine geringere Inzidenz von Komplikationen. Diese Technik hat jedoch gewisse Einschränkungen, die anerkannt werden müssen. Es erfordert ein hohes Maß an technischer Kompetenz und verlangt von den Chirurgen, dass sie über fortgeschrittene Fähigkeiten sowohl in der Thoraxchirurgie als auch in der Wirbelsäulenchirurgie verfügen. Darüber hinaus kann der thorakoskopisch-assistierte Ansatz im Vergleich zur offenen Operation die direkte Visualisierung und Palpation des Tumors einschränken, was möglicherweise die Bestätigung einer vollständigen Resektion beeinträchtigenkann 15. Darüber hinaus ist die Anwendbarkeit dieser Methode durch die Größe und Lokalisation des Tumors eingeschränkt. außergewöhnlich große Tumoren oder solche, die sich über bestimmte anatomische Grenzen hinaus erstrecken, sind für diese Technik möglicherweise nicht geeignet.
Ein entscheidendes Element des thorakoskopisch-assistierten Operationsprotokolls ist eine sorgfältige präoperative Planung, einschließlich des Einsatzes bildgebender Verfahren, um die Lage und das Ausmaß des Tumors genau abzugrenzen. Entscheidend für den Erfolg der Operation ist die optimale Positionierung des Patienten, um einen maximalen Zugang zu den Brustwirbeln zu gewährleisten. Darüber hinaus ist die sorgfältige Dissektion und der Erhalt der umgebenden vitalen Strukturen bei gleichzeitiger Sicherstellung einer vollständigen Resektion des Tumors ein heikles Gleichgewicht, das spezielle chirurgische Fähigkeiten erfordert.
Während der Implementierung dieses Protokolls können Chirurgen auf verschiedene Herausforderungen stoßen, die eine Änderung der Technik erforderlich machen. In Fällen, in denen eine umfangreiche Gefäßbeteiligung erforderlich ist, kann beispielsweise eine zusätzliche endovaskuläre Unterstützung erforderlich sein, um mögliche Blutungen zu behandeln. Die Fehlerbehebung während der Operation kann die Verwendung spezieller Instrumente oder die Anpassung des Eintrittswinkels umfassen, um das Gesichtsfeld zu verbessern. Die Anpassungsfähigkeit dieses Protokolls ermöglicht es Chirurgen, ihre Ansätze auf den Einzelfall zuzuschneiden und so die Patientenergebnisse zu optimieren.
Die Anwendung der erweiterten thorakoskopisch-assistierten Chirurgie stellt einen deutlichen Fortschritt gegenüber der traditionellen offenen Chirurgie und den bisherigen minimal-invasiven Techniken dar. Im Vergleich zur offenen Thorakotomie bietet unser Ansatz eine reduzierte Morbidität, geringere postoperative Schmerzen und verkürzte Genesungszeiten. Selbst im Vergleich zu anderen minimal-invasiven Ansätzen bietet die in dieser Studie beschriebene Methode überlegene ergonomische Bedingungen für den Chirurgen und potenziell eine höhere Präzision aufgrund einer verbesserten Visualisierung, die durch die thorakoskopische Vergrößerung ermöglicht wird15.
Die weiterentwickelte thorakoskopisch-assistierte Operationstechnik ist für die onkologische Forschung von großer Bedeutung, insbesondere für Untersuchungen mit den Schwerpunkten der chirurgischen Onkologie und des Managements von Spinalmetastasen16. Durch die minimalinvasive Entfernung von metastasierten Thoraxwirbeltumoren bietet dieses Protokoll eine Plattform für die Erforschung von Zusatztherapien wie intraoperativer Chemotherapie oder Strahlentherapie. Darüber hinaus erleichtert es die Untersuchung der Patientenergebnisse in Bezug auf die Lebensqualität nach der Operation unter Berücksichtigung eines reduzierten Traumas und einer möglicherweise schnelleren Wiederaufnahme der täglichen Aktivitäten. Diese Technik hat das Potenzial, Ansätze der personalisierten Medizin zu verbessern, indem sie eine Änderung des Operationsplans auf der Grundlage patientenspezifischer Anatomie und Tumoreigenschaften ermöglicht, die aus fortschrittlichen Bildgebungsmodalitäten abgeleitet werden.
Offenlegungen
Die Autoren erklären, dass kein Interessenkonflikt besteht.
Danksagungen
Nicht zutreffend.
Materialien
| Name | Company | Catalog Number | Comments |
| Absorbable sutures | ETHICON | VCP739D | Johnson & Johnson 2-0 Absorbable Suture for suturing incisions |
| anesthesia drug | Anlibang Pharmaceuticals | propofol injectable emulsion | Sedation used in anesthesia procedures |
| anterior fixation system | Medtronic | VANTAGE | Medtronic's Vertebral Lateral Fixation System can be used to fixate the adjacent vertebral bodies to the implanted artificial vertebral body from the lateral side of the vertebrae, creating a stable overall structure. |
| Artificial vertebral body | Stryker | VLIFT | Stryker Artificial Vertebral Body is used for implanting an artificial vertebral body prosthesis after the removal of a diseased vertebra to support the spine. |
| C-arm | GE | OEC One CFD | Used for intraoperative fluoroscopic confirmation of the proper positioning of metal implants. |
| Thoracoscope System | stryker | Precision Ideal Eyes HD | Used for imaging of visceral organs within the thoracic cavity to facilitate the surgical manipulation of pathological structures. |
| Ultrasonic bone knife | SMTP | XD860A | Used for intraoperative cutting of bone tissue. |
Referenzen
- Rosmini, S., et al. Cardiac computed tomography in cardio-oncology: an update on recent clinical applications. Eur Heart J Cardiovas Imaging. 22 (4), 397-405 (2021).
- Li, Y., et al. Distinct metabolism of bone marrow adipocytes and their role in bone metastasis. Front Endocrinol. 13, 902033 (2022).
- Bianchi, G., Ghobrial, I. M. Does my patient with a serum monoclonal spike have multiple myeloma. Hematol/Oncol Clinics North Am. 26 (2), 383-393 (2012).
- Choi, J. Y., Park, S. M., Kim, H. J., Yeom, J. S. Recent updates on minimally invasive spine surgery: Techniques, technologies, and indications. Asian Spine J. 16 (6), 1013-1021 (2022).
- Zhu, X., et al. A comparative study between minimally invasive spine surgery and traditional open surgery for patients with spinal metastasis. Spine. 46 (1), 62-68 (2021).
- Kuklo, T. R., Lenke, L. G. Thoracoscopic spine surgery: current indications and techniques. Ortho Nurs. 19 (6), 15-22 (2000).
- Roque, D., Cabral, D., Rodrigues, C., Simas, N. Extradural thoracic nerve root hemangioblastoma approached by a combined posterior thoracic spine and video-assisted thoracoscopic surgery: A case report. Surg Neurol Int. 13 (10), (2022).
- Hanna, G., Kim, T. T., Uddin, S. A., Ross, L., Johnson, J. P. Video-assisted thoracoscopic image-guided spine surgery: evolution of 19 years of experience, from endoscopy to fully integrated 3D navigation. Neurosurg Focus. 50 (1), E8 (2021).
- Johnson, J. P., Drazin, D., King, W. A., Kim, T. T. Image-guided navigation and video-assisted thoracoscopic spine surgery: the second generation. Neurosurg Focus. 36 (3), E8 (2014).
- Ragel, B. T., Amini, A., Schmidt, M. H. Thoracoscopic vertebral body replacement with an expandable cage after ventral spinal canal decompression. Neurosurg. 61 (5 Suppl 2), 317-322 (2007).
- Tokuhashi, Y., Uei, H., Oshima, M., Ajiro, Y. Scoring system for prediction of metastatic spine tumor prognosis. World J Ortho. 5 (3), 262-271 (2014).
- Mezei, T., et al. A novel prognostication system for spinal metastasis patients based on network science and correlation analysis. Clin Oncol. 35 (1), e20-e29 (2023).
- Zhu, X., et al. A comparative study between minimally invasive spine surgery and traditional open surgery for patients with spinal metastasis. Spine. 46 (1), 62-68 (2021).
- Qiu, J., et al. Novel technique for endoscopic-assisted nipple-sparing mastectomy and immediate breast reconstruction with endoscopic-assisted latissimus dorsi muscle flap harvest through a single axillary incision: a retrospective cohort study of comparing endoscopic and open surgery. Gland Surg. 11 (8), 1383-1394 (2022).
- Haoran, E., et al. Perioperative outcomes comparison of robotic and video-assisted thoracoscopic thymectomy for thymic epithelial tumor: a single-center experience. Updates Surg. , (2023).
- Maki, R., et al. Minimally invasive robot-assisted thoracoscopic surgery for mediastinal tumor. Kyobu geka. Japan J Thoracic Surg. 76 (7), 506-509 (2023).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten