Method Article
Kitosan Nanopartiküllerin İntraosseöz Enjeksiyonu Kullanılarak Gelişmiş Gen İletimi ve Ekspresyonu Kapsüllenmiş Adenin Baz Düzenleyici Plazmitler
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Burada, ABE kaplı kitosanı kemik içi enjeksiyon ile doğrudan kemik iliğine ileten bir gen tedavisi yaklaşımı sunuyoruz.
Özet
Ekzojen plazmitlerin deney hayvanlarına verilmesi, gen fonksiyonlarının araştırılması, hastalık mekanizmalarının aydınlatılması ve ilaç etkinliğinin değerlendirilmesi dahil olmak üzere biyomedikal araştırmalarda çok önemlidir. Bununla birlikte, mevcut yöntemin transfeksiyon verimliliği nispeten düşüktür ve uzun süreli gen ekspresyonu için plazmitlerin eklenmesi bağışıklık sisteminden etkilenebilir. Bu sınırlamaları ele almak için, adenin baz düzenleyici (ABE) plazmitlerini kapsüllemek için kitosan kullanan ve daha sonra kompleksi intraosseöz enjeksiyonla doğrudan farelerin kemik iliğine ileten yeni bir yöntem geliştirdik ve araştırdık. Bu çalışmada, osteoklast farklılaşması ile yakından ilişkili olan CaMK II δ genini hedeflemek için, ABE CaMK II δ plazmitlerini kapsüllemek için kitosan kullandık. Plazmid kargosunu kemik iliği boşluğuna intraosseöz enjeksiyon ile direkt olarak enjekte ettik. Sonuçlar, alıcı farelerde A1 lokusunda %14.27 ve A2 lokusunda %10.69 gibi yüksek bir in vivo düzenleme verimliliği gösterdi. Bu yeni strateji sadece anormal osteoklast fonksiyonunun neden olduğu hastalıklar için özellikle uygun olmakla kalmaz, aynı zamanda gen terapisi alanını ilerletmek için önemli bir potansiyele sahiptir.
Giriş
Gen terapisi, biyomedikal araştırma alanında umut verici bir yaklaşım olarak ortaya çıkmıştır 1,2. Belirli genlerin ekspresyonunu modüle etmek ve terapötik etkilerini incelemek için deney hayvanlarına yabancı plazmitler ekleyerek çeşitli bozuklukları tedavi etme potansiyeli sunar. Bununla birlikte, geleneksel teslimat yöntemleri, etkinliklerini ve güvenliklerini sınırlayan bazı sorunlarla karşılaşmıştır3. Endişeler arasında düşük transfeksiyon verimliliği, yüksek biyolojik hasar ve düşük gen ekspresyon verimliliği yer alır. Bu nedenle, bu sınırlamaların üstesinden gelebilecek gen tedavisi için yeni bir dağıtım yöntemi oluşturmak gerekir.
Kitosan, iyi biyolojik bozunabilirliğe vebiyouyumluluğa 4,5,6 sahip doğal bir polisakkarittir, bu da ciddi biyolojik toksisiteye neden olmadan hayvan vücutlarında bozunmayı kolaylaştırır. Yüksek ilaç yerleştirme oranı 7,8, gelişmiş dağıtım verimliliği ve hayvanlara verilen zararın azalması nedeniyle ilaç dağıtımında yaygın olarak kullanılmaktadır.
A-T'nin doğrudan baz çiftlerinin G-C'ye dönüştürülmesine izin veren ABE gen düzenleme teknolojisi, genetik ve tıbbi araştırmalarda umut vericidir. Mevcut ana akım gen düzenleme teknolojisi ile karşılaştırıldığında, ABE teknolojisi doğru tek baz mutasyonu elde edebilir, böylece hedef olmayan DNA dizilerinin düzenlenmesini azaltabilir, hedef dışı etkileriazaltabilir 9,10 ve sıfır DNA çift iplikli kırılmaya11 yol açabilir, bu da gen düzenleme riskini büyük ölçüde azaltır12. ABE teknolojisi ayrıca biyouyumludur ve hastalık tedavisi araştırmaları için daha uygundur.
Kuyruk ven enjeksiyonu, özellikle gen terapisinde plazmitlerin in vivo verilmesi için kullanılan yaygın bir yöntemdir. Bu çalışma için hedef gen, osteoklast farklılaşması13,14 ile yakından ilişkili olan CaMK II δ'dir. Kuyruk damarı yerine kemik içi enjeksiyonun kullanılması, düzenlenmiş plazmitin osteoklastlara doğrudan kemik iliğine girmesine izin verir. Kemik iliğine bu doğrudan geçiş, gen ekspresyonunun verimliliğini ve stabilitesini arttırır, bu da osteoklast disfonksiyonu ile ilgili hastalıkların tedavisi için avantajlıdır.
Burada, ABE plazmidinin kitosan ile kapsüllenmesini ve daha sonra kompleksin intraosseöz enjeksiyon ile doğrudan farelere sokulmasını içeren yeni bir yöntem sunuyoruz. Bu yöntem sayesinde, özellikle osteoklast disfonksiyonuna bağlı hastalıklar olmak üzere organizmalara giren yabancı plazmitler için daha etkili gen tedavisi tedavilerinin önünü açmayı umuyoruz.
Protokol
Açıklanan tüm hayvan deneyleri, Anhui Üniversitesi Hayvanların Kullanımı ve Bakımı Hayvan Sağlığı Komitesi tarafından onaylanmıştır. Bu çalışmada ABE, Profesör Tian Chi (Şanghay Bilim ve Teknoloji Üniversitesi, Şangay, Çin; Şekil 1D).
1. ABE plazmit yapımı
- PAM'ın GAC tarafından sunulduğu TCCATGATGCACACACAGGA dizisi ile gRNA tasarlayın.
- Şirketin astar listesi kılavuzuna göre, 100 μM'lik bir konsantrasyon elde etmek için astarı karşılık gelen ddH2Ohacmine ekleyin. Ardından, eşit dağılımı sağlamak için çalkalayın ve iyice karıştırın. Tavlama reaksiyonu için, yeni mikrosantrifüj tüpüne 10 μL stok astar çözeltisi, 90 μL ddH2O ekleyerek 10 μM'lik bir çözelti hazırlayın ve iyice karıştırın.
- Bir mikrosantrifüj tüpüne 5 μL yukarı akış astarı, 5 μL aşağı akış astarı ve 40 μL ddH2O ekleyin. Tavlama reaksiyonunu kolaylaştırmak için, tüpü 5 dakika kaynar suyla dolu bir kaba daldırın. Suyun astarlara girmesini ve kirletmesini önlemek için su seviyesinin borunun açıklığına ulaşmadığından emin olun. Tavlama reaksiyonunu tamamlamak için oda sıcaklığına soğutun.
- Bir mikrosantrifüj tüpüne 2 μg pLKO5.sgRNA.EFS.tRFP (Şekil 1D), 1 μL ESP3I, 4 μL tampon ve 33 μL ddH2O ekleyin ve 37 ° C'de sabit sıcaklıktaki bir su banyosunda 45 dakika reaksiyona girmeye bırakın.
- Agaroz jel elektroforezi gerçekleştirin. 0.5 g agaroz ağırlığında% 1'lik bir agaroz jeli hazırlayın ve bir cam şişeye dökün. Cam şişeye 50 mL 1x TAE tamponu ekleyin ve agaroz tozunu çözmek için çalkalayın. Mikrodalga fırında tamamen eriyene kadar 2 dakika ısıtın. 5 μL YeaRed Nükleik Asit Jel Lekesi ekleyin, iyice karıştırın ve jel kalıba dökün; Jel katılaştıktan sonra numuneleri eklemeye başlayın.
NOT: 1xTAE hazırlamak için Tablo 1'de listelenen reaktifleri kullanın. - Elektroforez tankına 1x TAE ekleyin ve TAE'ye daldırılması gereken yapılandırılmış agaroz jel bloğuna koyun. Adım 1.4'ten itibaren sindirim ürününe 5 μL 1x yükleme tamponu ekleyin ve karıştırın. Numuneyi jele ekleyin. Ek olarak, jele 6 μL işaretleyici de ekleyin.
- Elektroforez programını 35 dakika boyunca 110 V'luk sabit bir voltajda çalıştırın. Elektroforezden sonra, işaretleyiciye göre numunedeki bandın konumunu belirleyin ve jel geri kazanımı için jel şeridini temiz bir bıçakla kesin.
- Jel geri kazanım işlemini jel maxi arıtma kiti talimatlarına göre gerçekleştirin. Bir su banyosunu 50 °C'ye ayarlayın. Kite göre kesilmiş jeli içeren tüpe karşılık gelen hacimde PN çözeltisi ekleyin. Çözünmeyi kolaylaştırmak için jeli bir pipet ucuyla dürtün ve ardından su banyosuna koyun. Tüpü arada bir çalkalayın ve jel blok tamamen çözülene kadar çözünme sürecini gözlemleyin.
- Kitten bir döndürme sütunu (CA3) alın. Kitten spin kolonuna 500 μL BL çözeltisi ekleyin ve kolonu dengelemek için 1 dakika boyunca 2.000 x g'da santrifüjleyin. Santrifüjlemeden sonra, toplama tüpünün altındaki atık sıvıyı çıkarın ve adsorpsiyon kolonunu tekrar toplama tüpüne koyun.
- Santrifüjlemeye 1 dakika boyunca 2.000 x g'da devam edin. Santrifüj tüpünün altındaki atık sıvıyı atın, 600 μL PN çözeltisi ekleyin ve 30 saniye boyunca 2.000 x g santrifüjleyin; Atık sıvıyı tekrar atın. İşlemi tekrarlayın ve atık sıvıyı tekrar atın.
- Santrifüjlemeden sonra, 2 mL toplama tüpünü yeni bir 1.5 mL tüp ile değiştirin. Kapağı açın ve etanolü tamamen çıkarmak için havalandırılan bir yerde 30 dakika kurumaya bırakın. Daha sonra, önceden ısıtılmış 40 μL ddH2O, santrifüj ekleyin ve gerekli DNA'yı elüte edin.
NOT: PN, talimatlara göre susuz etanol ile eklenmelidir. Önceden ısıtılmış su kullanımı verimi artırabilir. - Adım 1.3'ten 7 μL tavlama ürünü, adım 1.11'den 3 μL jel geri kazanım ürünü, 1 μL T4 DNA Ligaz, 2 μL 10x T4 Ligaz Tamponu ve 7 μL ddH2O ekleyin bir mikrosantrifüj tüpüne ve ligasyon ürününü elde etmek için gece boyunca 16 ° C'de tutun.
- 10 μL ligasyon ürünü ve 70 μL DH5α ekleyin, 30 dakika boyunca buz üzerinde bir mikrosantrifüj tüpüne ekleyin. Su banyosunu 42 °C'ye ayarlayın. Buz banyosundan sonra, tüpü 90 saniye boyunca su banyosuna koyun ve ardından tekrar 2 dakika boyunca buzun üzerine koyun.
- Tüpe 600 μL Luria-Bertani (LB) sıvı ortam ekleyin ve 30 dakika boyunca bir çalkalayıcı üzerinde çalkalayın. Aynı zamanda, bir LB katı orta plakayı bir laminer akış kabini içinde 30 dakika boyunca ışınlayın. İnkübasyondan sonra, 100 μL çözeltiyi plaka üzerine eşit olarak dağıtın. Kaplamadan sonra, plakayı kültür için 37 ° C'lik bir bakteri inkübatöre baş aşağı yerleştirin.
NOT: DH5α genellikle -80 °C'de saklanır. LB katı ortam, Tablo 2'de listelenen reaktifler kullanılarak hazırlanır. LB sıvı ortamı, Tablo 3'te listelenen reaktifler kullanılarak hazırlanır. - Tek bir koloni seçin ve bakteri kolonisini taze bir tabakta 14 saat genişletin. 50 mL'lik bir santrifüj tüpü alın, 50 mL LB sıvı ortam ekleyin, 1:1000 oranında 50 μL ampisilin ekleyin ve iyice karıştırın. Bunu tüp başına 15 mL'lik yeni tüplere bölün.
- İyi büyüme gösteren yuvarlak beyaz koloniler için kültür plakasını kontrol edin. Bunları 10 μL'lik bir pipetle seçin ve LB ortamına aktarın. Bunu 12 saat boyunca bir çalkalayıcıda kültürleyin ve ardından bu numuneyi sıralama için gönderin.
- Hedef suş olarak eşleşen dizi olan Camk II δ-sgRNA ile suşu tanımlamak için dizileme sonuçlarını hedef gRNA ile karşılaştırın ve ardından plazmidi çıkarın.
- Mini plazmid kitinin talimatlarına göre plazmit ekstraksiyonu gerçekleştirin. CP3 adsorpsiyon kolonuna 500 μL BL ekleyin, 2.000 x g'da 1 dakika santrifüjleyin ve atık sıvıyı atın. Adsorpsiyon kolonunu tekrar toplama tüpüne koyun. 500 μL bakteri çözeltisi ekleyin ve 10 dakika boyunca 4.000 x g'da santrifüjleyin.
- Akışı toplayın. Tekrar santrifüjleyin ve süpernatanı çıkardıktan sonra, bakteriyel çökeltme ile santrifüj tüpüne 250 μL P1 ekleyin ve ardından bir mikrosantrifüj tüpüne ve girdaba aktarın. 250 μL P2 ekleyin ve 6x-8x için hafifçe ters çevirin. 350 μL P3 ekleyin ve tekrar 6x-8x için hafifçe ters çevirin. Beyaz topaklanan çökelti belirir.
- 2.000 x g'da 10 dakika santrifüjleyin. Süpernatanı yeni bir adsorpsiyon sütunu CP3'e aktarın, 30 saniye boyunca 2.000 x g'da santrifüjleyin ve atık sıvıyı çıkarın. 600 μL PW ekleyin, 30 saniye boyunca 2.000 x g'da tekrar santrifüjleyin ve atık sıvıyı çıkarın. Tekrar 600 μL PW ekleyin, 30 saniye boyunca 2.000 x g'da santrifüjleyin ve atık sıvıyı çıkarın.
- Adsorpsiyon kolonunu toplama tüpüne yerleştirin ve kalan PW'yi çıkarmak için 2.000 x g'da 2 dakika santrifüjleyin. Daha sonra, adsorpsiyon kolonunu temiz bir mikrosantrifüj tüpüne yerleştirin, 30 dakika kurumasını bekleyin ve adsorpsiyon filminin ortasına 35 μL önceden ısıtılmış ddH2O ekleyin, ardından elde edilen ürünü sonraki testler için -20 °C'de saklayın.
NOT: PW, talimatlara göre susuz etanol ile eklenmelidir. Önceden ısıtılmış su kullanımı verimi artırabilir.
2. İlik hücresi ekstraksiyonu
- 8-9 haftalık, erkek ve yaklaşık 30 g ağırlığındaki KM farelerini seçin. Fareleri baş aşağı bakacak şekilde sol elinize sabitleyin ve sağ elinizi kullanarak bir şırınga ile karnın yanından 150 μL% 1 Pentobarbital sodyum enjekte edin. Anesteziyi ayak parmağınızı sıkıştırarak onaylayın.
- Farelerin servikal çıkığını gerçekleştirin, tibiayı cerrahi makas ve cımbızla çıkarın ve çevredeki fazla kas dokusunu çıkarın. Çıkarılan kaval kemiğini PBS'ye batırın ve yıkayın, geriye sadece temiz kemikler bırakın.
- Kemik iliği hücrelerini tibianın bir ucundan kemik beyaz olana kadar yıkamak için bir şırıngada 1 mL PBS alın.
- Hücre süspansiyonunu toplayın ve 5 dakika boyunca 4 ° C'de 800 x g'da santrifüjleyin. Süpernatanı çıkardıktan sonra, kırmızı kan hücrelerini 500 μL kırmızı hücre lizatı ile parçalayın. 1 dakika sonra, kırmızı hücre lizatını sonlandırmak için 1 mL ayırma tamponu ekleyin. 5 dakika boyunca 4 ° C'de 800 x g'da santrifüjledikten sonra, süpernatanı çıkarın ve hücreleri daha sonra kullanmak üzere buzun üzerine yerleştirin.
NOT: Kırmızı kan hücreleri tamamen parçalanırsa, hücreler çökelir ve hiçbir kırmızı hücre görünmez. Kırmızı hücreler hala görülebiliyorsa, tekrar parçalanabilirler, ancak diğer hücrelere zarar vermemek için kuluçka süresi çok uzun olmamalıdır.
3. Kitosan transfeksiyonu
- Kitosan hazırlığı: 4 mg kitosan tartın ve 20 mL 0.2 mg / mL asetik asit çözeltisi içinde çözün. 10 M NaOH ile pH'ı 5,5'e ayarlayın. Bu çözeltiden 500 μL alın ve ayrı mikrosantrifüj tüplerine ekleyin.
- Tek tek tüplere 2 μg, 3 μg, 4 μg ve 5 μg ABE plazmitleri ekleyin ve bunları 500 μL'lik 30 mMNa2S04'teçözün. 500 μL kitosan çözeltisi ve 500 μL plazmidi karıştırın.
- Onları 50-55 ° C'de bir su banyosunda 15 dakika inkübe edin. İki çözeltiyi iyice karıştırdıktan sonra 15-30 saniye vorteks yapın ve 30 dakika bekletin.
- Kitosan karakterizasyonu: Dinamik ışık saçılımı (DLS) kullanarak Kitosanın çaplarını ve zeta potansiyellerini analiz edin, kitosan konsantrasyonu ddH2O'da 0.1 mg / mL'de tutuldu. Her numuneyi 3x çalıştırın.
- 0.1 mg / mL örnekleri bir silikon çip üzerine dökün. 20 μL yeniden süspanse edilmiş numuneleri 200 gözenekli ızgaralara ekleyin ve oda sıcaklığında 10 dakika inkübe edin. Izgaraları 3 dakika boyunca %2 fosfotungstik asitle boyayın ve kalan sıvıyı filtre kağıdı ile çıkarın. Transmisyon elektron mikroskobu ile gözlemleyin.
- Nanopartikül kapsülleme verimliliği: Çökelmemiş partikülleri gidermek için süpernatanı 0,1 μm'lik bir filtre ile filtreleyin. Plazmidi yükleyin ve konsantrasyonu 260 nm'de bir spektrofotometre ile ölçün. ABE Plazmid ve gRNA plazmidinin hesaplanan verimlilikleri sırasıyla %84 ± %0.37 ve %85 ± %0.53 idi.
- Plazmid ile gömülü 100 μL kitosanı kemik iliği boşluğundan farelere enjekte edin (adım 5). Enjeksiyondan 7 gün sonra, kemik iliği hücrelerini izole edin ve kırmızı kan hücrelerini adım 2'de tarif edildiği gibi parçalayın.
- 6 oyuklu hücre kültürü plakalarına 2 mL serum içeren DMEM ortamı ekleyin ve 500 μL serum içeren DMEM ortamında süspanse edilmiş kemik iliği hücrelerini (yaklaşık 1 x10 6) ekleyin. Floresan yoğunluğunu bir floresan mikroskobu altında ölçün. CaMK II δ-sgRNA plazmidi, 580 nm'de uyarıldığında TagRFP kırmızı floresansına sahiptir (Şekil 2B).
NOT: Serum içeren DMEM ortamı, Tablo 4'te listelenen reaktifler kullanılarak hazırlanır.
4. Akış sitometrisi
- ABE plazmitlerinin farklı dozajlarını hazırlayın: 2 μg, 3 μg, 4 μg ve 5 μg ve adım 3'te tarif edildiği gibi alıcı farelere verin. 7 gün sonra, kemik iliği hücrelerini adım 3'te tarif edildiği gibi farelerden izole edin.
- Kemik iliği hücrelerini toplayın ve 5 dakika boyunca 4 ° C'de 800 x g'da santrifüjleyin. Süpernatanı atın ve kırmızı kan hücrelerini 500 μL kırmızı kan hücresi lizatı ile parçalayın. 1 dakika sonra, 1 mL ayırma tamponu ile reaksiyonu sonlandırın ve bir hücre sayacı ile hücre sayısını sayın.
- 1 x 106 hücreyi yeni bir mikrosantrifüj tüpüne aktarın ve 800 x g ile 4 ° C'de 5 dakika santrifüjleyin. Süpernatanı çıkardıktan sonra, hücreleri 500 μL PBS ile yeniden süspanse edin ve bunları bir akış tüpüne aktarın. Akış sitometrisi ile verimliliği ölçün. Adım 2'de açıklandığı gibi bir akış sitometrisi kontrol grubu hazırlayın.
NOT: Daha düşük FSC sinyallerine sahip ve FSC'ye karşı SSC dağılım grafiğinin (400'den az) sol alt köşesinde bulunan hücre kalıntıları ve ölü hücreler hariç tutulmuştur (Şekil 3). Plazmitler TagRFP kırmızı floresansına sahip olduklarından, sıralanabilirler.
5. Kemik iliği boşluğu enjeksiyonu
- 8 ila 9 haftalık yaşları arasında, yaklaşık 30 g ağırlığında KM erkek fareleri seçin. 150 μL% 1 Pentobarbital sodyumun intraperitoneal enjeksiyonu ile uyuşturun (aşama 2.1). Anestezi derinliğini ayak parmağınızı sıkıştırarak onaylayın.
- Anestezi uygulanmış fareyi ameliyat masasına sırtüstü pozisyonda sabitleyin ve farenin ön uzvunu bantla sabitleyin.
- Farelerin arka tibiasını alkollü bir bezle dezenfekte edin. Enjekte edilecek plazmidi 1 mL'lik bir şırıngaya 26G'lik bir iğne ile doldurun. Hava kabarcıklarını çıkarın ve enjeksiyona hazırlanın.
- Farenin incik kemiğine dokunun ve farenin incik kemiğini parmaklarınızla tutun. Enjeksiyon iğnesinin konumunu, tibial şafta farenin diz eklemindeki tibial platodan nüfuz edecek şekilde belirleyin. Enjeksiyon iğnesini tibiaya paralel olarak döndürün, kemik iliği boşluğuna saplayın ve farelere verilen zararı en aza indirmek için yavaşça (yaklaşık 3 s) enjekte edin.
- Enjeksiyondan sonra, iğneyi yavaşça dışarı çekin (yaklaşık 3 saniye) ve kanamayı durdurmak ve delinme bölgesini dezenfekte etmek için hemen bir alkollü çubuk kullanın.
- Fareleri nazikçe ılık bir ortama (20-26 °C) koyun, farelerin anesteziden iyileşmesini bekleyin ve iyileşmelerini gözlemleyin.
6. Sanger sıralaması
- Enjeksiyondan 7 gün sonra, 2. adımda tarif edildiği gibi fare kemik iliği hücrelerini toplayın ve bir ekstraksiyon kiti kullanarak genomik DNA'yı izole edin. Hücreleri 1 dakika boyunca 2.000 x g'da santrifüjleyerek toplayın. Süpernatanı atın, 200 μL GA çözeltisi ekleyin ve bir girdap karıştırıcı ile titreştirin. 20 μL Proteinaz K ve 200 μL GB ekleyin, karıştırın ve ardından 10 dakika boyunca 70 ° C'lik bir su banyosuna koyun.
- İnkübasyondan sonra, 200 μL susuz etanol ekleyin, 15 saniye çalkalayın ve ardından karıştırılmış sıvıyı destekleyici adsorpsiyon kolonuna koyun. 1 dakika boyunca 2.500 x g'da santrifüjleyin, tüpün altındaki atık sıvıyı atın ve 500 μL GD çözeltisi ekleyin. Atık sıvıyı santrifüjleyin ve atın, peleti 2x PW ile yıkayın ve son olarak 40 μL saf su ile kurutun.
NOT: PW, talimatlara göre susuz etanol ile eklenmelidir. - Hedef gen CaMKIIδ'yi PCR ile ileri primer dizisi gctaaggtgataaatgtggcact ve ctagtgtgcggccagattc'nin ters primer dizisi ile amplifiye edin. 25 μL 2x tampon, 1 μL dNTP Karışımı, 2 μL ileri primer, 2 μL ters primer, 1 μL DNA Polimeraz, 2 μL şablon DNA ve 17 μL ddH2O ekleyerek PCR reaksiyonunu hazırlayın. Aşağıdaki PCR programını çalıştırın: 95 °C 3 dakika, 95 °C 15 saniye, 30 sn için 53,7 °C, 60 sn için 72 °C, ısı koruma için 12 °C.
- PCR'den sonra,% 1'lik bir agaroz jeli hazırlayın ve 35 dakika boyunca 110 V'ta agaroz jel elektroforezi gerçekleştirin (adım 1.5, adım 1.6). Elektroforezden sonra hedef jel alanını kesin ve Sanger dizilimi için gönderin (Şekil 4).
Sonuçlar
İn vitro plazmitler farelere intraosseöz enjeksiyon ile enjekte edildi (Şekil 1A). Nanopartiküllerin ortalama parçacık boyutu yaklaşık 202.9 nm, potansiyel 2.77 mV ve PDI 0.22 idi (Şekil 1B). Şekil 1C , elektron mikroskobu ile küresel olarak gözlemlenen nanopartiküllerin yüzey şeklini göstermektedir. Şekil 1D , ABE vektörünün plazmit haritasını ve gRNA vektörünün plazmit haritasını göstermektedir.
Floresan mikroskobu altında plazmit transdüksiyonu gözlendi. Şekil 2A , normal kemik iliği hücrelerini göstermektedir. Fareye 7 günlük plazmit transferinden sonra, farenin kemik iliği hücreleri bir floresan mikroskobu altında gözlendi. Kontrol grubu ile karşılaştırıldığında, kitosan transfeksiyon grubunun transfeksiyon etkinliği önemli ölçüde iyileştirilmiştir (Şekil 2B). Bu, bir gömme materyali olarak kitosanın in vitro transdüksiyon plazmidinin verimliliğini artırabileceğini gösterir.
Farelere verildikten 7 gün sonra, plazmit tamamen eksprese edildi. Farelerden alınan kemik iliği hücreleri ekstrakte edildi ve kemik iliği hücrelerinin transfeksiyon etkinliği akış sitometrisi ile tespit edildi. Sonuçlar, ABE plazmidi ile doğrudan transfekte edilen hücrelerin transfeksiyon etkinliğinin %0.92 ± %0.02 olduğunu gösterdi. Kitosan ile kaplanmış 2 μg ABE ile transfekte edilen kemik iliği hücrelerinin transfeksiyon etkinliği %40.80 ± %4.31, kitosan ile kaplanmış 3 μg ABE ile transfekte edilen kemik iliği hücrelerinin transfeksiyon etkinliği %47.20 ± %5.37, kitosan ile kaplanmış 4 μg ABE ile transfekte edilen kemik iliği hücrelerinin %51.20 ± %2.02 ve kitosan ile kaplanmış 5 μg ABE ile transfekte edilen kemik iliği hücrelerinin %48.2 ± %7.39 olarak bulunmuştur (Şekil 3B). Kitosan transfeksiyon grubunun etkinliği, kontrol grubununkinden daha yüksekti (Şekil 3A). Akış sitometrisi sonuçları, transdüksiyonlu plazmitin bu yazıda açıklanan yöntem kullanılarak farelerde kararlı ve verimli bir şekilde eksprese edilebileceğini gösterdi. Kapsamlı ekspresyon verimliliği ve malzeme tasarrufu perspektifinden, 3 μg plazmitin tek seferlik transdüksiyon şeması seçilebilir.
Kemik iliği hücrelerinden genomik DNA'yı çıkardık ve hedef geni PCR ile çoğalttık. Sanger dizilemesinden sonra, A1'deki in vivo düzenleme verimliliği %14.27 ± %0.35 ve A2'deki verimlilik %10.69 ± %0.30 idi (Şekil 4).

Şekil 1: Kemik enjeksiyon akış şeması, nanopartikül karakterizasyonu ve plazmit vektör haritası. (A) İntraosseöz enjeksiyon prosedürü. (B) Kitosan ile gömülü ABE plazmitleri tarafından oluşturulan nanopartiküllerin partikül boyutu, Zeta potansiyeli ve PDI'si. (C) Nanopartiküllerin elektron mikroskobik görüntüsü. (D) Sol taraf ABE vektör plazmidinin haritasını, sağ taraf ise gRNA vektör plazmidinin haritasını gösterir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
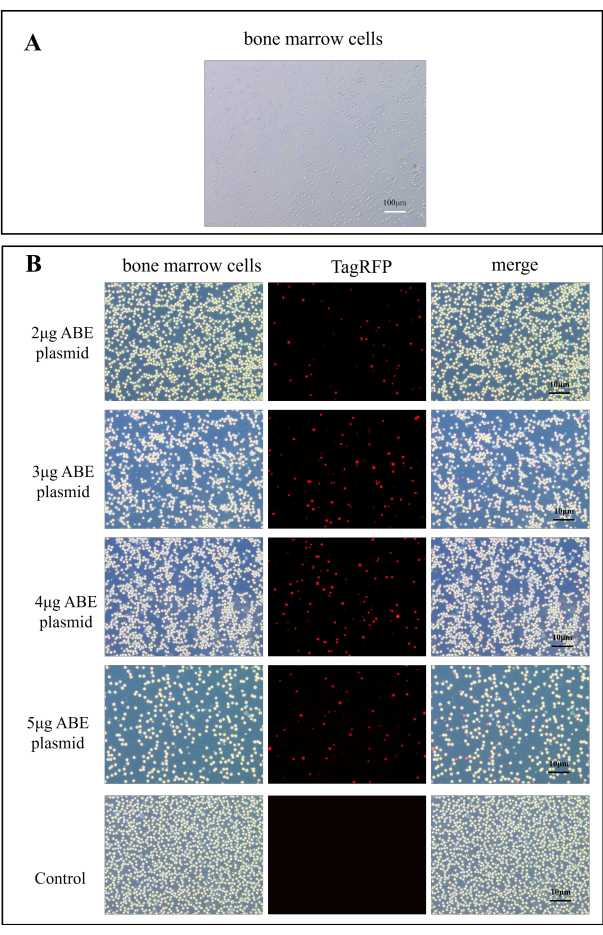
Şekil 2: ABE plazmid transfeksiyon verimliliği için floresan görüntüleri. (A) Kemik iliği hücrelerinin A100x görüntüsü. (B) Kitosan transfeksiyon grubundaki kemik iliği hücrelerinin floresan haritaları, ABE plazmidinin doğrudan enjeksiyonundan sonra kontrol grubundakilere kıyasla 2 μg, 3 μg, 4 μg ve 5 μg ABE plazmitinin transfeksiyonundan 7 gün sonra elde edildi. Bu rakamın daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
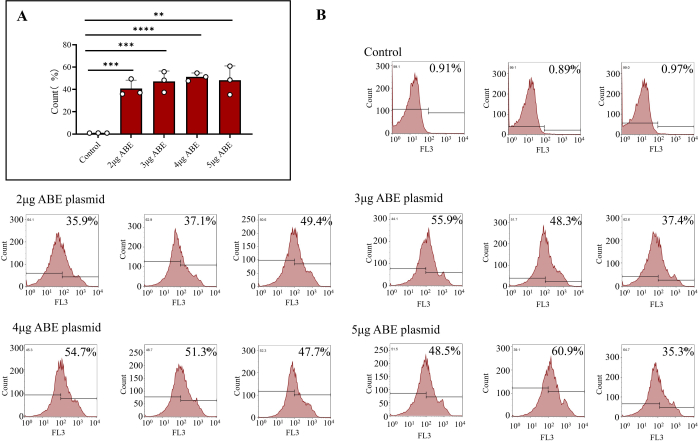
Şekil 3: Transfekte edilmiş kemik iliği hücrelerinin akış sitometrisi sonuçları. (A) 2 μg, 3 μg, 4 μg ve 5 μg ABE plazmitleri (Kitosan transfeksiyon grubu) ile transfekte edilen ve doğrudan enjekte edilen (kontrol grubu) akış sitometrisi ile tedavi edilen kemik iliği hücreleri. Sonuçlar, doğrudan ABE plazmitleri enjekte edilen kemik iliği hücrelerinin transfeksiyon etkinliğinin zayıf olduğunu, diğer dört grubun transfeksiyon etkinliği ve transfeksiyon etkisinin daha yüksek olduğunu gösterdi. (B) Akış sitometrisi sonuçları, kontrol grubunun transfeksiyon verimliliğini ve ABE plazmidinin farklı oranlarını içerir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
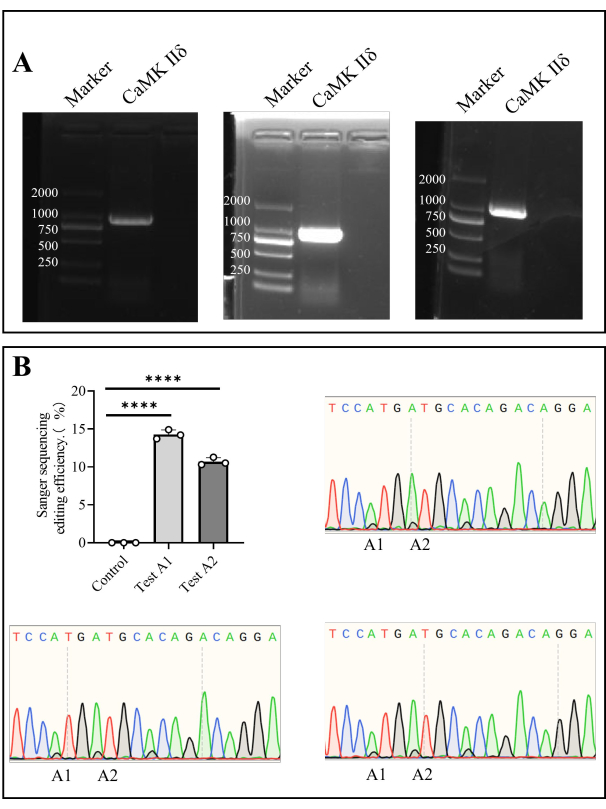
Şekil 4: Camk II'nin Sanger dizilimi farelerde düzenleme verimliliği δ. (A) Camk II'nin agaroz jel elektroforezi tespiti δ. (B) Çubuk grafik, farelerde Camk II δ'nin düzenleme verimliliğinin Sanger sıralama sonucu analizini gösterir ve Sanger sıralama diyagramları sıralama sonuçlarını gösterir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| Reaktif | Kullanılan konsantrasyon |
| Etilendiamintetraasetik asit | 1.142 mL |
| Buzlu asetik asit | 2 mL |
| Tris | 4.84 gr |
Tablo 1: 1X TAE tamponu hazırlamak için reaktifler
| Reaktif | Hacim |
| Ağar | 7.5 gr |
| Amp | Sterilize edildiğinde ve 70 °C'ye soğutulduğunda 500 μL ekleyin |
| ddH2O | 500 μL'ye kadar |
| Sodyum klorür | 5 gr |
| Tripton | 5 gr |
| Maya özü | 2.5 gr |
Tablo 2: LB katı ortamı hazırlamak için reaktifler.
| Reaktif | Hacim |
| ddH2O | 1 L'ye kadar |
| pepton | 10 gr |
| Sodyum klorür | 10 gr |
| Maya özü | 5 gr |
Tablo 3: LB sıvı ortamını hazırlamak için reaktifler.
| Reaktif | Hacim |
| DMEM (Ömer Çiçeğ | 450 mL |
| Fetal sığır serumu | 5 mL |
| MEM | 5 mL |
| Penisilin / Streptomisin | 5 mL |
| β-merkaptoetanol | 500 μL |
Tablo 4: Serum içeren DMEM ortamının hazırlanması için reaktifler.
Tartışmalar
Biyomedikal araştırmalar için, hayvanlara eksojen plazmitlerin verilmesindeki zorluk, istenen terapötik etkiyi elde etmek için hayvanlara verilen zararı en aza indirirken aynı zamanda iletim ve gen ekspresyonunun verimliliğini iyileştirmeyi içerir15,16. Alıcı farelerin kemik iliği hücrelerine kitosan aracılı ABE plazmid iletiminin intraosseöz enjeksiyonu için yeni bir yöntem sunuyoruz. Bu strateji, plazmit dağıtım verimliliğini ve gen ekspresyonunu iyileştirir.
İlk olarak, bu çalışmada, viral olmayan bir vektör sistemi olarak sunulan kitosan, plazmit iletimi için bir yöntem olarak kullanılmıştır. Konvansiyonel yöntemin transfeksiyon etkinliğinin nispeten düşük olduğu gösterildiğinden, uzun süreli gen ekspresyonu için plazmitlerin eklenmesi bağışıklık sisteminden etkilenebilir17,18. Doğal bir polisakkarit olan kitosan, mükemmel biyouyumluluğu, plazmit kapsülleme kabiliyeti ve düşük toksisitesi ile ünlüdür. Kitosanın bir dağıtım aracı olarak kullanılması, eksojen plazmitin uzun süreli ekspresyonu sırasında bağışıklıkla ilgili potansiyel etkilerin önlenmesine yardımcı olurken, aynı zamanda plazmit transfer verimliliğini de arttırır 19,20,21. Gelecekteki araştırmalar için, intraosseöz enjeksiyon ile uygulandığında kitosan nanopartiküllerinin toksisitesini ve potansiyel kemik iliği etkilerini değerlendirmenin önemini kabul ediyoruz. Bu yönleri, kapsamlı toksisite değerlendirmeleri ve histopatolojik analizler yapmak da dahil olmak üzere gelecekteki deneysel tasarımımıza dahil etmeyi planlıyoruz. Bu, farklı zaman noktalarında ve doz seviyelerinde hücre canlılığı, inflamatuar yanıtlar ve kemik iliği morfolojisi gibi çeşitli parametrelerin değerlendirilmesini içerecektir. Ek olarak, kitosan nanopartikülleri ile tedaviyi takiben güvenlik profili ve kemik iliği sağlığı üzerindeki potansiyel etkiler hakkında daha derin bir anlayış kazanmak için gelişmiş görüntüleme teknikleri ve moleküler biyoloji yöntemlerini kullanmayı düşüneceğiz.
İkincisi, ABE, çift sarmallı DNA kırılmaları oluşturmadan adenin nükleotidlerini guanin nükleotidlerine dönüştürebilen bir gen editörü olarak seçilir. CRISPR/Cas9 ile karşılaştırıldığında ABE, çift iplikçik kopmalarına neden olmadan tek bir tabanı doğrudan düzelterek daha yüksek hassasiyet sunar, böylece hedef dışı etkileri ve potansiyel hasarı azaltır. Bununla birlikte, hedef gRNA'yı tasarlarken, spesifik olmayan bağlanmayı önlemek ve hedef dışı etkileri azaltmak için dikkatli bir değerlendirme gereklidir22. Riski azaltmak için önlemler aldık, ancak tamamen kaçınma zorlu olmaya devam ediyor ve daha fazla araştırmaya ihtiyaç duyuyor.
Üçüncüsü, in vivo doğum için bir kemik içi enjeksiyon stratejisi geliştirdik. İntraosseöz enjeksiyon, Betzler ve ark.23 tarafından yapılan sistem incelemesinde bildirildiği gibi güvenli ve etkili bir yöntemdir. Bu çalışmadaki hedef gen, osteoklast farklılaşmasının düzenlenmesinde anahtar rol oynayan Camk II δ'dir 13,14. Konvansiyonel kuyruk ven enjeksiyon yöntemi ile karşılaştırıldığında, intraosseöz enjeksiyon, hedeflenen Camk II δ plazmidini doğrudan ve verimli bir şekilde osteoklastlara iletebilir, böylece alıcı farelerde A1 lokusunda %14.27 ve A2 lokusunda %10.69 gibi yüksek in vivo düzenleme verimliliği elde eder.
Ayrıca unutulmamalıdır ki kemik içi enjeksiyonu özel dikkat gerektiren bir ameliyattır. Bu nedenle, deneyden önce, enjeksiyonun farelerin kemik iliği boşluğuna doğru bir şekilde enjekte edilip edilmediğini izlemek için uygulama olarak mavi boya kullandık. Ek olarak, alıcı farelerin intraosseöz enjeksiyonun neden olduğu hasardan muzdarip olma olasılığı nedeniyle, yaklaşık 30 g ağırlığındaki farelerin seçilmesi önerilir. İntraosseöz enjeksiyon prosedüründe birkaç önemli adımın önemini vurguluyoruz: aşırı miktarda anestezik uygulamaktan kaçının, enfeksiyonu önlemek için enjeksiyondan önce ve sonra tam dezenfeksiyon sağlayın ve kemik iliğinin neden olduğu tıkanmaları önlemek için iğneyi döndürün. Engellenirse, sıvıyı farenin kemik iliği boşluğuna zorlamaktan kaçının, bu potansiyel olarak farenin ölümüne yol açabilir. Plazmit yavaşça enjekte edilmelidir ve yanlış manipülasyon nedeniyle herhangi bir ölüm meydana gelmediğinden emin olmak için enjeksiyondan sonra farelerin durumunu izlemek çok önemlidir. Belirtmemize rağmen, fareler başarılı intraosseöz enjeksiyon için 30 g ağırlığındadır. Klinik ortamlarda, hastaya özgü değişkenlik göz önünde bulundurulmalıdır ve farklı ağırlık aralıkları için enjeksiyon tekniklerinin optimize edilmesi ve alternatif uygulama yöntemlerinin araştırılması gibi gelecekteki çalışmalarımız şu anda devam etmektedir.
Bu yöntem, osteoblastlar, eritroid hücreleri, lenfositler, hematopoietik hücreler vb. dahil olmak üzere kemik iliği kaynaklı hücrelerin düzenlenmesinde yaygın olarak kullanılabilir. Yöntemin yüksek hassasiyeti ve verimliliği, araştırmacıların sadece anormal osteoklast fonksiyonunun neden olduğu hastalıklar için değil, aynı zamanda diğer kan bozuklukları için gen terapisi alanında da kullanmalarına izin verir. Örneğin, yaygın kan hastalıkları da tedavi yöntemlerimizle iyi bir şekilde uyumlu hale getirilebilir. Tek baz mutasyonlarının(24 ) neden olduğu kan hastalıkları, ABE gen editörleri ile tedavi edilebilir ve intraosseöz enjeksiyon, plazmitleri doğrudan hematopoietik kök hücrelere de iletebilir, böylece daha iyi terapötik etkiler elde edilebilir. Bununla birlikte, yöntem, kas ve yağ hücreleri gibi kemik iliği kökenli olmayan hücre tiplerinin düzenlenmesi ve verilmesi süreçleri için uygulamasında sınırlamalar sergilemektedir.
Açıklamalar
Yazarlar hiçbir rekabet çıkarı beyan etmezler.
Teşekkürler
Bu çalışma, Anhui Eyaleti Doğa Bilimleri Vakfı (2208085MC74, 2208085MC51) ve Çin'in Anhui Eyaleti Eğitim Departmanından Bilimsel Araştırma Vakfı (KJ2021A0055) tarafından finanse edilmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 0.2 ml PCR Tubes, Flat cap | LABSELECT | PT-02-C | |
| 1 mL syringe | Anhui Jiangnan medical equipment Co., LTD | / | |
| 1% Pentobarbital sodium | / | / | |
| 1.5 ml Microcentrifuge Tubes | LABSELECT | MCT-001-150 | |
| 10 × DNA Loading Buffer | Vazyme | P022-01 | |
| 10X T4 DNA Ligase Buffer 1 ml | TaKaRa Biotechnology(Dalian)Co.,LTD | 2011A | |
| 1250 μl Pipette Tip 102.1mm | LABSELECT | T-001-1250 | |
| 200 μl Pipette Tips 50.55mm | LABSELECT | T-001-200 | |
| 2x Phanta Max Buffera | Vazyme | P505-d1 | |
| 4 ? centrifuge | Thermo Fisher | 75002425 | |
| 50 ml Centrifuge tube | LABSELECT | T-012-50 | |
| 6-well Cell Culture Plates | LABSELECT | 11110 | |
| Agar | Sangon Biotech | A505255-0250 | |
| Amp | Abiowell | / | |
| Chitosan | Sangon Biotech | A600614-0500 | |
| Constant temperature culture shaker | Shanghai Zhicheng Analytical Instrument Manufacturing Co., LTD | ZWY-200D | |
| Countess Automated Cell Counter | Thermo Fisher Scientific | Countess II/II FL | |
| Countess Cell Counting Chamber Slides and Holder, disposable | Thermo Fisher Scientific | C10228 | |
| CutSmart Buffer | New England Biolabs | B7204SVIAL | |
| DH5α | General Biosystems | CS01010 | |
| DMEM | gibco | C11995500BT | |
| dNTP Mix | Vazyme | P505-d1 | |
| Esp3I enzyme | NEBiolabs | R0734S | |
| Ethylenediaminetetraacetic acid | VETEC (sigma-aldrich) | V900106 | |
| Fetal bovine serum | OriCell | FBSAD-01011-500 | |
| Flow cytometer | BD FACSCalibur | 342975 | |
| Flow tube | Beyotime Biotechnology | FFC005-1bag | |
| Fluorescence microscope | Leica | 427019 | |
| gel maxi purification kit | TIANGEN | DP210 | |
| Genomic DNA extraction kit | TIANGEN | DP304 | |
| Glacial acetic acid | China National Pharmaceutical Group Corporation | 10000218 | |
| GoldBand DL2,000 DNA Marker | YESEN | 10501ES60 | |
| Ice machine | shanghaizhengqiao | BNS-30 | laboratory reserved |
| ImunoSep Buffer | Precision Biomedicals Co.,LTD | 604050 | |
| Megafuge 8 Small Benchtop Centrifuge Series | Thermo Fisher Scientific | 75004250 | |
| MEM | Life Technology | 11140050 | |
| NanoDrop 2000 | Thermo Fisher Scientific, USA | ||
| NaOH | SIGAM | S5881-500G | |
| PBS | XiGene | XG3650 | |
| PCMV-SPRY-ABE8E vector | / | / | |
| pcr amplification apparatus | Thermo Fisher | AKC96300441 | |
| Penicillin/Streptomycin | Solarbio | P1400 | |
| peptone | Sangon Biotech | A505247-0500 | |
| Phanta Max Super-Fidelity DNA Polymerase | Vazyme | P505-d1 | |
| Red cell lysate | Beyotime | C3702 | |
| Sodium chloride | China National Pharmaceutical Group Corporation | 10019318 | |
| Sodium sulfate | aladdin | S433911 | |
| T-001-10 10μl Pipette Tips 31.65mm | LABSELECT | T-001-10 | |
| T4 DNA Ligase | TaKaRa Biotechnology(Dalian)Co.,LTD | 2011A | |
| Tris | BioFroxx | 1115KG001 | |
| tryptone | Sangon Biotech | A505250-0500 | |
| vortex mixer | sigma | Z258423 | |
| Water bath | shanghaiyiheng | DK-80 | |
| YeaRed Nucleic Acid Gel Stain | YESEN | 10203ES76 | |
| Yeast extract | BBI | A610961-0500 | |
| Zetasizer Nano | Malvern Panalytical | Zetasizer Nano ZS | |
| β-mercaptoethanol | Sigma | 444203 |
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır