Method Article
Улучшенная доставка и экспрессия генов с помощью внутрикостного введения наночастиц хитозана, инкапсулированных плазмид редактора адениновых оснований
* Эти авторы внесли равный вклад
В этой статье
Резюме
В этой статье мы представляем подход к генной терапии, который доставляет хитозан с покрытием ABE непосредственно в костный мозг путем внутрикостной инъекции.
Аннотация
Доставка экзогенных плазмид экспериментальным животным имеет решающее значение в биомедицинских исследованиях, включая изучение функций генов, выяснение механизмов заболевания и оценку эффективности лекарств. Тем не менее, эффективность трансфекции данного метода относительно низка, и введение плазмид для долгосрочной экспрессии генов может зависеть от иммунной системы. Чтобы устранить эти ограничения, мы разработали и исследовали новый метод, в котором хитозан используется для инкапсуляции плазмид редактора адениновых оснований (ABE), а затем непосредственно доставляется комплекс в костный мозг мышей путем внутрикостной инъекции. В этом исследовании для нацеливания на ген CaMK II δ , который тесно связан с дифференцировкой остеокластов, мы использовали хитозан для инкапсуляции δ плазмид ABE CaMK II . Мы вводили плазмидный груз непосредственно в полость костного мозга путем внутрикостного введения. Результаты показали высокую эффективность редактирования in vivo в 14,27% в локусе А1 и 10,69% в локусе А2 у мышей-реципиентов. Эта новая стратегия не только особенно подходит для заболеваний, вызванных аномальной функцией остеокластов, но и обладает значительным потенциалом для продвижения в области генной терапии.
Введение
Генная терапия стала перспективным подходом в области биомедицинских исследований 1,2. Он предлагает потенциал для лечения различных заболеваний путем введения чужеродных плазмид экспериментальным животным для модуляции экспрессии определенных генов и изучения их терапевтических эффектов. Однако традиционные методы доставки столкнулись с некоторыми проблемами, которые ограничивают их эффективность и безопасность3. Проблемы включают низкую эффективность трансфекции, высокие биологические повреждения и низкую эффективность экспрессии генов. Таким образом, необходимо разработать новый метод доставки генной терапии, который сможет преодолеть эти ограничения.
Хитозан является природным полисахаридом с хорошей биоразлагаемостью и биосовместимостью 4,5,6, что позволяет легко разлагаться в организме животных, не вызывая серьезной биологической токсичности. Он широко используется для доставки лекарств благодаря высокой скорости внедрения лекарств 7,8, повышенной эффективности доставки и снижению вреда для животных.
Технология редактирования генов ABE, которая позволяет напрямую конвертировать пары оснований A-T в G-C, является многообещающей в генетических и медицинских исследованиях. По сравнению с текущей основной технологией редактирования генов, технология ABE может достичь точной мутации одного основания, тем самым уменьшая редактирование нецелевых последовательностей ДНК, уменьшая побочные эффекты 9,10 и приводя к нулю двухцепочечных разрывов ДНК11, что значительно снижает риск редактирования генов12. Технология ABE также обладает высокой биосовместимостью и больше подходит для исследований в области лечения заболеваний.
Инъекция в хвостовую вену является распространенным методом, используемым для доставки плазмид in vivo, особенно в генной терапии. Целевым геном для данного исследования является CaMK II δ, который тесно связан с дифференцировкой остеокластов13,14. Использование внутрикостного введения вместо хвостовой вены позволяет отредактированной плазмиде вводить остеокласты непосредственно в костный мозг. Эта прямая передача в костный мозг повышает эффективность и стабильность экспрессии генов, что благоприятно для лечения заболеваний, связанных с дисфункцией остеокластов.
В данной статье мы представляем новый метод, который включает в себя инкапсуляцию плазмиды ABE с хитозаном и последующее непосредственное введение комплекса мышам путем внутрикостной инъекции. С помощью этого метода мы надеемся проложить путь к более эффективному лечению чужеродных плазмид, проникающих в организмы, особенно заболеваний, связанных с дисфункцией остеокластов.
протокол
Все описанные эксперименты на животных были одобрены Комитетом по охране здоровья животных Аньхойского университета по использованию и уходу за животными. В этом исследовании ABE был щедро пожертвован профессором Тянь Чи (Шанхайский университет науки и технологии, Шанхай, Китай; Рисунок 1D).
1. Конструкция плазмиды ABE
- Дизайн гРНК с последовательностью TCCATGATGCACAGACAGGA, где PAM представлен GAC.
- Согласно руководству компании по перечню праймеров, добавьте праймер к соответствующему объему ddH2O для достижения концентрации 100 μM. Затем встряхните и тщательно перемешайте, чтобы обеспечить равномерное распределение. Для реакции отжига приготовьте 10 мкМ раствор, добавив 10 мкл исходного раствора грунтовки в новую микроцентрифужную пробирку, 90 мкл ddH2O, и хорошо перемешайте.
- Добавьте 5 μL предварительного праймера, 5 μL нисходящего праймера и 40 μL ddH2O в микроцентрифужную пробирку. Чтобы облегчить реакцию отжига, погрузите трубку в емкость, наполненную кипятком, на 5 минут. Следите за тем, чтобы уровень воды не достигал отверстия трубки, чтобы предотвратить попадание воды и загрязнение грунтовки. Охладите до комнатной температуры, чтобы завершить реакцию отжига.
- Добавьте 2 мкг pLKO5.sgRNA.EFS.tRFP (рис. 1D), 1 мкл ESP3I, 4 мкл буфера и 33 мкл ddH2O в микроцентрифужную пробирку и дайте вступить в реакцию на водяной бане постоянной температуры при 37 °C в течение 45 минут.
- Проведите электрофорез в агарозном геле. Приготовьте 1% агарозный гель, взвесив 0,5 г агарозы и перелейте его в стеклянную бутылку. Добавьте 50 мл 1x TAE буфера в стеклянную бутылку и встряхните, чтобы порошок агарозы растворился. Нагревать в микроволновой печи 2 минуты до полного таяния. Добавьте 5 μL YeaRed Nucleic Acid Gel Stain, тщательно перемешайте и вылейте в форму для геля; После того как гель застынет, приступайте к добавлению образцов.
ПРИМЕЧАНИЕ: Для приготовления 1xTAE используйте реагенты, перечисленные в таблице 1. - Добавьте 1x ТАЭ в емкость для электрофореза и вставьте в него сконфигурированный блок агарозного геля, который следует погрузить в ТАЭ. Добавьте 5 мкл 1x загрузочного буфера в продукт разложения из шага 1.4 и перемешайте. Добавьте образец в гель. Кроме того, добавьте в гель 6 μл маркера.
- Запустите программу электрофореза при постоянном напряжении 110 В в течение 35 минут. После электрофореза определите положение полосы в образце по маркеру и разрежьте гелевую полоску чистым лезвием для восстановления геля.
- Выполните операцию восстановления геля в соответствии с инструкциями набора для очистки геля maxi. Установите водяную баню на 50 °C. Добавьте соответствующий объем раствора PN в пробирку с разрезанным гелем в соответствии с набором. Проткните гель наконечником пипетки, чтобы облегчить растворение, а затем поставьте его на водяную баню. Время от времени встряхивайте тюбик и наблюдайте за процессом растворения до полного растворения гелевого блока.
- Возьмите спиннинговую колонку, CA3, из комплекта. Добавьте 500 мкл раствора BL из набора в спиновую колонку и центрифугируйте ее при давлении 2 000 x g в течение 1 минуты для балансировки колонки. После центрифугирования удалите отработанную жидкость со дна сборной пробирки и поместите адсорбционную колонну обратно в сборную трубку.
- Продолжайте центрифугирование при давлении 2000 x g в течение 1 минуты. Слейте отработанную жидкость на дно пробирки центрифуги, добавьте 600 μл раствора PN и центрифугируйте 2 000 x г в течение 30 с; Снова выбросьте отработанную жидкость. Повторите операцию и снова выбросьте отработанную жидкость.
- После центрифугирования замените пробирку для сбора объемом 2 мл на новую пробирку объемом 1,5 мл. Откройте крышку и дайте высохнуть в проветриваемом месте в течение 30 минут, чтобы полностью удалить этанол. Затем добавьте предварительно нагретые 40 мкл ddH2O, центрифугу и элюируйте необходимую ДНК.
ПРИМЕЧАНИЕ: PN следует добавлять с безводным этанолом в соответствии с инструкцией. Использование предварительно подогретой воды может увеличить урожайность. - Добавьте 7 мкл продукта отжига из стадии 1.3, 3 мкл продукта восстановления геля из стадии 1.11, 1 мкл T4 ДНК-лигазы, 2 мкл 10x T4 лигазного буфера и 7 мкл ddH2O в микроцентрифужную пробирку и выдержите в течение ночи при 16 °C для получения продукта лигирования.
- Добавьте 10 μL продукта лигирования и 70 μL DH5α в микроцентрифужную пробирку на лед на 30 минут. Установите водяную баню на 42 °C. После ледяной ванны поместите трубку в водяную баню на 90 с, а затем снова на лед на 2 мин.
- Добавьте в пробирку 600 μL жидкой среды Luria-Bertani (LB) и встряхивайте на шейкере в течение 30 минут. В то же время облучайте твердую среднюю пластину LB внутри шкафа с ламинарным потоком в течение 30 минут. После инкубации равномерно распределите по тарелке 100 мкл раствора. После нанесения покрытия поместите пластину вверх дном в бактериальный инкубатор с температурой 37 °C для культивирования.
ПРИМЕЧАНИЕ: DH5α обычно хранят при температуре -80 °C. Твердую среду LB готовят с использованием реагентов, перечисленных в таблице 2. Жидкую среду LB готовят с использованием реагентов, перечисленных в таблице 3. - Выберите одну колонию и разверните бактериальную колонию на 14 часов на свежей тарелке. Возьмите центрифужную пробирку объемом 50 мл, добавьте 50 мл жидкой среды, добавьте 50 мл ампициллина в соотношении 1:1000 и хорошо перемешайте. Разделите его на новые пробирки по 15 мл на пробирку.
- Проверьте культурную пластину на наличие круглых белых колоний с хорошим ростом. Выберите их с помощью пипетки объемом 10 мкл и перенесите в среду LB. Культивируйте его в шейкере в течение 12 часов, а затем отправьте этот образец на секвенирование.
- Сравните результаты секвенирования с целевой гРНК, чтобы идентифицировать штамм с соответствующей последовательностью, Camk II δ-sgRNA, в качестве целевого штамма, а затем извлеките плазмиду.
- Проводите экстракцию плазмид в соответствии с инструкцией мини-набора плазмид. Добавьте 500 мкл BL в адсорбционную колонну CP3, центрифугируйте в течение 1 мин при концентрации 2 000 x g и выбросьте отработанную жидкость. Поместите адсорбционную колонну обратно в сборную трубку. Добавьте 500 μл бактериального раствора и центрифугируйте при 4 000 x g в течение 10 минут.
- Соберите поток наружу. Снова центрифугу, а после удаления надосадочной жидкости добавить 250 мкл Р1 в центрифужную пробирку с бактериальным осадком, а затем перенести в микроцентрифужную пробирку и вихрь. Добавьте 250 μL P2 и аккуратно переверните в 6-8 раз. Добавьте 350 μL P3 и снова аккуратно переверните на 6x-8x. Появляется осадок белого флокулянта.
- Центрифуга в течение 10 мин при 2 000 x g. Перенесите надосадочную жидкость в новую адсорбционную колонку CP3, центрифугируйте при давлении 2 000 x g в течение 30 с и удалите отработанную жидкость. Добавьте 600 μл PW, снова центрифугируйте при 2 000 x g в течение 30 с и удалите отработанную жидкость. Снова добавьте 600 μL PW, центрифугируйте при 2 000 x g в течение 30 с и удалите отработанную жидкость.
- Поместите адсорбционную колонну в сборную пробирку и центрифугуйте на 2 минуты при давлении 2 000 x g для удаления остаточного PW. Затем поместите адсорбционную колонну в чистую микроцентрифужную пробирку, дайте ей высохнуть в течение 30 минут и добавьте 35 μL предварительно нагретого ddH2O в середину адсорбционной пленки, затем храните полученный продукт при температуре -20 °C для последующих испытаний.
ПРИМЕЧАНИЕ: PW следует добавлять безводный этанол в соответствии с инструкцией. Использование предварительно подогретой воды может увеличить урожайность.
2. Экстракция клеток костного мозга
- Выберите мышей KM в возрасте 8-9 недель, самцов, весом около 30 г. Зафиксируйте мышей в левой руке головой вниз и введите 150 мкл 1% пентобарбитала натрия со стороны брюшной полости с помощью шприца правой рукой. Подтвердите анестезию путем защемления пальцев ног.
- Выполните шейный вывих мышей, удалите большеберцовую кость хирургическими ножницами и пинцетом, а также удалите окружающие лишние мышечные ткани. Замочите удаленную большеберцовую кость в PBS и промойте, оставив только чистые кости.
- Возьмите 1 мл PBS в шприц для промывания клеток костного мозга с одного конца большеберцовой кости до тех пор, пока кость не станет белой.
- Соберите клеточную суспензию и центрифугируйте при 800 х г при 4 °C в течение 5 минут. После удаления надосадочной жидкости лизируйте эритроциты 500 мкл лизата эритроцитов. Через 1 минуту добавьте 1 мл разделительного буфера, чтобы прекратить образование лизата эритроцитов. После центрифугирования при 800 x g при 4 °C в течение 5 минут удалите надосадочную жидкость и поместите клетки на лед для последующего использования.
ПРИМЕЧАНИЕ: Если эритроциты полностью лизированы, клетки выпадают в осадок, и эритроциты не видны. Если эритроциты все еще видны, их можно лизировать снова, но время инкубации не должно быть слишком большим, чтобы избежать повреждения других клеток.
3. Трансфекция хитозаном
- Препарат хитозана: Смассировать 4 мг хитозана и растворить в 20 мл 0,2 мг/мл раствора уксусной кислоты. Отрегулируйте pH до 5,5 с помощью 10 М NaOH. Возьмите 500 μл этого раствора и добавьте его в отдельные микроцентрифужные пробирки.
- Добавьте 2 мкг, 3 мкг, 4 мкг и 5 мкг плазмид ABE в отдельные пробирки и растворите их в 500 мкл 30 мМ Na2SO4. Смешайте 500 мкл раствора хитозана и 500 мкл плазмиды.
- Выдержите их на водяной бане при температуре 50-55 °C в течение 15 минут. Хорошо перемешав два раствора, перемешайте в течение 15-30 с и дайте постоять 30 минут.
- Определение характеристик хитозана: Проанализируйте диаметры и дзета-потенциалы хитозана с помощью динамического рассеяния света (DLS) с концентрацией хитозана на уровне 0,1 мг/мл в ddH2O. Проведите 3 раза для каждого образца.
- Отлите образцы с концентрацией 0,1 мг/мл на кремниевый чип. Добавьте 20 мкл ресуспендированных образцов в сетки с ячейками 200 меш и инкубируйте при комнатной температуре в течение 10 минут. Смочите сетки 2% фосфовольфрамовой кислотой в течение 3 минут и удалите остатки жидкости фильтровальной бумагой. Наблюдайте с помощью просвечивающего электронного микроскопа.
- Эффективность инкапсуляции наночастиц: Отфильтруйте надосадочную жидкость с помощью фильтра 0,1 мкм, чтобы удалить неосажденные частицы. Загрузите плазмиду и измерьте концентрацию с помощью спектрофотометра на длине волны 260 нм. Расчетная эффективность плазмиды ABE и гРНК-плазмиды составила 84% ± 0,37% и 85% ± 0,53% соответственно.
- Ввести мышам через полость костного мозга 100 мкл хитозана с плазмидой через полость костного мозга (шаг 5). После 7 дней инъекции изолируйте клетки костного мозга и лизируйте эритроциты, как описано в шаге 2.
- Добавьте 2 мл сыворотки, содержащей среду DMEM, в 6-луночные клеточные культуральные планшеты и добавьте клетки костного мозга (примерно 1 x 106), взвешенные в 500 μл сыворотки, содержащей среду DMEM. Измерьте интенсивность флуоресценции под флуоресцентным микроскопом. Плазмида CaMK II δ-sgРНК имеет красную флуоресценцию TagRFP при возбуждении на длине волны 580 нм (рис. 2B).
ПРИМЕЧАНИЕ: Сывороткосодержащую среду DMEM готовят с использованием реагентов, перечисленных в таблице 4.
4. Проточная цитометрия
- Приготовьте плазмиды ABE в различных дозировках: 2 мкг, 3 мкг, 4 мкг и 5 мкг, и подайте их мышам-реципиентам, как описано на шаге 3. Через 7 дней изолируйте клетки костного мозга от мышей, как описано на шаге 3.
- Соберите клетки костного мозга и центрифугируйте при 800 x g при 4 °C в течение 5 минут. Откажитесь от надосадочной жидкости и лизируйте эритроциты 500 мкл лизата эритроцитов. Через 1 мин завершите реакцию 1 мл разделительного буфера и подсчитайте количество клеток с помощью счетчика клеток.
- Перенесите 1 x 106 клеток в новую микроцентрифужную пробирку и центрифугируйте с 800 x g при 4 °C в течение 5 минут. После удаления надосадочной жидкости повторно суспендируйте клетки 500 мкл PBS и перенесите их в проточную трубку. Измерьте эффективность с помощью проточной цитометрии. Подготовьте контрольную группу проточной цитометрии, как описано на шаге 2.
ПРИМЕЧАНИЕ: Обломки и мертвые клетки с нижними сигналами FSC и расположенные в левом нижнем углу диаграммы рассеяния FSC в сравнении с SSC (менее 400), были исключены (рис. 3). Поскольку плазмиды имеют красную флуоресценцию TagRFP, их можно отсортировать.
5. Инъекция в полость костного мозга
- Выберите самцов мышей в возрасте от 8 до 9 недель, весом около 30 г. Обезболите их внутрибрюшинной инъекцией 150 мкл 1% пентобарбитала натрия (шаг 2.1). Подтвердите глубину анестезии щипцом пальца ноги.
- Зафиксируйте мышь под наркозом в лежачем положении на операционном столе и зафиксируйте переднюю конечность мыши скотчем.
- Продезинфицируйте заднюю большеберцовую кость мышей спиртовым тампоном. Наполните вводимую плазмиду в шприц объемом 1 мл с помощью иглы 26G. Удалите пузырьки воздуха и подготовьте к инъекции.
- Коснитесь голени мыши и зажмите голень мышки пальцами. Определите положение иглы для инъекции так, чтобы большеберцовый стержень проникал из плато большеберцовой кости в коленном суставе мыши. Поверните иглу для инъекции параллельно большеберцовой кости, введите в полость костного мозга и вводите медленно (около 3 с), чтобы свести к минимуму повреждение мышей.
- После инъекции медленно вытащите иглу (около 3 с) и сразу же используйте спиртовой тампон, чтобы остановить кровотечение и продезинфицировать место прокола.
- Аккуратно поместите мышей в теплую среду (20-26 °C), подождите, пока мыши оправятся от анестезии, и наблюдайте за их восстановлением.
6. Секвенирование по Сэнгеру
- Через 7 дней после инъекции соберите клетки костного мозга мыши, как описано на шаге 2, и выделите геномную ДНК с помощью набора для экстракции. Соберите клетки путем центрифугирования при давлении 2 000 x g в течение 1 минуты. Выбросьте надосадочную жидкость, добавьте 200 μл раствора ГА и вибрируйте вихревым смесителем. Добавьте 20 μL Proteinase K и 200 μL GB, перемешайте, а затем поместите на водяную баню при температуре 70 °C на 10 минут.
- После инкубации добавьте 200 μл безводного этанола, встряхните в течение 15 с, а затем поместите перемешанную жидкость во вспомогательную адсорбционную колонну. Центрифугируйте при давлении 2 500 x g в течение 1 минуты, выбросьте отработанную жидкость на дно пробирки и добавьте 500 μл раствора GD. Центрифугируйте и выбросьте отработанную жидкость, промойте гранулу 2 раза с PW и, наконец, высушите ее, намочив 40 μл чистой воды.
ПРИМЕЧАНИЕ: PW следует добавлять безводный этанол в соответствии с инструкцией. - Амплифицируйте ген-мишень CaMKIIδ методом ПЦР с помощью прямой последовательности праймера gctaaggtgataaatgtggcact и обратной последовательности праймера ctagtgtgcgggccagattc. Приготовьте ПЦР-реакцию, добавив 25 мкл 2x буфера, 1 мкл смеси dNTP, 2 мкл прямого праймера, 2 мкл обратного праймера, 1 мкл ДНК-полимеразы, 2 мкл матричной ДНК и 17 мкл ddH2O. Запустите следующую программу ПЦР: 95 °C в течение 3 мин, 95 °C в течение 15 с, 53,7 °C в течение 30 с, 72 °C в течение 60 с, 12 °C для сохранения тепла.
- После ПЦР приготовьте 1% агарозный гель и проведите электрофорез в агарозном геле при напряжении 110 В в течение 35 мин (шаг 1,5, шаг 1,6). Разрежьте целевую область геля после электрофореза и отправьте на секвенирование по Сэнгеру (Рисунок 4).
Результаты
Плазмиды in vitro вводили мышам путем внутрикостной инъекции (рис. 1A). Средний размер наночастиц составил около 202,9 нм, потенциал — 2,77 мВ, а PDI — 0,22 (рис. 1B). На рисунке 1C показана форма поверхности наночастиц, наблюдаемая как сферическая с помощью электронной микроскопии. На рисунке 1D показана плазмидная карта вектора ABE и плазмидная карта вектора гРНК.
Трансдукцию плазмиды наблюдали под флуоресцентным микроскопом. На рисунке 2А показаны нормальные клетки костного мозга. Через 7 дней после переноса плазмиды мышам клетки костного мозга мыши наблюдались под флуоресцентным микроскопом. По сравнению с контрольной группой, эффективность трансфекции в группе трансфекции хитозана была значительно улучшена (рис. 2В). Это указывает на то, что хитозан в качестве встраиваемого материала может повысить эффективность трансдукционной плазмиды in vitro.
Через 7 дней после доставки мышам плазмида была полностью экспрессирована. Были экстрагированы клетки костного мозга мышей, а эффективность трансфекции клеток костного мозга была выявлена с помощью проточной цитометрии. Результаты показали, что эффективность трансфекции клеток, непосредственно трансфицированных плазмидой ABE, составила 0,92% ± 0,02%. Эффективность трансфекции клеток костного мозга, трансфицированных 2 мкг АБЭ, покрытых хитозаном, составила 40,80% ± 4,31%, клеток костного мозга, трансфицированных 3 мкг АБЭ, покрытых хитозаном, составила 47,20% ± 5,37%, клеток костного мозга, трансфицированных 4 мкг АБЭ, покрытых хитозаном, составила 51,20% ± 2,02%, а клеток костного мозга, трансфицированных 5 мкг АБЭ, покрытых хитозаном, составила 48,2% ± 7,39% (рис. 3В). Эффективность группы трансфекции хитозана была выше, чем в контрольной группе (рис. 3А). Результаты проточной цитометрии показали, что трансдуцированная плазмида может стабильно и эффективно экспрессироваться у мышей с использованием метода, описанного в данной статье. С точки зрения комплексной эффективности экспрессии и экономии материала можно выбрать схему однократной трансдукции плазмиды 3 мкг.
Мы извлекли геномную ДНК из клеток костного мозга и амплифицировали ген-мишень методом ПЦР. После секвенирования по Сэнгеру эффективность редактирования in vivo в A1 составила 14,27% ± 0,35%, а в A2 — 10,69% ± 0,30% (рис. 4).

Рисунок 1: Схема инъекции костной ткани, характеристика наночастиц и карта плазмидного вектора. (A) Процедура внутрикостной инъекции. (B) Размер частиц, дзета-потенциал и PDI наночастиц, образованных плазмидами ABE, встроенными в хитозан. (C) Электронно-микроскопическое изображение наночастиц. (D) В левой части показана карта векторной плазмиды ABE, а в правой - карта векторной плазмиды гРНК. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
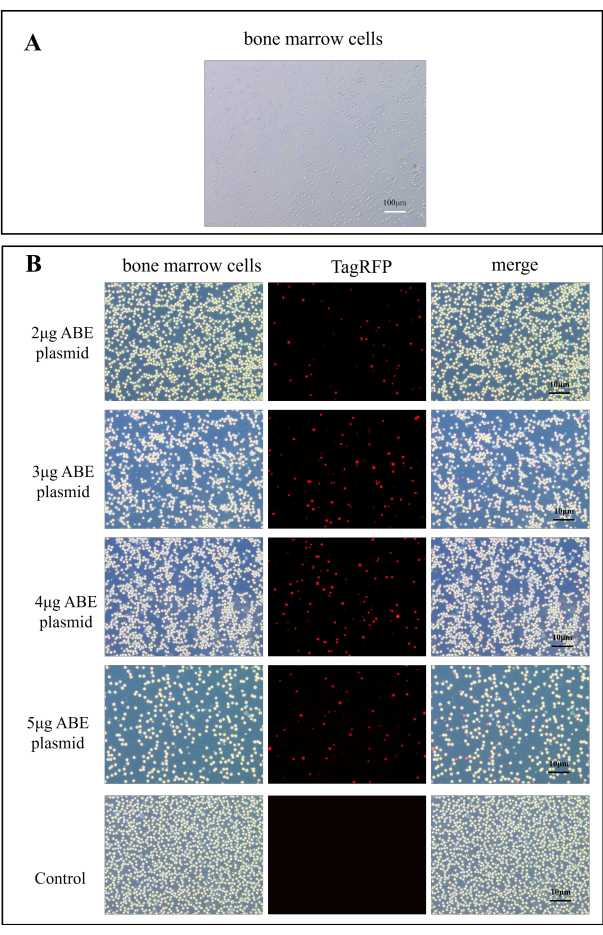
Рисунок 2: Флуоресцентные изображения эффективности трансфекции плазмиды ABE. (A) Изображение клеток костного мозга A100x. (B) Флуоресцентные карты клеток костного мозга в группе трансфекции хитозана были получены через 7 дней после трансфекции 2 мкг, 3 мкг, 4 мкг и 5 мкг плазмиды ABE, по сравнению с таковыми в контрольной группе после прямого введения плазмиды ABE.
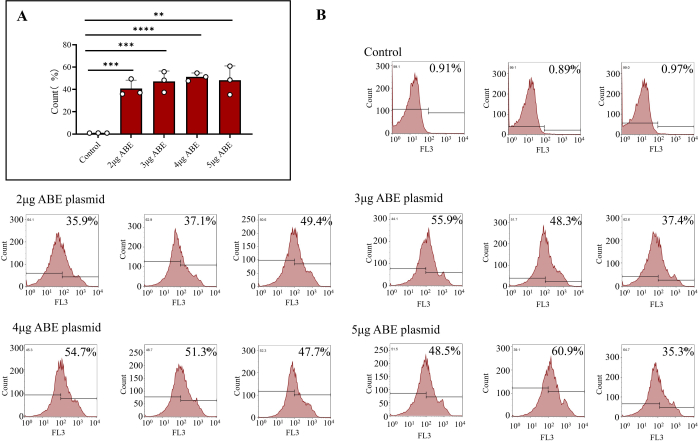
Рисунок 3: Результаты проточной цитометрии трансфицированных клеток костного мозга. (A) С помощью проточной цитометрии клетки костного мозга трансфицировали плазмидами ABE в дозах 2 мкг, 3 мкг, 4 мкг и 5 мкг (группа трансфекции Хитозана) и непосредственно вводили (контрольная группа). Результаты показали, что эффективность трансфекции клеток костного мозга, непосредственно вводимых плазмидами ABE, была низкой, в то время как эффективность трансфекции и трансфекционный эффект других четырех групп были выше. (B) Результаты проточной цитометрии включают эффективность трансфекции контрольной группы и различные соотношения плазмиды ABE. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
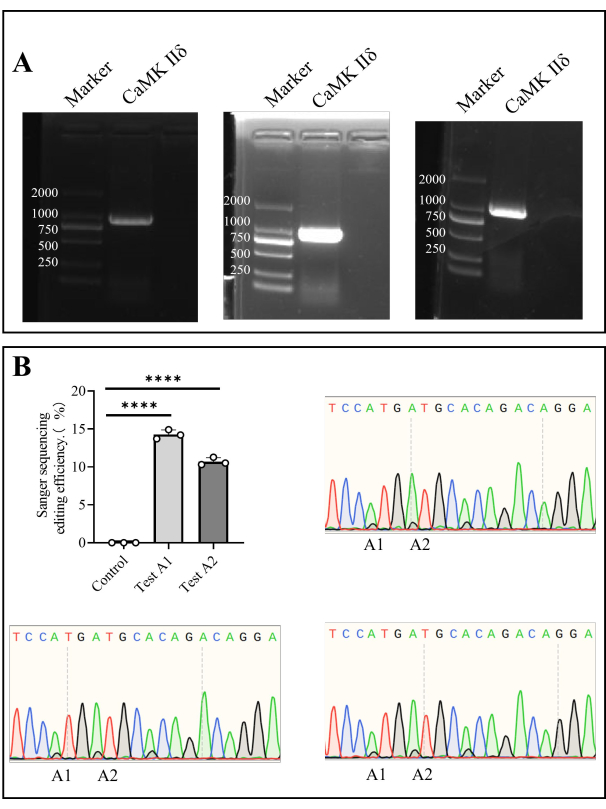
Рисунок 4: Секвенирование по Сэнгеру Camk II δ эффективность редактирования у мышей. (A) Обнаружение электрофореза в агарозном геле Camk II δ. (B) Линейчатая диаграмма показывает анализ результатов секвенирования по Сэнгеру эффективности редактирования Camk II δ у мышей, а диаграммы секвенирования по Сэнгеру показывают результаты секвенирования. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
| Реагентов | Используемая концентрация |
| Этилендиаминтетрауксусная кислота | 1.142 мл |
| Ледяная уксусная кислота | 2 мл |
| Трис | 4,84 г |
Таблица 1: Реагенты для приготовления буфера 1X TAE
| Реагент | Том |
| Агар | 7,5 г |
| Ампер | Добавьте 500 μЛ после стерилизации и охлаждения до 70 °C |
| ддН2О | До 500 μл |
| Хлорид натрия | 5 г |
| триптон | 5 г |
| Дрожжевой экстракт | 2,5 г |
Таблица 2: Реагенты для приготовления твердой среды LB.
| Реагент | Том |
| ддН2О | до 1 л |
| пептон | 10 г |
| Хлорид натрия | 10 г |
| Дрожжевой экстракт | 5 г |
Таблица 3: Реагенты для приготовления жидкой среды LB.
| Реагент | Том |
| DMEM | 450 мл |
| Фетальная бычья сыворотка | 5 мл |
| МЭМ | 5 мл |
| Пенициллин/стрептомицин | 5 мл |
| β-меркаптоэтанол | 500 мкл |
Таблица 4: Реагенты для приготовления сывороткосодержащей среды DMEM.
Обсуждение
В биомедицинских исследованиях задача доставки экзогенных плазмид животным заключается в повышении эффективности доставки и экспрессии генов при одновременной минимизации вреда для животных для достижения желаемого терапевтического эффекта15,16. Мы представляем новый метод внутрикостного введения хитозан-опосредованной доставки плазмиды ABE в клетки костного мозга мышей-реципиентов. Эта стратегия повышает эффективность доставки плазмид и экспрессию генов.
Во-первых, в этом исследовании хитозан, предлагаемый в качестве невирусной векторной системы, был использован в качестве метода доставки плазмид. Поскольку было продемонстрировано, что эффективность трансфекции при использовании традиционного метода относительно низка, иммуннаясистема может влиять на введение плазмид для долгосрочной экспрессии генов. Хитозан, природный полисахарид, известен своей превосходной биосовместимостью, способностью инкапсулировать плазмиды и низкой токсичностью. Использование хитозана в качестве средства доставки помогает предотвратить потенциальные иммунологические эффекты во время длительной экспрессии экзогенной плазмиды, а также повышает эффективность переноса плазмид 19,20,21. Для будущих исследований мы признаем важность оценки токсичности и потенциальных эффектов наночастиц хитозана на костный мозг при введении внутрикостных инъекций. Мы планируем учесть эти аспекты в нашем будущем экспериментальном дизайне, включая проведение всесторонней оценки токсичности и гистопатологического анализа. Это будет включать в себя оценку различных параметров, таких как жизнеспособность клеток, воспалительные реакции и морфология костного мозга в разные моменты времени и уровни дозы. Кроме того, мы рассмотрим возможность использования передовых методов визуализации и методов молекулярной биологии для более глубокого понимания профиля безопасности и потенциального воздействия на здоровье костного мозга после лечения наночастицами хитозана.
Во-вторых, ABE выбран в качестве редактора генов, который может превращать нуклеотиды аденина в нуклеотиды гуанина без введения двухцепочечных разрывов ДНК. По сравнению с CRISPR/Cas9, ABE обеспечивает более высокую точность за счет прямой коррекции одного основания без возникновения двухцепочечных разрывов, тем самым уменьшая побочные эффекты и потенциальные повреждения. Однако при проектировании целевой гРНК требуется тщательное рассмотрение, чтобы предотвратить неспецифическое связывание и уменьшить побочные эффекты22. Мы приняли меры по снижению риска, но полное предотвращение остается сложной задачей и требует дополнительных исследований.
В-третьих, для доставки in vivo мы разработали стратегию внутрикостной инъекции. Внутрикостная инъекция является безопасным и эффективным методом, о чем сообщалось в обзоре системы Betzler et al.23. Целевым геном в данном исследовании является Camk II δ, который играет ключевую роль в регуляции дифференцировки остеокластов13,14. По сравнению с обычным методом инъекции в хвостовую вену, внутрикостная инъекция может доставлять целевую плазмиду Camk II δ непосредственно и эффективно в остеокласты, тем самым достигая высокой эффективности редактирования in vivo в 14,27% в локусе А1 и 10,69% в локусе А2 у мышей-реципиентов.
Более того, следует отметить, что внутрикостное введение является операцией, требующей особого внимания. Так, перед экспериментом мы использовали синий краситель в качестве практики, чтобы следить за правильностью введения инъекции в полость костного мозга мышей. Кроме того, из-за возможности того, что мыши-реципиенты могут пострадать от повреждений, вызванных внутрикостным введением, рекомендуется выбирать мышей весом около 30 г. Мы подчеркиваем важность нескольких ключевых этапов в процедуре внутрикостной инъекции: избегайте введения чрезмерного количества анестетика, обеспечьте тщательную дезинфекцию как до, так и после инъекции, чтобы предотвратить инфицирование, и вращайте иглу, чтобы избежать закупорки, вызванной костным мозгом. При блокировке воздержитесь от введения жидкости в полость костного мозга мыши, что потенциально может привести к смерти мыши. Плазмида должна вводиться медленно, и крайне важно следить за состоянием мышей после инъекции, чтобы гарантировать, что из-за неправильных манипуляций не произойдет смертельных исходов. Хотя мы указали, что мышки весят 30 г для успешного внутрикостного введения. В клинических условиях необходимо учитывать вариабельность, специфичную для конкретного пациента, и наши будущие исследования, такие как оптимизация техник инъекций для различных диапазонов веса и изучение альтернативных методов доставки, в настоящее время продолжаются.
Этот метод может быть широко использован при редактировании клеток, полученных из костного мозга, в том числе остеобластов, эритроидных клеток, лимфоцитов, кроветворных клеток и т.д. Высокая точность и эффективность метода позволяют исследователям использовать его не только при заболеваниях, вызванных аномальной функцией остеокластов, но и в области генной терапии других заболеваний крови. Например, распространенные заболевания крови также могут быть хорошо согласованы с нашими методами лечения. Заболевания крови, вызванные мутациями одного основания24 , можно лечить с помощью редакторов гена ABE, а внутрикостная инъекция также может доставлять плазмиды непосредственно к гемопоэтическим стволовым клеткам, что позволяет достичь лучших терапевтических эффектов. Тем не менее, метод имеет ограничения в его применении для процессов редактирования и доставки типов клеток некостного происхождения, таких как мышечные и жировые клетки.
Раскрытие информации
Авторы заявляют об отсутствии конкурирующих интересов.
Благодарности
Эта работа была профинансирована Фондом естественных наук провинции Аньхой (2208085MC74, 2208085MC51) и Научно-исследовательским фондом Департамента образования провинции Аньхой, Китай (KJ2021A0055).
Материалы
| Name | Company | Catalog Number | Comments |
| 0.2 ml PCR Tubes, Flat cap | LABSELECT | PT-02-C | |
| 1 mL syringe | Anhui Jiangnan medical equipment Co., LTD | / | |
| 1% Pentobarbital sodium | / | / | |
| 1.5 ml Microcentrifuge Tubes | LABSELECT | MCT-001-150 | |
| 10 × DNA Loading Buffer | Vazyme | P022-01 | |
| 10X T4 DNA Ligase Buffer 1 ml | TaKaRa Biotechnology(Dalian)Co.,LTD | 2011A | |
| 1250 μl Pipette Tip 102.1mm | LABSELECT | T-001-1250 | |
| 200 μl Pipette Tips 50.55mm | LABSELECT | T-001-200 | |
| 2x Phanta Max Buffera | Vazyme | P505-d1 | |
| 4 ? centrifuge | Thermo Fisher | 75002425 | |
| 50 ml Centrifuge tube | LABSELECT | T-012-50 | |
| 6-well Cell Culture Plates | LABSELECT | 11110 | |
| Agar | Sangon Biotech | A505255-0250 | |
| Amp | Abiowell | / | |
| Chitosan | Sangon Biotech | A600614-0500 | |
| Constant temperature culture shaker | Shanghai Zhicheng Analytical Instrument Manufacturing Co., LTD | ZWY-200D | |
| Countess Automated Cell Counter | Thermo Fisher Scientific | Countess II/II FL | |
| Countess Cell Counting Chamber Slides and Holder, disposable | Thermo Fisher Scientific | C10228 | |
| CutSmart Buffer | New England Biolabs | B7204SVIAL | |
| DH5α | General Biosystems | CS01010 | |
| DMEM | gibco | C11995500BT | |
| dNTP Mix | Vazyme | P505-d1 | |
| Esp3I enzyme | NEBiolabs | R0734S | |
| Ethylenediaminetetraacetic acid | VETEC (sigma-aldrich) | V900106 | |
| Fetal bovine serum | OriCell | FBSAD-01011-500 | |
| Flow cytometer | BD FACSCalibur | 342975 | |
| Flow tube | Beyotime Biotechnology | FFC005-1bag | |
| Fluorescence microscope | Leica | 427019 | |
| gel maxi purification kit | TIANGEN | DP210 | |
| Genomic DNA extraction kit | TIANGEN | DP304 | |
| Glacial acetic acid | China National Pharmaceutical Group Corporation | 10000218 | |
| GoldBand DL2,000 DNA Marker | YESEN | 10501ES60 | |
| Ice machine | shanghaizhengqiao | BNS-30 | laboratory reserved |
| ImunoSep Buffer | Precision Biomedicals Co.,LTD | 604050 | |
| Megafuge 8 Small Benchtop Centrifuge Series | Thermo Fisher Scientific | 75004250 | |
| MEM | Life Technology | 11140050 | |
| NanoDrop 2000 | Thermo Fisher Scientific, USA | ||
| NaOH | SIGAM | S5881-500G | |
| PBS | XiGene | XG3650 | |
| PCMV-SPRY-ABE8E vector | / | / | |
| pcr amplification apparatus | Thermo Fisher | AKC96300441 | |
| Penicillin/Streptomycin | Solarbio | P1400 | |
| peptone | Sangon Biotech | A505247-0500 | |
| Phanta Max Super-Fidelity DNA Polymerase | Vazyme | P505-d1 | |
| Red cell lysate | Beyotime | C3702 | |
| Sodium chloride | China National Pharmaceutical Group Corporation | 10019318 | |
| Sodium sulfate | aladdin | S433911 | |
| T-001-10 10μl Pipette Tips 31.65mm | LABSELECT | T-001-10 | |
| T4 DNA Ligase | TaKaRa Biotechnology(Dalian)Co.,LTD | 2011A | |
| Tris | BioFroxx | 1115KG001 | |
| tryptone | Sangon Biotech | A505250-0500 | |
| vortex mixer | sigma | Z258423 | |
| Water bath | shanghaiyiheng | DK-80 | |
| YeaRed Nucleic Acid Gel Stain | YESEN | 10203ES76 | |
| Yeast extract | BBI | A610961-0500 | |
| Zetasizer Nano | Malvern Panalytical | Zetasizer Nano ZS | |
| β-mercaptoethanol | Sigma | 444203 |
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены