Method Article
使用骨内注射壳聚糖纳米颗粒包封的腺嘌呤碱基编辑器质粒增强基因递送和表达
摘要
在这里,我们提出了一种基因治疗方法,该方法通过骨内注射将 ABE 包被的壳聚糖直接输送到骨髓。
摘要
将外源质粒递送到实验动物体内在生物医学研究中至关重要,包括基因功能的研究、疾病机制的阐明和药物疗效的评估。但是,目前方法的转染效率相对较低,引入用于长期基因表达的质粒可能会受到免疫系统的影响。为了解决这些限制,我们开发并研究了一种利用壳聚糖包埋腺嘌呤碱基编辑器 (ABE) 质粒,然后通过骨内注射将复合物直接递送到小鼠骨髓的新方法。在这项研究中,为了靶向与破骨细胞分化密切相关的 CaMK II δ 基因,我们利用壳聚糖封装 ABE CaMK II δ 质粒。我们通过骨内注射将质粒货物直接注射到骨髓腔中。结果显示,受体小鼠 A1 位点的 体内 编辑效率高达 14.27%,A2 位点的编辑效率高达 10.69%。这种新策略不仅适用于破骨细胞功能异常引起的疾病,而且在推进基因治疗领域具有巨大潜力。
引言
基因治疗已成为生物医学研究领域的一种有前途的方法 1,2。它通过在实验动物中引入外源质粒来调节特定基因的表达并研究其治疗效果,从而提供了治疗各种疾病的潜力。然而,传统的给药方法遇到了一些问题,限制了其有效性和安全性3。问题包括转染效率低、生物损伤高和基因表达效率低。因此,有必要建立一种可以克服这些限制的新型基因治疗递送方法。
壳聚糖是一种天然多糖,具有良好的生物降解性和生物相容性 4,5,6,使其在动物体内易于降解,而不会引起严重的生物毒性。由于其高药物包埋率 7,8、提高递送效率和减少对动物的伤害,它已被广泛用于药物递送。
ABE 基因编辑技术允许将 A-T 直接碱基对转化为 G-C,在遗传和医学研究中前景广阔。与目前主流的基因编辑技术相比,ABE技术可以实现准确的单碱基突变,从而减少对非靶DNA序列的编辑,减少脱靶效应9,10,并导致DNA双链断裂为零11,大大降低了基因编辑的风险12。ABE 技术还具有高度的生物相容性,更适合用于疾病治疗研究。
尾静脉注射是体内递送质粒的常用方法,尤其是在基因治疗中。本研究的靶基因是 CaMK II δ,它与破骨细胞分化密切相关13,14。使用骨内注射而不是尾静脉允许编辑的质粒直接进入破骨细胞进入骨髓。这种直接传递到骨髓的途径提高了基因表达的效率和稳定性,有利于治疗与破骨细胞功能障碍相关的疾病。
在这里,我们提出了一种新方法,该方法涉及用壳聚糖封装 ABE 质粒,然后通过骨内注射将复合物直接引入小鼠。通过这种方法,我们希望为外来质粒进入生物体,特别是与破骨细胞功能障碍相关的疾病提供更有效的基因治疗铺平道路。
研究方案
所有描述的动物实验均已获得安徽大学动物卫生委员会关于动物使用和护理的批准。在这项研究中,ABE 由天驰教授(上海科技大学,中国上海; 图 1D)。
1. ABE 质粒构建
- 使用序列 TCCATGATGCACAGACAGGA 设计 gRNA,其中 PAM 由 GAC 表示。
- 根据公司的引物列表指南,将引物添加到相应体积的 ddH2O 中,以达到 100 μM 的浓度。然后,充分摇晃和混合以确保均匀分布。对于退火反应,通过将 10 μL 储备引物溶液添加到新的微量离心管中,制备 10 μM 溶液、90 μL ddH2O,并充分混合。
- 在微量离心管中加入 5 μL 上游引物、5 μL 下游引物和 40 μL ddH2O。为了促进退火反应,将试管浸入装满沸水的容器中 5 分钟。确保水位未达到管口,以防止水进入并污染底漆。冷却至室温以完成退火反应。
- 将 2 μg pLKO5.sgRNA.EFS.tRFP(图 1D)、1 μL ESP3I、4 μL 缓冲液和 33 μL ddH2O 加入微量离心管中,并在 37 °C 的恒温水浴中反应 45 分钟。
- 进行琼脂糖凝胶电泳。称取 0.5 g 琼脂糖制备 1% 琼脂糖凝胶,并将其倒入玻璃瓶中。将 50 mL 的 1x TAE 缓冲液加入玻璃瓶中并摇动以溶解琼脂糖粉末。在微波炉中加热 2 分钟,直至完全融化。加入 5 μL YeaRed 核酸凝胶染料,充分混合,倒入凝胶模具中;凝胶凝固后,开始添加样品。
注:要制备 1xTAE,请使用 表 1 中列出的试剂。 - 向电泳槽中加入 1x TAE 并放入配置的琼脂糖凝胶块中,该凝胶块应浸入 TAE 中。向步骤 1.4 中的消化产物中加入 5 μL 1x 上样缓冲液并混合。将样品添加到凝胶中。此外,向凝胶中加入 6 μL 标记物。
- 在 110 V 的恒定电压下运行电泳程序 35 分钟。电泳后,根据标记物确定条带在样品中的位置,并用干净的刀片切割凝胶条以进行凝胶回收。
- 根据 Gel maxi 纯化试剂盒说明进行凝胶回收作。将水浴设置为 50 °C。 根据试剂盒,将相应体积的 PN 溶液添加到含有切割凝胶的试管中。用移液管吸头戳凝胶以促进溶解,然后将其放入水浴中。每隔一段时间摇晃试管并观察溶解过程,直到凝胶块完全溶解。
- 从试剂盒中取出离心柱 CA3。将试剂盒中的 500 μL BL 溶液加入离心柱中,并以 2,000 x g 离心 1 分钟以平衡色谱柱。离心后,除去收集管底部的废液,将吸附柱放回收集管中。
- 继续以 2,000 x g 离心 1 分钟。丢弃离心管底部的废液,加入 600 μL PN 溶液,以 2,000 x g 离心 30 秒;再次丢弃废液。重复该作并再次丢弃废液。
- 离心后,将 2 mL 收集管更换为新的 1.5 mL 管。打开盖子,在通风处晾干 30 分钟,以完全去除乙醇。然后,加入预热的 40 μL ddH2O,离心并洗脱所需的 DNA。
注意:应按照说明加入无水乙醇 PN。使用预热水可以提高产量。 - 将步骤 1.3 中的 7 μL 退火产物、步骤 1.11 中 3 μL 凝胶回收产物、1 μL T4 DNA 连接酶、2 μL 10x T4 连接酶缓冲液和 7 μL ddH2O 加入微量离心管中,并在 16 °C 下放置过夜以获得连接产物。
- 在冰上的微量离心管中加入 10 μL 连接产物和 70 μL DH5α 30 分钟。将水浴设置为 42 °C。 冰浴后,将试管放入水浴中 90 秒,然后再次在冰上 2 分钟。
- 向试管中加入 600 μL Luria-Bertani (LB) 液体培养基,并在摇床上摇动 30 分钟。同时,在层流柜内照射 LB 固体培养基板 30 分钟。孵育后,将 100 μL 溶液均匀分布在板上。包被后,将板倒置在 37 °C 细菌培养箱中进行培养。
注:DH5α 通常储存在 -80 °C 下。LB 固体培养基使用 表 2 中列出的试剂制备。LB 液体培养基使用 表 3 中列出的试剂制备。 - 选择一个菌落并在新板上将细菌菌落扩增 14 小时。取 50 mL 离心管,加入 50 mL LB 液体培养基,以 1:1000 的比例加入 50 μL 氨苄青霉素,并充分混合。将其分装到新管中,每管 15 mL。
- 检查培养板是否有生长良好的圆形白色菌落。用 10 μL 移液器选择这些样品,然后将它们转移到 LB 培养基中。在摇床中培养 12 小时,然后将该样品送去测序。
- 将测序结果与目标 gRNA 进行比较,以鉴定具有匹配序列 Camk II δ-sgRNA 的菌株作为目标菌株,然后提取质粒。
- 根据迷你质粒试剂盒的说明进行质粒提取。向吸附柱 CP3 中加入 500 μL BL,以 2,000 x g 离心 1 分钟,然后弃去废液。将吸附柱放回收集管中。加入 500 μL 细菌溶液,以 4,000 x g 离心 10 分钟。
- 收集流出。再次离心,去除上清液后,将 250 μL P1 加入离心管中,并有细菌沉淀,然后将其转移到微量离心管中并涡旋。加入 250 μL P2 并轻轻倒置 6 倍至 8 倍。加入 350 μL 的 P3,然后再次轻轻倒置 6 次至 8 次。出现白色絮状沉淀。
- 以 2,000 x g 离心 10 分钟。将上清液转移到新的吸附柱 CP3 中,以 2,000 x g 离心 30 秒,然后除去废液。加入 600 μL PW,再次以 2,000 x g 离心 30 秒,然后除去废液。再次加入 600 μL PW,以 2,000 x g 离心 30 秒,并去除废液。
- 将吸附柱放入收集管中,以 2,000 x g 离心 2 分钟以去除残留的 PW。然后,将吸附柱放入干净的微量离心管中,干燥 30 分钟,并在吸附膜中间加入 35 μL 预热的 ddH2O,然后将所得产物储存在 -20 °C 中以供后续测试。
注意:PW 应按照说明加入无水乙醇。使用预热水可以提高产量。
2. 骨髓细胞提取
- 选择 8-9 周龄的雄性 KM 小鼠,体重约 30 克。将小鼠固定在左手,头部朝下,用右手注射器从腹部侧面注射 150 μL 1% 戊巴比妥钠。通过捏脚趾确认麻醉。
- 对小鼠进行颈椎脱位手术,用手术剪刀和镊子去除胫骨,并剥离周围多余的肌肉组织。将去除的胫骨浸泡在 PBS 中并清洗,只留下干净的骨头。
- 在注射器中取 1 mL PBS,从胫骨的一端冲洗骨髓细胞,直到骨头变白。
- 收集细胞悬液并在 4 °C 下以 800 x g 离心 5 分钟。去除上清液后,用 500 μL 红细胞裂解物裂解红细胞。1 分钟后,加入 1 mL 分离缓冲液以终止红细胞裂解物。在 4 °C 下以 800 x g 离心 5 分钟后,除去上清液并将细胞置于冰上以备后用。
注:如果红细胞完全裂解,细胞会沉淀,看不到红细胞。如果仍然可以看到红细胞,可以再次裂解,但孵育时间不宜过长,以免损伤其他细胞。
3. 壳聚糖转染
- 壳聚糖制备:称取 4 mg 壳聚糖,溶于 20 mL 0.2 mg/mL 乙酸溶液中。用 10 M NaOH 将 pH 调节至 5.5。取 500 μL 此溶液,将其添加到单个微量离心管中。
- 将 2 μg、3 μg、4 μg 和 5 μg ABE 质粒添加到单个试管中,并将其溶解在 500 μL 的 30 mM Na2SO4 中。 混合 500 μL 壳聚糖溶液和 500 μL 质粒。
- 将它们在 50-55 °C 的水浴中孵育 15 分钟。将两种溶液充分混合后,涡旋 15-30 秒,静置 30 分钟。
- 壳聚糖表征:使用动态光散射 (DLS) 分析壳聚糖的直径和 zeta 电位,壳聚糖浓度在 ddH2O 中保持在 0.1 mg/mL。每个样品运行 3 次。
- 将 0.1 mg/mL 样品浇注到硅芯片上。将 20 μL 重悬样品添加到 200 目网格中,并在室温下孵育 10 分钟。用 2% 磷钨酸对网格染色 3 分钟,然后用滤纸除去剩余液体。用透射电子显微镜观察。
- 纳米颗粒包封效率:用 0.1 μm 过滤器过滤上清液,以去除未沉淀的颗粒。上传质粒并用分光光度计在 260 nm 处测量浓度。ABE 质粒和 gRNA 质粒的计算效率分别为 84% ± 0.37% 和 85% ± 0.53%。
- 通过骨髓腔将 100 μL 包埋质粒的壳聚糖注射到小鼠中(步骤 5)。注射 7 天后,分离骨髓细胞并按照步骤 2 中的说明裂解红细胞。
- 将 2 mL 含血清的 DMEM 培养基添加到 6 孔细胞培养板中,并加入悬浮在 500 μL 含血清 DMEM 培养基中的骨髓细胞(约 1 x 106)。在荧光显微镜下测量荧光强度。 CaMK II δ-sgRNA 质粒在 580 nm 处激发时具有 TagRFP 红色荧光(图 2B)。
注:含血清的 DMEM 培养基使用 表 4 中列出的试剂制备。
4. 流式细胞术
- 制备不同剂量的 ABE 质粒:2 μg、3 μg、4 μg 和 5 μg,并按照步骤 3 中的说明交付给受体小鼠。7 天后,如步骤 3 所述,从小鼠中分离骨髓细胞。
- 收集骨髓细胞,并在 4 °C 下以 800 x g 离心 5 分钟。弃去上清液,用 500 μL 红细胞裂解物裂解红细胞。1 分钟后,用 1 mL 分离缓冲液终止反应,并用细胞计数器计数细胞数。
- 将 1 x 106 个细胞转移到新的微量离心管中,并在 4 °C 下以 800 x g 离心 5 分钟。去除上清液后,用 500 μL PBS 重悬细胞,并将其转移到流管中。通过流式细胞术测量效率。如步骤 2 中所述准备流式细胞术对照组。
注:具有较低 FSC 信号且位于 FSC 与 SSC 散点图左下角(小于 400)的细胞碎片和死细胞被排除在外(图 3)。因为质粒具有 TagRFP 红色荧光,所以可以将它们分选出来。
5. 骨髓腔注射
- 选择 8 至 9 周龄的 KM 雄性小鼠,体重约 30 克。通过腹膜内注射 150 μL 1% 戊巴比妥钠麻醉它们(步骤 2.1)。通过捏脚趾确认麻醉深度。
- 将麻醉的鼠标固定在手术台上的仰卧位,并用胶带固定鼠标的前肢。
- 用酒精棉签对小鼠的胫骨后部进行消毒。用 26G 针头将要注射的质粒填充到 1mL 注射器中。去除气泡并准备注射。
- 触摸鼠标的小腿,然后用手指按住鼠标的小腿。确定注射针的位置,使胫骨干从小鼠膝关节的胫骨平台穿透。平行于胫骨旋转注射针,刺入骨髓腔,缓慢注射(约 3 s),以尽量减少对小鼠的伤害。
- 注射后,慢慢拔出针头(约 3 s),并立即使用酒精棉签止血并对穿刺部位进行消毒。
- 轻轻地将小鼠置于温暖的环境 (20-26 °C) 中,等待小鼠从麻醉中恢复,并观察其恢复情况。
6. Sanger 测序
- 注射 7 天后,如步骤 2 所述收集小鼠骨髓细胞,并使用提取试剂盒分离基因组 DNA。通过以 2,000 x g 离心 1 分钟来收集细胞。弃去上清液,加入 200 μL GA 溶液,并用涡旋混合器振动。加入 20 μL 蛋白酶 K 和 200 μL GB,混合,然后置于 70 °C 水浴中 10 分钟。
- 孵育后,加入 200 μL 无水乙醇,振荡 15 s,然后将混合液放入支撑吸附柱中。以 2,500 x g 离心 1 分钟,丢弃管底部的废液,加入 500 μL GD 溶液。离心并丢弃废液,用 PW 洗涤沉淀 2 次,最后干燥,用 40 μL 纯水洗脱。
注意:PW 应按照说明加入无水乙醇。 - 用正向引物序列 gctaaggtgataaatgtggcact 和 ctagtgtgcgggccagattc 的反向引物序列,通过 PCR 扩增靶基因 CaMKIIδ 。通过添加 25 μL 2x 缓冲液、1 μL dNTP 混合物、2 μL 正向引物、2 μL 反向引物、1 μL DNA 聚合酶、2 μL 模板 DNA 和 17 μL ddH2O 来制备 PCR 反应。运行以下 PCR 程序:95 °C 3 分钟,95 °C 15 秒, 53.7 °C 持续 30 秒,72 °C 持续 60 秒,12 °C 保温。
- PCR 后,制备 1% 琼脂糖凝胶并在 110 V 下进行琼脂糖凝胶电泳 35 分钟(步骤 1.5、步骤 1.6)。电泳后切开目标凝胶区域并送去进行 Sanger 测序(图 4)。
结果
通过骨内注射将体外质粒注射到小鼠体内 (图 1A)。纳米颗粒的平均粒径约为 202.9 nm,电位为 2.77 mV,PDI 为 0.22(图 1B)。图 1C 显示了通过电子显微镜观察到的球形纳米颗粒的表面形状。图 1D 显示了 ABE 载体的质粒图谱和 gRNA 载体的质粒图谱。
在荧光显微镜下观察质粒转导。 图 2A 显示了正常的骨髓细胞。质粒转移到小鼠体内 7 天后,在荧光显微镜下观察小鼠的骨髓细胞。与对照组相比,壳聚糖转染组的转染效率显著提高 (图 2B)。这表明壳聚糖作为包埋材料可以提高转导质粒 的体外效率。
递送到小鼠体内 7 天后,质粒完全表达。提取小鼠骨髓细胞,流式细胞术检测骨髓细胞的转染效率。结果表明,直接转染 ABE 质粒的细胞转染效率为 0.92% ± 0.02%。转染 2 μg ABE壳聚糖包被的骨髓细胞的转染效率分别为40.80%±4.31%,转染3 μg ABE壳聚糖包被的骨髓细胞的转染效率分别为47.20%±5.37%,转染4 μg ABE壳聚糖包被的骨髓细胞的转染效率分别为51.20%±2.02%,转染5 μg ABE壳聚糖包被的骨髓细胞的转染效率分别为48.2%±7.39%(图3B).壳聚糖转染组的效率高于对照组(图 3A)。流式细胞术结果表明,使用本文描述的方法可以在小鼠中稳定有效地表达转导的质粒。从综合表达效率和材料节省的角度来看,可以选择 3 μg 质粒一次性转导的方案。
我们从骨髓细胞中提取基因组 DNA,并通过 PCR 扩增靶基因。经过 Sanger 测序后,A1 的体内编辑效率为 14.27% ± 0.35%,A2 的 体内 编辑效率为 10.69% ± 0.30%(图 4)。

图 1:骨注射流程图、纳米颗粒表征和质粒载体图。 (A) 骨内注射程序。(B) 由壳聚糖包埋的 ABE 质粒形成的纳米颗粒的粒径、Zeta 电位和 PDI。(C) 纳米颗粒的电子显微镜图像。(D) 左侧显示 ABE 载体质粒的图谱,右侧显示 gRNA 载体质粒的图谱。 请单击此处查看此图的较大版本。
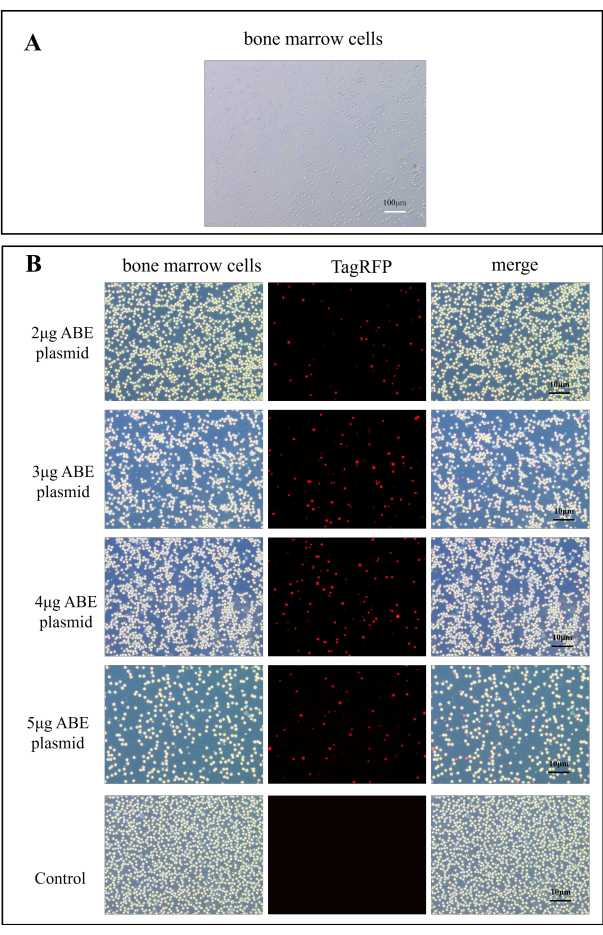
图 2:ABE 质粒转染效率的荧光图像。 (A) 骨髓细胞的 A100x 图像。(B) 壳聚糖转染组在转染 2 μg、3 μg、4 μg 和 5 μg ABE 质粒后 7 天获得骨髓细胞的荧光图,与对照组直接注射 ABE 质粒后相比, 请单击此处查看此图的较大版本。
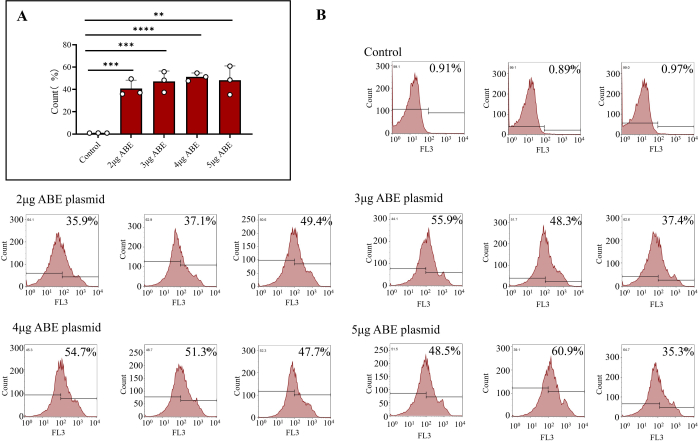
图 3:转染骨髓细胞的流式细胞术结果。 (A) 流式细胞术处理的骨髓细胞,转染 2 μg、3 μg、4 μg 和 5 μg ABE 质粒(壳聚糖转染组)和直接注射(对照组)。结果表明,直接注射 ABE 质粒的骨髓细胞转染效率较差,而其他 4 组的转染效率和转染效果较高。(B) 流式细胞术结果包括对照组的转染效率和不同比例的 ABE 质粒。 请单击此处查看此图的较大版本。
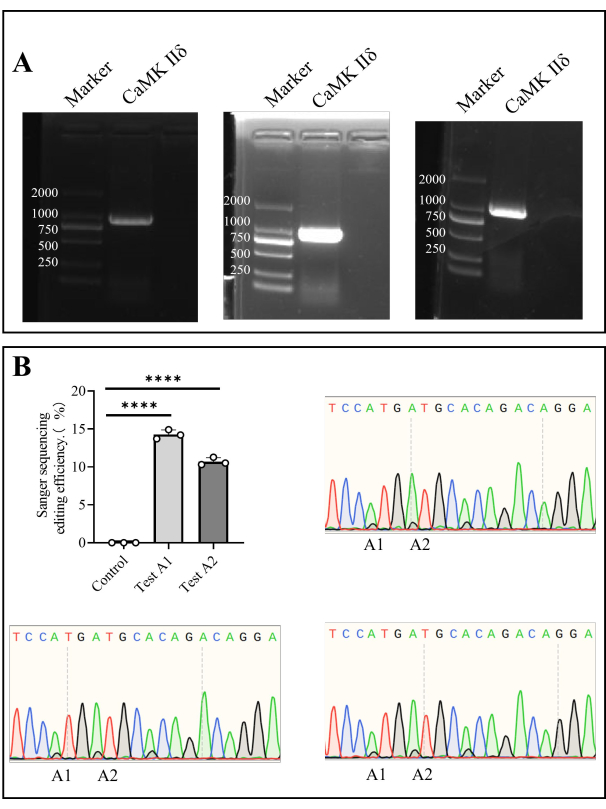
图 4: Camk II 的 Sanger 测序δ小鼠的编辑效率。 (A) Camk II δ 的琼脂糖凝胶电泳检测。(B) 条形图显示了 Camk II δ 在小鼠体内编辑效率的 Sanger 测序结果分析,Sanger 测序图显示了测序结果。 请单击此处查看此图的较大版本。
| 试剂 | 使用的浓度 |
| 乙二胺四乙酸 | 1.142 毫升 |
| 冰醋酸 | 2 毫升 |
| Tris | 4.84 克 |
表 1:用于制备 1X TAE 缓冲液的试剂
| 试剂 | 卷 |
| 琼脂 | 7.5 克 |
| 放大 器 | 灭菌后添加 500 μL 并冷却至 70 °C |
| ddH2O | 至 500 μL |
| 氯化钠 | 5 克 |
| 胰蛋白胨 | 5 克 |
| 酵母提取物 | 2.5 克 |
表 2:用于制备 LB 固体培养基的试剂。
| 试剂 | 卷 |
| ddH2O | 至 1 L |
| 蛋白胨 | 10 克 |
| 氯化钠 | 10 克 |
| 酵母提取物 | 5 克 |
表 3:用于制备 LB 液体培养基的试剂。
| 试剂 | 卷 |
| DMEM 系列 | 450 毫升 |
| 胎牛血清 | 5 毫升 |
| 微机电 | 5 毫升 |
| 青霉素/链霉素 | 5 毫升 |
| β-巯基乙醇 | 500 微升 |
表 4:用于制备含血清 DMEM 培养基的试剂。
讨论
对于生物医学研究,向动物递送外源质粒的挑战包括提高递送和基因表达的效率,同时最大限度地减少对动物的伤害以达到所需的治疗效果15,16。我们提出了一种将壳聚糖介导的 ABE 质粒骨内注射到受体小鼠骨髓细胞中的新方法。该策略提高了质粒递送效率和基因表达。
首先,在这项研究中,壳聚糖作为非病毒载体系统被用作质粒递送的方法。由于已经证明常规方法的转染效率相对较低,因此引入用于长期基因表达的质粒可能会受到免疫系统的影响17,18。壳聚糖是一种天然多糖,以其优异的生物相容性、质粒包封能力和低毒性而闻名。使用壳聚糖作为递送载体有助于防止外源质粒长期表达过程中潜在的免疫相关作用,同时还可以提高质粒转移效率 19,20,21。对于未来的研究,我们认识到评估壳聚糖纳米颗粒在骨内注射时的毒性和潜在骨髓影响的重要性。我们计划将这些方面纳入我们未来的实验设计中,包括进行全面的毒性评估和组织病理学分析。这将涉及评估各种参数,例如不同时间点和剂量水平的细胞活力、炎症反应和骨髓形态。此外,我们将考虑使用先进的成像技术和分子生物学方法,以更深入地了解壳聚糖纳米颗粒治疗后的安全性和对骨髓健康的潜在影响。
其次,ABE 被选为基因编辑器,它可以将腺嘌呤核苷酸转化为鸟嘌呤核苷酸,而不会引入双链 DNA 断裂。与 CRISPR/Cas9 相比,ABE 通过直接校正单个碱基而不诱导双链断裂来提供更高的精度,从而减少脱靶效应和潜在损伤。然而,在设计靶标 gRNA 时,需要仔细考虑以防止非特异性结合并减少脱靶效应22。我们已经实施了降低风险的措施,但完全避免仍然具有挑战性,需要更多的研究。
第三,对于体内递送,我们开发了一种骨内注射策略。骨内注射是一种安全有效的方法,正如 Betzler 等人的系统回顾中报道的那样23。本研究中的靶基因是 Camk II δ,它在破骨细胞分化的调节中起关键作用13,14。与传统的尾静脉注射方法相比,骨内注射可以将靶向 Camk II δ质粒直接高效地递送到破骨细胞中,从而在受体小鼠中实现 A1 位点 14.27% 的高体内编辑效率,而 A2 位点的 10.69% 的体内编辑效率。
此外,应该注意的是,骨内注射是一项需要特别注意的作。因此,在实验之前,我们使用蓝色染料作为练习来监测注射剂是否正确注射到小鼠的骨髓腔中。此外,由于受体小鼠可能会遭受骨内注射造成的损害,因此建议选择体重在 30 g 左右的小鼠。我们强调骨内注射过程中几个关键步骤的重要性:避免使用过量的麻醉剂,确保在注射前后进行彻底消毒以防止感染,并旋转针头以避免骨髓堵塞。如果堵塞,请勿将液体强行进入小鼠的骨髓腔,这可能会导致小鼠死亡。质粒应缓慢注射,注射后监测小鼠的状况至关重要,以确保不会因作不当而造成死亡。尽管我们指定小鼠体重为 30 g 才能成功骨内注射。在临床环境中,必须考虑患者特异性的变异性,我们未来的研究,例如针对不同体重范围优化注射技术和探索替代给药方法,目前正在进行中。
该方法可广泛用于骨髓来源细胞的编辑,包括成骨细胞、红细胞、淋巴细胞、造血细胞等。该方法的高精度和高效性使研究人员不仅可以将其用于破骨细胞功能异常引起的疾病,还可以用于其他血液疾病的基因治疗领域。例如,常见的血液疾病也可以与我们的治疗方法很好地保持一致。单碱基突变24 引起的血液疾病可以用 ABE 基因编辑器治疗,骨内注射也可以将质粒直接递送到造血干细胞,从而达到更好的治疗效果。然而,该方法在应用于非骨髓来源的细胞类型(例如肌肉和脂肪细胞)的编辑和递送过程中表现出局限性。
披露声明
作者声明没有利益冲突。
致谢
这项工作由安徽省自然科学基金 (2208085MC74, 2208085MC51) 和中国安徽省教育厅科学研究基金 (KJ2021A0055) 资助。
材料
| Name | Company | Catalog Number | Comments |
| 0.2 ml PCR Tubes, Flat cap | LABSELECT | PT-02-C | |
| 1 mL syringe | Anhui Jiangnan medical equipment Co., LTD | / | |
| 1% Pentobarbital sodium | / | / | |
| 1.5 ml Microcentrifuge Tubes | LABSELECT | MCT-001-150 | |
| 10 × DNA Loading Buffer | Vazyme | P022-01 | |
| 10X T4 DNA Ligase Buffer 1 ml | TaKaRa Biotechnology(Dalian)Co.,LTD | 2011A | |
| 1250 μl Pipette Tip 102.1mm | LABSELECT | T-001-1250 | |
| 200 μl Pipette Tips 50.55mm | LABSELECT | T-001-200 | |
| 2x Phanta Max Buffera | Vazyme | P505-d1 | |
| 4 ? centrifuge | Thermo Fisher | 75002425 | |
| 50 ml Centrifuge tube | LABSELECT | T-012-50 | |
| 6-well Cell Culture Plates | LABSELECT | 11110 | |
| Agar | Sangon Biotech | A505255-0250 | |
| Amp | Abiowell | / | |
| Chitosan | Sangon Biotech | A600614-0500 | |
| Constant temperature culture shaker | Shanghai Zhicheng Analytical Instrument Manufacturing Co., LTD | ZWY-200D | |
| Countess Automated Cell Counter | Thermo Fisher Scientific | Countess II/II FL | |
| Countess Cell Counting Chamber Slides and Holder, disposable | Thermo Fisher Scientific | C10228 | |
| CutSmart Buffer | New England Biolabs | B7204SVIAL | |
| DH5α | General Biosystems | CS01010 | |
| DMEM | gibco | C11995500BT | |
| dNTP Mix | Vazyme | P505-d1 | |
| Esp3I enzyme | NEBiolabs | R0734S | |
| Ethylenediaminetetraacetic acid | VETEC (sigma-aldrich) | V900106 | |
| Fetal bovine serum | OriCell | FBSAD-01011-500 | |
| Flow cytometer | BD FACSCalibur | 342975 | |
| Flow tube | Beyotime Biotechnology | FFC005-1bag | |
| Fluorescence microscope | Leica | 427019 | |
| gel maxi purification kit | TIANGEN | DP210 | |
| Genomic DNA extraction kit | TIANGEN | DP304 | |
| Glacial acetic acid | China National Pharmaceutical Group Corporation | 10000218 | |
| GoldBand DL2,000 DNA Marker | YESEN | 10501ES60 | |
| Ice machine | shanghaizhengqiao | BNS-30 | laboratory reserved |
| ImunoSep Buffer | Precision Biomedicals Co.,LTD | 604050 | |
| Megafuge 8 Small Benchtop Centrifuge Series | Thermo Fisher Scientific | 75004250 | |
| MEM | Life Technology | 11140050 | |
| NanoDrop 2000 | Thermo Fisher Scientific, USA | ||
| NaOH | SIGAM | S5881-500G | |
| PBS | XiGene | XG3650 | |
| PCMV-SPRY-ABE8E vector | / | / | |
| pcr amplification apparatus | Thermo Fisher | AKC96300441 | |
| Penicillin/Streptomycin | Solarbio | P1400 | |
| peptone | Sangon Biotech | A505247-0500 | |
| Phanta Max Super-Fidelity DNA Polymerase | Vazyme | P505-d1 | |
| Red cell lysate | Beyotime | C3702 | |
| Sodium chloride | China National Pharmaceutical Group Corporation | 10019318 | |
| Sodium sulfate | aladdin | S433911 | |
| T-001-10 10μl Pipette Tips 31.65mm | LABSELECT | T-001-10 | |
| T4 DNA Ligase | TaKaRa Biotechnology(Dalian)Co.,LTD | 2011A | |
| Tris | BioFroxx | 1115KG001 | |
| tryptone | Sangon Biotech | A505250-0500 | |
| vortex mixer | sigma | Z258423 | |
| Water bath | shanghaiyiheng | DK-80 | |
| YeaRed Nucleic Acid Gel Stain | YESEN | 10203ES76 | |
| Yeast extract | BBI | A610961-0500 | |
| Zetasizer Nano | Malvern Panalytical | Zetasizer Nano ZS | |
| β-mercaptoethanol | Sigma | 444203 |
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。