Method Article
تحسين توصيل الجينات والتعبير عنها باستخدام الحقن داخل العظام لجزيئات الشيتوزان النانوية المغلفة بلازميدات محرر قاعدة الأدينين
* These authors contributed equally
In This Article
Summary
هنا ، نقدم نهجا للعلاج الجيني يقوم بتوصيل الشيتوزان المطلي ب ABE مباشرة إلى نخاع العظم عن طريق الحقن داخل العظم.
Abstract
يعد توصيل البلازميدات الخارجية إلى التجارب أمرا بالغ الأهمية في البحوث الطبية الحيوية ، بما في ذلك التحقيق في وظائف الجينات ، وتوضيح آليات المرض ، وتقييم فعالية الدواء. ومع ذلك ، فإن كفاءة التعدي للطريقة الحالية منخفضة نسبيا ، وقد يتأثر إدخال البلازميدات للتعبير الجيني على المدى الطويل بجهاز المناعة. لمعالجة هذه القيود ، قمنا بتطوير وتحقيق طريقة جديدة تستخدم الشيتوزان لتغليف بلازميدات محرر قاعدة الأدينين (ABE) ثم توصيل المركب مباشرة إلى نخاع عظم الفئران عن طريق الحقن داخل العظم. في هذه الدراسة ، لاستهداف جين CaMK II δ ، والذي يرتبط ارتباطا وثيقا بتمايز ناقضات العظم ، استخدمنا الشيتوزان لتغليف بلازميدات ABE CaMK II δ . قمنا بحقن الشحنة البلازميدية مباشرة في تجويف نخاع العظم عن طريق الحقن داخل العظم. أظهرت النتائج كفاءة تحرير عالية في الجسم الحي بنسبة 14.27٪ في موضع A1 و 10.69٪ في موضع A2 في الفئران المتلقية. هذه الاستراتيجية الجديدة ليست مناسبة بشكل خاص للأمراض التي تسببها وظيفة ناقضات العظم غير الطبيعية فحسب ، بل تحمل أيضا إمكانات كبيرة للنهوض بمجال العلاج الجيني.
Introduction
ظهر العلاج الجيني كنهج واعد في مجال البحوث الطبية الحيوية1،2. إنه يوفر القدرة على علاج مجموعة متنوعة من الاضطرابات عن طريق إدخال البلازميدات الأجنبية في التجارب لتعديل التعبير عن جينات معينة ودراسة آثارها العلاجية. ومع ذلك ، فقد واجهت طرق التوصيل التقليدية بعض المشاكل التي تحد من فعاليتهاومأمونها 3. تشمل المخاوف كفاءة تعداء منخفضة ، وضرر بيولوجي مرتفع ، وكفاءة منخفضة للتعبير الجيني. لذلك ، من الضروري إنشاء طريقة توصيل جديدة للعلاج الجيني يمكنها التغلب على هذه القيود.
الشيتوزان هو عديد السكاريد الطبيعي ذو قابلية جيدة للتحلل البيولوجي والتوافق الحيوي4،5،6 ، مما يجعل من السهل التحلل في أجسام دون التسبب في سمية بيولوجية خطيرة. لقد تم استخدامه على نطاق واسع في توصيل الأدوية بسبب ارتفاع معدل تضمين الأدوية 7,8 ، وتعزيز كفاءة التوصيل ، وتقليل الضرر الذي يلحق بالحيوانات.
تعد تقنية تحرير الجينات ABE ، التي تسمح بالتحويل المباشر لأزواج القواعد من A-T إلى G-C ، واعدة في البحوث الجينية والطبية. بالمقارنة مع تقنية تحرير الجينات السائدة الحالية ، يمكن لتقنية ABE تحقيق طفرة أساسية واحدة دقيقة ، وبالتالي تقليل تحرير تسلسل الحمض النووي غير المستهدف ، وتقليل التأثيرات غير المستهدفة9،10 ، ويؤدي إلى صفر كسر مزدوج للحمض النووي11 ، مما يقلل بشكل كبير من خطر تحرير الجينات12. تقنية ABE متوافقة حيويا للغاية وهي أكثر ملاءمة لأبحاث علاج الأمراض.
يعد حقن وريد الذيل طريقة شائعة تستخدم لتوصيل البلازميدات في الجسم الحي ، خاصة في العلاج الجيني. الجين المستهدف لهذه الدراسة هو CaMK II δ ، والذي يرتبط ارتباطا وثيقا بتمايز ناقضات العظم13،14. يسمح استخدام الحقن داخل العظام بدلا من وريد الذيل للبلازميد المعدل بدخول ناقضات العظم مباشرة إلى نخاع العظام. يزيد هذا الانتقال المباشر إلى نخاع العظام من كفاءة واستقرار التعبير الجيني ، وهو أمر مفيد لعلاج الأمراض المتعلقة بخلل ناقضات العظم.
نقدم هنا طريقة جديدة تتضمن تغليف بلازميد ABE بالشيتوزان ثم إدخال المركب مباشرة في الفئران عن طريق الحقن داخل العظم. من خلال هذه الطريقة ، نأمل في تمهيد الطريق لعلاجات أكثر فعالية للعلاج الجيني للبلازميدات الأجنبية التي تدخل الكائنات الحية ، وخاصة الأمراض المتعلقة بخلل ناقضات العظم.
Protocol
تمت الموافقة على جميع التجارب على الموصوفة من قبل لجنة صحة بجامعة آنهوي حول استخدام ورعايتها. في هذه الدراسة ، تم التبرع ب ABE بسخاء من قبل البروفيسور تيان تشي (جامعة شنغهاي للعلوم والتكنولوجيا ، شنغهاي ، الصين. الشكل 1 د).
1. بناء البلازميد ABE
- صمم gRNA بالتسلسل TCCATGATGCACAGACAGGA حيث يتم تقديم PAM بواسطة GAC.
- وفقا لدليل قائمة التمهيدي الخاص بالشركة ، أضف التمهيدي إلى الحجم المقابل ddH2O لتحقيق تركيز 100 ميكرومتر. ثم رجها واخلطيها جيدا لضمان التوزيع المتساوي. بالنسبة لتفاعل التلدين ، قم بإعداد محلول 10 ميكرومتر عن طريق إضافة 10 ميكرولتر من محلول التمهيدي للمخزون إلى أنبوب الطرد المركزي الدقيق الجديد ، 90 ميكرولتر من ddH2O ، واخلطه جيدا.
- أضف 5 ميكرولتر من التمهيدي المنبع ، و 5 ميكرولتر من التمهيدي المصب ، و 40 ميكرولتر من ddH2O في أنبوب طرد مركزي دقيق. لتسهيل تفاعل التلدين ، اغمر الأنبوب في وعاء مملوء بالماء المغلي لمدة 5 دقائق. تأكد من أن مستوى الماء لا يصل إلى فتحة الأنبوب لمنع الماء من الدخول وتلويث البادئات. تبرد إلى درجة حرارة الغرفة لإكمال تفاعل التلدين.
- أضف 2 ميكروغرام pLKO5.sgRNA.EFS.tRFP (الشكل 1D) ، و 1 ميكرولتر من ESP3I ، و 4 ميكرولتر من المخزن المؤقت ، و 33 ميكرولتر من ddH2O في أنبوب الطرد المركزي الدقيق واتركه يتفاعل في حمام مائي بدرجة حرارة ثابتة عند 37 درجة مئوية لمدة 45 دقيقة.
- أداء الرحلان الكهربائي لهلام الاغاروز. قم بإعداد جل الاغاروز 1٪ بوزن 0.5 جرام من الاغاروز واسكبه في زجاجة زجاجية. أضف 50 مل من 1x TAE المؤقت في الزجاجة ورجها لإذابة مسحوق الاغاروز. سخنيها في فرن الميكروويف لمدة 2 دقيقة حتى تذوب تماما. أضف 5 ميكرولتر من YeaRed Nucleic Acid Gel Stain ، واخلطها جيدا ، واسكبها في قالب الجل ؛ بعد أن يصلب الجل ، ابدأ في إضافة العينات.
ملاحظة: لتحضير 1xTAE ، استخدم الكواشف المدرجة في الجدول 1. - أضف 1x TAE إلى خزان الرحلان الكهربائي وضع في كتلة هلام الاغاروز المكونة ، والتي يجب غمرها في TAE. أضف 5 ميكرولتر من 1x المخزن المؤقت للتحميل إلى منتج الهضم من الخطوة 1.4 واخلطه. أضف العينة إلى الجل. بالإضافة إلى ذلك ، أضف 6 ميكرولتر من العلامة إلى الجل أيضا.
- قم بتشغيل برنامج الرحلان الكهربائي بجهد ثابت يبلغ 110 فولت لمدة 35 دقيقة. بعد الرحلان الكهربائي ، حدد موضع الشريط في العينة وفقا للعلامة وقم بقص شريط الجل بشفرة نظيفة لاستعادة الجل.
- قم بإجراء عملية استعادة الجل وفقا لتعليمات مجموعة تنقية الجل ماكسي. اضبط الحمام المائي على 50 درجة مئوية. أضف الحجم المقابل لمحلول PN إلى الأنبوب الذي يحتوي على الجل المقطوع حسب المجموعة. كزة الجل بطرف ماصة لتسهيل الذوبان ثم ضعه في الحمام المائي. رج الأنبوب من حين لآخر وراقب عملية الذوبان حتى يذوب كتلة الجل تماما.
- خذ عمود دوران ، CA3 ، من المجموعة. أضف 500 ميكرولتر من محلول BL من المجموعة إلى عمود الدوران وقم بطرده عند 2,000 × جم لمدة دقيقة واحدة لموازنة العمود. بعد الطرد المركزي ، قم بإزالة سائل النفايات الموجود في الجزء السفلي من أنبوب التجميع وأعد عمود الامتزاز إلى أنبوب التجميع.
- استمر في الطرد المركزي عند 2,000 × جم لمدة 1 دقيقة. تخلص من سائل النفايات في قاع أنبوب الطرد المركزي ، وأضف 600 ميكرولتر من محلول PN ، وجهاز الطرد المركزي 2,000 × غرام لمدة 30 ثانية ؛ تخلص من سائل النفايات مرة أخرى. كرر العملية وتخلص مرة أخرى من سائل النفايات.
- بعد الطرد المركزي ، استبدل أنبوب التجميع سعة 2 مل بأنبوب جديد سعة 1.5 مل. افتح الغطاء واتركه يجف في مكان جيد التهوية لمدة 30 دقيقة لإزالة الإيثانول تماما. ثم أضف 40 ميكرولتر مسخنا مسبقا من ddH2O ، وجهاز الطرد المركزي ، وقم بإزالة الحمض النووي المطلوب.
ملاحظة: يجب إضافة PN مع الإيثانول اللامائي وفقا للتعليمات. يمكن أن يؤدي استخدام الماء المسخن مسبقا إلى زيادة المحصول. - أضف 7 ميكرولتر من منتج التلدين من الخطوة 1.3 ، و 3 ميكرولتر من منتج استعادة الهلام من الخطوة 1.11 ، و 1 ميكرولتر من T4 DNA Ligase ، و 2 ميكرولتر من 10x T4 Ligase Buffer ، و 7 ميكرولتر من ddH2O في أنبوب الطرد المركزي الدقيق ، واحتفظ به طوال الليل عند 16 درجة مئوية للحصول على منتج الربط.
- أضف 10 ميكرولتر من منتج الربط و 70 ميكرولتر من DH5α في أنبوب طرد مركزي دقيق على الجليد لمدة 30 دقيقة. اضبط الحمام المائي على 42 درجة مئوية. بعد الحمام الجليدي ، ضع الأنبوب في الحمام المائي لمدة 90 ثانية ثم مرة أخرى على الجليد لمدة دقيقتين.
- أضف 600 ميكرولتر من الوسط السائل لوريا بيرتاني (LB) إلى الأنبوب ورجه على شاكر لمدة 30 دقيقة. في الوقت نفسه ، قم بإشعاع صفيحة متوسطة صلبة LB داخل خزانة تدفق رقائقي لمدة 30 دقيقة. بعد الحضانة ، قم بتوزيع 100 ميكرولتر من المحلول بالتساوي على اللوحة. بعد الطلاء ، ضع اللوحة رأسا على عقب في حاضنة بكتيرية 37 درجة مئوية للثقافة.
ملاحظة: عادة ما يتم تخزين DH5α عند -80 درجة مئوية ، ويتم تحضير الوسط الصلب LB باستخدام الكواشف المدرجة في الجدول 2. يتم تحضير الوسط السائل LB باستخدام الكواشف المدرجة في الجدول 3. - حدد مستعمرة واحدة وقم بتوسيع المستعمرة البكتيرية لمدة 14 ساعة على طبق جديد. خذ أنبوب طرد مركزي سعة 50 مل ، وأضف 50 مل من الوسط السائل LB ، وأضف 50 ميكرولتر من الأمبيسلين بنسبة 1: 1000 ، واخلط جيدا. قسم هذا إلى أنابيب جديدة بمعدل 15 مل لكل أنبوب.
- تحقق من لوحة الثقافة بحثا عن مستعمرات بيضاء مستديرة ذات نمو جيد. حددها باستخدام ماصة سعة 10 ميكرولتر وانقلها إلى وسط LB. ثقافة هذا في شاكر لمدة 12 ساعة ثم أرسل هذه العينة للتسلسل.
- قارن نتائج التسلسل مع gRNA المستهدف لتحديد السلالة بالتسلسل المطابق ، Camk II δ-sgRNA ، كسلالة مستهدفة ، ثم استخرج البلازميد.
- قم بإجراء استخراج البلازميد وفقا لتعليمات مجموعة البلازميد المصغرة. أضف 500 ميكرولتر من BL إلى عمود الامتزاز CP3 ، وجهاز الطرد المركزي لمدة دقيقة واحدة عند 2,000 × جم ، وتخلص من سائل النفايات. ضع عمود الامتزاز مرة أخرى في أنبوب التجميع. أضف 500 ميكرولتر من المحلول البكتيري وأجهزة الطرد المركزي عند 4,000 × جم لمدة 10 دقائق.
- اجمع التدفق من خلال. جهاز الطرد المركزي مرة أخرى ، وبعد إزالة المادة الطافية ، أضف 250 ميكرولتر من P1 إلى أنبوب الطرد المركزي مع ترسيب بكتيري ثم انقله إلى أنبوب الطرد المركزي الدقيق والدوامة. أضف 250 ميكرولتر من P2 واقلبها برفق لمدة 6x-8x. أضف 350 ميكرولتر من P3 واقلبها برفق مرة أخرى لمدة 6x-8x. يظهر الراسب الندفي الأبيض.
- جهاز طرد مركزي لمدة 10 دقائق عند 2,000 × جم. انقل المادة الطافية إلى عمود امتصاص جديد CP3 ، وجهاز طرد مركزي عند 2,000 × جم لمدة 30 ثانية ، وقم بإزالة سائل النفايات. أضف 600 ميكرولتر من PW ، وجهاز الطرد المركزي مرة أخرى عند 2,000 × جم لمدة 30 ثانية ، وقم بإزالة سائل النفايات. أضف 600 ميكرولتر من PW مرة أخرى ، وجهاز الطرد المركزي عند 2,000 × جم لمدة 30 ثانية ، وقم بإزالة سائل النفايات.
- ضع عمود الامتزاز في أنبوب التجميع وجهاز الطرد المركزي لمدة دقيقتين عند 2,000 × جم لإزالة PW المتبقي. بعد ذلك ، ضع عمود الامتزاز في أنبوب نظيف للطرد المركزي الدقيق ، واتركه يجف لمدة 30 دقيقة ، وأضف 35 ميكرولتر من ddH2O المسخن مسبقا إلى منتصف فيلم الامتزاز ، ثم قم بتخزين المنتج الناتج في -20 درجة مئوية للاختبارات اللاحقة.
ملاحظة: يجب إضافة PW مع الإيثانول اللامائي وفقا للتعليمات. يمكن أن يؤدي استخدام الماء المسخن مسبقا إلى زيادة المحصول.
2. استخراج خلايا النخاع
- اختر الفئران KM التي تتراوح أعمارها بين 8-9 أسابيع ، ذكور ، ووزنها حوالي 30 جراما. ثبت الفئران في اليد اليسرى بحيث يكون الرأس متجها لأسفل وحقن 150 ميكرولتر من 1٪ بنتوباربيتال الصوديوم من جانب البطن بحقنة باستخدام اليد اليمنى. تأكد من التخدير عن طريق قرصة إصبع القدم.
- قم بإجراء خلع عنق الرحم للفئران ، وإزالة الظنبوب بالمقص الجراحي والملاقط ، وإزالة الأنسجة العضلية الزائدة المحيطة. انقع الساق التي تمت إزالتها في PBS واغسلها ، مع ترك العظام النظيفة فقط.
- خذ 1 مل من PBS في حقنة لطرد خلايا نخاع العظم من أحد طرفي الساق حتى يصبح العظم أبيض.
- اجمع تعليق الخلية وأجهزة الطرد المركزي عند 800 × جم عند 4 درجات مئوية لمدة 5 دقائق. بعد إزالة المادة الطافية ، قم بتحلل خلايا الدم الحمراء ب 500 ميكرولتر من محللة الخلايا الحمراء. بعد 1 دقيقة ، أضف 1 مل من المخزن المؤقت للفصل لإنهاء محللة الخلايا الحمراء. بعد الطرد المركزي عند 800 × جم عند 4 درجات مئوية لمدة 5 دقائق ، قم بإزالة المادة الطافية وضع الخلايا على الجليد لاستخدامها لاحقا.
ملاحظة: إذا تم تحلل خلايا الدم الحمراء تماما ، فإن الخلايا تترسب ولا تظهر خلايا حمراء. إذا كان لا يزال من الممكن رؤية الخلايا الحمراء ، فيمكن تحللها مرة أخرى ، ولكن يجب ألا يكون وقت الحضانة طويلا جدا لتجنب تلف الخلايا الأخرى.
3. تعداء الشيتوزان
- تحضير الشيتوزان: يزن 4 ملغ من الشيتوزان ويذوب في 20 مل من محلول حمض الأسيتيك 0.2 مجم / مل. اضبط الرقم الهيدروجيني إلى 5.5 مع 10 M هيدروكسيد الصوديوم. خذ 500 ميكرولتر من هذا المحلول وأضفه إلى أنابيب الطرد المركزي الدقيقة الفردية.
- أضف 2 ميكروغرام و 3 ميكروغرام و 4 ميكروغرام و 5 ميكروغرام من بلازميدات ABE إلى الأنابيب الفردية وقم بإذابتها في 500 ميكرولتر من 30 ملي مولار Na2SO4. امزج 500 ميكرولتر من محلول الشيتوزان و 500 ميكرولتر من البلازميد.
- احتضنها في حمام مائي عند 50-55 درجة مئوية لمدة 15 دقيقة. بعد خلط المحاللين جيدا ، قم بالدوامة لمدة 15-30 ثانية واتركها لمدة 30 دقيقة.
- توصيف الشيتوزان: قم بتحليل أقطار وإمكانيات زيتا للشيتوزان باستخدام تشتت الضوء الديناميكي (DLS) ، مع الحفاظ على تركيز الشيتوزان عند 0.1 مجم / مل في ddH2O. قم بتشغيل كل عينة 3x.
- صب عينات 0.1 مجم / مل على شريحة سيليكون. أضف 20 ميكرولتر من العينات المعلقة إلى شبكات 200 شبكة واحتضانها في درجة حرارة الغرفة لمدة 10 دقائق. قم بتلطيخ الشبكات بحمض الفوسفوتونغستيك بنسبة 2٪ لمدة 3 دقائق وقم بإزالة السائل المتبقي بورق الترشيح. راقب بالمجهر الإلكتروني الإرسال.
- كفاءة تغليف الجسيمات النانوية: قم بتصفية المادة الطافية بمرشح 0.1 ميكرومتر لإزالة الجسيمات غير المترسبة. قم بتحميل البلازميد وقياس التركيز باستخدام مقياس الطيف الضوئي عند 260 نانومتر. كانت الكفاءات المحسوبة لبلازميد ABE و gRNA 84٪ ± 0.37٪ و 85٪ ± 0.53٪ على التوالي.
- حقن 100 ميكرولتر من الشيتوزان المدمج في البلازميد في الفئران من خلال تجويف نخاع العظم (الخطوة 5). بعد 7 أيام من الحقن ، قم بعزل خلايا نخاع العظم وتحلل خلايا الدم الحمراء كما هو موضح في الخطوة 2.
- أضف 2 مل من وسط DMEM المحتوي على المصل إلى ألواح زراعة الخلايا المكونة من 6 آبار وأضف خلايا نخاع العظم (حوالي 1 × 106) معلقة في 500 ميكرولتر من وسط DMEM المحتوي على المصل. قم بقياس شدة التألق تحت المجهر الفلوري. يحتوي بلازميد CaMK II δ-sgRNA على مضان أحمر TagRFP عند الإثارة عند 580 نانومتر (الشكل 2 ب).
ملاحظة: يتم تحضير وسط DMEM المحتوي على المصل باستخدام الكواشف المدرجة في الجدول 4.
4. قياس التدفق الخلوي
- قم بإعداد جرعات مختلفة من بلازميدات ABE: 2 ميكروغرام ، 3 ميكروغرام ، 4 ميكروغرام ، و 5 ميكروغرام ، وتسليمها إلى الفئران المتلقية كما هو موضح في الخطوة 3. بعد 7 أيام ، اعزل خلايا نخاع العظم عن الفئران كما هو موضح في الخطوة 3.
- اجمع خلايا نخاع العظم وأجهزة الطرد المركزي عند 800 × جم عند 4 درجات مئوية لمدة 5 دقائق. تخلص من المادة الطافية وتحلل خلايا الدم الحمراء مع 500 ميكرولتر من محللة خلايا الدم الحمراء. بعد 1 دقيقة ، قم بإنهاء التفاعل ب 1 مل من المخزن المؤقت للفصل واحسب عدد الخلايا بعداد الخلايا.
- انقل 1 × 106 خلايا إلى أنبوب طرد مركزي دقيق جديد وجهاز طرد مركزي ب 800 × جم عند 4 درجات مئوية لمدة 5 دقائق. بعد إزالة المادة الطافية ، أعد تعليق الخلايا ب 500 ميكرولتر من PBS وانقلها إلى أنبوب تدفق. قياس الكفاءة عن طريق قياس التدفق الخلوي. قم بإعداد مجموعة تحكم قياس التدفق الخلوي كما هو موضح في الخطوة 2.
ملاحظة: تم استبعاد حطام الخلية والخلايا الميتة ذات إشارات FSC السفلية والموجودة في الزاوية اليسرى السفلية من مخطط مبعثر FSC مقابل SSC (أقل من 400) (الشكل 3). نظرا لأن البلازميدات تحتوي على مضان أحمر TagRFP ، فيمكن فرزها.
5. حقن تجويف نخاع العظم
- حدد ذكور KM من عمر 8 إلى 9 أسابيع ، ويزن حوالي 30 جراما. قم بتخديرها بحقن داخل الصفاق 150 ميكرولتر من 1٪ صوديوم بنتوباربيتال (الخطوة 2.1). تأكد من عمق التخدير عن طريق قرصة إصبع القدم.
- ثبت الماوس المخدر في وضع ضعيف على طاولة العمليات وقم بإصلاح الطرف الأمامي للماوس بشريط.
- تطهير الظنبوب الخلفي للفئران بمسحة كحولية. املأ البلازميد المراد حقنه في حقنة 1 مل بإبرة 26 جرام. قم بإزالة فقاعات الهواء والاستعداد للحقن.
- المس ساق الماوس وأمسك ساق الماوس بأصابعك. حدد موضع إبرة الحقن بحيث يتم اختراق عمود الظنبوب من هضبة الظنبوبة عند مفصل ركبة الفأر. قم بتدوير إبرة الحقن بالتوازي مع الساق ، وطعن في تجويف نخاع العظم ، وحقنها ببطء (حوالي 3 ثوان) لتقليل الضرر الذي يلحق بالفئران.
- بعد الحقن ، اسحب الإبرة ببطء (حوالي 3 ثوان) واستخدم على الفور مسحة كحولية لوقف النزيف وتطهير موقع البزل.
- ضع الفئران برفق في بيئة دافئة (20-26 درجة مئوية) ، وانتظر حتى تتعافى الفئران من التخدير ، ولاحظ تعافيها.
6. تسلسل سانجر
- بعد 7 أيام من الحقن ، اجمع خلايا نخاع عظم الفأر كما هو موضح في الخطوة 2 وعزل الحمض النووي الجيني باستخدام مجموعة الاستخراج. اجمع الخلايا عن طريق الطرد المركزي عند 2,000 × جم لمدة 1 دقيقة. تخلص من المادة الطافية ، وأضف 200 ميكرولتر من محلول GA ، واهتز باستخدام خلاط دوامة. أضف 20 ميكرولتر من البروتيناز K و 200 ميكرولتر من GB ، واخلطها ، ثم ضعها في حمام مائي 70 درجة مئوية لمدة 10 دقائق.
- بعد الحضانة ، أضف 200 ميكرولتر من الإيثانول اللامائي ، ورجه لمدة 15 ثانية ، ثم ضع السائل المختلط في عمود الامتزاز الداعم. جهاز طرد مركزي عند 2,500 × جم لمدة دقيقة واحدة ، تخلص من سائل النفايات في قاع الأنبوب وأضف 500 ميكرولتر من محلول GD. جهاز الطرد المركزي وتخلص من سائل النفايات ، وغسل الحبيبات 2x باستخدام PW ، وأخيرا جففها ، وقم بتغطيتها ب 40 ميكرولتر من الماء النقي.
ملاحظة: يجب إضافة PW مع الإيثانول اللامائي وفقا للتعليمات. - تضخيم الجين المستهدف CaMKIIδ بواسطة تفاعل البوليميراز المتسلسل باستخدام التسلسل التمهيدي الأمامي gctaaggtgataaatgtggcact والتسلسل التمهيدي العكسي ل ctagtgtgcgggccagattc. قم بإعداد تفاعل تفاعل تفاعل البوليميراز المتسلسل (PCR) بإضافة 25 ميكرولتر من المخزن المؤقت 2x ، و 1 ميكرولتر من dNTP Mix ، و 2 ميكرولتر من التمهيدي الأمامي ، و 2 ميكرولتر من التمهيدي العكسي ، و 1 ميكرولتر من بوليميراز الحمض النووي ، و 2 ميكرولتر من الحمض النووي للقالب ، و 17 ميكرولتر من ddH2O. قم بتشغيل برنامج تفاعل البوليميراز المتسلسل التالي: 95 درجة مئوية لمدة 3 دقائق ، 95 درجة مئوية لمدة 15 ثانية ، 53.7 درجة مئوية لمدة 30 ثانية ، 72 درجة مئوية لمدة 60 ثانية ، 12 درجة مئوية للحفاظ على الحرارة.
- بعد تفاعل البوليميراز المتسلسل ، قم بإعداد جل الاغاروز بنسبة 1٪ وإجراء الرحلان الكهربائي لهلام الاغاروز عند 110 فولت لمدة 35 دقيقة (الخطوة 1.5 ، الخطوة 1.6). قم بقص منطقة الهلام المستهدفة بعد الرحلان الكهربائي وأرسلها لتسلسل Sanger (الشكل 4).
النتائج
تم حقن البلازميدات في المختبر في الفئران عن طريق الحقن داخل العظام (الشكل 1 أ). كان متوسط حجم الجسيمات للجسيمات النانوية حوالي 202.9 نانومتر ، وكان الجهد 2.77 مللي فولت ، وكان PDI 0.22 (الشكل 1 ب). يوضح الشكل 1 ج الشكل السطحي للجسيمات النانوية التي لوحظت على أنها كروية بواسطة المجهر الإلكتروني. يوضح الشكل 1D خريطة البلازميد لمتجه ABE وخريطة البلازميد لمتجه gRNA.
لوحظ نقل البلازميد تحت المجهر الفلوري. يوضح الشكل 2 أ خلايا نخاع العظم الطبيعية. بعد 7 أيام من نقل البلازميد إلى الفأر ، لوحظت خلايا نخاع العظم للفأر تحت المجهر الفلوري. بالمقارنة مع المجموعة الضابطة ، تم تحسين كفاءة تعداء الشيتوزان بشكل ملحوظ (الشكل 2 ب). يشير هذا إلى أن الشيتوزان كمادة تضمين يمكن أن يحسن كفاءة بلازميد التحويل في المختبر.
بعد 7 أيام من التسليم إلى الفئران ، تم التعبير عن البلازميد بالكامل. تم استخراج خلايا نخاع العظم من الفئران ، وتم الكشف عن كفاءة تعداء خلايا نخاع العظم عن طريق قياس التدفق الخلوي. أظهرت النتائج أن كفاءة تعدي الخلايا التي تم نقلها مباشرة باستخدام بلازميد ABE كانت 0.92٪ ± 0.02٪. كانت كفاءة تعداء خلايا نخاع العظم المنقولة ب 2 ميكروغرام ABE المطلي بالشيتوزان 40.80٪ ± 4.31٪ ، وكفاءة خلايا نخاع العظم المنقولة ب 3 ميكروغرام ABE المطلي بالشيتوزان كانت 47.20٪ ± 5.37٪ ، وخلايا نخاع العظم المنقولة ب 4 ميكروغرام ABE المطلي بالشيتوزان كانت 51.20٪ ± 2.02٪ ، وخلايا نخاع العظم المنقولة ب 5 ميكروغرام ABE المطلية بالشيتوزان كانت 48.2٪ ± 7.39٪ (الشكل 3 ب). كانت كفاءة مجموعة تعداء الشيتوزان أعلى من تلك الخاصة بالمجموعة الضابطة (الشكل 3 أ). أظهرت نتائج قياس التدفق الخلوي أنه يمكن التعبير عن البلازميد المحول بثبات وكفاءة في الفئران باستخدام الطريقة الموضحة في هذه الورقة. من منظور كفاءة التعبير الشاملة وتوفير المواد ، يمكن اختيار مخطط التحويل لمرة واحدة ل 3 ميكروغرام بلازميد.
استخرجنا الحمض النووي الجيني من خلايا نخاع العظم وقمنا بتضخيم الجين المستهدف بواسطة تفاعل البوليميراز المتسلسل (PCR). بعد تسلسل Sanger ، كانت كفاءة التحرير في الجسم الحي في A1 14.27٪ ± 0.35٪ ، وذلك في A2 كانت 10.69٪ ± 0.30٪ (الشكل 4).

الشكل 1: مخطط تدفق حقن العظام ، وتوصيف الجسيمات النانوية ، وخريطة ناقل البلازميد. (أ) إجراء الحقن داخل العظم. (ب) حجم الجسيمات ، وإمكانات زيتا ، و PDI للجسيمات النانوية المكونة من بلازميدات ABE المضمنة في الشيتوزان. (ج) صورة مجهرية إلكترونية للجسيمات النانوية. (د) يظهر الجانب الأيسر خريطة البلازميد المتجه ABE ، ويظهر الجانب الأيمن خريطة البلازميد المتجه gRNA. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
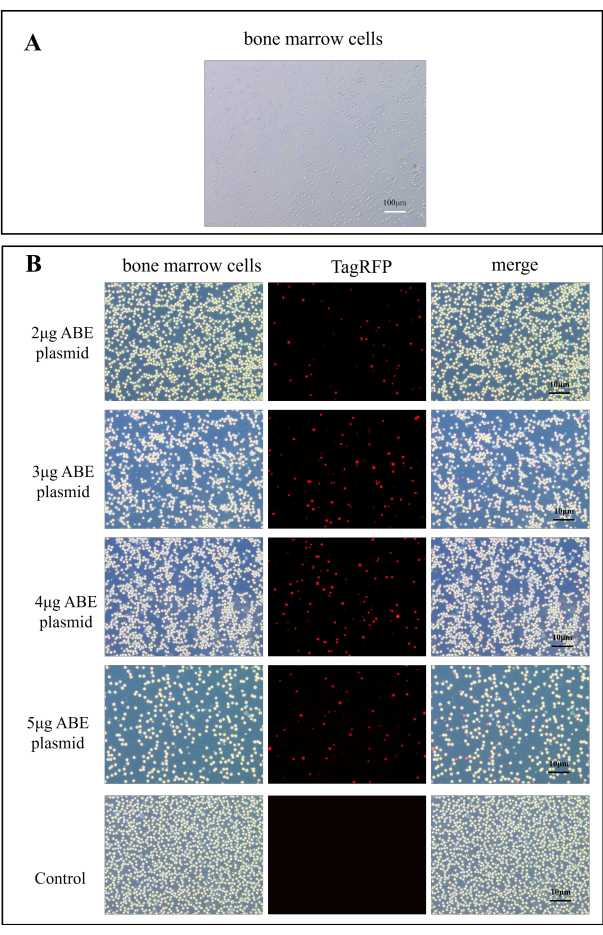
الشكل 2: صور مضان لكفاءة تعداء البلازميد ABE. (أ) صورة A100x لخلايا نخاع العظام. (ب) تم الحصول على خرائط التألق لخلايا نخاع العظم في مجموعة تعداء الشيتوزان بعد 7 أيام من تعداء 2 ميكروغرام و 3 ميكروغرام و 4 ميكروغرام و 5 ميكروغرام بلازميد ABE ، مقارنة بتلك الموجودة في المجموعة الضابطة بعد الحقن المباشر لبلازميد ABE الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.
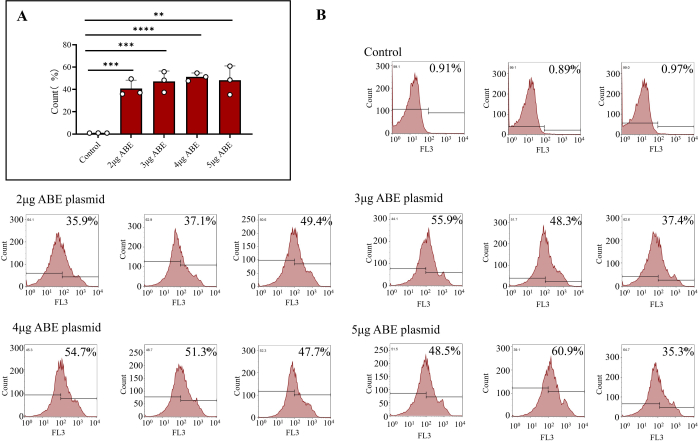
الشكل 3: نتائج قياس التدفق الخلوي لخلايا نخاع العظم المنقولة. (أ) معالجة خلايا نخاع العظم المعالجة بالتدفق الخلوي ب 2 ميكروغرام و 3 ميكروغرام و 4 ميكروغرام و 5 ميكروغرام من بلازميدات ABE (مجموعة تعداء الشيتوزان) وحقنها مباشرة (المجموعة الضابطة). أظهرت النتائج أن كفاءة تعدي خلايا نخاع العظم التي تم حقنها مباشرة ببلازميدات ABE كانت ضعيفة ، في حين أن كفاءة التعدي وتأثير التعدي للمجموعات الأربع الأخرى كانت أعلى. (ب) تتضمن نتائج قياس التدفق الخلوي كفاءة التعدي للمجموعة الضابطة ، ونسب مختلفة من بلازميد BE. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
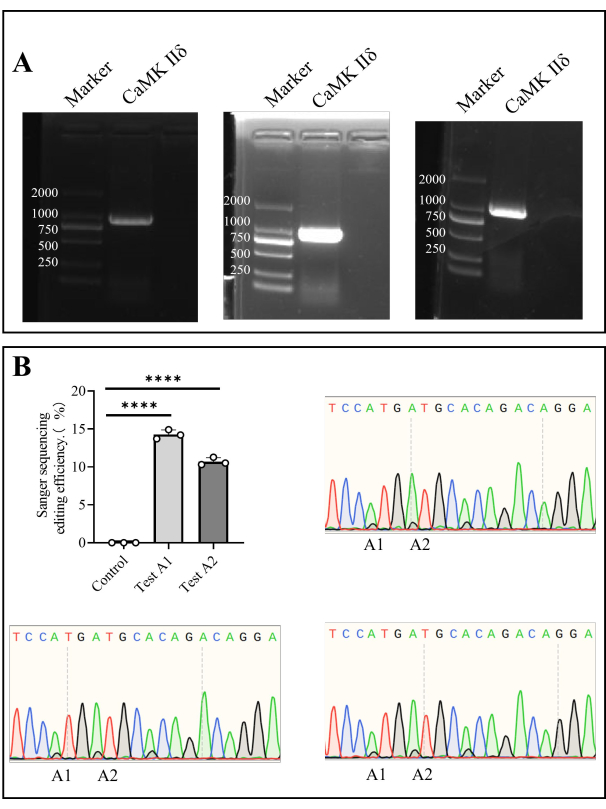
الشكل 4: تسلسل سانجر ل Camk II δ كفاءة التحرير في الفئران. (أ) الكشف عن الرحلان الكهربائي لهلام الاغاروز في Camk II δ. (ب) يوضح المخطط الشريطي تحليل نتيجة تسلسل Sanger لكفاءة تحرير Camk II δ في الفئران ، وتظهر مخططات تسلسل Sanger نتائج التسلسل. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
| الكواشف | التركيز المستخدم |
| حمض الإيثيلين ديامين تترا أسيتيك | 1.142 مل |
| حمض الخليك الجليدي | 2 مل |
| تريس | 4.84 جرام |
الجدول 1: الكواشف لإعداد 1X TAE buffer
| الكاشف | حجم |
| اجار | 7.5 جرام |
| امبير | أضف 500 ميكرولتر عند التعقيم والتبريد إلى 70 درجة مئوية |
| ddH2O | إلى 500 ميكرولتر |
| كلوريد الصوديوم | 5 جرام |
| التربتون | 5 جرام |
| مستخلص الخميرة | 2.5 جرام |
الجدول 2: الكواشف لتحضير الوسط الصلب LB.
| الكاشف | حجم |
| ddH2O | إلى 1 لتر |
| الببتون | 10 جرام |
| كلوريد الصوديوم | 10 جرام |
| مستخلص الخميرة | 5 جرام |
الجدول 3: الكواشف لتحضير وسط سائل LB.
| الكاشف | حجم |
| DMEM | 450 مل |
| مصل الأبقار الجنينية | 5 مل |
| MEM | 5 مل |
| البنسلين / الستربتومايسين | 5 مل |
| β ميركابتو إيثانول | 500 ميكرولتر |
الجدول 4: الكواشف لتحضير وسط DMEM المحتوي على المصل.
Discussion
بالنسبة للأبحاث الطبية الحيوية ، فإن التحدي في توصيل البلازميدات الخارجية للحيوانات ينطوي على تحسين كفاءة التوصيل والتعبير الجيني مع تقليل الضرر الذي يلحق بالحيوانات في نفس الوقت لتحقيق التأثير العلاجي المطلوب15،16. نقدم طريقة جديدة للحقن داخل العظام لتوصيل بلازميد ABE بوساطة الشيتوزان في خلايا نخاع العظام للفئران المتلقية. تعمل هذه الاستراتيجية على تحسين كفاءة توصيل البلازميد والتعبير الجيني.
أولا ، في هذه الدراسة ، تم استخدام الشيتوزان ، المقدم كنظام ناقل غير فيروسي ، كطريقة لإيصال البلازميد. نظرا لأنه ثبت أن كفاءة التعدي للطريقة التقليدية منخفضة نسبيا ، فإن إدخال البلازميدات للتعبير الجيني على المدى الطويل قد يتأثر بجهاز المناعة17،18. يشتهر الشيتوزان ، وهو عديد السكاريد الطبيعي ، بتوافقه الحيوي الممتاز ، وقدرته على تغليف البلازميد ، والسمية المنخفضة. يساعد استخدام الشيتوزان كوسيلة توصيل على منع الآثار المحتملة المتعلقة بالمناعة أثناء التعبير طويل المدى عن البلازميد الخارجي مع تعزيز كفاءة نقل البلازميد19،20،21. بالنسبة للأبحاث المستقبلية ، نعترف بأهمية تقييم السمية والتأثيرات المحتملة لنخاع العظم لجزيئات الشيتوزان النانوية عند إعطاؤها عن طريق الحقن داخل العظم. نخطط لدمج هذه الجوانب في تصميمنا التجريبي المستقبلي ، بما في ذلك إجراء تقييمات شاملة للسمية والتحليلات النسيجية. سيشمل ذلك تقييم معايير مختلفة مثل صلاحية الخلية ، والاستجابات الالتهابية ، ومورفولوجيا نخاع العظم في نقاط زمنية ومستويات جرعة مختلفة. بالإضافة إلى ذلك ، سننظر في استخدام تقنيات التصوير المتقدمة وطرق البيولوجيا الجزيئية لاكتساب فهم أعمق لملف السلامة والتأثيرات المحتملة على صحة نخاع العظام بعد العلاج بجسيمات الشيتوزان النانوية.
ثانيا ، يتم اختيار ABE كمحرر جيني يمكنه تحويل نيوكليوتيدات الأدينين إلى نيوكليوتيدات جوانين دون إدخال فواصل الحمض النووي مزدوجة الشريطة. بالمقارنة مع CRISPR / Cas9 ، يوفر ABE دقة أعلى من خلال تصحيح قاعدة واحدة مباشرة دون إحداث فواصل مزدوجة الخيط ، وبالتالي تقليل التأثيرات خارج الهدف والأضرار المحتملة. ومع ذلك ، عند تصميم gRNA المستهدف ، يلزم النظر بعناية لمنع الارتباط غير المحدد وتقليل التأثيرات خارج الهدف22. لقد نفذنا تدابير للحد من المخاطر ، لكن التجنب التام لا يزال يمثل تحديا ويحتاج إلى مزيد من البحث.
ثالثا ، من أجل الولادة في الجسم الحي ، قمنا بتطوير استراتيجية الحقن داخل العظم. الحقن داخل العظم هو طريقة آمنة وفعالة ، كما تم الإبلاغ عنها في مراجعة النظام من قبل Betzler et al.23. الجين المستهدف في هذه الدراسة هو Camk II δ ، والذي يلعب دورا رئيسيا في تنظيم تمايز ناقضات العظم13،14. بالمقارنة مع طريقة حقن وريد الذيل التقليدية ، يمكن للحقن داخل العظم توصيل بلازميد Camk II δ المستهدف مباشرة وكفاءة إلى ناقضات العظم ، وبالتالي تحقيق كفاءة تحرير عالية في الجسم الحي تبلغ 14.27٪ في موضع A1 ، بينما 10.69٪ في موضع A2 في الفئران المتلقية.
علاوة على ذلك ، تجدر الإشارة إلى أن الحقن داخل العظم هو عملية تتطلب اهتماما خاصا. لذلك ، قبل التجربة ، استخدمنا الصبغة الزرقاء كممارسة لمراقبة ما إذا كان الحقن قد تم حقنه بشكل صحيح في تجويف نخاع العظام للفئران. بالإضافة إلى ذلك ، نظرا لاحتمال أن تعاني الفئران المتلقية من الضرر الناجم عن الحقن داخل العظم ، يوصى باختيار الفئران التي تزن حوالي 30 جراما. نؤكد على أهمية عدة خطوات رئيسية في إجراء الحقن داخل العظم: تجنب إعطاء كمية زائدة من التخدير ، وضمان التطهير الشامل قبل الحقن وبعده لمنع العدوى ، وتدوير الإبرة لتجنب الانسداد الناجم عن نخاع العظام. في حالة انسدادها ، امتنع عن دفع السائل إلى تجويف نخاع عظم الفأر ، مما قد يؤدي إلى موت الفأر. يجب حقن البلازميد ببطء ، ومن الأهمية بمكان مراقبة حالة الفئران بعد الحقن للتأكد من عدم حدوث وفيات بسبب التلاعب غير السليم. على الرغم من أننا حددنا أن الفئران تزن 30 جراما لنجاح الحقن داخل العظام. في البيئات السريرية ، يجب مراعاة التباين الخاص بالمريض ، ودراساتنا المستقبلية ، مثل تحسين تقنيات الحقن لنطاقات الوزن المختلفة واستكشاف طرق التوصيل البديلة ، جارية حاليا.
يمكن استخدام هذه الطريقة على نطاق واسع في تحرير الخلايا المشتقة من نخاع العظام ، بما في ذلك بانيات العظم ، وخلايا الكريات الحمراء ، والخلايا الليمفاوية ، والخلايا المكونة للدم ، إلخ. تسمح الدقة العالية وكفاءة الطريقة للباحثين باستخدامها ليس فقط للأمراض التي تسببها وظيفة ناقضات العظم غير الطبيعية ولكن أيضا في مجال العلاج الجيني لاضطرابات الدم الأخرى. على سبيل المثال ، يمكن أيضا أن تتماشى أمراض الدم الشائعة بشكل جيد مع طرق العلاج لدينا. يمكن علاج أمراض الدم الناجمة عن طفرات قاعدة واحدة24 باستخدام محرري الجينات ABE ، ويمكن للحقن داخل العظم أيضا توصيل البلازميدات مباشرة إلى الخلايا الجذعية المكونة للدم ، وبالتالي تحقيق تأثيرات علاجية أفضل. ومع ذلك ، فإن الطريقة تظهر قيودا في تطبيقها لعمليات التحرير والتسليم لأنواع الخلايا ذات الأصل غير نخاع العظم ، مثل الخلايا العضلية والدهنية.
Disclosures
ويعلن أصحاب البلاغ عدم وجود مصالح متضاربة.
Acknowledgements
تم تمويل هذا العمل من قبل مؤسسة العلوم الطبيعية في مقاطعة آنهوي (2208085MC74 ، 2208085MC51) ومؤسسة البحث العلمي من إدارة التعليم في مقاطعة آنهوي ، الصين (KJ2021A0055).
Materials
| Name | Company | Catalog Number | Comments |
| 0.2 ml PCR Tubes, Flat cap | LABSELECT | PT-02-C | |
| 1 mL syringe | Anhui Jiangnan medical equipment Co., LTD | / | |
| 1% Pentobarbital sodium | / | / | |
| 1.5 ml Microcentrifuge Tubes | LABSELECT | MCT-001-150 | |
| 10 × DNA Loading Buffer | Vazyme | P022-01 | |
| 10X T4 DNA Ligase Buffer 1 ml | TaKaRa Biotechnology(Dalian)Co.,LTD | 2011A | |
| 1250 μl Pipette Tip 102.1mm | LABSELECT | T-001-1250 | |
| 200 μl Pipette Tips 50.55mm | LABSELECT | T-001-200 | |
| 2x Phanta Max Buffera | Vazyme | P505-d1 | |
| 4 ? centrifuge | Thermo Fisher | 75002425 | |
| 50 ml Centrifuge tube | LABSELECT | T-012-50 | |
| 6-well Cell Culture Plates | LABSELECT | 11110 | |
| Agar | Sangon Biotech | A505255-0250 | |
| Amp | Abiowell | / | |
| Chitosan | Sangon Biotech | A600614-0500 | |
| Constant temperature culture shaker | Shanghai Zhicheng Analytical Instrument Manufacturing Co., LTD | ZWY-200D | |
| Countess Automated Cell Counter | Thermo Fisher Scientific | Countess II/II FL | |
| Countess Cell Counting Chamber Slides and Holder, disposable | Thermo Fisher Scientific | C10228 | |
| CutSmart Buffer | New England Biolabs | B7204SVIAL | |
| DH5α | General Biosystems | CS01010 | |
| DMEM | gibco | C11995500BT | |
| dNTP Mix | Vazyme | P505-d1 | |
| Esp3I enzyme | NEBiolabs | R0734S | |
| Ethylenediaminetetraacetic acid | VETEC (sigma-aldrich) | V900106 | |
| Fetal bovine serum | OriCell | FBSAD-01011-500 | |
| Flow cytometer | BD FACSCalibur | 342975 | |
| Flow tube | Beyotime Biotechnology | FFC005-1bag | |
| Fluorescence microscope | Leica | 427019 | |
| gel maxi purification kit | TIANGEN | DP210 | |
| Genomic DNA extraction kit | TIANGEN | DP304 | |
| Glacial acetic acid | China National Pharmaceutical Group Corporation | 10000218 | |
| GoldBand DL2,000 DNA Marker | YESEN | 10501ES60 | |
| Ice machine | shanghaizhengqiao | BNS-30 | laboratory reserved |
| ImunoSep Buffer | Precision Biomedicals Co.,LTD | 604050 | |
| Megafuge 8 Small Benchtop Centrifuge Series | Thermo Fisher Scientific | 75004250 | |
| MEM | Life Technology | 11140050 | |
| NanoDrop 2000 | Thermo Fisher Scientific, USA | ||
| NaOH | SIGAM | S5881-500G | |
| PBS | XiGene | XG3650 | |
| PCMV-SPRY-ABE8E vector | / | / | |
| pcr amplification apparatus | Thermo Fisher | AKC96300441 | |
| Penicillin/Streptomycin | Solarbio | P1400 | |
| peptone | Sangon Biotech | A505247-0500 | |
| Phanta Max Super-Fidelity DNA Polymerase | Vazyme | P505-d1 | |
| Red cell lysate | Beyotime | C3702 | |
| Sodium chloride | China National Pharmaceutical Group Corporation | 10019318 | |
| Sodium sulfate | aladdin | S433911 | |
| T-001-10 10μl Pipette Tips 31.65mm | LABSELECT | T-001-10 | |
| T4 DNA Ligase | TaKaRa Biotechnology(Dalian)Co.,LTD | 2011A | |
| Tris | BioFroxx | 1115KG001 | |
| tryptone | Sangon Biotech | A505250-0500 | |
| vortex mixer | sigma | Z258423 | |
| Water bath | shanghaiyiheng | DK-80 | |
| YeaRed Nucleic Acid Gel Stain | YESEN | 10203ES76 | |
| Yeast extract | BBI | A610961-0500 | |
| Zetasizer Nano | Malvern Panalytical | Zetasizer Nano ZS | |
| β-mercaptoethanol | Sigma | 444203 |
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved