Method Article
Bakterilerde Bakır Nanopartikül Kaynaklı Programlanmış Hücre Ölümünün İncelenmesi
Bu Makalede
Özet
Bakır nanopartiküller, reaktif oksijen türleri üreterek antimikrobiyal ajanlar olarak işlev görür. Burada, bakır nanopartiküllerin klinik olarak ilgili üç patojene karşı etkili olduğunu ve bu bakterisidal süreçte belirli programlanmış hücre ölüm yollarının yer aldığını gösteren prosedürler sunulmaktadır.
Özet
Son zamanlarda, antibiyotiklerin aşırı ve yanlış kullanımı nedeniyle çoklu ilaca dirençli patojenler ve tedavi edilemeyen enfeksiyonlar ile ilgili endişeler artmıştır. Metalik ve metalik oksit nanopartiküller gibi nanomalzemeler, çoklu ilaca dirençli patojenlerle mücadele etmek için potansiyel yeni stratejiler olarak biyomedikal alanda popülerlik kazanmıştır. Bu çalışmada, giderek artan ilaç direnci gelişen üç yaygın hastane kökenli fırsatçı patojen olan Escherichia coli (E. coli), Acinetobacter baumannii (A. baumannii) ve Staphylococcus aureus (S. aureus) karşı bakterisit olarak bakır nanopartiküllerin (CuNP'ler) kullanımı araştırılmıştır. İki boyutta (20 nm ve 60 nm) CuNP'lerin sentezlenmesi ve koloni tahlilleri yoluyla bakterisidal etkinliklerinin değerlendirilmesi için ayrıntılı protokoller sunulmuştur. CuNP'lerin altında yatan antimikrobiyal etki mekanizmaları, reaktif oksijen türlerinin üretimindeki değişiklikler değerlendirilerek araştırıldı. Ek olarak, programlanmış hücre ölümü (PCD) yolaklarının bakteri öldürmeye potansiyel katılımını incelemek için insan protein fonksiyonlarını inhibe eden dört modülatör uygulandı. Bu yaklaşım sayesinde, bakıra bağımlı transkripsiyonel düzenleyiciler de dahil olmak üzere bakır homeostaz proteinleri üzerine yapılan araştırmalara dayanarak, bakıra dirençli suşların potansiyel olarak ortaya çıkması önerilmektedir. Bu bulgular, CuNP'lerin bakterisidal etkilerini ve antibiyotik direncinin ele alınmasındaki potansiyel rollerini incelemek için kapsamlı bir metodoloji sağlar.
Giriş
İlaca dirençli bakteriler tıpta ciddi bir endişe nedenidir. Hızlı ortaya çıkmaları, geleneksel antibiyotiklerin etkinliğini azaltmış ve daha fazla klinik komplikasyona neden olmuştur. Halk sağlığı için büyük bir tehdit oluştururlar ve yeni antimikrobiyal ajanlar için acil bir ihtiyaç oluştururlar. Araştırma yollarından biri nanomalzemelerdir. Nanomalzemeler, mikroplarla canlılıklarını tehlikeye atacak şekilde etkileşime girmelerine izin veren benzersiz fizikokimyasal özelliklere sahiptir. Örneğin, gümüş nanopartiküller (AgNP'ler) bakterilerde oksidatif strese neden olarak protein fonksiyon bozukluğuna, zar bozulmasına, DNA hasarına ve nihayetinde hücre ölümüne neden olur1. Öte yandan altın nanopartiküller (AuNP'ler), antifungal özellikleri ile bilinir ve taşıyıcı olarak görev yaparak antibiyotiklerin bakterisidal etkisini artırabilir2.
Ek olarak, bakır nanopartiküller (CuNP'ler) de güçlü antimikrobiyal etkileri ve düşük üretim maliyetleri nedeniyle büyük ilgi görmüştür. Çalışmalar, CuNP'lerin enzimatik aktivitenin bozulması ve reaktif oksijen türlerinin (ROS) oluşumu yoluyla geniş spektrumlu bakterisidal aktivite sergilediğini göstermektedir.3. CuNP'lerin pozitif yükü, bakterilere nüfuz etmelerini kolaylaştırarak hücresel alımlarını arttırır4. Bu mekanizma, CuNP'leri enfeksiyonları önlemek için implantlar gibi yüzey kaplaması için umut verici bir seçenek haline getirir3. Bununla birlikte, ilginç bir bulgu, CuNP'lerin bakterisidal etkisinin boyuta bağlı görünmesidir. Bazı çalışmalar, daha küçük CuNP'lerin, muhtemelen üstün yüzey alanı-hacim oranları5 nedeniyle daha yüksek antibakteriyel aktivite sergilediğini bulmuştur.
ROS üretimi, lipid peroksidasyonu, protein disfonksiyonu, DNA parçalanması ve glukoneogenez/glikojenolizin inhibisyonu dahil olmak üzere hücrelerde ve bakterilerde yaygın hasara neden olur ve nekroz veya programlanmış hücre ölümü (PCD) ile ilgilidir6,7,8. Son çalışmalar, PCD sistemlerinin bakterilerde var olduğunu, ökaryotik sistemlerdekilere benzer etki modları ve efektörleri olduğunu ortaya koymuştur9. Bakteri toplulukları, bir toksin-antitoksin (TA) sistemi10 aracılığıyla oksidatif stres de dahil olmak üzere strese yanıt olarak PCD'yi indükleyebilir. Basit bir ifadeyle, toksin-antitoksin sistemi, temel hücresel süreçleri bozabilen toksinlerden ve normal büyüme koşulları altında toksisitelerini inhibe etmek için toksinlerle kararlı kompleksler oluşturabilen antitoksinlerden oluşur. Çoğu bakteri ve arke, genomlarında TA lokusları içerir ve genellikle kromozom dışı ve kromozomal DNA'nın çoklu kopyalarında bulunur. Tip II TA (MazE/MazF modülü olarak bilinir) özellikle ilgi çekici olan birkaç tür TA sistemi vardır. Stres koşulları altında, antitoksinler bozulur ve toksinlerin hücresel hedeflerini inhibe etmesine izin verir. E. coli ve S. aureus'ta, toksin MazF, oksidatif stres, yüksek sıcaklık ve amino asit açlığı gibi stres koşullarına yanıt olarak aktive edilir. Sonuç olarak, antitoksin MazE'nin ekspresyonu azalır ve toksin MazF10 serbest bırakılır. Çalışmalar, MazF'nin, küçük bir alt popülasyonun olumsuz koşullar altında hayatta kalmasına izin veren proteinlerin sentezini sağladığını, popülasyonun çoğunun ise mazEF aracılı hücre ölümüne maruz kaldığını bulmuştur. Bu hücre ölümü, ROS'un transkripsiyonel veya translasyonel inhibisyonu indüklediği ROS'a bağlı veya DNA hasarının ölüm yollarını11 tetiklediği ROS'tan bağımsız olabilir.
Bu çalışma, CuNP'lerin bakteriyel ölümü indüklediği mekanizmaları araştırmaktadır. Yalnızca TA sistemine odaklanmak yerine, bakterilerdeki potansiyel PCD yolaklarını araştırmak için daha önce araştırmamızda 7,12 kullanılan dört PCD modülatörü kullanıldı.
İki farklı boyuttaki (20 ve 60 nm) CuNP'lerin bakterisidal etkilerini farklı konsantrasyonlarda inceleyerek ve koloni tahlilleri, ROS tespiti ve PCD modülatörleri (SBI, Z-VAD, NSA ve Wortmannin) gibi yöntemleri kullanarak, bu araştırma, PCD'nin çok hücreli organizmalara özel olmadığını, aynı zamanda stres altındaki bakteri topluluklarında da meydana geldiğini vurgulamaktadır. Bu çalışma, ayrıntılı protokoller sağlayarak, araştırmacıların kendi sistemlerindeki CuNP etkinliğini ve bakterisidal mekanizmaları değerlendirmelerini sağlamayı amaçlamaktadır. Ayrıca, bu bulgular bakteriyel PCD'nin anlaşılmasını ilerletmekte ve antibiyotiğe dirençli bakterilerle savaşmak için CuNP bazlı tedavilerin geliştirilmesini desteklemektedir.
Protokol
Bu çalışmada kullanılan reaktifler ve ekipmanlar Malzeme Tablosunda listelenmiştir.
1. Bakır nanopartikülün hazırlanması
- Ticari bir kaynaktan ticari bakır nanotozlar (25 nm ve 60-80 nm) elde edin.
- İki boyutta 1 mg / mL nanopartikül için dağıtıcı olarak 1.0 mM sodyum dodesil sülfat (SDS) kullanın.
- Nanopartikülleri ultrasonik bir banyo kullanarak oda sıcaklığında en az 30 dakika boyunca dağıtın. Tamamen dağılmış nanopartiküller daha sonra sonraki deneylerde kullanıma hazırdır.
2. Bakterilerin hazırlanması
- Amerikan Tip Kültür Koleksiyonundan E. coli (Migula) Castellani ve Chalmers suşu 25922 ve A. baumannii Bouvet ve Grimont suşunu edinin. S. aureus'u Biyokaynak Toplama ve Araştırma Merkezi'nden edinin.
- Bakterileri Luria-Bertani (LB) suyunda 37 ° C'de aerobik koşullar altında kültürleyin.
- Bakteri kültürlerini LB ortamında 600 nm'de (OD600) yaklaşık 0.5'lik bir optik yoğunluğa seyreltin.
3. Hücre canlılığı değerlendirmesi
- Koloni tahlili
- 0 μg/mL, 1 μg/mL, 5 μg/mL, 10 μg/mL, 50 μg/mL ve 100 μg/mL dahil olmak üzere iki boyutta CuNP'nin çeşitli konsantrasyonlarını hazırlamak için stok CuNP çözeltileri (1 mg/mL) kullanın.
- Adım 2.3'te hazırlanan bakteri kültürlerini mikrosantrifüj tüplerine bölün ve oda sıcaklığında 10 dakika boyunca 3300 × g'da santrifüjleyin.
- Bakteri peletlerini koruyun ve nazik pipetleme ile sırasıyla iki boyutta CuNP'nin farklı konsantrasyonlarını ekleyin.
- Bakteriyel peletleri sırasıyla negatif ve pozitif kontroller olarak PBS ve% 70 alkol ile tedavi edin.
- Tedavi edilen tüm bakterileri 24 saat boyunca 37 ° C'de 200 rpm'de çalkalayarak inkübe edin.
- İnkübasyondan sonra, tedavi edilen tüm bakterileri PBS ile yıkayın ve LB agar plakalarına yayın. Plakaları 24 saat boyunca 37 ° C'lik bir inkübatöre yerleştirin.
- Ertesi gün her tedavi grubundaki koloni sayılarını sayın ve istatistiksel analiz yapın. İstatistiksel doğruluk için bunun üç nüsha halinde yapılması önerilir.
- Bakterisidal mekanizma çalışması
- Bakterileri adım 3.1.2'de tarif edildiği gibi hazırlayın ve 2 saat boyunca 5 μM SBI-0206965 (SBI), 1 saat boyunca 0.5 μM nekrosülfonamid (NSA), 30 dakika boyunca 100 nM wortmannin (Wort) veya 30 dakika boyunca 100 nM Z-VAD-FMK (Z-VAD) ile tedavi edin.
- Bakterileri, 5 μM SBI, 0.5 μM NSA, 100 nM Wort ve 100 nM Z-VAD varlığında veya yokluğunda, adım 3.1.1'de tarif edildiği gibi iki boyutta CuNP çözeltisinin farklı konsantrasyonlarıyla birlikte tedavi edin.
- Modülatör işlemlerinden sonra bakterileri santrifüjleyin (adım 3.2.1) ve süpernatanları çıkarın.
- Bakteri peletlerini adım 3.2.2'de hazırlanan çözeltilerde yeniden süspanse edin ve 24 saat boyunca 37 ° C'de 200 rpm'de çalkalayarak inkübe edin.
- Bakterileri sırasıyla% 70 etanol ve PBS ile pozitif ve negatif kontroller olarak tedavi edin. Her grup için aynı inhibitör koşulları altında CuNP boş kontrolü (0 μg/mL; sahte) olarak CuNP'leri olmayan bir çözelti kullanın. Tüm numuneleri 24 saat daha inkübe edin.
- İnkübasyondan sonra, kültürlere 1:10 hacim oranında hücre canlılığı reaktifi ekleyin. Kültürleri 37 ° C'de çalkalanarak 2 saat daha inkübe edin.
- 2 saatlik inkübasyondan sonra kültürleri (adım 3.1.2) santrifüjleyin. Floresan süpernatanları 96 oyuklu plakalara aktarın. Bir mikroplaka okuyucu ile 560 nm'lik bir uyarma dalga boyu ve 590 nm'lik bir emisyon dalga boyu kullanarak floresansı ölçün.
- Kalan süpernatanı 10-5 ve 10-4'e seyreltin ve kültürleme için LB agar plakalarına yayın.
- Ertesi gün tek kolonileri sayın.
4. Reaktif oksijen türlerinin tespiti
- Bakteri kültürlerini adım 2.3'te anlatıldığı gibi hazırlayın ve bunları mikrosantrifüj tüplerine bölün.
- Bakterileri çeşitli stres koşullarıyla ROS indükleyen pozitif kontrol grupları olarak tedavi edin (veriler sonuçlarda gösterilmemiştir). Tedaviler adım 4.2.1-4.2.4'te açıklanmıştır.
- Bakterileri 3 saat boyunca 405 nm UV ışığına maruz bırakın. Bakterileri 45 °C'de 2 saat inkübe edin.
- Daha sonra, bakterileri 4 ° C'de 2 saat inkübe edin.
- Bakterileri 30 dakika boyunca% 3 H2O2 ile tedavi edin.
- Negatif kontrol olarak bakterileri LB suyunda 37 ° C'de tutun.
- Adım 3.1.1'de tarif edildiği gibi çeşitli CuNP konsantrasyonları hazırlayın ve bakterileri 24 saat boyunca 1 μg/mL, 5 μg/mL, 10 μg/mL ve 100 μg/mL konsantrasyonlarda 20 nm veya 60 nm CuNP'lerle tedavi edin.
- Kalan nanopartikülleri çıkarmak için inkübe edilmiş bakterileri PBS ile iki kez yıkayın.
- PBS'de 2 μM'lik bir nihai konsantrasyonda 2',7'-diklorodihidrofloresein diasetat (H2DCFDA) boyası hazırlayın.
- Bakteri peletlerini 5 μM H2DCFDA içinde yeniden süspanse edin ve bir akış sitometresi kullanarak 520/30 nm emisyonda floresan yoğunluğunu ölçün.
NOT: FL1 yeşil floresansının yoğunluğu, tedavi edilen kültürdeki ROS seviyesi ile ilişkilidir. İstatistiksel doğruluk için bunun üç nüsha halinde yapılması önerilir.
Sonuçlar
Üç patojende iki boyutlu CuNP'lerin antimikrobiyal aktiviteleri
CuNP'lerin bakterisidal aktivitelerini test etmek için üç fırsatçı patojen (E. coli, S. aureus ve A. baumannii) kullanıldı. Bakteriler 0 μg/mL, 1 μg/mL, 5 μg/mL, 10 μg/mL, 50 μg/mL ve 100 μg/mL 20 nm veya 60 nm CuNP ile tedavi edildi ve bakterisidal aktiviteler, koloni sayımlarından elde edilen minimum bakterisidal konsantrasyon (MBC) kullanılarak belirlendi. Sonuçlarımız, her üç suş için her iki boyutta CuNP'nin (Şekil 1) pozitif bakterisidal etkilerini göstermiştir. E. coli'de, 20 nm ve 60 nm CuNP tedavileri için sırasıyla 1 μg / mL ve 5 μg / mL'den başlayarak koloni sayılarında önemli düşüşler gözlenmiştir (Şekil 1A). Buna karşılık, S. aureus için koloni sayımlarında kayda değer azalmalar, her iki CuNP boyutunun tüm konsantrasyonlarında gösterilmiştir (Şekil 1B). A. baumannii için, koloni sayımlarında bir azalma elde etmek için daha yüksek CuNP konsantrasyonlarına (20 nm CuNP'lerde 5 μg/mL ve 60 nm CuNP'lerde 10 μg/mL) ihtiyaç duyulmuştur (Şekil 1C).
Önceki çalışmalarımız, daha küçük CuNP'lerin (20 nm), daha büyük olanlara (60 nm) kıyasla daha olağanüstü bakterisidal yetenek sergilediğini göstermiştir7,12. Burada, tutarlı sonuçları gösteren benzer eğilimler gösterildi. Ayrıca, bu bulgular gram pozitif bakterilerin (bu durumda, S. aureus) CuNP'lere test edilen gram negatif bakterilerden (E. coli ve A. baumannii) daha duyarlı olduğunu göstermektedir.

Şekil 1: Üç bakteri türünde iki farklı boyuttaki CuNP'lerin bakterisidal aktivitesi. E. coli (A), S. aureus (B) ve A. baumannii (C) 20 nm veya 60 nm CuNP'lik değişen konsantrasyonlarda tedavi edildi ve bakteri koloni sayıları belirlendi. PBS ve% 70 alkolle tedavi edilen bakteriler sırasıyla negatif ve pozitif kontroller olarak görev yaptı. Veriler, her biri üç nüsha halinde gerçekleştirilen dört bağımsız deneyden elde edilen ortalama ± standart sapma (SD) olarak ifade edilir. Aykırı değerler görsel inceleme yoluyla tespit edildi. Veri normalliğini değerlendirmek için Shapiro-Wilk testi kullanıldı. İstatistiksel karşılaştırmalar Student t-testi kullanılarak yapıldı. Yıldız işaretleri (*) ve pound işaretleri (#), negatif kontrole göre sırasıyla 20 nm ve 60 nm CuNP tedavileri için P < 0.05'i gösterir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
CuNP kaynaklı ROS üretimi yoluyla bakterilerde ölümcül hasar
CuNP'lerin bakterileri öldürmesi için önerilen mekanizmalar değişir. İki temel teori tartışılmaktadır: demir-sülfür küme proteinlerinin nanopartiküllerden salınan bakır ile değiştirilmesi ve CuNP'nin neden olduğu ROS üretimi13,14. Mekanizmaları araştırmak için CuNP ile tedavi edilen üç bakteride ROS üretimi değerlendirildi (Şekil 2). E. coli, S. aureus ve A. baumannii, 20 nm veya 60 nm CuNP'lerin farklı konsantrasyonları ile muamele edildi, ardından ROS tespiti içinH2DCFDA uygulandı. Yeşil floresan popülasyonlarının yüksek fraksiyonları, 20 nm ve 60 nm CuNP tedavilerinin tüm konsantrasyonlarında akış sitometrisi ile ölçüldü (Şekil 2). İlginç bir şekilde, 20 nm CuNP tedavilerindeki pozitif hücre popülasyonları konsantrasyondan bağımsızdı (Şekil 2A). Özellikle, 20 nm CuNP'lerin daha düşük konsantrasyonları daha yüksek ROS oluşumuna neden olurken, daha yüksek konsantrasyonlar daha düşük bir pozitif hücre fraksiyonu sergiledi. Bununla birlikte, bu fenomen 60 nm CuNP ile tedavi edilen hücrelerde gözlenmemiştir (Şekil 2B). 20 nm veya 60 nm CuNP'ler ile tedavi edilen üç bakteri arasında önemli bir fark kaydedilmemiştir (Şekil 2). 0 μg/mL'de pozitif popülasyonlarda hafif yükselmeler tespit edildi, bu da dağıtıcılara ve ozmoz basıncına atfedilebilir (Şekil 2).

Şekil 2: Üç bakteri türünde iki farklı boyutta CuNP'ler ile muamele sonrası ROS üretimi. E. coli, S. aureus ve A. baumannii , 20 nm (A) veya 60 nm (B) CuNP'lerin farklı konsantrasyonlarına maruz bırakıldı. ROS üretimi, CuNP tedavisini takibenH2DCFDA boyaması kullanılarak değerlendirildi ve floresan pozitif hücrelerin fraksiyonu akış sitometrisi ile analiz edildi. Veriler, her biri üç kopya halinde gerçekleştirilen beş bağımsız deneyden elde edilen ortalama ± SD olarak sunulur. Aykırı değerler görsel inceleme yoluyla tespit edildi. Veri normalliğini değerlendirmek için Shapiro-Wilk testi kullanıldı. İstatistiksel karşılaştırmalar Kruskal-Wallis tek yönlü analizi kullanılarak yapılmıştır. Semboller (*, # ve $), negatif kontrole göre sırasıyla 20 nm ve 60 nm CuNP tedavileri için P < 0.05'i gösterir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Dört PCD modülatörü, CuNP'lerin bakteriyel ölüm mekanizmalarını ortaya çıkardı
Üç patojende CuNP tedavilerinin neden olduğu hücre ölüm mekanizmalarını daha fazla araştırmak için sonraki deneylerde dört PCD modülatörü kullanıldı. Bu modülatörlerin -SBI, Z-VAD, NSA ve Wort- memeli hücrelerinde apoptoz (Z-VAD), otofaji (SBI ve Wort) ve nekrotoz (NSA) ile ilişkili sinyal iletim yollarını bloke ettiği bilinmektedir15-17. Çalışmalar, PCD'nin çok hücreli organizmalarla sınırlı olmadığını göstermiştir; Bakteri kolonilerinde zorlu koşullara yanıt olarak tüm koloniye fayda sağlayan ve genetik dönüşüm ve biyofilm oluşumu gibi adaptif stratejileri kolaylaştıran farklı PCD formları gözlemlenmiştir10. Bu anlayışa dayanarak, PCD ile ilişkili yolların bakterilerde CuNP kaynaklı hücre ölümüne katkıda bulunup bulunmadığını inceledik. Üç bakteri, E. coli, S. aureus ve A. baumannii, dört modülatör ile ön işleme tabi tutuldu, ardından iki boyutta CuNP ve modülatörler ile birlikte muamele edildi (Şekil 3).
Hücre canlılıkları, Şekil 1'de sunulan sonuçlarla tutarlı olarak, üç bakteride (Şekil 3) CuNP tedavilerinin her iki boyutunda konsantrasyona bağlı düşüşler göstermiştir. E. coli'de, 1 μg / mL ve 5 μg / mL 20 nm CuNP tedavisi altındaki Z-VAD grubunda ve ayrıca 10 μg / mL 20 nm CuNP ile tedavi edilen NSA grubunda artan sağkalım gözlenmiştir (Şekil 3A). Bununla birlikte, Z-VAD, 60 nm-CuNP tedavisinin tüm konsantrasyonlarında E. coli'de sağkalımı kurtarmada etkiliydi, ancak 100 μg / mL'de değildi (Şekil 3B). S. aureus'taki farklı canlılık sonuçları, 20 nm CuNP tedavilerinde belirli bakterisidal yolakları düşündürmektedir (Şekil 3C). NSA, 20 nm CuNP tedavilerinin tüm konsantrasyonlarında kritik bir rol oynarken, Z-VAD sadece 1 μg / mL 20 nm CuNP'de etkiliydi. S. aureus, 10 μg / mL 60 nm CuNP tedavisinde Z-VAD dışında herhangi bir konsantrasyonda modülatörlere yanıt göstermedi (Şekil 3D). Hücre sağkalım oranlarında E. coli'de gözlenenlere benzer eğilimler, 20 nm CuNP'ler ile tedavi edilen A. baumannii'de de kaydedilmiştir (Şekil 3E). Z-VAD, 20 nm ve 60 nm CuNP tedavilerinde 1 μg/mL, 5 μg/mL ve 10 μg/mL'de kurtarmada etkiliyken, NAS sadece 10 μg/mL 20 nm CuNP'de canlılıkları artırdı. SBI, etkilerini sadece 1 μg / mL ve 5 μg / mL konsantrasyonlarında 60 nm CuNP'ler ile tedavi edilen A. baumannii'de göstermiştir (Şekil 3F).
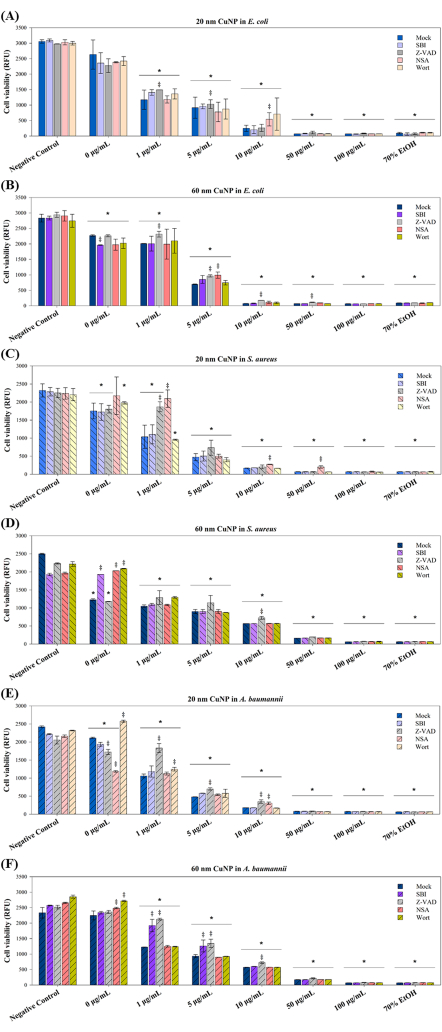
Şekil 3: PCD modülatörlerinin iki farklı boyuttaki CuNP'lerle tedaviyi takiben bakteriyel sağkalım üzerindeki etkisi. E. coli (A, B), S. aureus (C, D) ve A. baumannii (E, F), PBS (negatif kontrol) ve değişen konsantrasyonlar (0 μg / mL, 1 μg / mL, 5 μg / mL, 10 μg / mL, 50 μg / mL ve 100 μg / mL) ile tedavi edildi PCD modülatörleri SBI'nin yokluğunda (sahte) veya varlığında 20 nm veya 60 nm CuNP'ler, Z-VAD, NSA ve Wort. % 70 alkol ile tedavi edilen bakteriler pozitif kontrol görevi gördü. Hücre canlılığı, ticari olarak temin edilebilen bir canlılık testi kullanılarak değerlendirildi. Veriler, her biri üç kopya halinde gerçekleştirilen en az üç bağımsız deneyden elde edilen ortalama ± SD olarak sunulur. Aykırı değerler görsel inceleme yoluyla tespit edildi. Veri normalliğini değerlendirmek için Shapiro-Wilk testi kullanıldı. İstatistiksel karşılaştırmalar ANOVA ve Student t-testi kullanılarak yapılmıştır. Bir yıldız işareti (*), negatif kontrole kıyasla CuNP tedavileri için P < 0.05'i gösterirken, çift çarpı (‡), her konsantrasyonda sahte < diğer modülatörler arasındaki karşılaştırmalar için P ve 0.05'i gösterir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Bakterisitin sinerjik etkileri, dağıtıcılar ve CuNP'ler ile de gözlenmiştir (Şekil 3). SBI, Wort ve NSA, 0 μg / mL 60 nm CuNP'lerde SDS'ye maruz kaldığında S. aureus'ta bakteriyel canlılığı geliştirdi (Şekil 3F). Sahte gruplarda 20 nm ve 60 nm CuNP'ler ile tedavi edilen A. baumannii'de wort sağkalım oranlarını arttırdı (Şekil 3E, F). NSA ayrıca 60 nm CuNP'ler ile sahte tedavide A. baumannii canlılıklarını arttırdı (Şekil 3F). Buna karşılık, SBI, 60 nm CuNP'lerin sahtesi ile tedavi edilen E. coli'deki canlılıkları azaltırken (Şekil 3B), Z-VAD ve NSA, 20 nm CuNP'lerin sahtesi ile tedavi edilen A. baumannii'de sağkalım oranlarını azaltmıştır (Şekil 3E). Bu sonuçlar, bu üç bakterideki bakterisidal mekanizmaların, dağıtıcılarla tedavi edildiğinde, nanopartikülleri içerenlerden farklı olabileceğini düşündürmektedir.
Bakır, çeşitli biyolojik süreçler için önemli bir eser elementtir ve bakteriler içindeki bakır iyonlarının dengesini korumak hayati önem taşır. Bakterilerde bakır homeostaz sisteminde bulunan önemli bileşenler, bakır ihraç eden ATPazlar, bakır şaperon proteinleri ve bakıra duyarlı transkripsiyonel düzenleyiciler yoluyla bakırın alımını, dağılımını ve atılımını düzenler (Şekil 4). Bu bileşenler, hücre içi bakır seviyelerine yanıt olarak bakır bağlayıcı ve taşıma proteinlerinin ekspresyonunu modüle ederek, toksisiteyi önlerken temel işlemler için uygun bir konsantrasyon sağlar18.

Şekil 4: Gram pozitif (A) ve gram negatif (B) bakterilerde bakır homeostazı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
CuNP'lerin bakterisidal etkisinin, bakır homeostaz mekanizmalarının bozulması ile yakından ilişkili olduğunu varsayıyoruz. Bakteriler aşırı bakır tarafından boğulduğunda, normal düzenleyici süreç devam edemez, bu da ROS oluşumu ve bakteriyel PCD sisteminin aktivasyonu yoluyla oksidatif strese yol açar. Bu da önemli protein sentezini aşağı regüle eder ve ölümle ilgili proteinlerin üretimini teşvik eder. Modülatörlerin uygulanması, bu ajanların bakteri sağkalımını nasıl artırabileceğini gösterir, bu da CuNP'nin neden olduğu bakteri öldürmenin otofaji ve proteoliz gibi süreçlere de müdahale ettiğini ve sonuçta bakteri ölümüyle sonuçlandığını gösterir. Bu sonuçlar, CuNP ile indüklenen bakteriyel ölümde PCD yolaklarının önemini vurgulamaktadır.
Tartışmalar
Bu çalışmada E. coli, S. aureus ve A. baumannii'ye karşı iki boyutta ve çeşitli konsantrasyonlarda CuNP'lerin antimikrobiyal etkileri ve mekanizmaları araştırılmıştır. Belirlenen protokoller kullanılarak, CuNP ile indüklenen bakterisidal etkilerin oksidatif stres ve potansiyel PCD aktivasyonunu içerdiği gözlenmiştir. Bununla birlikte, metal homeostazı ve bakteriyel stres tepkileri arasındaki etkileşim büyük ölçüde keşfedilmemiştir. Önceki çalışmalar, CuNP duyarlılığını etkileyebilecek bakır akış pompaları ve metal bağlayıcı proteinler gibi bakteriyel direnç stratejilerini tanımlamıştır19. Ayrıca, bakır iyonlarının potansiyel sitotoksisitesi, terapötik uygulamalar için bir endişe kaynağı olmaya devam etmekte ve dikkatli dozaj optimizasyonuna olan ihtiyacı vurgulamaktadır20. CuNP'lerin bakterisidal mekanizmalarının daha derin bir şekilde anlaşılması, güvenli ve etkili kullanımlarını ilerletmek için çok önemlidir.
Buradaki tartışma, bu yöntemin usule ilişkin yönlerini ve bunların sonuçlarını vurgulayacaktır. Protokolün kritik adımları, uygun CuNP hazırlığı ve dispersiyonunu, tekrarlanabilir sonuçlar için 600 nm'de (OD600) 0.5'lik bir optik yoğunlukta tek tip bakteri kültürlerinin sağlanmasını ve agregasyonu önlemek için CuNP solüsyonlarında bakteri peletlerinin doğru şekilde yeniden süspansiyonunu içerir. Özellikle CuNP maruziyeti ile ilgili olarak modülatör eklemenin uygun sırası, etkili deneysel sonuçlar için çok önemlidir. Negatif (PBS) ve pozitif (%70 alkol) kontrollerin yanı sıra CuNP boş kontrolü de dahil olmak üzere kontrol tedavileri, temel canlılığı belirlemek ve gözlenen etkilerin doğrudan CuNP tedavisi ile ilişkili olmasını sağlamak için gereklidir.
Yöntem ayrıca, bakterisidal aktivitenin doğru bir şekilde değerlendirilmesi için koloni sayımını PrestoBlue testi ile birleştiren kantitatif hücre canlılığı ölçümlerini de içerir. Ek olarak, H2DCFDA boya ve akış sitometrisi kullanılarak ROS tespiti, CuNP'lerin neden olduğu oksidatif stresi anlamak için önemli bir analitik adımdır ve ROS üretimini bakteriyel hücre ölümüne katkıda bulunan bir faktör olarak belirler. Yöntemin modifikasyonları ve sorun gidermeleri, her bir bakteri suşunun duyarlılığına dayalı olarak modülatör konsantrasyonlarının ayarlanmasına, inkübasyon sürelerinin optimize edilmesine ve ROS'u doğru bir şekilde tespit etmek için uygun akış sitometrisi ayarlarının sağlanmasına odaklanır. Bununla birlikte, çalışma, yalnızca üç bakteri suşuna odaklanması ve PCD modülatörlerinin farklı bakteri türleri arasındaki etkilerindeki potansiyel değişkenlik ile sınırlıdır. Daha küçük CuNP'lerin daha fazla bakterisidal aktivite göstermesiyle boyuta bağlı bir etki gözlendi, ancak etkilerini tam olarak anlamak için boyut ve konsantrasyon değişimlerinin daha fazla araştırılmasına ihtiyaç var.
Bu yöntem, CuNP'leri potansiyel antimikrobiyal ajanlar olarak değerlendirmek için kapsamlı bir yaklaşım sağlar. Koloni tahlilleri, hücre canlılık testleri, ROS tespiti ve PCD modülatör çalışmalarının birleştirilmesi, CuNP bakterisidal mekanizmalarının çok yönlü bir şekilde anlaşılmasını sağlar. Bu çalışma, CuNP'lerin ilaca dirençli bakterilerle mücadeledeki potansiyelini vurgulamakta ve bakteriyel PCD yollarını manipüle eden hedefe yönelik antimikrobiyal tedaviler geliştirmek için fırsatlar sunmaktadır. Ayrıca, yöntemin uygulamaları, enfeksiyonları önlemek için tıbbi cihazlar için CuNP bazlı biyomateryal kaplamaların geliştirilmesine kadar uzanır. Bakteriyel PCD'yi anlamak için temel bir araç olan bu protokol, bakteri biyolojisi ve antimikrobiyal stratejilere yönelik araştırmaları ilerletmek için değerli bir kaynaktır.
Açıklamalar
Yazar, finansal veya başka türlü herhangi bir çıkar çatışması beyan etmez.
Teşekkürler
Tayvan'daki Tzu Chi Üniversitesi Çekirdek Tesis Merkezi'nden gelen destek için minnettarız.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Acinetobacter baumannii Bouvet and Grimont strain | American Type Culture Collection (ATCC), Manassas, VA, USA | 17978 | Bacteria for CuNP toxocity experiment |
| Bio-Rad iMark Microplate Reader | Bio-Rad Laboratories, Hercules, CA, USA | 168-1130 | Used to measure absorbance in bacterial viability assays. |
| cell-permeant 2’,7’-dichlorodihydrofluorescein diacetate (H2DCFDA) | Sigma-Aldrich, Saint Louis, MO, USA | D6883 | Used for detecting reactive oxygen species (ROS) in treated bacterial cells. |
| Copper nanoparticles (CuNPs) 25 nm | Sigma-Aldrich, St. Louis, MO, USA | 774081 | Used to prepare CuNP stock solution |
| Copper nanoparticles (CuNPs) 60-80 nm | Sigma-Aldrich, St. Louis, MO, USA | 774103 | Used to prepare CuNP stock solution |
| Escherichia coli (Migula) Castellani and Chalmers | American Type Culture Collection (ATCC), Manassas, VA, USA | 25922 | Bacteria for CuNP toxocity experiment |
| Gallios flow cytometer | Beckman Coulter, Brea, CA, USA | Used for flow cytometric analysis in multiple experiments, including reactive oxygen species detection. | |
| LB agar | FocusBio, Miaoli, Taiwan | LBA500 | Used for culturing bacteria |
| Luria-Bertani (LB) broth | Becton, Dickinson and Company, Sparks, MD, USA | 244620 | Used for culturing bacteria |
| Necrosulfonamide (NSA) | Sigma-Aldrich, St. Louis, MO, USA | 480073 | Used as a modulator for pretreatment in bacterial death pathway studies. |
| PrestoBlue Cell Viability Reagent | Invitrogen, Carlsbad, CA, USA | P50200 | Used for assessing cell viability via fluorescence. |
| SBI-0206965 (SBI) | BioVision, Milpitas, CA, USA | 9580 | Used as a modulator for pretreatment in bacterial death pathway studies. |
| Sodium dodecyl sulfate (SDS) | Sigma-Aldrich, St. Louis, MO, USA | L4509 | Used as a dispersant for copper nanoparticles to reduce aggregation. |
| Staphylococcus aureus | American Type Culture Collection (ATCC), Manassas, VA, USA Bioresource Collection and Research Center (BCRC), Hsinchu, Taiwan | 13567 | Bacteria for CuNP toxocity experiment |
| Varioskan LUX multimode microplate reader | Thermo Fisher Scientific, Waltham, MA, USA | VLBLATGD2 | Used for measuring fluorescence in cell viability assays |
| Wortmannin (Wort) | Abcam, MA, USA | ab120148 | Used as a modulator for pretreatment in bacterial death pathway studies. |
| Z-VAD-FMK (Z-VAD) | Sigma-Aldrich, St. Louis, MO, USA | V116 | Used as a modulator for pretreatment in bacterial death pathway studies. |
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır