Method Article
دراسة موت الخلايا المبرمج الناجم عن الجسيمات النانوية للنحاس في البكتيريا
In This Article
Summary
تعمل جزيئات النحاس النانوية كعوامل مضادة للميكروبات عن طريق توليد أنواع الأكسجين التفاعلية. هنا ، يتم تقديم الإجراءات التي توضح أن جزيئات النحاس النانوية فعالة ضد ثلاثة مسببات الأمراض ذات الصلة سريريا وأن بعض مسارات موت الخلايا المبرمجة تشارك في هذه العملية المضادة للجراثيم.
Abstract
في الآونة الأخيرة ، ازدادت المخاوف بشأن مسببات الأمراض المقاومة للأدوية المتعددة والالتهابات المستعصية بسبب الإفراط في استخدام المضادات الحيوية وإساءة استخدامها. اكتسبت المواد النانوية ، مثل الجسيمات النانوية للأكسيد المعدني والمعدني ، شعبية في المجال الطبي الحيوي كاستراتيجيات جديدة محتملة لمكافحة مسببات الأمراض المقاومة للأدوية المتعددة. بحثت هذه الدراسة في استخدام جزيئات النحاس النانوية (CuNPs) كمبيد للجراثيم ضد ثلاثة مسببات الأمراض الانتهازية الشائعة المكتسبة من المستشفى - الإشريكية القولونية (الإشريكية القولونية) ، Acinetobacter baumannii (A. baumannii) ، والمكورات العنقودية الذهبية (S. aureus) - والتي تطور بشكل متزايد مقاومة للأدوية. يتم تقديم بروتوكولات مفصلة لتصنيع CuNPs بحجمين (20 نانومتر و 60 نانومتر) وتقييم فعاليتها في مبيد الجراثيم من خلال فحوصات المستعمرة. تم استكشاف آليات العمل المضاد للميكروبات الكامنة وراء CuNPs من خلال تقييم التغيرات في إنتاج أنواع الأكسجين التفاعلية. بالإضافة إلى ذلك ، تم تطبيق أربعة معدلات تثبط وظائف البروتين البشري لدراسة المشاركة المحتملة لمسارات موت الخلايا المبرمجة (PCD) في قتل البكتيريا. من خلال هذا النهج ، يقترح الظهور المحتمل لسلالات مقاومة للنحاس ، بناء على البحث في بروتينات توازن النحاس ، بما في ذلك منظمات النسخ المعتمدة على النحاس. توفر هذه النتائج منهجية شاملة لدراسة التأثيرات المبيدة للجراثيم لعصا المضغوطات ودورها المحتمل في معالجة مقاومة المضادات الحيوية.
Introduction
البكتيريا المقاومة للأدوية هي سبب خطير للقلق في الطب. أدى ظهورها السريع إلى تقليل فعالية المضادات الحيوية التقليدية ، مما أدى إلى المزيد من المضاعفات السريرية. إنها تشكل تهديدا كبيرا للصحة العامة وتخلق حاجة ملحة لعوامل جديدة مضادة للميكروبات. أحد طرق البحث هو المواد النانوية. تمتلك المواد النانوية خصائص فيزيائية وكيميائية فريدة تسمح لها بالتفاعل مع الميكروبات بطرق تضر بقدرتها على البقاء. على سبيل المثال ، تحفز الجسيمات النانوية الفضية (AgNPs) الإجهاد التأكسدي في البكتيريا ، مما يؤدي إلى خلل في البروتين ، واضطراب الغشاء ، وتلف الحمض النووي ، وموت الخلايافي النهاية 1. من ناحية أخرى ، تشتهر جزيئات الذهب النانوية (AuNPs) بخصائصها المضادة للفطريات ويمكن أن تعزز التأثير المبيد للجراثيم للمضادات الحيوية من خلال العمل كناقلات2.
بالإضافة إلى ذلك ، جذبت جزيئات النحاس النانوية (CuNPs) أيضا اهتماما كبيرا بسبب تأثيرها القوي المضاد للميكروبات وتكلفة الإنتاج المنخفضة. تشير الدراسات إلى أن CuNPs تظهر نشاطا واسع الطيف للجراثيم عن طريق تعطيل النشاط الأنزيمي وتوليد أنواع الأكسجين التفاعلية (ROS)3. تسهل الشحنة الموجبة ل CuNPs اختراقها في البكتيريا ، مما يعزز امتصاصها الخلوي4. هذه الآلية تجعل CuNPs خيارا واعدا لطلاء الأسطح ، مثل الغرسات ، لمنع العدوى3. ومع ذلك ، فإن إحدى النتائج المثيرة للاهتمام هي أن التأثير المبيد للجراثيم ل CuNPs يبدو أنه يعتمد على الحجم. وجدت بعض الدراسات أن CuNPs الأصغر تظهر نشاطا مضادا للبكتيريا أعلى ، ربما بسبب نسبة مساحة السطح إلى الحجمالفائقة 5.
يتسبب توليد ROS في تلف واسع النطاق للخلايا والبكتيريا ، بما في ذلك بيروكسيد الدهون ، وخلل البروتين ، وتجزئة الحمض النووي ، وتثبيط استحداث السكر / تحلل الجليكوجين ، ويشارك في النخر أو موت الخلايا المبرمج (PCD) 6،7،8. كشفت الدراسات الحديثة أن أنظمة PCD موجودة في البكتيريا ، مع أنماط عمل ومؤثرات مشابهة لتلك الموجودة في أنظمة حقيقيةالنواة 9. يمكن للمجتمعات البكتيرية أن تحفز PCD استجابة للإجهاد ، بما في ذلك الإجهاد التأكسدي ، من خلال نظام مضاد السموم (TA)10. بعبارات بسيطة ، يتكون نظام السموم المضاد للسموم من السموم التي يمكن أن تعطل العمليات الخلوية الأساسية ومضادات السموم التي يمكن أن تشكل مجمعات مستقرة مع السموم لتثبيط سميتها في ظل ظروف النمو العادية. تحتوي معظم البكتيريا والعتائق على مواقع TA في جينوماتها ، وغالبا ما توجد في نسخ متعددة من الحمض النووي خارج الكروموسومات والكروموسومات. هناك عدة أنواع من أنظمة TA ، مع النوع الثاني TA (المعروف باسم وحدة MazE / MazF) ذات أهمية خاصة. في ظل ظروف الإجهاد ، تتحلل مضادات السموم ، مما يسمح للسموم بتثبيط أهدافها الخلوية. في الإشريكية القولونية والمكورات العنقودية الذهبية ، يتم تنشيط السم MazF استجابة لظروف الإجهاد مثل الإجهاد التأكسدي وارتفاع درجة الحرارة ومجاعة الأحماض الأمينية. وبالتالي ، يتم تقليل التعبير عن مضاد السموم MazE ، مما يؤدي إلى إطلاق السم MazF10. وجدت الدراسات أن MazF يتيح تخليق البروتينات التي تسمح لمجموعة سكانية فرعية صغيرة بالبقاء على قيد الحياة في ظل ظروف معاكسة ، بينما يخضع معظم السكان لموت الخلايا بوساطة mazEF. يمكن أن يكون موت الخلية هذا إما معتمدا على ROS ، حيث يحفز ROS تثبيط النسخ أو الانتقالي ، أو مستقلا عن ROS ، حيث يؤدي تلف الحمض النووي إلى مسارات الموت11.
تستكشف هذه الدراسة الآليات التي تحفز بها CuNPs الموت البكتيري. بدلا من التركيز فقط على نظام TA ، تم استخدام أربعة معدلات PCD ، مستخدمة سابقا في بحثنا7،12 ، للتحقيق في مسارات PCD المحتملة في البكتيريا.
من خلال فحص التأثيرات القاتلة للجراثيم ل CuNPs بحجمين مختلفين (20 و 60 نانومتر) بتركيزات متفاوتة ، واستخدام طرق مثل فحوصات المستعمرة ، واكتشاف ROS ، ومعدلات PCD (SBI و Z-VAD و NSA و Wortmannin) ، يسلط هذا البحث الضوء على أن PCD ليس حصريا للكائنات متعددة الخلايا ولكنه يحدث أيضا في المجتمعات البكتيرية تحت الضغط. من خلال توفير بروتوكولات مفصلة ، يهدف هذا العمل إلى تمكين الباحثين من تقييم فعالية CuNP وآليات مبيد الجراثيم في أنظمتهم الخاصة. علاوة على ذلك ، تعمل هذه النتائج على تعزيز فهم PCD البكتيري ودعم تطوير العلاجات القائمة على CuNP لمكافحة البكتيريا المقاومة للمضادات الحيوية.
Protocol
الكواشف والمعدات المستخدمة في هذه الدراسة مدرجة في جدول المواد.
1. تحضير جسيمات النحاس النانوية
- الحصول على مساحيق النحاس النانوية التجارية (25 نانومتر و 60-80 نانومتر) من مصدر تجاري.
- استخدم 1.0 ملي مولار كبريتات دوديسيل الصوديوم (SDS) كمشتت لحجمين من الجسيمات النانوية 1 مجم / مل.
- قم بتفريق الجسيمات النانوية باستخدام حمام بالموجات فوق الصوتية لمدة 30 دقيقة على الأقل في درجة حرارة الغرفة. ثم تكون الجسيمات النانوية المشتتة بالكامل جاهزة للاستخدام في التجارب اللاحقة.
2. تحضير البكتيريا
- احصل على الإشريكية القولونية (Migula) كاستيلاني وشالمرز سلالة 25922 و A. baumannii Bouvet و Grimont سلالة من مجموعة ثقافة النوع الأمريكي. احصل على المكورات العنقودية الذهبية من مركز جمع وأبحاث الموارد الحيوية.
- استزراع البكتيريا في مرق لوريا بيرتاني (LB) في الظروف الهوائية عند 37 درجة مئوية.
- تمييع الثقافات البكتيرية في وسط LB إلى كثافة بصرية عند 600 نانومتر (OD600) تبلغ حوالي 0.5.
3. تقييم جدوى الخلية
- فحص المستعمرة
- استخدم محاليل CuNP (1 ملغم/مل) لتحضير تركيزات مختلفة من حجمين من Nics، بما في ذلك 0 ميكروغرام/مل، و1 ميكروغرام/مل، و5 ميكروغرام/مل، و10 ميكروغرام/مل، و50 ميكروغرام/مل، و100 ميكروغرام/مل.
- قسم المزارع البكتيرية المحضرة في الخطوة 2.3 إلى أنابيب طرد مركزي دقيقة وأجهزة طرد مركزي عند 3300 × جم لمدة 10 دقائق في درجة حرارة الغرفة.
- احتفظ بالكريات البكتيرية وأضف تركيزات مختلفة من حجمين من CuNPs، على التوالي، مع سحب العينة اللطيف.
- عالج الكريات البكتيرية باستخدام PBS و 70٪ كحول كعناصر تحكم سلبية وإيجابية ، على التوالي.
- احتضان جميع البكتيريا المعالجة بالرج عند 200 دورة في الدقيقة عند 37 درجة مئوية لمدة 24 ساعة.
- بعد الحضانة ، اغسل جميع البكتيريا المعالجة باستخدام PBS وانشرها على ألواح LB أجار. ضع الألواح في حاضنة 37 درجة مئوية لمدة 24 ساعة.
- احسب أرقام المستعمرات في كل مجموعة علاج في اليوم التالي وقم بإجراء تحليل إحصائي. يوصى بإجراء ذلك ثلاث نسخ من أجل الدقة الإحصائية.
- دراسة آلية مبيد الجراثيم
- قم بإعداد البكتيريا كما هو موضح في الخطوة 3.1.2 ومعالجتها إما ب 5 ميكرومتر من SBI-0206965 (SBI) لمدة ساعتين ، أو 0.5 ميكرومتر من نيكروسلفوناميد (NSA) لمدة ساعة واحدة ، أو 100 نانومتر من نبتة الشعير (نقيع) لمدة 30 دقيقة ، أو 100 نانومتر من Z-VAD-FMK (Z-VAD) لمدة 30 دقيقة.
- تعاالج البكتيريا بتركيزات مختلفة من حجمين من محاليل CuNP ، كما هو موضح في الخطوة 3.1.1 ، في وجود أو عدم وجود 5 ميكرومتر من SBI ، و 0.5 ميكرومتر من NSA ، و 100 نانومتر من نقيع الشعير ، و 100 نانومتر من Z-VAD.
- الطرد المركزي للبكتيريا بعد العلاجات المغير (الخطوة 3.2.1) وإزالة المواد الطافية.
- أعد تعليق الكريات البكتيرية في المحاليل المحضرة في الخطوة 3.2.2 واحتضانها بالرج عند 200 دورة في الدقيقة عند 37 درجة مئوية لمدة 24 ساعة.
- عالج البكتيريا بنسبة 70٪ من الإيثانول و PBS كعناصر تحكم إيجابية وسلبية ، على التوالي. استخدم محلولا بدون CuNPs كعنصر تحكم فارغ CuNP (0 ميكروغرام / مل ؛ وهمي) في ظل نفس ظروف المثبط لكل مجموعة. احتضان جميع العينات لمدة 24 ساعة إضافية.
- بعد الحضانة ، أضف كاشف صلاحية الخلية إلى الثقافات بنسبة حجم 1:10. احتضان الثقافات لمدة ساعتين أخرى مع الاهتزاز عند 37 درجة مئوية.
- الطرد المركزي الثقافات (الخطوة 3.1.2) بعد حضانة 2 ساعة. انقل المواد الطافية الفلورية إلى 96 بئرا من الأطباق. قم بقياس التألق باستخدام طول موجي للإثارة يبلغ 560 نانومتر وطول موجة انبعاث يبلغ 590 نانومتر باستخدام قارئ صفيحة دقيقة.
- خفف المادة الطافية المتبقية إلى 10-5 و 10-4 ووزعها على ألواح أجار LB للزراعة.
- عد المستعمرات الفردية في اليوم التالي.
4. الكشف عن أنواع الأكسجين التفاعلية
- قم بإعداد المزارع البكتيرية كما هو موضح في الخطوة 2.3 وقسمها إلى أنابيب طرد مركزي دقيقة.
- عالج البكتيريا التي تعاني من ظروف الإجهاد المختلفة كمجموعات تحكم إيجابية مسببة ل ROS (البيانات غير معروضة في النتائج). يتم وصف العلاجات في الخطوات 4.2.1-4.2.4.
- تعريض البكتيريا لضوء الأشعة فوق البنفسجية 405 نانومتر لمدة 3 ساعات. احتضان البكتيريا عند 45 درجة مئوية لمدة 2 ساعة.
- بعد ذلك ، احتضان البكتيريا عند 4 درجات مئوية لمدة ساعتين.
- عالج البكتيريا بنسبة 3٪ H2O2 لمدة 30 دقيقة.
- الحفاظ على البكتيريا عند 37 درجة مئوية في مرق LB كعنصر تحكم سلبي.
- تحضير تركيزات مختلفة من CuNPs كما هو موضح في الخطوة 3.1.1 ، ومعالجة البكتيريا ب 20 نانومتر أو 60 نانومتر CuNPs بتركيزات 1 ميكروغرام / مل و 5 ميكروغرام / مل و 10 ميكروغرام / مل و 100 ميكروغرام / مل لمدة 24 ساعة.
- اغسل البكتيريا المحتضنة مرتين باستخدام PBS لإزالة أي جزيئات نانوية متبقية.
- تحضير صبغة 2 ′ ، 7 ′-ثنائي كلورو ثنائي هيدروفلوريسين ثنائي الأسيتات (H2DCFDA) في PBS بتركيز نهائي قدره 5 ميكرومتر.
- أعد تعليق الكريات البكتيرية في 5 ميكرومتر من H2DCFDA وقم بقياس شدة التألق عند انبعاث 520/30 نانومتر باستخدام مقياس التدفق الخلوي.
ملاحظة: ترتبط شدة التألق الأخضر FL1 بمستوى ROS في الثقافة المعالجة. يوصى بإجراء ذلك ثلاث نسخ للحصول على الدقة الإحصائية.
النتائج
الأنشطة المضادة للميكروبات لنانوNPs ذات الحجمين في ثلاثة مسببات الأمراض
تم استخدام ثلاثة مسببات الأمراض الانتهازية (الإشريكية القولونية ، المكورات العنقودية الذهبية ، و A. baumannii) لاختبار الأنشطة القاتلة للجراثيم من CuNPs. عولجت البكتيريا ب 0 ميكروغرام / مل ، 1 ميكروغرام / مل ، 5 ميكروغرام / مل ، 10 ميكروغرام / مل ، 50 ميكروغرام / مل ، و 100 ميكروغرام / مل من 20 نانومتر أو 60 نانومتر CuNPs ، وتم تحديد أنشطة مبيد الجراثيم باستخدام الحد الأدنى لتركيز مبيد الجراثيم (MBC) المشتق من تعداد المستعمرات. أظهرت نتائجنا آثارا إيجابية على الجراثيم لكلا الحجمين من CuNPs (الشكل 1) لجميع السلالات الثلاثة. في بكتريا قولونية ، لوحظت انخفاضات كبيرة في أعداد المستعمرات بدءا من 1 ميكروغرام / مل و 5 ميكروغرام / مل لعلاجات CuNP 20 نانومتر و 60 نانومتر ، على التوالي (الشكل 1 أ). في المقابل ، انخفاضات ملحوظة في عدد المستعمرات ل S. الذهب تم عرضها عبر جميع التركيزات لكلا الحجمين من CuNPs (الشكل 1 ب). بالنسبة إلى A. baumannii ، كانت هناك حاجة إلى تركيزات أعلى من CuNPs (5 ميكروغرام / مل في 20 نانومتر CuNPs و 10 ميكروغرام / مل في 60 نانومتر CuNPs) لتحقيق انخفاض في عدد المستعمرات (الشكل 1 ج).
أشارت دراساتنا السابقة إلى أن CuNPs الأصغر (20 نانومتر) تظهر قدرة أكثر استثنائية على مبيد الجراثيم مقارنة بتلك الأكبر (60 نانومتر) 7،12. هنا ، تم عرض اتجاهات مماثلة ، مما يشير إلى النتائج المتسقة. علاوة على ذلك ، تشير هذه النتائج إلى أن البكتيريا موجبة الجرام (في هذه الحالة ، المكورات العنقودية الذهبية) أكثر عرضة للإصابة ب CuNPs من البكتيريا سالبة الجرام المختبرة (الإشريكية القولونية و A. baumannii).

الشكل 1: النشاط المبيد للجراثيم لعصا النحاس بحجمين مختلفين في ثلاثة أنواع بكتيرية. بكتريا قولونية (A) و S. aureus (B) و A. baumannii (C) تمت معالجتها بتركيزات متفاوتة من 20 نانومتر أو 60 نانومتر CuNPs ، وتم تحديد عدد المستعمرات البكتيرية. PBS- و 70٪ من البكتيريا المعالجة بالكحول بمثابة ضوابط سلبية وإيجابية ، على التوالي. يتم التعبير عن البيانات كمتوسط ± الانحراف المعياري (SD) من أربع تجارب مستقلة ، تم إجراء كل منها ثلاث نسخ. تم تحديد القيم المتطرفة من خلال الفحص البصري. تم استخدام اختبار شابيرو ويلك لتقييم طبيعية البيانات. أجريت المقارنات الإحصائية باستخدام اختبار t للطالب. تشير العلامات النجمية (*) وعلامات الجنيه (#) إلى P < 0.05 لعلاجات CuNP 20 نانومتر و 60 نانومتر بالنسبة للتحكم السلبي ، على التوالي. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
الضرر المميت للبكتيريا عن طريق توليد ROS الناجم عن CuNP
تختلف الآليات المقترحة التي تقتل بها CuNPs البكتيريا. تتم مناقشة نظريتين أساسيتين: استبدال بروتينات عنقودية الحديد والكبريت بالنحاس المنبعث من الجسيمات النانوية ، وإنتاج ROS الناجم عن CuNP13،14. تم تقييم إنتاج ROS في ثلاث بكتيريا معالجة ب CuNP لاستكشاف الآليات (الشكل 2). الإشريكية القولونية ، العقدية العنقودية الذهبية ، و A. baumannii تمت معالجتها بتركيزات مختلفة من 20 نانومتر أو 60 نانومتر CuNPs ، متبوعا بتطبيق H2DCFDA للكشف عن ROS. تم قياس أجزاء عالية من مجموعات الفلورسنت الخضراء عن طريق قياس التدفق الخلوي في جميع تركيزات معالجات CuNP 20 نانومتر و 60 نانومتر (الشكل 2). ومن المثير للاهتمام أن مجموعات الخلايا الإيجابية في علاجات CuNP 20 نانومتر كانت مستقلة عن التركيز (الشكل 2 أ). والجدير بالذكر أن التركيزات المنخفضة من 20 نانومتر من CuNPs تسببت في توليد أعلى من أنواع الأكسجين التفاعلية ، بينما أظهرت التركيزات الأعلى جزءا أقل من الخلايا الموجبة. ومع ذلك ، لم يتم ملاحظة هذه الظاهرة في الخلايا المعالجة ب CuNP 60 نانومتر (الشكل 2 ب). لم يتم ملاحظة فروق ذات دلالة إحصائية بين البكتيريا الثلاث المعالجة إما ب 20 نانومتر أو 60 نانومتر CuNPs (الشكل 2). تم الكشف عن ارتفاعات خفيفة في المجموعات الإيجابية في 0 ميكروغرام / مل ، والتي يمكن أن تعزى إلى المشتتات وضغط التناضح (الشكل 2).

الشكل 2: توليد ROS بعد المعالجة باستخدام CuNPs بحجمين مختلفين في ثلاثة أنواع بكتيرية. الإشريكية القولونية ، المكورات العنقودية الذهبية ، و A. baumannii تعرضت لتركيزات مختلفة من 20 نانومتر (A) أو 60 نانومتر (B) CuNPs. تم تقييم إنتاج ROS باستخدام تلطيخ H2DCFDA بعد معالجة CuNP ، وتم تحليل جزء الخلايا الإيجابية للفلورسنت بواسطة قياس التدفق الخلوي. يتم تقديم البيانات كمتوسط ± SD من خمس تجارب مستقلة ، تم إجراء كل منها في ثلاث نسخ. تم تحديد القيم المتطرفة من خلال الفحص البصري. تم استخدام اختبار شابيرو ويلك لتقييم طبيعية البيانات. أجريت المقارنات الإحصائية باستخدام تحليل Kruskal-Wallis أحادي الاتجاه. تشير الرموز (* و # و $) إلى P < 0.05 لمعالجات CuNP 20 نانومتر و 60 نانومتر بالنسبة للتحكم السلبي ، على التوالي. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
كشفت أربعة معدلات PCD عن آليات الموت البكتيري ل CuNPs
تم استخدام أربعة معدلات PCD في التجارب اللاحقة لاستكشاف آليات موت الخلايا الناجمة عن علاجات CuNP في ثلاثة مسببات الأمراض. من المعروف أن هذه المعدلات - SBI و Z-VAD و NSA و Wort - تمنع مسارات نقل الإشارة المرتبطة بموت الخلايا المبرمج (Z-VAD) ، والالتهام الذاتي (SBI و Wort) ، والتشريح (NSA) في خلايا الثدييات15-17. أشارت الدراسات إلى أن PCD لا يقتصر على الكائنات متعددة الخلايا. لوحظت أشكال مختلفة من PCD في المستعمرات البكتيرية استجابة للظروف القاسية ، مما يفيد المستعمرة بأكملها ويسهل استراتيجيات التكيفية مثل التحول الجيني وتكوين الأغشيةالحيوية 10. بناء على هذا الفهم ، درسنا ما إذا كانت المسارات المرتبطة ب PCD تساهم في موت الخلايا الناجم عن CuNP في البكتيريا. البكتيريا الثلاث ، الإشريكية القولونية ، المكورات العنقودية الذهبية ، و A. baumannii ، تمت معالجتها مسبقا باستخدام المعدلات الأربعة ، تليها المعالجة المشتركة بحجمين من CuNPs والمغيرات (الشكل 3).
أظهرت صلاحية الخلية انخفاضا يعتمد على التركيز في كلا الحجمين من علاجات CuNP في ثلاث بكتيريا (الشكل 3) ، بما يتفق مع النتائج المعروضة في الشكل 1. في الإشريكية القولونية ، لوحظت زيادة في البقاء على قيد الحياة في مجموعة Z-VAD تحت معالجة 1 ميكروغرام / مل و 5 ميكروغرام / مل من 20 نانومتر CuNPs ، وكذلك في مجموعة NSA الخاضعة للعلاج ب 10 ميكروغرام / مل من 20 نانومتر CuNPs (الشكل 3 أ). ومع ذلك ، كان Z-VAD فعالا في إنقاذ البقاء على قيد الحياة في الإشريكية القولونية عبر جميع تركيزات علاجات 60 نانومتر من CuNP ، ولكن ليس عند 100 ميكروغرام / مل (الشكل 3 ب). نتائج الجدوى المختلفة في المكورات العنقودية الذهبية تشير إلى مسارات معينة للجراثيم في علاجات CuNP 20 نانومتر (الشكل 3 ج). لعبت NSA دورا مهما في جميع تركيزات معالجات CuNP 20 نانومتر ، بينما كان Z-VAD فعالا فقط عند 1 ميكروغرام / مل من 20 نانومتر CuNPs. لم تظهر المكورات العنقودية الذهبية أي استجابة للمعدلات بأي تركيز ، باستثناء Z-VAD عند 10 ميكروغرام / مل من معالجات CuNP 60 نانومتر (الشكل 3 د). اتجاهات مماثلة في معدلات بقاء الخلايا لتلك التي لوحظت في بكتريا قولونية لوحظت في A. baumannii المعالجة ب 20 نانومتر CuNPs (الشكل 3E). كان Z-VAD فعالا في الإنقاذ عند 1 ميكروغرام / مل ، و 5 ميكروغرام / مل ، و 10 ميكروغرام / مل في معالجات CuNP 20 نانومتر و 60 نانومتر ، بينما زاد NAS من الجدوى فقط عند 10 ميكروغرام / مل من 20 نانومتر CuNPs. أظهرت SBI آثارها فقط في A. baumannii المعالجة ب 60 نانومتر CuNPs بتركيزات 1 ميكروغرام / مل و 5 ميكروغرام / مل (الشكل 3F).
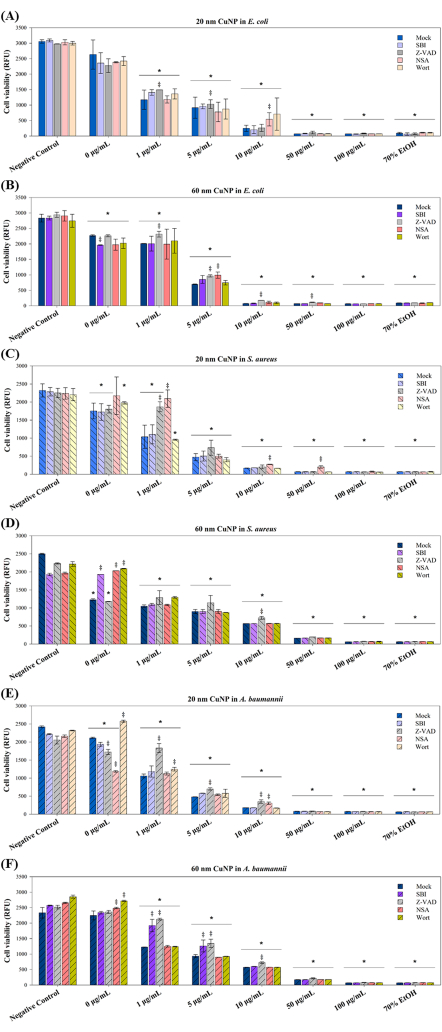
الشكل 3: تأثير معدلات PCD على بقاء البكتيريا بعد العلاج باستخدام CuNPs بحجمين مختلفين. الإشريكية القولونية (A,B) والمكورات العنقودية الذهبية (C,D) وA. baumannii (E,F) تمت معالجتها ب PBS (التحكم السلبي) وتركيزات متفاوتة (0 ميكروغرام/مل، 1 ميكروغرام/مل، 5 ميكروغرام/مل، 10 ميكروغرام/مل، 50 ميكروغرام/مل) إما 20 نانومتر أو 60 نانومتر CuNPs في غياب (وهمي) أو وجود معدلات PCD SBI ، Z-VAD و NSA و Wort. كانت البكتيريا المعالجة بالكحول بنسبة 70٪ بمثابة عنصر تحكم إيجابي. تم تقييم صلاحية الخلية باستخدام مقايسة الجدوى المتاحة تجاريا. يتم تقديم البيانات كمتوسط ± SD من ثلاث تجارب مستقلة على الأقل ، تم إجراء كل منها ثلاث نسخ. تم تحديد القيم المتطرفة من خلال الفحص البصري. تم استخدام اختبار شابيرو ويلك لتقييم طبيعية البيانات. تم إجراء المقارنات الإحصائية باستخدام ANOVA واختبار Student's t-test. تشير علامة النجمة (*) إلى P < 0.05 لمعالجات CuNP مقارنة بالتحكم السلبي ، بينما يشير التقاطع المزدوج (‡) إلى P < 0.05 للمقارنات بين المعدلات الوهمية والمغيرات الأخرى عند كل تركيز. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
كما لوحظت التأثيرات التآزرية لمبيد الجراثيم مع المشتتات و CuNPs (الشكل 3). حسنت SBI و Wort و NSA قابلية البكتيريا للبقاء في S. aureus عند تعرضها ل SDS في 0 ميكروغرام / مل من 60 نانومتر CuNPs (الشكل 3F). زادت نقيع الشعير من معدلات البقاء على قيد الحياة في A. baumannii المعالجة ب 20 نانومتر و 60 نانومتر CuNPs في مجموعات وهمية (الشكل 3E ، F). زادت وكالة الأمن القومي أيضا من A. baumannii في العلاج الوهمي مع 60 نانومتر CuNPs (الشكل 3F). في المقابل ، خفضت SBI الجدوى في الإشريكية القولونية المعالجة بوهمية 60 نانومتر CuNPs (الشكل 3 ب) ، بينما خفضت Z-VAD و NSA معدلات البقاء على قيد الحياة في A. baumannii المعالجة بوهمية 20 نانومتر CuNPs (الشكل 3 ه). تشير هذه النتائج إلى أن آليات مبيد الجراثيم في هذه البكتيريا الثلاث ، عند معالجتها بمشتتات ، قد تختلف عن تلك التي تنطوي على الجسيمات النانوية.
يعتبر النحاس عنصرا أساسيا للعمليات البيولوجية المختلفة ، ومن الضروري الحفاظ على توازن أيونات النحاس داخل البكتيريا. تنظم المكونات المهمة الموجودة في نظام توازن النحاس في البكتيريا امتصاص النحاس وتوزيعه وإفرازه من خلال ATPases المصدرة للنحاس ، وبروتينات مرافقة النحاس ، ومنظمات النسخ المستجيبة للنحاس (الشكل 4). تعدل هذه المكونات التعبير عن بروتينات ربط النحاس ونقلها استجابة لمستويات النحاس داخل الخلايا ، مما يضمن تركيزا مناسبا للعمليات الأساسية مع منع السمية18.

الشكل 4: توازن النحاس في البكتيريا موجبة الجرام (A) وسالبة الجرام (B). الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.
نفترض أن التأثير المبيد للجراثيم ل CuNPs يرتبط ارتباطا وثيقا بتعطيل آليات توازن النحاس. عندما يغمر النحاس المفرط البكتيريا ، لا يمكن للعملية التنظيمية العادية مواكبة ذلك ، مما يؤدي إلى الإجهاد التأكسدي من خلال توليد ROS وتنشيط نظام PCD البكتيري. وهذا بدوره يقلل من تنظيم تخليق البروتين المهم ويعزز إنتاج البروتينات المرتبطة بالوفاة. يوضح تطبيق المعدلات كيف يمكن لهذه العوامل أن تعزز القدرة على البقاء على قيد الحياة البكتيرية ، مما يشير إلى أن القتل البكتيري الناجم عن CuNP يتداخل أيضا مع عمليات مثل الالتهام الذاتي والتحلل البروتيني ، مما يؤدي في النهاية إلى موت البكتيريا. تسلط هذه النتائج الضوء على أهمية مسارات PCD في الموت البكتيري الناجم عن CuNP.
Discussion
بحثت هذه الدراسة في التأثيرات المضادة للميكروبات وآليات CuNPs بحجمين وتركيزات مختلفة ضد الإشريكية القولونية ، المكورات العنقودية الذهبية ، و A. baumannii. باستخدام البروتوكولات المعمول بها ، لوحظ أن تأثيرات مبيد للجراثيم التي يسببها CuNP تنطوي على الإجهاد التأكسدي والتنشيط المحتمل ل PCD. ومع ذلك ، فإن التفاعل بين التوازن المعدني واستجابات الإجهاد البكتيري لا يزال غير مستكشف إلى حد كبير. حددت الدراسات السابقة استراتيجيات المقاومة البكتيرية ، مثل مضخات تدفق النحاس والبروتينات المرتبطة بالمعادن ، والتي قد تؤثر على قابلية CuNP19. علاوة على ذلك ، تظل السمية الخلوية المحتملة لأيونات النحاس مصدر قلق للتطبيقات العلاجية ، مما يسلط الضوء على الحاجة إلى تحسين الجرعةبعناية 20. يعد الفهم الأعمق لآليات مبيد الجراثيم لعصا النياس أمرا ضروريا لتعزيز استخدامها الآمن والفعال.
ستركز المناقشة هنا على الجوانب الإجرائية لهذه الطريقة وآثارها. تشمل الخطوات الحاسمة للبروتوكول التحضير السليم لقناة CuNP وتشتتها ، وضمان الثقافات البكتيرية الموحدة بكثافة بصرية عند 600 نانومتر (OD600) من 0.5 للحصول على نتائج قابلة للتكرار ، وإعادة تعليق دقيقة للكريات البكتيرية في محاليل CuNP لمنع التجميع. يعد التسلسل الصحيح لإضافة المعدلات ، لا سيما فيما يتعلق بالتعرض ل CuNP ، أمرا بالغ الأهمية للنتائج التجريبية الفعالة. تعتبر علاجات التحكم ، بما في ذلك الضوابط السلبية (PBS) والإيجابية (70٪ كحول) ، بالإضافة إلى التحكم الفارغ CuNP ، ضرورية لإثبات صلاحية خط الأساس وضمان أن التأثيرات الملحوظة مرتبطة ارتباطا مباشرا بعلاج CuNP.
تتضمن الطريقة أيضا قياسات كمية لبقاء الخلايا ، حيث تجمع بين عد المستعمرات ومقايسة PrestoBlue لإجراء تقييم دقيق لنشاط مبيد الجراثيم. بالإضافة إلى ذلك ، يعد اكتشاف ROS باستخدام صبغة H2DCFDA وقياس التدفق الخلوي خطوة تحليلية رئيسية لفهم الإجهاد التأكسدي الناجم عن CuNPs ، مما يؤسس إنتاج ROS كعامل مساهم في موت الخلايا البكتيرية. تركز التعديلات واستكشاف الأخطاء وإصلاحها على ضبط تركيزات المغير بناء على قابلية كل سلالة بكتيرية ، وتحسين أوقات الحضانة ، وضمان إعدادات قياس التدفق الخلوي المناسبة لاكتشاف ROS بدقة. ومع ذلك ، فإن الدراسة محدودة بسبب تركيزها على ثلاث سلالات بكتيرية فقط والتباين المحتمل في تأثيرات معدلات PCD عبر الأنواع البكتيرية المختلفة. ولوحظ تأثير يعتمد على الحجم، حيث أظهرت النيران النووية الأصغر نشاطا أكبر في مبيد الجراثيم، ولكن هناك حاجة إلى مزيد من الاستكشاف لاختلافات الحجم والتركيز لفهم تأثيرها بشكل كامل.
توفر هذه الطريقة نهجا شاملا لتقييم CuNPs كعوامل محتملة مضادة للميكروبات. يوفر الجمع بين فحوصات المستعمرة واختبارات بقاء الخلية واكتشاف ROS ودراسات معدل PCD فهما متعدد الأوجه لآليات مبيد الجراثيم CuNP. تسلط هذه الدراسة الضوء على إمكانات CuNPs في مكافحة البكتيريا المقاومة للأدوية وتقدم فرصا لتطوير علاجات مستهدفة مضادة للميكروبات تتلاعب بمسارات PCD البكتيرية. علاوة على ذلك ، تمتد تطبيقات الطريقة إلى تطوير طلاء المواد الحيوية القائمة على CuNP للأجهزة الطبية لمنع العدوى. كأداة أساسية لفهم PCD البكتيري ، يعد هذا البروتوكول مصدرا قيما لتطوير البحث في البيولوجيا البكتيرية واستراتيجيات مضادات الميكروبات.
Disclosures
يعلن صاحب البلاغ عدم وجود تضارب في المصالح ، مالية أو غير ذلك.
Acknowledgements
نحن ممتنون للدعم المقدم من مركز المرافق الأساسية ، جامعة تزو تشي ، تايوان.
Materials
| Name | Company | Catalog Number | Comments |
| Acinetobacter baumannii Bouvet and Grimont strain | American Type Culture Collection (ATCC), Manassas, VA, USA | 17978 | Bacteria for CuNP toxocity experiment |
| Bio-Rad iMark Microplate Reader | Bio-Rad Laboratories, Hercules, CA, USA | 168-1130 | Used to measure absorbance in bacterial viability assays. |
| cell-permeant 2’,7’-dichlorodihydrofluorescein diacetate (H2DCFDA) | Sigma-Aldrich, Saint Louis, MO, USA | D6883 | Used for detecting reactive oxygen species (ROS) in treated bacterial cells. |
| Copper nanoparticles (CuNPs) 25 nm | Sigma-Aldrich, St. Louis, MO, USA | 774081 | Used to prepare CuNP stock solution |
| Copper nanoparticles (CuNPs) 60-80 nm | Sigma-Aldrich, St. Louis, MO, USA | 774103 | Used to prepare CuNP stock solution |
| Escherichia coli (Migula) Castellani and Chalmers | American Type Culture Collection (ATCC), Manassas, VA, USA | 25922 | Bacteria for CuNP toxocity experiment |
| Gallios flow cytometer | Beckman Coulter, Brea, CA, USA | Used for flow cytometric analysis in multiple experiments, including reactive oxygen species detection. | |
| LB agar | FocusBio, Miaoli, Taiwan | LBA500 | Used for culturing bacteria |
| Luria-Bertani (LB) broth | Becton, Dickinson and Company, Sparks, MD, USA | 244620 | Used for culturing bacteria |
| Necrosulfonamide (NSA) | Sigma-Aldrich, St. Louis, MO, USA | 480073 | Used as a modulator for pretreatment in bacterial death pathway studies. |
| PrestoBlue Cell Viability Reagent | Invitrogen, Carlsbad, CA, USA | P50200 | Used for assessing cell viability via fluorescence. |
| SBI-0206965 (SBI) | BioVision, Milpitas, CA, USA | 9580 | Used as a modulator for pretreatment in bacterial death pathway studies. |
| Sodium dodecyl sulfate (SDS) | Sigma-Aldrich, St. Louis, MO, USA | L4509 | Used as a dispersant for copper nanoparticles to reduce aggregation. |
| Staphylococcus aureus | American Type Culture Collection (ATCC), Manassas, VA, USA Bioresource Collection and Research Center (BCRC), Hsinchu, Taiwan | 13567 | Bacteria for CuNP toxocity experiment |
| Varioskan LUX multimode microplate reader | Thermo Fisher Scientific, Waltham, MA, USA | VLBLATGD2 | Used for measuring fluorescence in cell viability assays |
| Wortmannin (Wort) | Abcam, MA, USA | ab120148 | Used as a modulator for pretreatment in bacterial death pathway studies. |
| Z-VAD-FMK (Z-VAD) | Sigma-Aldrich, St. Louis, MO, USA | V116 | Used as a modulator for pretreatment in bacterial death pathway studies. |
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved