Method Article
Estudo da morte celular programada induzida por nanopartículas de cobre em bactérias
Neste Artigo
Resumo
As nanopartículas de cobre atuam como agentes antimicrobianos, gerando espécies reativas de oxigênio. Aqui, são apresentados procedimentos demonstrando que as nanopartículas de cobre são eficazes contra três patógenos clinicamente relevantes e que certas vias de morte celular programada estão envolvidas nesse processo bactericida.
Resumo
Recentemente, as preocupações com patógenos multirresistentes e infecções incuráveis aumentaram devido ao uso excessivo e indevido de antibióticos. Nanomateriais, como nanopartículas metálicas e de óxidos metálicos, ganharam popularidade no campo biomédico como potenciais novas estratégias para combater patógenos multirresistentes. Este estudo investigou o uso de nanopartículas de cobre (CuNPs) como bactericida contra três patógenos oportunistas comuns adquiridos em hospitais - Escherichia coli (E. coli), Acinetobacter baumannii (A. baumannii) e Staphylococcus aureus (S. aureus) - que estão desenvolvendo cada vez mais resistência aos medicamentos. Protocolos detalhados são apresentados para sintetizar CuNPs de dois tamanhos (20 nm e 60 nm) e avaliar sua eficácia bactericida por meio de ensaios de colônias. Os mecanismos de ação antimicrobiana subjacentes aos CuNPs foram explorados avaliando mudanças na produção de espécies reativas de oxigênio. Além disso, quatro moduladores que inibem as funções proteicas humanas foram aplicados para estudar o envolvimento potencial das vias de morte celular programada (PCD) na morte bacteriana. Por meio dessa abordagem, sugere-se o surgimento potencial de cepas resistentes ao cobre, com base na pesquisa de proteínas da homeostase do cobre, incluindo reguladores transcricionais dependentes de cobre. Essas descobertas fornecem uma metodologia abrangente para estudar os efeitos bactericidas dos CuNPs e seu papel potencial no tratamento da resistência aos antibióticos.
Introdução
As bactérias resistentes a medicamentos são uma séria causa de preocupação na medicina. Seu rápido surgimento reduziu a eficácia dos antibióticos convencionais, resultando em mais complicações clínicas. Representam uma grande ameaça para a saúde pública e criam uma necessidade urgente de novos agentes antimicrobianos. Uma via de pesquisa são os nanomateriais. Os nanomateriais possuem propriedades físico-químicas únicas que lhes permitem interagir com micróbios de maneiras que comprometem sua viabilidade. Por exemplo, as nanopartículas de prata (AgNPs) induzem estresse oxidativo em bactérias, resultando em disfunção proteica, ruptura da membrana, danos ao DNA e, finalmente, morte celular1. As nanopartículas de ouro (AuNPs), por outro lado, são conhecidas por suas propriedades antifúngicas e podem aumentar o efeito bactericida dos antibióticos, servindo como transportadores2.
Além disso, as nanopartículas de cobre (CuNPs) também atraíram atenção considerável devido ao seu potente efeito antimicrobiano e baixo custo de produção. Estudos sugerem que as CuNPs exibem atividade bactericida de amplo espectro pela interrupção da atividade enzimática e pela geração de espécies reativas de oxigênio (ROS)3. A carga positiva das CuNPs facilita sua penetração nas bactérias, aumentando sua captação celular4. Esse mecanismo torna os CuNPs uma opção promissora para revestimento de superfícies, como em implantes, para prevenir infecções3. Uma descoberta interessante, no entanto, é que o efeito bactericida dos CuNPs parece ser dependente do tamanho. Alguns estudos descobriram que CuNPs menores exibem maior atividade antibacteriana, provavelmente devido à sua relação superfície-volume superior5.
A geração de ROS causa danos generalizados a células e bactérias, incluindo peroxidação lipídica, disfunção proteica, fragmentação do DNA e inibição da gliconeogênese / glicogenólise, e está envolvida na necrose ou morte celular programada (PCD) 6 , 7 , 8 . Estudos recentes revelaram que os sistemas PCD existem em bactérias, com modos de ação e efetores semelhantes aos dos sistemas eucarióticos9. As comunidades bacterianas podem induzir PCD em resposta ao estresse, incluindo o estresse oxidativo, por meio de um sistema toxina-antitoxina (TA)10. Em termos simples, o sistema toxina-antitoxina consiste em toxinas que podem interromper processos celulares essenciais e antitoxinas que podem formar complexos estáveis com as toxinas para inibir sua toxicidade em condições normais de crescimento. A maioria das bactérias e arqueias contém loci TA em seus genomas, muitas vezes presentes em múltiplas cópias de DNA extracromossômico e cromossômico. Existem vários tipos de sistemas TA, sendo o TA tipo II (conhecido como módulo MazE/MazF) de particular interesse. Sob condições de estresse, as antitoxinas são degradadas, permitindo que as toxinas inibam seus alvos celulares. Em E. coli e S. aureus, a toxina MazF é ativada em resposta a condições de estresse, como estresse oxidativo, alta temperatura e falta de aminoácidos. Consequentemente, a expressão da antitoxina MazE é reduzida, liberando a toxina MazF10. Estudos descobriram que o MazF permite a síntese de proteínas que permitem que uma pequena subpopulação sobreviva em condições adversas, enquanto a maioria da população sofre morte celular mediada por mazEF. Essa morte celular pode ser dependente de ROS, onde ROS induz inibição transcricional ou translacional, ou independente de ROS, onde o dano ao DNA desencadeia as vias de morte11.
Este estudo explora os mecanismos pelos quais os CuNPs induzem a morte bacteriana. Em vez de focar apenas no sistema TA, quatro moduladores de PCD, usados anteriormente em nossa pesquisa 7,12, foram empregados para investigar possíveis vias de PCD em bactérias.
Ao examinar os efeitos bactericidas de CuNPs de dois tamanhos diferentes (20 e 60 nm) em concentrações variadas e utilizar métodos como ensaios de colônias, detecção de ROS e moduladores de PCD (SBI, Z-VAD, NSA e Wortmannin), esta pesquisa destaca que o PCD não é exclusivo de organismos multicelulares, mas também ocorre em comunidades bacterianas sob estresse. Ao fornecer protocolos detalhados, este trabalho visa permitir que os pesquisadores avaliem a eficácia do CuNP e os mecanismos bactericidas em seus próprios sistemas. Além disso, essas descobertas avançam na compreensão da PCD bacteriana e apoiam o desenvolvimento de terapias baseadas em CuNP para combater bactérias resistentes a antibióticos.
Protocolo
Os reagentes e os equipamentos utilizados neste estudo estão listados na Tabela de Materiais.
1. Preparação de nanopartículas de cobre
- Obtenha nanopós de cobre comerciais (25 nm e 60-80 nm) de uma fonte comercial.
- Use dodecil sulfato de sódio (SDS) 1,0 mM como dispersante para dois tamanhos de nanopartículas de 1 mg/mL.
- Disperse as nanopartículas usando um banho ultrassônico por pelo menos 30 min em temperatura ambiente. As nanopartículas totalmente dispersas estão então prontas para uso em experimentos subsequentes.
2. Preparação de bactérias
- Obtenha E. coli (Migula) Castellani e Chalmers cepa 25922 e A. baumannii Bouvet e Grimont da American Type Culture Collection. Obtenha S. aureus do Centro de Pesquisa e Coleta de Biorrecursos.
- Cultivar as bactérias em caldo Luria-Bertani (LB) em condições aeróbias a 37 °C.
- Diluir as culturas bacterianas em meio LB até obter uma densidade óptica a 600 nm (OD600) de aproximadamente 0,5.
3. Avaliação da viabilidade celular
- Ensaio de colônia
- Use soluções de estoque de CuNP (1 mg / mL) para preparar várias concentrações de dois tamanhos de CuNPs, incluindo 0 μg / mL, 1 μg / mL, 5 μg / mL, 10 μg / mL, 50 μg / mL e 100 μg / mL.
- Divida as culturas bacterianas preparadas na etapa 2.3 em tubos de microcentrífuga e centrifugue a 3300 × g por 10 min em temperatura ambiente.
- Reter os grânulos bacterianos e adicionar diferentes concentrações de dois tamanhos de CuNPs, respectivamente, com pipetagem suave.
- Trate os pellets bacterianos com PBS e álcool 70% como controles negativos e positivos, respectivamente.
- Incubar todas as bactérias tratadas com agitação a 200 rpm a 37 °C durante 24 h.
- Após a incubação, lave todas as bactérias tratadas com PBS e espalhe-as em placas de ágar LB. Colocar as placas numa incubadora a 37 °C durante 24 h.
- Conte o número de colônias em cada grupo de tratamento no dia seguinte e faça análises estatísticas. Recomenda-se realizar isso em triplicado para precisão estatística.
- Estudo do mecanismo bactericida
- Prepare as bactérias conforme descrito na etapa 3.1.2 e trate-as com 5 μM de SBI-0206965 (SBI) por 2 h, 0,5 μM de necrossulfonamida (NSA) por 1 h, 100 nM de wortmannin (Wort) por 30 min ou 100 nM de Z-VAD-FMK (Z-VAD) por 30 min.
- Co-trate as bactérias com diferentes concentrações de dois tamanhos de soluções CuNP, conforme descrito na etapa 3.1.1, na presença ou ausência de 5 μM de SBI, 0,5 μM de NSA, 100 nM de mosto e 100 nM de Z-VAD.
- Centrifugar as bactérias após tratamentos com moduladores (etapa 3.2.1) e remover os sobrenadantes.
- Ressuspender os sedimentos bacterianos em soluções preparadas no passo 3.2.2 e incubá-los com agitação a 200 rpm a 37 °C durante 24 h.
- Trate as bactérias com etanol a 70% e PBS como controles positivos e negativos, respectivamente. Use uma solução sem CuNPs como controle em branco de CuNP (0 μg / mL; mock) sob as mesmas condições inibidoras para cada grupo. Incubar todas as amostras por mais 24 horas.
- Após a incubação, adicione reagente de viabilidade celular às culturas na proporção de 1:10 em volume. Incubar as culturas durante mais 2 h agitando a 37 °C.
- Centrifugar as culturas (passo 3.1.2) após 2 h de incubação. Transferir os sobrenadantes fluorescentes para placas de 96 poços. Meça a fluorescência usando um comprimento de onda de excitação de 560 nm e um comprimento de onda de emissão de 590 nm com um leitor de microplacas.
- Diluir o sobrenadante restante a 10-5 e 10-4 e espalhá-lo em placas de ágar-LB para cultura.
- Conte colônias únicas no dia seguinte.
4. Detecção de espécies reativas de oxigênio
- Preparar as culturas bacterianas conforme descrito no passo 2.3 e dividi-las em tubos de microcentrífuga.
- Trate as bactérias com várias condições de estresse como grupos de controle positivo indutores de ROS (dados não mostrados nos resultados). Os tratamentos são descritos nas etapas 4.2.1 a 4.2.4.
- Exponha as bactérias à luz UV de 405 nm por 3 h. Incubar as bactérias a 45 °C durante 2 h.
- Em seguida, incubar as bactérias a 4 °C durante 2 h.
- Trate as bactérias com 3% H2O2 por 30 min.
- Manter as bactérias a 37 °C em caldo LB como controlo negativo.
- Prepare várias concentrações de CuNPs conforme descrito na etapa 3.1.1 e trate as bactérias com CuNPs de 20 nm ou 60 nm nas concentrações de 1 μg / mL, 5 μg / mL, 10 μg / mL e 100 μg / mL por 24 h.
- Lave as bactérias incubadas duas vezes com PBS para remover quaisquer nanopartículas restantes.
- Preparar o corante diacetato de 2′,7′-diclorodihidrofluoresceína (H2DCFDA) em PBS a uma concentração final de 5 μM.
- Ressuspender os sedimentos bacterianos em 5 μM de H2DCFDA e medir a intensidade de fluorescência a 520/30 nm de emissão utilizando um citómetro de fluxo.
NOTA: A intensidade da fluorescência verde FL1 se correlaciona com o nível de ROS na cultura tratada. Recomenda-se realizar isso em triplicado para precisão estatística.
Resultados
Atividades antimicrobianas de CuNPs de dois tamanhos em três patógenos
Três patógenos oportunistas (E. coli, S. aureus e A. baumannii) foram usados para testar as atividades bactericidas de CuNPs. As bactérias foram tratadas com 0 μg/mL, 1 μg/mL, 5 μg/mL, 10 μg/mL, 50 μg/mL e 100 μg/mL de CuNPs de 20 nm ou 60 nm, e as atividades bactericidas foram determinadas usando a concentração bactericida mínima (CBM) derivada da contagem de colônias. Nossos resultados mostraram efeitos bactericidas positivos de ambos os tamanhos de CuNPs (Figura 1) para as três cepas. Em E. coli, foram observadas reduções significativas no número de colônias a partir de 1 μg/mL e 5 μg/mL para os tratamentos CuNP de 20 nm e 60 nm, respectivamente (Figura 1A). Em contraste, reduções notáveis na contagem de colônias para S. aureus foram mostradas em todas as concentrações de ambos os tamanhos de CuNPs ( Figura 1B ). Para A. baumannii, concentrações mais altas de CuNPs (5 μg/mL em CuNPs de 20 nm e 10 μg/mL em CuNPs de 60 nm) foram necessárias para obter uma redução na contagem de colônias (Figura 1C).
Nossos estudos anteriores indicaram que CuNPs menores (20 nm) exibem capacidade bactericida mais extraordinária em comparação com os maiores (60 nm)7,12. Aqui, tendências semelhantes foram mostradas, indicando resultados consistentes. Além disso, esses achados sugerem que bactérias gram-positivas (neste caso, S. aureus) são mais suscetíveis a CuNPs do que as bactérias gram-negativas testadas (E. coli e A. baumannii).

Figura 1: Atividade bactericida de CuNPs de dois tamanhos diferentes em três espécies bacterianas. E. coli (A), S. aureus (B) e A. baumannii (C) foram tratados com concentrações variadas de CuNPs de 20 nm ou 60 nm, e a contagem de colônias bacterianas foi determinada. As bactérias tratadas com PBS e 70% de álcool serviram como controles negativos e positivos, respectivamente. Os dados são expressos como a média ± desvio padrão (DP) de quatro experimentos independentes, cada um realizado em triplicata. Os outliers foram identificados por meio de inspeção visual. O teste de Shapiro-Wilk foi utilizado para avaliar a normalidade dos dados. As comparações estatísticas foram realizadas por meio do teste t de Student. Asteriscos (*) e sinais de libra (#) indicam P < 0,05 para tratamentos CuNP de 20 nm e 60 nm em relação ao controle negativo, respectivamente. Clique aqui para ver uma versão maior desta figura.
Danos letais a bactérias por meio da geração de ROS induzida por CuNP
Os mecanismos propostos pelos quais os CuNPs matam bactérias variam. Duas teorias primárias estão sendo discutidas: a substituição de proteínas de aglomerado ferro-enxofre por cobre liberado de nanopartículas e a produção de ROS induzida por CuNP13,14. A produção de ROS foi avaliada em três bactérias tratadas com CuNP para explorar os mecanismos (Figura 2). E. coli, S. aureus e A. baumannii foram tratados com diferentes concentrações de CuNPs de 20 nm ou 60 nm, seguido da aplicação de H2DCFDA para detecção de ROS. Altas frações de populações fluorescentes verdes foram medidas por citometria de fluxo em todas as concentrações dos tratamentos CuNP de 20 nm e 60 nm (Figura 2). Curiosamente, as populações de células positivas nos tratamentos CuNP de 20 nm foram independentes da concentração (Figura 2A). Notavelmente, concentrações mais baixas de CuNPs de 20 nm causaram maior geração de ROS, enquanto concentrações mais altas exibiram uma fração menor de células positivas. No entanto, esse fenômeno não foi observado nas células tratadas com CuNP de 60 nm (Figura 2B). Não foram observadas diferenças significativas entre as três bactérias tratadas com CuNPs de 20 nm ou 60 nm (Figura 2). Elevações leves de populações positivas foram detectadas em 0 μg/mL, o que pode ser atribuído aos dispersantes e à pressão de osmose (Figura 2).

Figura 2: Geração de ROS após tratamento com CuNPs de dois tamanhos diferentes em três espécies bacterianas. E. coli, S. aureus e A. baumannii foram expostos a diferentes concentrações de CuNPs de 20 nm (A) ou 60 nm (B). A produção de ROS foi avaliada usando a coloração H2DCFDA após o tratamento com CuNP, e a fração de células fluorescentes positivas foi analisada por citometria de fluxo. Os dados são apresentados como a média ± DP de cinco experimentos independentes, cada um realizado em triplicata. Os outliers foram identificados por meio de inspeção visual. O teste de Shapiro-Wilk foi utilizado para avaliar a normalidade dos dados. As comparações estatísticas foram realizadas usando a análise unidirecional de Kruskal-Wallis. Os símbolos (*, # e $) indicam P < 0,05 para os tratamentos CuNP de 20 nm e 60 nm em relação ao controle negativo, respectivamente. Clique aqui para ver uma versão maior desta figura.
Quatro moduladores de PCD revelaram os mecanismos de morte bacteriana de CuNPs
Quatro moduladores de PCD foram usados em experimentos subsequentes para explorar ainda mais os mecanismos de morte celular induzidos por tratamentos com CuNP em três patógenos. Esses moduladores - SBI, Z-VAD, NSA e Wort - eram conhecidos por bloquear as vias de transdução de sinal associadas à apoptose (Z-VAD), autofagia (SBI e Wort) e necroptose (NSA) em células de mamíferos15-17. Estudos têm sugerido que a PCD não se restringe a organismos multicelulares; diferentes formas de PCD foram observadas em colônias bacterianas em resposta a condições adversas, beneficiando toda a colônia e facilitando estratégias adaptativas, como transformação genética e formação de biofilme10. Com base nesse entendimento, examinamos se as vias relacionadas ao PCD contribuem para a morte celular induzida por CuNP em bactérias. As três bactérias, E. coli, S. aureus e A. baumannii, foram pré-tratadas com os quatro moduladores, seguido de co-tratamento com dois tamanhos de CuNPs e os moduladores (Figura 3).
As viabilidades celulares apresentaram reduções dependentes da concentração em ambos os tamanhos dos tratamentos com CuNP em três bactérias (Figura 3), consistentes com os resultados apresentados na Figura 1. Em E. coli, foi observada sobrevida aumentada no grupo Z-VAD sob tratamento de 1 μg/mL e 5 μg/mL de CuNPs de 20 nm, bem como no grupo NSA sob tratamento com 10 μg/mL de CuNPs de 20 nm (Figura 3A). No entanto, o Z-VAD foi eficaz no resgate da sobrevida em E. coli em todas as concentrações de tratamentos com 60 nm-CuNP, mas não a 100 μg / mL ( Figura 3B ). Diferentes resultados de viabilidade em S. aureus sugerem vias bactericidas específicas nos tratamentos CuNP de 20 nm ( Figura 3C ). A NSA desempenhou um papel crítico em todas as concentrações de tratamentos CuNP de 20 nm, enquanto o Z-VAD foi eficaz apenas em 1 μg / mL de CuNPs de 20 nm. S. aureus não apresentou resposta aos moduladores em nenhuma concentração, exceto para Z-VAD a 10 μg/mL de tratamentos CuNP de 60 nm (Figura 3D). Tendências semelhantes nas taxas de sobrevivência celular às observadas em E. coli foram observadas em A. baumannii tratado com CuNPs de 20 nm (Figura 3E). O Z-VAD foi eficaz no resgate a 1 μg/mL, 5 μg/mL e 10 μg/mL nos tratamentos CuNP de 20 nm e 60 nm, enquanto o NAS aumentou as viabilidades apenas a 10 μg/mL de CuNPs de 20 nm. O SBI exibiu seus efeitos apenas em A. baumannii tratado com CuNPs de 60 nm nas concentrações de 1 μg/mL e 5 μg/mL (Figura 3F).
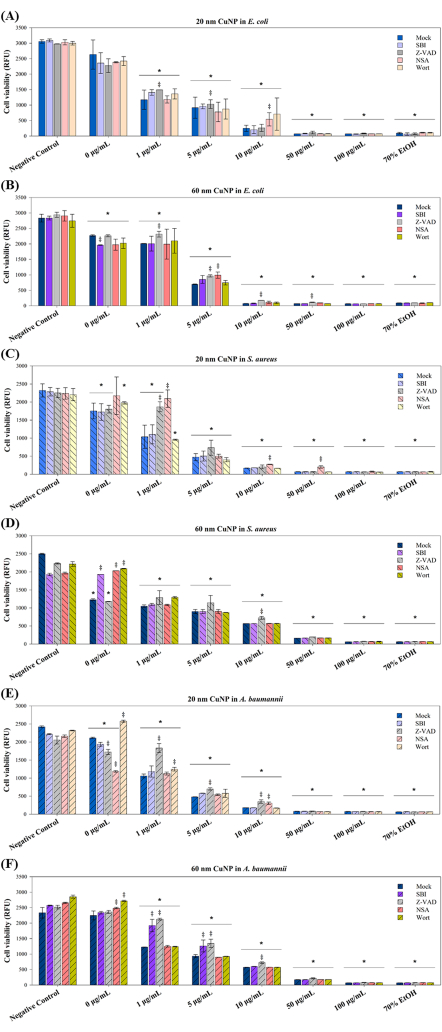
Figura 3: Efeito dos moduladores de PCD na sobrevivência bacteriana após tratamento com CuNPs de dois tamanhos diferentes. E. coli (A,B), S. aureus (C,D) e A. baumannii (E,F) foram tratados com PBS (controle negativo) e concentrações variadas (0 μg/mL, 1 μg/mL, 5 μg/mL, 10 μg/mL, 50 μg/mL e 100 μg/mL) de CuNPs de 20 nm ou 60 nm na ausência (simulação) ou presença dos moduladores PCD SBI, Z-VAD, NSA e Wort. As bactérias tratadas com álcool 70% serviram como controle positivo. A viabilidade celular foi avaliada usando um ensaio de viabilidade comercialmente disponível. Os dados são apresentados como a média ± DP de pelo menos três experimentos independentes, cada um realizado em triplicata. Os outliers foram identificados por meio de inspeção visual. O teste de Shapiro-Wilk foi utilizado para avaliar a normalidade dos dados. As comparações estatísticas foram realizadas por meio de ANOVA e teste t de Student. Um asterisco (*) denota P < 0,05 para tratamentos CuNP em comparação com o controle negativo, enquanto um cruzamento duplo (‡) indica P < 0,05 para comparações entre o mock e outros moduladores em cada concentração. Clique aqui para ver uma versão maior desta figura.
Efeitos sinérgicos do bactericida também foram observados com os dispersantes e CuNPs (Figura 3). SBI, Wort e NSA melhoraram a viabilidade bacteriana em S. aureus quando expostos a SDS em 0 μg / mL de CuNPs de 60 nm ( Figura 3F ). O mosto aumentou as taxas de sobrevivência em A. baumannii tratado com CuNPs de 20 nm e 60 nm em grupos simulados ( Figura 3E, F ). A NSA também aumentou as viabilidades de A. baumannii no tratamento simulado com CuNPs de 60 nm (Figura 3F). Em contraste, o SBI diminuiu as viabilidades em E. coli tratada com o mock de CuNPs de 60 nm ( Figura 3B ), enquanto o Z-VAD e o NSA reduziram as taxas de sobrevivência em A. baumannii tratados com o mock de CuNPs de 20 nm ( Figura 3E ). Esses resultados sugerem que os mecanismos bactericidas nessas três bactérias, quando tratadas com dispersantes, podem diferir daqueles envolvendo nanopartículas.
O cobre é um oligoelemento essencial para vários processos biológicos e é vital manter o equilíbrio dos íons de cobre dentro das bactérias. Os componentes importantes encontrados no sistema de homeostase do cobre em bactérias regulam a absorção, distribuição e excreção de cobre por meio de ATPases exportadoras de cobre, proteínas chaperonas de cobre e reguladores transcricionais responsivos ao cobre (Figura 4). Esses componentes modulam a expressão de proteínas de ligação e transporte de cobre em resposta aos níveis intracelulares de cobre, garantindo uma concentração adequada para processos essenciais e evitando toxicidade18.

Figura 4: Homeostase do cobre em bactérias gram-positivas (A) e gram-negativas (B). Clique aqui para ver uma versão maior desta figura.
Postulamos que o efeito bactericida dos CuNPs está intimamente relacionado à interrupção dos mecanismos de homeostase do cobre. Quando as bactérias são sobrecarregadas pelo excesso de cobre, o processo regulatório normal não consegue acompanhar, levando ao estresse oxidativo por meio da geração de ROS e da ativação do sistema bacteriano de PCD. Isso, por sua vez, regula negativamente a síntese de proteínas importantes e promove a produção de proteínas relacionadas à morte. A aplicação dos moduladores demonstra como esses agentes podem aumentar a capacidade de sobrevivência bacteriana, indicando que a morte bacteriana induzida por CuNP também interfere em processos como autofagia e proteólise, resultando em morte bacteriana. Esses resultados destacam a importância das vias de PCD na morte bacteriana induzida por CuNP.
Discussão
Este estudo investigou os efeitos antimicrobianos e os mecanismos dos CuNPs em dois tamanhos e várias concentrações contra E. coli, S. aureus e A. baumannii. Utilizando os protocolos estabelecidos, observou-se que os efeitos bactericidas induzidos por CuNP envolvem estresse oxidativo e potencial ativação de PCD. No entanto, a interação entre a homeostase do metal e as respostas ao estresse bacteriano permanece amplamente inexplorada. Estudos anteriores identificaram estratégias de resistência bacteriana, como bombas de efluxo de cobre e proteínas de ligação a metais, que podem afetar a suscetibilidade ao CuNP19. Além disso, a potencial citotoxicidade dos íons de cobre continua sendo uma preocupação para aplicações terapêuticas, destacando a necessidade de otimização cuidadosa da dosagem20. Uma compreensão mais profunda dos mecanismos bactericidas das CuNPs é essencial para avançar em seu uso seguro e eficaz.
A discussão aqui enfatizará os aspectos processuais desse método e suas implicações. As etapas críticas do protocolo incluem a preparação e dispersão adequadas de CuNP, garantindo culturas bacterianas uniformes em uma densidade óptica a 600 nm (OD600) de 0,5 para resultados reprodutíveis e ressuspensão precisa de pellets bacterianos em soluções CuNP para evitar a agregação. A sequência adequada de adição de moduladores, particularmente em relação à exposição ao CuNP, é crucial para resultados experimentais eficazes. Os tratamentos de controle, incluindo controles negativos (PBS) e positivos (álcool 70%), bem como um controle em branco de CuNP, são essenciais para estabelecer a viabilidade basal e garantir que os efeitos observados estejam diretamente relacionados ao tratamento com CuNP.
O método também inclui medições quantitativas de viabilidade celular, combinando a contagem de colônias com o ensaio PrestoBlue para avaliação precisa da atividade bactericida. Além disso, a detecção de ROS usando corante H2DCFDA e citometria de fluxo é uma etapa analítica fundamental para entender o estresse oxidativo induzido por CuNPs, estabelecendo a produção de ROS como um fator contribuinte na morte celular bacteriana. As modificações e a solução de problemas do método se concentram no ajuste das concentrações do modulador com base na suscetibilidade de cada cepa bacteriana, otimizando os tempos de incubação e garantindo as configurações adequadas de citometria de fluxo para detectar ROS com precisão. No entanto, o estudo é limitado por seu foco em apenas três cepas bacterianas e pela potencial variabilidade nos efeitos dos moduladores de PCD em diferentes espécies bacterianas. Foi observado um efeito dependente do tamanho, com CuNPs menores mostrando maior atividade bactericida, mas é necessária uma exploração mais aprofundada das variações de tamanho e concentração para entender completamente seu impacto.
Este método fornece uma abordagem abrangente para avaliar CuNPs como potenciais agentes antimicrobianos. A combinação de ensaios de colônias, testes de viabilidade celular, detecção de ROS e estudos de moduladores de PCD oferece uma compreensão multifacetada dos mecanismos bactericidas do CuNP. Este estudo destaca o potencial das CuNPs no combate a bactérias resistentes a medicamentos e apresenta oportunidades para o desenvolvimento de terapias antimicrobianas direcionadas que manipulam as vias bacterianas de PCD. Além disso, as aplicações do método se estendem ao desenvolvimento de revestimentos de biomateriais à base de CuNP para dispositivos médicos para prevenir infecções. Como uma ferramenta fundamental para entender o PCD bacteriano, este protocolo é um recurso valioso para o avanço da pesquisa em biologia bacteriana e estratégias antimicrobianas.
Divulgações
O autor declara não haver conflito de interesses, financeiros ou outros.
Agradecimentos
Somos gratos pelo apoio do Core Facility Center, Tzu Chi University, Taiwan.
Materiais
| Name | Company | Catalog Number | Comments |
| Acinetobacter baumannii Bouvet and Grimont strain | American Type Culture Collection (ATCC), Manassas, VA, USA | 17978 | Bacteria for CuNP toxocity experiment |
| Bio-Rad iMark Microplate Reader | Bio-Rad Laboratories, Hercules, CA, USA | 168-1130 | Used to measure absorbance in bacterial viability assays. |
| cell-permeant 2’,7’-dichlorodihydrofluorescein diacetate (H2DCFDA) | Sigma-Aldrich, Saint Louis, MO, USA | D6883 | Used for detecting reactive oxygen species (ROS) in treated bacterial cells. |
| Copper nanoparticles (CuNPs) 25 nm | Sigma-Aldrich, St. Louis, MO, USA | 774081 | Used to prepare CuNP stock solution |
| Copper nanoparticles (CuNPs) 60-80 nm | Sigma-Aldrich, St. Louis, MO, USA | 774103 | Used to prepare CuNP stock solution |
| Escherichia coli (Migula) Castellani and Chalmers | American Type Culture Collection (ATCC), Manassas, VA, USA | 25922 | Bacteria for CuNP toxocity experiment |
| Gallios flow cytometer | Beckman Coulter, Brea, CA, USA | Used for flow cytometric analysis in multiple experiments, including reactive oxygen species detection. | |
| LB agar | FocusBio, Miaoli, Taiwan | LBA500 | Used for culturing bacteria |
| Luria-Bertani (LB) broth | Becton, Dickinson and Company, Sparks, MD, USA | 244620 | Used for culturing bacteria |
| Necrosulfonamide (NSA) | Sigma-Aldrich, St. Louis, MO, USA | 480073 | Used as a modulator for pretreatment in bacterial death pathway studies. |
| PrestoBlue Cell Viability Reagent | Invitrogen, Carlsbad, CA, USA | P50200 | Used for assessing cell viability via fluorescence. |
| SBI-0206965 (SBI) | BioVision, Milpitas, CA, USA | 9580 | Used as a modulator for pretreatment in bacterial death pathway studies. |
| Sodium dodecyl sulfate (SDS) | Sigma-Aldrich, St. Louis, MO, USA | L4509 | Used as a dispersant for copper nanoparticles to reduce aggregation. |
| Staphylococcus aureus | American Type Culture Collection (ATCC), Manassas, VA, USA Bioresource Collection and Research Center (BCRC), Hsinchu, Taiwan | 13567 | Bacteria for CuNP toxocity experiment |
| Varioskan LUX multimode microplate reader | Thermo Fisher Scientific, Waltham, MA, USA | VLBLATGD2 | Used for measuring fluorescence in cell viability assays |
| Wortmannin (Wort) | Abcam, MA, USA | ab120148 | Used as a modulator for pretreatment in bacterial death pathway studies. |
| Z-VAD-FMK (Z-VAD) | Sigma-Aldrich, St. Louis, MO, USA | V116 | Used as a modulator for pretreatment in bacterial death pathway studies. |
Referências
- Anees Ahmad, S., et al. Bactericidal activity of silver nanoparticles: A mechanistic review. Mater Sci Energy Technol. 3, 756-769 (2020).
- Zhang, Y., Shareena Dasari, T. P., Deng, H., Yu, H. Antimicrobial activity of gold nanoparticles and ionic gold. J Environ Sci Health C Environ Carcinog Ecotoxicol Rev. 33 (3), 286-327 (2015).
- Solioz, M. . Copper and Bacteria: Evolution, Homeostasis and ToxicitySpringerBriefs in Molecular Science. Ch 2, 11-19 (2018).
- Ma, X., Zhou, S., Xu, X., Du, Q. Copper-containing nanoparticles: Mechanism of antimicrobial effect and application in dentistry-a narrative review. Front Surg. 9, 905892 (2022).
- Draviana, H. T., et al. Size and charge effects of metal nanoclusters on antibacterial mechanisms. J Nanobiotechnology. 21 (1), 428 (2023).
- Hasanuzzaman, M., et al. Regulation of ROS metabolism in plants under environmental stress: A review of recent experimental evidence. Int J Mol Sci. 21 (22), ijms21228695 (2020).
- Lai, M. J., et al. Effect of size and concentration of copper nanoparticles on the antimicrobial activity in Escherichia coli through multiple mechanisms. Nanomaterials (Basel). 12 (21), 12213715 (2022).
- Sai, D. L., Lee, J., Nguyen, D. L., Kim, Y. P. Tailoring photosensitive ROS for advanced photodynamic therapy. Exp Mol Med. 53 (4), 495-504 (2021).
- Peeters, S. H., de Jonge, M. I. For the greater good: Programmed cell death in bacterial communities. Microbiol Res. 207, 161-169 (2018).
- Allocati, N., Masulli, M., Di Ilio, C., De Laurenzi, V. Die for the community: An overview of programmed cell death in bacteria. Cell Death Dis. 6 (1), e1609 (2015).
- Kolodkin-Gal, I., Sat, B., Keshet, A., Engelberg-Kulka, H. The communication factor EDF and the toxin-antitoxin module mazEF determine the mode of action of antibiotics. PLoS Biol. 6 (12), e319 (2008).
- Lai, M. J., Huang, Y. W., Wijaya, J., Liu, B. R., Fernández, G. D. . Copper Overview. Ch 4, (2024).
- Macomber, L., Imlay, J. A. The iron-sulfur clusters of dehydratases are primary intracellular targets of copper toxicity. Proc Natl Acad Sci U S A. 106 (20), 8344-8349 (2009).
- Ramos-Zúñiga, J., Bruna, N., Pérez-Donoso, J. M. Toxicity mechanisms of copper nanoparticles and copper surfaces on bacterial cells and viruses. Int J Mol Sci. 24 (13), ijms241310503 (2023).
- Ihara, M., Shichijo, K., Takeshita, S., Kudo, T. Wortmannin, a specific inhibitor of phosphatidylinositol-3-kinase, induces accumulation of DNA double-strand breaks. J Radiat Res. 61 (2), 171-176 (2020).
- Yang, Y. P., et al. Application and interpretation of current autophagy inhibitors and activators. Acta Pharmacol Sin. 34 (5), 625-635 (2013).
- Li, X., et al. The caspase inhibitor Z-VAD-FMK alleviates endotoxic shock via inducing macrophages necroptosis and promoting MDSCs-mediated inhibition of macrophages activation. Front Immunol. 10, 1824 (2019).
- Solioz, M. . Copper and Bacteria: Evolution, Homeostasis and ToxicitySpringerBriefs in Molecular Science. Chapter 3, 21-48 (2018).
- Greene, N. P., Koronakis, V. Bacterial metal resistance: Coping with copper without cooperativity. mBio. 12 (3), e0065321 (2021).
- Butsyk, A., et al. Copper nanoparticle loaded electrospun patches for infected wound treatment: from development to in-vivo application. Polymers (Basel). 16 (19), polym16192733 (2024).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados