Method Article
Изучение индуцированной наночастицами меди запрограммированной гибели клеток у бактерий
В этой статье
Резюме
Наночастицы меди действуют как противомикробные агенты, генерируя активные формы кислорода. Здесь представлены процедуры, демонстрирующие, что наночастицы меди эффективны против трех клинически значимых патогенов и что определенные запрограммированные пути гибели клеток участвуют в этом бактерицидном процессе.
Аннотация
В последнее время возросла обеспокоенность по поводу патогенов с множественной лекарственной устойчивостью и неизлечимых инфекций из-за чрезмерного и неправильного использования антибиотиков. Наноматериалы, такие как наночастицы металлов и оксидов металлов, завоевали популярность в биомедицинской области как потенциальные новые стратегии борьбы с патогенами с множественной лекарственной устойчивостью. В этом исследовании изучалось использование наночастиц меди (CuNPs) в качестве бактерицида против трех распространенных внутрибольничных оппортунистических патогенов - Escherichia coli (E. coli), Acinetobacter baumannii (A. baumannii) и Staphylococcus aureus (S. aureus), у которых все чаще развивается лекарственная устойчивость. Представлены подробные протоколы синтеза CuNP двух размеров (20 нм и 60 нм) и оценки их бактерицидной эффективности с помощью колонийных анализов. Механизмы антимикробного действия, лежащего в основе CuNP, были изучены путем оценки изменений в продукции активных форм кислорода. Кроме того, четыре модулятора, которые ингибируют функции белка человека, были применены для изучения потенциального участия путей программируемой клеточной смерти (PCD) в уничтожении бактерий. С помощью этого подхода предполагается потенциальное появление устойчивых к медью штаммов, основанных на исследованиях белков гомеостаза меди, включая медь-зависимые транскрипционные регуляторы. Эти результаты обеспечивают всестороннюю методологию для изучения бактерицидных эффектов CuNP и их потенциальной роли в борьбе с устойчивостью к антибиотикам.
Введение
Лекарственно-устойчивые бактерии являются серьезной причиной беспокойства в медицине. Их быстрое появление снизило эффективность обычных антибиотиков, что привело к большему количеству клинических осложнений. Они представляют серьезную угрозу для здоровья населения и создают острую потребность в новых противомикробных препаратах. Одним из направлений исследований являются наноматериалы. Наноматериалы обладают уникальными физико-химическими свойствами, которые позволяют им взаимодействовать с микробами таким образом, что это ставит под угрозу их жизнеспособность. Например, наночастицы серебра (AgNPs) вызывают окислительный стресс у бактерий, что приводит к дисфункции белка, разрушению мембран, повреждению ДНК и, в конечном итоге, к гибели клеток. Наночастицы золота (AuNPs), с другой стороны, известны своими противогрибковыми свойствами и могут усиливать бактерицидное действие антибиотиков, выступая в качестве носителей2.
Кроме того, наночастицы меди (CuNP) также привлекли значительное внимание благодаря своему мощному антимикробному эффекту и низкой стоимости производства. Исследования показывают, что CuNP проявляют бактерицидную активность широкого спектра действия за счет нарушения ферментативной активности и образования активных форм кислорода (АФК)3. Положительный заряд CuNP облегчает их проникновение в бактерии, усиливая их клеточное поглощение4. Этот механизм делает CuNP перспективным вариантом для поверхностного покрытия, например, имплантатов, для предотвращения инфекций3. Однако одним из интересных открытий является то, что бактерицидный эффект CuNPs, по-видимому, зависит от размера. Некоторые исследования показали, что меньшие по размеру CuNP проявляют более высокую антибактериальную активность, вероятно, из-за ихпревосходного отношения площади поверхности к объему5.
Образование АФК вызывает обширное повреждение клеток и бактерий, включая перекисное окисление липидов, дисфункцию белков, фрагментацию ДНК и ингибирование глюконеогенеза/гликогенолиза, а также участвует в некрозе или запрограммированной гибели клеток (ПЦД)6,7,8. Недавние исследования показали, что системы PCD существуют у бактерий с режимами действия и эффекторами, аналогичными таковым в эукариотических системах9. Бактериальные сообщества могут индуцировать ПЦД в ответ на стресс, включая окислительный стресс, через систему токсин-антитоксин (ТА)10. Проще говоря, токсин-антитоксинная система состоит из токсинов, которые могут нарушать основные клеточные процессы, и антитоксинов, которые могут образовывать стабильные комплексы с токсинами для ингибирования их токсичности в нормальных условиях роста. Большинство бактерий и архей содержат локусы ТА в своих геномах, часто присутствующие в множественных копиях внехромосомной и хромосомной ДНК. Существует несколько типов систем TA, из которых особый интерес представляет тип II TA (известный как модуль MazE/MazF). В условиях стресса антитоксины разрушаются, что позволяет токсинам подавлять свои клеточные мишени. В E. coli и S. aureus токсин MazF активируется в ответ на стрессовые условия, такие как окислительный стресс, высокая температура и аминокислотное голодание. Следовательно, экспрессия антитоксина MazE снижается, высвобождая токсин MazF10. Исследования показали, что MazF позволяет синтезировать белки, которые позволяют небольшой субпопуляции выживать в неблагоприятных условиях, в то время как большая часть популяции подвергается опосредованной mazEF клеточной смерти. Эта гибель клеток может быть либо АФК-зависимой, когда АФК индуцирует транскрипционное или трансляционное ингибирование, либо АФК-независимой, когда повреждение ДНК запускает пути смерти11.
В этом исследовании изучаются механизмы, с помощью которых CuNP вызывают гибель бактерий. Вместо того, чтобы сосредоточиться исключительно на системе ТА, четыре модулятора PCD, ранее использовавшиеся в нашем исследовании 7,12, были использованы для изучения потенциальных путей PCD у бактерий.
Изучая бактерицидные эффекты CuNP двух разных размеров (20 и 60 нм) в различных концентрациях и используя такие методы, как анализ колоний, обнаружение АФК и модуляторы PCD (SBI, Z-VAD, NSA и Wortmannin), это исследование подчеркивает, что PCD не является исключительным для многоклеточных организмов, но также встречается в бактериальных сообществах в условиях стресса. Предоставляя подробные протоколы, эта работа направлена на то, чтобы позволить исследователям оценить эффективность CuNP и бактерицидные механизмы в их собственных системах. Кроме того, эти результаты углубляют понимание бактериальной ПЦД и поддерживают разработку методов лечения на основе CuNP для борьбы с устойчивыми к антибиотикам бактериями.
протокол
Реагенты и оборудование, использованные в данном исследовании, перечислены в Таблице материалов.
1. Получение наночастиц меди
- Получение коммерческих нанопорошков меди (25 нм и 60-80 нм) из коммерческого источника.
- Используйте 1,0 мМ додецилсульфата натрия (SDS) в качестве диспергатора для двух размеров наночастиц 1 мг/мл.
- Диспергируйте наночастицы с помощью ультразвуковой ванны в течение не менее 30 минут при комнатной температуре. Затем полностью диспергированные наночастицы готовы к использованию в последующих экспериментах.
2. Подготовка бактерий
- Получить штамм E. coli (Migula) Castellani and Chalmers 25922 и штамм A. baumannii Bouvet and Grimont из американской коллекции типовых культур. Получите S. aureus в Центре сбора и исследования биоресурсов.
- Культивируйте бактерии в бульоне Лурия-Бертани (LB) в аэробных условиях при 37 °C.
- Разбавьте бактериальные культуры в среде LB до оптической плотности при длине волны 600 нм (наружный диаметр600) примерно 0,5.
3. Оценка жизнеспособности клеток
- Колонийный анализ
- Используйте исходные растворы CuNP (1 мг/мл) для приготовления различных концентраций двух размеров CuNPs, включая 0 мкг/мл, 1 мкг/мл, 5 мкг/мл, 10 мкг/мл, 50 мкг/мл и 100 мкг/мл.
- Приготовленные на шаге 2.3 бактериальные культуры разделить на микроцентрифужные пробирки и центрифугировать при температуре 3300 × г в течение 10 минут при комнатной температуре.
- Сохраните бактериальные гранулы и добавьте различные концентрации двух размеров CuNPs, соответственно, с помощью щадящего пипетирования.
- Обрабатывайте бактериальные гранулы PBS и 70% спиртом в качестве отрицательного и положительного контроля соответственно.
- Инкубируйте все обработанные бактерии при встряхивании при 200 об/мин при 37 °C в течение 24 часов.
- После инкубации промойте все обработанные бактерии PBS и распределите их на пластинах из агара LB. Поместите планшеты в инкубатор с температурой 37 °C на 24 часа.
- Подсчитайте численность колонии в каждой группе лечения на следующий день и проведите статистический анализ. Для статистической точности рекомендуется проводить это в трех экземплярах.
- Исследование бактерицидного механизма
- Подготовьте бактерии, как описано в шаге 3.1.2, и обработайте их либо 5 мкМ SBI-0206965 (SBI) в течение 2 ч, 0,5 мкМ некросульфанида (NSA) в течение 1 ч, 100 нМ вортманнина (Wort) в течение 30 мин или 100 нМ Z-VAD-FMK (Z-VAD) в течение 30 мин.
- Совместно обрабатывают бактерии различными концентрациями растворов CuNP двух размеров, как описано на шаге 3.1.1, в присутствии или отсутствии 5 мкМ SBI, 0,5 мкМ NSA, 100 нМ Wort и 100 нМ Z-VAD.
- Центрифугируйте бактерии после процедур модуляторами (шаг 3.2.1) и удалите надосадочную жидкость.
- Суспендировать бактериальные гранулы в растворах, приготовленных на шаге 3.2.2, и инкубировать их с встряхиванием при 200 об/мин при 37 °C в течение 24 ч.
- Обрабатывайте бактерии 70% этанолом и PBS в качестве положительного и отрицательного контроля соответственно. Используйте раствор без CuNPs в качестве пустого контроля CuNP (0 мкг/мл; имитация) при одинаковых условиях ингибитора для каждой группы. Инкубируйте все образцы еще 24 часа.
- После инкубации добавьте в культуры реагент для жизнеспособности клеток в соотношении объема 1:10. Инкубировать культуры еще 2 ч при встряхивании при 37 °С.
- Центрифугируйте культуры (шаг 3.1.2) после 2-часовой инкубации. Перенесите флуоресцентные надосадочные жидкости на 96-луночные планшеты. Измерьте флуоресценцию с использованием длины волны возбуждения 560 нм и длины волны излучения 590 нм с помощью считывателя микропланшетов.
- Оставшуюся надосадочную жидкость развести до 10-5 и 10-4 и распределить на агаровые пластины LB для культивирования.
- Посчитайте одиночные колонии на следующий день.
4. Обнаружение активных форм кислорода
- Подготовьте бактериальные культуры, как описано в шаге 2.3, и разделите их на микроцентрифужные пробирки.
- Относитесь к бактериям с различными стрессовыми состояниями как к контрольным группам, индуцирующим АФК (данные не показаны в результатах). Методы лечения описаны в шагах 4.2.1-4.2.4.
- Подвергайте бактерии воздействию ультрафиолетового излучения с длиной волны 405 нм в течение 3 часов. Инкубировать бактерии при 45 °C в течение 2 ч.
- Далее инкубируйте бактерии при температуре 4 °C в течение 2 ч.
- Обрабатывайте бактерии 3%H2O2 в течение 30 минут.
- Поддерживайте бактерии при температуре 37 °C в бульоне LB в качестве отрицательного контроля.
- Приготовьте различные концентрации CuNPs, как описано на шаге 3.1.1, и обработайте бактерии 20 нм или 60 нм CuNP в концентрациях 1 г/мл, 5 г/мл, 10 г/мл и 100 мкг/мл в течение 24 ч.
- Дважды промойте инкубированные бактерии PBS, чтобы удалить оставшиеся наночастицы.
- Получить краситель 2',7'-дихлордигидрофлуоресцеина диацетата (H2DCFDA) в PBS при конечной концентрации 5 мкМ.
- Ресуспендируйте бактериальные гранулы в 5 мкМ H2DCFDA и измерьте интенсивность флуоресценции при излучении 520/30 нм с помощью проточного цитометра.
ПРИМЕЧАНИЕ: Интенсивность флуоресценции зеленого FL1 коррелирует с уровнем АФК в обработанной культуре. Для статистической точности рекомендуется выполнять это в трех экземплярах.
Результаты
Антимикробная активность двухразмерных CuNP у трех патогенов
Три условно-патогенных микроорганизма (E. coli, S. aureus и A. baumannii) были использованы для проверки бактерицидной активности CuNPs. Бактерии обрабатывали 0 мкг/мл, 1 мкг/мл, 5 мкг/мл, 10 мкг/мл, 50 мкг/мл и 100 мкг/мл 20 нм или 60 нм CuNPs, а бактерицидную активность определяли с использованием минимальной бактерицидной концентрации (MBC), полученной из количества колоний. Наши результаты показали положительные бактерицидные эффекты обоих размеров CuNP (рис. 1) для всех трех штаммов. У E. coli наблюдалось значительное снижение численности колоний, начиная с 1 мкг/мл и 5 мкг/мл для лечения 20 нм и 60 нм CuNP соответственно (рис. 1A). Напротив, заметное снижение количества колоний для S. aureus было продемонстрировано при всех концентрациях CuNP обоих размеров (рис. 1B). Для A . baumannii для достижения снижения количества колоний требовались более высокие концентрации CuNP (5 мкг/мл в 20 нм CuNP и 10 мкг/мл в 60 нм CuNPs) (рис. 1C).
Наши предыдущие исследования показали, что меньшие CuNP (20 нм) проявляют более экстраординарную бактерицидную способность по сравнению с более крупными (60 нм)7,12. Здесь были продемонстрированы аналогичные тенденции, свидетельствующие о стабильных результатах. Кроме того, эти данные свидетельствуют о том, что грамположительные бактерии (в данном случае S. aureus) более чувствительны к CuNP, чем протестированные грамотрицательные бактерии (E. coli и A. baumannii).

Рисунок 1: Бактерицидная активность CuNP двух разных размеров у трех видов бактерий. E. coli (A), S. aureus (B) и A. baumannii (C) обрабатывали различными концентрациями 20 нм или 60 нм CuNPs, и определяли количество колоний бактерий. PBS- и 70% обработанные спиртом бактерии служили отрицательным и положительным контролем соответственно. Данные выражены в виде среднего значения ± стандартного отклонения (SD) из четырех независимых экспериментов, каждый из которых проводился в трех экземплярах. Выбросы были выявлены с помощью визуального осмотра. Для оценки нормальности данных использовался тест Шапиро-Уилка. Статистические сравнения проводились с использованием t-критерия Стьюдента. Звездочки (*) и знаки фунта (#) указывают на P < 0,05 для обработок CuNP 20 нм и 60 нм относительно отрицательного контроля, соответственно. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Летальное повреждение бактерий в результате индуцированной CuNP генерации АФК
Предлагаемые механизмы, с помощью которых CuNP убивают бактерии, различаются. Обсуждаются две основные теории: замена железо-серных кластерных белков медью, высвобождаемой из наночастиц, и индуцированное CuNP производство АФК13,14. Для изучения механизмов была оценена продукция АФК у трех бактерий, обработанных CuNP (Рисунок 2). E. coli, S. aureus и A. baumannii обрабатывали различными концентрациями 20 нм или 60 нм CuNPs с последующим применением H2DCFDA для обнаружения АФК. Высокие фракции зеленых флуоресцентных популяций измеряли методом проточной цитометрии во всех концентрациях 20 нм и 60 нм обработки CuNP (рис. 2). Интересно, что популяции положительных клеток при лечении 20 нм CuNP не зависели от концентрации (рисунок 2A). Примечательно, что более низкие концентрации 20 нм CuNP вызывали более высокую генерацию АФК, в то время как более высокие концентрации демонстрировали меньшую долю положительных клеток. Однако это явление не наблюдалось в клетках, обработанных CuNP с длиной волны 60 нм (рис. 2B). Не было отмечено существенных различий между тремя бактериями, получавшими CuNP с длиной волны 20 нм или 60 нм (Рисунок 2). Было обнаружено умеренное повышение положительных популяций в 0 мкг/мл, что может быть связано с диспергаторами и давлением осмоса (рис. 2).

Рисунок 2: Генерация АФК после обработки CuNP двух разных размеров у трех видов бактерий. E. coli, S. aureus и A. baumannii подвергались воздействию различных концентраций 20 нм (A) или 60 нм (B) CuNPs. Продукцию АФК оценивали с помощью окрашивания H2DCFDA после лечения CuNP, а фракцию флуоресцентно-положительных клеток анализировали с помощью проточной цитометрии. Данные представлены в виде среднего ± SD из пяти независимых экспериментов, каждый из которых проводился в трех экземплярах. Выбросы были выявлены с помощью визуального осмотра. Для оценки нормальности данных использовался тест Шапиро-Уилка. Статистические сравнения проводились с использованием одностороннего анализа Краскела-Уоллиса. Символы (*, # и $) указывают на P < 0,05 для обработок CuNP с длиной волны 20 нм и 60 нм относительно отрицательного контроля соответственно. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Четыре модулятора PCD выявили механизмы бактериальной смерти CuNP
Четыре модулятора PCD были использованы в последующих экспериментах для дальнейшего изучения механизмов гибели клеток, вызванных лечением CuNP у трех патогенов. Известно, что эти модуляторы -SBI, Z-VAD, NSA и Wort блокируют пути передачи сигнала, связанные с апоптозом (Z-VAD), аутофагией (SBI и Wort) и некроптозом (NSA) в клетках млекопитающих15-17. Исследования показали, что ПЦД не ограничивается многоклеточными организмами; различные формы ПЦД наблюдались в бактериальных колониях в ответ на суровые условия, что приносило пользу всей колонии и способствовало адаптационным стратегиям, таким как генетическая трансформация и образование биопленки10. Основываясь на этом понимании, мы изучили, способствуют ли связанные с PCD пути индуцированной CuNP гибели клеток у бактерий. Три бактерии, E. coli, S. aureus и A. baumannii, были предварительно обработаны четырьмя модуляторами с последующей совместной обработкой двумя размерами CuNP и модуляторами (рис. 3).
Жизнеспособность клеток показала зависящее от концентрации снижение обоих размеров обработки CuNP у трех бактерий (Рисунок 3), что согласуется с результатами, представленными на Рисунке 1. У E. coli повышенная выживаемость наблюдалась в группе Z-VAD при обработке 1 мкг/мл и 5 мкг/мл 20 нм CuNPs, а также в группе NSA при обработке 10 мкг/мл 20 нм CuNP (рис. 3A). Тем не менее, Z-VAD был эффективен в спасении выживаемости E. coli при всех концентрациях 60 нм-CuNP, но не при 100 мкг/мл (рис. 3B). Различные результаты жизнеспособности S. aureus указывают на определенные бактерицидные пути в лечении 20 нм CuNP (рис. 3C). NSA играл решающую роль во всех концентрациях 20 нм лечения CuNP, в то время как Z-VAD был эффективен только при 1 мкг/мл 20 нм CuNPs. S. aureus не проявлял ответа на модуляторы в любой концентрации, за исключением Z-VAD при 10 мкг/мл 60 нм обработки CuNP (рис. 3D). Тенденции в выживаемости клеток, аналогичные тем, которые наблюдались у E. coli, были отмечены у A. baumannii, получавших 20 нм CuNP (рис. 3E). Z-VAD был эффективен при концентрации 1 мкг/мл, 5 мкг/мл и 10 мкг/мл при обработке CuNP 20 нм и 60 нм, в то время как NAS увеличивал жизнеспособность только при 10 мкг/мл 20 нм CuNPs. SBI проявлял свои эффекты только у A. baumannii, обработанных 60 нм CuNP в концентрациях 1 г/мл и 5 г/мл (рис. 3F).
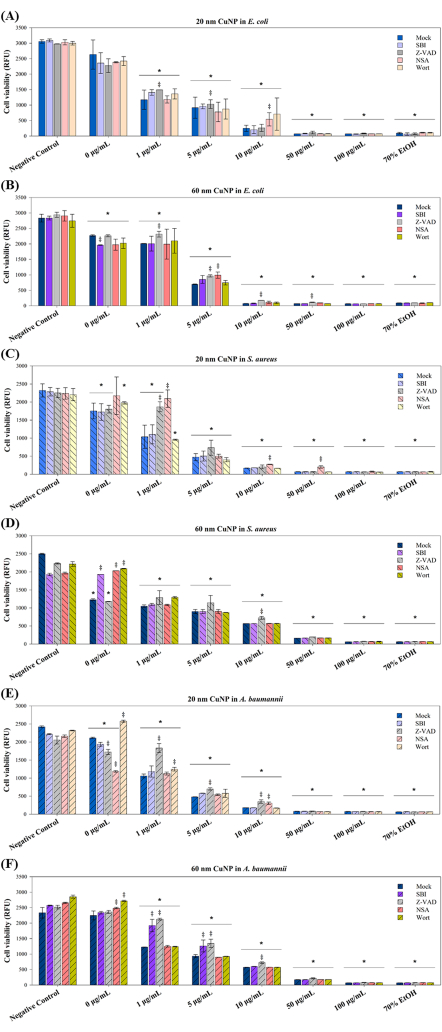
Рисунок 3: Влияние модуляторов PCD на выживаемость бактерий после лечения CuNP двух разных размеров. E. coli (A,B), S. aureus (C,D) и A. baumannii (E,F) обрабатывали PBS (отрицательный контроль) и различными концентрациями (0 мкг/мл, 1 мкг/мл, 5 мкг/мл, 10 мкг/мл, 50 мкг/мл и 100 мкг/мл) либо 20 нм, либо 60 нм CuNP в отсутствие (имитация) или присутствие модуляторов PCD SBI, Z-VAD, NSA и Wort. Бактерии, обработанные 70% спиртом, служили положительным контролем. Жизнеспособность клеток оценивали с помощью коммерчески доступного анализа жизнеспособности. Данные представлены в виде среднего значения SD ± как минимум трех независимых экспериментов, каждый из которых проводился в трех экземплярах. Выбросы были выявлены с помощью визуального осмотра. Для оценки нормальности данных использовался тест Шапиро-Уилка. Статистические сравнения проводились с использованием ANOVA и t-критерия Стьюдента. Звездочка (*) обозначает P < 0,05 для лечения CuNP по сравнению с отрицательным контролем, в то время как двойной крест (‡) обозначает P < 0,05 для сравнения между фиктивным и другими модуляторами при каждой концентрации. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Синергетические эффекты бактерицида также наблюдались с диспергаторами и CuNP (Рисунок 3). SBI, Wort и NSA улучшили бактериальную жизнеспособность S. aureus при воздействии SDS в 0 мкг/мл 60 нм CuNP (рис. 3F). Повышение выживаемости сусла у A. baumannii, обработанных 20 нм и 60 нм CuNP в фиктивных группах (рис. 3E, F). NSA также увеличила жизнеспособность A. baumannii при имитации обработки 60 нм CuNP (рис. 3F). Напротив, SBI снижал жизнеспособность у E. coli , обработанных имитацией 60 нм CuNP (рис. 3B), в то время как Z-VAD и NSA снижали выживаемость у A. baumannii , обработанных имитацией 20 нм CuNP (рис. 3E). Эти результаты свидетельствуют о том, что бактерицидные механизмы у этих трех бактерий при обработке диспергаторами могут отличаться от тех, которые связаны с наночастицами.
Медь является важным микроэлементом для различных биологических процессов, и она жизненно важна для поддержания баланса ионов меди в бактериях. Важные компоненты, обнаруженные в системе гомеостаза меди у бактерий, регулируют поглощение, распределение и выведение меди через АТФазы, экспортирующие медь, белки шаперона меди и реакционные транскрипционные регуляторы меди (рис. 4). Эти компоненты модулируют экспрессию медьсвязывающих и транспортных белков в ответ на внутриклеточные уровни меди, обеспечивая надлежащую концентрацию для основных процессов и предотвращаятоксичность.

Рисунок 4: Гомеостаз меди у грамположительных (А) и грамотрицательных (В) бактерий. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Мы постулируем, что бактерицидный эффект CuNPs тесно связан с нарушением механизмов гомеостаза меди. Когда бактерии перегружены избытком меди, нормальный регуляторный процесс не может идти в ногу со временем, что приводит к окислительному стрессу за счет образования АФК и активации бактериальной системы PCD. Это, в свою очередь, подавляет важный синтез белка и способствует производству белков, связанных со смертью. Применение модуляторов демонстрирует, как эти агенты могут повысить выживаемость бактерий, указывая на то, что индуцированное CuNP уничтожение бактерий также вмешивается в такие процессы, как аутофагия и протеолиз, что в конечном итоге приводит к гибели бактерий. Эти результаты подчеркивают важность путей ПЦД в CuNP-индуцированной бактериальной смерти.
Обсуждение
В этом исследовании изучались антимикробные эффекты и механизмы применения CuNP в двух размерах и различных концентрациях против E. coli, S. aureus и A. baumannii. Используя установленные протоколы, было отмечено, что бактерицидные эффекты, вызванные CuNP, включают окислительный стресс и потенциальную активацию PCD. Тем не менее, взаимодействие между гомеостазом металлов и бактериальными реакциями на стресс остается в значительной степени неизученным. В предыдущих исследованиях были выявлены стратегии бактериальной резистентности, такие как насосы для оттока меди и металлсвязывающие белки, которые могут влиять на восприимчивость к CuNP19. Кроме того, потенциальная цитотоксичность ионов меди остается проблемой для терапевтического применения, что подчеркивает необходимость тщательной оптимизациидозировки20. Более глубокое понимание бактерицидных механизмов CuNP имеет важное значение для продвижения их безопасного и эффективного использования.
В данном обсуждении будут рассмотрены процедурные аспекты этого метода и их последствия. Важнейшими этапами протокола являются надлежащее приготовление и диспергирование CuNP, обеспечение однородных бактериальных культур при оптической плотности 600 нм (OD600) 0,5 для воспроизводимых результатов, а также точная ресуспендия бактериальных гранул в растворах CuNP для предотвращения агрегации. Правильная последовательность добавления модуляторов, особенно в отношении воздействия CuNP, имеет решающее значение для эффективных экспериментальных результатов. Контрольная терапия, включая отрицательный (PBS) и положительный (70% алкоголя) контроль, а также холостой контроль CuNP, имеет важное значение для установления исходной жизнеспособности и обеспечения прямой связи наблюдаемых эффектов с лечением CuNP.
Метод также включает в себя количественное измерение жизнеспособности клеток, сочетая подсчет колоний с анализом PrestoBlue для точной оценки бактерицидной активности. Кроме того, обнаружение АФК с использованием красителя H2DCFDA и проточной цитометрии является ключевым аналитическим шагом для понимания окислительного стресса, индуцированного CuNPs, устанавливая, что продукция АФК является фактором, способствующим гибели бактериальных клеток. Модификации и устранение неисправностей метода сосредоточены на корректировке концентраций модулятора в зависимости от восприимчивости каждого штамма бактерий, оптимизации времени инкубации и обеспечении надлежащих настроек проточной цитометрии для точного обнаружения АФК. Тем не менее, исследование ограничено тем, что оно сосредоточено только на трех бактериальных штаммах и потенциальной изменчивости эффектов модуляторов PCD у разных видов бактерий. Наблюдался эффект, зависящий от размера, при этом меньшие CuNP проявляли большую бактерицидную активность, но для полного понимания их влияния необходимо дальнейшее изучение изменений размера и концентрации.
Этот метод обеспечивает комплексный подход к оценке CuNP как потенциальных антимикробных агентов. Сочетание колонийных анализов, тестов на жизнеспособность клеток, обнаружения АФК и исследований модулятора PCD дает многогранное понимание бактерицидных механизмов CuNP. Это исследование подчеркивает потенциал CuNP в борьбе с лекарственно-устойчивыми бактериями и представляет возможности для разработки таргетной антимикробной терапии, которая манипулирует бактериальными путями PCD. Кроме того, применение метода распространяется на разработку покрытий на основе биоматериалов на основе CuNP для медицинских устройств для предотвращения инфекций. Являясь основополагающим инструментом для понимания бактериальной ПЦД, этот протокол является ценным ресурсом для продвижения исследований в области биологии бактерий и антимикробных стратегий.
Раскрытие информации
Автор заявляет об отсутствии конфликта интересов, финансового или иного.
Благодарности
Мы благодарны за поддержку со стороны Центра основных средств Университета Цзу Чи, Тайвань.
Материалы
| Name | Company | Catalog Number | Comments |
| Acinetobacter baumannii Bouvet and Grimont strain | American Type Culture Collection (ATCC), Manassas, VA, USA | 17978 | Bacteria for CuNP toxocity experiment |
| Bio-Rad iMark Microplate Reader | Bio-Rad Laboratories, Hercules, CA, USA | 168-1130 | Used to measure absorbance in bacterial viability assays. |
| cell-permeant 2’,7’-dichlorodihydrofluorescein diacetate (H2DCFDA) | Sigma-Aldrich, Saint Louis, MO, USA | D6883 | Used for detecting reactive oxygen species (ROS) in treated bacterial cells. |
| Copper nanoparticles (CuNPs) 25 nm | Sigma-Aldrich, St. Louis, MO, USA | 774081 | Used to prepare CuNP stock solution |
| Copper nanoparticles (CuNPs) 60-80 nm | Sigma-Aldrich, St. Louis, MO, USA | 774103 | Used to prepare CuNP stock solution |
| Escherichia coli (Migula) Castellani and Chalmers | American Type Culture Collection (ATCC), Manassas, VA, USA | 25922 | Bacteria for CuNP toxocity experiment |
| Gallios flow cytometer | Beckman Coulter, Brea, CA, USA | Used for flow cytometric analysis in multiple experiments, including reactive oxygen species detection. | |
| LB agar | FocusBio, Miaoli, Taiwan | LBA500 | Used for culturing bacteria |
| Luria-Bertani (LB) broth | Becton, Dickinson and Company, Sparks, MD, USA | 244620 | Used for culturing bacteria |
| Necrosulfonamide (NSA) | Sigma-Aldrich, St. Louis, MO, USA | 480073 | Used as a modulator for pretreatment in bacterial death pathway studies. |
| PrestoBlue Cell Viability Reagent | Invitrogen, Carlsbad, CA, USA | P50200 | Used for assessing cell viability via fluorescence. |
| SBI-0206965 (SBI) | BioVision, Milpitas, CA, USA | 9580 | Used as a modulator for pretreatment in bacterial death pathway studies. |
| Sodium dodecyl sulfate (SDS) | Sigma-Aldrich, St. Louis, MO, USA | L4509 | Used as a dispersant for copper nanoparticles to reduce aggregation. |
| Staphylococcus aureus | American Type Culture Collection (ATCC), Manassas, VA, USA Bioresource Collection and Research Center (BCRC), Hsinchu, Taiwan | 13567 | Bacteria for CuNP toxocity experiment |
| Varioskan LUX multimode microplate reader | Thermo Fisher Scientific, Waltham, MA, USA | VLBLATGD2 | Used for measuring fluorescence in cell viability assays |
| Wortmannin (Wort) | Abcam, MA, USA | ab120148 | Used as a modulator for pretreatment in bacterial death pathway studies. |
| Z-VAD-FMK (Z-VAD) | Sigma-Aldrich, St. Louis, MO, USA | V116 | Used as a modulator for pretreatment in bacterial death pathway studies. |
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены