Method Article
박테리아에서 구리 나노 입자 유도 프로그래밍 된 세포 사멸 연구
요약
구리 나노 입자는 반응성 산소 종을 생성하여 항균제로 작용합니다. 여기에서는 구리 나노 입자가 임상적으로 관련된 세 가지 병원체에 효과적이며 프로그래밍된 특정 세포 사멸 경로가 이 살균 과정에 관여한다는 것을 입증하는 절차가 제시됩니다.
초록
최근에는 항생제의 과용과 오용으로 인해 다제내성 병원체와 난치성 감염에 대한 우려가 높아지고 있습니다. 금속 및 금속 산화물 나노 입자와 같은 나노 물질은 다제내성 병원체와 싸우기 위한 잠재적인 새로운 전략으로 생물 의학 분야에서 인기를 얻고 있습니다. 본 연구는 약물 내성이 점점 더 커지고 있는 병원에서 흔히 발생하는 3종의 기회감염 병원균인 대장균(E. coli), 아시네토박터 바우마니(A. baumannii), 황색포도상구균(S. aureus)에 대한 구리 나노입자(CuNP)의 사용을 조사했다. 두 가지 크기(20nm 및 60nm)의 CuNP를 합성하고 콜로니 분석을 통해 살균 효능을 평가하기 위한 자세한 프로토콜이 제시됩니다. CuNP의 기저에 있는 항균 작용 메커니즘은 반응성 산소 종 생산의 변화를 평가하여 탐구되었습니다. 또한, 박테리아 사멸에 프로그래밍된 세포 사멸(PCD) 경로의 잠재적 관여를 연구하기 위해 인간 단백질 기능을 억제하는 4가지 조절제를 적용했습니다. 이 접근 방식을 통해 구리 의존성 전사 조절자를 포함한 구리 항상성 단백질에 대한 연구를 기반으로 구리 내성 균주의 잠재적인 출현을 제안합니다. 이러한 발견은 CuNP의 살균 효과와 항생제 내성 해결에 대한 잠재적인 역할을 연구하기 위한 포괄적인 방법론을 제공합니다.
서문
약물 내성 박테리아는 의학계에서 심각한 우려 사항이다. 이 항생제의 급속한 출현은 기존 항생제의 효능을 감소시켜 더 많은 임상 합병증을 초래했습니다. 이는 공중 보건에 큰 위협이 되며 새로운 항균제에 대한 긴급한 필요성을 야기합니다. 연구 분야 중 하나는 나노 물질입니다. 나노 물질은 생존 능력을 손상시키는 방식으로 미생물과 상호 작용할 수 있는 고유한 물리화학적 특성을 가지고 있습니다. 예를 들어, 은 나노 입자(AgNP)는 박테리아에 산화 스트레스를 유발하여 단백질 기능 장애, 막 파괴, DNA 손상 및 궁극적으로 세포 사멸을 초래합니다1. 반면에 금 나노 입자(AuNP)는 항진균 특성으로 알려져 있으며 운반체 역할을 하여 항생제의 살균 효과를 향상시킬 수 있습니다2.
또한 구리 나노 입자(CuNP)도 강력한 항균 효과와 낮은 생산 비용으로 인해 상당한 주목을 받고 있습니다. 연구에 따르면 CuNP는 효소 활성의 중단과 활성 산소 종(ROS)의 생성에 의해 광범위한 살균 활성을 나타냅니다3. CuNP의 양전하는 박테리아로의 침투를 촉진하여 세포 흡수를 향상시킵니다4. 이 메커니즘으로 인해 CuNP는 감염을 예방하기 위해 임플란트와 같은 표면 코팅에 대한 유망한 옵션입니다3. 그러나 한 가지 흥미로운 발견은 CuNP의 살균 효과가 크기에 따라 달라지는 것으로 보인다는 것입니다. 일부 연구에서는 CuNP가 작을수록 항균 활성이 더 높다는 사실이 밝혀졌는데, 이는 표면적 대 부피 비율이 우수하기 때문일 수 있습니다5.
ROS 생성은 지질 과산화, 단백질 기능 장애, DNA 단편화, 포도당 신생합성/글리코겐분해 억제를 포함하여 세포와 박테리아에 광범위한 손상을 일으키며 괴사 또는 프로그래밍된 세포 사멸(PCD)6,7,8에 관여합니다. 최근 연구에 따르면 PCD 시스템은 박테리아에 존재하며, 진핵 시스템과 유사한 작용 모드 및 효과기가 존재합니다9. 박테리아 군집은 독소-항독소(TA) 시스템을 통해 산화 스트레스를 포함한 스트레스에 대한 반응으로 PCD를 유도할 수 있습니다10. 간단히 말해서 독소-항독소 시스템은 필수 세포 과정을 방해할 수 있는 독소와 독소와 안정적인 복합체를 형성하여 정상적인 성장 조건에서 독성을 억제할 수 있는 항독소로 구성됩니다. 대부분의 박테리아와 고세균은 게놈에 TA 유전자좌를 포함하고 있으며, 종종 염색체 외 및 염색체 DNA의 여러 사본에 존재합니다. TA 시스템에는 여러 유형이 있으며, 특히 유형 II TA(MazE/MazF 모듈이라고 함)가 중요합니다. 스트레스 상태에서는 항독소가 분해되어 독소가 세포 표적을 억제할 수 있습니다. 대장균(E. coli)과 황색포도상구균(S. aureus)에서 독소인 MazF는 산화 스트레스, 고온, 아미노산 결핍과 같은 스트레스 조건에 반응하여 활성화됩니다. 결과적으로 항독소 MazE의 발현이 감소하여 독소 MazF10이 방출됩니다. 연구에 따르면 MazF는 대부분의 인구가 mazEF 매개 세포 사멸을 겪는 동안 소수의 하위 집단이 불리한 조건에서 생존할 수 있도록 하는 단백질의 합성을 가능하게 합니다. 이 세포 사멸은 ROS가 전사 또는 번역 억제를 유도하는 ROS 의존성 또는 DNA 손상이 사멸 경로를 유발하는 ROS 독립적일 수 있습니다11.
이 연구는 CuNP가 박테리아 사멸을 유도하는 메커니즘을 탐구합니다. TA 시스템에만 초점을 맞추는 대신, 이전에 본 연구에서 사용된 4개의 PCD 조절제 7,12를 사용하여 박테리아의 잠재적인 PCD 경로를 조사했습니다.
본 연구는 서로 다른 농도에서 두 가지 크기(20 및 60nm)의 CuNP의 살균 효과를 조사하고 콜로니 분석, ROS 검출 및 PCD 조절제(SBI, Z-VAD, NSA 및 Wortmannin)와 같은 방법을 활용함으로써 PCD가 다세포 유기체에만 국한되지 않고 스트레스를 받는 박테리아 군집에서도 발생한다는 점을 강조합니다. 이 연구는 상세한 프로토콜을 제공함으로써 연구자들이 자신의 시스템에서 CuNP 효능 및 살균 메커니즘을 평가할 수 있도록 하는 것을 목표로 합니다. 또한, 이러한 발견은 세균성 PCD에 대한 이해를 증진하고 항생제 내성 박테리아와 싸우기 위한 CuNP 기반 치료법의 개발을 지원합니다.
프로토콜
이 연구에 사용된 시약과 장비는 재료 표에 나열되어 있습니다.
1. 구리 나노 입자의 제조
- 상업용 소스에서 상업용 구리 나노 분말 (25 nm 및 60-80 nm)을 얻습니다.
- 1.0mM 도데실황산나트륨(SDS)을 두 가지 크기의 1mg/mL 나노입자에 대한 분산제로 사용합니다.
- 실온에서 최소 30분 동안 초음파 수조를 사용하여 나노 입자를 분산시킵니다. 그런 다음 완전히 분산된 나노 입자는 후속 실험에 사용할 준비가 됩니다.
2. 박테리아의 준비
- American Type Culture Collection에서 E. coli (Migula) Castellani 및 Chalmers 균주 25922 및 A. baumannii Bouvet 및 Grimont 균주를 얻습니다. 생물자원 수집 및 연구 센터(Bioresource Collection and Research Center)에서 S. aureus 를 입수합니다.
- 37 °C의 호기성 조건에서 Luria-Bertani (LB) 육수에 박테리아를 배양합니다.
- LB 배지의 박테리아 배양액을 600nm(OD600)에서 약 0.5의 광학 밀도로 희석합니다.
3. 세포 생존율 평가
- 콜로니 분석
- 스톡 CuNP 용액(1mg/mL)을 사용하여 0μg/mL, 1μg/mL, 5μg/mL, 10μg/mL, 50μg/mL 및 100μg/mL를 포함한 두 가지 크기의 CuNP의 다양한 농도를 준비합니다.
- 2.3단계에서 준비한 박테리아 배양액을 마이크로 원심분리기 튜브로 분리하고 실온에서 10 분 동안 3300 ×g으로 원심분리합니다.
- 박테리아 펠릿을 유지하고 부드러운 피펫팅으로 각각 두 가지 크기의 CuNP를 다른 농도로 첨가합니다.
- 박테리아 펠릿을 PBS 및 70% 알코올로 각각 음성 및 양성 대조군으로 처리합니다.
- 처리된 모든 박테리아를 200rpm, 37°C에서 24시간 동안 진탕하여 배양합니다.
- 배양 후 처리된 모든 박테리아를 PBS로 세척하고 LB 한천 플레이트에 펴 바릅니다. 플레이트를 37°C 인큐베이터에 24시간 동안 놓습니다.
- 다음 날 각 치료 그룹의 군집 수를 세고 통계 분석을 수행합니다. 통계적 정확성을 위해 이 작업을 세 번 수행하는 것이 좋습니다.
- 살균 메커니즘 연구
- 3.1.2 단계에서 설명한대로 박테리아를 준비하고 2 시간 동안 5 μM의 SBI-0206965 (SBI), 1 시간 동안 0.5 μM의 네크로 설 폰 아미드 (NSA), 30 분 동안 100 nM의 워트 마닌 (맥아 즙) 또는 30 분 동안 100 nM의 Z-VAD-FMK (Z-VAD)로 처리합니다.
- 3.1.1단계에서 설명한 바와 같이 5μM의 SBI, 0.5μM의 NSA, 100nM의 Wort 및 100nM의 Z-VAD의 존재 여부에 관계없이 두 가지 크기의 CuNP 용액의 농도가 다른 박테리아를 공동 처리합니다.
- 조절제 처리 후(3.2.1단계) 박테리아를 원심분리하고 상층액을 제거합니다.
- 3.2.2단계에서 준비한 용액에 박테리아 펠릿을 재현탁시키고 24시간 동안 37°C에서 200rpm으로 진탕하면서 배양합니다.
- 박테리아를 각각 70% 에탄올과 PBS를 양성 및 음성 대조군으로 처리합니다. 각 그룹에 대해 동일한 억제제 조건에서 CuNP 블랭크 대조군(0μg/mL, 모의)으로 CuNP가 없는 용액을 사용합니다. 모든 샘플을 추가로 24시간 동안 배양합니다.
- 배양 후, 세포 생존율 시약을 1:10 부피 비율로 배양액에 첨가합니다. 37 ° C에서 흔들면서 2 시간 동안 배양물을 더 배양합니다.
- 배양 후 배양물을 원심분리(단계 3.1.2) 2시간 배양 후. 형광 상등액을 96웰 플레이트로 옮깁니다. 마이크로플레이트 리더로 560nm의 excitation 파장과 590nm의 방출 파장을 사용하여 형광을 측정합니다.
- 남은 상등액을 10-5 및 10-4 로 희석하고 배양을 위해 LB 한천 플레이트에 펴 바릅니다.
- 다음 날 단일 식민지를 계산합니다.
4. 활성산소종의 검출
- 2.3단계에서 설명한 대로 박테리아 배양을 준비하고 마이크로 원심분리기 튜브로 분리합니다.
- 다양한 스트레스 조건을 가진 박테리아를 ROS 유도 양성 대조군으로 처리합니다(데이터는 결과에 표시되지 않음). 치료법은 4.2.1-4.2.4 단계에 설명되어 있습니다.
- 박테리아를 405nm 자외선에 3시간 동안 노출시킵니다. 박테리아를 45°C에서 2시간 동안 배양합니다.
- 그런 다음 4°C에서 2시간 동안 박테리아를 배양합니다.
- 30분 동안 3% H2O2 로 박테리아를 처리합니다.
- LB 육수에 있는 박테리아를 음성 대조군으로 37°C로 유지하십시오.
- 3.1.1 단계에서 설명한대로 다양한 농도의 CuNP를 준비하고 24 시간 동안 1 μg / mL, 5 μg / mL, 10 μg / mL 및 100 μg / mL 농도의 20 nm 또는 60 nm CuNP로 박테리아를 처리합니다.
- 배양된 박테리아를 PBS로 두 번 세척하여 남아 있는 나노 입자를 제거합니다.
- 5μM의 최종 농도에서 PBS에서 2",7"-dichlorodihydrofluorescein diacetate (H2DCFDA) 염료를 준비합니다.
- 박테리아 펠릿을 5μM의 H2DCFDA에 재현탁시키고 유세포 분석기를 사용하여 520/30nm 방출에서 형광 강도를 측정합니다.
참고: FL1 녹색 형광의 강도는 처리된 배양액의 ROS 수준과 관련이 있습니다. 통계적 정확성을 위해 이 작업을 세 번 수행하는 것이 좋습니다.
결과
3가지 병원체에서 2가지 크기의 CuNP의 항균 활성
CuNP의 살균 활성을 테스트하기 위해 세 가지 기회 병원체(E. coli, S. aureus 및 A. baumannii)를 사용했습니다. 박테리아를 0 μg/mL, 1 μg/mL, 5 μg/mL, 10 μg/mL, 50 μg/mL 및 100 μg/mL의 20 nm 또는 60 nm CuNP로 처리하고, 군집 수에서 파생된 최소 살균 농도(MBC)를 사용하여 살균 활성을 측정했습니다. 우리의 결과는 세 가지 균주 모두에 대해 두 가지 크기의 CuNP(그림 1)에서 긍정적인 살균 효과를 보여주었습니다. 대장균에서 20nm 및 60nm CuNP 처리에 대해 각각 1μg/mL 및 5μg/mL에서 시작하여 콜로니 수의 현저한 감소가 관찰되었습니다(그림 1A). 대조적으로, S. aureus 에 대한 콜로니 수의 현저한 감소는 두 가지 크기의 CuNP의 모든 농도에서 나타났습니다(그림 1B). A. baumannii의 경우 콜로니 수를 줄이기 위해 더 높은 농도의 CuNP(20nm CuNP에서 5μg/mL 및 60nm CuNP에서 10μg/mL)가 필요했습니다(그림 1C).
우리의 이전 연구는 더 작은 CuNP (20 nm)가 더 큰 (60 nm)에 비해 더 특별한 살균 능력을 나타낸다는 것을 나타냈다7,12. 여기서도 유사한 추세가 나타나 일관된 결과를 나타냅니다. 또한, 이러한 발견은 그람 양성 박테리아(이 경우 S. aureus)가 테스트된 그람 음성 박테리아(E. coli 및 A. baumannii)보다 CuNP에 더 취약하다는 것을 시사합니다.

그림 1: 3개의 박테리아 종에서 2개의 서로 다른 크기의 CuNP의 살균 활성. E. coli (A), S. aureus (B) 및 A. baumannii (C)를 20 nm 또는 60 nm CuNPs의 다양한 농도로 처리하고, 박테리아 콜로니 수를 측정하였다. PBS 및 70% 알코올 처리된 박테리아는 각각 음성 및 양성 대조군으로 작용했습니다. 데이터는 각각 3± 걸쳐 수행된 4개의 독립적인 실험의 평균 표준 편차(SD)로 표현됩니다. 이상치는 육안 검사를 통해 식별되었습니다. Shapiro-Wilk 검정은 데이터 정규성을 평가하는 데 사용되었습니다. 통계적 비교는 Student's t-test를 사용하여 수행되었습니다. 별표(*) 및 파운드 기호(#)는 음성 대조군에 비해 각각 20nm 및 60nm CuNP 처리에 대해 P < 0.05를 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
CuNP 유도 ROS 생성을 통한 박테리아에 대한 치명적인 피해
CuNP가 박테리아를 죽이는 제안된 메커니즘은 다양합니다. 두 가지 주요 이론이 논의되고 있습니다 : 나노 입자에서 방출 된 구리에 의한 철 - 황 클러스터 단백질의 대체와 CuNP 유도 ROS 생산13, 14. 메커니즘을 탐색하기 위해 3개의 CuNP 처리 박테리아에서 ROS 생산을 평가했습니다(그림 2). E. coli, S. aureus 및 A. baumannii를 20nm 또는 60nm CuNP의 다른 농도로 처리한 후 ROS 검출을 위해 H2DCFDA를 적용했습니다. 녹색 형광 집단의 높은 비율은 20nm 및 60nm CuNP 처리의 모든 농도에서 유세포 분석으로 측정되었습니다(그림 2). 흥미롭게도, 20nm CuNP 처리에서 양성 세포의 집단은 농도와 무관했습니다(그림 2A). 특히, 20nm CuNP의 농도가 낮을수록 ROS 생성이 높아진 반면, 농도가 높을수록 양성 세포의 비율이 낮아졌습니다. 그러나 이러한 현상은 60nm CuNP 처리 된 세포에서는 관찰되지 않았습니다 (그림 2B). 20nm 또는 60nm CuNP로 처리된 3가지 박테리아 간에 유의미한 차이는 관찰되지 않았습니다(그림 2). 양성 집단의 경미한 상승은 0 μg/mL에서 검출되었으며, 이는 분산제와 삼투압에 기인할 수 있습니다(그림 2).

그림 2: 3가지 박테리아 종에서 두 가지 크기의 CuNP를 사용한 처리 후 ROS 생성. E. coli, S. aureus 및 A. baumannii 는 20nm(A) 또는 60nm(B) CuNP의 서로 다른 농도에 노출되었습니다. ROS 생산은 CuNP 처리 후H2DCFDA 염색을 사용하여 평가하고, 형광 양성 세포의 분획을 유세포 분석으로 분석했습니다. 데이터는 각각 3회씩 수행된 5개의 독립적인 실험에서 SD의 평균 ±으로 제공됩니다. 이상치는 육안 검사를 통해 식별되었습니다. Shapiro-Wilk 검정은 데이터 정규성을 평가하는 데 사용되었습니다. 통계적 비교는 Kruskal-Wallis 일원 분석을 사용하여 수행되었습니다. 기호(*, # 및 $)는 음성 대조군에 비해 각각 20nm 및 60nm CuNP 처리에 대해 P < 0.05를 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
4개의 PCD 조절제는 CuNP의 박테리아 사멸 메커니즘을 밝혔습니다.
3개의 병원체에서 CuNP 처리에 의해 유도된 세포 사멸 메커니즘을 더 자세히 탐구하기 위해 후속 실험에서 4개의 PCD 조절제를 사용했습니다. 이러한 조절제(SBI, Z-VAD, NSA 및 Wort)는 포유류 세포15-17에서 세포사멸(apoptosis, Z-VAD), 자가포식(autophagy, SBI 및 Wort) 및 괴사(necroptosis, NSA)와 관련된 신호 전달 경로를 차단하는 것으로 알려져 있습니다. 연구에 따르면 PCD는 다세포 유기체에만 국한되지 않습니다. 가혹한 조건에 대한 반응으로 박테리아 군체에서 다양한 형태의 PCD가 관찰되어 전체 군체에 도움이 되고 유전자 형질전환 및 생물막 형성과 같은 적응 전략을 촉진합니다10. 이러한 이해를 바탕으로 PCD 관련 경로가 박테리아의 CuNP 유도 세포 사멸에 기여하는지 여부를 조사했습니다. E. coli, S. aureus 및 A. baumannii의 세 가지 박테리아를 4가지 조절제로 전처리한 후 두 가지 크기의 CuNP와 조절제로 동시 처리했습니다(그림 3).
세포 생존율은 3개의 박테리아에서 두 가지 크기의 CuNP 처리에서 농도에 따른 감소를 보였으며(그림 3), 이는 그림 1에 제시된 결과와 일치합니다. 대장균의 경우, 1 μg/mL 및 5 μg/mL의 20 nm CuNP를 치료한 Z-VAD 그룹과 10 μg/mL의 20 nm CuNP를 치료한 NSA 그룹에서 생존율 증가가 관찰되었습니다(그림 3A). 그러나 Z-VAD는 60nm-CuNP 처리의 모든 농도에서 대장 균의 생존을 구하는 데 효과적이었지만 100μg/mL에서는 그렇지 않았습니다(그림 3B). S. aureus 의 다양한 생존 결과는 20nm CuNP 처리에서 특정 살균 경로를 시사합니다(그림 3C). NSA는 모든 농도의 20nm CuNP 처리에서 중요한 역할을 한 반면, Z-VAD는 20nm CuNP의 1μg/mL에서만 효과적이었습니다. S. aureus 는 60nm CuNP 처리의 10μg/mL에서 Z-VAD를 제외하고는 모든 농도에서 조절제에 대해 반응을 보이지 않았습니다(그림 3D). E. coli 에서 관찰된 것과 유사한 세포 생존율 추세는 20nm CuNP로 처리된 A. baumannii 에서 관찰되었습니다(그림 3E). Z-VAD는 20nm 및 60nm CuNP 처리에서 1μg/mL, 5μg/mL 및 10μg/mL에서 구출하는 데 효과적이었던 반면, NAS는 20nm CuNP의 10μg/mL에서만 생존력을 증가시켰습니다. SBI는 1 μg/mL 및 5 μg/mL 농도에서 60 nm CuNP로 처리된 A. baumannii 에서만 그 효과를 나타냈습니다(그림 3F).
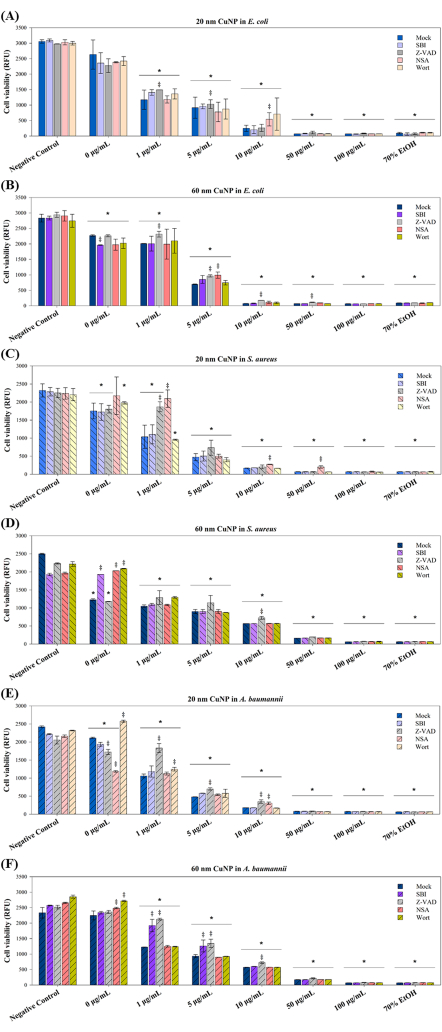
그림 3: 두 가지 크기의 CuNP로 처리한 후 PCD 조절제가 박테리아 생존에 미치는 영향. 대장균 (A,B), S. 아우레우스 (C,D) 및 A. 바우마니 (E,F)를 PCD 조절제 SBI의 부재(모의) 또는 존재 하에서 20 nm 또는 60 nm CuNP의 PBS(음성 대조군) 및 다양한 농도(0 μg/mL, 1 μg/mL, 5 μg/mL, 10 μg/mL, 50 μg/mL 및 100 μg/mL)로 처리하고, Z-VAD, NSA 및 Wort. 70% 알코올로 처리된 박테리아가 양성 대조군 역할을 했습니다. 세포 생존율은 상업적으로 이용 가능한 생존율 분석을 사용하여 평가되었습니다. 데이터는 각각 3회씩 수행된 최소 3개의 독립적인 실험에서 SD의 평균 ±으로 제시됩니다. 이상치는 육안 검사를 통해 식별되었습니다. Shapiro-Wilk 검정은 데이터 정규성을 평가하는 데 사용되었습니다. 통계적 비교는 ANOVA와 학생의 t-검정을 사용하여 수행되었습니다. 별표(*)는 음성 대조군과 비교하여 CuNP 처리에 대한 P < 0.05를 나타내고, 이중 십자가(‡)는 각 농도에서 모의 변조제와 다른 변조기 간의 비교를 위해 P < 0.05를 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
살균제의 시너지 효과는 분산제 및 CuNP에서도 관찰되었습니다(그림 3). SBI, Wort 및 NSA는 60nm CuNP의 0μg/mL에서 SDS에 노출되었을 때 S. aureus 의 박테리아 생존율을 개선했습니다(그림 3F). 모의 그룹에서 20nm 및 60nm CuNP로 처리된 A. baumannii 에서 Wort는 생존율을 증가시켰습니다(그림 3E, F). NSA는 또한 60nm CuNP를 사용한 모의 처리에서 A. baumannii 의 생존력을 증가시켰습니다(그림 3F). 대조적으로, SBI는 60nm CuNP의 모의로 처리된 대장 균에서 생존율을 감소시킨 반면(그림 3B), Z-VAD 및 NSA는 20nm CuNP의 모의로 처리된 A. baumannii 에서 생존율을 감소시켰습니다(그림 3E). 이러한 결과는 분산제로 처리했을 때 이 세 가지 박테리아의 살균 메커니즘이 나노 입자와 관련된 메커니즘과 다를 수 있음을 시사합니다.
구리는 다양한 생물학적 과정에 필수적인 미량 원소이며 박테리아 내에서 구리 이온의 균형을 유지하는 것이 중요합니다. 박테리아의 구리 항상성 시스템에서 발견되는 중요한 구성 요소는 구리 내보내기 ATPase, 구리 샤페론 단백질 및 구리 반응성 전사 조절자를 통해 구리의 흡수, 분포 및 배설을 조절합니다(그림 4). 이러한 구성 요소는 구리 결합의 발현을 조절하고 세포 내 구리 수준에 반응하여 단백질을 수송하여 독성을 예방하면서 필수 과정에 대한 적절한 농도를 보장합니다18.

그림 4: 그람 양성(A) 및 그람 음성(B) 박테리아의 구리 항상성.이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
우리는 CuNP의 살균 효과가 구리 항상성 메커니즘의 파괴와 밀접한 관련이 있다고 가정합니다. 박테리아가 과도한 구리에 압도되면 정상적인 조절 과정이 따라갈 수 없어 ROS 생성과 박테리아 PCD 시스템의 활성화를 통한 산화 스트레스로 이어집니다. 이것은 차례로 중요한 단백질 합성을 하향 조절하고 죽음과 관련된 단백질의 생산을 촉진합니다. 조절제의 적용은 이러한 물질이 박테리아의 생존성을 향상시킬 수 있는 방법을 보여주며, 이는 CuNP에 의한 박테리아 사멸이 자가포식 및 단백질 분해와 같은 과정을 방해하여 궁극적으로 박테리아 사멸을 초래한다는 것을 나타냅니다. 이러한 결과는 CuNP 유발 세균 사멸에서 PCD 경로의 중요성을 강조합니다.
토론
이 연구는 E. coli, S. aureus 및 A. baumannii에 대해 두 가지 크기와 다양한 농도에서 CuNP의 항균 효과와 메커니즘을 조사했습니다. 확립된 프로토콜을 사용하여 CuNP 유도 살균 효과가 산화 스트레스 및 잠재적인 PCD 활성화를 포함하는 것으로 관찰되었습니다. 그러나 금속 항상성과 박테리아 스트레스 반응 사이의 상호 작용은 대부분 연구되지 않은 상태로 남아 있습니다. 이전 연구에서는 구리 유출 펌프 및 금속 결합 단백질과 같은 박테리아 저항성 전략을 확인했으며, 이는 CuNP 감수성에 영향을 미칠 수 있습니다19. 또한, 구리 이온의 잠재적인 세포 독성은 치료 응용 분야에서 여전히 우려 사항으로 남아 있어 신중한 투여량 최적화의 필요성이 강조됩니다20. CuNP의 살균 메커니즘에 대한 심층적인 이해는 CuNP의 안전하고 효과적인 사용을 촉진하는 데 필수적입니다.
여기에서는 이 방법의 절차적 측면과 그 의미를 강조합니다. 프로토콜의 중요한 단계에는 적절한 CuNP 준비 및 분산, 재현 가능한 결과를 위해 0.5의 600nm(OD600)에서 광학 밀도에서 균일한 박테리아 배양을 보장하고, 응집을 방지하기 위해 CuNP 용액에서 박테리아 펠릿을 정확하게 재현하는 것이 포함됩니다. 특히 CuNP 노출과 관련하여 조절제를 적절하게 추가하는 순서는 효과적인 실험 결과를 위해 매우 중요합니다. CuNP 블랭크 대조군뿐만 아니라 음성(PBS) 및 양성(70% 알코올) 대조군을 포함한 대조군 처리는 기준선 생존 가능성을 확립하고 관찰된 효과가 CuNP 처리와 직접적인 관련이 있는지 확인하는 데 필수적입니다.
이 방법에는 살균 활성의 정확한 평가를 위해 집락 계수와 PrestoBlue 분석을 결합하는 정량적 세포 생존율 측정도 포함됩니다. 또한 H2DCFDA 염료 및 유세포 분석을 사용한 ROS 검출은 CuNP에 의해 유발되는 산화 스트레스를 이해하기 위한 핵심 분석 단계이며, ROS 생산이 박테리아 세포 사멸에 기여하는 요인임을 입증합니다. 이 방법의 수정 및 문제 해결은 각 박테리아 균주의 민감도에 따라 조절제 농도를 조정하고, 배양 시간을 최적화하고, ROS를 정확하게 검출하기 위한 적절한 유세포 분석 설정을 보장하는 데 중점을 둡니다. 그러나 이 연구는 세 가지 박테리아 균주에만 초점을 맞추고 있으며 서로 다른 박테리아 종에 걸친 PCD 조절제의 영향에 대한 잠재적 변동성으로 인해 제한됩니다. 더 작은 CuNP가 더 큰 살균 활성을 보이는 등 크기 의존적 효과가 관찰되었지만, 그 영향을 완전히 이해하려면 크기 및 농도 변화에 대한 추가 조사가 필요합니다.
이 방법은 잠재적인 항균제로서 CuNP를 평가하기 위한 포괄적인 접근 방식을 제공합니다. 집락 분석, 세포 생존도 검사, ROS 검출 및 PCD 조절제 연구를 결합하여 CuNP 살균 메커니즘에 대한 다각적인 이해를 제공합니다. 이 연구는 약물 내성 박테리아와 싸우는 데 있어 CuNP의 잠재력을 강조하고 박테리아 PCD 경로를 조작하는 표적 항균 요법을 개발할 수 있는 기회를 제시합니다. 또한, 이 방법의 응용 분야는 감염을 예방하기 위한 의료 기기용 CuNP 기반 생체 재료 코팅 개발로 확장됩니다. 세균성 PCD를 이해하기 위한 기본 도구인 이 프로토콜은 세균 생물학 및 항균 전략에 대한 연구를 진전시키는 데 유용한 리소스입니다.
공개
저자는 재정적 또는 기타 이해 상충이 없음을 선언합니다.
감사의 말
대만 Tzu Chi University의 핵심 시설 센터의 지원에 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| Acinetobacter baumannii Bouvet and Grimont strain | American Type Culture Collection (ATCC), Manassas, VA, USA | 17978 | Bacteria for CuNP toxocity experiment |
| Bio-Rad iMark Microplate Reader | Bio-Rad Laboratories, Hercules, CA, USA | 168-1130 | Used to measure absorbance in bacterial viability assays. |
| cell-permeant 2’,7’-dichlorodihydrofluorescein diacetate (H2DCFDA) | Sigma-Aldrich, Saint Louis, MO, USA | D6883 | Used for detecting reactive oxygen species (ROS) in treated bacterial cells. |
| Copper nanoparticles (CuNPs) 25 nm | Sigma-Aldrich, St. Louis, MO, USA | 774081 | Used to prepare CuNP stock solution |
| Copper nanoparticles (CuNPs) 60-80 nm | Sigma-Aldrich, St. Louis, MO, USA | 774103 | Used to prepare CuNP stock solution |
| Escherichia coli (Migula) Castellani and Chalmers | American Type Culture Collection (ATCC), Manassas, VA, USA | 25922 | Bacteria for CuNP toxocity experiment |
| Gallios flow cytometer | Beckman Coulter, Brea, CA, USA | Used for flow cytometric analysis in multiple experiments, including reactive oxygen species detection. | |
| LB agar | FocusBio, Miaoli, Taiwan | LBA500 | Used for culturing bacteria |
| Luria-Bertani (LB) broth | Becton, Dickinson and Company, Sparks, MD, USA | 244620 | Used for culturing bacteria |
| Necrosulfonamide (NSA) | Sigma-Aldrich, St. Louis, MO, USA | 480073 | Used as a modulator for pretreatment in bacterial death pathway studies. |
| PrestoBlue Cell Viability Reagent | Invitrogen, Carlsbad, CA, USA | P50200 | Used for assessing cell viability via fluorescence. |
| SBI-0206965 (SBI) | BioVision, Milpitas, CA, USA | 9580 | Used as a modulator for pretreatment in bacterial death pathway studies. |
| Sodium dodecyl sulfate (SDS) | Sigma-Aldrich, St. Louis, MO, USA | L4509 | Used as a dispersant for copper nanoparticles to reduce aggregation. |
| Staphylococcus aureus | American Type Culture Collection (ATCC), Manassas, VA, USA Bioresource Collection and Research Center (BCRC), Hsinchu, Taiwan | 13567 | Bacteria for CuNP toxocity experiment |
| Varioskan LUX multimode microplate reader | Thermo Fisher Scientific, Waltham, MA, USA | VLBLATGD2 | Used for measuring fluorescence in cell viability assays |
| Wortmannin (Wort) | Abcam, MA, USA | ab120148 | Used as a modulator for pretreatment in bacterial death pathway studies. |
| Z-VAD-FMK (Z-VAD) | Sigma-Aldrich, St. Louis, MO, USA | V116 | Used as a modulator for pretreatment in bacterial death pathway studies. |
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유