Method Article
研究铜纳米颗粒诱导的细菌程序性细胞死亡
摘要
铜纳米颗粒通过产生活性氧来充当抗菌剂。这里提出了一些程序,证明铜纳米颗粒对三种临床相关的病原体有效,并且某些程序性细胞死亡途径参与这种杀菌过程。
摘要
最近,由于抗生素的过度使用和滥用,人们对多重耐药病原体和不治之症感染的担忧有所增加。纳米材料,如金属和金属氧化物纳米颗粒,在生物医学领域越来越受欢迎,成为对抗多重耐药病原体的潜在新策略。本研究调查了使用铜纳米颗粒 (CuNPs) 作为杀菌剂对抗三种常见的医院获得性机会性病原体——大肠杆菌 (E. coli)、 鲍曼不动杆菌 (A. baumannii) 和 金黄色葡萄球菌 (S. aureus) - 它们越来越产生耐药性。提出了合成两种大小 (20 nm 和 60 nm) 的 CuNP 并通过菌落测定评估其杀菌效果的详细方案。通过评估活性氧产生的变化来探索 CuNPs 的抗菌作用机制。此外,应用四种抑制人类蛋白质功能的调节剂来研究程序性细胞死亡 (PCD) 途径在细菌杀伤中的潜在参与。通过这种方法,基于对铜稳态蛋白(包括铜依赖性转录调节因子)的研究,提出了铜耐药菌株的潜在出现。这些发现为研究 CuNPs 的杀菌作用及其在解决抗生素耐药性方面的潜在作用提供了一种全面的方法。
引言
耐药细菌是医学上引起严重关注的原因。它们的迅速出现降低了常规抗生素的疗效,导致更多的临床并发症。它们对公共卫生构成重大威胁,并迫切需要新的抗菌剂。纳米材料是一种研究途径。纳米材料具有独特的物理化学性质,使它们能够以损害其生存能力的方式与微生物相互作用。例如,纳米银颗粒 (AgNP) 会在细菌中诱导氧化应激,导致蛋白质功能障碍、膜破坏、DNA 损伤,并最终导致细胞死亡1。另一方面,金纳米颗粒 (AuNP) 以其抗真菌特性而闻名,可以通过作为载体来增强抗生素的杀菌作用2。
此外,纳米铜颗粒 (CuNPs) 也因其强大的抗菌作用和低生产成本而受到广泛关注。研究表明,CuNP 通过破坏酶活性和产生活性氧 (ROS) 而表现出广谱杀菌活性3。CuNP 的正电荷有助于它们渗透到细菌中,增强其细胞摄取4。这种机制使 CuNP 成为表面涂层(例如植入物)以防止感染的有前途的选择3。然而,一个有趣的发现是,CuNP 的杀菌作用似乎与大小有关。一些研究发现,较小的 CuNP 表现出更高的抗菌活性,这可能是由于它们优越的表面积与体积比5。
ROS 生成对细胞和细菌造成广泛的损伤,包括脂质过氧化、蛋白质功能障碍、DNA 片段化和糖异生/糖原分解抑制,并参与坏死或程序性细胞死亡 (PCD)6,7,8。最近的研究表明,PCD 系统存在于细菌中,其作用模式和效应器与真核系统中的相似9。细菌群落可以通过毒素-抗毒素 (TA) 系统诱导 PCD 以应对压力,包括氧化应激10。简单来说,毒素-抗毒素系统由可以破坏基本细胞过程的毒素和可以与毒素形成稳定复合物以抑制其在正常生长条件下的毒性的抗毒素组成。大多数细菌和古细菌的基因组中含有 TA 位点,通常存在于染色体外和染色体 DNA 的多个拷贝中。TA 系统有几种类型,其中 II 型 TA(称为 MazE/MazF 模块)特别有趣。在压力条件下,抗毒素被降解,使毒素能够抑制其细胞靶标。在大肠杆菌和金黄色葡萄球菌中,毒素 MazF 在氧化应激、高温和氨基酸饥饿等应激条件下被激活。因此,抗毒素 MazE 的表达降低,释放毒素 MazF10。研究发现,MazF 能够合成蛋白质,使一小部分亚群能够在不利条件下存活,而大多数群体经历 mazEF 介导的细胞死亡。这种细胞死亡可以是 ROS 依赖性的,其中 ROS 诱导转录或翻译抑制,也可以是 ROS 非依赖性的,其中 DNA 损伤触发死亡途径11。
本研究探讨了 CuNPs 诱导细菌死亡的机制。我们不仅仅关注 TA 系统,还采用了以前在我们的研究中使用的四种 PCD 调节剂 7,12,用于研究细菌中潜在的 PCD 途径。
通过检查不同浓度下两种不同大小(20 和 60 nm)的 CuNP 的杀菌作用,并利用菌落测定、ROS 检测和 PCD 调节剂(SBI、Z-VAD、NSA 和渥曼青霉素)等方法,本研究强调 PCD 不仅存在于多细胞生物中,还发生在压力下的细菌群落中。通过提供详细的方案,这项工作旨在使研究人员能够在自己的系统中评估 CuNP 的功效和杀菌机制。此外,这些发现促进了对细菌 PCD 的理解,并支持开发基于 CuNP 的疗法来对抗抗生素耐药细菌。
研究方案
本研究中使用的试剂和设备列在 材料表中。
1. 纳米铜颗粒的制备
- 从商业来源获得商业铜纳米粉末(25 nm 和 60-80 nm)。
- 使用 1.0 mM 十二烷基硫酸钠 (SDS) 作为两种尺寸 1 mg/mL 纳米颗粒的分散剂。
- 在室温下使用超声波浴分散纳米颗粒至少 30 分钟。然后,完全分散的纳米颗粒可用于后续实验。
2. 细菌的制备
- 从美国典型培养物保藏中心获得 大肠杆菌 (Migula) Castellani 和 Chalmers 菌株 25922 以及 鲍曼不 动杆菌 Bouvet 和 Grimont 菌株。从生物资源收集和研究中心获取 金黄色 葡萄球菌。
- 在 37 °C 的好氧条件下在 Luria-Bertani (LB) 肉汤中培养细菌。
- 将 LB 培养基中的细菌培养物稀释至约 0.5 nm (OD600) 的光密度。
3. 细胞活力评估
- 菌落测定
- 使用CuNP储备液(1 mg/mL)制备各种浓度的两种尺寸的CuNP,包括0 μg/mL、1 μg/mL、5 μg/mL、10 μg/mL、50 μg/mL和100 μg/mL。
- 将步骤 2.3 中制备的细菌培养物分液到微量离心管中,并在室温下以 3300 × g 离心 10 分钟。
- 保留细菌沉淀,并分别加入不同浓度的两种大小的 CuNPs,轻轻移液。
- 分别用 PBS 和 70% 酒精处理细菌颗粒作为阴性和阳性对照。
- 将所有处理过的细菌在 37 °C 下以 200 rpm 振荡孵育 24 小时。
- 孵育后,用 PBS 洗涤所有处理过的细菌,并将它们铺在 LB 琼脂平板上。将板置于 37 °C 培养箱中 24 小时。
- 第二天计算每个处理组中的菌落数并进行统计分析。建议一式三份进行此作,以确保统计准确性。
- 杀菌机理研究
- 如步骤 3.1.2 中所述制备细菌,并用 5 μM SBI-0206965 (SBI) 处理 2 小时,0.5 μM 坏死磺酰胺 (NSA) 处理 1 小时,100 nM 渥曼青霉素(麦芽汁)处理 30 分钟,或 100 nM Z-VAD-FMK (Z-VAD) 处理 30 分钟。
- 如步骤 3.1.1 所述,在存在或不存在 5 μM SBI、0.5 μM NSA、100 nM 麦芽汁和 100 nM Z-VAD 的情况下,用不同浓度的两种大小的 CuNP 溶液共处理细菌。
- 调节剂处理后离心细菌(步骤 3.2.1)并去除上清液。
- 将细菌沉淀重悬于步骤 3.2.2 中制备的溶液中,并在 37 °C 下以 200 rpm 振荡孵育 24 小时。
- 用 70% 乙醇和 PBS 分别作为阳性和阴性对照处理细菌。在每组相同的抑制剂条件下,使用不含 CuNP 的溶液作为 CuNP 空白对照(0 μg/mL;模拟)。将所有样品再孵育 24 小时。
- 孵育后,以 1:10 的体积比例向培养物中加入细胞活力试剂。将培养物在 37 °C 下振荡再孵育 2 小时。
- 孵育 2 小时后离心培养物(步骤 3.1.2)。将荧光上清液转移到 96 孔板中。使用酶标仪使用 560 nm 的激发波长和 590 nm 的发射波长测量荧光。
- 将剩余的上清液稀释至 10-5 和 10-4 ,并将其涂在 LB 琼脂平板上进行培养。
- 第二天对单个菌落进行计数。
4. 活性氧的检测
- 如步骤 2.3 所述制备细菌培养物,并将它们分成微量离心管。
- 将具有各种应激条件的细菌视为 ROS 诱导的阳性对照组(结果中未显示数据)。处理在步骤 4.2.1-4.2.4 中描述。
- 将细菌暴露在 405 nm 紫外光下 3 小时。将细菌在 45 °C 下孵育 2 小时。
- 接下来,将细菌在 4 °C 下孵育 2 小时。
- 用 3% H2O2 处理细菌 30 分钟。
- 将细菌保持在 37 °C 的 LB 肉汤中作为阴性对照。
- 如步骤 3.1.1 所述制备不同浓度的 CuNPs,并用浓度为 1 μg/mL、5 μg/mL、10 μg/mL 和 100 μg/mL 的 20 nm 或 60 nm CuNPs 处理细菌 24 小时。
- 用 PBS 洗涤孵育的细菌两次,以去除任何残留的纳米颗粒。
- 在 PBS 中制备终浓度为 5 μM 的 2',7'-二氯二氢荧光素二乙酸酯 (H2DCFDA) 染料。
- 将细菌沉淀重悬于 5 μM H2DCFDA 中,并使用流式细胞仪测量 520/30 nm 发射时的荧光强度。
注意:FL1 绿色荧光的强度与处理过的培养物中的 ROS 水平相关。建议一式三份执行此作,以确保统计准确性。
结果
两种规格 CuNPs 在 3 种病原体中的抑菌活性
使用三种机会性病原体 (大肠杆菌、金 黄色葡萄球菌和 鲍曼不动杆菌) 检测 CuNPs 的杀菌活性。用 0 μg/mL、1 μg/mL、5 μg/mL、10 μg/mL、50 μg/mL 和 100 μg/mL 的 20 nm 或 60 nm CuNPs 处理细菌,并使用来自菌落计数的最低杀菌浓度 (MBC) 测定杀菌活性。我们的结果表明,两种大小的 CuNPs (图 1) 对所有三种菌株都有积极的杀菌作用。在 大肠杆菌中,对于 20 nm 和 60 nm CuNP 处理,分别从 1 μg/mL 和 5 μg/mL 开始观察到菌落数显着减少(图 1A)。相比之下,在两种大小的 CuNP 的所有浓度中,金黄色葡萄球 菌 的菌落计数均显示显着减少(图 1B)。对于 鲍曼曲霉,需要更高浓度的 CuNPs(20 nm CuNPs 中为 5 μg/mL,60 nm CuNPs 中为 10 μg/mL)才能实现菌落计数的减少(图 1C)。
我们之前的研究表明,与较大的 CuNP (60 nm) 相比,较小的 CuNP (60 nm) 表现出更非凡的杀菌能力7,12。在这里,显示了类似的趋势,表明了一致的结果。此外,这些发现表明,革兰氏阳性菌(在本例中为金黄色葡萄球菌)比测试的革兰氏阴性菌(大肠杆菌和鲍曼不动杆菌)更容易感染 CuNP。

图 1:两种不同大小的 CuNP 在三种细菌中的杀菌活性。 用不同浓度的 20 nm 或 60 nm CuNPs 处理大肠杆菌 (A)、金黄色葡萄球菌 (B) 和鲍曼不动杆菌 (C),并测定细菌菌落计数。PBS 和 70% 酒精处理的细菌分别用作阴性和阳性对照。数据表示为四个独立实验的平均值±标准差 (SD),每个实验一式三份。通过目视检查识别异常值。采用 Shapiro-Wilk 检验评估数据正态性。使用 Student 的 t 检验进行统计比较。星号 (*) 和井号 (#) 表示相对于阴性对照,20 nm 和 60 nm CuNP 处理的 P < 0.05。请单击此处查看此图的较大版本。
通过 CuNP 诱导的 ROS 生成对细菌造成致命损伤
CuNP 杀死细菌的拟议机制各不相同。正在讨论两种主要理论:用纳米颗粒释放的铜取代铁硫簇蛋白,以及 CuNP 诱导的 ROS 产生13,14。在三种 CuNP 处理的细菌中评估了 ROS 的产生,以探索机制(图 2)。用不同浓度的 20 nm 或 60 nm CuNPs 处理大肠杆菌、金黄色葡萄球菌和鲍曼不动杆菌,然后应用 H2DCFDA 进行 ROS 检测。通过流式细胞术测量所有浓度的 20 nm 和 60 nm CuNP 处理中的高浓度绿色荧光群(图 2)。有趣的是,20 nm CuNP 处理中的阳性细胞群与浓度无关(图 2A)。值得注意的是,较低浓度的 20 nm CuNPs 导致较高的 ROS 生成,而较高浓度的阳性细胞比例较低。然而,在 60 nm CuNP 处理的细胞中未观察到这种现象(图 2B)。用 20 nm 或 60 nm CuNPs 处理的三种细菌之间没有观察到显着差异(图 2)。在 0 μg/mL 中检测到阳性群体的轻度升高,这可能归因于分散剂和渗透压(图 2)。

图 2:在三种细菌物种中用两种不同大小的 CuNP 处理后生成 ROS。 大肠杆菌、 金黄色葡萄球菌和 鲍曼不动杆菌 暴露于不同浓度的 20 nm (A) 或 60 nm (B) CuNPs。CuNP 处理后使用 H2DCFDA 染色评估 ROS 的产生,并通过流式细胞术分析荧光阳性细胞的分数。数据表示为来自五个独立实验的平均值 ± SD,每个实验一式三份。通过目视检查识别异常值。采用 Shapiro-Wilk 检验评估数据正态性。使用 Kruskal-Wallis 单因素分析进行统计比较。符号 (*、# 和 $) 表示相对于阴性对照,20 nm 和 60 nm CuNP 处理的 P < 0.05。 请单击此处查看此图的较大版本。
4 种 PCD 调节剂揭示了 CuNPs 的细菌死亡机制
在随后的实验中使用了四种 PCD 调节剂,以进一步探索 CuNP 处理在三种病原体中诱导的细胞死亡机制。已知这些调节剂 - SBI、Z-VAD、NSA 和 Wort- 可阻断与哺乳动物细胞中细胞凋亡 (Z-VAD)、自噬 (SBI 和 Wort) 和坏死性凋亡 (NSA) 相关的信号转导通路15-17。研究表明,PCD 不仅限于多细胞生物;在细菌菌落中观察到不同形式的 PCD 以响应恶劣的条件,使整个菌落受益并促进适应性策略,例如遗传转化和生物膜形成10。基于这种理解,我们研究了 PCD 相关途径是否会导致 CuNP 诱导的细菌细胞死亡。用四种调节剂对三种细菌,大肠杆菌、金黄色葡萄球菌和鲍曼不动杆菌进行预处理,然后用两种大小的 CuNP 和调节剂进行共处理(图 3)。
在三种细菌中,细胞活力在两种大小的 CuNP 处理中均显示出浓度依赖性降低(图 3),与图 1 中所示的结果一致。在大肠杆菌中,在 1 μg/mL 和 5 μg/mL 的 20 nm CuNPs 处理下的 Z-VAD 组以及接受 10 μg/mL 的 20 nm CuNPs 处理的 NSA 组中观察到存活率增加(图 3A)。然而,在所有浓度的 60 nm-CuNP 处理中,Z-VAD 可有效挽救大肠杆菌的存活率,但在 100 μg/mL 时则无效(图 3B)。金黄色葡萄球菌的不同活力结果表明 20 nm CuNP 处理中存在特定的杀菌途径(图 3C)。NSA 在所有浓度的 20 nm CuNP 处理中都起着关键作用,而 Z-VAD 仅在 1 μg/mL 的 20 nm CuNPs 处理下有效。金黄色葡萄球菌对任何浓度的调节剂都没有反应,除了 10 μg/mL 的 60 nm CuNP 处理的 Z-VAD(图 3D)。在用 20 nm CuNP 处理的鲍曼不动杆菌中观察到的细胞存活率趋势与在大肠杆菌中观察到的相似趋势(图 3E)。Z-VAD 在 20 nm 和 60 nm CuNPs 处理中以 1 μg/mL、5 μg/mL 和 10 μg/mL 有效挽救,而 NAS 仅在 10 μg/mL 的 20 nm CuNPs 处理下增加活力。SBI 仅在用 1 μg/mL 和 5 μg/mL 浓度的 60 nm CuNP 处理的鲍曼不动杆菌中表现出其效果(图 3F)。
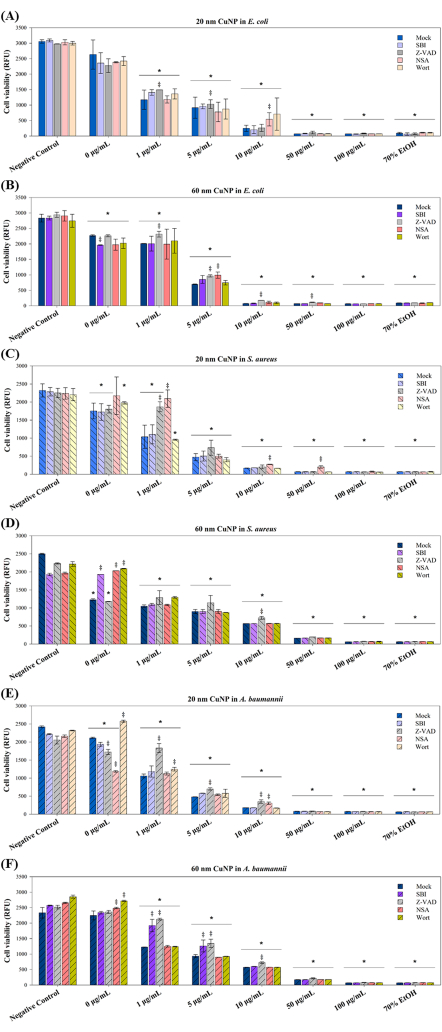
图 3:PCD 调节剂对两种不同大小的 CuNP 处理后细菌存活的影响。 大肠杆菌 (A,B)、金黄色葡萄球菌 (C,D) 和鲍曼不动杆菌 (E,F) 用 PBS(阴性对照)和不同浓度(0 μg/mL、1 μg/mL、5 μg/mL、10 μg/mL、50 μg/mL 和 100 μg/mL)的 20 nm 或 60 nm CuNPs 处理,在不存在(模拟)或 PCD 调节剂 SBI 的情况下, Z-VAD、NSA 和 Wort。用 70% 酒精处理的细菌作为阳性对照。使用市售活力测定法评估细胞活力。数据表示为来自至少三个独立实验的平均值 ± SD,每个实验一式三份进行。通过目视检查识别异常值。采用 Shapiro-Wilk 检验评估数据正态性。使用 ANOVA 和 Student t 检验进行统计比较。星号 (*) 表示与阴性对照相比,CuNP 处理的 P < 0.05,而双叉 (‡) 表示 P < 0.05,用于每个浓度的模拟和其他调节剂之间的比较。请单击此处查看此图的较大版本。
还观察到杀菌剂与分散剂和 CuNP 的协同效应(图 3)。当暴露于 0 μg/mL 的 60 nm CuNP 中的 SDS 时,SBI、Wort 和 NSA 改善了金黄色葡萄球菌的细菌活力(图 3F)。麦芽汁提高了模拟组中用 20 nm 和 60 nm CuNP 处理的鲍曼不动杆菌的存活率(图 3E,F)。NSA 还在用 60 nm CuNP 模拟处理中增加了鲍曼不动杆菌的活力(图 3F)。相比之下,SBI 降低了用 60 nm CuNP 模拟处理的大肠杆菌的活力(图 3B),而 Z-VAD 和 NSA 降低了用 20 nm CuNP 模拟处理的鲍曼不动杆菌的存活率(图 3E)。这些结果表明,当用分散剂处理时,这三种细菌的杀菌机制可能与涉及纳米颗粒的杀菌机制不同。
铜是各种生物过程中必不可少的微量元素,对于维持细菌内铜离子的平衡至关重要。细菌中铜稳态系统中发现的重要成分通过铜输出 ATP 酶、铜伴侣蛋白和铜反应性转录调节因子调节铜的摄取、分布和排泄(图 4)。这些成分响应细胞内铜水平调节铜结合蛋白和转运蛋白的表达,确保基本过程的适当浓度,同时防止毒性18。

图 4:革兰氏阳性 (A) 和革兰氏阴性 (B) 细菌中的铜稳态。请点击此处查看此图的较大版本。
我们假设 CuNPs 的杀菌作用与铜稳态机制的破坏密切相关。当细菌被过量的铜压倒时,正常的调节过程就跟不上,导致氧化应激通过产生 ROS 和激活细菌 PCD 系统。这反过来又下调了重要的蛋白质合成并促进了死亡相关蛋白质的产生。调节剂的应用证明了这些药物如何提高细菌的存活率,表明 CuNP 诱导的细菌杀灭也会干扰自噬和蛋白水解等过程,最终导致细菌死亡。这些结果强调了 PCD 通路在 CuNP 诱导的细菌死亡中的重要性。
讨论
本研究探讨了两种大小和不同浓度的 CuNPs 对 大肠杆菌、 金黄色葡萄球菌和 鲍曼不动杆菌的抗菌作用和机制。使用既定方案,观察到 CuNP 诱导的杀菌作用涉及氧化应激和潜在的 PCD 激活。然而,金属稳态和细菌应激反应之间的相互作用在很大程度上仍未得到探索。以前的研究已经确定了细菌耐药策略,例如铜外排泵和金属结合蛋白,这可能会影响 CuNP 易感性19。此外,铜离子的潜在细胞毒性仍然是治疗应用的一个问题,突出了仔细优化剂量的必要性20。更深入地了解 CuNP 的杀菌机制对于促进其安全有效使用至关重要。
此处的讨论将强调此方法的程序方面及其含义。该方案的关键步骤包括适当的 CuNP 制备和分散,确保在 600 nm (OD600) 的光密度为 0.5 时均匀的细菌培养物以获得可重复的结果,以及在 CuNP 溶液中准确重悬细菌沉淀以防止聚集。添加调节剂的正确顺序,特别是与 CuNP 暴露相关的顺序,对于有效的实验结果至关重要。对照处理,包括阴性 (PBS) 和阳性 (70% 酒精) 对照,以及 CuNP 空白对照,对于建立基线活力和确保观察到的效果与 CuNP 处理直接相关至关重要。
该方法还包括定量细胞活力测量,将菌落计数与 PrestoBlue 检测相结合,以准确评估杀菌活性。此外,使用 H2DCFDA 染料和流式细胞术进行 ROS 检测是了解 CuNP 诱导的氧化应激的关键分析步骤,将 ROS 产生确定为细菌细胞死亡的一个促成因素。该方法的修改和故障排除侧重于根据每种细菌菌株的敏感性调整调节剂浓度,优化孵育时间,并确保适当的流式细胞术设置以准确检测 ROS。然而,该研究受到其仅关注三种细菌菌株以及 PCD 调节剂在不同细菌种类中作用的潜在差异的限制。观察到大小依赖性效应,较小的 CuNP 显示出更大的杀菌活性,但需要进一步探索大小和浓度变化以充分了解它们的影响。
该方法为评估 CuNP 作为潜在抗菌剂提供了一种全面的方法。结合集落测定、细胞活力检测、ROS 检测和 PCD 调节剂研究,可以多方面地了解 CuNP 杀菌机制。本研究强调了 CuNPs 在对抗耐药细菌方面的潜力,并为开发纵细菌 PCD 通路的靶向抗菌疗法提供了机会。此外,该方法的应用扩展到开发用于医疗器械的 CuNP 基生物材料涂层以防止感染。作为理解细菌 PCD 的基础工具,该协议是推进细菌生物学和抗菌策略研究的宝贵资源。
披露声明
作者声明不存在利益冲突,无论是财务还是其他方面。
致谢
我们感谢台湾慈济大学核心设施中心的支持。
材料
| Name | Company | Catalog Number | Comments |
| Acinetobacter baumannii Bouvet and Grimont strain | American Type Culture Collection (ATCC), Manassas, VA, USA | 17978 | Bacteria for CuNP toxocity experiment |
| Bio-Rad iMark Microplate Reader | Bio-Rad Laboratories, Hercules, CA, USA | 168-1130 | Used to measure absorbance in bacterial viability assays. |
| cell-permeant 2’,7’-dichlorodihydrofluorescein diacetate (H2DCFDA) | Sigma-Aldrich, Saint Louis, MO, USA | D6883 | Used for detecting reactive oxygen species (ROS) in treated bacterial cells. |
| Copper nanoparticles (CuNPs) 25 nm | Sigma-Aldrich, St. Louis, MO, USA | 774081 | Used to prepare CuNP stock solution |
| Copper nanoparticles (CuNPs) 60-80 nm | Sigma-Aldrich, St. Louis, MO, USA | 774103 | Used to prepare CuNP stock solution |
| Escherichia coli (Migula) Castellani and Chalmers | American Type Culture Collection (ATCC), Manassas, VA, USA | 25922 | Bacteria for CuNP toxocity experiment |
| Gallios flow cytometer | Beckman Coulter, Brea, CA, USA | Used for flow cytometric analysis in multiple experiments, including reactive oxygen species detection. | |
| LB agar | FocusBio, Miaoli, Taiwan | LBA500 | Used for culturing bacteria |
| Luria-Bertani (LB) broth | Becton, Dickinson and Company, Sparks, MD, USA | 244620 | Used for culturing bacteria |
| Necrosulfonamide (NSA) | Sigma-Aldrich, St. Louis, MO, USA | 480073 | Used as a modulator for pretreatment in bacterial death pathway studies. |
| PrestoBlue Cell Viability Reagent | Invitrogen, Carlsbad, CA, USA | P50200 | Used for assessing cell viability via fluorescence. |
| SBI-0206965 (SBI) | BioVision, Milpitas, CA, USA | 9580 | Used as a modulator for pretreatment in bacterial death pathway studies. |
| Sodium dodecyl sulfate (SDS) | Sigma-Aldrich, St. Louis, MO, USA | L4509 | Used as a dispersant for copper nanoparticles to reduce aggregation. |
| Staphylococcus aureus | American Type Culture Collection (ATCC), Manassas, VA, USA Bioresource Collection and Research Center (BCRC), Hsinchu, Taiwan | 13567 | Bacteria for CuNP toxocity experiment |
| Varioskan LUX multimode microplate reader | Thermo Fisher Scientific, Waltham, MA, USA | VLBLATGD2 | Used for measuring fluorescence in cell viability assays |
| Wortmannin (Wort) | Abcam, MA, USA | ab120148 | Used as a modulator for pretreatment in bacterial death pathway studies. |
| Z-VAD-FMK (Z-VAD) | Sigma-Aldrich, St. Louis, MO, USA | V116 | Used as a modulator for pretreatment in bacterial death pathway studies. |
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。