Method Article
Köpek Nazal İmmün Mikroçevresinin Örneklenmesi için Tuzlu Su Lavajı
Bu Makalede
Özet
Tuzlu burun lavajı, köpek burun bağışıklık mikroçevresini örneklemek için kullanılabilir. Yaklaşım nispeten non-invaziv olduğu ve burun dokularını bozmadığı için seri olarak uygulanabilir. Nazal lavaj tekniğinden toplanan hücreler ve proteinler çeşitli laboratuvar analizleri için işlenebilir.
Özet
Köpek burun boşluğunun lokal bağışıklık mikro ortamının değerlendirilmesi, normal doku sağlığı ve hastalık durumlarının, özellikle de lokal inflamasyonla ilişkili olanların araştırılması için önemli olabilir. Seri nazal lavaj yoluyla köpeklerin lokal nazal bağışıklık mikro çevresini değerlendirmek için bir tekniği optimize ettik. Kısaca, anestezi altındaki köpeklerde ve sternal yaslanma pozisyonunda, önceden ısıtılmış steril salin, esnek bir yumuşak kauçuk kateter kullanılarak etkilenen burun deliğine akıtılır. Sıvı geri akışı konik borularda toplanır ve bu işlem tekrarlanır. Yerinden çıkmış hücreler ve proteinler içeren sıvılar toplanır ve havuzlanan nazal lavaj örnekleri, büyük döküntüleri ve mukusu uzaklaştırmak için bir hücre süzgecinden süzülür. Numuneler santrifüjlenir ve hücre peletleri analiz için izole edilir. Numuneler işlendikten sonra, nazal lavajı takip edebilecek analizler arasında akış sitometrisi, toplu veya tek hücreli RNA dizilimi yoluyla hücrelerin transkriptomik analizi ve/veya lavaj sıvısında bulunan sitokinlerin miktar tayini yer alır.
Giriş
Köpekler yaşamları boyunca rutin olarak inflamatuar burun rahatsızlıkları geliştirirler. Köpeklerde akut veya kronik rinitin altında yatan neden, bulaşıcı (viral: örneğin, grip, parainfluenza, herpesvirüsler; bakteriyel [örneğin, Bordetella, mikoplazmalar], mantar [örneğin, aspergilloz, kriptokokoz]; parazitik [örneğin, burun akarları]) neoplastik (örneğin, sinonazal maligniteler, en yaygın olarak karsinom veya sarkom histotipleri) yabancı maddelere (örneğin, yabancı cisim, yer değiştirmiş dişlerin intranazal göçü) periodontal hastalığa kadar değişebilir. yanı sıra köpek idiyopatik inflamatuar rinit 1,2,3,4,5,6,7.
Fizik muayeneye ek olarak, burun iltihabı olan köpeklerde sinonazal boşluğun durumunu değerlendirmek için çeşitli yaklaşımlar kullanılır. Görüntüleme prosedürleri radyografileri (diş, kafatası), bilgisayarlı tomografi (BT) veya manyetik rezonans görüntülemeyi (MRI) içerebilir. Burun boşluğunu görüntülemek için başka bir yaklaşım rinoskopidir. Doku örneklemesi, sitolojik ve/veya histopatolojik değerlendirmenin yapılabileceği burun sürüntüleri, fırça örnekleri veya doku biyopsilerinin alınmasını ve ayrıca mantar veya bakteri kültürü için örnek gönderimini içerebilir. Bu örnekler, "kör" örneklemeden, rinoskopi veya ileri görüntüleme ile görüntü kılavuzluğuna kadar çeşitli yaklaşımlarla elde edilebilir ve burun bölgesinden, nazofarenksten veya trefinasyon, rinotomi veya sinüzotomi gibi cerrahi bir yaklaşımla elde edilebilir.
Burun boşluğuna steril salin uygulanmasını içeren burun lavajı, teşhis ve tedavi amaçlı köpek burun boşluğundan numune almak için de kullanılmıştır. Nazal tümörler için kullanılan nazal lavaj tekniğinin alternatif bir versiyonu, nazal hidropulsiyon olarak adlandırılır ve tanısal değerlendirme için büyük tümör örneklerini yerinden çıkarabilen ve aynı zamanda nazal kanser ile ilişkili klinik belirtilerin iyileştirilmesi için terapötik rahatlama sağlayan güçlü burun kızarması olarak tanımlanır8.
Burada, nazal immün mikroçevrenin hücrelerini ve proteinlerini toplamak ve analiz etmek amacıyla nazal lavaj tekniğinin başka bir versiyonunu sunuyoruz. Nazik, nispeten invaziv olmayan bir yaklaşımla, bu nazal lavaj tekniğini seri nazal immün mikroçevre örneklemesi için optimize ettik. İltihapsız burun boşlukları, aktif herpes virüsü enfeksiyonu ve sinonazal tümörleri olan köpekleri içeren denemelerde, aşağı akış uygulamaları için numunelerin toplanması ve işlenmesi için nazal lavajın faydasını gösterdik 9,10.
Bu yazıda, köpek nazal immün mikroçevresinin seri örneklemesi için bir tuzlu burun lavajı tekniği tanımlanmıştır. Nazal lavaj örneğinin dokularda minimum bozulma ile etkili bir şekilde elde edilmesi ve ardından örneklerin çeşitli analizler için işlenmesi için protokol ayrıntıları sağlıyoruz.
Protokol
Bu nazal lavaj prosedürü, Colorado Eyalet Üniversitesi Kurumsal Hayvan Bakımı ve Kullanımı Komitesi ve Klinik İnceleme Kurulu (IACUC # 2425) tarafından onaylanmıştır. Nazal lavaj yönteminin bir şeması Şekil 1'de sunulmuştur.
1. Burun lavajı için hazırlık
- Nazal lavaj işleminden bir gün önce, beş adet 20 mL'lik şırıngayı steril fizyolojik salin (% 0.9 sodyum klorür çözeltisi) ile doldurun ve bir kapakla kapatın. Şırıngaları, gece boyunca ısınabilmeleri için 37 °C'ye ayarlanmış bir inkübatöre yerleştirin.
2. Köpeği burun lavajı için konumlandırma
- Prosedür için köpeği uyuşturun (ör., intravenöz (IV) deksmedetomidin (1-4 μg / kg) ve butorphanol (0.2-0.5 mg / kg) enjeksiyonu ile bir IV kateter aracılığıyla), ardından propofol IV (2-5 mg / kg) entübasyon için titre edilir; Etkili olması için% 1-2 inhalan izofluran ile anesteziyi sürdürün.) Palpebral yanıtı ve çene tonusunu kontrol ederek uygun anestezi derinliğini onaylayın.
- İşlem sırasında kurumasını önlemek için gözleri yağlayın.
- İşlem boyunca kardiyak telemetri, kan basıncı, kapnografi ve nabız oksimetre değerlerini izleyin.
- Anestezi uygulanmış köpeği sternal yaslanacak şekilde konumlandırın. Köpeğin kafasını, optimum nazal lavaj örneği toplamak için tedavi masasının kenarından aşağı doğru bir açıyla doğal ve rahat bir açıyla açılandıracak şekilde yerleştirin.
- Hava yolunun sıkı bir şekilde kapatılmasını sağlamak için endotrakeal tüpün manşetini şişirin.
3. Burun lavajının yapılması
- Tabanda 8 FR steril, kırmızı kauçuk kateter, ılık salin içeren önceden doldurulmuş 20 mL şırıngalardan birine sıkıca oturacak şekilde kesin. Steril bir kırmızı kauçuk kateter ölçün, böylece kateterin distal ucu burun deliğinden sokulduğunda burun boşluğunun yaklaşık ortasına kadar uzanacaktır. Bir burun tümöründen numune alıyorsanız, kırmızı kauçuk kateterin uzunluğunu ölçmek için burun tümörünün rostral yönünün konumunu tahmin etmek için görüntüleme veya rinoskopik rehberlik kullanın, böylece uç tümörün rostral yönüne uzanacaktır.
- Daha sonra burun boşluğuna yerleştirildiğinde ucun uygun yere inmesi için tanımlanan burun içi kateter uzunluğu için kateteri uçtan kesin. Bununla birlikte, burun deliğinin dışına uzanan kateter tabanı için ek uzunluk bırakın (şırınga sabitleme noktasından burun deliği girişine kadar kateter uzunluğu, yaklaşık 3-5 cm). Burun deliği girişine karşılık gelen başlangıç noktasını belirtmek için kateterin taban ucuna kalıcı bir işaretleyici ile bir işaret uygulayın; Önceden belirlenen kateter uzunluğu, kateter ucu burun boşluğu içinde istenen yere yerleştirilerek intranazal olarak uzanacaktır.
- Nazal lavaj prosedürünün gerçekleştirilmesi iki kişinin katılımını gerektirecektir. Bir kişiyi (Kişi A) kateteri burun boşluğuna beslemekten ve lavajı uygulamaktan ve diğer kişiyi (Kişi B) numuneyi burundan çıkarken almaktan sorumlu tutun.
- A Kişisinin kendisini köpeğin başının önünde ve altında konumlandırmasını sağlayın. Eldivenli ellerle, A Kişisinin kırmızı lastik kateterin ucunu nazikçe burun boşluğunun medial yönüne yönlendirmesini ve kateter üzerindeki işaret burun deliğinin dış yüzü ile aynı hizaya gelene kadar ilerletmesini sağlayın. Bu işlem sırasında, kateterin ısıtılmış steril salin içeren şırıngaya bağlı olduğundan emin olun. B Kişisinin, kateter yerindeyken burun deliğinin altında 50 mL'lik konik bir tüp tutmasını sağlayın.
- A kişisi, kontralateral burun deliğini nazikçe tıkar ve salini yavaş, sabit bir basınçla veya darbeli bir infüzyonla burun boşluğuna infüze etmeye başlar. Köpeğin kafası aşağı doğru bir açıyla konumlandırıldığından, B kişisi yerçekimi yoluyla burun boşluğundan dışarı akan sıvıyı 50 mL'lik konik tüpe toplar.
- Bu nazal lavaj tekniğini toplam beş adet 20 mL tuzlu su lavajı için tekrarlayın ve havuzlanan numuneleri toplamak için gerektiğinde konik tüpleri değiştirin. İşlemin tamamlanmasının ardından infüze edilen salin miktarına göre toplanan toplam nazal lavaj sıvısı hacmini kaydedin.
- Tamamlandıktan sonra, deksmedetomidin ile anestezi yapılırsa, deksmedetomidin için kullanılanla aynı hacimde atipamezolün intramüsküler olarak uygulayın ve köpeğin anesteziden kurtulmasına izin verin. Dikkatli olmak için, nazal lavajdan kalan tuzlu suyun ek drenajını kolaylaştırmak için köpeği baş aşağı bakacak şekilde sternal yaslanmada tutun.
4. Nazal lavaj örneğinin işlenmesi
- Kalıntı ve hücre kümelerini parçalamak için konik tüplerin içinde bulunan nazal lavaj örneklerini nazikçe girdaplayın ve/veya pipetleyin. Büyük kalıntıları ve mukusu gidermek için havuzlanmış nazal lavaj örneklerini 70 μm'lik bir hücre süzme filtresinden geçirin. Bir hücre peleti oluşturmak için numuneleri 300 × g'da 5-10 dakika santrifüjleyin.
- Süpernatanı bir pipetle aspirasyon yoluyla toplayın ve ilgilenilen proteinlerin analizi için temiz bir tüpe koyun.
- Hücre peletlerini fosfat tamponlu salin (PBS) veya ilgilenilen hücre tahlilleri için tercih edilen çözelti içinde yeniden süspanse edin.
- Örneklerden kırmızı kan hücrelerini temizlemek için, nazal lavajdan çekirdekli hücreleri toplamak için amonyum-klorür-potasyum (ACK) lizisi gerçekleştirin11,12.
Sonuçlar
Bu nazal lavaj yöntemiyle, toplanan örnek, tüp döndürüldüğünde muhtemelen görünür hücresel kalıntı ve mukus parçaları ile birlikte hafif bulanık görünecektir. Lavaj prosedürü yanlışlıkla kanamaya neden olursa ve numune kırmızıya boyanırsa, bir numune periferik kanla kontamine olarak kabul edilir. İnfüzyon edilen salinin bir kısmı prosedür sırasında kaybolacak olsa da, infüze edilen salin burun deliğinden tüpe geri akmazsa negatif bir lavaj düşünülecektir; Potansiyel nedenler, başın etkili bir geri akışa izin verecek kadar aşağı doğru eğilmemesi, numunenin kontralateral burun deliğinden kaudal veya lateral olarak dışarı boşalması veya kırmızı kauçuk kateterin şırıngaya sıkıca sabitlenmemesi ve salinin bağlantı noktasından dışarı doğru sızması olabilir.
Nazal kanserli köpeklerden nazal lavaj örnekleri başarıyla toplandığında,% 75-96 canlı hücre ile 1 × 10 6-200 × 106 aralığında çekirdekli hücre sayıları beklenir. Alternatif olarak, sağlıklı, iltihaplanmamış burun boşlukları olan köpeklerden nazal lavaj örnekleri başarılı bir şekilde toplandığında, hücre sayıları %6-16 canlı hücre ile 7 × 105-2 × 106 aralığında olmuştur. Tümör taşıyan köpeklerin nazal lavaj örneklemesinden elde edilen sitolojik örneklerin temsili bir görüntüsü Şekil 2'de yer almaktadır. Ek olarak, sağlıklı ve tümör taşıyan köpeklerin nazal lavaj örneklerinden analiz edilen hücresel popülasyonların akış sitometrik değerlendirmesi Şekil 3'te sunulmuştur. Hücre sayılarının ve bu aralıklardan daha düşük canlılık yüzdesinin, nazal lavaj prosedürünün ve numune toplamanın başarısız olduğunu göstermesi beklenir. Tablo 1, yazarlar tarafından gerçekleştirilen prosedür sayısı, köpek sayısı, burun boşluğunun durumu (sağlıklı veya tümör taşıyan), çekirdekli hücre sayımlarının verimi, prosedür için elde edilen hücrelerin canlılığı ve lavaj örneğinin aşağı akış analizi için başarılı mı yoksa başarısız mı olarak kabul edilip edilmediği ile ilgili olarak gerçekleştirilen nazal lavaj tekniğinin sonuçlarını özetlemektedir. Tablo 1'de yer alan nazal lavaj örnekleri ile yapılan deneylerin amaçları doğrultusunda, minimum 150.000 hücre sayısı verimi, başarılı bir nazal lavaj örneği koleksiyonu olarak kabul edildi.
Bu nazal lavaj tekniği ile hücreleri toplamak için steril% 0.9 salin kullanılır. Alternatif olarak, Hartmann'ın çözeltisi (laktasyonlu Ringer çözeltisi) düşünülebilir; bununla birlikte, salin veya Hartmann çözeltisi ile toplanan örneklerin, ilgili hücreler için karşılaştırılabilir canlılık ve sonuçlar sağlamak için test edilmesi gerekecektir. Ek olarak, tümör taşımayan köpeklerde kırmızı kauçuk kateter kullanmanın bir alternatifi, burun lavajını bir Foley kateteri ile yapmak olabilir. Burada sunulan nazal lavaj tekniğinde kullanılmamakla birlikte, Foley kateterin kullanılması, kateterin ucundaki balonun şişirilmesine, burun boşluğunun tıkanmasına ve kaudal olarak sıvı kaybının önlenmesine izin verecektir. Ayrıca, burada sunulan nazal lavaj işleme yaklaşımında test edilmemiş olsa da, nazal lavaj örneğine hyaluronidaz eklenmesinin, nazal lavaj örneğinde toplanan mukusu parçaladığı ve analiz için daha fazla hücreyi serbest bıraktığı düşünülebilir. Bunun aynı zamanda, nazal lavaj işleme prosedürüne hyaluronidaz ilavesi ile sonuçların değiştirilmemesini sağlamak için optimize edilmesi gerekecektir.
Köpek kanseri klinik çalışmasına kayıtlı köpeklerde gerçekleştirilen başarılı nazal lavaj prosedürlerinden elde edilen yayınlanmış sonuçlar Şekil 3: 10'da sunulmuştur. Şekil 3'te sunulan sonuçlar, elektif nodal ışınlamanın, tümörleri tek başına veya bölgesel servikal lenvikal lenf nodu ışınlaması ile kombinasyon halinde ışınlanan sinonazal tümörlü köpeklerin lokal immün mikro çevresi üzerindeki etkisini araştıran bir çalışmadan alınmıştır. Nazal lavaj ile yapılan klinik çalışmada köpeklerin burun boşluğunun seri örneklemesi yoluyla, toplanan hücrelerin akış sitometrik analizi, bölgesel lenf nodlarının sinonazal tümör ile eş zamanlı olarak ışınlandığı radyoterapinin son gününde, tümörü hedefleyen radyoterapi alan köpeklere kıyasla efektör T hücrelerinin popülasyonlarında önemli bir azalma olduğunu ortaya koydu ve bölgesel lenf düğümleri korundu. Bu, farklı noktalarda ve farklı tedavi koşullarında hücre popülasyonlarındaki değişimleri araştırmak için burun boşluğundan lavaj ile seri olarak numune almanın faydasını göstermektedir.

Şekil 1: Nazal lavaj yönteminin şeması. Isıtılmış, steril salin, kırmızı bir kauçuk kateter kullanılarak anestezi uygulanmış köpeklerin burun boşluğuna infüze edilir. Burun lavaj sıvısı, burundan dışarı akarken bir tüpe toplanır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
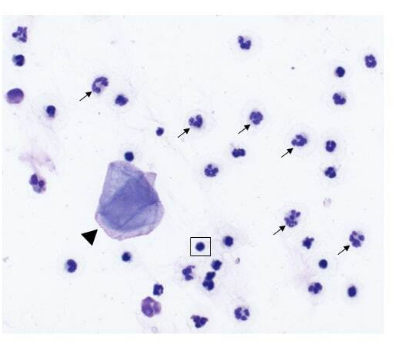
Şekil 2: Nazal tümörü olan bir köpekten toplanan nazal lavaj örneğinin hücresel bileşimi. Nazal lavaj örneklemesinden elde edilen sitolojik örneklerin temsili görüntüsü (500x büyütme, Modifiye Wright-Giemsa boyası). Nötrofiller (oklar) baskın hücrelerdir, birkaç skuamöz epitel hücresi (ok ucu) ve küçük olgun lenfositler (kare kutuda vurgulanmıştır) da mevcuttur. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
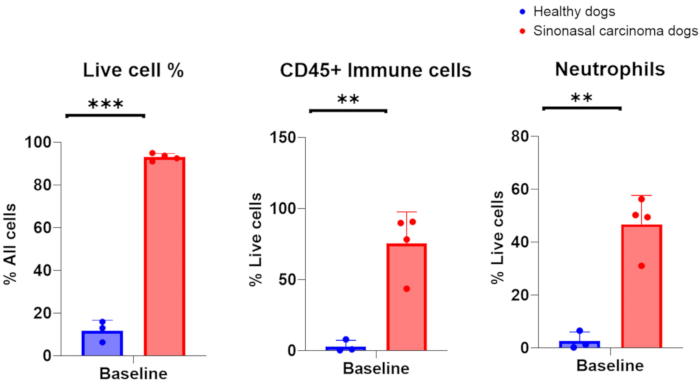
Şekil 3. Sağlıklı ve tümör taşıyan köpeklerden toplanan nazal lavaj örneklerinin akış sitometrik analizi. Sağlıklı köpekler (mavi, n = 3) ve sinonazal karsinomlu tümör taşıyan köpekler (kırmızı, n = 4) arasındaki canlı hücrelerin, bağışıklık hücrelerinin ve nötrofillerin bolluğunun karşılaştırılması. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
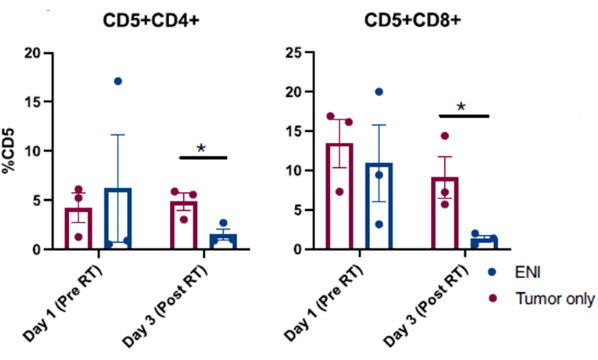
Şekil 4: Elektif nodal ışınlamanın (ENI) lokal immün mikro çevre üzerindeki etkisini araştıran bir klinik araştırmaya kayıtlı köpeklerden alınan nazal lavajdan toplanan hücrelerin akış sitometrik analizi. Nazal lavaj örneklerinden CD4 (CD5+CD4+) ve CD8 (CD5+CD8+) T hücrelerinin miktar tayini. Tümör ışınlaması ile eş zamanlı olarak ENI ile tedavi edilen köpekler (n = 3), radyasyonun son gününde (3. Gün) efektör CD4 ve CD8 T hücrelerini, yalnızca tümörü hedef alan radyasyonla tedavi edilen köpeklere kıyasla (n = 3) önemli ölçüde azaltmıştır. Bu rakam Darragh ve ark.10'dan değiştirilmiştir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| Sağlıklı (n=3) | Tümör yatağı (n= 19) | |
| Gerçekleştirilen işlem sayısı | 3 | 80 |
| Hücre sayısı | 0,7 x 106 - 2,8 x 106 | 1,6 x 106 - 210 x 106; Medyan: 8.7 x 106 |
| Hücre canlılığı | 6.3 - 15.9% | 75% - 96%; Medyan: %87 |
| Başarı oranı | 100% | 98.80% |
Tablo 1: Gerçekleştirilen nazal lavaj prosedürlerinin özeti ve elde edilen örneklerin hücresel özellikleri.
Tartışmalar
Nazal lavaj protokolünde birkaç kritik adım vardır. Nazal lavaj prosedürü uygulanan köpekle ilgili olarak, köpeğin kateter yerleştirilmesine veya lavaj uygulamasına tepki vermemesi için yeterince derin bir anestezi düzlemi içinde olması gerekir. Anestezi altında reaktif olurlarsa, bu, lavaj örneği toplamanın kalitesini ve miktarını tehlikeye atabilir ve ayrıca intranazal kateterden gelen lokal travma veya lavaj sıvısını aspire eden köpek için akut burun dokusu yaralanması risklerini potansiyel olarak artırabilir.
Köpeğin kafasının konumlandırılması da optimum burun lavajı örneği toplanması için kritik öneme sahiptir. Başın aşağı doğru açısı, damlatılan salinin yerçekimine bağlı geri akışı için yetersizse, nazal lavaj sıvısı kaudal olarak akabilir ve numune nazofarenksten kaybolabilir. Ek olarak, burun lavajı işlemi sırasında A Kişisi ile B Kişisi arasında net bir iletişim önemlidir. A Kişisi kızarırken sıvı burun deliğinden boşaldığından, toplama tüpünün yerleştirilmesi için B Kişisi tarafından hızlı ayarlamalar gerekebilir; Konik tüpe akan lavaj sıvısının görünürlüğü, prosedür sırasında hem A Kişisi hem de B Kişisi için tamamen net olmayabilir, bu nedenle süreç boyunca aktif iletişim, başarılı numune toplama için çok önemlidir. Nazal lavaj örneği toplandıktan sonra, hücre canlılığı gelecekteki analizler için korunacaksa, hücrelerin% 0.9 salin veya 1x PBS gibi fizyolojik bir pH çözeltisinde tutulması kritik öneme sahiptir.
Toplama ve işleme aşamaları boyunca nazal lavaj protokolünde değişiklikler yapılabilir. Numune toplama sırasında, köpeğin burun lavajına tepki vermemesini sağlamak için anestezi derinliği ayarlanabilir. Bu, anestezik gazın yüzdesini ayarlayarak (ör., izofluran) veya kısa etkili intravenöz anestezik bolus (ör., propofol).
Salinin burun boşluğuna damlatılmasından sonra, tüpte sadece küçük bir miktar sıvı toplanırsa, köpeğin kafasını aşağı doğru bir açıyla yeniden konumlandırın, böylece masanın kenarından rahatça dinlenir, sıvının burundan akmasına izin vermek için yerçekimi potansiyelini artırmak için. Kontralateral burun deliğinden sıvının aktığı not edilirse, aşağıdaki lavajlar için kontralateral burun deliğini sıkıca kapatın. İşleme aşaması sırasında, ilk numune hücresi sayısı düşükse, toplam verimi artırmak için mevcut olabilecek ek hücreleri toplamak için numunenin süpernatan kısmını yeniden santrifüjleyin.
Köpek burun bağışıklık mikroçevresini analiz etmek için nazal lavaj yöntemini kullanmanın dikkate değer sınırlamaları vardır. Bu teknikle, nazal lavaj örnekleri, burun boşluğundan kolayca yerinden çıkan yüzey hücrelerinin ve proteinlerin bir koleksiyonudur. Bu yüzey hücreleri ve proteinler, köpek burun mikro çevresinin daha derin dokularını tamamen temsil etmeyebilir. İki burun boşluğu örnekleme tekniği arasındaki benzerlikleri ve farklılıkları belirlemek için köpek burun lavajının hücresel ve protein profillerini biyopsi örnekleriyle karşılaştırma çalışmaları devam etmektedir.
Bu sınırlamalara rağmen, köpek burun bağışıklık mikroçevresini örneklemek için nazal lavaj tekniği, mevcut yöntemlere alternatif bir yaklaşım sağlar. Bir doku biyopsisi veya hatta bir rinoskopi prosedürü ile karşılaştırıldığında, nazal lavaj köpek hastası için nispeten invaziv değildir. Doku biyopsisine kıyasla nazal lavaj yoluyla hücre ve proteinlerin toplanması, klinik olarak ilgili, uzun süreli veya önemli akut kanama risklerini azaltır; Nazal lavaj prosedürünü takiben, burun dokusu biyopsisine kıyasla muhtemelen daha az lokal iltihaplanma ve rahatsızlık vardır. Bu nedenle, analizler için zaman içinde birden fazla numune toplamak için nazal lavaj seri olarak gerçekleştirilebilir. Ek olarak, burun lavajı örneklerinin işlenmesinde, sonraki laboratuvar yöntemleri ve tahliller için hücresel bileşenin süpernatan içindeki proteinlerden ayrılması ile ilgili olarak doku biyopsi örneklerine kıyasla artan nispi kolaylık vardır.
Nazal lavaj yöntemi, bağışıklık mikroçevresi ile ilişkili araştırma alanlarında önemli uygulamalar için potansiyele sahiptir. Kanser araştırmalarında, nazal lavaj tekniğikullanılmıştır 10 ve tedavi koşullarına bağlı olarak tümör taşıyan köpeklerde burun boşluğu mikro ortamındaki seri değişiklikleri belgelemek için kullanılabilir; Bu nazal lavaj örnekleri, kanser tedavisine verilen yanıtları daha iyi anlamak için bağışıklık mikro ortamındaki değişimleri ilişkilendirmede de değerli olabilir. Nazal immün mikroçevredeki seri değişikliklerin araştırılmasının benzer yönleri, çok sayıda veterinerlik klinik ve translasyonel enfeksiyöz ve enflamatuar araştırma alanı için araştırılabilir ve araştırılabilir.
Açıklamalar
Yazarların beyan edebilecekleri herhangi bir çıkar çatışması yoktur.
Teşekkürler
Burada açıklanan köpek burun lavajı tekniği, K01 OD03109, CCTSI Colorado Pilot Hibe Ödülü, CSU CVMBS Koleji Araştırma Konseyi Paylaşılan Kaynaklar Programı ve CO HNC SPORE CA261605: Kariyer Geliştirme Programı tarafından desteklenen projeler aracılığıyla optimize edilmiştir. Şekil 1 , BioRender.com ile oluşturulmuştur.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1.5 mL Tubes | Eppendorf | 05-402 | |
| 1000 µL Pipette | VWR | 89079-974 | |
| 1x PBS | Corning | 21-040-CV | |
| 20 mL Syringes | VWR | BD302830 | |
| 50 mL Conical Tubes | VWR | 89039-656 | |
| 70 µm Cell Strainer | Fisherbrand | 22-363-548 | |
| 8FR Sterile Red Rubber Catheter | Med Vet International | 50-252-2428 | |
| ACK Lysis Buffer | Gibco | A1049201 | |
| Centrifuge | Beckman Coulter | 366816 | |
| Physiological Saline (0.9%) | Vetivex | 17033-492-01 | |
| Vortex | VWR | 10153-838 |
Referanslar
- Cohn, L. A. Canine nasal disease: An update. Vet Clin: Small Anim Pract. 50 (2), 359-374 (2020).
- Mortier, J., Blackwood, L. Treatment of nasal tumours in dogs: A review. J Small Anim Pract. 61 (7), 404-415 (2020).
- Plickert, H., Tichy, A., Hirt, R. Characteristics of canine nasal discharge related to intranasal diseases: A retrospective study of 105 cases. J Small Anim Pract. 55 (3), 145-152 (2014).
- Windsor, R. C., Johnson, L. R. Canine chronic inflammatory rhinitis. Clin Tech Small Anim Practice. 21 (2), 76-81 (2006).
- Van Pelt, D. R., Mckiernan, B. C. Pathogenesis and treatment of canine rhinitis. Vet Clin North Am Small Anim Pract. 24 (5), 789-806 (1994).
- Hazuchova, K., Neiger, R., Stengel, C. Topical treatment of mycotic rhinitis-rhinosinusitis in dogs with meticulous debridement and 1% clotrimazole cream: 64 cases (2007-2014). JAVMA. 250 (3), 309-315 (2017).
- Lobetti, R. Idiopathic lymphoplasmacytic rhinitis in 33 dogs. JS Afr Vet Assoc. 85 (1), 1-5 (2014).
- Ashbaugh, E. A., Mckiernan, B. C., Miller, C. J., Powers, B. Nasal hydropulsion: A novel tumor biopsy technique. JAAHA. 47 (5), 312-316 (2011).
- Wheat, W., et al. Local immune and microbiological responses to mucosal administration of a liposome-tlr agonist immunotherapeutic in dogs. BMC Vet Res. 15 (1), 330(2019).
- Darragh, L. B., et al. Elective nodal irradiation mitigates local and systemic immunity generated by combination radiation and immunotherapy in head and neck tumors. Nat Commun. 13 (1), 7015(2022).
- Pinard, C. J., et al. Evaluation of lymphocyte-specific programmed cell death protein 1 receptor expression and cytokines in blood and urine in canine urothelial carcinoma patients. Vet Comp Oncol. 20 (2), 427-436 (2022).
- Choi, J. W., et al. Development of canine pd-1/pd-l1 specific monoclonal antibodies and amplification of canine t cell function. PLoS One. 15 (7), e0235518(2020).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır