Method Article
用于犬鼻免疫微环境采样的盐水灌洗
摘要
盐水洗鼻可用于对犬鼻免疫微环境进行采样。因为这种方法相对无创并且不会破坏鼻组织,所以可以连续进行。从洗鼻技术中收集的细胞和蛋白质可以处理用于各种实验室分析。
摘要
评估犬鼻腔的局部免疫微环境对于研究正常的组织健康和疾病状况非常重要,尤其是与局部炎症相关的组织和疾病状况。我们优化了一种技术,通过连续洗鼻来评估狗的局部鼻免疫微环境。简而言之,在狗处于麻醉状态并位于胸骨卧位的情况下,使用柔性软橡胶导管将预热的无菌盐水冲洗到受影响的鼻孔中。流体回流被收集到锥形管中,并重复此过程。混合含有脱落细胞和蛋白质的液体,混合的洗鼻液样品通过细胞过滤器过滤,以去除大碎片和粘液。离心样品并分离细胞沉淀进行分析。处理完样品后,洗鼻后可能进行的分析包括流式细胞术、通过大块或单细胞 RNA 序列对细胞进行转录组学分析和/或灌洗液中存在的细胞因子的定量。
引言
狗一生中经常会出现炎症性鼻部疾病。犬急性或慢性鼻炎的根本原因包括感染性(病毒性:例如流感、副流感、疱疹病毒;细菌 [例如博德特氏菌、支原体]、真菌 [例如曲霉菌病、隐球菌病];寄生虫 [例如鼻螨]到肿瘤(例如鼻窦恶性肿瘤,最常见的是癌症或肉瘤组织型)到异物(例如异物、移位牙齿的鼻内迁移)再到牙周病, 以及犬特发性炎症性鼻炎 1,2,3,4,5,6,7。
除了身体检查外,还使用了各种方法来评估患有鼻炎的狗的鼻窦腔状况。影像学检查可能包括 X 光片(牙科、颅骨)、计算机断层扫描 (CT) 或磁共振成像 (MRI)。另一种鼻腔成像方法是鼻镜检查。组织取样可包括采集鼻拭子、刷状样本或组织活检,从中可以进行细胞学和/或组织病理学评估,以及提交样本进行真菌或细菌培养。这些样本可以通过多种方法获得,从“盲目”采样到鼻镜或高级成像的图像引导,并通过鼻孔、鼻咽部或环钻术、鼻切开术或鼻窦切开术的手术方法获得。
洗鼻,包括将无菌盐水注入鼻腔,也已用于对犬鼻腔进行采样,用于诊断和治疗目的。用于鼻肿瘤的洗鼻技术的另一种版本称为鼻灌水,被描述为强力鼻腔冲洗,它可以移开大肿瘤样本进行诊断评估,并为改善与鼻癌相关的临床症状提供治疗缓解8。
我们在这里介绍另一种版本的洗鼻技术,其预期目的是收集和分析鼻腔免疫微环境的细胞和蛋白质。通过一种温和、相对无创的方法,我们优化了这种洗鼻技术,用于连续鼻免疫微环境采样。在涉及鼻腔未发炎、活动性疱疹病毒感染和鼻窦肿瘤的狗的试验中,我们已经证明了洗鼻液在收集和处理下游应用样本方面的效用 9,10。
在这份手稿中,我们描述了一种用于对犬鼻免疫微环境进行连续采样的盐水洗鼻技术。我们提供了有效采集洗鼻样本的方案细节,对组织的影响最小,然后处理样本以进行各种分析。
研究方案
这种洗鼻手术已获得科罗拉多州立大学机构动物护理和使用委员会和临床审查委员会 (IACUC #2425) 的批准。洗鼻方法的示意图如图 1 所示。
1. 准备洗鼻
- 洗鼻手术前一天,用无菌生理盐水(0.9% 氯化钠溶液)装满五个 20 mL 注射器,并用盖子盖上。将注射器放入设置为 37 °C 的培养箱中,以便它们可以加热过夜。
2. 调整狗狗的洗鼻姿势
- 麻醉狗进行手术(例如,通过 IV 导管静脉内 (IV) 注射右美托咪定 (1-4 μg/kg) 和布托啡诺 (0.2-0.5 mg/kg),然后给予异丙酚 IV (2-5 mg/kg) 滴定至插管效果;用 1-2% 吸入剂异氟醚维持麻醉以发挥作用。通过检查睑反应和下颌张力来确认适当的麻醉深度。
- 润滑眼睛以防止手术过程中干燥。
- 在整个手术过程中监测心脏遥测、血压、二氧化碳图和脉搏血氧饱和度值。
- 将麻醉的狗置于胸骨卧位。放置狗的头部,使其从治疗台边缘自然舒适地向下倾斜,以实现最佳的鼻腔灌洗样本采集。
- 给气管插管的套囊充气,以确保气道的紧密密封。
3. 进行洗鼻
- 在底部切出一根 8 FR 无菌红色橡胶导管,使其紧贴在装有温盐水的预装 20 mL 注射器之一上。测量无菌红色橡胶导管,以便通过鼻孔引入导管的远端尖端时,导管的远端将延伸到鼻腔的大约中间。如果对鼻肿瘤进行取样,请使用影像学或鼻镜引导来估计鼻肿瘤喙侧的位置,以测量红色橡胶导管的长度,以便尖端延伸到肿瘤的喙侧。
- 然后,在尖端切开导管,使其达到规定的鼻内导管长度,以便尖端在插入鼻腔时落在适当的位置。但是,为延伸到鼻孔外的导管底部留出额外的长度(从注射器固定点到鼻孔入口的导管长度,大约 3-5 厘米)。在导管的基端贴上带有永久性记号笔的标记,以指示起点,对应于鼻孔入口;预定的导管长度将跨越鼻内,导管尖端位于鼻腔内的所需位置。
- 进行洗鼻手术需要两个人的参与。让一个人(人员 A)负责将导管送入鼻腔并进行灌洗,另一个人(人员 B)负责收集从鼻子流出的样本。
- 让 A 将自己放在狗的头前面和下面。戴上手套的手,让 A 轻轻地将红色橡胶导管的尖端引导到鼻腔的内侧,然后向前推进,直到导管上的标记与鼻孔的外侧对齐。在此过程中,确保导管连接到装有加热无菌盐水的注射器。让 B 将一根 50 mL 锥形管放在鼻孔下方,并将导管固定到位。
- A 轻轻堵塞对侧鼻孔,开始以缓慢、稳定的压力或脉冲输注将盐水注入鼻腔。由于狗的头部呈向下角度放置,因此 B 将液体收集起来,这些液体通过重力从鼻腔流出,进入 50 mL 锥形管。
- 重复这种洗鼻技术,最多总共 5 次 20 mL 盐水灌洗,根据需要更换锥形管,以收集混合样品。记录收集的洗鼻液总量相对于手术完成后输注的生理盐水量。
- 完成后,如果用右美托咪定麻醉,肌肉注射与右美托咪定相同体积的阿替美唑,并让狗从麻醉中恢复。为谨慎起见,请让狗保持胸骨卧位,头部朝下,以利于从洗鼻液中额外排出任何残留的盐水。
4. 处理洗鼻样本
- 轻轻涡旋和/或移液锥形管中包含的洗鼻液样品,以打碎碎屑和细胞团块。将混合的洗鼻液样品通过 70 μm 细胞过滤过滤器,以去除大碎片和粘液。将样品以 300 × g 离心 5-10 分钟以形成细胞沉淀。
- 用移液管抽吸收集上清液,并将其沉积在干净的试管中,用于分析感兴趣的蛋白质。
- 将细胞沉淀重悬于磷酸盐缓冲盐水 (PBS) 或目标细胞分析的首选溶液中。
- 为了从样品中清除红细胞,进行氯化铵钾 (ACK) 裂解,从鼻腔灌洗中收集有核细胞11,12。
结果
使用这种洗鼻方法,收集的样本会显得略微浑浊,当试管旋转时,可能会有可见的细胞碎片和粘液。如果灌洗程序无意中引起出血,并且样本呈红色,则视为样本被外周血污染。虽然一些注入的盐水在手术过程中会丢失,但如果注入的盐水没有从鼻孔流回管中,则考虑阴性灌洗;可能的原因可能是头部没有充分向下倾斜以允许有效的回流,样品已通过对侧鼻孔从尾部或横向排出,或者红色橡胶导管未紧紧固定在注射器上,盐水从连接点向外泄漏。
当从患有鼻癌的狗身上成功收集洗鼻样本时,预计有核细胞计数在 1 × 10 6-200 × 10 6 之间,其中 75-96% 的活细胞。或者,当从具有其他方面健康、无炎症的鼻腔的狗中成功收集洗鼻样本时,细胞计数在 7 × 105-2 × 106 的范围内,活细胞为 6-16%。图 2 显示了从荷瘤狗的鼻腔灌洗采样中获得的细胞学标本的代表性图像。此外,图 3 显示了从健康和荷瘤狗的洗鼻样本中分析的细胞群的流式细胞术评估。预计细胞计数和活力百分比低于这些范围表明洗鼻程序和样本采集不成功。表 1 总结了作者进行的洗鼻技术的结果,涉及执行的手术数量、狗的数量、鼻腔状况(健康或携带肿瘤)、有核细胞计数的产量、为手术获得的细胞活力,以及灌洗样本是否被认为是下游分析的成功或失败。对于使用表 1 中包含的洗鼻样品进行的实验,最低细胞数产量为 150,000 个被认为是成功的洗鼻样品采集。
通过这种洗鼻技术,使用无菌 0.9% 盐水收集细胞。或者,可以考虑 Hartmann 溶液(乳酸林格氏液);但是,需要对使用生理盐水或 Hartmann 溶液采集的样品进行测试,以确保目标细胞的活力和结果相当。此外,在非荷瘤狗中使用红色橡胶导管的替代方法是使用 Foley 导管进行洗鼻。虽然此处介绍的洗鼻技术未使用,但使用 Foley 导管将允许球囊在导管尖端充气,阻塞鼻腔并防止尾部液体流失。此外,虽然未在此处介绍的洗鼻处理方法中进行测试,但可以考虑在洗鼻样品中添加透明质酸酶以分解洗鼻样品中收集的粘液并释放更多细胞进行分析。这也需要进行优化,以确保在洗鼻处理程序中添加透明质酸酶不会改变结果。
图 310 显示了在参加犬癌临床试验的狗中成功进行洗鼻手术所获得的已发表结果。图 3 中呈现的结果来自一项研究,该研究调查了选择性淋巴结照射对鼻窦肿瘤狗局部免疫微环境的影响,这些鼻窦肿瘤要么单独照射,要么与局部颈部淋巴结照射联合照射。通过对洗鼻临床试验中狗鼻腔的连续采样,对收集的细胞进行流式细胞术分析,结果显示,与接受针对肿瘤的放疗的狗相比,当区域淋巴结与鼻窦肿瘤同时照射时,放疗最后一天效应 T 细胞群显着减少,并且区域淋巴结幸免于难。这证明了用灌洗液对鼻腔进行连续采样以研究不同点和不同治疗条件下细胞群变化的实用性。

图 1:洗鼻法示意图。 使用红色橡胶导管将加热的无菌盐水注入麻醉狗的鼻腔中。洗鼻液从鼻子流出时被收集到一根管子中。 请单击此处查看此图的较大版本。
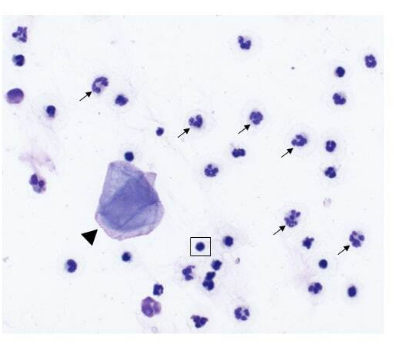
图 2:从患有鼻肿瘤的狗身上收集的洗鼻液样本的细胞组成。 从鼻腔灌洗采样中获得的细胞学标本的代表性图像(500 倍放大倍率,改良 Wright-Giemsa 染色)。中性粒细胞(箭头)是主要细胞,也存在一些鳞状上皮细胞(箭头)和小的成熟淋巴细胞(在方框中突出显示)。 请单击此处查看此图的较大版本。
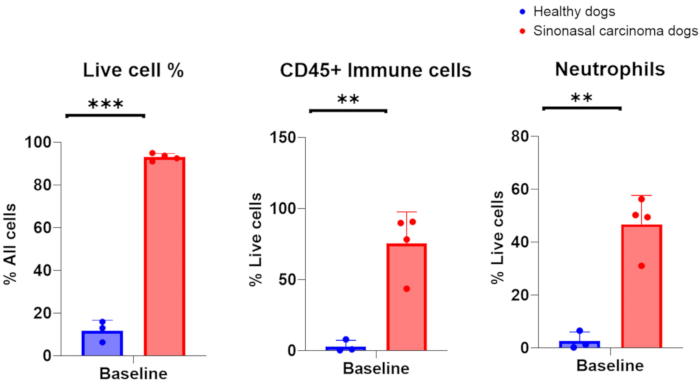
图 3.对从健康和荷瘤狗收集的洗鼻样本进行流式细胞术分析。 健康犬(蓝色,n = 3)和荷瘤鼻窦癌犬(红色,n = 4)之间活细胞、免疫细胞和中性粒细胞丰度的比较。 请单击此处查看此图的较大版本。
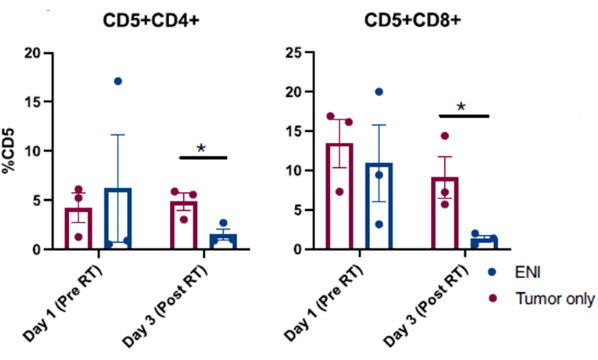
图 4:对参加择期淋巴结照射 (ENI) 对局部免疫微环境影响的临床试验的狗鼻腔灌洗中收集的细胞进行流式细胞术分析。 定量洗鼻样本中的 CD4 (CD5+CD4+) 和 CD8 (CD5+CD8+) T 细胞。与仅接受针对肿瘤的放疗的狗 (n = 3) 相比,用 ENI 治疗同时进行肿瘤照射的狗 (n = 3) 在放疗的最后一天 (第 3 天) 效应 CD4 和 CD8 T 细胞显著减少。该图是从 Darragh 等人 10 修改而来的。 请单击此处查看此图的较大版本。
| 正常 (n=3) | 荷瘤 (n= 19) | |
| 执行的程序数量 | 3 | 80 |
| 细胞计数 | 0.7 x 106 - 2.8 x 106 | 1.6 x 106 - 210 x 106;中位数: 8.7 x 106 |
| 细胞活力 | 6.3 - 15.9% | 75% - 96%;中位数:87% |
| 成功率 | 100% | 98.80% |
表 1:进行的洗鼻程序和所获得样品的细胞特性总结。
讨论
洗鼻方案有几个关键步骤。对于接受洗鼻手术的狗,狗必须在足够深的麻醉平面内,这样它们就不会对导管放置或灌洗给药做出反应。如果它们在麻醉下有反应,这可能会损害灌洗样本采集的质量和数量,并可能增加由于鼻内导管局部创伤或狗吸入灌洗液而导致急性鼻组织损伤的风险。
狗头部的位置对于最佳洗鼻样本采集也至关重要。如果头部的向下角度不足以使滴注的盐水在重力依赖性回流中,则洗鼻液可能会沿尾部流动,样品可能会通过鼻咽部丢失。此外,在洗鼻过程中,A 和 B 之间的清晰沟通很重要。人员 B 可能需要快速调整收集管的放置,因为在人员 A 冲洗时液体会从鼻孔流出;在手术过程中,人员 A 和人员 B 可能都无法完全清楚地看到流入锥形管的灌洗液,因此在整个过程中的积极沟通是成功采集样本的关键。收集鼻腔灌洗样品后,如果要保留细胞活力以备将来分析,则必须将细胞维持在生理 pH 溶液中,例如 0.9% 盐水或 1x PBS。
在整个收集和处理阶段,可以对洗鼻方案进行修改。在样本采集过程中,可以调整麻醉深度以确保狗不会对洗鼻产生反应。这可以通过调整麻醉气体(例如异氟醚)的百分比或推注短效静脉麻醉剂(例如异丙酚)来实现。
如果在将盐水滴入鼻腔后,管中仅收集了少量液体,请将狗的头部向下重新定位,使其舒适地靠在桌子边缘上,以增加重力的可能性,让液体从鼻子流出。如果注意到液体从对侧鼻孔流出,请紧紧闭对侧鼻孔以进行以下灌洗。在处理阶段,如果初始样品细胞计数较低,请重新离心样品的上清液部分,以收集可能存在的任何其他细胞,从而提高总产量。
利用洗鼻法分析犬鼻免疫微环境存在明显的局限性。使用这种技术,洗鼻样本是来自鼻腔的表面细胞和蛋白质的集合,很容易脱落。这些表面细胞和蛋白质可能无法完全代表犬鼻微环境的更深组织。正在努力将犬鼻灌洗液的细胞和蛋白质谱与活检样本进行比较,以确定两种鼻腔采样技术之间这些因素的相似性和差异性。
尽管存在这些限制,但用于对犬鼻免疫微环境进行采样的洗鼻技术为现有方法提供了一种替代方法。与组织活检甚至鼻镜检查程序相比,洗鼻对犬类患者来说相对无创。与组织活检相比,通过鼻腔灌洗收集细胞和蛋白质可降低临床上令人担忧的、长期或严重的急性出血的风险;与鼻组织活检相比,洗鼻手术后的局部炎症和不适也可能较少。因此,可以连续进行洗鼻,以随着时间的推移收集多个样本进行分析。此外,与组织活检样品相比,在将细胞成分与上清液中的蛋白质分离用于下游实验室方法和测定方面,处理鼻腔灌洗样品的难度更高。
洗鼻方法在与免疫微环境相关的研究领域具有重要应用的潜力。在癌症研究中,洗鼻技术已被使用10 并且可用于记录荷瘤犬鼻腔微环境相对于治疗条件的连续变化;这些洗鼻样本也可能被证明在关联免疫微环境的变化以更好地了解对癌症治疗的反应方面很有价值。研究鼻免疫微环境序列变化的类似方面可以在许多兽医临床和转化感染和炎症研究领域进行探索和研究。
披露声明
作者没有需要声明的利益冲突。
致谢
本文描述的犬鼻灌洗技术已通过 K01 OD03109、CCTSI 科罗拉多州试点资助奖、CSU CVMBS 学院研究委员会共享资源计划和 CO HNC SPORE CA261605:职业提升计划支持的项目进行了优化。 图 1 是使用 BioRender.com 创建的。
材料
| Name | Company | Catalog Number | Comments |
| 1.5 mL Tubes | Eppendorf | 05-402 | |
| 1000 µL Pipette | VWR | 89079-974 | |
| 1x PBS | Corning | 21-040-CV | |
| 20 mL Syringes | VWR | BD302830 | |
| 50 mL Conical Tubes | VWR | 89039-656 | |
| 70 µm Cell Strainer | Fisherbrand | 22-363-548 | |
| 8FR Sterile Red Rubber Catheter | Med Vet International | 50-252-2428 | |
| ACK Lysis Buffer | Gibco | A1049201 | |
| Centrifuge | Beckman Coulter | 366816 | |
| Physiological Saline (0.9%) | Vetivex | 17033-492-01 | |
| Vortex | VWR | 10153-838 |
参考文献
- Cohn, L. A. Canine nasal disease: An update. Vet Clin: Small Anim Pract. 50 (2), 359-374 (2020).
- Mortier, J., Blackwood, L. Treatment of nasal tumours in dogs: A review. J Small Anim Pract. 61 (7), 404-415 (2020).
- Plickert, H., Tichy, A., Hirt, R. Characteristics of canine nasal discharge related to intranasal diseases: A retrospective study of 105 cases. J Small Anim Pract. 55 (3), 145-152 (2014).
- Windsor, R. C., Johnson, L. R. Canine chronic inflammatory rhinitis. Clin Tech Small Anim Practice. 21 (2), 76-81 (2006).
- Van Pelt, D. R., Mckiernan, B. C. Pathogenesis and treatment of canine rhinitis. Vet Clin North Am Small Anim Pract. 24 (5), 789-806 (1994).
- Hazuchova, K., Neiger, R., Stengel, C. Topical treatment of mycotic rhinitis-rhinosinusitis in dogs with meticulous debridement and 1% clotrimazole cream: 64 cases (2007-2014). JAVMA. 250 (3), 309-315 (2017).
- Lobetti, R. Idiopathic lymphoplasmacytic rhinitis in 33 dogs. JS Afr Vet Assoc. 85 (1), 1-5 (2014).
- Ashbaugh, E. A., Mckiernan, B. C., Miller, C. J., Powers, B. Nasal hydropulsion: A novel tumor biopsy technique. JAAHA. 47 (5), 312-316 (2011).
- Wheat, W., et al. Local immune and microbiological responses to mucosal administration of a liposome-tlr agonist immunotherapeutic in dogs. BMC Vet Res. 15 (1), 330 (2019).
- Darragh, L. B., et al. Elective nodal irradiation mitigates local and systemic immunity generated by combination radiation and immunotherapy in head and neck tumors. Nat Commun. 13 (1), 7015 (2022).
- Pinard, C. J., et al. Evaluation of lymphocyte-specific programmed cell death protein 1 receptor expression and cytokines in blood and urine in canine urothelial carcinoma patients. Vet Comp Oncol. 20 (2), 427-436 (2022).
- Choi, J. W., et al. Development of canine pd-1/pd-l1 specific monoclonal antibodies and amplification of canine t cell function. PLoS One. 15 (7), e0235518 (2020).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。