Method Article
שטיפת מי מלח לדגימת מיקרו-סביבה חיסונית של האף של הכלבים
In This Article
Summary
ניתן להשתמש בשטיפת אף מלוחה כדי לדגום את המיקרו-סביבה החיסונית של האף הכלבי. מכיוון שהגישה אינה פולשנית יחסית ואינה משבשת את רקמות האף, ניתן לבצע אותה באופן סדרתי. ניתן לעבד תאים וחלבונים שנאספו מטכניקת שטיפת האף לניתוחי מעבדה שונים.
Abstract
הערכת המיקרו-סביבה החיסונית המקומית של חלל האף של הכלב יכולה להיות חשובה לחקירת בריאות רקמות תקינות ומצבי מחלה, במיוחד אלה הקשורים לדלקת מקומית. ביצענו אופטימיזציה של טכניקה להערכת המיקרו-סביבה החיסונית המקומית של כלבים באמצעות שטיפת אף סדרתית. בקצרה, כאשר כלבים מורדמים וממוקמים בשכיבה על עצם החזה, מי מלח סטריליים שחוממו מראש נשטפים לנחיר הפגוע באמצעות קטטר גומי רך וגמיש. זרימת הנוזל החוזרת נאספת לצינורות חרוטיים, ותהליך זה חוזר על עצמו. הנוזלים המכילים תאים וחלבונים שנעקרו מאוגדים, ודגימות שטיפת האף המאוגדות מסוננות דרך מסננת תאים כדי להסיר פסולת גדולה וריר. הדגימות עוברות צנטריפוגה וכדורי התא מבודדים לניתוח. לאחר עיבוד הדגימות, ניתוחים שעשויים לעקוב אחר שטיפת האף כוללים ציטומטריית זרימה, ניתוח טרנסקריפטומי של תאים באמצעות רצף RNA בתפזורת או חד-תאית, ו/או כימות של ציטוקינים הקיימים בנוזל השטיפה.
Introduction
כלבים מפתחים באופן שגרתי מצבים דלקתיים באף לאורך חייהם. הגורם הבסיסי לנזלת חריפה או כרונית בכלבים יכול לנוע בין זיהומי (ויראלי: למשל, שפעת, פאראינפלואנזה, וירוסי הרפס; חיידקים [למשל, בורדטלה, מיקופלזמה], פטרייתי [למשל, אספרגילוזיס, קריפטוקוקוזיס]; טפילי [למשל, קרדית האף]) לניאופלסטי (למשל, ממאירויות סינונאליות, לרוב קרצינומה או היסטוטיפים של סרקומה) לחומר זר (למשל, גוף זר, נדידה תוך-אפית של שיניים עקורות) למחלות חניכיים, כמו גם נזלת דלקתית אידיופטית כלבית 1,2,3,4,5,6,7.
בנוסף לבדיקה גופנית, נעשה שימוש בגישות שונות להערכת מצב החלל הסינונאלי בכלבים עם דלקת באף. הליכי הדמיה עשויים לכלול צילומי רנטגן (שיניים, גולגולת), טומוגרפיה ממוחשבת (CT) או הדמיית תהודה מגנטית (MRI). גישה נוספת להדמיית חלל האף היא רינוסקופיה. דגימת רקמות יכולה לכלול רכישת ספוגיות אף, דגימות מברשת או ביופסיות רקמות, מהן ניתן לבצע הערכה ציטולוגית ו/או היסטופתולוגית, כמו גם הגשת דגימות לתרבית פטרייתית או חיידקית. דגימות אלו עשויות להתקבל במגוון גישות, החל מדגימה "עיוורת", ועד להנחיית הדמיה עם רינוסקופיה או הדמיה מתקדמת, ונרכשות דרך הנרס, מהלוע האף, או בגישה כירורגית של טרפינציה, רינוטומיה או סינוסוטומיה.
שטיפת אף, הכוללת מתן מי מלח סטריליים לחלל האף, שימשה גם לדגימת חלל האף של הכלב למטרות אבחון וטיפול. גרסה חלופית של טכניקת שטיפת האף ששימשה לגידולי אף נקראת הידרופלסיה באף, המתוארת כשטיפה חזקה באף, שיכולה לעקור דגימות גידול גדולות להערכה אבחנתית וכן לספק הקלה טיפולית לשיפור הסימנים הקליניים הקשורים לסרטן האף8.
אנו מציגים כאן גרסה נוספת של טכניקת שטיפת האף למטרה המיועדת לאסוף ולנתח תאים וחלבונים של מיקרו-סביבת חיסון האף. באמצעות גישה עדינה ולא פולשנית יחסית, ביצענו אופטימיזציה של טכניקת שטיפת האף הזו לדגימת מיקרו-סביבה חיסונית סדרתית באף. בניסויים שכללו כלבים עם חללי אף לא דלקתיים, זיהום פעיל בנגיף ההרפס וגידולים סינונאליים, הדגמנו את התועלת של שטיפת אף לאיסוף ועיבוד דגימות ליישומים במורד הזרם 9,10.
בכתב יד זה, אנו מתארים טכניקה של שטיפת אף מלוחה לדגימה סדרתית של מיקרו-סביבת חיסון האף של הכלבים. אנו מספקים פרטי פרוטוקול לרכישת דגימת שטיפת האף ביעילות עם הפרעה מינימלית לרקמות ולאחר מכן, עיבוד הדגימות למגוון ניתוחים.
Protocol
הליך שטיפת אף זה אושר על ידי הוועדה המוסדית לטיפול ושימוש בבעלי חיים של אוניברסיטת קולורדו סטייט ומועצת הסקירה הקלינית (IACUC #2425). סכימה של שיטת שטיפת האף מוצגת באיור 1.
1. הכנה לשטיפת האף
- יום לפני הליך שטיפת האף, מלאו חמישה מזרקים של 20 מ"ל במי מלח פיזיולוגיים סטריליים (תמיסת נתרן כלורי 0.9%) וסגרו עם מכסה. מניחים את המזרקים באינקובטור המכוון ל-37 מעלות צלזיוסכדי שיוכלו להתחמם למשך הלילה.
2. מיקום הכלב לשטיפת האף
- להרדים את הכלב לצורך ההליך (למשל, עם הזרקה תוך-ורידית (IV) של דקסמדטומידין (1-4 מיקרוגרם/ק"ג) ובוטאורפנול (0.2-0.5 מ"ג/ק"ג) דרך צנתר IV), ולאחר מכן מתן פרופופול IV (2-5 מ"ג/ק"ג) המיועד לאינטובציה; לשמור על הרדמה עם 1-2% איזופלורן משאף כדי להשפיע.) אשר את עומק ההרדמה המתאים על ידי בדיקת תגובת פלפברל וטונוס הלסת.
- יש לשמן את העיניים כדי למנוע ייבוש במהלך ההליך.
- עקוב אחר טלמטריית לב, לחץ דם, קפנוגרפיה וערכי אוקסימטריית דופק לאורך כל ההליך.
- מקם את הכלב המורדם בשכיבה על עצם החזה. הנח את ראש הכלב כך שהוא יהיה בזווית טבעית ונוחה בזווית כלפי מטה מקצה שולחן הטיפולים לאיסוף דגימות שטיפת אף אופטימלי.
- נפח את השרוול של הצינור האנדוטרכיאלי כדי להבטיח אטימה הדוקה של דרכי הנשימה.
3. ביצוע שטיפת האף
- חותכים קטטר גומי אדום סטרילי 8 FR בבסיס כך שיתאים היטב לאחד ממזרקי 20 מ"ל הממולאים מראש המכילים את מי המלח החמים. מדוד קטטר גומי אדום סטרילי כך שהקצה הדיסטלי של הקטטר יימשך בערך עד אמצע הדרך לתוך חלל האף כאשר הוא מוחדר דרך הנחיר. אם דוגמים גידול באף, השתמש בהדמיה או בהנחיה רינוסקופית כדי להעריך את מיקום האספקטר הרוסטרלי של גידול האף למדידת אורך צנתר הגומי האדום כך שהקצה ישתרע עד להיבט הרוסטרלי של הגידול.
- לאחר מכן, חתוך את הקטטר בקצה לאורך הצנתר התוך-אף המוגדר כך שהקצה ינחת במיקום המתאים כאשר הוא מוכנס לחלל האף. עם זאת, אפשר אורך נוסף לבסיס הקטטר המשתרע מחוץ לנחיר (אורך הצנתר מנקודת קיבוע המזרק לכניסת הנחיר, כ-3-5 ס"מ). החל סימן עם טוש קבוע על קצה הבסיס של הצנתר כדי לציין את נקודת ההתחלה, המתאימה לכניסת הנחיר; אורך הצנתר שנקבע מראש יתפרש בתוך האף, כאשר קצה הצנתר ממוקם במיקום הרצוי בתוך חלל האף.
- ביצוע הליך שטיפת האף ידרוש השתתפות של שני אנשים. הפוך אדם אחד (אדם א') לאחראי על הזנת הקטטר לחלל האף ומתן השטיפה והאדם השני (אדם ב') לאיסוף הדגימה כשהיא יוצאת מהאף.
- בקש מאדם א' למקם את עצמו לפני ומתחת לראשו של הכלב. בידיים עטויות כפפות, בקש מאדם א' להנחות בעדינות את קצה קטטר הגומי האדום לתוך ההיבט המדיאלי של חלל האף ולקדם אותו עד שהסימן על הקטטר מתיישר עם ההיבט החיצוני של הנחיר. במהלך תהליך זה, ודא שהקטטר מחובר למזרק המכיל את מי המלח הסטריליים המחוממים. בקש מאדם ב' להחזיק צינור חרוטי של 50 מ"ל מתחת לנחיר כשהצנתר במקומו.
- אדם א' חוסם בעדינות את הנחיר הנגדי ומתחיל להחדיר את מי המלח לחלל האף בלחץ איטי ויציב או בעירוי פועם. כאשר ראשו של הכלב ממוקם בזווית כלפי מטה, אדם ב' אוסף את הנוזל שמתנקז מחלל האף באמצעות כוח הכבידה לתוך הצינור החרוטי של 50 מ"ל.
- חזור על טכניקת שטיפת האף הזו עד לסך של חמש שטיפות מי מלח של 20 מ"ל, והחלף צינורות חרוטיים, לפי הצורך, כדי לאסוף את הדגימות שנאספו. רשום את הנפח הכולל של נוזל שטיפת האף שנאסף ביחס לכמות מי המלח שהוחדרה לאחר השלמת ההליך.
- לאחר השלמתו, אם מורדמים עם דקסמדטומידין, יש לתת תוך שרירי את אותו נפח של אטיפמזול המשמש לדקסמדטומידין, ולאפשר לכלב להתאושש מההרדמה. כדי להיות זהירים, החזיקו את הכלב בשכיבה חזה כשהראש ממוקם כלפי מטה כדי להקל על ניקוז נוסף של שאריות מלח משטיפת האף.
4. עיבוד דגימת שטיפת האף
- מערבולת ו/או פיפטה בעדינות את דגימות שטיפת האף הכלולות בצינורות החרוטיים כדי לפרק גושי פסולת ותאים. העבירו את דגימות שטיפת האף המאוגדות דרך מסנן מאמץ תאים של 70 מיקרומטר כדי להסיר פסולת גדולה וריר. צנטריפוגה את הדגימות ב-300 × גרם למשך 5-10 דקות ליצירת כדור תא.
- אסוף את הסופרנטנט באמצעות שאיפה עם פיפטה והפקיד אותו בשפופרת נקייה לניתוח חלבונים מעניינים.
- השעו מחדש כדורי תאים בתמיסת מלח עם פוספט (PBS) או תמיסה מועדפת לבדיקות תאים מעניינות.
- כדי לנקות כדוריות דם אדומות מהדגימות, בצע ליזה של אמוניום-כלוריד-אשלגן (ACK) כדי לאסוף תאים גרעיניים משטיפת האף11,12.
תוצאות
בשיטת שטיפת אף זו, הדגימה שנאספה תיראה מעט עכורה, אולי עם חתיכות גלויות של פסולת תאית וריר כאשר הצינור מסתחרר. דגימה תיחשב מזוהמת בדם היקפי אם הליך השטיפה גורם בטעות לדימום, והדגימה צבועה באדום. בעוד שחלק ממי המלח המוחדרים יאבדו במהלך ההליך, שטיפה שלילית תישקל אם מי המלח המוחדרים לא יזרמו חזרה מהנחיר לתוך הצינור; סיבות אפשריות יכולות להיות שהראש אינו מוטה כלפי מטה מספיק כדי לאפשר זרימה חוזרת יעילה, הדגימה התנקזה בזנב או לרוחב החוצה דרך הנחיר הנגדי, או שקטטר הגומי האדום אינו מקובע היטב למזרק והמלח דלף החוצה מנקודת החיבור.
כאשר דגימות שטיפת אף נאספו בהצלחה מכלבים עם סרטן האף, צפויות ספירת תאים גרעיניים בטווח של 1 ×10 6-200 × 106 , עם 75-96% תאים חיים. לחלופין, כאשר דגימות שטיפת אף נאספו בהצלחה מכלבים עם חללי אף בריאים ולא דלקתיים, ספירת התאים הייתה בטווח של 7 × 105-2 × 106, עם 6-16% תאים חיים. תמונה מייצגת של דגימות ציטולוגיות שהתקבלו מדגימת שטיפת אף של כלבים נושאי גידול מוצגת באיור 2. בנוסף, הערכה ציטומטרית זרימה של אוכלוסיות תאים שנותחו מדגימות שטיפת אף של כלבים בריאים ונושאי גידול מוצגת באיור 3. ניתן היה לצפות שספירת תאים ואחוז כדאיות נמוכים מטווחים אלה יעידו על כך שהליך שטיפת האף ואיסוף הדגימות לא היו מוצלחים. טבלה 1 מסכמת את תוצאות טכניקת שטיפת האף שבוצעה על ידי המחברים ביחס למספר ההליכים שבוצעו, מספר הכלבים, מצב חלל האף (בריא או נושא גידול), תפוקת ספירת תאים גרעיניים, כדאיות התאים שהושגו להליך, והאם דגימת השטיפה נחשבה להצלחה או כישלון לניתוח במורד הזרם. למטרות הניסויים שבוצעו עם דגימות שטיפת האף הכלולות בטבלה 1, תפוקת מספר תאים מינימלית של 150,000 נחשבה לאיסוף דגימות שטיפת אף מוצלח.
בטכניקת שטיפת אף זו משתמשים במי מלח סטריליים של 0.9% לאיסוף התאים. לחלופין, ניתן לשקול את הפתרון של הרטמן (תמיסת רינגר חלבי); עם זאת, דגימות שנאספו עם תמיסת מלח או תמיסת הרטמן יצטרכו להיבדק כדי להבטיח כדאיות ותוצאות דומות עבור התאים המעניינים. בנוסף, חלופה לשימוש בצנתר גומי אדום בכלבים שאינם נושאי גידול יכולה להיות ביצוע שטיפת האף עם קטטר פולי. למרות שאינו בשימוש בטכניקת שטיפת האף המוצגת כאן, השימוש בצנתר פולי יאפשר ניפוח של הבלון בקצה הצנתר, לסתום את חלל האף ולמנוע אובדן נוזלים בזנב. כמו כן, למרות שלא נבדק בגישת עיבוד שטיפת האף המוצגת כאן, ניתן לשקול תוספת של היאלורונידאז לדגימת שטיפת האף כדי לפרק את הריר שנאסף בדגימת שטיפת האף ולשחרר תאים נוספים לניתוח. זה גם יצטרך להיות אופטימלי כדי להבטיח שהתוצאות לא ישתנו על ידי הוספת היאלורונידאז להליך עיבוד שטיפת האף.
תוצאות שפורסמו שהתקבלו מהליכי שטיפת אף מוצלחים שבוצעו בכלבים שנרשמו לניסוי קליני בסרטן כלבים מוצגות באיור 310. התוצאות המוצגות באיור 3 הן ממחקר החוקר את ההשפעה של הקרנה אלקטיבית על המיקרו-סביבה החיסונית המקומית של כלבים עם גידולים סינונאליים שהגידולים שלהם הוקרנו לבד או בשילוב עם הקרנה אזורית של בלוטות הלימפה הצוואריות. באמצעות דגימה סדרתית של חלל האף של כלבים בניסוי הקליני עם שטיפת אף, ניתוח זרימה ציטומטרי של תאים שנאספו חשף ירידה משמעותית באוכלוסיות תאי T אפקטורים ביום האחרון של ההקרנות כאשר בלוטות לימפה אזוריות הוקרנו במקביל לגידול הסינונאלי בהשוואה לכלבים שקיבלו רדיותרפיה ממוקדת לגידול ובלוטות הלימפה האזוריות ניצלו. זה מדגים את התועלת של דגימה סדרתית של חלל האף עם שטיפה כדי לחקור תזוזות באוכלוסיות תאים בנקודות שונות ובתנאי טיפול שונים.

איור 1: סכמטי של שיטת שטיפת האף. מי מלח מחוממים וסטריליים מוזרקים לחלל האף של כלבים מורדמים באמצעות קטטר גומי אדום. נוזל שטיפת האף נאסף לתוך צינור כשהוא מתנקז מהאף. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
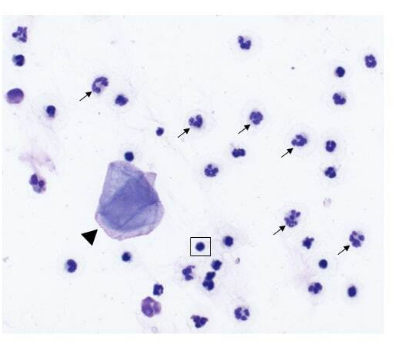
איור 2: הרכב תאי של דגימת שטיפת אף שנאספה מכלב עם גידול באף. תמונה מייצגת של דגימות ציטולוגיות שהתקבלו מדגימת שטיפת אף (הגדלה פי 500, צבע רייט-גימסה שונה). נויטרופילים (חצים) הם התאים השולטים, עם כמה תאי אפיתל קשקשיים (ראש חץ) ולימפוציטים בוגרים קטנים (מודגשים בתיבה המרובעת). אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
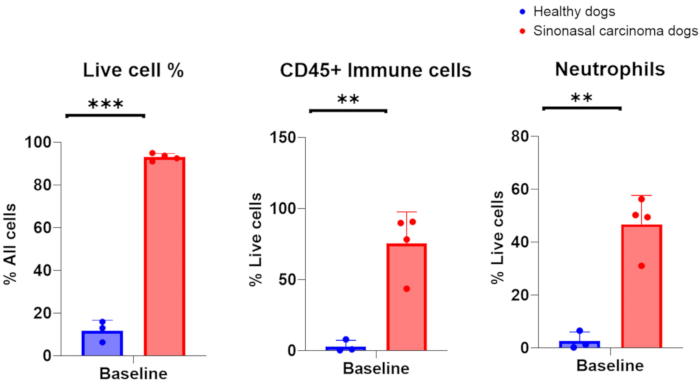
איור 3. ניתוח זרימה ציטומטרי של דגימות שטיפת אף שנאספו מכלבים בריאים ונושאי גידולים. השוואה של שפע תאים חיים, תאים חיסוניים ונויטרופילים בין כלבים בריאים (כחול, n = 3) וכלבים נושאי גידול עם קרצינומה סינונאלית (אדום, n = 4). אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
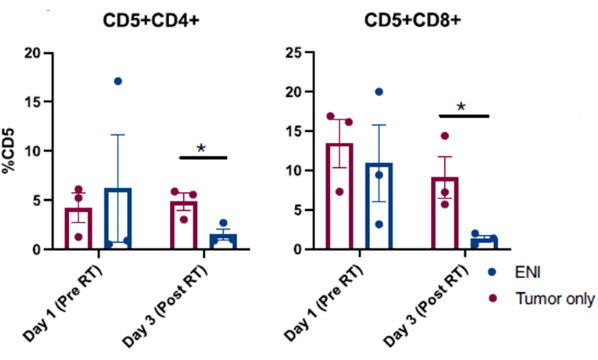
איור 4: ניתוח זרימה ציטומטרי של תאים שנאספו משטיפת אף מכלבים שנרשמו לניסוי קליני החוקר את ההשפעה של הקרנת קשריות אלקטיביות (ENI) על המיקרו-סביבה החיסונית המקומית. כימות של תאי T CD4 (CD5+CD4+) ו-CD8 (CD5+CD8+) מדגימות שטיפת אף. כלבים שטופלו ב-ENI במקביל להקרנת גידול (n = 3) הפחיתו משמעותית את תאי CD4 ו-CD8 T ביום האחרון של ההקרנה (יום 3) בהשוואה לכלבים שטופלו בקרינה ממוקדת לגידול בלבד (n = 3). נתון זה שונה מ-Darragh et al.10. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
| בריא (n=3) | נושא גידול (n=19) | |
| מספר ההליכים שבוצעו | 3 | 80 |
| ספירת תאים | 0.7 x 106 - 2.8 x 106 | 1.6 x 106 - 210 x 106; חציון: 8.7 x 106 |
| כדאיות התא | 6.3 - 15.9% | 75% - 96%; חציון: 87% |
| אחוזי הצלחה | 100% | 98.80% |
טבלה 1: סיכום הליכי שטיפת האף שבוצעו והמאפיינים התאיים של הדגימות שהתקבלו.
Discussion
ישנם מספר שלבים קריטיים בפרוטוקול שטיפת האף. ביחס לכלב שעובר את הליך שטיפת האף, הכלב חייב להיות במישור הרדמה עמוק מספיק כדי שלא יגיב להנחת הצנתר או למתן השטיפה. אם הם מגיבים בהרדמה, הדבר עלול לפגוע באיכות ובכמות איסוף דגימות השטיפה, כמו גם להגביר את הסיכון לפגיעה חריפה ברקמת האף עקב טראומה מקומית מהצנתר התוך-אף או לכלב השואב את נוזל השטיפה.
מיקום ראש הכלב הוא גם קריטי לאיסוף דגימות שטיפת אף אופטימלי. אם הזווית כלפי מטה של הראש אינה מספיקה לזרימה חוזרת תלוית כוח הכבידה של מי המלח המוחדרים, נוזל שטיפת האף עלול לזרום בזנב, והדגימה עלולה ללכת לאיבוד דרך הלוע האף. בנוסף, תקשורת ברורה בין אדם א' לאדם ב' חשובה במהלך הליך שטיפת האף. ייתכן שיידרשו התאמות מהירות על ידי אדם ב' למיקום צינור האיסוף מכיוון שהנוזל מתנקז מהנחיר בזמן שאדם א' שוטף; הנראות של נוזל השטיפה הזורם לתוך הצינור החרוטי עשויה להיות לא ברורה לחלוטין הן עבור אדם א' והן עבור אדם ב' במהלך ההליך, כך שתקשורת פעילה לאורך כל התהליך היא המפתח לאיסוף דגימות מוצלח. לאחר איסוף דגימת שטיפת האף, אם יש לשמר את כדאיות התאים לניתוח עתידי, זה קריטי שהתאים יישמרו בתמיסת pH פיזיולוגית, כגון 0.9% מי מלח או 1x PBS.
ניתן לבצע שינויים בפרוטוקול שטיפת האף לאורך שלבי האיסוף והעיבוד. במהלך איסוף הדגימה, ניתן להתאים את עומק ההרדמה כדי להבטיח שהכלב לא יגיב לשטיפת האף. ניתן להשיג זאת על ידי התאמת אחוז גז ההרדמה (למשל, איזופלורן) או מתן בולוס של חומר הרדמה תוך ורידי קצר טווח (למשל, פרופופול).
אם לאחר החדרת מי המלח לחלל האף, רק כמות קטנה של הנוזל נאספת בצינור, מקם מחדש את ראש הכלב בזווית כלפי מטה, כך שהוא נח בנוחות מקצה השולחן, כדי להגדיל את פוטנציאל הכבידה לאפשר לנוזל להתנקז מהאף. אם צוין כי נוזל מתנקז מהנחיר הנגדי, חסום היטב את הנחיר הנגדי לשטיפות הבאות. במהלך שלב העיבוד, אם ספירת תאי הדגימה הראשונית נמוכה, צנטריפוגה מחדש את החלק העל-טבעי של הדגימה כדי לאסוף תאים נוספים שעשויים להיות נוכחים כדי להגדיל את התפוקה הכוללת.
ישנן מגבלות בולטות לשימוש בשיטת שטיפת האף כדי לנתח את המיקרו-סביבה החיסונית של הכלבים. בטכניקה זו, דגימות שטיפת האף הן אוסף של תאי שטח וחלבונים מחלל האף שנעקרים בקלות. ייתכן שתאי פני השטח והחלבונים הללו אינם מייצגים לחלוטין את הרקמות העמוקות יותר של מיקרו-סביבת האף של הכלב. נעשים מאמצים להשוות את הפרופילים התאיים והחלבונים של שטיפת האף של הכלבים לדגימות ביופסיה כדי לקבוע את הדמיון וההבדלים בגורמים אלה בין שתי טכניקות הדגימה של חלל האף.
למרות מגבלות אלה, טכניקת שטיפת האף לדגימת המיקרו-סביבה החיסונית של האף הכלבי מספקת גישה חלופית לשיטות הקיימות. בהשוואה לביופסיית רקמות או אפילו הליך רינוסקופיה, שטיפת האף אינה פולשנית יחסית עבור המטופל הכלבי. איסוף תאים וחלבונים באמצעות שטיפת אף בהשוואה לביופסיית רקמות מפחית את הסיכונים לדימום חריף מדאיג קלינית, ממושך או משמעותי; לאחר הליך שטיפת האף, סביר להניח שיש פחות דלקת ואי נוחות מקומית בהשוואה לביופסיה של רקמת האף. בשל כך, שטיפת האף עשויה להתבצע באופן סדרתי כדי לאסוף דגימות מרובות לאורך זמן לצורך ניתוחים. בנוסף, יש קלות יחסית מוגברת בעיבוד דגימות שטיפת האף בהשוואה לדגימות ביופסיה של רקמות ביחס להפרדת המרכיב התאי מהחלבונים בתוך הסופרנטנט לשיטות מעבדה ובדיקות במורד הזרם.
לשיטת שטיפת האף יש פוטנציאל ליישומים חשובים בתחומי מחקר הקשורים למיקרו-סביבה החיסונית. בחקר הסרטן, נעשה שימוש בטכניקת שטיפת האף10 וניתן להשתמש בה כדי לתעד שינויים סדרתיים במיקרו-סביבה של חלל האף בכלבים נושאי גידול ביחס לתנאי הטיפול; דגימות שטיפת האף הללו עשויות גם להתגלות כבעלות ערך בקורלציה בין שינויים במיקרו-סביבה החיסונית כדי להבין טוב יותר את התגובות לטיפול בסרטן. היבטים דומים של חקירת שינויים סדרתיים במיקרו-סביבה החיסונית של האף עשויים להיחקר ולחקור עבור תחומי מחקר זיהומיים ודלקתיים וטרינריים רבים.
Disclosures
למחברים אין ניגודי אינטרסים להצהיר עליהם.
Acknowledgements
טכניקת שטיפת האף של הכלבים המתוארת כאן עברה אופטימיזציה באמצעות פרויקטים הנתמכים על ידי K01 OD03109, פרס מענק הפיילוט של CCTSI קולורדו, תוכנית המשאבים המשותפים של מועצת המחקר של מכללת CSU CVMBS ו-CO HNC SPORE CA261605: תוכנית לשיפור קריירה. איור 1 נוצר עם BioRender.com.
Materials
| Name | Company | Catalog Number | Comments |
| 1.5 mL Tubes | Eppendorf | 05-402 | |
| 1000 µL Pipette | VWR | 89079-974 | |
| 1x PBS | Corning | 21-040-CV | |
| 20 mL Syringes | VWR | BD302830 | |
| 50 mL Conical Tubes | VWR | 89039-656 | |
| 70 µm Cell Strainer | Fisherbrand | 22-363-548 | |
| 8FR Sterile Red Rubber Catheter | Med Vet International | 50-252-2428 | |
| ACK Lysis Buffer | Gibco | A1049201 | |
| Centrifuge | Beckman Coulter | 366816 | |
| Physiological Saline (0.9%) | Vetivex | 17033-492-01 | |
| Vortex | VWR | 10153-838 |
References
- Cohn, L. A. Canine nasal disease: An update. Vet Clin: Small Anim Pract. 50 (2), 359-374 (2020).
- Mortier, J., Blackwood, L. Treatment of nasal tumours in dogs: A review. J Small Anim Pract. 61 (7), 404-415 (2020).
- Plickert, H., Tichy, A., Hirt, R. Characteristics of canine nasal discharge related to intranasal diseases: A retrospective study of 105 cases. J Small Anim Pract. 55 (3), 145-152 (2014).
- Windsor, R. C., Johnson, L. R. Canine chronic inflammatory rhinitis. Clin Tech Small Anim Practice. 21 (2), 76-81 (2006).
- Van Pelt, D. R., Mckiernan, B. C. Pathogenesis and treatment of canine rhinitis. Vet Clin North Am Small Anim Pract. 24 (5), 789-806 (1994).
- Hazuchova, K., Neiger, R., Stengel, C. Topical treatment of mycotic rhinitis-rhinosinusitis in dogs with meticulous debridement and 1% clotrimazole cream: 64 cases (2007-2014). JAVMA. 250 (3), 309-315 (2017).
- Lobetti, R. Idiopathic lymphoplasmacytic rhinitis in 33 dogs. JS Afr Vet Assoc. 85 (1), 1-5 (2014).
- Ashbaugh, E. A., Mckiernan, B. C., Miller, C. J., Powers, B. Nasal hydropulsion: A novel tumor biopsy technique. JAAHA. 47 (5), 312-316 (2011).
- Wheat, W., et al. Local immune and microbiological responses to mucosal administration of a liposome-tlr agonist immunotherapeutic in dogs. BMC Vet Res. 15 (1), 330 (2019).
- Darragh, L. B., et al. Elective nodal irradiation mitigates local and systemic immunity generated by combination radiation and immunotherapy in head and neck tumors. Nat Commun. 13 (1), 7015 (2022).
- Pinard, C. J., et al. Evaluation of lymphocyte-specific programmed cell death protein 1 receptor expression and cytokines in blood and urine in canine urothelial carcinoma patients. Vet Comp Oncol. 20 (2), 427-436 (2022).
- Choi, J. W., et al. Development of canine pd-1/pd-l1 specific monoclonal antibodies and amplification of canine t cell function. PLoS One. 15 (7), e0235518 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved