Method Article
Lavagem salina para amostragem do microambiente imunológico nasal canino
Neste Artigo
Resumo
A lavagem nasal salina pode ser usada para coletar amostras do microambiente imunológico nasal canino. Como a abordagem é relativamente não invasiva e não rompe os tecidos nasais, ela pode ser realizada em série. Células e proteínas coletadas da técnica de lavagem nasal podem ser processadas para várias análises laboratoriais.
Resumo
Avaliar o microambiente imunológico local da cavidade nasal canina pode ser importante para investigar condições normais de saúde e doença dos tecidos, particularmente aquelas associadas à inflamação local. Otimizamos uma técnica para avaliar o microambiente imune nasal local de cães por meio de lavagem nasal seriada. Resumidamente, com cães sob anestesia e posicionados em decúbito esternal, solução salina estéril pré-aquecida é lavada na narina afetada usando um cateter de borracha macia flexível. O refluxo do fluido é coletado em tubos cônicos e esse processo é repetido. Os fluidos contendo células e proteínas desalojadas são agrupados e as amostras de lavagem nasal agrupadas são filtradas através de um filtro de células para remover grandes detritos e muco. As amostras são centrifugadas e os pellets celulares são isolados para análise. Uma vez que as amostras tenham sido processadas, as análises que podem seguir a lavagem nasal incluem citometria de fluxo, análise transcriptômica de células via RNA seq em massa ou de célula única e/ou quantificação de citocinas presentes no fluido de lavagem.
Introdução
Os cães desenvolvem rotineiramente condições nasais inflamatórias ao longo da vida. A causa subjacente da rinite aguda ou crônica em cães pode variar de infecciosa (viral: por exemplo, gripe, parainfluenza, herpesvírus; bacteriana [por exemplo, Bordetella, micoplasmas], fúngica [por exemplo, aspergilose, criptococose]; parasitária [por exemplo, ácaros nasais]) a neoplásica (por exemplo, neoplasias nasossinusais, mais comumente histotipos de carcinoma ou sarcoma) a material estranho (por exemplo, corpo estranho, migração intranasal de dentes deslocados) a doença periodontal, bem como rinite inflamatória idiopática canina 1,2,3,4,5,6,7.
Além de um exame físico, várias abordagens são usadas para avaliar a condição da cavidade nasossinusal em cães com inflamação nasal. Os procedimentos de imagem podem incluir radiografias (dentária, crânio), tomografia computadorizada (TC) ou ressonância magnética (RM). Outra abordagem para a imagem da cavidade nasal é a rinoscopia. A amostragem de tecido pode envolver a aquisição de swabs nasais, amostras de escova ou biópsias de tecido, a partir das quais pode ser realizada avaliação citológica e/ou histopatológica, bem como o envio de amostras para cultura fúngica ou bacteriana. Essas amostras podem ser obtidas em uma variedade de abordagens, desde amostragem "cega" até guiada por imagem com rinoscopia ou imagem avançada, e adquiridas através das narinas, da nasofaringe ou com uma abordagem cirúrgica de trepanação, rinotomia ou sinusotomia.
A lavagem nasal, que envolve a administração de solução salina estéril na cavidade nasal, também tem sido usada para amostragem da cavidade nasal canina para fins diagnósticos e terapêuticos. Uma versão alternativa da técnica de lavagem nasal que tem sido usada para tumores nasais é denominada hidropulsão nasal, descrita como lavagem nasal forçada, que pode desalojar grandes amostras tumorais para avaliação diagnóstica, bem como fornecer alívio terapêutico para a melhora dos sinais clínicos associados ao câncer nasal8.
Apresentamos aqui outra versão da técnica de lavagem nasal com o objetivo pretendido de coletar e analisar células e proteínas do microambiente imunológico nasal. Por meio de uma abordagem suave e relativamente não invasiva, otimizamos essa técnica de lavagem nasal para amostragem serial de microambiente imunológico nasal. Em ensaios envolvendo cães com fossas nasais não inflamadas, infecção ativa por herpesvírus e tumores nasossinusais, demonstramos a utilidade da lavagem nasal para a coleta e processamento de amostras para aplicações a jusante 9,10.
Neste manuscrito, descrevemos uma técnica de lavagem nasal salina para amostragem seriada do microambiente imune nasal canino. Fornecemos detalhes do protocolo para adquirir a amostra de lavagem nasal de forma eficaz, com o mínimo de interrupção dos tecidos e, em seguida, processar as amostras para uma variedade de análises.
Protocolo
Este procedimento de lavagem nasal foi aprovado pelo Comitê Institucional de Cuidados e Uso de Animais da Universidade Estadual do Colorado e pelo Conselho de Revisão Clínica (IACUC # 2425). Um esquema do método de lavagem nasal é apresentado na Figura 1.
1. Preparação para a lavagem nasal
- No dia anterior ao procedimento de lavagem nasal, encha cinco seringas de 20 mL com soro fisiológico estéril (solução de cloreto de sódio a 0,9%) e feche com uma tampa. Coloque as seringas em uma incubadora ajustada para 37 oC para que possam aquecer durante a noite.
2. Posicionando o cão para a lavagem nasal
- Anestesiar o cão para o procedimento (por exemplo, com injeção intravenosa (IV) de dexmedetomidina (1-4 μg/kg) e butorfanol (0,2-0,5 mg/kg) através de um cateter IV), seguido pela administração de propofol IV (2-5 mg/kg) titulado para efeito para intubação; manter a anestesia com 1-2% de isoflurano inalante para efeito.) Confirme a profundidade apropriada da anestesia verificando a resposta palpebral e o tônus da mandíbula.
- Lubrifique os olhos para evitar o ressecamento durante o procedimento.
- Monitore os valores de telemetria cardíaca, pressão arterial, capnografia e oximetria de pulso durante todo o procedimento.
- Posicione o cão anestesiado em decúbito esternal. Coloque a cabeça do cão de forma que fique inclinada de forma natural e confortável em um ângulo descendente a partir da borda da mesa de tratamento para uma coleta ideal de amostras de lavagem nasal.
- Infle o manguito do tubo endotraqueal para garantir uma vedação firme das vias aéreas.
3. Realização da lavagem nasal
- Corte um cateter de borracha vermelha estéril de 8 FR na base para que ele se encaixe perfeitamente em uma das seringas pré-cheias de 20 mL contendo a solução salina quente. Meça um cateter de borracha vermelha estéril de modo que a ponta distal do cateter se estenda aproximadamente até a metade da cavidade nasal quando introduzida pela narina. Se estiver coletando amostras de um tumor nasal, use orientação por imagem ou rinoscópica para estimar a localização do aspecto rostral do tumor nasal para medir o comprimento do cateter de borracha vermelha para que a ponta se estenda até o aspecto rostral do tumor.
- Em seguida, corte o cateter na ponta para o comprimento do cateter intranasal definido para que a ponta caia no local apropriado quando inserida na cavidade nasal. No entanto, deixe um comprimento adicional para a base do cateter que se estenda para fora da narina (comprimento do cateter do ponto de fixação da seringa até a entrada da narina, aproximadamente 3-5 cm). Aplicar uma marca com um marcador permanente na extremidade da base do cateter para indicar o ponto de partida, correspondente à entrada da narina; O comprimento predeterminado do cateter será intranasal, com a ponta do cateter posicionada no local desejado dentro da cavidade nasal.
- A realização do procedimento de lavagem nasal exigirá a participação de dois indivíduos. Faça uma pessoa (Pessoa A) responsável por alimentar o cateter na cavidade nasal e administrar a lavagem e a outra pessoa (Pessoa B) por coletar a amostra quando ela sai do nariz.
- Faça com que a Pessoa A se posicione na frente e abaixo da cabeça do cão. Com as mãos enluvadas, faça com que a Pessoa A guie suavemente a ponta do cateter de borracha vermelha para o aspecto medial da cavidade nasal e avance-o até que a marca no cateter se alinhe com o aspecto externo da narina. Durante este processo, certifique-se de que o cateter esteja conectado à seringa contendo a solução salina estéril aquecida. Faça com que a Pessoa B segure um tubo cônico de 50 mL abaixo da narina com o cateter no lugar.
- A pessoa A oclui suavemente a narina contralateral e começa a infundir a solução salina na cavidade nasal com pressão lenta e constante ou com uma infusão pulsada. À medida que a cabeça do cão é posicionada em um ângulo descendente, a Pessoa B coleta o fluido que drena da cavidade nasal por gravidade para o tubo cônico de 50 mL.
- Repita esta técnica de lavagem nasal para um total de cinco lavagens salinas de 20 mL, trocando os tubos cônicos, conforme necessário, para coletar as amostras agrupadas. Registre o volume total de líquido de lavagem nasal coletado em relação à quantidade de solução salina infundida após a conclusão do procedimento.
- Uma vez concluído, se anestesiado com dexmedetomidina, administre por via intramuscular o mesmo volume de atipamezol usado para dexmedetomidina e permita que o cão se recupere da anestesia. Para ser cauteloso, mantenha o cão em decúbito esternal com a cabeça posicionada para baixo para facilitar a drenagem adicional de qualquer solução salina residual da lavagem nasal.
4. Processamento da amostra de lavagem nasal
- Agite suavemente e/ou pipete as amostras de lavagem nasal contidas nos tubos cônicos para quebrar aglomerados de detritos e células. Passe as amostras de lavagem nasal agrupadas através de um filtro de coação celular de 70 μm para remover grandes detritos e muco. Centrifugue as amostras a 300 × g por 5-10 min para formar um pellet de célula.
- Colete o sobrenadante por aspiração com uma pipeta e deposite-o em um tubo limpo para análise das proteínas de interesse.
- Ressuspenda os grânulos celulares em solução salina tamponada com fosfato (PBS) ou solução preferida para ensaios celulares de interesse.
- Para eliminar os glóbulos vermelhos das amostras, faça a lise de cloreto de amônio-potássio (ACK) para coletar células nucleadas da lavagem nasal11,12.
Resultados
Com este método de lavagem nasal, a amostra coletada parecerá ligeiramente turva, possivelmente com pedaços visíveis de detritos celulares e muco quando o tubo for girado. Uma amostra seria considerada contaminada com sangue periférico se o procedimento de lavagem induzir inadvertidamente sangramento e a amostra for tingida de vermelho. Embora parte da solução salina infundida seja perdida durante o procedimento, uma lavagem negativa seria considerada se a solução salina infundida não fluir de volta para fora da narina e para o tubo; As causas potenciais podem ser que a cabeça não esteja inclinada para baixo o suficiente para permitir um refluxo eficaz, a amostra tenha sido drenada caudal ou lateralmente pela narina contralateral ou o cateter de borracha vermelha não esteja firmemente fixado à seringa e a solução salina tenha vazado para fora do ponto de conexão.
Quando as amostras de lavagem nasal foram coletadas com sucesso de cães com câncer nasal, contagens de células nucleadas na faixa de 1 × 10 6-200 × 106 são esperadas, com 75-96% de células vivas. Alternativamente, quando amostras de lavagem nasal foram coletadas com sucesso de cães com cavidades nasais saudáveis e não inflamadas, as contagens de células estiveram na faixa de 7 ×10 5-2 × 106, com 6-16% de células vivas. Uma imagem representativa de espécimes citológicos obtidos de amostras de lavagem nasal de cães portadores de tumor é apresentada na Figura 2. Além disso, a avaliação por citometria de fluxo de populações celulares analisadas a partir de amostras de lavado nasal de cães saudáveis e portadores de tumor é apresentada na Figura 3. Seria de se esperar que a contagem de células e a porcentagem de viabilidade inferior a essas faixas indicassem que o procedimento de lavagem nasal e a coleta de amostras não foram bem-sucedidos. A Tabela 1 resume os resultados da técnica de lavagem nasal realizada pelos autores em relação ao número de procedimentos realizados, ao número de cães, à condição da cavidade nasal (saudável ou portadora de tumor), ao rendimento da contagem de células nucleadas, à viabilidade das células obtidas para o procedimento e se a amostra de lavagem foi considerada um sucesso ou fracasso para análise a jusante. Para os fins dos experimentos realizados com as amostras de lavagem nasal incluídas na Tabela 1, um rendimento mínimo de número de células de 150.000 foi considerado uma coleta de amostra de lavagem nasal bem-sucedida.
Com esta técnica de lavagem nasal, solução salina estéril a 0,9% é usada para coletar as células. Alternativamente, a solução de Hartmann (solução de Ringer com lactato) pode ser considerada; no entanto, as amostras coletadas com solução salina ou de Hartmann precisariam ser testadas para garantir viabilidade e resultados comparáveis para as células de interesse. Além disso, uma alternativa ao uso de cateter de borracha vermelha em cães sem tumor poderia ser realizar a lavagem nasal com cateter de Foley. Embora não seja utilizado na técnica de lavagem nasal aqui apresentada, o uso de um cateter de Foley permitiria a insuflação do balão na ponta do cateter, ocluindo a cavidade nasal e evitando a perda de líquido caudalmente. Além disso, embora não tenha sido testado na abordagem de processamento da lavagem nasal apresentada aqui, a adição de hialuronidase à amostra de lavagem nasal pode ser considerada para quebrar o muco coletado na amostra de lavagem nasal e liberar mais células para análise. Isso também precisaria ser otimizado para garantir que os resultados não sejam alterados pela adição de hialuronidase ao procedimento de processamento da lavagem nasal.
Os resultados publicados obtidos de procedimentos bem-sucedidos de lavagem nasal realizados em cães inscritos em um ensaio clínico de câncer canino são apresentados na Figura 310. Os resultados apresentados na Figura 3 são de um estudo que investigou o impacto da irradiação nodal eletiva no microambiente imunológico local de cães com tumores nasossinusais cujos tumores foram irradiados isoladamente ou em combinação com irradiação linfonodal cervical regional. Por meio de amostragem seriada da cavidade nasal de cães no ensaio clínico com lavagem nasal, a análise por citometria de fluxo das células coletadas revelou uma diminuição significativa nas populações de células T efetoras no último dia de radioterapia quando os linfonodos regionais foram irradiados concomitantemente com o tumor nasossinusal em comparação com os cães que receberam radioterapia direcionada ao tumor e os linfonodos regionais foram poupados. Isso demonstra a utilidade da amostragem em série da cavidade nasal com lavagem para investigar mudanças nas populações de células em diferentes pontos e com diferentes condições de tratamento.

Figura 1: Esquema do método de lavagem nasal. Solução salina aquecida e estéril é infundida na cavidade nasal de cães anestesiados usando um cateter de borracha vermelha. O fluido de lavagem nasal é coletado em um tubo à medida que é drenado para fora do nariz. Clique aqui para ver uma versão maior desta figura.
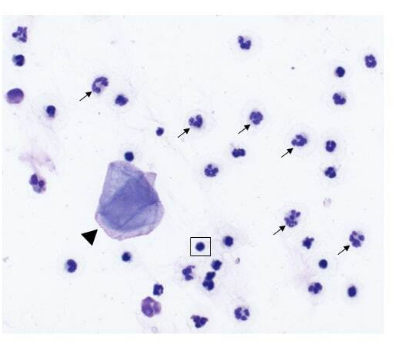
Figura 2: Composição celular de uma amostra de lavagem nasal coletada de um cão com tumor nasal. Imagem representativa de espécimes citológicos obtidos a partir de amostragem de lavagem nasal (aumento de 500x, coloração de Wright-Giemsa modificada). Os neutrófilos (setas) são as células predominantes, com algumas células epiteliais escamosas (cabeça de seta) e pequenos linfócitos maduros (destacados na caixa quadrada) também presentes. Clique aqui para ver uma versão maior desta figura.
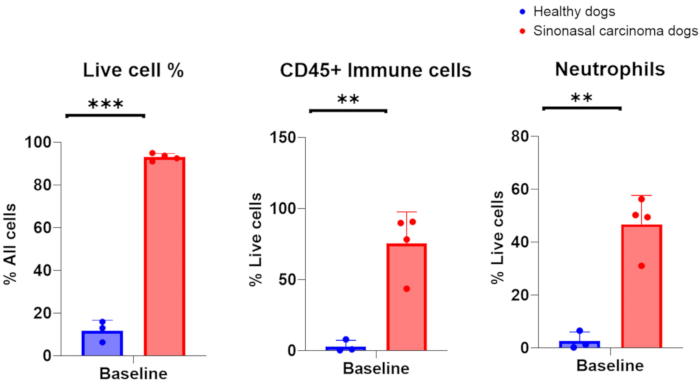
Figura 3. Análise por citometria de fluxo de amostras de lavagem nasal coletadas de cães saudáveis e portadores de tumor. Comparação da abundância de células vivas, células imunes e neutrófilos entre cães saudáveis (azul, n = 3) e cães portadores de tumor com carcinoma nasossinusal (vermelho, n = 4). Clique aqui para ver uma versão maior desta figura.
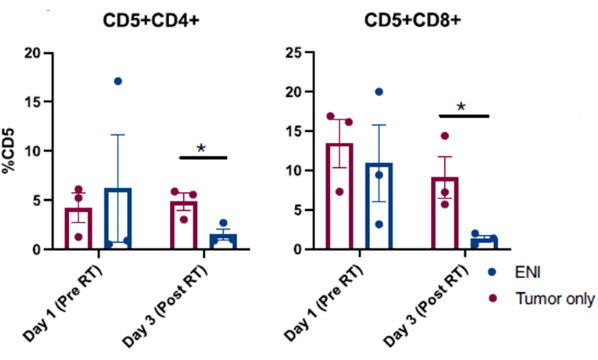
Figura 4: Análise por citometria de fluxo de células coletadas da lavagem nasal de cães inscritos em um ensaio clínico que investiga o impacto da irradiação nodal eletiva (ENI) no microambiente imunológico local. Quantificação de células T CD4 (CD5+CD4+) e CD8 (CD5+CD8+) de amostras de lavagem nasal. Cães tratados com ENI simultaneamente com irradiação tumoral (n = 3) tiveram células T CD4 e CD8 efetoras significativamente reduzidas no último dia de radiação (Dia 3) em comparação com cães tratados com radiação direcionada apenas ao tumor (n = 3). Essa figura foi modificada de Darragh et al.10. Clique aqui para ver uma versão maior desta figura.
| Saudável (n=3) | Portador de tumor (n= 19) | |
| Número de procedimentos realizados | 3 | 80 |
| Contagem de células | 0,7 x 106 - 2,8 x 106 | 1,6 x 106 - 210 x 106; Mediana: 8,7 x 106 |
| Viabilidade celular | 6.3 - 15.9% | 75% - 96%; Mediana: 87% |
| Taxa de sucesso | 100% | 98.80% |
Tabela 1: Resumo dos procedimentos de lavagem nasal realizados e características celulares das amostras obtidas.
Discussão
Existem várias etapas críticas no protocolo de lavagem nasal. Com relação ao cão submetido ao procedimento de lavagem nasal, o cão deve estar dentro de um plano de anestesia profundo o suficiente para que não reaja à colocação do cateter ou à administração da lavagem. Se forem reagentes sob anestesia, isso pode comprometer a qualidade e a quantidade da coleta da amostra de lavagem, além de aumentar potencialmente os riscos de lesão aguda do tecido nasal devido a trauma local do cateter intranasal ou para o cão aspirar o fluido de lavagem.
O posicionamento da cabeça do cão também é fundamental para a coleta ideal de amostras de lavagem nasal. Se o ângulo descendente da cabeça for insuficiente para o refluxo dependente da gravidade do soro fisiológico instilado, o fluido de lavagem nasal pode fluir caudalmente e a amostra pode ser perdida pela nasofaringe. Além disso, a comunicação clara entre a Pessoa A e a Pessoa B é importante durante o procedimento de lavagem nasal. Ajustes rápidos podem ser necessários pela Pessoa B para a colocação do tubo de coleta, pois o fluido está drenando da narina enquanto a Pessoa A está lavando; a visibilidade do fluido de lavagem que flui para o tubo cônico pode não ser totalmente clara para a Pessoa A e a Pessoa B durante o procedimento, portanto, a comunicação ativa durante todo o processo é fundamental para uma coleta de amostra bem-sucedida. Uma vez coletada a amostra de lavagem nasal, para que a viabilidade celular seja preservada para análise futura, é fundamental que as células sejam mantidas em uma solução fisiológica de pH, como solução salina a 0,9% ou PBS 1x.
Modificações podem ser feitas no protocolo de lavagem nasal ao longo das fases de coleta e processamento. Durante a coleta da amostra, a profundidade da anestesia pode ser ajustada para garantir que o cão não reaja à lavagem nasal. Isso pode ser obtido ajustando a porcentagem do gás anestésico (por exemplo, isoflurano) ou administrando um bolus de anestésico intravenoso de ação curta (por exemplo, propofol).
Se após a instilação da solução salina na cavidade nasal, apenas uma pequena quantidade do fluido for coletada no tubo, reposicione a cabeça do cão em um ângulo para baixo, de modo que ela fique confortavelmente apoiada na borda da mesa, para aumentar o potencial de gravidade para permitir que o fluido seja drenado do nariz. Se for notado que o fluido está drenando da narina contralateral, oclua firmemente a narina contralateral para as lavagens seguintes. Durante a fase de processamento, se a contagem inicial de células da amostra for baixa, centrifugue novamente a porção sobrenadante da amostra para coletar quaisquer células adicionais que possam estar presentes para aumentar o rendimento total.
Existem limitações notáveis na utilização do método de lavagem nasal para analisar o microambiente imunológico nasal canino. Com essa técnica, as amostras de lavagem nasal são uma coleção de células superficiais e proteínas da cavidade nasal que são facilmente desalojadas. Essas células e proteínas de superfície podem não ser totalmente representativas dos tecidos mais profundos do microambiente nasal canino. Esforços estão em andamento para comparar os perfis celulares e proteicos da lavagem nasal canina com amostras de biópsia para determinar as semelhanças e diferenças nesses fatores entre as duas técnicas de amostragem da cavidade nasal.
Apesar dessas limitações, a técnica de lavagem nasal para amostragem do microambiente imune nasal canino fornece uma abordagem alternativa aos métodos existentes. Quando comparada a uma biópsia de tecido ou mesmo a um procedimento de rinoscopia, a lavagem nasal é relativamente não invasiva para o paciente canino. A coleta de células e proteínas por meio da lavagem nasal em comparação com a biópsia de tecido diminui os riscos de hemorragia aguda clinicamente preocupante, prolongada ou significativa; Após o procedimento de lavagem nasal, provavelmente também há menos inflamação e desconforto local quando comparado a uma biópsia de tecido nasal. Por isso, a lavagem nasal pode ser realizada em série para coletar várias amostras ao longo do tempo para análises. Além disso, há maior facilidade relativa no processamento das amostras de lavagem nasal em comparação com amostras de biópsia de tecido no que diz respeito à separação do componente celular das proteínas dentro do sobrenadante para métodos e ensaios laboratoriais a jusante.
O método de lavagem nasal tem potencial para importantes aplicações em áreas de pesquisa associadas ao microambiente imunológico. Na pesquisa do câncer, a técnica de lavagem nasal tem sido usada10 e pode ser usada para documentar alterações seriadas no microambiente da cavidade nasal em cães portadores de tumor em relação às condições de tratamento; Essas amostras de lavagem nasal também podem ser valiosas para correlacionar mudanças no microambiente imunológico para entender melhor as respostas ao tratamento do câncer. Aspectos semelhantes da investigação de alterações seriais no microambiente imunológico nasal podem ser explorados e investigados por várias áreas de pesquisa clínica e translacional veterinária infecciosa e inflamatória.
Divulgações
Os autores não têm conflitos de interesse a declarar.
Agradecimentos
A técnica de lavagem nasal canina aqui descrita foi otimizada por meio de projetos apoiados pelo K01 OD03109, CCTSI Colorado Pilot Grant Award, Programa de Recursos Compartilhados do Conselho de Pesquisa da Faculdade CSU CVMBS e CO HNC SPORE CA261605: Programa de Aprimoramento de Carreira. A Figura 1 foi criada com BioRender.com.
Materiais
| Name | Company | Catalog Number | Comments |
| 1.5 mL Tubes | Eppendorf | 05-402 | |
| 1000 µL Pipette | VWR | 89079-974 | |
| 1x PBS | Corning | 21-040-CV | |
| 20 mL Syringes | VWR | BD302830 | |
| 50 mL Conical Tubes | VWR | 89039-656 | |
| 70 µm Cell Strainer | Fisherbrand | 22-363-548 | |
| 8FR Sterile Red Rubber Catheter | Med Vet International | 50-252-2428 | |
| ACK Lysis Buffer | Gibco | A1049201 | |
| Centrifuge | Beckman Coulter | 366816 | |
| Physiological Saline (0.9%) | Vetivex | 17033-492-01 | |
| Vortex | VWR | 10153-838 |
Referências
- Cohn, L. A. Canine nasal disease: An update. Vet Clin: Small Anim Pract. 50 (2), 359-374 (2020).
- Mortier, J., Blackwood, L. Treatment of nasal tumours in dogs: A review. J Small Anim Pract. 61 (7), 404-415 (2020).
- Plickert, H., Tichy, A., Hirt, R. Characteristics of canine nasal discharge related to intranasal diseases: A retrospective study of 105 cases. J Small Anim Pract. 55 (3), 145-152 (2014).
- Windsor, R. C., Johnson, L. R. Canine chronic inflammatory rhinitis. Clin Tech Small Anim Practice. 21 (2), 76-81 (2006).
- Van Pelt, D. R., Mckiernan, B. C. Pathogenesis and treatment of canine rhinitis. Vet Clin North Am Small Anim Pract. 24 (5), 789-806 (1994).
- Hazuchova, K., Neiger, R., Stengel, C. Topical treatment of mycotic rhinitis-rhinosinusitis in dogs with meticulous debridement and 1% clotrimazole cream: 64 cases (2007-2014). JAVMA. 250 (3), 309-315 (2017).
- Lobetti, R. Idiopathic lymphoplasmacytic rhinitis in 33 dogs. JS Afr Vet Assoc. 85 (1), 1-5 (2014).
- Ashbaugh, E. A., Mckiernan, B. C., Miller, C. J., Powers, B. Nasal hydropulsion: A novel tumor biopsy technique. JAAHA. 47 (5), 312-316 (2011).
- Wheat, W., et al. Local immune and microbiological responses to mucosal administration of a liposome-tlr agonist immunotherapeutic in dogs. BMC Vet Res. 15 (1), 330 (2019).
- Darragh, L. B., et al. Elective nodal irradiation mitigates local and systemic immunity generated by combination radiation and immunotherapy in head and neck tumors. Nat Commun. 13 (1), 7015 (2022).
- Pinard, C. J., et al. Evaluation of lymphocyte-specific programmed cell death protein 1 receptor expression and cytokines in blood and urine in canine urothelial carcinoma patients. Vet Comp Oncol. 20 (2), 427-436 (2022).
- Choi, J. W., et al. Development of canine pd-1/pd-l1 specific monoclonal antibodies and amplification of canine t cell function. PLoS One. 15 (7), e0235518 (2020).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados