Method Article
Lavage salin pour l’échantillonnage du microenvironnement immunitaire nasal canin
Dans cet article
Résumé
Le lavage nasal salin peut être utilisé pour échantillonner le microenvironnement immunitaire nasal canin. Parce que l’approche est relativement non invasive et ne perturbe pas les tissus nasaux, elle peut être réalisée en série. Les cellules et les protéines collectées à partir de la technique de lavage nasal peuvent être traitées pour diverses analyses de laboratoire.
Résumé
L’évaluation du microenvironnement immunitaire local de la cavité nasale canine peut être importante pour étudier la santé normale des tissus et les maladies, en particulier celles associées à une inflammation locale. Nous avons optimisé une technique pour évaluer le microenvironnement immunitaire nasal local des chiens via un lavage nasal en série. Brièvement, avec les chiens sous anesthésie et positionnés en décubitus sternal, une solution saline stérile préchauffée est rincée dans la narine affectée à l’aide d’un cathéter en caoutchouc souple flexible. Le reflux de fluide est collecté dans des tubes coniques, et ce processus est répété. Les fluides contenant les cellules et les protéines délogées sont regroupés, et les échantillons de lavage nasal sont filtrés à travers une crépine cellulaire pour éliminer les gros débris et le mucus. Les échantillons sont centrifugés et les pastilles de cellules sont isolées pour analyse. Une fois les échantillons traités, les analyses qui peuvent suivre le lavage nasal comprennent la cytométrie en flux, l’analyse transcriptomique des cellules par séquençage de l’ARN en vrac ou sur cellule unique, et/ou la quantification des cytokines présentes dans le liquide de lavage.
Introduction
Les chiens développent régulièrement des affections nasales inflammatoires tout au long de leur vie. La cause sous-jacente de la rhinite aiguë ou chronique chez le chien peut aller d’infectieuse (virale : par exemple, grippe, parainfluenza, herpèsvirus ; bactérienne [par exemple, Bordetella, mycoplasmes], fongique [par exemple, aspergillose, cryptococcose] ; parasitaire [par exemple, acariens nasaux]) à néoplasique (par exemple, tumeurs malignes sinusales, le plus souvent des histotypes de carcinome ou de sarcome) à des matériaux étrangers (par exemple, corps étranger, migration intranasale des dents déplacées) à une maladie parodontale, ainsi que la rhinite inflammatoire idiopathique canine 1,2,3,4,5,6,7.
En plus d’un examen physique, diverses approches sont utilisées pour évaluer l’état de la cavité sinuso-nasale chez les chiens souffrant d’inflammation nasale. Les procédures d’imagerie peuvent inclure des radiographies (dentaire, crâne), une tomodensitométrie (TDM) ou une imagerie par résonance magnétique (IRM). Une autre approche de l’imagerie de la cavité nasale est la rhinoscopie. L’échantillonnage des tissus peut impliquer l’acquisition d’écouvillons nasaux, d’échantillons de brosses ou de biopsies tissulaires, à partir desquels une évaluation cytologique et/ou histopathologique peut être effectuée, ainsi que la soumission d’échantillons pour une culture fongique ou bactérienne. Ces échantillons peuvent être obtenus par diverses approches, allant de l’échantillonnage « à l’aveugle » à la rhinoscopie guidée par l’imagerie ou l’imagerie avancée, et acquis par les narines, à partir du nasopharynx, ou par une approche chirurgicale de trépanation, de rhinotomie ou de sinusotomie.
Le lavage nasal, qui consiste à administrer une solution saline stérile dans la cavité nasale, a également été utilisé pour prélever des échantillons dans la cavité nasale canine à des fins diagnostiques et thérapeutiques. Une version alternative de la technique de lavage nasal qui a été utilisée pour les tumeurs nasales est appelée hydropulsion nasale, décrite comme un rinçage nasal puissant, qui peut déloger de grands échantillons de tumeurs pour une évaluation diagnostique ainsi que fournir un soulagement thérapeutique pour l’amélioration des signes cliniques associés au cancer du nez8.
Nous présentons ici une autre version de la technique de lavage nasal dans le but de collecter et d’analyser les cellules et les protéines du microenvironnement immunitaire nasal. Grâce à une approche douce et relativement non invasive, nous avons optimisé cette technique de lavage nasal pour l’échantillonnage en série du microenvironnement immunitaire nasal. Dans des essais impliquant des chiens présentant des cavités nasales non enflammées, une infection à herpèsvirus active et des tumeurs sinuso-nasales, nous avons démontré l’utilité du lavage nasal pour la collecte et le traitement d’échantillons pour des applications en aval 9,10.
Dans ce manuscrit, nous décrivons une technique de lavage nasal salin pour l’échantillonnage en série du microenvironnement immunitaire nasal canin. Nous fournissons les détails du protocole pour acquérir efficacement l’échantillon de lavage nasal avec un minimum de perturbation des tissus, puis traiter les échantillons pour une variété d’analyses.
Protocole
Cette procédure de lavage nasal a été approuvée par le comité institutionnel de soin et d’utilisation des animaux de l’Université d’État du Colorado et le conseil d’examen clinique (IACUC #2425). Un schéma de la méthode de lavage nasal est présenté à la figure 1.
1. Préparation au lavage nasal
- La veille de la procédure de lavage nasal, remplissez cinq seringues de 20 ml avec une solution saline physiologique stérile (solution de chlorure de sodium à 0,9 %) et fermez avec un bouchon. Placez les seringues dans un incubateur réglé à 37 °C pour qu’elles puissent se réchauffer pendant la nuit.
2. Positionnement du chien pour le lavage nasal
- Anesthésier le chien pour l’intervention (p. ex., par injection intraveineuse (IV) de dexmédétomidine (1-4 μg/kg) et de butorphanol (0,2-0,5 mg/kg) à travers un cathéter IV), suivie de l’administration de propofol IV (2-5 mg/kg) titré pour l’intubation ; Maintenez l’anesthésie avec 1-2 % d’isoflurane inhalé pour faire effet.) Confirmez la profondeur appropriée de l’anesthésie en vérifiant la réponse palpébrale et le tonus de la mâchoire.
- Lubrifiez les yeux pour éviter le dessèchement pendant la procédure.
- Surveiller la télémétrie cardiaque, la pression artérielle, la canographie et les valeurs d’oxymétrie de pouls tout au long de la procédure.
- Positionnez le chien anesthésié en décubitus sternal. Placez la tête du chien de manière à ce qu’elle soit inclinée naturellement et confortablement vers le bas par rapport au bord de la table de traitement pour un prélèvement optimal d’échantillons de lavage nasal.
- Gonflez le ballonnet de la sonde endotrachéale pour assurer une étanchéité des voies respiratoires.
3. Réalisation du lavage nasal
- Coupez un cathéter en caoutchouc rouge stérile de 8 FR à la base de manière à ce qu’il s’adapte parfaitement à l’une des seringues préremplies de 20 ml contenant la solution saline chaude. Mesurez un cathéter en caoutchouc rouge stérile de sorte que l’extrémité distale du cathéter s’étende jusqu’à environ mi-chemin dans la cavité nasale lorsqu’elle est introduite par la narine. Si vous prélevez une tumeur nasale, utilisez l’imagerie ou le guidage rhinoscopique pour estimer l’emplacement de la face rostrale de la tumeur nasale afin de mesurer la longueur du cathéter en caoutchouc rouge afin que la pointe s’étende à la face rostrale de la tumeur.
- Ensuite, coupez le cathéter à l’extrémité sur la longueur définie du cathéter intranasal afin que l’extrémité atterrisse à l’endroit approprié lorsqu’elle est insérée dans la cavité nasale. Cependant, prévoyez une longueur supplémentaire pour la base du cathéter s’étendant à l’extérieur de la narine (longueur du cathéter du point de fixation de la seringue à l’entrée de la narine, environ 3 à 5 cm). Appliquer une marque avec un marqueur permanent à l’extrémité inférieure du cathéter pour indiquer le point de départ, correspondant à l’entrée de la narine ; La longueur prédéterminée du cathéter s’étendra par voie intranasale, l’extrémité du cathéter étant positionnée à l’endroit souhaité dans la cavité nasale.
- La réalisation de la procédure de lavage nasal nécessitera la participation de deux personnes. Désigner une personne (personne A) responsable de l’introduction du cathéter dans la cavité nasale et de l’administration du lavage, et la charge de l’autre personne (personne B) du prélèvement de l’échantillon à la sortie du nez.
- Demandez à la personne A de se positionner devant et en dessous de la tête du chien. Avec des mains gantées, demandez à la personne A de guider doucement l’extrémité du cathéter en caoutchouc rouge dans la face médiale de la cavité nasale et de l’avancer jusqu’à ce que la marque sur le cathéter s’aligne avec la face externe de la narine. Au cours de ce processus, assurez-vous que le cathéter est connecté à la seringue contenant la solution saline stérile chauffée. Demandez à la personne B de tenir un tube conique de 50 ml sous la narine avec le cathéter en place.
- La personne A obstrue doucement la narine controlatérale et commence à perfuser la solution saline dans la cavité nasale avec une pression lente et régulière ou avec une perfusion pulsée. Lorsque la tête du chien est positionnée vers le bas, la personne B recueille le liquide qui s’écoule de la cavité nasale par gravité dans le tube conique de 50 ml.
- Répétez cette technique de lavage nasal pour un total de cinq lavages salins de 20 ml, en changeant les tubes coniques, au besoin, pour prélever les échantillons groupés. Noter le volume total de liquide de lavage nasal recueilli par rapport à la quantité de solution saline perfusée après la fin de l’intervention.
- Une fois terminé, s’il est anesthésié avec de la dexmédétomidine, administrez par voie intramusculaire le même volume d’atipamézole que celui utilisé pour la dexmédétomidine, et permettez au chien de se remettre de l’anesthésie. Pour être prudent, gardez le chien en position couchée sternale avec la tête positionnée vers le bas pour faciliter le drainage supplémentaire de toute solution saline résiduelle du lavage nasal.
4. Traitement de l’échantillon de lavage nasal
- Manipulez doucement et/ou pipetez les échantillons de lavage nasal contenus dans les tubes coniques pour briser les amas de débris et de cellules. Faites passer les échantillons de lavage nasal groupés à travers un filtre de filtrage cellulaire de 70 μm pour éliminer les gros débris et le mucus. Centrifuger les échantillons à 300 × g pendant 5 à 10 minutes pour former une pastille cellulaire.
- Prélever le surnageant par aspiration à l’aide d’une pipette et le déposer dans un tube propre pour l’analyse des protéines d’intérêt.
- Remettre en suspension les pastilles cellulaires dans une solution saline tamponnée au phosphate (PBS) ou dans une solution préférée pour les tests cellulaires d’intérêt.
- Pour éliminer les globules rouges des échantillons, effectuez une lyse ammonium-chlorure-potassium (ACK) pour collecter les cellules nucléées du lavage nasal11,12.
Résultats
Avec cette méthode de lavage nasal, l’échantillon collecté apparaîtra légèrement trouble, éventuellement avec des morceaux visibles de débris cellulaires et de mucus lorsque le tube est tourbillonné. Un échantillon serait considéré comme contaminé par du sang périphérique si la procédure de lavage induit par inadvertance un saignement et que l’échantillon est teinté de rouge. Bien qu’une partie de la solution saline perfusée soit perdue pendant la procédure, un lavage négatif serait envisagé si la solution saline perfusion ne reflue pas hors de la narine et dans le tube ; Les causes potentielles pourraient être que la tête n’est pas suffisamment inclinée vers le bas pour permettre un reflux efficace, que l’échantillon s’est écoulé caudalement ou latéralement par la narine controlatérale, ou que le cathéter en caoutchouc rouge n’est pas solidement fixé à la seringue et que la solution saline s’est échappée vers l’extérieur à partir du point de connexion.
Lorsque des échantillons de lavage nasal ont été prélevés avec succès chez des chiens atteints d’un cancer du nez, on s’attend à ce que le nombre de cellules nucléées soit compris entre 1 × 10 6-200 × 10 6, avec 75 à 96 % de cellules vivantes. Alternativement, lorsque des échantillons de lavage nasal ont été collectés avec succès chez des chiens présentant des cavités nasales saines et non enflammées, le nombre de cellules a été compris entre 7 × 105-2 × 106, avec 6 à 16 % de cellules vivantes. Une image représentative d’échantillons cytologiques obtenus à partir d’un prélèvement par lavage nasal de chiens porteurs de tumeurs est présentée à la figure 2. De plus, l’évaluation par cytométrie en flux des populations cellulaires analysées à partir d’échantillons de lavage nasal de chiens sains et porteurs de tumeurs est présentée dans la figure 3. On s’attendrait à ce que le nombre de cellules et le pourcentage de viabilité inférieurs à ces fourchettes indiquent que la procédure de lavage nasal et le prélèvement d’échantillons ont échoué. Le tableau 1 résume les résultats de la technique de lavage nasal réalisée par les auteurs en ce qui concerne le nombre d’interventions effectuées, le nombre de chiens, l’état de la cavité nasale (saine ou porteuse d’une tumeur), le rendement du nombre de cellules nucléées, la viabilité des cellules obtenues pour l’intervention et si l’échantillon de lavage a été considéré comme un succès ou un échec pour l’analyse en aval. Aux fins des expériences réalisées avec les échantillons de lavage nasal inclus dans le tableau 1, un rendement minimal de 150 000 échantillons de lavage nasal a été considéré comme un prélèvement réussi d’échantillons de lavage nasal.
Avec cette technique de lavage nasal, une solution saline stérile à 0,9 % est utilisée pour collecter les cellules. Alternativement, la solution de Hartmann (solution de Ringer lactate) pourrait être envisagée ; cependant, les échantillons prélevés avec une solution saline ou une solution de Hartmann devraient être testés pour garantir une viabilité et des résultats comparables pour les cellules d’intérêt. De plus, une alternative à l’utilisation d’un cathéter en caoutchouc rouge chez les chiens non porteurs de tumeurs pourrait être d’effectuer le lavage nasal avec un cathéter de Foley. Bien qu’elle ne soit pas utilisée dans la technique de lavage nasal présentée ici, l’utilisation d’un cathéter de Foley permettrait de gonfler le ballonnet à l’extrémité du cathéter, obstruant la cavité nasale et empêchant la perte de liquide caudalement. De plus, bien qu’elle n’ait pas été testée dans l’approche de traitement du lavage nasal présentée ici, l’ajout de hyaluronidase à l’échantillon de lavage nasal pourrait être envisagé pour briser le mucus recueilli dans l’échantillon de lavage nasal et libérer plus de cellules pour l’analyse. Cela devrait également être optimisé pour s’assurer que les résultats ne sont pas altérés par l’ajout de hyaluronidase à la procédure de traitement du lavage nasal.
Les résultats publiés obtenus à partir de procédures de lavage nasal réussies effectuées chez des chiens inscrits à un essai clinique sur le cancer canin sont présentés à la figure 310. Les résultats présentés dans la figure 3 proviennent d’une étude portant sur l’impact de l’irradiation ganglionnaire élective sur le microenvironnement immunitaire local de chiens atteints de tumeurs sinuso-nasales dont les tumeurs ont été irradiées seules ou en combinaison avec une irradiation régionale des ganglions lymphatiques cervicaux. Grâce à un échantillonnage en série de la cavité nasale de chiens dans l’essai clinique avec lavage nasal, l’analyse cytométrique en flux des cellules collectées a révélé une diminution significative des populations de cellules T effectrices le dernier jour de la radiothérapie lorsque les ganglions lymphatiques régionaux ont été irradiés en même temps que la tumeur sinonasale par rapport aux chiens qui ont reçu une radiothérapie ciblée sur la tumeur et que les ganglions lymphatiques régionaux ont été épargnés. Cela démontre l’utilité de l’échantillonnage en série de la cavité nasale avec lavage pour étudier les changements dans les populations cellulaires à différents points et dans différentes conditions de traitement.

Figure 1 : Schéma de la méthode de lavage nasal. Une solution saline chaude et stérile est infusée dans la cavité nasale des chiens anesthésiés à l’aide d’un cathéter en caoutchouc rouge. Le liquide de lavage nasal est recueilli dans un tube lorsqu’il s’écoule du nez. Veuillez cliquer ici pour voir une version agrandie de cette figure.
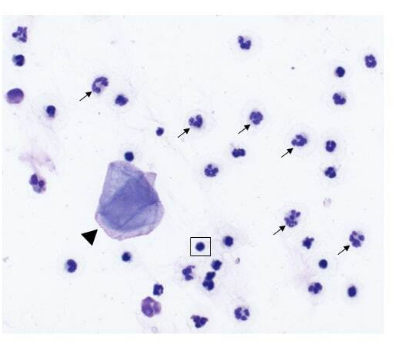
Figure 2 : Composition cellulaire d’un échantillon de lavage nasal prélevé sur un chien atteint d’une tumeur nasale. Image représentative d’échantillons cytologiques obtenus à partir d’un prélèvement par lavage nasal (grossissement de 500x, coloration Wright-Giemsa modifiée). Les neutrophiles (flèches) sont les cellules prédominantes, avec quelques cellules épithéliales squameuses (pointe de flèche) et de petits lymphocytes matures (mis en évidence dans l’encadré carré) également présents. Veuillez cliquer ici pour voir une version agrandie de cette figure.
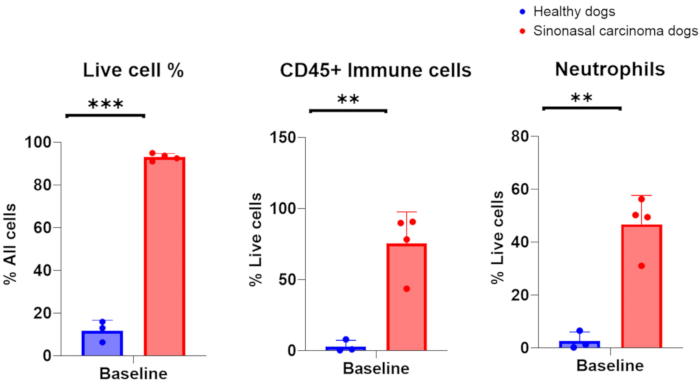
Graphique 3. Analyse par cytométrie en flux d’échantillons de lavage nasal prélevés sur des chiens sains et porteurs de tumeurs. Comparaison de l’abondance de cellules vivantes, de cellules immunitaires et de neutrophiles entre des chiens sains (bleu, n = 3) et des chiens porteurs de tumeurs atteints d’un carcinome sinonasal (rouge, n = 4). Veuillez cliquer ici pour voir une version agrandie de cette figure.
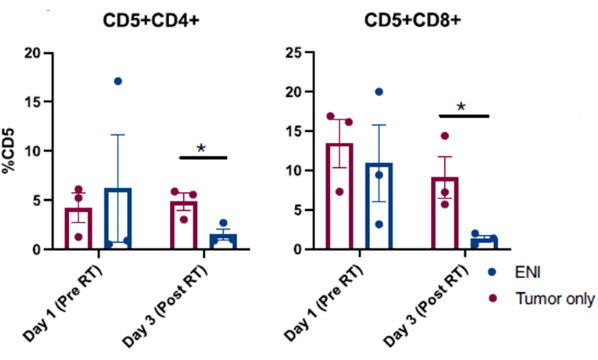
Figure 4 : Analyse cytométrique en flux de cellules prélevées lors d’un lavage nasal chez des chiens inscrits à un essai clinique portant sur l’impact de l’irradiation ganglionnaire élective (IEN) sur le microenvironnement immunitaire local. Quantification des lymphocytes T CD4 (CD5+CD4+) et CD8 (CD5+CD8+) à partir d’échantillons de lavage nasal. Les chiens traités par ENI en même temps que l’irradiation tumorale (n = 3) présentaient une réduction significative des lymphocytes T effecteurs CD4 et CD8 le dernier jour de l’irradiation (jour 3) par rapport aux chiens traités par des radiations ciblant uniquement la tumeur (n = 3). Cette figure a été modifiée à partir de Darragh et al.10. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Sain (n = 3) | Porteur de tumeur (n = 19) | |
| Nombre d’interventions effectuées | 3 | 80 |
| Numération cellulaire | 0,7 x 106 - 2,8 x 106 | 1,6 x 106 - 210 x 106 ; médiane : 8,7 x 106 |
| Viabilité cellulaire | 6.3 - 15.9% | 75% - 96%; médiane : 87 % |
| Taux de réussite | 100% | 98.80% |
Tableau 1 : Résumé des procédures de lavage nasal effectuées et des caractéristiques cellulaires des échantillons obtenus.
Discussion
Le protocole de lavage nasal comporte plusieurs étapes critiques. En ce qui concerne le chien subissant la procédure de lavage nasal, le chien doit se trouver dans un plan d’anesthésie suffisamment profond pour qu’il ne réagisse pas à la mise en place du cathéter ou à l’administration du lavage. S’ils réagissent sous anesthésie, cela peut compromettre la qualité et la quantité de la collecte d’échantillons de lavage, ainsi qu’augmenter les risques de lésions aiguës du tissu nasal dues à un traumatisme local du cathéter intranasal ou pour le chien aspirant le liquide de lavage.
Le positionnement de la tête du chien est également essentiel pour une collecte optimale des échantillons de lavage nasal. Si l’angle vers le bas de la tête est insuffisant pour permettre le reflux dépendant de la gravité de la solution saline instillée, le liquide de lavage nasal peut s’écouler caudalement et l’échantillon peut être perdu par le nasopharynx. De plus, une communication claire entre la personne A et la personne B est importante pendant la procédure de lavage nasal. Il se peut que la personne B doive faire des ajustements rapides pour la mise en place du tube de prélèvement, car le liquide s’écoule de la narine pendant que la personne A rince le ballon ; La visibilité du liquide de lavage s’écoulant dans le tube conique peut ne pas être tout à fait claire pour la personne A et la personne B pendant la procédure, de sorte qu’une communication active tout au long du processus est essentielle pour une collecte d’échantillon réussie. Une fois que l’échantillon de lavage nasal a été prélevé, si la viabilité cellulaire doit être préservée pour une analyse future, il est essentiel que les cellules soient maintenues dans une solution de pH physiologique, telle qu’une solution saline à 0,9 % ou 1x PBS.
Des modifications peuvent être apportées au protocole de lavage nasal tout au long des phases de collecte et de traitement. Lors du prélèvement d’échantillons, la profondeur de l’anesthésie peut être ajustée pour s’assurer que le chien ne réagira pas au lavage nasal. Pour ce faire, on peut ajuster le pourcentage de gaz anesthésique (p. ex., l’isoflurane) ou administrer un bolus d’anesthésique intraveineux à courte durée d’action (p. ex., propofol).
Si, après l’instillation de la solution saline dans la cavité nasale, seule une petite quantité de liquide est recueillie dans le tube, repositionnez la tête du chien à un angle vers le bas, de sorte qu’elle repose confortablement sur le bord de la table, afin d’augmenter le potentiel de gravité pour permettre au liquide de s’écouler du nez. S’il est noté que du liquide s’écoule de la narine controlatérale, obstruez étroitement la narine controlatérale pour les lavages suivants. Au cours de la phase de traitement, si le nombre initial de cellules de l’échantillon est faible, il faut centrifuger à nouveau la partie surnageante de l’échantillon pour recueillir toutes les cellules supplémentaires qui peuvent être présentes afin d’augmenter le rendement total.
Il existe des limites notables à l’utilisation de la méthode de lavage nasal pour analyser le microenvironnement immunitaire nasal canin. Avec cette technique, les échantillons de lavage nasal sont une collection de cellules de surface et de protéines de la cavité nasale qui sont facilement délogées. Ces cellules et protéines de surface peuvent ne pas être entièrement représentatives des tissus plus profonds du microenvironnement nasal canin. Des efforts sont en cours pour comparer les profils cellulaires et protéiques du lavage nasal canin à des échantillons de biopsie afin de déterminer les similitudes et les différences de ces facteurs entre les deux techniques d’échantillonnage des fosses nasales.
Malgré ces limites, la technique de lavage nasal pour échantillonner le microenvironnement immunitaire nasal canin offre une approche alternative aux méthodes existantes. Comparé à une biopsie tissulaire ou même à une procédure de rhinoscopie, le lavage nasal est relativement non invasif pour le patient canin. La collecte de cellules et de protéines par lavage nasal par rapport à la biopsie tissulaire diminue les risques d’hémorragie aiguë cliniquement préoccupante, prolongée ou importante ; Après la procédure de lavage nasal, il y a probablement moins d’inflammation et d’inconfort locaux par rapport à une biopsie du tissu nasal. Pour cette raison, le lavage nasal peut être effectué en série pour recueillir plusieurs échantillons au fil du temps pour les analyses. De plus, il y a une facilité relative accrue dans le traitement des échantillons de lavage nasal par rapport aux échantillons de biopsie tissulaire en ce qui concerne la séparation du composant cellulaire des protéines dans le surnageant pour les méthodes de laboratoire et les tests en aval.
La méthode de lavage nasal a le potentiel d’applications importantes dans les domaines de recherche associés au microenvironnement immunitaire. Dans la recherche sur le cancer, la technique de lavage nasal a été utilisée10 et peut être utilisée pour documenter les changements en série dans le microenvironnement de la cavité nasale chez les chiens porteurs de tumeurs par rapport aux conditions de traitement ; Ces échantillons de lavage nasal peuvent également s’avérer précieux pour corréler les changements dans le microenvironnement immunitaire afin de mieux comprendre les réponses au traitement du cancer. Des aspects similaires de l’étude des changements en série dans le microenvironnement immunitaire nasal peuvent être explorés et étudiés pour de nombreux domaines de recherche vétérinaire, clinique et translationnelle, infectieuse et inflammatoire.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à déclarer.
Remerciements
La technique de lavage nasal canin décrite dans le présent document a été optimisée grâce à des projets soutenus par K01 OD03109, le CCTSI Colorado Pilot Grant Award, le programme de ressources partagées du CSU CVMBS College Research Council et le CO HNC SPORE CA261605 : Career Enhancement Program. La figure 1 a été créée avec BioRender.com.
matériels
| Name | Company | Catalog Number | Comments |
| 1.5 mL Tubes | Eppendorf | 05-402 | |
| 1000 µL Pipette | VWR | 89079-974 | |
| 1x PBS | Corning | 21-040-CV | |
| 20 mL Syringes | VWR | BD302830 | |
| 50 mL Conical Tubes | VWR | 89039-656 | |
| 70 µm Cell Strainer | Fisherbrand | 22-363-548 | |
| 8FR Sterile Red Rubber Catheter | Med Vet International | 50-252-2428 | |
| ACK Lysis Buffer | Gibco | A1049201 | |
| Centrifuge | Beckman Coulter | 366816 | |
| Physiological Saline (0.9%) | Vetivex | 17033-492-01 | |
| Vortex | VWR | 10153-838 |
Références
- Cohn, L. A. Canine nasal disease: An update. Vet Clin: Small Anim Pract. 50 (2), 359-374 (2020).
- Mortier, J., Blackwood, L. Treatment of nasal tumours in dogs: A review. J Small Anim Pract. 61 (7), 404-415 (2020).
- Plickert, H., Tichy, A., Hirt, R. Characteristics of canine nasal discharge related to intranasal diseases: A retrospective study of 105 cases. J Small Anim Pract. 55 (3), 145-152 (2014).
- Windsor, R. C., Johnson, L. R. Canine chronic inflammatory rhinitis. Clin Tech Small Anim Practice. 21 (2), 76-81 (2006).
- Van Pelt, D. R., Mckiernan, B. C. Pathogenesis and treatment of canine rhinitis. Vet Clin North Am Small Anim Pract. 24 (5), 789-806 (1994).
- Hazuchova, K., Neiger, R., Stengel, C. Topical treatment of mycotic rhinitis-rhinosinusitis in dogs with meticulous debridement and 1% clotrimazole cream: 64 cases (2007-2014). JAVMA. 250 (3), 309-315 (2017).
- Lobetti, R. Idiopathic lymphoplasmacytic rhinitis in 33 dogs. JS Afr Vet Assoc. 85 (1), 1-5 (2014).
- Ashbaugh, E. A., Mckiernan, B. C., Miller, C. J., Powers, B. Nasal hydropulsion: A novel tumor biopsy technique. JAAHA. 47 (5), 312-316 (2011).
- Wheat, W., et al. Local immune and microbiological responses to mucosal administration of a liposome-tlr agonist immunotherapeutic in dogs. BMC Vet Res. 15 (1), 330 (2019).
- Darragh, L. B., et al. Elective nodal irradiation mitigates local and systemic immunity generated by combination radiation and immunotherapy in head and neck tumors. Nat Commun. 13 (1), 7015 (2022).
- Pinard, C. J., et al. Evaluation of lymphocyte-specific programmed cell death protein 1 receptor expression and cytokines in blood and urine in canine urothelial carcinoma patients. Vet Comp Oncol. 20 (2), 427-436 (2022).
- Choi, J. W., et al. Development of canine pd-1/pd-l1 specific monoclonal antibodies and amplification of canine t cell function. PLoS One. 15 (7), e0235518 (2020).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon