Method Article
개의 비강 면역 미세환경 샘플링을 위한 식염수 세척
요약
식염수 비강 세척액은 개의 비강 면역 미세환경을 샘플링하는 데 사용할 수 있습니다. 이 접근법은 상대적으로 비침습적이고 코 조직을 파괴하지 않기 때문에 연속적으로 수행할 수 있습니다. 비강 세척 기법으로 채취한 세포와 단백질은 다양한 실험실 분석을 위해 처리할 수 있습니다.
초록
개 비강의 국소 면역 미세환경을 평가하는 것은 정상 조직 건강 및 질병 상태, 특히 국소 염증과 관련된 상태를 조사하는 데 중요할 수 있습니다. 우리는 연속 비강 세척을 통해 개의 국소 비강 면역 미세환경을 평가하는 기술을 최적화했습니다. 간단히 말해서, 개가 마취 상태에 있고 흉골 누운 상태로 배치된 상태에서 예열된 멸균 식염수를 유연하고 부드러운 고무 카테터를 사용하여 영향을 받은 콧구멍으로 씻어냅니다. 유체 역류는 원뿔형 튜브로 수집되고 이 과정이 반복됩니다. 제거된 세포와 단백질을 포함하는 액체를 모으고, 풀링된 비강 세척 샘플을 세포 여과기를 통해 여과하여 큰 파편과 점액을 제거합니다. 시료를 원심분리하고 세포 펠릿을 분리하여 분석합니다. 샘플이 처리되면 비강 세척 후에 발생할 수 있는 분석에는 유세포 분석, 벌크 또는 단일 세포 RNA 염기서열분석을 통한 세포의 전사체 분석 및/또는 세척액에 존재하는 사이토카인의 정량화가 포함됩니다.
서문
개는 일생 동안 일상적으로 염증성 코 질환을 앓습니다. 반려견의 급성 또는 만성 비염의 근본 원인은 감염성(바이러스성: 인플루엔자, 파라인플루엔자, 헤르페스 바이러스, 박테리아[예: 보르데텔라, 마이코플라스마], 진균성[예: 아스페르길루스증, 크립토코코시스], 기생충[예: 코 진드기])에서 종양성(예: 부비강 악성 종양, 가장 일반적으로 암종 또는 육종 조직형), 이물질(예: 이물질, 탈구된 치아의 비강 내 이동), 치주 질환에 이르기까지 다양합니다. 뿐만 아니라 개 특발성 염증성 비염 1,2,3,4,5,6,7.
신체 검사 외에도 비강 염증이 있는 개의 부비강 상태를 평가하기 위해 다양한 접근 방식이 사용됩니다. 영상 절차에는 방사선 사진(치과, 두개골), 컴퓨터 단층 촬영(CT) 또는 자기 공명 영상(MRI)이 포함될 수 있습니다. 비강을 촬영하는 또 다른 방법은 코내시경 검사입니다. 조직 샘플링에는 비강 면봉, 브러시 샘플 또는 조직 생검을 획득하는 작업이 포함될 수 있으며, 이를 통해 세포학적 및/또는 조직학적 평가를 수행할 수 있을 뿐만 아니라 진균 또는 박테리아 배양을 위한 샘플 제출도 수행할 수 있습니다. 이러한 샘플은 "블라인드" 샘플링에서 코 내시경 또는 고급 이미징을 통한 이미지 유도에 이르기까지 다양한 접근 방식으로 얻을 수 있으며, 비인두에서 콧구멍, 비인두, 트레피네이션, 코 절개술 또는 부비동 절개술의 외과적 접근 방식에 이르기까지 다양한 접근 방식으로 얻을 수 있습니다.
멸균 식염수를 비강에 투여하는 비강 세척은 진단 및 치료 목적으로 개의 비강을 샘플링하는 데에도 사용되었습니다. 비강 종양에 사용된 비강 세척 기법의 대안적 버전은 비강 수압 작용(forceful nasal flushing)이라고 불리며, 이는 진단 평가를 위해 큰 종양 샘플을 제거할 수 있을 뿐만 아니라 비강암과 관련된 임상 징후의 개선을 위한 치료 완화를 제공할 수 있습니다8.
우리는 여기에서 비강 면역 미세환경의 세포와 단백질을 수집하고 분석하기 위한 의도된 목적을 위한 또 다른 버전의 비강 세척 기술을 제시합니다. 부드럽고 상대적으로 비침습적인 접근 방식을 통해 이 비강 세척 기술을 연속 비강 면역 미세환경 샘플링에 최적화했습니다. 염증이 없는 비강, 활동성 헤르페스 바이러스 감염 및 부비강 종양이 있는 개를 대상으로 한 시험에서 우리는 다운스트림 응용 프로그램을 위한 샘플 수집 및 처리를 위한 비강 세척의 유용성을 입증했습니다 9,10.
이 원고에서는 개의 비강 면역 미세환경의 연속 샘플링을 위한 식염수 비강 세척 기술에 대해 설명합니다. 당사는 조직의 파괴를 최소화하면서 비강 세척 샘플을 효과적으로 획득하고 다양한 분석을 위해 샘플을 처리하기 위한 프로토콜 세부 정보를 제공합니다.
프로토콜
이 비강 세척 절차는 Colorado State University Institutional Animal Care and Use Committee 및 Clinical Review Board(IACUC #2425)의 승인을 받았습니다. 비강 세척 방법의 개략도는 그림 1에 나와 있습니다.
1. 비강 세척 준비
- 비강 세척 시술 전날, 20mL 주사기 5개에 멸균 생리식염수(0.9% 염화나트륨 용액)를 채우고 뚜껑으로 닫습니다. 주사기를 37 °C로설정된 인큐베이터에 넣어 밤새 데울 수 있도록 합니다.
2. 코 세척을 위해 개 배치
- 시술을 위해 개를 마취한 다음(예: IV 카테터를 통해 덱스메데토미딘(1-4 μg/kg) 및 부토르파놀(0.2-0.5 mg/kg)을 정맥 주사한 다음 삽관 효과를 위해 적정된 프로포폴 IV(2-5 mg/kg)를 투여합니다. 효과를 보려면 1-2% 흡입제 이소플루란으로 마취를 유지하십시오.) 마취 깊이를 확인하려면 손바닥 반응과 턱 긴장도를 확인합니다.
- 시술 중 건조를 방지하기 위해 눈을 윤활하십시오.
- 절차 전반에 걸쳐 심장 원격 측정, 혈압, 카프노그래피 및 맥박 산소 측정 값을 모니터링합니다.
- 마취된 개를 흉골 누운 상태로 놓습니다. 최적의 비강 세척 샘플 수집을 위해 개의 머리가 치료 테이블 가장자리에서 아래쪽 각도로 자연스럽고 편안하게 각도가 잡히도록 개의 머리를 놓습니다.
- 기도가 단단히 밀봉되도록 기관내관의 커프를 팽창시킵니다.
3. 비강 세척 시행
- 따뜻한 식염수가 들어 있는 미리 채워진 20mL 주사기 중 하나에 꼭 맞도록 바닥에서 8 FR 멸균 빨간색 고무 카테터를 자릅니다. 멸균된 빨간색 고무 카테터를 측정하여 카테터의 원위 끝이 콧구멍을 통해 삽입될 때 비강 중간쯤까지 확장되도록 합니다. 코 종양을 샘플링하는 경우, 영상 또는 코 투시경 유도를 사용하여 코종양의 상부 측면의 위치를 추정하고 빨간색 고무 카테터의 길이를 측정하여 팁이 종양의 상부 측면까지 확장되도록 합니다.
- 그런 다음 정의된 비강 내 카테터 길이에 맞게 팁의 카테터를 절단하여 팁이 비강에 삽입될 때 적절한 위치에 안착하도록 합니다. 그러나 콧구멍 바깥쪽으로 뻗어 있는 카테터 기저부에 추가 길이를 허용하십시오(주사기 고정 지점에서 콧구멍 입구까지의 카테터 길이, 약 3-5cm). 콧구멍 입구에 해당하는 시작점을 나타내기 위해 카테터의 기저부 끝에 영구 마커가 있는 표시를 적용합니다. 미리 결정된 카테터 길이는 비강 내까지 확장되며 카테터 팁은 비강 내 원하는 위치에 배치됩니다.
- 비강 세척 절차를 수행하려면 두 명의 참여가 필요합니다. 한 사람(사람 A)은 카테터를 비강에 공급하고 세척을 투여하고, 다른 사람(사람 B)은 코에서 나오는 샘플을 채취하도록 합니다.
- 사람 A가 개의 머리 앞과 아래에 위치하도록 합니다. 장갑을 낀 손으로 사람 A가 빨간색 고무 카테터의 끝을 비강의 내측으로 부드럽게 안내하고 카테터의 표시가 콧구멍의 바깥쪽과 일직선이 될 때까지 전진시킵니다. 이 과정에서 카테터가 가열된 멸균 식염수가 들어 있는 주사기에 연결되어 있는지 확인합니다. 사람 B가 카테터를 삽입한 상태에서 콧구멍 아래에 50mL 원뿔형 튜브를 잡도록 합니다.
- 사람 A는 반대쪽 콧구멍을 부드럽게 막고 느리고 일정한 압력 또는 펄스 주입으로 식염수를 비강에 주입하기 시작합니다. 개의 머리가 아래쪽 각도로 위치하면 사람 B는 중력을 통해 비강에서 배출되는 액체를 50mL 원뿔형 튜브로 모읍니다.
- 총 5개의 20mL 식염수 세척에 대해 이 비강 세척 기술을 반복하고 필요에 따라 원뿔형 튜브를 교체하여 풀링된 샘플을 수집합니다. 절차 완료 후 주입된 식염수의 양과 관련하여 수집된 비강 세척액의 총량을 기록합니다.
- 완료되면 덱스메데토미딘으로 마취한 경우 덱스메데토미딘에 사용된 것과 동일한 양의 아티파메졸을 근육 주사로 투여하고 개가 마취에서 회복할 수 있도록 합니다. 조심해야 하며, 개를 흉골 누운 상태로 유지하고 머리를 아래로 향하게 하여 코 세척에서 잔류 식염수를 추가로 배출할 수 있도록 합니다.
4. 비강 세척 샘플 처리
- 원뿔형 튜브 안에 들어있는 비강 세척 샘플을 부드럽게 와류 및/또는 피펫팅하여 파편과 세포 덩어리를 분해합니다. 풀링된 비강 세척 샘플을 70μm 세포 변형 필터에 통과시켜 큰 파편과 점액을 제거합니다. 샘플을 300 × g 에서 5-10분 동안 원심분리하여 세포 펠릿을 형성합니다.
- 피펫으로 흡인을 통해 상층액을 수집하고 관심 단백질을 분석하기 위해 깨끗한 튜브에 보관합니다.
- 세포 펠릿을 인산염 완충 식염수(PBS) 또는 관심 세포 분석을 위해 선호되는 용액에 재현탁합니다.
- 샘플에서 적혈구를 제거하려면, 암모늄-염화물-칼륨(ACK) 용해를 수행하여 비강 세척11,12에서 핵세포를 채취한다.
결과
이 비강 세척 방법을 사용하면 수집된 샘플이 약간 흐린 것처럼 보이며 튜브를 소용돌이칠 때 세포 파편과 점액 조각이 보일 수 있습니다. 세척 절차가 실수로 출혈을 유발하고 샘플이 붉게 물들면 샘플이 말초 혈액에 오염된 것으로 간주됩니다. 주입된 식염수의 일부는 시술 중에 손실되지만, 주입된 식염수가 콧구멍에서 튜브로 역류하지 않으면 음의 세척이 고려됩니다. 잠재적인 원인은 헤드가 효과적인 역류를 허용할 만큼 충분히 아래쪽으로 기울어져 있지 않거나, 샘플이 반대쪽 콧구멍을 통해 꼬리 또는 옆으로 배출되었거나, 빨간색 고무 카테터가 주사기에 단단히 고정되지 않아 식염수가 연결 지점에서 바깥쪽으로 누출된 것 등일 수 있습니다.
비강암에 걸린 개로부터 비강 세척 샘플을 성공적으로 채취하면 1 × 10 6-200 × 106 범위의 핵 세포 수가 예상되며 75-96%의 살아있는 세포가 있습니다. 또는, 건강하고 염증이 없는 비강을 가진 개로부터 비강 세척 샘플을 성공적으로 채취한 경우, 세포 수는 7 ×10 5-2 × 106 범위이며 6-16%의 살아있는 세포가 있습니다. 종양이 있는 개의 비강 세척 샘플링에서 얻은 세포학적 표본의 대표적인 이미지가 그림 2에 나와 있습니다. 또한 건강한 개와 종양이 있는 개의 비강 세척 샘플에서 분석한 세포 집단의 유세포 분석 평가가 그림 3에 나와 있습니다. 세포 수와 생존율이 이 범위보다 낮으면 비강 세척 절차와 샘플 채취가 실패했음을 나타낼 것으로 예상됩니다. 표 1은 수행된 시술 횟수, 개 수, 비강 상태(건강 또는 종양 보유), 핵 세포 수의 수율, 시술을 위해 얻은 세포의 생존력, 세척 샘플이 다운스트림 분석의 성공 또는 실패로 간주되었는지 여부와 관련하여 저자가 수행한 비강 세척 기술의 결과를 요약합니다. 표 1에 포함된 비강 세척 샘플로 수행된 실험의 목적상, 최소 세포 수 수율 150,000이 성공적인 비강 세척 샘플 수집으로 간주되었습니다.
이 비강 세척 기술에서는 멸균 0.9% 식염수를 사용하여 세포를 수집합니다. 대안적으로, Hartmann의 용액 (젖산 Ringer의 용액)을 고려할 수 있습니다. 그러나 식염수 또는 Hartmann 용액으로 수집된 샘플은 관심 세포에 대한 유사한 생존력과 결과를 보장하기 위해 테스트해야 합니다. 또한 종양이 없는 개에서 빨간색 고무 카테터를 사용하는 대신 폴리 카테터로 비강 세척을 수행할 수 있습니다. 여기에 제시된 비강 세척 기술에는 사용되지 않았지만 폴리 카테터를 사용하면 카테터 끝에서 풍선을 팽창시켜 비강을 막고 꼬리 방향의 체액 손실을 방지할 수 있습니다. 또한 여기에 제시된 비강 세척 처리 방법에서 테스트되지는 않았지만 비강 세척 샘플에 히알루로니다아제를 추가하면 비강 세척 샘플에 수집된 점액을 분해하고 분석을 위해 더 많은 세포를 확보하는 것으로 간주될 수 있습니다. 이것은 또한 비강 세척 처리 절차에 히알루로니다아제를 추가하여 결과가 변경되지 않도록 최적화해야 합니다.
반려견암 임상시험에 등록된 개에서 수행된 성공적인 비강 세척 시술에서 얻은 발표된 결과는 그림 310에 제시되어 있습니다. 그림 3 에 제시된 결과는 종양이 단독으로 또는 국소 경추 림프절 방사선 조사와 병행하여 방사선 조사를 받은 부비강 종양이 있는 개의 국소 면역 미세환경에 대한 선택적 결절 조사의 영향을 조사한 연구에서 나온 것입니다. 비강 세척제를 사용한 임상시험에서 개의 비강을 연속 샘플링한 결과, 수집된 세포의 유세포 분석을 통해 방사선 요법 마지막 날에 종양을 표적으로 하는 방사선 요법을 받은 개와 국소 림프절을 살린 개에 비해 부비동 종양과 동시에 국소 림프절을 방사선 조사한 결과 효과기 T 세포의 개체군이 현저히 감소한 것으로 나타났습니다. 이는 세척제로 비강을 연속적으로 샘플링하여 다른 지점과 다른 치료 조건에서 세포 집단의 변화를 조사하는 것의 유용성을 보여줍니다.

그림 1: 비강 세척 방법의 개략도. 데워진 멸균 식염수를 빨간색 고무 카테터를 사용하여 마취된 개의 비강에 주입합니다. 비강 세척액은 코에서 배출될 때 튜브에 모입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
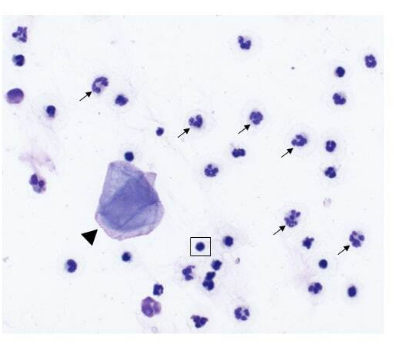
그림 2: 비강 종양이 있는 개에서 채취한 비강 세척 샘플의 세포 조성. 비강 세척 샘플링에서 얻은 세포학적 표본의 대표 이미지(500x 배율, Modified Wright-Giemsa 염색). 호중구(화살표)가 우세한 세포이며, 몇 개의 편평 상피 세포(화살촉)와 작은 성숙한 림프구(사각형 상자에 강조 표시됨)도 존재합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
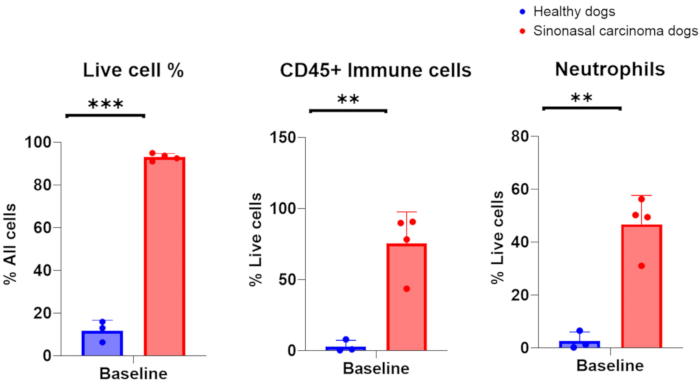
그림 3. 건강한 개와 종양이 있는 개에서 채취한 비강 세척 샘플의 유세포 분석. 건강한 개(파란색, n = 3)와 부비강 암종(빨간색, n = 4)이 있는 종양 보유 개 간의 살아있는 세포, 면역 세포 및 호중구의 풍부도 비교. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
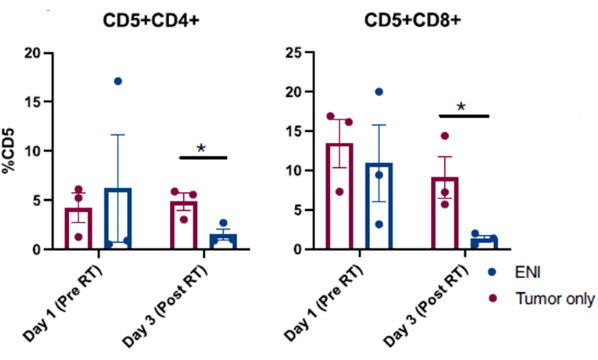
그림 4: 선택적 결절 조사(ENI)가 국소 면역 미세환경에 미치는 영향을 조사하는 임상시험에 등록된 개의 비강 세척에서 채취한 세포의 유세포 분석 분석. 비강 세척 샘플에서 CD4(CD5+CD4+) 및 CD8(CD5+CD8+) T 세포의 정량화. 종양 방사선 조사와 동시에 ENI를 투여받은 개(n=3)는 종양만을 대상으로 방사선을 투여한 개(n=3)에 비해 방사선 조사 마지막 날(3일차)에 효과기 CD4 및 CD8 T 세포가 유의하게 감소했다. 이 그림은 Darragh et al.10에서 수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 정상 (n = 3) | 종양 보유 (n= 19) | |
| 수행된 시술 횟수 | 3 | 80 |
| 세포 수 | 0.7 엑스 106 - 2.8 엑스 106 | 1.6 x 106 - 210 x 106; 중앙값: 8.7 x 106 |
| 세포 생존율 | 6.3 - 15.9% | 75% - 96%; 중앙값: 87% |
| 성공률 | 100% | 98.80% |
표 1: 수행된 비강 세척 절차 요약 및 얻은 샘플의 세포 특성.
토론
비강 세척 프로토콜에는 몇 가지 중요한 단계가 있습니다. 코 세척 절차를 받는 개와 관련하여, 개는 카테터 배치 또는 세척 투여에 반응하지 않도록 충분히 깊은 마취 평면 내에 있어야 합니다. 마취 상태에서 반응하는 경우, 이는 세척 샘플 수집의 품질과 양을 손상시킬 수 있을 뿐만 아니라 비강 내 카테터의 국소 외상 또는 세척액을 흡인하는 개로 인한 급성 비강 조직 손상의 위험을 잠재적으로 증가시킬 수 있습니다.
개의 머리를 배치하는 것도 최적의 비강 세척 샘플 수집을 위해 중요합니다. 머리의 아래쪽 각도가 주입된 식염수의 중력에 따른 역류에 충분하지 않은 경우, 비강 세척액이 꼬리로 흐를 수 있으며 샘플이 비인두를 통해 손실될 수 있습니다. 또한 비강 세척 시술 중에는 A와 B인 사이의 명확한 의사 소통이 중요합니다. 사람 A가 물을 내리는 동안 콧구멍에서 액체가 배출되기 때문에 수집 튜브 배치를 위해 사람 B가 빠른 조정이 필요할 수 있습니다. 원뿔형 튜브로 유입되는 세척액의 가시성은 시술 중 사람 A와 사람 B 모두에게 완전히 명확하지 않을 수 있으므로 프로세스 전반에 걸쳐 적극적인 의사 소통이 성공적인 샘플 수집의 핵심입니다. 비강 세척 샘플을 채취한 후 향후 분석을 위해 세포 생존력을 보존하려면 0.9% 식염수 또는 1x PBS와 같은 생리학적 pH 용액에서 세포를 유지하는 것이 중요합니다.
비강 세척 프로토콜은 수집 및 처리 단계 전반에 걸쳐 수정할 수 있습니다. 검체를 채취하는 동안 개가 코 세척에 반응하지 않도록 마취 깊이를 조정할 수 있습니다. 이는 마취 가스(예: 이소플루란)의 비율을 조정하거나 속효성 정맥 마취제(예: 프로포폴)를 투여함으로써 달성할 수 있습니다.
식염수를 비강에 주입한 후 소량의 액체만 튜브에 모이면 개의 머리를 아래쪽 각도로 재배치하여 테이블 가장자리에서 편안하게 놓이도록 하여 중력의 가능성을 높여 액체가 코에서 배출될 수 있도록 합니다. 반대쪽 콧구멍에서 액체가 배출되는 것이 확인되면 다음 세척을 위해 반대쪽 콧구멍을 단단히 막습니다. 처리 단계에서 초기 샘플 셀 수가 적으면 샘플의 상등액 부분을 다시 원심분리하여 총 수율을 높이기 위해 존재할 수 있는 추가 셀을 수집합니다.
개의 비강 면역 미세환경을 분석하기 위해 비강 세척 방법을 사용하는 데에는 주목할 만한 한계가 있습니다. 이 기술을 사용하면 비강 세척 샘플은 쉽게 제거되는 비강의 표면 세포와 단백질의 집합체입니다. 이러한 표면 세포와 단백질은 개의 코 미세환경의 더 깊은 조직을 완전히 대표하지 않을 수 있습니다. 두 비강 샘플링 기술 간의 이러한 요인의 유사점과 차이점을 결정하기 위해 개 비강 세척액의 세포 및 단백질 프로필을 생검 샘플과 비교하기 위한 노력이 진행 중입니다.
이러한 한계에도 불구하고 개의 비강 면역 미세환경을 샘플링하기 위한 비강 세척 기술은 기존 방법에 대한 대안적인 접근 방식을 제공합니다. 조직 생검이나 코 내시경 시술과 비교할 때, 코 세척은 개 환자에게 상대적으로 비침습적입니다. 조직 생검과 비교하여 비강 세척을 통해 세포와 단백질을 수집하면 임상적으로 우려되는 급성 출혈, 장기 또는 심각한 급성 출혈의 위험을 줄일 수 있습니다. 비강 세척 시술 후에는 코 조직 생검과 비교할 때 국소 염증과 불편함이 적을 수 있습니다. 이 때문에 비강 세척을 연속적으로 수행하여 분석을 위해 시간이 지남에 따라 여러 샘플을 수집할 수 있습니다. 또한, 다운스트림 실험실 방법 및 분석을 위해 상층액 내의 단백질에서 세포 성분을 분리하는 것과 관련하여 조직 생검 샘플에 비해 비강 세척 샘플을 처리하는 것이 상대적으로 용이합니다.
비강 세척 방법은 면역 미세환경과 관련된 연구 분야에서 중요한 응용 분야에 대한 잠재력을 가지고 있습니다. 암 연구에서는 비강 세척 기법이 사용되어 왔으며10 종양이 있는 개의 비강 미세환경의 연속적인 변화를 치료 조건과 관련하여 문서화하는 데 사용할 수 있다. 이러한 비강 세척 샘플은 암 치료에 대한 반응을 더 잘 이해하기 위해 면역 미세환경의 변화를 연관시키는 데 가치가 있는 것으로 입증될 수도 있습니다. 비강 면역 미세환경의 연속적인 변화를 조사하는 유사한 측면은 수많은 수의학, 임상 및 중개, 감염 및 염증 연구 분야에서 탐구 및 조사될 수 있습니다.
공개
저자는 선언할 이해 상충이 없습니다.
감사의 말
본 명세서에 기술된 송곳니 비강 세척 기법은 K01 OD03109, CCTSI Colorado Pilot Grant Award, CSU CVMBS College Research Council Shared Resources Program 및 CO HNC SPORE CA261605: Career Enhancement Program의 지원을 받는 프로젝트를 통해 최적화되었습니다. 그림 1 은 BioRender.com 를 사용하여 만든 것입니다.
자료
| Name | Company | Catalog Number | Comments |
| 1.5 mL Tubes | Eppendorf | 05-402 | |
| 1000 µL Pipette | VWR | 89079-974 | |
| 1x PBS | Corning | 21-040-CV | |
| 20 mL Syringes | VWR | BD302830 | |
| 50 mL Conical Tubes | VWR | 89039-656 | |
| 70 µm Cell Strainer | Fisherbrand | 22-363-548 | |
| 8FR Sterile Red Rubber Catheter | Med Vet International | 50-252-2428 | |
| ACK Lysis Buffer | Gibco | A1049201 | |
| Centrifuge | Beckman Coulter | 366816 | |
| Physiological Saline (0.9%) | Vetivex | 17033-492-01 | |
| Vortex | VWR | 10153-838 |
참고문헌
- Cohn, L. A. Canine nasal disease: An update. Vet Clin: Small Anim Pract. 50 (2), 359-374 (2020).
- Mortier, J., Blackwood, L. Treatment of nasal tumours in dogs: A review. J Small Anim Pract. 61 (7), 404-415 (2020).
- Plickert, H., Tichy, A., Hirt, R. Characteristics of canine nasal discharge related to intranasal diseases: A retrospective study of 105 cases. J Small Anim Pract. 55 (3), 145-152 (2014).
- Windsor, R. C., Johnson, L. R. Canine chronic inflammatory rhinitis. Clin Tech Small Anim Practice. 21 (2), 76-81 (2006).
- Van Pelt, D. R., Mckiernan, B. C. Pathogenesis and treatment of canine rhinitis. Vet Clin North Am Small Anim Pract. 24 (5), 789-806 (1994).
- Hazuchova, K., Neiger, R., Stengel, C. Topical treatment of mycotic rhinitis-rhinosinusitis in dogs with meticulous debridement and 1% clotrimazole cream: 64 cases (2007-2014). JAVMA. 250 (3), 309-315 (2017).
- Lobetti, R. Idiopathic lymphoplasmacytic rhinitis in 33 dogs. JS Afr Vet Assoc. 85 (1), 1-5 (2014).
- Ashbaugh, E. A., Mckiernan, B. C., Miller, C. J., Powers, B. Nasal hydropulsion: A novel tumor biopsy technique. JAAHA. 47 (5), 312-316 (2011).
- Wheat, W., et al. Local immune and microbiological responses to mucosal administration of a liposome-tlr agonist immunotherapeutic in dogs. BMC Vet Res. 15 (1), 330 (2019).
- Darragh, L. B., et al. Elective nodal irradiation mitigates local and systemic immunity generated by combination radiation and immunotherapy in head and neck tumors. Nat Commun. 13 (1), 7015 (2022).
- Pinard, C. J., et al. Evaluation of lymphocyte-specific programmed cell death protein 1 receptor expression and cytokines in blood and urine in canine urothelial carcinoma patients. Vet Comp Oncol. 20 (2), 427-436 (2022).
- Choi, J. W., et al. Development of canine pd-1/pd-l1 specific monoclonal antibodies and amplification of canine t cell function. PLoS One. 15 (7), e0235518 (2020).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유