Method Article
Çoğullanmış Zebra Balığı Görüntüleme için Düşük Maliyetli Polietilen Tereftalat Laminasyon Mikroakışkan Tasarımları
Bu Makalede
Özet
Polietilen tereftalat (PET) laminasyonu kullanarak mikroakışkan cihazlar üretmek için yenilikçi bir yöntem, birden fazla canlı zebra balığı embriyosunu yakalamanın ve görüntülemenin maliyetini ve karmaşıklığını önemli ölçüde azaltır.
Özet
Zebra balığı embriyoları şeffaftır ve bu nedenle yara iyileşmesi ve bağışıklık hücresi göçü gibi temel süreçlerin noninvaziv intravital görüntülemesi için benzersiz bir şekilde uygundur. Mikroakışkan cihazlar, zebra balığı da dahil olmak üzere çok hücreli organizmaların uzun süreli görüntülenmesini desteklemek için tuzak için kullanılır. Bununla birlikte, bu cihazların yumuşak litografi kullanılarak üretilmesi, her laboratuvar tarafından erişilemeyebilecek 3D baskıda özel tesisler ve yetkinlik gerektirir. Mikroakışkan cihazlar oluşturmak için daha önce geliştirilmiş düşük maliyetli bir polietilen tereftalat laminasyon yöntemini uyarlamamız, geleneksel tekniklerin teknik yatırımının bir kısmı için tasarım üretimi ve yinelemesini mümkün kılarak erişilebilirliği artırır. Bu yöntemle yapılmış bir cihaz olan Danio Görüntüleme için Rotasyonel Asistan (RADISH), ilaç tedavisini, elle yaralamayı ve aynı görüş alanında dört embriyoya kadar uzun süreli görüntülemeyi sağlamak için kullanıyoruz. Bu yeni tasarımla, yaralanmadan hemen sonraki 2 saat içinde birden fazla embriyo için lazer ablasyon ve manuel transeksiyon yaraları etrafındaki kalsiyum sinyalinin brüt morfolojik özelliklerini ve 24 saat boyunca yara kenarına nötrofil alımını başarıyla yakalıyoruz.
Giriş
Yaralanmaya yeterince yanıt verme yeteneği, tek bir hücreden birden fazla dokuya kadar her ölçekte her organizmanın hayatta kalması için kritik öneme sahiptir. Bu nedenle, yaralama ve hasarlı bölgelere fagosit alımıgibi ilişkili tepkiler 1, hücre ve doku biyolojisinde önemli konulardır. Yaralar, doku bariyeri ihlal edildikten hemen sonra algılanır ve yara iyileşmesini ve ardından yeniden büyümeyikoordine eden yara kasılmasını2,3 içeren bir doku gradyan tepkisine neden olur 4. Bu kasılmanın mekanik doğası nedeniyle, deney sırasında kullanılan aletler, yaralanma bölgesinin yakınındaki hücrelerin hareketini fiziksel olarak engellememelidir.
Zebra balığı embriyoları, bakım kolaylığı, genetik izlenebilirliği ve optik şeffaflığı nedeniyle omurgalı yara tepkisi de dahil olmak üzere gelişim ve hastalıkları incelemek için mükemmel bir modeldir 5,6. Bununla birlikte, bir yaralanma bölgesinin yakınındaki hücrelerin uzun vadeli davranışlarını incelemek için tüm organizmayı uzun bir süre boyunca hareketsiz hale getirmek gerekir. Embriyoların düşük erime noktalı agaroza gömülmesi, yarasız dokunun kısa süreli görüntülenmesi için yeterlidir. Bununla birlikte, çevreleyen jel matrisi, yaraların kasılmasını ve gevşemesini kısıtlar ve zamanla gelişen embriyoların büyümesini engeller 7,8,9.
Mikroakışkan cihazlar, zebra balığı embriyolarını farklı gelişim aşamalarında hareketsiz hale getirebilir 10,11,12,13,14,15,16 ve zWEDGI 7 gibi bazıları manuel yaralamayı barındırır. Bununla birlikte, mevcut cihaz tasarımlarının birkaç dezavantajı vardır. Örneğin, doğrudan plastik üzerine basılan birçok cihaz, zayıf optik şeffaflık nedeniyle ters mikroskop sistemlerinde görüntüleme ile uyumlu değildir. Ayrıca, paralel kanallar çok pozisyonlu görüntülemeyeizin verir 10,11, ancak mikroskop aşamasının fiziksel hareketi görüntü elde etmede gecikmeye neden olur. Bu sorunları çözmek için tekrarlanan yineleme ve optimizasyon, özellikle polidimetilsiloksan (PDMS) yumuşak litografi kullanan mevcut altın standart cihaz üretim yöntemleri için, her yeni tasarım için gereken finansal ve teknik yatırım göz önüne alındığında zordur. İlk adım olan bir ana kalıbın oluşturulması, genellikle 3D modelleme yazılımı bilgisi, özel imalat ekipmanına erişim ve (kullanılan malzemeye bağlı olarak) kalıp kullanılmadan önce silanizasyon gibi ek bir yapışma önleyici işlem gerektirir. PDMS'nin döküldükten sonra kürlenmesi, yüksek sıcaklıklarda en az bir saat sürer ve genellikle en iyi sonucu almak için bir vakum altında veya bir kelepçe ile, genellikle temiz bir odada 7,17,18 yapılmalıdır. Gelişimsel biyolojide olduğu gibi, bu maliyetler, birden fazla modelde birçok benzersiz mikroakışkan ortam gerektiren deneyler için hızla engelleyici olabilir.
Mevcut alternatif inşaat malzemelerinden polietilen tereftalat (PET) dayanıklıdır, toksik değildir ve manipüle edilmesi kolaydır. PET levhalar, çoğu ofis malzemeleri mağazasında taşınan, önceden uygulanmış termal olarak etkinleştirilmiş yapıştırıcı (genellikle etilen vinil asetat) ile yaygın olarak bulunan plastik laminasyon torbalarıdır. Bu PET levhaları, piyasada bulunan zanaat kesiciler (yani, ev zanaatkarları için tasarlanmış bilgisayar kontrollü kesme çizicileri) kullanarak şekillendirerek ve standart termal laminasyon ekipmanı kullanarak katmanları birbirine yapıştırarak, çok çeşitli potansiyel tasarımlar hızlı bir şekilde oluşturulabilir ve yinelenebilir. Bu nedenle, Subsequent Healing'in (RADISH) Danio Imagingi için Rotational Assistant'ı oluşturmak için istiflenmiş PET18'i içeren daha önce tanımlanmış bir tasarım ve yapım yöntemini uyarladık (Şekil 1A,B). Yaklaşık olarak kama şeklindeki birkaç sınırlama kanalının rotasyonel düzenlemesi, manuel kuyruk yüzgeci transeksiyonu için yer sağlarken yakınlığı optimize eder, yaralamadan hemen sonra görüntülemeyi ve aynı görüş alanı içinde birden fazla yaralı zebra balığı embriyosunun eşzamanlı uzun süreli görüntülemesini barındırır. Ek olarak, bu inşaat yöntemi, yeniden kullanılabilirliği korurken, ön sermaye maliyetlerini ve cihaz yapımı için gereken süreyi büyük ölçüde azaltır.
Protokol
Bu çalışmada döllenmeden 3 gün sonra (dpf) embriyolar kullanılmıştır, ancak 2-14 dpf embriyo kullanmak üzere tasarlanabilir. Zebra balığı deneyi, uluslararası kabul görmüş standartlara göre gerçekleştirilmiştir. Hayvan Bakımı ve Kullanımı Protokolü, NIH İntramural Araştırma Programında Zebra Balığı kullanımına ilişkin Yönergelere (protokol numarası: 1401001018) bağlı kalarak Purdue Hayvan Bakım ve Kullanım Komitesi (PACUC) tarafından onaylanmıştır.
1. PET mikroakışkan cihazının montajı
NOT: Bu protokolün herhangi bir parçası, siyanoakrilatın kuruma süresine duyarlı olan 1.8 ve 1.9 adımları dışında herhangi bir zamanda duraklatılabilir.
- Tercih ettiğiniz yazılımda cihaz için deseni tasarlayın (örneğin, Adobe Illustrator, Şekil 1A). Embriyonun yaşına ve boyutuna bağlı olarak, kanalın genişliğini ve merkezi görüntüleme odasının boyutunu en iyi uyum için ayarlayın.
- Her katmanı aynı boyutlara sahip ayrı bir görüntü dosyası olarak kaydedin. Her dosyayı, kullanılacak tabakanın kalınlığı ve montaj sırası belirgin olacak şekilde adlandırın.
- Kesme makinesini üreticinin talimatlarına göre başlatın.
- Tasarlanan her deseni kesmek için tasarım yazılımına yükleyin.
- Tasarım çalışma alanında, yeni yüklenen tasarımları seçin. Aynı kalınlıktaki PET levha için amaçlanan desenleri aynı kesimde gruplandırın (Şekil 2A). Gerekirse, tasarım yazılımındaki desenlerin boyutunu doğru boyutlara yeniden ayarlayın.
- Kesimdeki desenlerin sayısını ve türünü onaylayın, ardından kesilen malzemeyi seçin.
NOT: PET levhalar, "plastik laminasyon poşeti" gibi adlar da dahil olmak üzere tasarım yazılımında bir malzeme seçimi olmayabilir. Bunun yerine benzer kalınlık ve dokuya sahip herhangi bir malzeme (örneğin, şeffaf levhalar veya yapışkan olmayan vinil) seçilebilir. - PET levhaları kesme matına takın, hava kabarcıklarını çıkarmak için sıkıca bastırın ve matı kesme makinesine yükleyin. Kesme makinesinden kesime başlamasını istemek için ekrandaki talimatları izleyin.
- Bitmiş kesimleri kesme matından çıkarın. Gerekirse, bir maket bıçağı veya neşter bıçağı kullanarak kesim desenlerini ayarlayın.
NOT: RADISH tasarımını oluşturmak için kullanılan görüntü dosyaları (Şekil 1A) vektör ve PNG dosya formatları (Ek Dosya 1) olarak indirilebilir. Kesme makinesi PET levhayı kaldırıyorsa, yırtılıyorsa veya temiz bir şekilde kesemiyorsa, kesme matını değiştirmeyi düşünün.
- Katmanları lamel camı üzerinde, yardımsız veya önceden kesilmiş kayıt işaretleriyle hizalayın. Laminasyondan önce birden fazla katman birbirine sabitlenebiliyorsa, bunları aynı anda hizalayın.
- Laminasyon sırasında kaymayı önlemek için katmanları ofis bandı ile sabitleyin (Şekil 2B). Cihaz boyutuna ve laminasyon kapasitesine bağlı olarak, laminatör beslemesinin sıkışmasını veya tıkanmasını önlemek için küçük tasarımları daha fazla bantla daha büyük bir desteğe monte edin (Şekil 2C).
NOT: Laminasyonda kullanılan destek, kesme matı ile aynı DEĞİLDİR ve esas olarak laminatör için çekiş sağlamaya hizmet eder. İhmal edilebilir kalınlıktaki herhangi bir ısıya dayanıklı malzeme bir destek olarak çalışacaktır (kart stoğu, katlanmış ofis kağıdı veya daha büyük bir PET levha dahil ancak bunlarla sınırlı olmamak üzere). - Laminatörü ve laminatı üreticinin talimatlarına göre açın. Bir sonraki katmanı hizalamadan önce ofis bandını çıkarın (Şekil 2D).
- Tüm katmanlara uyulana kadar 1.4 ile 1.6 arasındaki adımları tekrarlayın.
- Cihazı, siyanoakrilat yapıştırıcı kullanılarak 3/4" delikle delinmiş 35 mm'lik bir tabağa sabitleyin (Şekil 2E,F). Yemeğin şeklini ve türünü deneysel ihtiyaçlara göre ayarlayın (örneğin, 24 oyuklu bir plakada veya daha büyük bir Petri kabında cihaz bir kuyuyu barındıracak kadar büyük herhangi bir kap). Cihazı su bastırmadan tabağa tam olarak yapıştırmak için yeterli yapıştırıcı kullanın.
NOT: Cihazın çalışması için cihazı bir tutma kabına sabitlemek gerekli değildir. DİKKAT: Siyanoakrilat cildi ve gözleri saniyeler içinde bağlar ve solunum sistemini, gözleri ve cildi tahriş eder. El ve göz koruması kullanın ve iyi havalandırılan bir alanda çalışın. - Dış cihaz kenarlarını siyanoakrilat yapıştırıcı ile iyice kaplayarak PET laminatı su geçirmez hale getirin (Şekil 2F). Dış kenarları tamamen kaplayacak kadar yapıştırıcı kullanın. Kullanmadan önce yapıştırıcının en az 2 saat kürlenmesine izin verin.
NOT: Siyanoakrilat dumanlarının dışarı çıkması için yeterli alan olduğundan emin olun. Duman birikmesi, siyanoakrilatın cihaz üzerinde birikmesine ve optik olarak şeffaf malzemeyi gizlemesine neden olabilir.
2. Embriyoların RAP içine yerleştirilmesi ve görüntüleme için hazırlanması
- Zebra balığı embriyolarını standart embriyo yetiştirme ortamı E319'da büyütün. Gerekirse, düzleşmelerine izin vermek için görüntülemeden en az 1 saat önce embriyoları dekoryonatın. Bu deneyde 3 dpf'de embriyolar kullanılmıştır, ancak embriyolar 14 dpf'ye kadar çıkabilir (Şekil 1E).
- Embriyoları deneysel ihtiyaçlara göre boyayın veya tedavi edin.
NOT: Bu deneylerde, dış epitel tabakasının hücre zarları, 100 nM MemGlow 560 ile inkübe edilerek uygun yerlerde boyandı. - 164 mg / L MS-22220 kullanarak embriyoları uyuşturun.
NOT: Kullanılan tam konsantrasyon ve anestezik, deneycinin tercihine göre ayarlanabilir. Anestezik konsantrasyon, uzun süreli görüntüler sırasında başarılı bir gelişim sağlamak için azaltılabilir (bkz. adım 4.1). - Monte edilmiş cihazı içeren tutma kabını 164 mg/L MS-222 içeren 5 mL E3 ile doldurun.
- Bir transfer pipeti kullanarak, cihazın her bir tutma odasına anestezi uygulanmış bir embriyo yerleştirin. Görüntüleme süresi boyunca embriyoların sıvıya batırılmış halde kaldığından emin olun.
NOT: RAP tasarımı 1-4 embriyoyu hareketsiz hale getirebilir. - Bir saç halkası kullanarak, embriyoları, embriyonun kuyruğu merkezi görüntüleme odasına çıkacak ve yumurta sarısı kama şeklindeki kanalda güvenli bir şekilde hareketsiz hale getirilecek şekilde yönlendirin (Şekil 1C).
NOT: Yönlendirme embriyoları, manipülasyon kolaylığı için stereomikroskop altında gerçekleştirilebilir. - İstenirse, bir mikropipet kullanarak tutma haznesine %1.5 düşük erimiş agaroz ekleyerek embriyonun başını sabitleyin.
- Görüntülemeye başlamak için embriyoların bulunduğu cihazı tercih ettiğiniz görüntüleme sistemine taşıyın.
3. Yara sonrası kalsiyum geçişlerinin görüntülenmesi
NOT: Bu bölüm ve Bölüm 4 isteğe bağlıdır ve olası örnek deneyler olarak sağlanır.
- Görüntüleme için uygun sistemi ve hedefi seçin.
NOT: Burada, ters çevrilmiş bir lazer taramalı konfokal 20x objektif ile donatılmıştır. - Optimum sinyal-gürültü oranı ve çekim hızı için örnek odağını ve görüntüleme parametrelerini (örn. lazer gücü: 5, kazanç: 90, iğne deliği boyutu: 2 AU, pozlama süresi [tarama hızı: 1 kare/sn]) ayarlayın.
NOT: Yara oluşumu ile görüntü elde etme arasındaki gecikmeyi azaltmak için numunelerin önceden odaklanması ve tercih edilen görüntüleme sistemindeki her kanal için parametrelerin yaralamadan önce ayarlanması önerilir. - Bir Tg (krt4: Gal4, UAS: GCaMP6f) x (cdh1-dTomato) xt1821,22 embriyo yaraladı.
- Embriyoyu manuel transeksiyon ile sarmak için, stereomikroskop altında notokordun ucundaki kuyruk yüzgeci dokusuna neşter bıçağıyla baskı uygulayın (Video 1), ardından cihazı sahneye geri koyun.
DİKKAT: Neşter bıçağıyla aşırı basınç uygulamak alttaki camı çatlatabilir. Cam çatlarsa, cihazı atın ve Adım 1.2'den yeniden başlatın. - Embriyoyu lazer stimülasyonu ile sarmak için, kuyruk yüzgeci kıvrımının kenarına yakın bir ilgi alanı (ROI) tanımlayın ve mevcut lazer gücüne göre uyarın.
NOT: Burada, 800 nm'de 30 saniye boyunca 2,4 W'lık bir lazer gücü, tam kalınlıkta bir yarayı indüklemek için yeterliydi.
- Embriyoyu manuel transeksiyon ile sarmak için, stereomikroskop altında notokordun ucundaki kuyruk yüzgeci dokusuna neşter bıçağıyla baskı uygulayın (Video 1), ardından cihazı sahneye geri koyun.
- GFP (uyarma 488 nm, emisyon 510 nm) ve RFP (uyarma 561 nm, emisyon 610 nm) kanalları kullanılarak 1 dakikalık kare aralığı kullanılarak toplam 1 saat boyunca oda sıcaklığında görüntü.
- (İsteğe bağlı): Gerekirse, bir transfer pipeti kullanarak veya tabağı döndürerek başın yakınında hafifçe emerek görüntülemeden sonra embriyoları almak için serbest bırakın.
4. Yaralama sonrası nötrofil alımının görüntülenmesi
- Görüntülemeden en az 1 saat önce, embriyoları standart anestezik konsantrasyonunun yarısı, bu durumda 82 mg / L MS-222 içeren E3'e aktarın.
- Görüntüleme için uygun hedefi seçin (burada, 10x objektif ile donatılmış ters çevrilmiş bir lazer tarama konfokal).
- Optimum sinyal-gürültü oranı ve çekim hızı için örnek odağını ve görüntüleme parametrelerini (örn. lazer gücü: 5, kazanç: 90, iğne deliği boyutu: 2 AU, pozlama süresi [tarama hızı: 0,5 kare/sn])) ayarlayın.
NOT: Yara oluşumu ile görüntü elde etme arasındaki gecikmeyi azaltmak için numunelerin önceden odaklanması ve tercih edilen görüntüleme sistemindeki her kanal için parametrelerin yaralamadan önce ayarlanması önerilir. - Dört Tol2(mpx:Dendra2)23 embriyoyu, stereomikroskop altında kuyruk yüzgeci dokusu boyunca bir neşter bıçağı ile basınç uygulayarak manuel transeksiyon yoluyla yaralayın, ardından cihazı sahneye geri koyun.
- Görüntüyü, 24 saat boyunca 5 dakikalık kare aralığı kullanarak oda sıcaklığında GFP (uyarma 488 nm, emisyon 510 nm) kanalında yakalayın.
- Gerekirse, bir transfer pipeti kullanarak veya tabağı döndürerek başın yanında hafifçe emerek görüntülemeden sonra embriyoları almak için serbest bırakın.
Sonuçlar
RADISH yardımı ile ve yardımı olmadan bir lazer tarama konfokali tarafından üretilen görüntü kalitesinin karşılaştırılması için, dış epitel tabakasında yoğun kalsiyum biyosensörü GCaMP6f22,24'ü eksprese eden embriyolar MemGlow 560 kullanılarak boyandı ve çerçeve başına 1 dakikalık bir zaman aralığında kuyruk yüzgeci kıvrımının tüm kalınlığını kaplayan ters lazer taramalı konfokal ile görüntülendi (Video 2). Cihaz olmadan (Şekil 3A), numuneler önemli ölçüde sürüklendi ve cihazla görüntülemeye kıyasla belirtilen zamansal çözünürlüğe sığması için Z yığınının 25 dilimle sınırlandırılmasından kaynaklanan bantlama artefaktları gösterdi (Şekil 3B). RAP ayrıca, Tg(krt4:Gal4, UAS:GCaMP6f) x (cdh1-dTomato)xt1821 eksprese eden embriyolarda yaralandıktan hemen sonra kalsiyum geçişlerini incelemek için kullanıldı ve kırmızıda endojen E-kaderin ve apikal epitelde yeşil renkte sitoplazmik kalsiyumun altını çizdi. Embriyolar, bir neşter bıçağı (Şekil 4A ve Video 3) veya bir IR lazer ile doğrudan lazer ablasyonu (Şekil 4B) kullanılarak merkezi odanın kenarlarına paralel olarak yaralandı, daha sonra kuyruk yüzgeci kıvrımının tam kalınlığı boyunca görüntülendi.
RADISH'in daha uzun süreli görüntüleme için etkinliğini göstermek için, yaralamadan sonra 24 saat boyunca yara kenarına bağışıklık hücresi alımını araştırdık. Nötrofilleri yeşil23 olarak etiketlemek için Tol2(mpx:Dendra2) eksprese eden 3 dpf'de dört zebra balığı embriyosu kuyruk transeksiyonu ile yaralandı ve art arda 24 saat boyunca görüntülendi (Şekil 5). Tipik olarak geç 3 dpf ila 4 dpf embriyoları ile ilişkili, eğilme ve yüzme, özellikle yoktu (Video 4) ve doku yeniden büyümesi deney için engellenmeden devam etti. Yara kenarına nötrofil alımı görüntü boyunca devam eder (Şekil 5B), göç eden hücrelerin çoğu yaralamadan 24 saat sonra ayrılır (Şekil 5C), beklenen inflamasyon çözünürlüğü25,26 ile tutarlı olarak.

Şekil 1: PET laminat mikroakışkan cihazının (RADISH) tasarımı ve kullanımı. (A) Tek tek PET katmanlarının düzenini ve kalınlığını, montajını ve cihaz montajını ve kullanımını gösteren şema. (B) 35 mm'lik bir tabakta 3/4" oyuğa monte edilmiş nihai ürün. (C) 3 dpf embriyosu, (D) 5 dpf embriyosu, (E) cihazın içine yerleştirilmiş 14 dpf embriyosu. Ölçek çubukları = 1.000 μm (C,D,E). Kısaltmalar: PET = polietilen tereftalat; RADISH = sonraki iyileşmenin Danio görüntülemesi için rotasyon asistanı; dpf = döllenmeden sonraki gün sayısı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: PET cihaz düzeneğinin adım adım fotoğrafik gösterimi. (A) Laminasyondan önce ayrı PET katmanları. (B) Ofis bandı kullanılarak 25 mm lamel ile sabitlenmiş PET katmanı. (C) Devam eden cihaz, laminasyon için plastik bir desteğe sabitlenmiştir. (D) Tamamlanmış PET laminat cihazı. (E) Cihaz montajından önce modifiye edilmiş 35 mm çanak. (F) Tamamlanmış cihaz. Kısaltma: PET = polietilen tereftalat. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 3: RADISH tasarımında 3 dpf embriyosunun lazer taramalı konfokal görüntülerinin kalitesi iyileştirildi. (A) RADISH kullanılmadan MemGlow 560 ile boyanmış 3 dpf Tg(krt4:Gal4, UAS:GCaMP6f) embriyonun temsili görüntüsü. (B) RADISH'e monte edilmiş MemGlow 560 ile boyanmış Tg(krt4:Gal4, UAS:GCaMP6f) embriyosunun temsili görüntüsü. Ölçek çubuğu = 100 μm. Kısaltmalar: RADISH = sonraki iyileşmenin Danio görüntülemesi için rotasyon asistanı; dpf = döllenmeden sonraki gün sayısı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
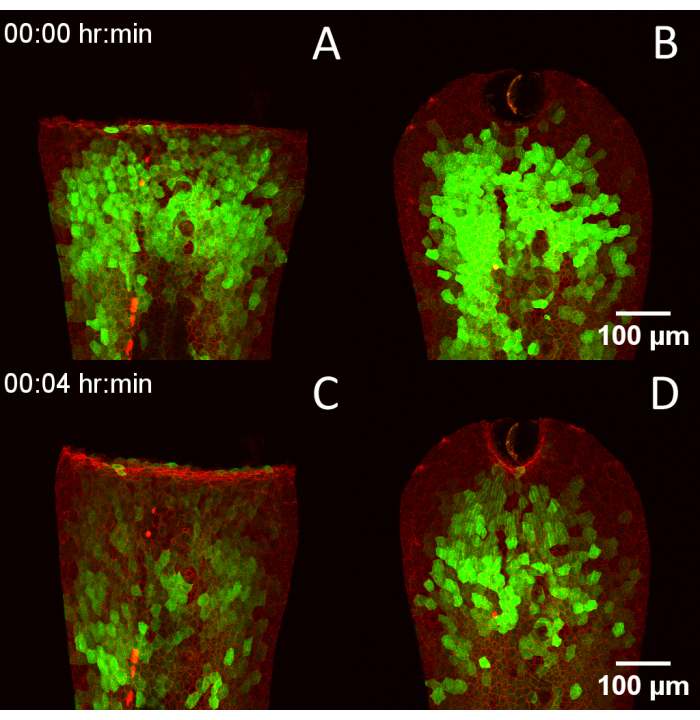
Şekil 4: RADISH tasarımının çoklu yaralama teknikleriyle uyumluluğu. (A) 3 dpf Tg(krt4:Gal4, UAS:GCaMP6f) x (cdh1-dTomato)xt18 embriyo manuel kuyruk yüzgeci transeksiyonu ile yaralandı. (B) Lazer ablasyonu ile yaralanan embriyo. (C,D) Aynı embriyolar 4 dakika sonra, yaralamadan sonra kalsiyum geçişlerinin ilerlemesini gösterir. Ölçek çubukları = 100 μm. Kısaltmalar: RADISH = sonraki iyileşmenin Danio görüntülemesi için rotasyon asistanı; dpf = döllenmeden sonraki gün sayısı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 5: Fagosit göçünün görüntülenmesi için embriyoların uzun süreli tuzaklanması. (A) Tol2 (mpx: Dendra2) embriyoları yaralamadan hemen sonra ve aynı embriyolar (B) 25 dakika, (C) 12 saat ve (D) 24 saat sonra. Ölçek çubukları = 100 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Ek Dosya 1: Şekil 1A'da gösterildiği gibi RADISH cihaz tasarımı için vektör ve PNG dosyaları. Bu dosyayı indirmek için lütfen buraya tıklayın.
Video 1: RADISH cihaz tasarımı kullanılarak manuel kuyruk yüzgeci transeksiyonunun parlak alan videosu. Kısaltma: RADISH = sonraki iyileşmenin Danio görüntülemesi için rotasyon asistanı. Bu videoyu indirmek için lütfen buraya tıklayın.
Video 2: Şekil 3'ten 1 kare/dk'da elde edilen, monte edilmemiş ve monte edilmiş 3 dpf Tg(krt4:Gal4, UAS:GCaMP6f) embriyolarının karşılaştırılması. Bu videoyu indirmek için lütfen buraya tıklayın.
Video 3: Şekil 4'ten neşter transeksiyonu veya lazer ablasyonu ile yaralanan Tg(krt4:Gal4, UAS:GCaMP6f) x (cdh1-dTomato)xt18 embriyolarındaki kalsiyum geçişleri, 1 kare/dk'da elde edildi. Bu videoyu indirmek için lütfen buraya tıklayın.
Video 4: Tol2(mpx:Dendra2) embriyolarında lökosit alımı ve kuyruk yüzgeci rejenerasyonunun uzun süreli görüntülenmesi. Kısaltmalar: RADISH = sonraki iyileşmenin Danio görüntülemesi için rotasyon asistanı; hpw = yaralanmadan sonraki saat. Bu videoyu indirmek için lütfen buraya tıklayın.
Tartışmalar
PET laminasyon yönteminin temel dayanağı, yumuşak litografi veya PDMS kalıplama gibi mikroakışkan cihazlar oluşturmanın geleneksel yollarına kıyasla maliyetin düşürülmesini ve girişin önündeki teknik engellerin en aza indirilmesini içerir. Bu nedenle, bu protokoldeki tek kritik adım, laminasyon sırasında PET katmanlarının doğru bir şekilde hizalanması ve inşaattan sonra cihaz kenarlarının su geçirmez hale getirilmesidir. Yöntemin diğer tüm kısımları deneysel ihtiyaçlara göre değiştirilebilir (örneğin, genç veya daha yaşlı embriyoların immobilizasyonu gerekiyorsa, PET tabakalarının kalınlığı kanalı buna göre daraltmak veya genişletmek için ayarlanabilir). Tasarımlar herhangi bir şekilde oluşturulabilir ve malzeme ısıya dayanıklı ve laminatörden18,27 gönderilebilecek kadar ince olduğu sürece herhangi bir temel malzeme üzerine lamine edilebilir. PET levhalar, üç boyutlu görüntü dosyaları yerine iki boyutlu olarak okunan, piyasada bulunan zanaat kesiciler kullanılarak kesildiğinden, herhangi bir cihazın tasarımı ve yinelemesi, yalnızca bir görüntü düzenleme programında siyah beyaz şekilleri manipüle etme yeteneği gerektirir ve bu da zorluğu önemli ölçüde azaltır. Yazılım seçimindeki bu esneklik ve kullanılan malzemelerin ticari kullanılabilirliği, genel olarak mikroakışkan cihazların erişilebilirliğinde çarpıcı bir artışı temsil eder ve bu makalenin yazıldığı sırada herhangi bir laboratuvarda veya sınıfta 500 ABD Dolarından daha düşük bir ön maliyetle kullanılmalarını sağlar, PDMS kalıpimalatı için başlangıç ekipmanı maliyetlerinde 2000 ABD Dolarının üzerindedir.
Ayrıca, bu yöntemi kullanarak tek bir kullanılabilir cihaz oluşturmak için gereken süre, tipik yumuşak litografiye kıyasla önemli ölçüde azaltılmıştır. Gerekli yazılıma aşinalık olduğunu varsayarsak, benzersiz bir PET laminat mikroakışkan cihaz, siyanoakrilatın kürlenme süresi de dahil olmak üzere ~ 3 saat içinde kavramsallaştırılabilir, üretilebilir ve hemen kullanılabilir. Orijinal tasarım dosyalarında gereken düzenlemelerin ölçeğine bağlı olarak yineleme daha da az sürer ve birden fazla varyant cihaz, minimum ek zaman harcanarak ve ekstra ekipman olmadan paralel olarak yapılabilir. Bu yöntem kullanılarak oluşturulan cihazlar, çeşitli nedenlerle (çok katmanlı ve uzun en-boy oranlarına sahip şekiller için yapıştırıcı arızası ve iç gerilmeler dahil) PDMS ile yapılanlardan daha az dayanıklı olsa da, ucuz yapıları ve ölçeklenebilir üretimleri, çok daha kolay değiştirilebilecekleri anlamına gelir. Ticari zanaat kesiciler, aynı hassas kesimi defalarca tekrarlama kabiliyeti ile pazarlandığından ve PET'in son kullanma tarihi olmadığından, tamamlanmış bir tasarımın tek tek katmanları, gelecekte herhangi bir noktada montaj ve kullanım için toplu olarak önceden hazırlanabilir ve bu da gereken toplam zaman yatırımını daha da azaltır.
Bununla birlikte, hız ve değişkenlik hassasiyet pahasına gelir. Geleneksel PDMS kalıplama ile karşılaştırıldığında PET laminasyonunun ana sınırlaması uzamsal çözünürlüktür. Ticari zanaat kesiciler genellikle yaklaşık 500 μm'den daha küçük şekiller üzerinde keskin açılarla mücadele eder ve PET laminasyon levhaları 33 μm'nin altındaki kalınlıklarda mevcut değildir (paket üzerindeki ölçüme dahil olmayan yapıştırıcının kendisinin kalınlığı dahil değildir), bu tekniğin uygulanabileceği ölçeği önemli ölçüde sınırlar. Maksimum katman sayısı, üreticiden üreticiye değişebilen laminatörün boyutuyla da sınırlıdır.
Kayıt ve hizalama tekniği, malzeme tedarikçileri ve yazılımdaki farklılıklar dahil olmak üzere protokolün son sürümü, büyük ölçüde kullanıcı tercihine bağlı olacaktır. Bununla birlikte, yöntemin erişilebilirliği ve genel esnekliği, adaptasyon maliyetini azaltır. Bireysel kullanıcılar, yaklaşımı kendi benzersiz ihtiyaçlarına göre uyarlamak için gerektiği kadar yinelemeye teşvik edilir.
Açıklamalar
Yazarların açıklanacak herhangi bir çıkar çatışması yoktur.
Teşekkürler
Çalışma, Ulusal Sağlık Enstitüleri'nden (R35GM119787 QD'ye) araştırma fonu ile desteklenmiştir. Bu çalışma, bir Ulusal Bilim Vakfı (NSF) Biyoloji Entegrasyon Enstitüsü olan EMBRIO Enstitüsü, NSF sözleşmesi #2120200 tarafından desteklenen çabalara dayanmaktadır. Konfokal görüntüleme Purdue Görüntüleme Tesisi'nde yapıldı. Dr. Guangjun Zhang'a (Purdue Üniversitesi) Tg (UAS: GCaMP6f) hattını sağladığı için teşekkür ederiz. Dr. David Tobin'e (Duke Üniversitesi) (cdh1-tdtomato) xt18 hattını sağladığı için teşekkür ederiz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 25 mm diameter round coverglass #1 thickness | Chemglass Life Sciences | CLS-1760-025 | Base mounting material. Thickness was chosen based on the specifications of the microscope lens. |
| Adobe Illustrator v28.5 | Adobe | N/A | Vector editor for designing the device pattern. |
| Calcium Chloride Dihydrate | Fisher | C79 | For making E3 medium. |
| Design PNG Files (Online Mirror) | N/A | N/A | https://i.ibb.co/QPYj7BL/multipositionalv7-1.png https://i.ibb.co/FDpQYXc/multipositionalv7-2.png https://i.ibb.co/5TG4SB6/multipositionalv7-3.png |
| Design Space for Desktop v8.39 | Cricut | N/A | Proprietary software to drive the craft cutter. |
| Fusion Plus 7000L | GBC | 1703098 | Thermal laminator. This specific model was selected for quality of life features, such as maximum sheet stack size. |
| German Carbide Premium Blade | Cricut | 10396595 | Replacement blade for craft cutter. |
| Gray Basic Tool Set | Cricut | 10307854 | Tool set for weeding cuts, cleaning mats, and mounting PET sheets. Optional. |
| Magnesium Chloride Hexahydrate | Acros Organic | 223211000 | For making E3 medium. |
| Maker 3 | Cricut | 10669040 | Craft cutter. The Cricut Maker 3 was selected over the Silhouette Cameo 4 for software user friendliness, but any craft cutter capable of reading black and white images will work. |
| MemGlow 560 | Cytoskeleton | MG02-10 | Red live cell dye for cell membranes. No washing needed. Used in Figure 3. |
| No. 22 Carbon Scalpel Blade | Surgical Design | 22-079-697 | Scalpel blade for manual cut adjustments. Any similar craft knife (e.g., X-acto #2 knife) will also work. |
| Potassium Chloride | Fisher | BP366 | For making E3 medium. |
| Sodium Chloride | Fisher | BP358 | For making E3 medium. |
| StandardGrip Adhesive Cutting Mat | Cricut | 10138842 | Mounting mat for craft cutter. The LightGrip cutting mat will also work, but avoid the StrongGrip and FabricGrip cutting mats as the strength of the adhesive may warp the final cut during weeding and removal. Adhesive on mats will eventually wear out with continued use; replace mats as needed. |
| Stationery Tape 12 mm | Deli | 30014 | Office tape. Deli brand was chosen via testing for ease of removal after lamination. |
| Super glue, liquid | Loctite | 1364076 | Cyanoacrylate glue. Glue used must be liquid. Gel formulations will not sufficiently seal or waterproof device edges. |
| PET Thermal Laminating Pouches, 3 mil | Scotch | TP3854 | PET sheets with thermal adhesive. Sheets arrive as sandwiched pairs and should be separated before use. Cut with adhesive side facing down. |
| PET Thermal Laminating Pouches, 5 mil | Scotch | TP5854 | PET sheets with thermal adhesive. Sheets arrive as sandwiched pairs and should be separated before use. Cut with adhesive side facing down. |
| Tricaine (MS-222) | Syndel | IC10310680 | Fish anaesthetic. |
Referanslar
- De Oliveira, S., Rosowski, E. E., Huttenlocher, A. Neutrophil migration in infection and wound repair: going forward in reverse. Nat Rev Immunol. 16 (6), 378-391 (2016).
- Xu, S., Hsiao, T. I., Chisholm, A. D. The wounded worm. Worm. 1 (2), 134-138 (2012).
- Belacortu, Y., Paricio, N. Drosophila as a model of wound healing and tissue regeneration in vertebrates. Dev Dyn. 240 (11), 2379-2404 (2011).
- Yoo, S. K., Freisinger, C. M., LeBert, D. C., Huttenlocher, A. Early redox, Src family kinase, and calcium signaling integrate wound responses and tissue regeneration in zebrafish. J Cell Biol. 199 (2), 225-234 (2012).
- Kawakami, A., Fukazawa, T., Takeda, H. Early fin primordia of zebrafish larvae regenerate by a similar growth control mechanism with adult regeneration. Dev Dyn. 231 (4), 693-699 (2004).
- Gault, W. J., Enyedi, B., Niethammer, P. Osmotic surveillance mediates rapid wound closure through nucleotide release. J Cell Biol. 207 (6), 767-782 (2014).
- Huemer, K., et al. zWEDGI: Wounding and entrapment device for imaging live zebrafish larvae. Zebrafish. 14 (1), 42-50 (2017).
- Kaufmann, A., Mickoleit, M., Weber, M., Huisken, J. Multilayer mounting enables long-term imaging of zebrafish development in a light sheet microscope. Development. 139 (17), 3242-3247 (2012).
- Hirsinger, E., Steventon, B. A versatile mounting method for long term imaging of zebrafish development. J Vis Exp. (119), e55210 (2017).
- Wielhouwer, E. M., et al. Zebrafish embryo development in a microfluidic flow-through system. Lab Chip. 11 (10), 1815-1824 (2011).
- Khalili, A., Rezai, P. Microfluidic devices for embryonic and larval zebrafish studies. Brief Funct Genomics. 18 (6), 419-432 (2019).
- Choudhury, D., et al. Fish and Chips: a microfluidic perfusion platform for monitoring zebrafish development. Lab Chip. 12 (5), 892-900 (2012).
- Zhang, G., et al. An integrated microfluidic system for zebrafish larva organs injection. , 8563-8566 (2017).
- Erickstad, M., Hale, L. A., Chalasani, S. H., Groisman, A. A microfluidic system for studying the behavior of zebrafish larvae under acute hypoxia. Lab Chip. 15 (3), 857-866 (2015).
- Mani, K., Hsieh, Y. C., Panigrahi, B., Chen, C. Y. A noninvasive light driven technique integrated microfluidics for zebrafish larvae transportation. Biomicrofluidics. 12 (2), 021101 (2018).
- Lee, Y., Seo, H. W., Lee, K. J., Jang, J. W., Kim, S. A microfluidic system for stable and continuous EEG monitoring from multiple larval zebrafish. Sensors (Basel). 20 (20), 5903 (2020).
- Sonnen, K. F., Merten, C. A. Microfluidics as an emerging precision tool in developmental biology. Dev Cell. 48 (3), 293-311 (2019).
- Levis, M., et al. Microfluidics on the fly: Inexpensive rapid fabrication of thermally laminated microfluidic devices for live imaging and multimodal perturbations of multicellular systems. Biomicrofluidics. 13 (2), 024111 (2019).
- . E3 medium (for zebrafish embryos). Cold Spring Harbor Protocols. 2011 (10), (2011).
- Matthews, M., Varga, Z. M. Anesthesia and euthanasia in zebrafish. ILAR J. 53 (2), 192-204 (2012).
- Cronan, M. R., Tobin, D. M. Endogenous tagging at the cdh1 locus for live visualization of E-cadherin dynamics. Zebrafish. 16 (3), 324 (2019).
- Thiele, T. R., Donovan, J. C., Baier, H. Descending control of swim posture by a midbrain nucleus in zebrafish. Neuron. 83 (3), 679-691 (2014).
- Yoo, S. K., Huttenlocher, A. Spatiotemporal photolabeling of neutrophil trafficking during inflammation in live zebrafish. J Leukoc Biol. 89 (5), 661-667 (2011).
- Chen, T. W., et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499 (7458), 295-300 (2013).
- Li, L., Yan, B., Shi, Y. -. Q., Zhang, W. -. Q., Wen, Z. -. L. Live imaging reveals differing roles of macrophages and neutrophils during zebrafish tail fin regeneration. J Biol Chem. 287 (30), 25353-25360 (2012).
- Mathias, J. R., et al. Resolution of inflammation by retrograde chemotaxis of neutrophils in transgenic zebrafish. J Leukoc Biol. 80, 1281-1288 (2006).
- Levis, M., Ontiveros, F., Juan, J., Kavanagh, A., Zartman, J. J. Rapid fabrication of custom microfluidic devices for research and educational applications. J Vis Exp. 2019, (2019).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır