Method Article
Conceptions microfluidiques de laminage de polyéthylène téréphtalate à faible coût pour l’imagerie multiplexée du poisson-zèbre
Dans cet article
Résumé
Une méthode innovante de fabrication de dispositifs microfluidiques à l’aide de la stratification en polyéthylène téréphtalate (PET) réduit considérablement le coût et la complexité du piégeage et de l’imagerie de plusieurs embryons de poisson-zèbre vivants.
Résumé
Les embryons de poisson-zèbre sont transparents et conviennent donc particulièrement à l’imagerie intravitale non invasive de processus fondamentaux, tels que la cicatrisation des plaies et la migration des cellules immunitaires. Les dispositifs microfluidiques sont utilisés pour le piégeage afin de soutenir l’imagerie à long terme d’organismes multicellulaires, y compris le poisson zèbre. Cependant, la fabrication de ces dispositifs à l’aide de la lithographie douce nécessite des installations spécialisées et des compétences en impression 3D, qui peuvent ne pas être accessibles à tous les laboratoires. Notre adaptation d’une méthode de stratification du polyéthylène téréphtalate à faible coût précédemment développée pour la construction de dispositifs microfluidiques augmente l’accessibilité en permettant la conception, la fabrication et l’itération pour une fraction de l’investissement technique des techniques conventionnelles. Nous utilisons un appareil fabriqué avec cette méthode, l’assistant rotatif pour l’imagerie Danio de la cicatrisation ultérieure (RADISH), pour permettre le traitement médicamenteux, les blessures manuelles et l’imagerie à long terme d’un maximum de quatre embryons dans le même champ de vision. Grâce à cette nouvelle conception, nous réussissons à capturer les caractéristiques morphologiques grossières du signal calcique autour de l’ablation laser et des plaies de transsection manuelle pour plusieurs embryons dans les 2 heures suivant immédiatement la blessure, ainsi que le recrutement des neutrophiles sur le bord de la plaie pendant 24 h.
Introduction
La capacité de réagir adéquatement aux dommages est essentielle à la survie de chaque organisme à toutes les échelles, d’une seule cellule à plusieurs tissus. La blessure et ses réponses associées, telles que le recrutement de phagocytes dans les zones endommagées1, sont donc des sujets importants en biologie cellulaire et tissulaire. Les plaies sont détectées immédiatement après la rupture de la barrière tissulaire, provoquant une réponse de gradient tissulaire impliquant une contraction de la plaie 2,3 qui coordonne la cicatrisation de la plaie et la repousse ultérieure4. En raison de la nature mécanique de cette contraction, les outils utilisés lors de l’expérimentation ne doivent pas entraver physiquement le mouvement des cellules à proximité du site de la lésion.
Les embryons de poisson-zèbre sont un excellent modèle pour étudier le développement et les maladies, y compris la réponse des blessures des vertébrés, en raison de leur facilité d’entretien, de leur traçabilité génétique et de leur transparence optique 5,6. Cependant, l’immobilisation de l’ensemble de l’organisme pendant une période prolongée est nécessaire pour étudier le comportement à long terme des cellules proches d’un site de lésion. L’intégration d’embryons dans de l’agarose à bas point de fusion est suffisante pour l’imagerie à court terme des tissus non blessés. Cependant, la matrice de gel environnante limite la contraction et le relâchement des plaies et entrave la croissance des embryons en développement au fil du temps 7,8,9.
Les dispositifs microfluidiques peuvent immobiliser les embryons de poisson-zèbre à différents stades de développement 10,11,12,13,14,15,16, et certains, comme le zWEDGI 7, permettent des blessures manuelles. Cependant, il existe plusieurs inconvénients aux conceptions d’appareils disponibles. Par exemple, de nombreux appareils imprimés directement sur du plastique sont incompatibles avec l’imagerie sur des systèmes de microscope inversé en raison de leur faible transparence optique. De plus, les canaux parallèles permettent une imagerie multipositionnelle10,11, mais le mouvement physique de la platine du microscope introduit un décalage dans l’acquisition de l’image. Il est difficile d’itérer et d’optimiser à plusieurs reprises pour résoudre ces problèmes si l’on considère l’investissement financier et technique requis pour chaque nouvelle conception, en particulier pour les méthodes actuelles de fabrication de dispositifs utilisant la lithographie douce au polydiméthylsiloxane (PDMS). La toute première étape, la création d’un moule maître, nécessite souvent la connaissance d’un logiciel de modélisation 3D, l’accès à des équipements de fabrication spécialisés et (selon le matériau utilisé) un traitement anti-adhérence supplémentaire tel que la silanisation avant même que le moule ne soit utilisé. Le durcissement du PDMS une fois coulé prend au moins une heure à haute température, et généralement, doit être effectué sous vide ou avec une pince pour de meilleurs résultats, souvent dans une salle blanche 7,17,18. Comme en biologie du développement, ces coûts peuvent rapidement s’avérer prohibitifs pour des expériences nécessitant de nombreux environnements microfluidiques uniques sur plusieurs modèles.
Parmi les matériaux de construction alternatifs disponibles, le polyéthylène téréphtalate (PET) est durable, non toxique et facile à manipuler. Les feuilles de PET sont des pochettes de laminage en plastique largement disponibles dans la plupart des magasins de fournitures de bureau, avec un adhésif activé thermiquement pré-appliqué (généralement de l’éthylène-acétate de vinyle). En façonnant ces feuilles de PET à l’aide de découpeuses artisanales disponibles dans le commerce (c’est-à-dire des traceurs de découpe contrôlés par ordinateur conçus pour les bricoleurs amateurs) et en collant les couches les unes aux autres à l’aide d’un équipement de laminage thermique standard, un large éventail de conceptions potentielles peut être rapidement généré et itéré. Nous avons donc adapté une méthode de conception et de construction précédemment décrite impliquant du PET18 empilé pour créer le Rotational Assistant pour la Danio Imaging of Subsequent Hailing (RADISH) (Figure 1A,B). Une disposition rotative de plusieurs canaux de retenue en forme de coin optimise la proximité tout en laissant de la place pour la transsection manuelle de la nageoire caudale, permettant l’imagerie immédiatement après la blessure et l’imagerie simultanée à long terme de plusieurs embryons de poisson-zèbre blessés dans le même champ de vision. De plus, cette méthode de construction réduit considérablement les coûts d’investissement initiaux et le temps nécessaire à la construction du dispositif tout en maintenant la réutilisabilité.
Protocole
Cette étude a utilisé des embryons 3 jours après la fécondation (dpf), mais peut être conçue pour utiliser de 2 à 14 embryons dpf. L’expérience du poisson-zèbre a été menée selon les normes internationalement acceptées. Le protocole de soin et d’utilisation des animaux a été approuvé par le Purdue Animal Care and Use Committee (PACUC), conformément aux lignes directrices pour l’utilisation du poisson-zèbre dans le programme de recherche intra-muros des NIH (numéro de protocole : 1401001018).
1. Assemblage du dispositif microfluidique PET
REMARQUE : Toute partie de ce protocole peut être interrompue à tout moment, à l’exception des étapes 1.8 et 1.9, qui sont sensibles au temps de séchage du cyanoacrylate.
- Concevez le motif de l’appareil dans le logiciel de votre choix (par exemple, Adobe Illustrator, Figure 1A). En fonction de l’âge et de la taille de l’embryon, ajustez la largeur du canal et la taille de la chambre d’imagerie centrale pour un meilleur ajustement.
- Enregistrez chaque calque sous la forme d’un fichier image individuel aux dimensions identiques. Nommez chaque fichier de manière à ce que l’épaisseur de la tôle à utiliser et l’ordre d’assemblage soient évidents.
- Initialisez la machine de découpe selon les instructions du fabricant.
- Téléchargez chaque motif conçu dans le logiciel de conception pour la découpe.
- Dans l’espace de travail de conception, sélectionnez les conceptions nouvellement téléchargées. Regroupez les motifs destinés à la même épaisseur de feuille de PET dans la même coupe (figure 2A). Si nécessaire, réajustez la taille des motifs dans le logiciel de conception aux dimensions correctes.
- Confirmez le nombre et le type de motifs dans la coupe, puis sélectionnez le matériau coupé.
REMARQUE : Les feuilles de PET peuvent ne pas être un choix de matériau dans le logiciel de conception, y compris sous des noms tels que « pochette de plastification en plastique ». Tout matériau d’épaisseur et de texture similaires (par exemple, des feuilles transparentes ou du vinyle non adhésif) peut être sélectionné à la place. - Fixez les feuilles de PET sur le tapis de découpe, en appuyant fermement pour éliminer les bulles d’air, et chargez le tapis dans la machine de découpe. Suivez les instructions à l’écran pour demander à la machine de découpe de commencer la coupe.
- Retirez les coupes finies du tapis de découpe. Si nécessaire, ajustez les motifs de coupe à l’aide d’un couteau artisanal ou d’une lame de scalpel.
REMARQUE : Les fichiers image utilisés pour créer la conception RADISH (Figure 1A) peuvent être téléchargés aux formats de fichier vectoriel et PNG (Fichier supplémentaire 1). Si la machine de découpe soulève, déchire ou ne parvient pas à couper proprement la feuille de PET, envisagez de remplacer le tapis de découpe.
- Alignez les couches sur du verre lamelle, sans aide ou avec des marques de repérage prédécoupées. Si plusieurs couches peuvent être fixées ensemble avant le laminage, alignez-les simultanément.
- Fixez les couches avec du ruban adhésif de bureau pour éviter de les déplacer pendant le laminage (Figure 2B). En fonction de la taille de l’appareil et de la capacité de la plastifieuse, montez les petits motifs sur un support plus grand avec plus de ruban adhésif pour éviter de coincer ou d’obstruer l’alimentation de la plastifieuse (Figure 2C).
REMARQUE : Le support utilisé dans le laminage n’est PAS le même que le tapis de découpe et sert principalement à fournir une traction pour la plastifieuse. Tout matériau résistant à la chaleur d’une épaisseur négligeable fonctionnera comme support (y compris, mais sans s’y limiter, le papier cartonné, le papier de bureau plié ou une feuille de PET plus grande). - Allumez la plastifieuse et plastifiez selon les instructions du fabricant. Retirez le ruban adhésif de bureau avant d’aligner la couche suivante (Figure 2D).
- Répétez les étapes 1.4 à 1.6 jusqu’à ce que toutes les couches aient été respectées.
- Fixez l’appareil à une parabole de 35 mm percée d’un trou de 3/4" à l’aide de colle cyanoacrylate (Figure 2E,F). Ajustez la forme et le type de la boîte en fonction des besoins expérimentaux (par exemple, tout récipient suffisamment grand pour accueillir l’appareil - un puits dans une plaque à 24 puits ou une boîte de Pétri plus grande). Utilisez suffisamment de colle pour sceller complètement l’appareil sur le plat sans l’inonder.
REMARQUE : Il n’est pas nécessaire de fixer l’appareil à un plat de maintien pour le fonctionnement de l’appareil. ATTENTION : Le cyanoacrylate lie la peau et les yeux en quelques secondes et irrite le système respiratoire, les yeux et la peau. Portez une protection pour les mains et les yeux et travaillez dans un endroit bien ventilé. - Imperméabilisez le stratifié PET en enduissant soigneusement les bords extérieurs de l’appareil avec de la colle cyanoacrylate (Figure 2F). Utilisez suffisamment de colle pour couvrir entièrement les bords extérieurs. Laissez la colle durcir pendant au moins 2 h avant de l’utiliser.
REMARQUE : Assurez-vous d’un espace suffisant pour que les vapeurs de cyanoacrylate s’évacuent. L’accumulation de fumées peut provoquer le dépôt de cyanoacrylate sur l’appareil, obscurcissant ainsi les matériaux optiquement transparents.
2. Positionnement des embryons dans le RADISH et préparation à l’imagerie
- Élever des embryons de poisson-zèbre dans le milieu d’élevage d’embryons standard E319. Si nécessaire, déchorionner les embryons au moins 1 h avant l’imagerie pour leur permettre de s’aplatir. Cette expérience a utilisé des embryons à 3 dpf, mais les embryons peuvent avoir jusqu’à 14 dpf (figure 1E).
- Colorez ou traitez les embryons selon les besoins expérimentaux.
REMARQUE : Dans ces expériences, les membranes cellulaires de la couche épithéliale externe ont été colorées le cas échéant par incubation avec 100 nM de MemGlow 560. - Anesthésier les embryons à l’aide de 164 mg/L de MS-22220.
REMARQUE : La concentration exacte et l’anesthésique utilisés peuvent être ajustés selon les préférences de l’expérimentateur. La concentration anesthésique peut être réduite pour permettre un développement réussi lors des images à long terme (voir étape 4.1). - Remplissez le récipient contenant l’appareil monté avec 5 mL de E3 contenant 164 mg/L de MS-222.
- À l’aide d’une pipette de transfert, déposez un embryon anesthésié dans chaque chambre de maintien du dispositif. Assurez-vous que les embryons restent immergés dans le liquide pendant toute la durée de l’imagerie.
REMARQUE : Le modèle RADISH peut immobiliser 1 à 4 embryons. - À l’aide d’une boucle de cheveux, orientez les embryons de manière à ce que la queue de l’embryon dépasse dans la chambre d’imagerie centrale et que le jaune soit solidement immobilisé dans le canal cunéiforme (figure 1C).
REMARQUE : L’orientation des embryons peut être effectuée sous un stéréomicroscope pour faciliter la manipulation. - Si vous le souhaitez, fixez la tête de l’embryon en ajoutant 1,5 % d’agarose à bas point de fusion dans la chambre de rétention à l’aide d’une micropipette.
- Déplacez l’appareil contenant les embryons vers le système d’imagerie de votre choix pour commencer l’imagerie.
3. Imagerie des transitoires calciques après une blessure
REMARQUE : Cette section et la section 4 sont facultatives et fournies à titre d’exemples d’expériences potentielles.
- Sélectionnez le système et l’objectif appropriés pour l’imagerie.
REMARQUE : Ici, un confocal à balayage laser inversé a été équipé d’un objectif 20x. - Ajustez la mise au point de l’échantillon et les paramètres d’imagerie (par exemple, puissance laser : 5, gain : 90, taille du sténopé : 2 AU, temps d’exposition [vitesse de balayage : 1 image/s]) pour un rapport signal/bruit et une vitesse d’acquisition optimaux.
REMARQUE : Il est recommandé de préfocaliser les échantillons et d’ajuster les paramètres de chaque canal sur le système d’imagerie du choix avant la blessure afin de réduire le décalage entre la formation de la plaie et l’acquisition de l’image. - Blessure d’un embryon Tg(krt4 :Gal4, UAS :GCaMP6f) x (cdh1-dTomato)xt1821,22.
- Pour blesser l’embryon par transsection manuelle, appliquez une pression avec une lame de scalpel sur le tissu de la nageoire caudale à l’extrémité de la notocorde sous un stéréomicroscope (Vidéo 1), puis remettez le dispositif sur la scène.
ATTENTION : L’application d’une pression excessive avec la lame du scalpel peut fissurer le verre sous-jacent. Si le verre se fissure, jetez l’appareil et redémarrez à partir de l’étape 1.2. - Pour blesser l’embryon par stimulation laser, définissez une région d’intérêt (ROI) près du bord du pli de la nageoire caudale et stimulez en fonction de la puissance laser disponible.
REMARQUE : Ici, une puissance laser de 2,4 W pendant 30 s à 800 nm était suffisante pour induire une blessure de pleine épaisseur.
- Pour blesser l’embryon par transsection manuelle, appliquez une pression avec une lame de scalpel sur le tissu de la nageoire caudale à l’extrémité de la notocorde sous un stéréomicroscope (Vidéo 1), puis remettez le dispositif sur la scène.
- Image à température ambiante à l’aide des canaux GFP (excitation 488 nm, émission 510 nm) et RFP (excitation 561 nm, émission 610 nm) en utilisant un intervalle d’image de 1 min pour un total de 1 h.
- (Facultatif) : Si nécessaire, libérez les embryons pour le prélèvement après imagerie par aspiration douce près de la tête à l’aide d’une pipette de transfert ou en faisant tourner la boîte.
4. Imagerie du recrutement des neutrophiles après une blessure
- Au moins 1 h avant l’imagerie, transférez les embryons dans E3 contenant la moitié de la concentration standard d’anesthésique, dans ce cas, 82 mg/L MS-222.
- Sélectionnez l’objectif approprié pour l’imagerie (ici, un confocal à balayage laser inversé équipé d’un objectif 10x).
- Ajustez la mise au point de l’échantillon et les paramètres d’imagerie (par exemple, puissance laser : 5, gain : 90, taille du sténopé : 2 AU, temps d’exposition [vitesse de balayage : 0,5 image/s])) pour un rapport signal/bruit et une vitesse d’acquisition optimaux.
REMARQUE : Il est recommandé de préfocaliser les échantillons et d’ajuster les paramètres de chaque canal sur le système d’imagerie du choix avant la blessure afin de réduire le décalage entre la formation de la plaie et l’acquisition de l’image. - Enroulez quatre embryons de Tol2(mpx :Dendra2)23 par section manuelle en appliquant une pression avec une lame de scalpel sur le tissu de la nageoire caudale sous un stéréomicroscope, puis remettez l’appareil sur la scène.
- Capturez l’image sur le canal GFP (excitation 488 nm, émission 510 nm) à température ambiante en utilisant un intervalle d’image de 5 minutes pendant 24 h.
- Si nécessaire, libérez les embryons pour le prélèvement après l’imagerie par aspiration douce près de la tête à l’aide d’une pipette de transfert ou en faisant tourner la boîte.
Résultats
Pour comparer la qualité d’image produite par un confocal à balayage laser avec et sans l’aide du RADISH, des embryons exprimant le biocapteur calcique intensiométrique GCaMP6f22,24 dans la couche épithéliale externe ont été colorés à l’aide de MemGlow 560 et imagés avec un confocal à balayage laser inversé couvrant toute l’épaisseur du pli de la nageoire caudale à un intervalle de temps de 1 min par image (Vidéo 2). Sans le dispositif (Figure 3A), les échantillons ont dérivé de manière significative et ont présenté des artefacts de bandes, résultant de la limitation de la pile Z à 25 tranches pour s’adapter à la résolution temporelle spécifiée par rapport à l’imagerie avec le dispositif (Figure 3B). Le RADISH a ensuite été utilisé pour examiner les transitoires calciques immédiatement après la blessure chez les embryons exprimant Tg(krt4 :Gal4, UAS :GCaMP6f) x (cdh1-dTomato)xt1821, mettant en évidence la E-cadhérine endogène en rouge et le calcium cytoplasmique dans l’épithélium apical en vert. Les embryons ont été blessés parallèlement aux côtés de la chambre centrale à l’aide d’une lame de scalpel (Figure 4A et Vidéo 3) ou par ablation laser directe avec un laser IR (Figure 4B), puis imagés sur toute l’épaisseur du pli de la nageoire caudale.
Pour démontrer l’efficacité du RADISH pour l’imagerie à plus long terme, nous avons étudié le recrutement des cellules immunitaires sur le bord de la plaie pendant 24 heures après la blessure. Quatre embryons de poisson-zèbre à 3 dpf exprimant Tol2(mpx :Dendra2) pour marquer les neutrophiles en vert23 ont été blessés par la section de la queue et imagés pendant 24 heures consécutives (Figure 5). Les artefacts d’imagerie généralement associés aux embryons tardifs de 3 dpf à 4 dpf, tels que l’inclinaison et le flottement, étaient remarquablement absents (vidéo 4), et la repousse des tissus s’est poursuivie sans entrave pendant l’expérience. Le recrutement des neutrophiles sur le bord de la plaie se poursuit tout au long de l’image (Figure 5B), la plupart des cellules migratrices partant 24 heures après la blessure (Figure 5C), ce qui correspond à la résolution attendue del’inflammation 25,26.

Figure 1 : Conception et utilisation d’un dispositif microfluidique à stratifié PET (RADISH). (A) Schéma illustrant la disposition et l’épaisseur des couches individuelles de PET, l’assemblage, le montage et l’utilisation du dispositif. (B) Produit final, monté dans une découpe de 3/4" dans un plat de 35 mm. (C) 3 embryons dpf, (D) 5 embryons dpf, (E) 14 embryons dpf logés à l’intérieur du dispositif. Barres d’échelle = 1 000 μm (C, D, E). Abréviations : PET = polyéthylène téréphtalate ; RADISH = assistant en rotation pour l’imagerie Danio de la cicatrisation ultérieure ; DFF = jours après la fertilisation. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Illustration photographique étape par étape de l’assemblage d’un dispositif PET. (A) Couches individuelles en PET avant laminage. (B) Couche de PET fixée à la lamelle de 25 mm à l’aide de ruban adhésif. (C) Dispositif en cours fixé à un support en plastique pour le laminage. (D) Dispositif stratifié PET terminé. (E) Antenne parabolique de 35 mm modifiée avant le montage de l’appareil. (F) Appareil terminé. Abréviation : PET = polyéthylène téréphtalate. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3 : Amélioration de la qualité des images confocales à balayage laser d’embryons de 3 dpf dans le design RADISH. (A) Image représentative d’un embryon de 3 dpf Tg(krt4 :Gal4, UAS :GCaMP6f) coloré avec MemGlow 560 sans utiliser le RADISH. (B) Image représentative de l’embryon Tg(krt4 :Gal4, UAS :GCaMP6f) coloré avec MemGlow 560 monté dans le RADISH. Barre d’échelle = 100 μm. Abréviations : RADISH = assistant de rotation pour l’imagerie Danio de la cicatrisation ultérieure ; DFF = jours après la fertilisation. Veuillez cliquer ici pour voir une version agrandie de cette figure.
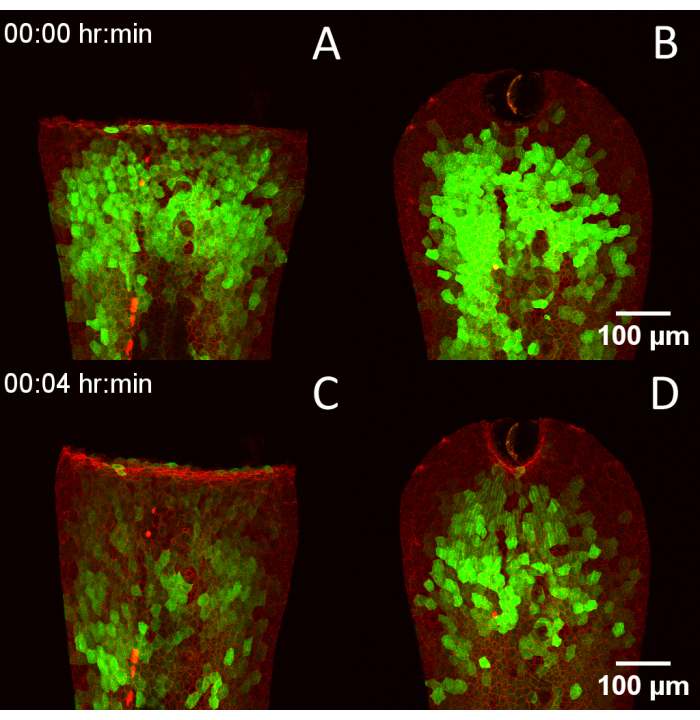
Figure 4 : Compatibilité de la conception RADISH avec plusieurs techniques de blessure. (A) 3 dpf Tg(krt4 :Gal4, UAS :GCaMP6f) x (cdh1-dTomato)xt18 embryon blessé par transsection manuelle de la nageoire caudale. (B) Embryon blessé par ablation au laser. (C, D) Les mêmes embryons 4 minutes plus tard, montrant la progression des transitoires calciques après la blessure. Barres d’échelle = 100 μm. Abréviations : RADISH = assistant de rotation pour l’imagerie Danio de la cicatrisation ultérieure ; DFF = jours après la fertilisation. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 5 : Piégeage à long terme d’embryons pour l’imagerie de la migration des phagocytes. (A) Les embryons Tol2(mpx :Dendra2) post-blessure et les mêmes embryons (B) 25 min, (C) 12 h et (D) 24 h plus tard. Barres d’échelle = 100 μm. Veuillez cliquer ici pour voir une version plus grande de cette figure.
Fichier supplémentaire 1 : Fichiers vectoriels et PNG pour la conception du dispositif RADISH, comme illustré à la figure 1A. Veuillez cliquer ici pour télécharger ce fichier.
Vidéo 1 : Vidéo en fond clair de la section manuelle de l’aileron arrière à l’aide de la conception du dispositif RADISH. Abréviation : RADISH = assistant de rotation pour l’imagerie Danio de la cicatrisation ultérieure. Veuillez cliquer ici pour télécharger cette vidéo.
Vidéo 2 : Comparaison d’embryons non montés et d’embryons montés de 3 dpf Tg(krt4 :Gal4, UAS :GCaMP6f) de la figure 3, acquis à 1 image/min. Veuillez cliquer ici pour télécharger cette vidéo.
Vidéo 3 : Transitoires calciques dans les embryons Tg(krt4 :Gal4, UAS :GCaMP6f) x (cdh1-dTomato)xt18 blessés par section de scalpel ou ablation laser de la figure 4, acquis à 1 image/min. Veuillez cliquer ici pour télécharger cette vidéo.
Vidéo 4 : Imagerie à long terme du recrutement des leucocytes et de la régénération de la nageoire caudale chez les embryons de Tol2(mpx :Dendra2). Abréviations : RADISH = assistant de rotation pour l’imagerie Danio de la cicatrisation ultérieure ; HPW = heures après la blessure. Veuillez cliquer ici pour télécharger cette vidéo.
Discussion
Le principe de base de la méthode de laminage PET implique la réduction des coûts et la minimisation des barrières techniques à l’entrée par rapport aux méthodes traditionnelles de création de dispositifs microfluidiques, telles que la lithographie douce ou le moulage PDMS. En tant que tel, les seules étapes critiques de ce protocole sont l’alignement précis des couches de PET lors du laminage et l’imperméabilisation des bords de l’appareil après la construction. Toutes les autres parties de la méthode peuvent être modifiées en fonction des besoins expérimentaux (par exemple, si l’immobilisation d’embryons plus jeunes ou plus âgés est nécessaire, l’épaisseur des couches de PET peut être ajustée pour rétrécir ou élargir le canal en conséquence). Les motifs peuvent être créés dans n’importe quelle forme et stratifiés sur n’importe quel matériau de base, à condition que le matériau soit résistant à la chaleur et suffisamment fin pour être envoyé à travers la plastifieuse18,27. Comme les feuilles de PET sont découpées à l’aide de découpeuses artisanales disponibles dans le commerce, qui lisent des fichiers d’image bidimensionnels plutôt que tridimensionnels, la conception et l’itération d’un appareil donné ne nécessitent que la capacité de manipuler des formes en noir et blanc dans un programme d’édition d’images, ce qui réduit considérablement la difficulté. Cette flexibilité dans le choix des logiciels et la disponibilité commerciale des matériaux utilisés représentent une augmentation spectaculaire de l’accessibilité des dispositifs microfluidiques en général, permettant leur utilisation dans n’importe quel laboratoire ou salle de classe pour un coût initial de moins de 500 $ au moment de la rédaction de cet article, contre plus de 2000 $ en coûts d’équipement de départ pour la fabrication de moules PDMS17.
De plus, le temps nécessaire à la création d’un seul appareil utilisable à l’aide de cette méthode est considérablement réduit par rapport à la lithographie douce typique. En supposant une familiarité avec le logiciel requis, un dispositif microfluidique unique de stratifié PET peut être conceptualisé, fabriqué et immédiatement utilisé en ~3 h, y compris le temps de durcissement du cyanoacrylate. L’itération prend encore moins de temps, en fonction de l’ampleur des modifications nécessaires aux fichiers de conception originaux, et plusieurs variantes d’appareils peuvent être créées en parallèle avec un minimum de temps supplémentaire investi et aucun équipement supplémentaire. Bien que les dispositifs créés à l’aide de cette méthode soient moins durables que ceux fabriqués avec PDMS pour diverses raisons (notamment la défaillance de l’adhésif et les contraintes internes pour les formes avec de nombreuses couches et de longs rapports d’aspect), leur nature peu coûteuse et leur fabrication évolutive signifient qu’ils sont beaucoup plus faciles à remplacer. Étant donné que les découpeuses artisanales commerciales sont commercialisées avec la capacité de répéter la même coupe précise encore et encore et que le PET n’a pas de date d’expiration, les couches individuelles d’une conception terminée peuvent être pré-préparées en vrac pour l’assemblage et l’utilisation à tout moment dans le futur, ce qui réduit encore l’investissement global en temps requis.
Cependant, la vitesse et la variabilité se font au détriment de la précision. La principale limitation du laminage PET par rapport au moulage PDMS traditionnel est la résolution spatiale. Les découpeurs artisanaux commerciaux ont souvent du mal à utiliser les angles vifs sur des formes inférieures à environ 500 μm, et les feuilles de laminage PET ne sont pas disponibles à des épaisseurs inférieures à 33 μm (sans compter l’épaisseur de l’adhésif lui-même, qui n’est pas incluse dans la mesure sur l’emballage), ce qui limite considérablement l’échelle à laquelle cette technique peut être appliquée. Le nombre maximum de couches est également limité par la taille de la plastifieuse, qui peut varier d’un fabricant à l’autre.
La version finale du protocole, y compris les variations dans les techniques d’enregistrement et d’alignement, les fournisseurs de matériaux et les logiciels, dépendra en grande partie des préférences de l’utilisateur. Cependant, l’accessibilité et la flexibilité globale de la méthode réduisent le coût de l’adaptation. Les utilisateurs individuels sont encouragés à itérer autant que nécessaire pour adapter l’approche à leurs besoins uniques.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à divulguer.
Remerciements
Les travaux ont été soutenus par des fonds de recherche des National Institutes of Health (R35GM119787 to QD). Ce travail est basé sur les efforts soutenus par l’Institut EMBRIO, contrat NSF #2120200, un institut d’intégration de la biologie de la National Science Foundation (NSF). L’imagerie confocale a été réalisée à l’installation d’imagerie de Purdue. Nous remercions le Dr Guangjun Zhang (Université Purdue) d’avoir fourni la ligne Tg(UAS :GCaMP6f). Nous remercions le Dr David Tobin (Université Duke) d’avoir fourni la lignée (cdh1-tdtomato)xt18.
matériels
| Name | Company | Catalog Number | Comments |
| 25 mm diameter round coverglass #1 thickness | Chemglass Life Sciences | CLS-1760-025 | Base mounting material. Thickness was chosen based on the specifications of the microscope lens. |
| Adobe Illustrator v28.5 | Adobe | N/A | Vector editor for designing the device pattern. |
| Calcium Chloride Dihydrate | Fisher | C79 | For making E3 medium. |
| Design PNG Files (Online Mirror) | N/A | N/A | https://i.ibb.co/QPYj7BL/multipositionalv7-1.png https://i.ibb.co/FDpQYXc/multipositionalv7-2.png https://i.ibb.co/5TG4SB6/multipositionalv7-3.png |
| Design Space for Desktop v8.39 | Cricut | N/A | Proprietary software to drive the craft cutter. |
| Fusion Plus 7000L | GBC | 1703098 | Thermal laminator. This specific model was selected for quality of life features, such as maximum sheet stack size. |
| German Carbide Premium Blade | Cricut | 10396595 | Replacement blade for craft cutter. |
| Gray Basic Tool Set | Cricut | 10307854 | Tool set for weeding cuts, cleaning mats, and mounting PET sheets. Optional. |
| Magnesium Chloride Hexahydrate | Acros Organic | 223211000 | For making E3 medium. |
| Maker 3 | Cricut | 10669040 | Craft cutter. The Cricut Maker 3 was selected over the Silhouette Cameo 4 for software user friendliness, but any craft cutter capable of reading black and white images will work. |
| MemGlow 560 | Cytoskeleton | MG02-10 | Red live cell dye for cell membranes. No washing needed. Used in Figure 3. |
| No. 22 Carbon Scalpel Blade | Surgical Design | 22-079-697 | Scalpel blade for manual cut adjustments. Any similar craft knife (e.g., X-acto #2 knife) will also work. |
| Potassium Chloride | Fisher | BP366 | For making E3 medium. |
| Sodium Chloride | Fisher | BP358 | For making E3 medium. |
| StandardGrip Adhesive Cutting Mat | Cricut | 10138842 | Mounting mat for craft cutter. The LightGrip cutting mat will also work, but avoid the StrongGrip and FabricGrip cutting mats as the strength of the adhesive may warp the final cut during weeding and removal. Adhesive on mats will eventually wear out with continued use; replace mats as needed. |
| Stationery Tape 12 mm | Deli | 30014 | Office tape. Deli brand was chosen via testing for ease of removal after lamination. |
| Super glue, liquid | Loctite | 1364076 | Cyanoacrylate glue. Glue used must be liquid. Gel formulations will not sufficiently seal or waterproof device edges. |
| PET Thermal Laminating Pouches, 3 mil | Scotch | TP3854 | PET sheets with thermal adhesive. Sheets arrive as sandwiched pairs and should be separated before use. Cut with adhesive side facing down. |
| PET Thermal Laminating Pouches, 5 mil | Scotch | TP5854 | PET sheets with thermal adhesive. Sheets arrive as sandwiched pairs and should be separated before use. Cut with adhesive side facing down. |
| Tricaine (MS-222) | Syndel | IC10310680 | Fish anaesthetic. |
Références
- De Oliveira, S., Rosowski, E. E., Huttenlocher, A. Neutrophil migration in infection and wound repair: going forward in reverse. Nat Rev Immunol. 16 (6), 378-391 (2016).
- Xu, S., Hsiao, T. I., Chisholm, A. D. The wounded worm. Worm. 1 (2), 134-138 (2012).
- Belacortu, Y., Paricio, N. Drosophila as a model of wound healing and tissue regeneration in vertebrates. Dev Dyn. 240 (11), 2379-2404 (2011).
- Yoo, S. K., Freisinger, C. M., LeBert, D. C., Huttenlocher, A. Early redox, Src family kinase, and calcium signaling integrate wound responses and tissue regeneration in zebrafish. J Cell Biol. 199 (2), 225-234 (2012).
- Kawakami, A., Fukazawa, T., Takeda, H. Early fin primordia of zebrafish larvae regenerate by a similar growth control mechanism with adult regeneration. Dev Dyn. 231 (4), 693-699 (2004).
- Gault, W. J., Enyedi, B., Niethammer, P. Osmotic surveillance mediates rapid wound closure through nucleotide release. J Cell Biol. 207 (6), 767-782 (2014).
- Huemer, K., et al. zWEDGI: Wounding and entrapment device for imaging live zebrafish larvae. Zebrafish. 14 (1), 42-50 (2017).
- Kaufmann, A., Mickoleit, M., Weber, M., Huisken, J. Multilayer mounting enables long-term imaging of zebrafish development in a light sheet microscope. Development. 139 (17), 3242-3247 (2012).
- Hirsinger, E., Steventon, B. A versatile mounting method for long term imaging of zebrafish development. J Vis Exp. (119), e55210 (2017).
- Wielhouwer, E. M., et al. Zebrafish embryo development in a microfluidic flow-through system. Lab Chip. 11 (10), 1815-1824 (2011).
- Khalili, A., Rezai, P. Microfluidic devices for embryonic and larval zebrafish studies. Brief Funct Genomics. 18 (6), 419-432 (2019).
- Choudhury, D., et al. Fish and Chips: a microfluidic perfusion platform for monitoring zebrafish development. Lab Chip. 12 (5), 892-900 (2012).
- Zhang, G., et al. An integrated microfluidic system for zebrafish larva organs injection. , 8563-8566 (2017).
- Erickstad, M., Hale, L. A., Chalasani, S. H., Groisman, A. A microfluidic system for studying the behavior of zebrafish larvae under acute hypoxia. Lab Chip. 15 (3), 857-866 (2015).
- Mani, K., Hsieh, Y. C., Panigrahi, B., Chen, C. Y. A noninvasive light driven technique integrated microfluidics for zebrafish larvae transportation. Biomicrofluidics. 12 (2), 021101 (2018).
- Lee, Y., Seo, H. W., Lee, K. J., Jang, J. W., Kim, S. A microfluidic system for stable and continuous EEG monitoring from multiple larval zebrafish. Sensors (Basel). 20 (20), 5903 (2020).
- Sonnen, K. F., Merten, C. A. Microfluidics as an emerging precision tool in developmental biology. Dev Cell. 48 (3), 293-311 (2019).
- Levis, M., et al. Microfluidics on the fly: Inexpensive rapid fabrication of thermally laminated microfluidic devices for live imaging and multimodal perturbations of multicellular systems. Biomicrofluidics. 13 (2), 024111 (2019).
- . E3 medium (for zebrafish embryos). Cold Spring Harbor Protocols. 2011 (10), (2011).
- Matthews, M., Varga, Z. M. Anesthesia and euthanasia in zebrafish. ILAR J. 53 (2), 192-204 (2012).
- Cronan, M. R., Tobin, D. M. Endogenous tagging at the cdh1 locus for live visualization of E-cadherin dynamics. Zebrafish. 16 (3), 324 (2019).
- Thiele, T. R., Donovan, J. C., Baier, H. Descending control of swim posture by a midbrain nucleus in zebrafish. Neuron. 83 (3), 679-691 (2014).
- Yoo, S. K., Huttenlocher, A. Spatiotemporal photolabeling of neutrophil trafficking during inflammation in live zebrafish. J Leukoc Biol. 89 (5), 661-667 (2011).
- Chen, T. W., et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499 (7458), 295-300 (2013).
- Li, L., Yan, B., Shi, Y. -. Q., Zhang, W. -. Q., Wen, Z. -. L. Live imaging reveals differing roles of macrophages and neutrophils during zebrafish tail fin regeneration. J Biol Chem. 287 (30), 25353-25360 (2012).
- Mathias, J. R., et al. Resolution of inflammation by retrograde chemotaxis of neutrophils in transgenic zebrafish. J Leukoc Biol. 80, 1281-1288 (2006).
- Levis, M., Ontiveros, F., Juan, J., Kavanagh, A., Zartman, J. J. Rapid fabrication of custom microfluidic devices for research and educational applications. J Vis Exp. 2019, (2019).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon