Method Article
Diseños microfluídicos de laminación de tereftalato de polietileno de bajo costo para imágenes multiplexadas de pez cebra
En este artículo
Resumen
Un método innovador para fabricar dispositivos microfluídicos utilizando la laminación de tereftalato de polietileno (PET) reduce significativamente el costo y la complejidad de atrapar e obtener imágenes de múltiples embriones vivos de pez cebra.
Resumen
Los embriones de pez cebra son transparentes y, por lo tanto, son especialmente adecuados para la obtención de imágenes intravitales no invasivas de procesos fundamentales, como la cicatrización de heridas y la migración de células inmunitarias. Los dispositivos microfluídicos se utilizan para el atrapamiento para respaldar la obtención de imágenes a largo plazo de organismos multicelulares, incluido el pez cebra. Sin embargo, la fabricación de estos dispositivos mediante litografía blanda requiere instalaciones especializadas y competencia en impresión 3D, que puede no ser accesible para todos los laboratorios. Nuestra adaptación de un método de laminación de tereftalato de polietileno de bajo costo desarrollado anteriormente para construir dispositivos microfluídicos aumenta la accesibilidad al permitir el diseño, la fabricación y la iteración por una fracción de la inversión técnica de las técnicas convencionales. Utilizamos un dispositivo fabricado con este método, el Asistente Rotacional para la Imagen Danio de la Curación Posterior (RADISH), para acomodar el tratamiento farmacológico, las heridas manuales y la obtención de imágenes a largo plazo de hasta cuatro embriones en el mismo campo de visión. Con este nuevo diseño, capturamos con éxito las características morfológicas macroscópicas de la señal de calcio alrededor de la ablación con láser y las heridas de transección manual para múltiples embriones en las 2 h inmediatamente posteriores a la lesión, así como el reclutamiento de neutrófilos al borde de la herida durante 24 h.
Introducción
La capacidad de responder adecuadamente a las lesiones es fundamental para la supervivencia de todos los organismos a todas las escalas, desde una sola célula hasta múltiples tejidos. Las heridas y sus respuestas asociadas, como el reclutamiento de fagocitos a las áreas dañadas1 son, por lo tanto, temas importantes en biología celular y tisular. Las heridas se detectan inmediatamente después de que se rompe la barrera tisular, lo que provoca una respuesta de gradiente tisular que implica la contracción de la herida 2,3 que coordina la cicatrización de la herida y su posterior recrecimiento4. Debido a la naturaleza mecánica de esta contracción, las herramientas utilizadas durante la experimentación no deben impedir físicamente el movimiento de las células cerca del sitio de la lesión.
Los embriones de pez cebra son un excelente modelo para estudiar el desarrollo y la enfermedad, incluida la respuesta de los vertebrados a las heridas, debido a su facilidad de cuidado, trazabilidad genética y transparencia óptica 5,6. Sin embargo, es necesario inmovilizar todo el organismo durante un período prolongado para estudiar el comportamiento a largo plazo de las células cerca de un sitio de lesión. La inclusión de embriones en agarosa de bajo punto de fusión es suficiente para obtener imágenes a corto plazo del tejido no herido. Sin embargo, la matriz de gel circundante restringe la contracción y relajación de las heridas e impide el crecimiento de los embriones en desarrollo con el tiempo 7,8,9.
Los dispositivos de microfluídica pueden inmovilizar embriones de pez cebra en diferentes etapas de desarrollo 10,11,12,13,14,15,16, y algunos, como el zWEDGI 7, admiten heridas manuales. Sin embargo, hay varios inconvenientes en los diseños de dispositivos disponibles. Por ejemplo, muchos dispositivos impresos directamente en plástico son incompatibles con la obtención de imágenes en sistemas de microscopio invertido debido a la escasa transparencia óptica. Además, los canales paralelos permiten la obtención de imágenes multiposicionales10,11, pero el movimiento físico de la platina del microscopio introduce un retraso en la adquisición de imágenes. La iteración repetida y la optimización para resolver estos problemas son difíciles cuando se considera la inversión financiera y técnica requerida para cada nuevo diseño, especialmente para los métodos actuales de fabricación de dispositivos que utilizan litografía blanda de polidimetilsiloxano (PDMS). El primer paso, la creación de un molde maestro, a menudo requiere conocimiento de software de modelado 3D, acceso a equipos de fabricación especializados y (dependiendo del material utilizado) un tratamiento antiadherente adicional, como la silanización, antes de que se use el molde. El curado del PDMS una vez vertido toma al menos una hora a altas temperaturas y, generalmente, debe realizarse al vacío o con una pinza para obtener mejores resultados, a menudo en una sala limpia 7,17,18. Al igual que en la biología del desarrollo, estos costos pueden resultar rápidamente prohibitivos para experimentos que requieren muchos entornos microfluídicos únicos en múltiples modelos.
De los materiales de construcción alternativos disponibles, el tereftalato de polietileno (PET) es duradero, no tóxico y fácil de manipular. Las láminas de PET son bolsas de laminación de plástico ampliamente disponibles que se venden en la mayoría de las tiendas de suministros de oficina, con adhesivo activado térmicamente preaplicado (generalmente etileno acetato de vinilo). Al dar forma a estas láminas de PET utilizando cortadores artesanales disponibles en el mercado (es decir, plotters de corte controlados por computadora diseñados para artesanos domésticos) y adherir las capas entre sí utilizando equipos de laminación térmica estándar, se puede generar e iterar rápidamente una amplia gama de diseños potenciales. Por lo tanto, hemos adaptado un método de diseño y construcción descrito anteriormente que involucra PET18 apilado para crear el Asistente Rotacional para el Danio Imaging de Subsultent Healing (RADISH) (Figura 1A, B). Una disposición rotacional de varios canales de restricción aproximadamente en forma de cuña optimiza la proximidad al tiempo que permite espacio para la transección manual de la aleta caudal, lo que permite la obtención de imágenes inmediatamente después del herido y la obtención simultánea de imágenes a largo plazo de múltiples embriones de pez cebra heridos dentro del mismo campo de visión. Además, este método de construcción reduce drásticamente los costos de capital iniciales y el tiempo requerido para la construcción del dispositivo, al tiempo que mantiene la reutilización.
Protocolo
Este estudio utilizó embriones de 3 días después de la fertilización (dpf), pero se puede diseñar para usar embriones de 2 a 14 dpf. El experimento del pez cebra se llevó a cabo según los estándares internacionalmente aceptados. El Protocolo de Cuidado y Uso de Animales fue aprobado por el Comité de Cuidado y Uso de Animales de Purdue (PACUC), adhiriéndose a las Pautas para el uso de pez cebra en el Programa de Investigación Intramuros de los NIH (número de protocolo: 1401001018).
1. Montaje del dispositivo de microfluídica PET
NOTA: Cualquier parte de este protocolo puede detenerse en cualquier momento, excepto los pasos 1.8 y 1.9, que son sensibles al tiempo de secado del cianocrilato.
- Diseñe el patrón para el dispositivo en el software de su elección (por ejemplo, Adobe Illustrator, Figura 1A). Dependiendo de la edad y el tamaño del embrión, ajuste el ancho del canal y el tamaño de la cámara central de imágenes para un mejor ajuste.
- Guarde cada capa como un archivo de imagen individual con dimensiones idénticas. Asigne un nombre a cada archivo de manera que el grosor de la hoja que se utilizará y el orden de montaje sean evidentes.
- Inicialice la máquina de corte de acuerdo con las instrucciones del fabricante.
- Cargue cada patrón diseñado en el software de diseño para cortar.
- En el espacio de trabajo de diseño, seleccione los diseños recién cargados. Agrupe los patrones destinados al mismo grosor de lámina de PET en el mismo corte (Figura 2A). Si es necesario, reajuste el tamaño de los patrones en el software de diseño a las dimensiones correctas.
- Confirme el número y el tipo de patrones en el corte y, a continuación, seleccione el material de corte.
NOTA: Es posible que las láminas de PET no sean una opción de material en el software de diseño, incluso con nombres como "bolsa de laminación de plástico". En su lugar, se puede seleccionar cualquier material de grosor y textura similares (por ejemplo, láminas de transparencia o vinilo no adhesivo). - Fije las láminas de PET a la alfombrilla de corte, presionando firmemente para eliminar las burbujas de aire, y cargue la alfombrilla en la máquina de corte. Siga las instrucciones en pantalla para indicar a la máquina de corte que comience el corte.
- Retire los cortes terminados del tapete de corte. Si es necesario, ajuste los patrones de corte con un cuchillo artesanal o una hoja de bisturí.
NOTA: Los archivos de imagen utilizados para crear el diseño de RADISH (Figura 1A) están disponibles para su descarga como formatos de archivo vectorial y PNG (Archivo complementario 1). Si la máquina de corte levanta, rasga o no corta limpiamente la lámina de PET, considere reemplazar el tapete de corte.
- Alinee las capas en el vidrio cubreobjetos, sin ayuda o con marcas de registro precortadas. Si se pueden unir varias capas antes de la laminación, alinéelas simultáneamente.
- Asegure las capas con cinta de oficina para evitar que se muevan durante el laminado (Figura 2B). Dependiendo del tamaño del dispositivo y la capacidad de la laminadora, monte los diseños pequeños en un respaldo más grande con más cinta para evitar atascos u obstrucciones en la alimentación de la laminadora (Figura 2C).
NOTA: El soporte utilizado en la laminación NO es el mismo que la alfombrilla de corte, y sirve principalmente para proporcionar tracción a la laminadora. Cualquier material resistente al calor de grosor insignificante funcionará como soporte (incluidos, entre otros, cartulina, papel de oficina doblado o una hoja de PET más grande). - Encienda la laminadora y el laminado de acuerdo con las instrucciones del fabricante. Retire la cinta de oficina antes de alinear la siguiente capa (Figura 2D).
- Repita los pasos 1.4 a 1.6 hasta que se hayan adherido todas las capas.
- Asegure el dispositivo a un plato de 35 mm perforado con un orificio de 3/4" con pegamento de cianoacrilato (Figura 2E, F). Ajuste la forma y el tipo de plato de acuerdo con las necesidades experimentales (por ejemplo, cualquier recipiente lo suficientemente grande como para acomodar el dispositivo: un pozo en una placa de 24 pocillos o una placa de Petri más grande). Use suficiente pegamento para sellar el dispositivo completamente al plato sin inundarlo.
NOTA: No es necesario asegurar el dispositivo a un plato de sujeción para el funcionamiento del dispositivo. PRECAUCIÓN: El cianoacrilato adhiere la piel y los ojos en segundos e irrita el sistema respiratorio, los ojos y la piel. Use protección para las manos y los ojos y trabaje en un área bien ventilada. - Impermeabilice el laminado PET cubriendo completamente los bordes exteriores del dispositivo con pegamento de cianoacrilato (Figura 2F). Use suficiente pegamento para cubrir completamente los bordes exteriores. Deje que el pegamento se cure durante al menos 2 horas antes de usarlo.
NOTA: Asegúrese de que haya un espacio adecuado para que los vapores de cianoacrilato se ventilen. La acumulación de humos puede hacer que el cianoacrilato se deposite en el dispositivo, oscureciendo el material ópticamente transparente.
2. Posicionamiento de los embriones dentro del RÁBANO y preparación para la obtención de imágenes
- Cría embriones de pez cebra en el medio estándar de cría de embriones E319. Si es necesario, descorionar los embriones al menos 1 h antes de la toma de imágenes para permitir que se aplanen. En este experimento se utilizaron embriones a 3 dpf, pero los embriones pueden tener hasta 14 dpf (Figura 1E).
- Teñir o tratar los embriones de acuerdo con las necesidades experimentales.
NOTA: En estos experimentos, las membranas celulares de la capa epitelial externa se tiñeron donde correspondía incubando con MemGlow 560 de 100 nM. - Anestesiar embriones con 164 mg/L MS-22220.
NOTA: La concentración exacta y el anestésico utilizado pueden ajustarse de acuerdo con las preferencias del experimentador. La concentración del anestésico puede reducirse para permitir un revelado exitoso durante las imágenes a largo plazo (ver paso 4.1). - Llene el plato de retención que contiene el dispositivo montado con 5 mL de E3 que contenga 164 mg/L MS-222.
- Con una pipeta de transferencia, deposite un embrión anestesiado en cada cámara de retención del dispositivo. Asegúrese de que los embriones permanezcan sumergidos en líquido durante la duración de la toma de imágenes.
NOTA: El diseño de rábano puede inmovilizar de 1 a 4 embriones. - Usando un lazo de cabello, oriente los embriones de manera que la cola del embrión sobresalga en la cámara central de imágenes y la yema quede inmovilizada de forma segura en el canal en forma de cuña (Figura 1C).
NOTA: La orientación de los embriones se puede realizar bajo un microscopio estereoscópico para facilitar la manipulación. - Si lo desea, asegure la cabeza del embrión añadiendo un 1,5% de agarosa de bajo punto de fusión en la cámara de retención con una micropipeta.
- Mueva el dispositivo con embriones al sistema de diagnóstico por imágenes de su elección para comenzar la toma de imágenes.
3. Imágenes de transitorios de calcio después de la herida
NOTA: Esta sección y la sección 4 son opcionales y se proporcionan como posibles experimentos de muestra.
- Seleccione el sistema y el objetivo adecuados para la obtención de imágenes.
NOTA: Aquí, un confocal de escaneo láser invertido estaba equipado con un objetivo 20x. - Ajuste el enfoque de la muestra y los parámetros de imagen (p. ej., potencia del láser: 5, ganancia: 90, tamaño del agujero de alfiler: 2 UA, tiempo de exposición [velocidad de escaneo: 1 fotograma/s]) para obtener una relación señal-ruido y una velocidad de adquisición óptimas.
NOTA: Se recomienda que las muestras estén preenfocadas y que los parámetros de cada canal en el sistema de imágenes de elección se ajusten antes de la herida para reducir el retraso entre la formación de la herida y la adquisición de la imagen. - Herida a Tg(krt4:Gal4, UAS:GCaMP6f) x (cdh1-dTomato)xt1821,22 embrión.
- Para herir el embrión a través de la transección manual, aplique presión con una hoja de bisturí a través del tejido de la aleta caudal en la punta de la notocorda bajo un microscopio estereoscópico (Video 1), luego regrese el dispositivo a la etapa.
PRECAUCIÓN: La aplicación de una presión excesiva con la hoja del bisturí puede agrietar el vidrio subyacente. Si el vidrio se agrieta, deseche el dispositivo y reinicie desde el paso 1.2. - Para enrollar el embrión mediante estimulación láser, defina una región de interés (ROI) cerca del borde del pliegue de la aleta caudal y estimule de acuerdo con la potencia láser disponible.
NOTA: En este caso, una potencia láser de 2,4 W durante 30 s a 800 nm fue suficiente para inducir una herida de espesor completo.
- Para herir el embrión a través de la transección manual, aplique presión con una hoja de bisturí a través del tejido de la aleta caudal en la punta de la notocorda bajo un microscopio estereoscópico (Video 1), luego regrese el dispositivo a la etapa.
- Imagen a temperatura ambiente utilizando canales GFP (excitación 488 nm, emisión 510 nm) y RFP (excitación 561 nm, emisión 610 nm) utilizando un intervalo de fotograma de 1 min para un total de 1 h.
- (Opcional): Si es necesario, libere los embriones para su recuperación después de la obtención de imágenes mediante una succión suave cerca de la cabeza utilizando una pipeta de transferencia o girando el plato.
4. Imagen del reclutamiento de neutrófilos después de la herida
- Al menos 1 h antes de la toma de imágenes, transfiera los embriones a E3 que contengan la mitad de la concentración estándar de anestésico, en este caso, 82 mg/L MS-222.
- Seleccione el objetivo apropiado para la obtención de imágenes (en este caso, un confocal de escaneo láser invertido equipado con un objetivo 10x).
- Ajuste el enfoque de la muestra y los parámetros de imagen (p. ej., potencia del láser: 5, ganancia: 90, tamaño del orificio: 2 UA, tiempo de exposición [velocidad de escaneo: 0,5 fotogramas/s])) para obtener una relación señal-ruido y una velocidad de adquisición óptimas.
NOTA: Se recomienda que las muestras estén preenfocadas y que los parámetros de cada canal en el sistema de imágenes de elección se ajusten antes de la herida para reducir el retraso entre la formación de la herida y la adquisición de la imagen. - Enrolló cuatro embriones de Tol2(mpx:Dendra2)23 mediante transección manual aplicando presión con una hoja de bisturí a través del tejido de la aleta caudal bajo un microscopio estereoscópico, y luego devolvió el dispositivo a la etapa.
- Capture la imagen en el canal GFP (excitación de 488 nm, emisión de 510 nm) a temperatura ambiente utilizando un intervalo de fotogramas de 5 minutos durante 24 h.
- Si es necesario, libere los embriones para su recuperación después de la obtención de imágenes mediante una succión suave cerca de la cabeza utilizando una pipeta de transferencia o girando el plato.
Resultados
Para comparar la calidad de imagen producida por un confocal de escaneo láser con y sin la ayuda del RADISH, los embriones que expresan el biosensor de calcio intensivo GCaMP6f22,24 en la capa epitelial externa se tiñeron con MemGlow 560 y se obtuvieron imágenes con un confocal de escaneo láser invertido que cubre todo el espesor del pliegue de la aleta caudal en un intervalo de tiempo de 1 minuto por fotograma (Video 2). Sin el dispositivo (Figura 3A), las muestras se desviaron significativamente y mostraron artefactos de bandas, como resultado de limitar la pila Z a 25 cortes para que se ajusten a la resolución temporal especificada en comparación con las imágenes con el dispositivo (Figura 3B). El rábano se utilizó además para examinar los transitorios de calcio inmediatamente después de la herida en embriones que expresaban Tg(krt4:Gal4, UAS:GCaMP6f) x (cdh1-dTomato)xt1821, destacando la E-cadherina endógena en rojo y el calcio citoplasmático en el epitelio apical en verde. Los embriones fueron heridos paralelos a los lados de la cámara central utilizando una hoja de bisturí (Figura 4A y Video 3) o mediante ablación directa con láser IR (Figura 4B), luego se obtuvieron imágenes a través de todo el espesor del pliegue de la aleta caudal.
Para demostrar la eficacia del rábano para la obtención de imágenes a largo plazo, investigamos el reclutamiento de células inmunitarias en el borde de la herida durante 24 horas después de la herida. Cuatro embriones de pez cebra a 3 dpf que expresan Tol2 (mpx:Dendra2) para marcar neutrófilos enverde 23 fueron heridos por transección de cola y se les tomaron imágenes durante 24 horas consecutivas (Figura 5). Los artefactos de imagen típicamente asociados con los embriones tardíos de 3 a 4 dpf, como la inclinación y la flotación, estaban notablemente ausentes (Video 4), y el recrecimiento del tejido continuó sin obstáculos para el experimento. El reclutamiento de neutrófilos hacia el borde de la herida continúa a lo largo de la imagen (Figura 5B), y la mayoría de las células migratorias se van a las 24 h después de la herida (Figura 5C), lo que es consistente con la resolución de inflamación esperada25,26.

Figura 1: Diseño y uso del dispositivo de microfluídica laminado de PET (RADISH). (A) Esquema que ilustra la disposición y el espesor de las capas individuales de PET, el ensamblaje y el montaje y uso del dispositivo. (B) Producto final, montado en un recorte de 3/4" en un plato de 35 mm. (C) embriones de 3 dpf, (D) embriones de 5 dpf, (E) embriones de 14 dpf alojados dentro del dispositivo. Barras de escala = 1.000 μm (C,D,E). Abreviaturas: PET = tereftalato de polietileno; RADISH = Asistente de rotación para la obtención de imágenes Danio de la curación posterior; DPF = días después de la fecundación. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Ilustración fotográfica paso a paso del montaje del dispositivo de PET. (A) Capas individuales de PET antes de la laminación. (B) Capa de PET asegurada a un cubreobjetos de 25 mm con cinta de oficina. (C) Dispositivo en progreso asegurado a un soporte de plástico para laminación. (D) Dispositivo de laminado de PET completo. (E) Antena modificada de 35 mm antes del montaje del dispositivo. (F) Dispositivo completado. Abreviatura: PET = tereftalato de polietileno. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Mejora de la calidad de las imágenes confocales de escaneo láser de embriones de 3 dpf en el diseño RADISH. (A) Imagen representativa de un embrión de 3 dpf Tg (krt4:Gal4, UAS:GCaMP6f) teñido con MemGlow 560 sin usar el RADISH. (B) Imagen representativa del embrión Tg(krt4:Gal4, UAS:GCaMP6f) teñido con MemGlow 560 montado en el RÁBANO. Barra de escala = 100 μm. Abreviaturas: RADISH = Asistente de rotación para la obtención de imágenes Danio de la curación posterior; DPF = días después de la fecundación. Haga clic aquí para ver una versión más grande de esta figura.
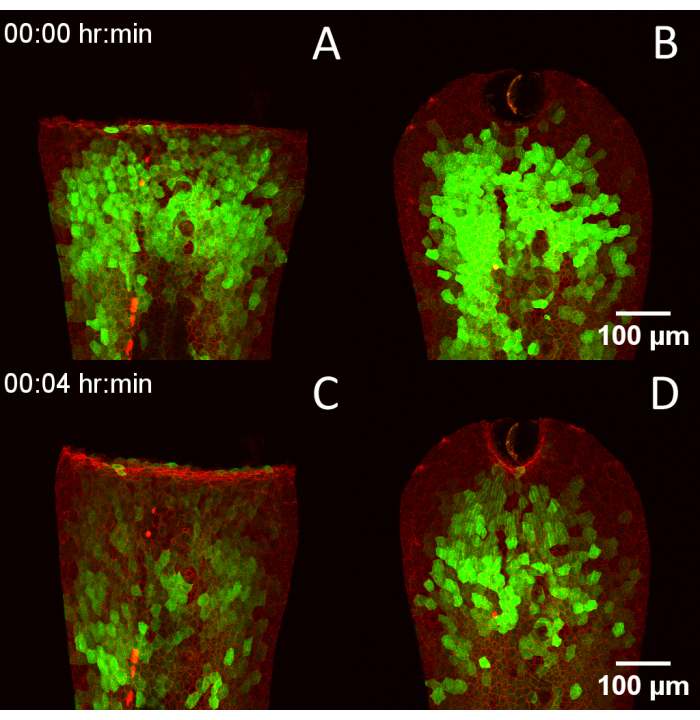
Figura 4: Compatibilidad del diseño RADISH con múltiples técnicas de herido. (A) 3 dpf Tg(krt4:Gal4, UAS:GCaMP6f) x (cdh1-dTomato)xt18 embrión herido mediante transección manual de la aleta caudal. (B) Embrión herido mediante ablación láser. (C,D) Los mismos embriones 4 min después, mostrando la progresión de los transitorios de calcio después de la herida. Barras de escala = 100 μm. Abreviaturas: RADISH = Asistente de rotación para la obtención de imágenes Danio de la curación posterior; DPF = días después de la fecundación. Haga clic aquí para ver una versión más grande de esta figura.

Figura 5: Atrapamiento a largo plazo de embriones para obtener imágenes de la migración de fagocitos. (A) embriones de Tol2(mpx:Dendra2) inmediatamente después de la herida, y los mismos embriones (B) 25 min, (C) 12 h y (D) 24 h después. Barras de escala = 100 μm. Haga clic aquí para ver una versión más grande de esta figura.
Archivo complementario 1: Archivos vectoriales y PNG para el diseño de dispositivos RADISH como se muestra en la Figura 1A. Haga clic aquí para descargar este archivo.
Video 1: Vídeo de campo claro de la transección manual de la aleta caudal utilizando el diseño de un dispositivo RADISH. Abreviatura: RADISH = Asistente de rotación para la obtención de imágenes Danio de la curación posterior. Haga clic aquí para descargar este video.
Vídeo 2: Comparación de embriones Tg(krt4:Gal4, UAS:GCaMP6f) no montados frente a embriones de 3 dpf montados de la Figura 3, adquiridos a 1 fotograma/min. Haga clic aquí para descargar este video.
Vídeo 3: Transitorios de calcio en embriones Tg(krt4:Gal4, UAS:GCaMP6f) x (cdh1-dTomato)xt18 heridos mediante transección con bisturí o ablación láser de la Figura 4, adquiridos a 1 fotograma/min. Haga clic aquí para descargar este video.
Video 4: Imágenes a largo plazo del reclutamiento de leucocitos y la regeneración de la aleta caudal en embriones Tol2(mpx:Dendra2). Abreviaturas: RADISH = Asistente de rotación para la obtención de imágenes Danio de la curación posterior; HPW = horas después de la herida. Haga clic aquí para descargar este video.
Discusión
La premisa central del método de laminación de PET implica la reducción de costos y la minimización de las barreras técnicas de entrada en comparación con los medios tradicionales de creación de dispositivos microfluídicos, como la litografía blanda o el moldeo PDMS. Como tal, los únicos pasos críticos en este protocolo son la alineación precisa de las capas de PET durante la laminación y la impermeabilización de los bordes del dispositivo después de la construcción. Todas las demás partes del método pueden modificarse de acuerdo con las necesidades experimentales (por ejemplo, si se requiere la inmovilización de embriones más jóvenes o mayores, el grosor de las capas de PET se puede ajustar para estrechar o ensanchar el canal en consecuencia). Los diseños se pueden crear en cualquier forma y laminar sobre cualquier material base, siempre que el material sea resistente al calor y lo suficientemente delgado como para ser enviado a través de la laminadora18,27. Dado que las láminas de PET se cortan con cortadores artesanales disponibles en el mercado, que leen archivos de imagen bidimensionales en lugar de tridimensionales, el diseño y la iteración de cualquier dispositivo dado solo requieren la capacidad de manipular formas en blanco y negro en un programa de edición de imágenes, lo que disminuye drásticamente la dificultad. Esta flexibilidad en la elección del software y la disponibilidad comercial de los materiales utilizados representan un aumento dramático en la accesibilidad de los dispositivos microfluídicos en general, lo que permite su uso en cualquier laboratorio o aula por un costo inicial de menos de $ 500 en el momento de escribir este artículo, en comparación con más de $ 2000 en costos iniciales de equipo para la fabricación de moldes PDMS17.
Además, el tiempo necesario para crear un único dispositivo utilizable con este método se reduce drásticamente en comparación con la litografía blanda típica. Suponiendo que esté familiarizado con el software requerido, se puede conceptualizar, fabricar y usar de inmediato un dispositivo microfluídico de laminado PET único en ~ 3 h, incluido el tiempo de curado del cianocrilato. La iteración tarda aún menos, dependiendo de la escala de ediciones necesarias en los archivos de diseño originales, y se pueden hacer múltiples dispositivos variantes en paralelo con un mínimo de tiempo adicional invertido y sin equipo adicional. Aunque los dispositivos creados con este método son menos duraderos que los fabricados con PDMS por una variedad de razones (incluida la falla del adhesivo y las tensiones internas para formas con muchas capas y relaciones de aspecto largas), su naturaleza económica y su fabricación escalable significan que son mucho más fáciles de reemplazar. Dado que los cortadores artesanales comerciales se comercializan con la capacidad de repetir el mismo corte preciso una y otra vez y el PET no tiene fecha de caducidad, las capas individuales de un diseño completo se pueden preparar previamente a granel para su montaje y uso en cualquier momento en el futuro, lo que reduce aún más la inversión total de tiempo requerida.
Sin embargo, la velocidad y la variabilidad tienen el costo de la precisión. La principal limitación de la laminación de PET en comparación con el moldeo PDMS tradicional es la resolución espacial. Los cortadores artesanales comerciales a menudo luchan con ángulos agudos en formas más pequeñas de aproximadamente 500 μm, y las láminas de laminación de PET no están disponibles en espesores inferiores a 33 μm (sin incluir el espesor del adhesivo en sí, que no está incluido en la medición en el paquete), lo que limita significativamente la escala a la que se puede aplicar esta técnica. El número máximo de capas también está restringido por el tamaño de la laminadora, que puede variar de un fabricante a otro.
La versión final del protocolo, incluidas las variaciones en la técnica de registro y alineación, los proveedores de materiales y el software, dependerá en gran medida de las preferencias del usuario. Sin embargo, la accesibilidad del método y la flexibilidad general reducen el costo de adaptación. Se anima a los usuarios individuales a iterar tanto como sea necesario para adaptar el enfoque a sus necesidades únicas.
Divulgaciones
Los autores no tienen conflictos de intereses que revelar.
Agradecimientos
El trabajo fue financiado por fondos de investigación de los Institutos Nacionales de Salud (R35GM119787 a QD). Este trabajo se basa en los esfuerzos apoyados por el Instituto EMBRIO, contrato de la NSF # 2120200, un Instituto de Integración Biológica de la Fundación Nacional de Ciencias (NSF). Las imágenes confocales se realizaron en el Centro de Imágenes de Purdue. Agradecemos al Dr. Guangjun Zhang (Universidad de Purdue) por proporcionar la línea Tg (UAS: GCaMP6f). Agradecemos al Dr. David Tobin (Universidad de Duke) por proporcionar la línea (cdh1-tdtomato)xt18.
Materiales
| Name | Company | Catalog Number | Comments |
| 25 mm diameter round coverglass #1 thickness | Chemglass Life Sciences | CLS-1760-025 | Base mounting material. Thickness was chosen based on the specifications of the microscope lens. |
| Adobe Illustrator v28.5 | Adobe | N/A | Vector editor for designing the device pattern. |
| Calcium Chloride Dihydrate | Fisher | C79 | For making E3 medium. |
| Design PNG Files (Online Mirror) | N/A | N/A | https://i.ibb.co/QPYj7BL/multipositionalv7-1.png https://i.ibb.co/FDpQYXc/multipositionalv7-2.png https://i.ibb.co/5TG4SB6/multipositionalv7-3.png |
| Design Space for Desktop v8.39 | Cricut | N/A | Proprietary software to drive the craft cutter. |
| Fusion Plus 7000L | GBC | 1703098 | Thermal laminator. This specific model was selected for quality of life features, such as maximum sheet stack size. |
| German Carbide Premium Blade | Cricut | 10396595 | Replacement blade for craft cutter. |
| Gray Basic Tool Set | Cricut | 10307854 | Tool set for weeding cuts, cleaning mats, and mounting PET sheets. Optional. |
| Magnesium Chloride Hexahydrate | Acros Organic | 223211000 | For making E3 medium. |
| Maker 3 | Cricut | 10669040 | Craft cutter. The Cricut Maker 3 was selected over the Silhouette Cameo 4 for software user friendliness, but any craft cutter capable of reading black and white images will work. |
| MemGlow 560 | Cytoskeleton | MG02-10 | Red live cell dye for cell membranes. No washing needed. Used in Figure 3. |
| No. 22 Carbon Scalpel Blade | Surgical Design | 22-079-697 | Scalpel blade for manual cut adjustments. Any similar craft knife (e.g., X-acto #2 knife) will also work. |
| Potassium Chloride | Fisher | BP366 | For making E3 medium. |
| Sodium Chloride | Fisher | BP358 | For making E3 medium. |
| StandardGrip Adhesive Cutting Mat | Cricut | 10138842 | Mounting mat for craft cutter. The LightGrip cutting mat will also work, but avoid the StrongGrip and FabricGrip cutting mats as the strength of the adhesive may warp the final cut during weeding and removal. Adhesive on mats will eventually wear out with continued use; replace mats as needed. |
| Stationery Tape 12 mm | Deli | 30014 | Office tape. Deli brand was chosen via testing for ease of removal after lamination. |
| Super glue, liquid | Loctite | 1364076 | Cyanoacrylate glue. Glue used must be liquid. Gel formulations will not sufficiently seal or waterproof device edges. |
| PET Thermal Laminating Pouches, 3 mil | Scotch | TP3854 | PET sheets with thermal adhesive. Sheets arrive as sandwiched pairs and should be separated before use. Cut with adhesive side facing down. |
| PET Thermal Laminating Pouches, 5 mil | Scotch | TP5854 | PET sheets with thermal adhesive. Sheets arrive as sandwiched pairs and should be separated before use. Cut with adhesive side facing down. |
| Tricaine (MS-222) | Syndel | IC10310680 | Fish anaesthetic. |
Referencias
- De Oliveira, S., Rosowski, E. E., Huttenlocher, A. Neutrophil migration in infection and wound repair: going forward in reverse. Nat Rev Immunol. 16 (6), 378-391 (2016).
- Xu, S., Hsiao, T. I., Chisholm, A. D. The wounded worm. Worm. 1 (2), 134-138 (2012).
- Belacortu, Y., Paricio, N. Drosophila as a model of wound healing and tissue regeneration in vertebrates. Dev Dyn. 240 (11), 2379-2404 (2011).
- Yoo, S. K., Freisinger, C. M., LeBert, D. C., Huttenlocher, A. Early redox, Src family kinase, and calcium signaling integrate wound responses and tissue regeneration in zebrafish. J Cell Biol. 199 (2), 225-234 (2012).
- Kawakami, A., Fukazawa, T., Takeda, H. Early fin primordia of zebrafish larvae regenerate by a similar growth control mechanism with adult regeneration. Dev Dyn. 231 (4), 693-699 (2004).
- Gault, W. J., Enyedi, B., Niethammer, P. Osmotic surveillance mediates rapid wound closure through nucleotide release. J Cell Biol. 207 (6), 767-782 (2014).
- Huemer, K., et al. zWEDGI: Wounding and entrapment device for imaging live zebrafish larvae. Zebrafish. 14 (1), 42-50 (2017).
- Kaufmann, A., Mickoleit, M., Weber, M., Huisken, J. Multilayer mounting enables long-term imaging of zebrafish development in a light sheet microscope. Development. 139 (17), 3242-3247 (2012).
- Hirsinger, E., Steventon, B. A versatile mounting method for long term imaging of zebrafish development. J Vis Exp. (119), e55210 (2017).
- Wielhouwer, E. M., et al. Zebrafish embryo development in a microfluidic flow-through system. Lab Chip. 11 (10), 1815-1824 (2011).
- Khalili, A., Rezai, P. Microfluidic devices for embryonic and larval zebrafish studies. Brief Funct Genomics. 18 (6), 419-432 (2019).
- Choudhury, D., et al. Fish and Chips: a microfluidic perfusion platform for monitoring zebrafish development. Lab Chip. 12 (5), 892-900 (2012).
- Zhang, G., et al. An integrated microfluidic system for zebrafish larva organs injection. , 8563-8566 (2017).
- Erickstad, M., Hale, L. A., Chalasani, S. H., Groisman, A. A microfluidic system for studying the behavior of zebrafish larvae under acute hypoxia. Lab Chip. 15 (3), 857-866 (2015).
- Mani, K., Hsieh, Y. C., Panigrahi, B., Chen, C. Y. A noninvasive light driven technique integrated microfluidics for zebrafish larvae transportation. Biomicrofluidics. 12 (2), 021101 (2018).
- Lee, Y., Seo, H. W., Lee, K. J., Jang, J. W., Kim, S. A microfluidic system for stable and continuous EEG monitoring from multiple larval zebrafish. Sensors (Basel). 20 (20), 5903 (2020).
- Sonnen, K. F., Merten, C. A. Microfluidics as an emerging precision tool in developmental biology. Dev Cell. 48 (3), 293-311 (2019).
- Levis, M., et al. Microfluidics on the fly: Inexpensive rapid fabrication of thermally laminated microfluidic devices for live imaging and multimodal perturbations of multicellular systems. Biomicrofluidics. 13 (2), 024111 (2019).
- . E3 medium (for zebrafish embryos). Cold Spring Harbor Protocols. 2011 (10), (2011).
- Matthews, M., Varga, Z. M. Anesthesia and euthanasia in zebrafish. ILAR J. 53 (2), 192-204 (2012).
- Cronan, M. R., Tobin, D. M. Endogenous tagging at the cdh1 locus for live visualization of E-cadherin dynamics. Zebrafish. 16 (3), 324 (2019).
- Thiele, T. R., Donovan, J. C., Baier, H. Descending control of swim posture by a midbrain nucleus in zebrafish. Neuron. 83 (3), 679-691 (2014).
- Yoo, S. K., Huttenlocher, A. Spatiotemporal photolabeling of neutrophil trafficking during inflammation in live zebrafish. J Leukoc Biol. 89 (5), 661-667 (2011).
- Chen, T. W., et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499 (7458), 295-300 (2013).
- Li, L., Yan, B., Shi, Y. -. Q., Zhang, W. -. Q., Wen, Z. -. L. Live imaging reveals differing roles of macrophages and neutrophils during zebrafish tail fin regeneration. J Biol Chem. 287 (30), 25353-25360 (2012).
- Mathias, J. R., et al. Resolution of inflammation by retrograde chemotaxis of neutrophils in transgenic zebrafish. J Leukoc Biol. 80, 1281-1288 (2006).
- Levis, M., Ontiveros, F., Juan, J., Kavanagh, A., Zartman, J. J. Rapid fabrication of custom microfluidic devices for research and educational applications. J Vis Exp. 2019, (2019).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados