Method Article
تصاميم الموائع الدقيقة للتصفيح البولي إيثيلين تيريفثاليت منخفضة التكلفة لتصوير أسماك الزرد متعددة الإرسال
In This Article
Summary
طريقة مبتكرة لتصنيع أجهزة الموائع الدقيقة باستخدام تصفيح البولي إيثيلين تيريفثاليت (PET) تقلل بشكل كبير من تكلفة وتعقيد محاصرة وتصوير أجنة متعددة من أسماك الزرد الحية.
Abstract
أجنة أسماك الزرد شفافة وبالتالي فهي مناسبة بشكل فريد للتصوير غير الجراحي داخل العمليات الأساسية ، مثل التئام الجروح وهجرة الخلايا المناعية. تستخدم أجهزة الموائع الدقيقة للاحتجاز لدعم التصوير طويل الأمد للكائنات متعددة الخلايا ، بما في ذلك أسماك الزرد. ومع ذلك ، فإن تصنيع هذه الأجهزة باستخدام الطباعة الحجرية الناعمة يتطلب مرافق وكفاءة متخصصة في الطباعة ثلاثية الأبعاد ، والتي قد لا تكون في متناول كل مختبر. إن تكيفنا مع طريقة تصفيح البولي إيثيلين تيريفثاليت منخفضة التكلفة المطورة مسبقا لبناء أجهزة الموائع الدقيقة يزيد من إمكانية الوصول من خلال تمكين تصنيع التصميم والتكرار لجزء بسيط من الاستثمار التقني للتقنيات التقليدية. نستخدم جهازا مصنوعا بهذه الطريقة ، وهو المساعد الدوراني لتصوير Danio للشفاء اللاحق (RADISH) ، لاستيعاب العلاج بالعقاقير ، والجرح اليدوي ، والتصوير طويل المدى لما يصل إلى أربعة أجنة في نفس مجال الرؤية. مع هذا التصميم الجديد ، نجحنا في التقاط الخصائص المورفولوجية الإجمالية لإشارة الكالسيوم حول الاستئصال بالليزر وجروح القطع اليدوي لأجنة متعددة في ساعتين مباشرة بعد الإصابة ، بالإضافة إلى تجنيد العدلات على حافة الجرح لمدة 24 ساعة.
Introduction
تعد القدرة على الاستجابة بشكل كاف للإصابة أمرا بالغ الأهمية لبقاء كل كائن حي على كل مقياس ، من خلية واحدة إلى أنسجة متعددة. وبالتالي ، فإن الجرح والاستجابات المرتبطة به ، مثل تجنيد الخلايا البلعمية في المناطق المتضررة1 ، هي موضوعات مهمة في بيولوجيا الخلايا والأنسجة. يتم استشعار الجروح فور اختراق حاجز الأنسجة ، مما يتسبب في استجابة تدرج الأنسجة التي تنطوي على تقلص الجرح2،3 الذي ينسق التئام الجروح وإعادة النمواللاحق 4. نظرا للطبيعة الميكانيكية لهذا الانكماش ، يجب ألا تعيق الأدوات المستخدمة أثناء التجريب حركة الخلايا بالقرب من موقع الإصابة.
تعتبر أجنة الزرد نموذجا ممتازا لدراسة التطور والمرض ، بما في ذلك استجابة الجرح الفقارية ، نظرا لسهولة العناية بها ، وقابليتها للتتبع الجيني ، والشفافية البصرية5،6. ومع ذلك ، فإن شل حركة الكائن الحي بأكمله لفترة طويلة ضروري لدراسة السلوك طويل المدى للخلايا بالقرب من موقع الإصابة. يعد تضمين الأجنة في الاغاروز منخفض الذوبان كافيا للتصوير قصير المدى للأنسجة غير المصابة. ومع ذلك ، فإن مصفوفة الجل المحيطة تقيد تقلص واسترخاء الجروح وتعيق نمو الأجنة النامية بمرور الوقت7،8،9.
يمكن لأجهزة الموائع الدقيقة شل حركة أجنة أسماك الزرد في مراحل نمو مختلفة10،11،12،13،14،15،16 ، وبعضها ، مثل zWEDGI7 ، يستوعب الجرح اليدوي. ومع ذلك ، هناك العديد من العيوب لتصميمات الأجهزة المتاحة. على سبيل المثال ، العديد من الأجهزة المطبوعة مباشرة على البلاستيك غير متوافقة مع التصوير على أنظمة المجهر المقلوب بسبب ضعف الشفافية البصرية. علاوة على ذلك ، تسمح القنوات المتوازية بالتصوير متعدد المواضع10،11 ، لكن الحركة المادية لمرحلة المجهر تقدم تأخرا في الحصول على الصورة. يصعب التكرار المتكرر والتحسين لحل هذه المشكلات عند النظر في الاستثمار المالي والتقني المطلوب لكل تصميم جديد ، خاصة بالنسبة للطرق الحالية القياسية الذهبية لتصنيع الأجهزة باستخدام الطباعة الحجرية الناعمة polydimethylsiloxane (PDMS). غالبا ما تتطلب الخطوة الأولى ، وهي إنشاء قالب رئيسي ، معرفة برامج النمذجة ثلاثية الأبعاد ، والوصول إلى معدات التصنيع المتخصصة ، و (اعتمادا على المواد المستخدمة) معالجة إضافية مضادة للالتصاق مثل السيلان قبل استخدام القالب. تستغرق معالجة PDMS بمجرد سكبها ساعة واحدة على الأقل في درجات حرارة عالية ، وبشكل عام ، يجب أن يتم ذلك تحت فراغ أو بمشبك للحصول على أفضل النتائج ، غالبا في غرفة نظيفة7،17،18. كما هو الحال في علم الأحياء التنموي ، يمكن أن تكون هذه التكاليف باهظة بسرعة للتجارب التي تتطلب العديد من بيئات الموائع الدقيقة الفريدة عبر نماذج متعددة.
من بين مواد البناء البديلة المتاحة ، يعتبر البولي إيثيلين تيريفثاليت (PET) متينا وغير سام وسهل التلاعب. صفائح PET هي أكياس تصفيح بلاستيكية متوفرة على نطاق واسع يتم حملها في معظم متاجر المستلزمات المكتبية ، مع مادة لاصقة منشطة حراريا مطبقة مسبقا (أسيتات فينيل الإيثيلين بشكل عام). من خلال تشكيل صفائح PET هذه باستخدام قواطع حرفية متوفرة تجاريا (أي راسمات القطع التي يتم التحكم فيها بواسطة الكمبيوتر والمصممة للحرفيين المنزليين) ولصق الطبقات ببعضها البعض باستخدام معدات التصفيح الحراري القياسية ، يمكن إنشاء مجموعة واسعة من التصميمات المحتملة وتكرارها بسرعة. لذلك قمنا بتكييف طريقة موصوفة سابقا للتصميم والبناء تتضمن PET18 المكدسة لإنشاء R otational Assistant ل Danio Imaging of Subsequent Healing (RADISH) (الشكل 1 أ ، ب). يعمل الترتيب الدوراني لعدة قنوات تقييد على شكل إسفين تقريبا على تحسين القرب مع إتاحة مساحة لقطع زعنفة الذيل اليدوية ، واستيعاب التصوير مباشرة بعد الجرح والتصوير المتزامن طويل المدى للعديد من أجنة الزرد المصابة في نفس مجال الرؤية. بالإضافة إلى ذلك ، تقلل طريقة البناء هذه بشكل كبير من التكاليف الرأسمالية الأولية والوقت اللازم لبناء الجهاز مع الحفاظ على قابلية إعادة الاستخدام.
Protocol
استخدمت هذه الدراسة أجنة بعد 3 أيام من الإخصاب (dpf) ولكن يمكن تصميمها لاستخدام 2-14 أجنة dpf. أجريت تجربة أسماك الزرد وفقا للمعايير المقبولة دوليا. تمت الموافقة على بروتوكول رعاية واستخدامه من قبل لجنة رعاية واستخدام بوردو (PACUC) ، مع الالتزام بالمبادئ التوجيهية لاستخدام أسماك الزرد في برنامج البحوث الداخلية للمعاهد الوطنية للصحة (رقم البروتوكول: 1401001018).
1. تجميع جهاز الموائع الدقيقة PET
ملاحظة: يمكن إيقاف أي جزء من هذا البروتوكول مؤقتا في أي وقت باستثناء الخطوتين 1.8 و 1.9 ، الحساسة لوقت تجفيف السيانوا أكريلات.
- صمم نمط الجهاز في البرنامج الذي تختاره (على سبيل المثال ، Adobe Illustrator ، الشكل 1 أ). اعتمادا على عمر الجنين وحجمه ، اضبط عرض القناة وحجم غرفة التصوير المركزية للحصول على أفضل ملاءمة.
- احفظ كل طبقة كملف صورة فردي بأبعاد متطابقة. قم بتسمية كل ملف بحيث يكون سمك الورقة المراد استخدامها وترتيب التجميع واضحا.
- قم بتهيئة آلة القطع وفقا لتعليمات الشركة المصنعة.
- قم بتحميل كل نمط مصمم إلى برنامج التصميم للقطع.
- في مساحة عمل التصميم، حدد التصميمات التي تم تحميلها حديثا. أنماط المجموعة المخصصة لنفس سمك لوح PET معا في نفس القطع (الشكل 2 أ). إذا لزم الأمر ، أعد ضبط حجم الأنماط في برنامج التصميم على الأبعاد الصحيحة.
- قم بتأكيد عدد ونوع الأنماط في القطع ، ثم حدد المادة المقطوعة.
ملاحظة: قد لا تكون صفائح PET خيارا ماديا في برنامج التصميم ، بما في ذلك تحت أسماء مثل "كيس الترقق البلاستيكي". يمكن اختيار أي مادة ذات سمك وملمس متشابهين (على سبيل المثال ، صفائح شفافة أو فينيل غير لاصق) بدلا من ذلك. - قم بتوصيل صفائح PET ببساط القطع ، واضغط بقوة لإزالة فقاعات الهواء ، وقم بتحميل السجادة في آلة القطع. اتبع التعليمات التي تظهر على الشاشة لمطالبة آلة القطع ببدء القطع.
- قم بإزالة الجروح النهائية من حصيرة القطع. إذا لزم الأمر ، اضبط أنماط القطع باستخدام سكين حرفي أو شفرة مشرط.
ملاحظة: تتوفر ملفات الصور المستخدمة لإنشاء تصميم RADISH (الشكل 1A) للتنزيل كتنسيقات ملفات متجهة وملفات PNG (ملف تكميلي 1). إذا كانت آلة القطع ترفع أو تمزق أو تفشل في القطع بشكل نظيف من خلال لوح PET ، ففكر في استبدال حصيرة القطع.
- قم بمحاذاة الطبقات على زجاج الغطاء ، بدون مساعدة أو بعلامات تسجيل مقطوعة مسبقا. إذا كان من الممكن تثبيت طبقات متعددة في مكانها معا قبل التصفيح ، فقم بمحاذاة ذلك في وقت واحد.
- قم بتأمين الطبقات بشريط مكتبي لتجنب التحول أثناء التصفيح (الشكل 2 ب). اعتمادا على حجم الجهاز وسعة آلة تغليف ، قم بتركيب تصميمات صغيرة على دعامة أكبر مع المزيد من الشريط لتجنب التشويش أو انسداد تغذية آلة تغليف (الشكل 2C).
ملاحظة: الدعامة المستخدمة في التصفيح ليست هي نفسها حصيرة القطع ، وتعمل بشكل أساسي على توفير الجر لآلة التغليف. ستعمل أي مادة مقاومة للحرارة بسماكة ضئيلة كدعم (بما في ذلك ، على سبيل المثال لا الحصر ، البطاقات أو ورق المكتب المطوي أو ورقة PET الأكبر). - قم بتشغيل آلة تغليف وصفح وفقا لتعليمات الشركة المصنعة. قم بإزالة شريط المكتب قبل محاذاة الطبقة التالية (الشكل 2 د).
- كرر الخطوات من 1.4 إلى 1.6 حتى يتم الالتزام بجميع الطبقات.
- قم بتأمين الجهاز في طبق 35 مم محفور بفتحة 3/4 بوصة باستخدام غراء سيانواكريليت (الشكل 2E ، F). اضبط شكل ونوع الطبق وفقا للاحتياجات التجريبية (على سبيل المثال ، أي حاوية كبيرة بما يكفي لاستيعاب الجهاز - بئر واحد في طبق 24 بئرا أو طبق بتري أكبر). استخدم ما يكفي من الغراء لإغلاق الجهاز بالكامل بالطبق دون إغراقه.
ملاحظة: لا يلزم تثبيت الجهاز في طبق التثبيت لوظيفة الجهاز. تنبيه: يربط السيانواكريلات الجلد والعينين في ثوان ويهيج الجهاز التنفسي والعينين والجلد. ارتد واقيا لليدين والعين واعمل في منطقة جيدة التهوية. - قم بمقاومة صفائح PET عن طريق طلاء حواف الجهاز الخارجية تماما بغراء سيانواكريليت (الشكل 2F). استخدم ما يكفي من الغراء لتغطية الحواف الخارجية بالكامل. اترك الغراء يشفى لمدة 2 ساعة على الأقل قبل الاستخدام.
ملاحظة: تأكد من وجود مساحة كافية لتنفيس أبخرة سيانواكريلات. قد يتسبب تراكم الأبخرة في ترسب السيانواكريلات على الجهاز ، مما يحجب المواد الشفافة بصريا.
2. وضع الأجنة داخل الفجل والتحضير للتصوير
- قم بتربية أجنة الزرد في وسط تربية الأجنة القياسي E319. إذا لزم الأمر ، قم بإزالة الأجنة قبل ساعة واحدة على الأقل من التصوير للسماح لها بالتسطيح. استخدمت هذه التجربة أجنة عند 3 dpf ، ولكن يمكن أن تصل الأجنة إلى 14 نقطة في الدقيقة (الشكل 1E).
- تلطيخ الأجنة أو علاجها وفقا للاحتياجات التجريبية.
ملاحظة: في هذه التجارب ، تم تلطيخ أغشية الخلايا في الطبقة الظهارية الخارجية عند الاقتضاء عن طريق الحضانة ب 100 نانومتر MemGlow 560. - تخدير الأجنة باستخدام 164 مجم / لتر MS-22220.
ملاحظة: يمكن تعديل التركيز الدقيق والتخدير المستخدم وفقا لتفضيل المجريب. يمكن تقليل تركيز التخدير للسماح بالتطور الناجح أثناء الصور طويلة المدى (انظر الخطوة 4.1). - املأ طبق التثبيت الذي يحتوي على الجهاز المركب ب 5 مل من E3 يحتوي على 164 مجم / لتر MS-222.
- باستخدام ماصة النقل، قم بإيداع جنين مخدر واحد في كل غرفة احتجاز بالجهاز. تأكد من بقاء الأجنة مغمورة في السائل طوال مدة التصوير.
ملاحظة: يمكن لتصميم الفجل أن يشل حركة 1-4 أجنة. - باستخدام حلقة الشعر ، قم بتوجيه الأجنة بحيث يبرز ذيل الجنين في غرفة التصوير المركزية ويتم تثبيت صفار البيض بشكل آمن في القناة على شكل إسفين (الشكل 1 ج).
ملاحظة: يمكن إجراء توجيه الأجنة تحت مجهر مجسم لسهولة التلاعب. - إذا رغبت في ذلك ، قم بتأمين رأس الجنين عن طريق إضافة 1.5٪ من الاغاروز منخفض الذوبان في غرفة الاحتجاز باستخدام ماصة دقيقة.
- انقل الجهاز مع الأجنة إلى نظام التصوير المفضل لبدء التصوير.
3. تصوير عابرات الكالسيوم بعد الجرح
ملاحظة: هذا القسم والقسم 4 اختياريان ويتم توفيرهما كتجارب نموذجية محتملة.
- حدد النظام والهدف المناسبين للتصوير.
ملاحظة: هنا ، تم تجهيز المسح الضوئي بالليزر المقلوب متحدي البؤر بهدف 20x. - اضبط تركيز العينة ومعلمات التصوير (على سبيل المثال، طاقة الليزر: 5، الكسب: 90، حجم الثقب: 2 وحدة فلكية، وقت التعرض [سرعة المسح: 1 إطار/ثانية]) للحصول على نسبة الإشارة إلى الضوضاء المثلى وسرعة الاستحواذ.
ملاحظة: يوصى بالتركيز المسبق على العينات وتعديل المعلمات لكل قناة على نظام التصوير المفضل قبل الجرح لتقليل الفجوة بين تكوين الجرح والحصول على الصورة. - جرح Tg (krt4: Gal4 ، UAS: GCaMP6f) × (cdh1-dTomato) xt1821،22 جنين.
- لجرح الجنين عن طريق القطع اليدوي ، قم بالضغط بشفرة مشرط عبر أنسجة زعنفة الذيل عند طرف الحبل الظهري تحت مجهر مجسم (فيديو 1) ، ثم أعد الجهاز إلى المسرح.
تنبيه: يمكن أن يؤدي الضغط المفرط بشفرة المشرط إلى كسر الزجاج الأساسي. في حالة تشقق الزجاج ، تخلص من الجهاز وأعد تشغيله من الخطوة 1.2. - لجرح الجنين عن طريق التحفيز بالليزر ، حدد منطقة الاهتمام (ROI) بالقرب من حافة طية زعنفة الذيل وتحفز وفقا لقوة الليزر المتاحة.
ملاحظة: هنا ، كانت قوة الليزر البالغة 2.4 واط لمدة 30 ثانية عند 800 نانومتر كافية لإحداث جرح كامل السماكة.
- لجرح الجنين عن طريق القطع اليدوي ، قم بالضغط بشفرة مشرط عبر أنسجة زعنفة الذيل عند طرف الحبل الظهري تحت مجهر مجسم (فيديو 1) ، ثم أعد الجهاز إلى المسرح.
- صورة في درجة حرارة الغرفة باستخدام قنوات GFP (الإثارة 488 نانومتر، الانبعاث 510 نانومتر) وقنوات RFP (الإثارة 561 نانومتر، الإرسال 610 نانومتر) باستخدام فاصل رتل مدته دقيقة واحدة ليصبح المجموع 1 ساعة.
- (اختياري): إذا لزم الأمر، حرر الأجنة لاسترجاعها بعد التصوير عن طريق الشفط اللطيف بالقرب من الرأس باستخدام ماصة النقل أو تحريك الطبق.
4. تصوير تجنيد العدلات بعد الجرح
- قبل ساعة واحدة على الأقل من التصوير ، قم بنقل الأجنة إلى E3 التي تحتوي على نصف التركيز القياسي للتخدير ، في هذه الحالة ، 82 مجم / لتر MS-222.
- حدد الهدف المناسب للتصوير (هنا ، مسح ليزر مقلوب متحد البؤر مزود بهدف 10x).
- اضبط تركيز العينة ومعلمات التصوير (على سبيل المثال، طاقة الليزر: 5، الكسب: 90، حجم الثقب: 2 وحدة فلكية، وقت التعريض الضوئي [سرعة المسح: 0.5 إطار/ثانية])) للحصول على نسبة الإشارة إلى الضوضاء المثلى وسرعة الاستحواذ.
ملاحظة: يوصى بالتركيز المسبق على العينات وتعديل المعلمات لكل قناة على نظام التصوير المفضل قبل الجرح لتقليل الفجوة بين تكوين الجرح والحصول على الصورة. - جرح أربعة أجنة Tol2 (mpx: Dendra2) 23 عن طريق القطع اليدوي عن طريق الضغط بشفرة مشرط عبر أنسجة زعنفة الذيل تحت مجهر مجسم ، ثم أعد الجهاز إلى المسرح.
- التقط الصورة على قناة GFP (الإثارة 488 نانومتر، البث 510 نانومتر) في درجة حرارة الغرفة باستخدام فاصل إطار مدته 5 دقائق لمدة 24 ساعة.
- إذا لزم الأمر ، حرر الأجنة لاسترجاعها بعد التصوير عن طريق الشفط اللطيف بالقرب من الرأس باستخدام ماصة نقل أو تحريك الطبق.
النتائج
لمقارنة جودة الصورة التي ينتجها المسح الضوئي بالليزر متحد البؤر بمساعدة الفجل وبدونه، تم تلطيخ الأجنة التي تعبر عن المستشعر الحيوي للكالسيوم المكثف GCaMP6f22،24 في الطبقة الظهارية الخارجية باستخدام MemGlow 560 وتم تصويرها باستخدام مسح ليزر مقلوب متحدي البؤر يغطي سمك طية زعنفة الذيل بالكامل في فاصل زمني قدره 1 دقيقة لكل إطار (فيديو 2). بدون الجهاز (الشكل 3 أ) ، انجرفت العينات بشكل كبير وعرضت القطع الأثرية للنطاقات ، الناتجة عن الحد من مكدس Z إلى 25 شريحة لتلائم الدقة الزمنية المحددة مقارنة بالتصوير باستخدام الجهاز (الشكل 3 ب). تم استخدام الفجل أيضا لفحص عابرات الكالسيوم مباشرة بعد الجرح في الأجنة التي تعبر عن Tg (krt4: Gal4 ، UAS: GCaMP6f) x (cdh1-dTomato) xt1821 ، مما يسلط الضوء على E-cadherin الداخلي باللون الأحمر والكالسيوم السيتوبلازمي في الظهارة القمية باللون الأخضر. تم إصابة الأجنة بالتوازي مع جوانب الغرفة المركزية باستخدام شفرة مشرط (الشكل 4 أ والفيديو 3) أو عن طريق الاستئصال المباشر بالليزر باستخدام ليزر الأشعة تحت الحمراء (الشكل 4 ب) ، ثم تم تصويرها من خلال السماكة الكاملة لطية زعنفة الذيل.
لإثبات فعالية الفجل للتصوير على المدى الطويل ، قمنا بالتحقيق في تجنيد الخلايا المناعية على حافة الجرح لمدة 24 ساعة بعد الجرح. أصيبت أربعة أجنة من أسماك الزرد عند 3 dpf تعبر عن Tol2 (mpx: Dendra2) لتسمية العدلات باللون الأخضر23 بجروح عن طريق قطع الذيل وتم تصويرها لمدة 24 ساعة متتالية (الشكل 5). كانت القطع الأثرية التصويرية المرتبطة عادة بأجنة متأخرة من 3 إلى 4 dpf ، مثل الإمالة والعائمة ، غائبة بشكل ملحوظ (فيديو 4) ، واستمرت إعادة نمو الأنسجة دون عوائق للتجربة. يستمر تجنيد العدلات على حافة الجرح في جميع أنحاء الصورة (الشكل 5 ب) ، حيث تغادر معظم الخلايا المهاجرة بعد 24 ساعة من الجرح (الشكل 5 ج) ، بما يتفق مع دقة الالتهاب المتوقعة25،26.

الشكل 1: تصميم واستخدام جهاز الموائع الدقيقة الخشبية PET (RADISH). (أ) تخطيطي يوضح ترتيب طبقات PET الفردية وسمكها وتجميعها وتركيب الجهاز واستخدامه. (ب) المنتج النهائي ، مركب في فتحة 3/4 بوصة في طبق 35 مم. (ج) 3 أجنة dpf ، (د) 5 أجنة dpf ، (ه) 14 جنين dpf موجود داخل الجهاز. أشرطة المقياس = 1,000 ميكرومتر (C ، D ، E). الاختصارات: PET = البولي إيثيلين تيريفثاليت. الفجل = مساعد دوراني لتصوير دانيو للشفاء اللاحق ؛ DPF = أيام بعد الإخصاب. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: رسم توضيحي فوتوغرافي خطوة بخطوة لتجميع جهاز PET. (أ) طبقات PET الفردية قبل التصفيح. (ب) طبقة PET مثبتة على غطاء 25 مم باستخدام شريط مكتبي. (ج) الجهاز قيد الإنشاء المثبت على دعامة بلاستيكية للتصفيح. (د) اكتمل جهاز صفح PET. (ه) طبق معدل مقاس 35 مم قبل تركيب الجهاز. (و) الجهاز المكتمل. اختصار: PET = البولي إيثيلين تيريفثاليت. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: تحسين جودة الصور متحدة البؤر للمسح الضوئي بالليزر ل 3 أجنة dpf في تصميم الفجل. (أ) صورة تمثيلية ل 3 dpf Tg (krt4: Gal4 ، UAS: GCaMP6f) الجنين الملطخ ب MemGlow 560 دون استخدام الفجل. (ب) صورة تمثيلية لجنين Tg (krt4: Gal4 ، UAS: GCaMP6f) ملطخ ب MemGlow 560 المثبت في الفجل. شريط المقياس = 100 ميكرومتر. الاختصارات: الفجل = مساعد دوراني لتصوير دانيو للشفاء اللاحق ؛ DPF = أيام بعد الإخصاب. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
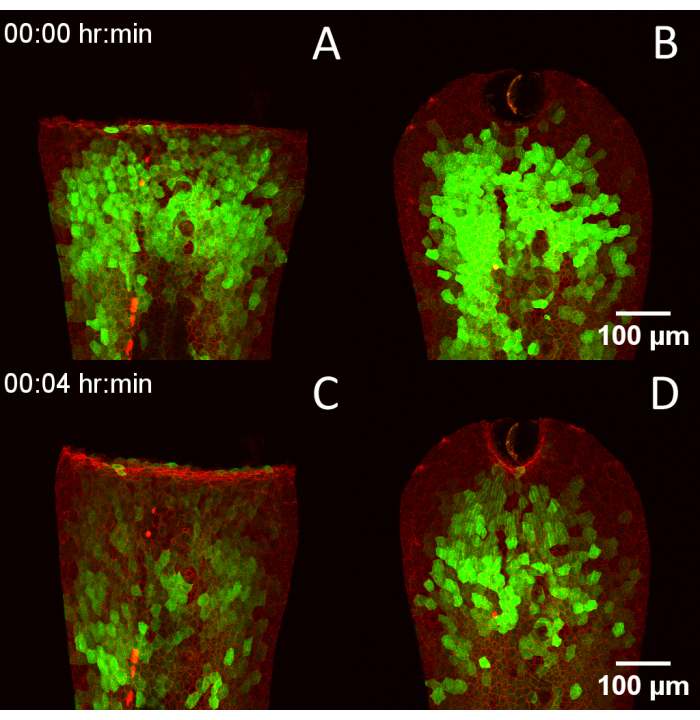
الشكل 4: توافق تصميم الفجل مع تقنيات الجرح المتعددة. (أ) 3 dpf Tg (krt4: Gal4 ، UAS: GCaMP6f) x (cdh1-dTomato) xt18 جرح جنين عن طريق القطع اليدوي لزعنفة الذيل. (ب) الجنين المصاب عن طريق الاستئصال بالليزر. (ج، د) نفس الأجنة بعد 4 دقائق ، تظهر تطور عابرات الكالسيوم بعد الجرح. أشرطة المقياس = 100 ميكرومتر. الاختصارات: الفجل = مساعد دوراني لتصوير دانيو للشفاء اللاحق ؛ DPF = أيام بعد الإخصاب. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 5: محاصرة الأجنة على المدى الطويل لتصوير هجرة البلعمة. (أ) أ) Tol2 (mpx: Dendra2) الأجنة مباشرة بعد الجرح ، ونفس الأجنة (ب) 25 دقيقة ، (ج) 12 ساعة ، و (د) بعد 24 ساعة. أشرطة المقياس = 100 ميكرومتر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
الملف التكميلي 1: ملفات المتجهات و PNG لتصميم جهاز RADISH كما هو موضح في الشكل 1 أ. الرجاء النقر هنا لتنزيل هذا الملف.
فيديو 1: فيديو Brightfield لمقطع يدوي لزعانف الذيل باستخدام تصميم جهاز RADISH. اختصار: RADIDISH = مساعد دوراني لتصوير Danio للشفاء اللاحق. الرجاء النقر هنا لتنزيل هذا الفيديو.
الفيديو 2: مقارنة بين الأجنة غير المثبتة مقابل 3 dpf Tg (krt4: Gal4 ، UAS: GCaMP6f) من الشكل 3 ، المكتسبة بمعدل 1 إطار / دقيقة. الرجاء النقر هنا لتنزيل هذا الفيديو.
فيديو 3: عابرات الكالسيوم في أجنة Tg (krt4: Gal4 ، UAS: GCaMP6f) x (cdh1-dTomato) xt18 الجرحى عن طريق قطع المشرط أو الاستئصال بالليزر من الشكل 4 ، تم الحصول عليها بمعدل 1 إطار / دقيقة. الرجاء النقر هنا لتنزيل هذا الفيديو.
فيديو 4: تصوير طويل الأمد لتجنيد الكريات البيض وتجديد زعانف الذيل في أجنة Tol2 (mpx: Dendra2). الاختصارات: الفجل = مساعد دوراني لتصوير دانيو للشفاء اللاحق ؛ HPW = ساعات بعد الجرح. الرجاء النقر هنا لتنزيل هذا الفيديو.
Discussion
تتضمن الفرضية الأساسية لطريقة تصفيح PET تقليل التكلفة وتقليل الحواجز التقنية أمام الدخول مقارنة بالوسائل التقليدية لإنشاء أجهزة الموائع الدقيقة ، مثل الطباعة الحجرية الناعمة أو قولبة PDMS. على هذا النحو ، فإن الخطوات الحاسمة الوحيدة في هذا البروتوكول هي المحاذاة الدقيقة لطبقات PET أثناء التصفيح والعزل المائي لحواف الجهاز بعد البناء. يمكن تعديل جميع الأجزاء الأخرى من الطريقة وفقا للاحتياجات التجريبية (على سبيل المثال ، إذا كان تثبيت الأجنة الأصغر سنا أو الأكبر سنا مطلوبا ، فيمكن تعديل سمك طبقات PET لتضييق أو توسيع القناة وفقا لذلك). يمكن إنشاء التصميمات بأي شكل وتصفيرها على أي مادة أساسية طالما أن المادة آمنة للحرارة ورقيقة بما يكفي لإرسالها عبر آلة تغليف18،27. نظرا لأن أوراق PET يتم قصها باستخدام قواطع حرفية متوفرة تجاريا ، والتي تقرأ ملفات الصور ثنائية الأبعاد بدلا من ملفات الصور ثلاثية الأبعاد ، فإن تصميم وتكرار أي جهاز معين لا يتطلب سوى القدرة على معالجة الأشكال بالأبيض والأسود في برنامج تحرير الصور ، مما يقلل بشكل كبير من الصعوبة. تمثل هذه المرونة في اختيار البرامج والتوافر التجاري للمواد المستخدمة زيادة كبيرة في إمكانية الوصول إلى أجهزة الموائع الدقيقة بشكل عام ، مما يتيح استخدامها في أي مختبر أو فصل دراسي بتكلفة أولية أقل من 500 دولار في وقت كتابة هذه الورقة ، مقارنة بأكثر من 2000 دولار في تكاليف المعدات الأولية لتصنيع قوالب PDMS17.
علاوة على ذلك ، يتم تقليل الوقت اللازم لإنشاء جهاز واحد قابل للاستخدام باستخدام هذه الطريقة بشكل كبير مقارنة بالطباعة الحجرية اللينة النموذجية. بافتراض الإلمام بالبرنامج المطلوب ، يمكن تصور جهاز واحد فريد من نوعه من الموائع الدقيقة الخشبية PET وتصنيعه واستخدامه على الفور في ~ 3 ساعات ، بما في ذلك وقت معالجة السيانواكريلات. يستغرق التكرار أقل ، اعتمادا على حجم التعديلات اللازمة لملفات التصميم الأصلية ، ويمكن إجراء أجهزة متغيرة متعددة بالتوازي مع الحد الأدنى من الوقت الإضافي المستثمر وعدم وجود معدات إضافية. على الرغم من أن الأجهزة التي تم إنشاؤها باستخدام هذه الطريقة أقل متانة من تلك المصنوعة باستخدام PDMS لمجموعة متنوعة من الأسباب (بما في ذلك فشل المادة اللاصقة والضغوط الداخلية للأشكال ذات الطبقات العديدة ونسب العرض إلى الارتفاع الطويلة) ، إلا أن طبيعتها الرخيصة وتصنيعها القابل للتطوير تعني أنه يمكن استبدالها بسهولة أكبر. نظرا لأن قواطع الحرف التجارية يتم تسويقها مع القدرة على تكرار نفس القطع الدقيق مرارا وتكرارا ولا يوجد تاريخ انتهاء صلاحية ل PET ، يمكن تحضير الطبقات الفردية للتصميم المكتمل مسبقا بكميات كبيرة للتجميع والاستخدام في أي وقت في المستقبل ، مما يقلل من استثمار الوقت الإجمالي المطلوب.
ومع ذلك ، فإن السرعة والتباين يأتيان على حساب الدقة. القيد الرئيسي لتصفيح PET مقارنة بقولبة PDMS التقليدية هو الدقة المكانية. غالبا ما تكافح قواطع الحرف التجارية مع زوايا حادة على أشكال أصغر من حوالي 500 ميكرومتر ، ولا تتوفر صفائح التصفيح PET بسماكات أقل من 33 ميكرومتر (لا تشمل سمك المادة اللاصقة نفسها ، والتي لا يتم تضمينها في القياس على العبوة) ، مما يحد بشكل كبير من المقياس الذي يمكن تطبيق هذه التقنية به. يتم تقييد الحد الأقصى لعدد الطبقات أيضا بحجم آلة تغليف ، والتي قد تختلف من مصنع لآخر.
ستعتمد النسخة النهائية من البروتوكول ، بما في ذلك الاختلافات في تقنية التسجيل والمحاذاة وموردي المواد والبرمجيات ، إلى حد كبير على تفضيل المستخدم. ومع ذلك ، فإن إمكانية الوصول إلى الطريقة والمرونة الإجمالية تقلل من تكلفة التكيف. يتم تشجيع المستخدمين الفرديين على التكرار بقدر ما هو ضروري لتكييف النهج مع احتياجاتهم الفريدة.
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح للإفصاح عنه.
Acknowledgements
تم دعم العمل بتمويل بحثي من المعاهد الوطنية للصحة (R35GM119787 إلى QD). يعتمد هذا العمل على الجهود التي يدعمها معهد EMBRIO ، عقد NSF # 2120200 ، معهد تكامل الأحياء التابع لمؤسسة العلوم الوطنية (NSF). تم إجراء التصوير متحد البؤر في مرفق بوردو للتصوير. نشكر الدكتور قوانغجون تشانغ (جامعة بوردو) على توفير خط Tg (UAS: GCaMP6f). نشكر الدكتور ديفيد توبين (جامعة ديوك) على توفير خط (cdh1-tdtomato) xt18.
Materials
| Name | Company | Catalog Number | Comments |
| 25 mm diameter round coverglass #1 thickness | Chemglass Life Sciences | CLS-1760-025 | Base mounting material. Thickness was chosen based on the specifications of the microscope lens. |
| Adobe Illustrator v28.5 | Adobe | N/A | Vector editor for designing the device pattern. |
| Calcium Chloride Dihydrate | Fisher | C79 | For making E3 medium. |
| Design PNG Files (Online Mirror) | N/A | N/A | https://i.ibb.co/QPYj7BL/multipositionalv7-1.png https://i.ibb.co/FDpQYXc/multipositionalv7-2.png https://i.ibb.co/5TG4SB6/multipositionalv7-3.png |
| Design Space for Desktop v8.39 | Cricut | N/A | Proprietary software to drive the craft cutter. |
| Fusion Plus 7000L | GBC | 1703098 | Thermal laminator. This specific model was selected for quality of life features, such as maximum sheet stack size. |
| German Carbide Premium Blade | Cricut | 10396595 | Replacement blade for craft cutter. |
| Gray Basic Tool Set | Cricut | 10307854 | Tool set for weeding cuts, cleaning mats, and mounting PET sheets. Optional. |
| Magnesium Chloride Hexahydrate | Acros Organic | 223211000 | For making E3 medium. |
| Maker 3 | Cricut | 10669040 | Craft cutter. The Cricut Maker 3 was selected over the Silhouette Cameo 4 for software user friendliness, but any craft cutter capable of reading black and white images will work. |
| MemGlow 560 | Cytoskeleton | MG02-10 | Red live cell dye for cell membranes. No washing needed. Used in Figure 3. |
| No. 22 Carbon Scalpel Blade | Surgical Design | 22-079-697 | Scalpel blade for manual cut adjustments. Any similar craft knife (e.g., X-acto #2 knife) will also work. |
| Potassium Chloride | Fisher | BP366 | For making E3 medium. |
| Sodium Chloride | Fisher | BP358 | For making E3 medium. |
| StandardGrip Adhesive Cutting Mat | Cricut | 10138842 | Mounting mat for craft cutter. The LightGrip cutting mat will also work, but avoid the StrongGrip and FabricGrip cutting mats as the strength of the adhesive may warp the final cut during weeding and removal. Adhesive on mats will eventually wear out with continued use; replace mats as needed. |
| Stationery Tape 12 mm | Deli | 30014 | Office tape. Deli brand was chosen via testing for ease of removal after lamination. |
| Super glue, liquid | Loctite | 1364076 | Cyanoacrylate glue. Glue used must be liquid. Gel formulations will not sufficiently seal or waterproof device edges. |
| PET Thermal Laminating Pouches, 3 mil | Scotch | TP3854 | PET sheets with thermal adhesive. Sheets arrive as sandwiched pairs and should be separated before use. Cut with adhesive side facing down. |
| PET Thermal Laminating Pouches, 5 mil | Scotch | TP5854 | PET sheets with thermal adhesive. Sheets arrive as sandwiched pairs and should be separated before use. Cut with adhesive side facing down. |
| Tricaine (MS-222) | Syndel | IC10310680 | Fish anaesthetic. |
References
- De Oliveira, S., Rosowski, E. E., Huttenlocher, A. Neutrophil migration in infection and wound repair: going forward in reverse. Nat Rev Immunol. 16 (6), 378-391 (2016).
- Xu, S., Hsiao, T. I., Chisholm, A. D. The wounded worm. Worm. 1 (2), 134-138 (2012).
- Belacortu, Y., Paricio, N. Drosophila as a model of wound healing and tissue regeneration in vertebrates. Dev Dyn. 240 (11), 2379-2404 (2011).
- Yoo, S. K., Freisinger, C. M., LeBert, D. C., Huttenlocher, A. Early redox, Src family kinase, and calcium signaling integrate wound responses and tissue regeneration in zebrafish. J Cell Biol. 199 (2), 225-234 (2012).
- Kawakami, A., Fukazawa, T., Takeda, H. Early fin primordia of zebrafish larvae regenerate by a similar growth control mechanism with adult regeneration. Dev Dyn. 231 (4), 693-699 (2004).
- Gault, W. J., Enyedi, B., Niethammer, P. Osmotic surveillance mediates rapid wound closure through nucleotide release. J Cell Biol. 207 (6), 767-782 (2014).
- Huemer, K., et al. zWEDGI: Wounding and entrapment device for imaging live zebrafish larvae. Zebrafish. 14 (1), 42-50 (2017).
- Kaufmann, A., Mickoleit, M., Weber, M., Huisken, J. Multilayer mounting enables long-term imaging of zebrafish development in a light sheet microscope. Development. 139 (17), 3242-3247 (2012).
- Hirsinger, E., Steventon, B. A versatile mounting method for long term imaging of zebrafish development. J Vis Exp. (119), e55210 (2017).
- Wielhouwer, E. M., et al. Zebrafish embryo development in a microfluidic flow-through system. Lab Chip. 11 (10), 1815-1824 (2011).
- Khalili, A., Rezai, P. Microfluidic devices for embryonic and larval zebrafish studies. Brief Funct Genomics. 18 (6), 419-432 (2019).
- Choudhury, D., et al. Fish and Chips: a microfluidic perfusion platform for monitoring zebrafish development. Lab Chip. 12 (5), 892-900 (2012).
- Zhang, G., et al. An integrated microfluidic system for zebrafish larva organs injection. , 8563-8566 (2017).
- Erickstad, M., Hale, L. A., Chalasani, S. H., Groisman, A. A microfluidic system for studying the behavior of zebrafish larvae under acute hypoxia. Lab Chip. 15 (3), 857-866 (2015).
- Mani, K., Hsieh, Y. C., Panigrahi, B., Chen, C. Y. A noninvasive light driven technique integrated microfluidics for zebrafish larvae transportation. Biomicrofluidics. 12 (2), 021101 (2018).
- Lee, Y., Seo, H. W., Lee, K. J., Jang, J. W., Kim, S. A microfluidic system for stable and continuous EEG monitoring from multiple larval zebrafish. Sensors (Basel). 20 (20), 5903 (2020).
- Sonnen, K. F., Merten, C. A. Microfluidics as an emerging precision tool in developmental biology. Dev Cell. 48 (3), 293-311 (2019).
- Levis, M., et al. Microfluidics on the fly: Inexpensive rapid fabrication of thermally laminated microfluidic devices for live imaging and multimodal perturbations of multicellular systems. Biomicrofluidics. 13 (2), 024111 (2019).
- . E3 medium (for zebrafish embryos). Cold Spring Harbor Protocols. 2011 (10), (2011).
- Matthews, M., Varga, Z. M. Anesthesia and euthanasia in zebrafish. ILAR J. 53 (2), 192-204 (2012).
- Cronan, M. R., Tobin, D. M. Endogenous tagging at the cdh1 locus for live visualization of E-cadherin dynamics. Zebrafish. 16 (3), 324 (2019).
- Thiele, T. R., Donovan, J. C., Baier, H. Descending control of swim posture by a midbrain nucleus in zebrafish. Neuron. 83 (3), 679-691 (2014).
- Yoo, S. K., Huttenlocher, A. Spatiotemporal photolabeling of neutrophil trafficking during inflammation in live zebrafish. J Leukoc Biol. 89 (5), 661-667 (2011).
- Chen, T. W., et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499 (7458), 295-300 (2013).
- Li, L., Yan, B., Shi, Y. -. Q., Zhang, W. -. Q., Wen, Z. -. L. Live imaging reveals differing roles of macrophages and neutrophils during zebrafish tail fin regeneration. J Biol Chem. 287 (30), 25353-25360 (2012).
- Mathias, J. R., et al. Resolution of inflammation by retrograde chemotaxis of neutrophils in transgenic zebrafish. J Leukoc Biol. 80, 1281-1288 (2006).
- Levis, M., Ontiveros, F., Juan, J., Kavanagh, A., Zartman, J. J. Rapid fabrication of custom microfluidic devices for research and educational applications. J Vis Exp. 2019, (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved