Method Article
Недорогие микрофлюидные конструкции для ламинирования полиэтилентерефталата для мультиплексной визуализации рыбок данио-рерио
В этой статье
Резюме
Инновационный метод изготовления микрофлюидных устройств с использованием полиэтилентерефталата (ПЭТ) значительно снижает стоимость и сложность захвата и визуализации нескольких живых эмбрионов рыбок данио.
Аннотация
Эмбрионы рыбок данио прозрачны и, таким образом, уникально подходят для неинвазивной прижизненной визуализации фундаментальных процессов, таких как заживление ран и миграция иммунных клеток. Микрофлюидные устройства используются для захвата для поддержки долгосрочной визуализации многоклеточных организмов, включая рыбок данио. Тем не менее, изготовление этих устройств с использованием мягкой литографии требует специализированного оборудования и компетенций в области 3D-печати, которые могут быть доступны не каждой лаборатории. Наша адаптация ранее разработанного недорогого метода ламинирования полиэтилентерефталата для создания микрофлюидных устройств повышает доступность, позволяя проектировать, изготавливать и итерировать за небольшую часть технических инвестиций по сравнению с традиционными методами. Мы используем устройство, изготовленное с помощью этого метода, Rotational Assistant for Danio Imaging of Subsequent Healing (RADISH), для медикаментозного лечения, мануального ранения и долгосрочной визуализации до четырех эмбрионов в одном поле зрения. С помощью этой новой конструкции мы успешно фиксируем общие морфологические характеристики кальциевого сигнала вокруг лазерной абляции и ручного рассечения ран для множественных эмбрионов в течение 2 часов сразу после травмы, а также рекрутирование нейтрофилов к краю раны в течение 24 часов.
Введение
Способность адекватно реагировать на травмы имеет решающее значение для выживания каждого организма в любом масштабе, от одной клетки до нескольких тканей. Таким образом, ранение и связанные с ним реакции, такие как рекрутирование фагоцитов вповрежденные участки1, являются важными темами в клеточной и тканевой биологии. Раны ощущаются сразу после прорыва тканевого барьера, вызывая тканевый градиентный ответ, включающий сокращение раны 2,3, который координирует заживление раны и последующий повторный рост4. Из-за механической природы этого сокращения, инструменты, используемые во время эксперимента, не должны физически препятствовать движению клеток вблизи места повреждения.
Эмбрионы рыбок данио являются отличной моделью для изучения развития и заболеваний, включая реакцию на раны позвоночных, благодаря их простоте в уходе, генетической податливости и оптической прозрачности 5,6. Тем не менее, иммобилизация всего организма в течение длительного периода времени необходима для изучения долгосрочного поведения клеток вблизи места повреждения. Встраивание эмбрионов в низкоплавкую агарозу достаточно для кратковременной визуализации неповрежденной ткани. Тем не менее, окружающая гелевая матрица ограничивает сокращение и расслабление ран и препятствует росту развивающихся эмбрионов с течением времени 7,8,9.
Микрофлюидные устройства могут иммобилизовать эмбрионы рыбок данио на разных стадиях развития 10,11,12,13,14,15,16, а некоторые, такие как zWEDGI 7, позволяют наносить ручные ранения. Тем не менее, у доступных конструкций устройств есть несколько недостатков. Например, многие устройства, напечатанные непосредственно на пластике, несовместимы с визуализацией на инвертированных микроскопах из-за плохой оптической прозрачности. Кроме того, параллельные каналы позволяют получать многопозиционную визуализацию10,11, но физическое перемещение предметного столика микроскопа приводит к задержке в получении изображения. Повторные итерации и оптимизация для решения этих проблем затруднительны, если учесть финансовые и технические инвестиции, необходимые для каждого нового проекта, особенно для современных методов изготовления устройств золотого стандарта с использованием мягкой литографии на основе полидиметилсилоксана (PDMS). Самый первый шаг, создание мастер-формы, часто требует знания программного обеспечения для 3D-моделирования, доступа к специализированному производственному оборудованию и (в зависимости от используемого материала) дополнительной антиадгезионной обработки, такой как силанизация, прежде чем форма будет использована. Отверждение PDMS после заливки занимает не менее одного часа при высоких температурах, и, как правило, для достижения наилучших результатов должно проводиться в вакууме или с помощью зажима, часто в чистом помещении 7,17,18. Как и в биологии развития, эти затраты могут быстро оказаться непомерно высокими для экспериментов, требующих множества уникальных микрофлюидных сред на нескольких моделях.
Из доступных альтернативных строительных материалов полиэтилентерефталат (ПЭТ) долговечен, нетоксичен и прост в обращении. ПЭТ-листы – это широко доступные пластиковые пакеты для ламинирования, которые можно приобрести в большинстве магазинов канцелярских товаров, с предварительно нанесенным термоактивированным клеем (как правило, этиленвинилацетатом). Формируя эти листы из ПЭТ с помощью коммерчески доступных резаков (т.е. плоттеров с компьютерным управлением, предназначенных для домашних мастеров) и приклеивая слои друг к другу с помощью стандартного оборудования для термического ламинирования, можно быстро создавать и повторять широкий спектр потенциальных дизайнов. Поэтому мы адаптировали ранее описанный метод проектирования и конструирования с использованием уложенного PET18 для создания Rotational Assistant для Danio Imaging of Subsequent Healing (RADISH) (рис. 1A, B). Вращательное расположение нескольких приблизительно клиновидных ограничивающих каналов оптимизирует близость, обеспечивая при этом пространство для ручного пересечения хвостового плавника, обеспечивая визуализацию сразу после ранения и одновременную долгосрочную визуализацию нескольких раненых эмбрионов данио-рерио в одном поле зрения. Кроме того, этот метод строительства значительно снижает первоначальные капитальные затраты и время, необходимое для создания устройства, сохраняя при этом возможность повторного использования.
протокол
В этом исследовании использовались эмбрионы через 3 дня после оплодотворения (dpf), но оно может быть разработано для использования 2-14 эмбрионов dpf. Эксперимент с рыбками данио проводился по международно признанным стандартам. Протокол по уходу за животными и их использованию был одобрен Комитетом по уходу за животными и их использованию (PACUC) в соответствии с Руководством по использованию рыбок данио в Программе внутренних исследований NIH (номер протокола: 1401001018).
1. Сборка устройства для микрофлюидики ПЭТ
ПРИМЕЧАНИЕ: Любая часть данного протокола может быть приостановлена в любое время, за исключением этапов 1.8 и 1.9, которые чувствительны к времени высыхания цианоакрилата.
- Разработайте шаблон для устройства в выбранном вами программном обеспечении (например, Adobe Illustrator, рисунок 1A). В зависимости от возраста и размера эмбриона отрегулируйте ширину канала и размер центральной камеры визуализации для наилучшего прилегания.
- Сохраните каждый слой в виде отдельного файла изображения с идентичными размерами. Назовите каждый файл так, чтобы была очевидна толщина используемого листа и порядок сборки.
- Инициализируйте режущий станок в соответствии с инструкциями производителя.
- Загрузите каждый разработанный узор в программное обеспечение для проектирования.
- В рабочей области дизайна выберите только что загруженные проекты. Сгруппируйте шаблоны, предназначенные для одинаковой толщины листа ПЭТ, вместе в одном разрезе (рисунок 2А). При необходимости измените размер шаблонов в программном обеспечении для проектирования до правильных размеров.
- Подтвердите количество и тип шаблонов в вырезе, затем выберите материал резки.
ПРИМЕЧАНИЕ: Листы ПЭТ могут не использоваться в качестве материала в программном обеспечении для проектирования, в том числе под такими названиями, как «пластиковый пакет для ламинирования». Вместо него можно выбрать любой материал аналогичной толщины и текстуры (например, прозрачные листы или неадгезивный винил). - Прикрепите листы ПЭТ к коврику для резки, сильно надавливая, чтобы удалить пузырьки воздуха, и загрузите коврик в режущую машину. Следуйте инструкциям на экране, чтобы сообщить машине для резки о начале резки.
- Готовые срезы снимите с коврика для резки. При необходимости скорректируйте схемы выреза с помощью крафтового ножа или лезвия скальпеля.
ПРИМЕЧАНИЕ: Файлы изображений, использованные для создания дизайна RADISH (Рисунок 1A), доступны для загрузки в векторном форматах и форматах PNG (Дополнительный файл 1). Если режущая машина поднимает, рвет или не может чисто разрезать лист ПЭТ, рассмотрите возможность замены режущего коврика.
- Выровняйте слои на покровном стекле без посторонней помощи или с предварительно вырезанными метками приводки. Если перед ламинированием можно скрепить несколько слоев друг с другом, совместите их одновременно.
- Закрепите слои офисным скотчем, чтобы избежать смещения во время ламинирования (Рисунок 2B). В зависимости от размера устройства и емкости ламинатора устанавливайте небольшие конструкции на более крупную подложку с большим количеством ленты, чтобы избежать заклинивания или засорения подачи ламинатора (рис. 2C).
ПРИМЕЧАНИЕ: Подложка, используемая при ламинировании, НЕ то же самое, что коврик для резки, и служит в первую очередь для обеспечения сцепления с ламинатором. В качестве подложки подойдет любой термостойкий материал незначительной толщины (включая, помимо прочего, картон, сложенную офисную бумагу или лист ПЭТ большего размера). - Включите ламинатор и заламинируйте в соответствии с инструкцией производителя. Удалите офисный скотч перед выравниванием следующего слоя (рис. 2D).
- Повторяйте шаги с 1.4 по 1.6 до тех пор, пока все слои не будут приклеены.
- Закрепите устройство на чашке диаметром 35 мм, просверленной с отверстием 3/4 дюйма с помощью цианоакрилатного клея (рис. 2E, F). Отрегулируйте форму и тип чашки в соответствии с экспериментальными потребностями (например, любой контейнер, достаточно большой, чтобы вместить устройство, — одну лунку в 24-луночной тарелке или большую чашку Петри). Используйте достаточное количество клея, чтобы полностью приклеить устройство к блюду, не заливая его.
ПРИМЕЧАНИЕ: Крепление устройства к удерживающей тарелке не требуется для функционирования устройства. ВНИМАНИЕ: Цианоакрилат связывает кожу и глаза за считанные секунды и раздражает дыхательную систему, глаза и кожу. Носите средства защиты рук и глаз и работайте в хорошо проветриваемом помещении. - Водонепроницаемость ламината из ПЭТ путем тщательного покрытия внешних краев устройства цианоакрилатным клеем (Рисунок 2F). Используйте достаточное количество клея, чтобы полностью покрыть внешние края. Дайте клею застыть не менее 2 часов перед использованием.
ПРИМЕЧАНИЕ: Обеспечьте достаточное пространство для выхода паров цианоакрилата. Накопление паров может привести к тому, что цианоакрилат оседает на устройстве, закрывая оптически прозрачный материал.
2. Позиционирование эмбрионов в редисе и подготовка к визуализации
- Выращивайте эмбрионы рыбок данио в стандартной среде для выращивания эмбрионов E319. При необходимости дехорионатизируйте эмбрионы не менее чем за 1 ч до визуализации, чтобы дать им возможность сплющиться. В этом эксперименте использовались эмбрионы с концентрацией 3 dpf, но эмбрионы могут иметь до 14 dpf (рис. 1E).
- Окрашивайте или обрабатывайте эмбрионы в соответствии с экспериментальными потребностями.
Примечание: В этих экспериментах клеточные мембраны наружного эпителиального слоя окрашивали там, где это было уместно, путем инкубации со 100 нМ MemGlow 560. - Обезболите эмбрионы с помощью 164 мг/л MS-22220.
ПРИМЕЧАНИЕ: Точная концентрация и используемый анестетик могут быть скорректированы в соответствии с предпочтениями экспериментатора. Концентрация анестетика может быть снижена, чтобы обеспечить успешное проявление во время долговременных изображений (см. шаг 4.1). - Наполните чашку для хранения, в которой находится установленное устройство, 5 мл E3, содержащего 164 мг/л MS-222.
- С помощью пипетки для переноса поместите по одному обезболиваемому эмбриону в каждую камеру хранения устройства. Убедитесь, что эмбрионы остаются погруженными в жидкость в течение всего времени визуализации.
ПРИМЕЧАНИЕ: Конструкция RADISH может обездвижить 1-4 эмбриона. - С помощью петли для волос сориентируйте эмбрионы таким образом, чтобы хвост эмбриона выступал в центральную камеру визуализации, а желток был надежно обездвижен в клиновидном канале (рисунок 1В).
ПРИМЕЧАНИЕ: Ориентация эмбрионов может быть выполнена под стереомикроскопом для облегчения манипуляций. - При желании обезопасьте головку эмбриона, добавив в камеру выдержки 1,5% малоплавкой агарозы с помощью микропипетки.
- Переместите устройство с эмбрионами в выбранную систему визуализации, чтобы начать визуализацию.
3. Визуализация кальциевых переходных процессов после ранения
ПРИМЕЧАНИЕ: Этот раздел и раздел 4 являются необязательными и предоставляются в качестве потенциальных образцовых экспериментов.
- Выберите подходящую систему и цель для визуализации.
ПРИМЕЧАНИЕ: Здесь инвертированный лазерный сканирующий конфокальный объектив был оснащен 20-кратным объективом. - Отрегулируйте фокус образца и параметры изображения (например, мощность лазера: 5, усиление: 90, размер отверстия: 2 а.е., время экспозиции [скорость сканирования: 1 кадр/с]) для оптимального соотношения сигнал/шум и скорости захвата.
ПРИМЕЧАНИЕ: Рекомендуется предварительно сфокусировать образцы и отрегулировать параметры для каждого канала на выбранной системе визуализации перед нанесением ранения , чтобы уменьшить задержку между формированием раны и получением изображения. - Рана Tg(krt4:Gal4, UAS:GCaMP6f) x (cdh1-dTomato)xt1821,22 эмбриона.
- Чтобы ранить эмбрион путем ручного пересечения, надавите лезвием скальпеля на ткань хвостового плавника на кончике хорды под стереомикроскопом (видео 1), затем верните устройство в стадию.
ВНИМАНИЕ: Чрезмерное давление лезвием скальпеля может привести к растрескиванию стекла. Если стекло треснуло, выбросьте устройство и начните заново с шага 1.2. - Чтобы ранить эмбрион с помощью лазерной стимуляции, определите область интереса (ROI) у края складки хвостового плавника и стимулируйте в соответствии с доступной мощностью лазера.
ПРИМЕЧАНИЕ: В данном случае мощность лазера 2,4 Вт в течение 30 с на длине волны 800 нм была достаточной для создания раны на всю толщину.
- Чтобы ранить эмбрион путем ручного пересечения, надавите лезвием скальпеля на ткань хвостового плавника на кончике хорды под стереомикроскопом (видео 1), затем верните устройство в стадию.
- Изображение при комнатной температуре с использованием каналов GFP (возбуждение 488 нм, излучение 510 нм) и RFP (возбуждение 561 нм, излучение 610 нм) с интервалом кадров 1 мин в общей сложности 1 ч.
- (По желанию): При необходимости отпустите эмбрионы для извлечения после визуализации с помощью мягкого отсасывания возле головки с помощью пипетки для переноса или поворачивая чашку.
4. Визуализация рекрутирования нейтрофилов после ранения
- Не менее чем за 1 ч до визуализации перенесите эмбрионы в Е3, содержащий половину стандартной концентрации анестетика, в данном случае 82 мг/л MS-222.
- Выберите подходящий объектив для визуализации (в данном случае инвертированный лазерный сканирующий конфокальный объектив, оснащенный 10-кратным объективом).
- Отрегулируйте фокус образца и параметры изображения (например, мощность лазера: 5, усиление: 90, размер точечного отверстия: 2 а.е., время экспозиции [скорость сканирования: 0,5 кадра/с])) для оптимального соотношения сигнал/шум и скорости захвата.
ПРИМЕЧАНИЕ: Рекомендуется предварительно сфокусировать образцы и отрегулировать параметры для каждого канала на выбранной системе визуализации перед нанесением ранения , чтобы уменьшить задержку между формированием раны и получением изображения. - Намотанные четыре эмбриона Tol2(mpx:Dendra2)23 путем ручного рассечения путем надавливания лезвием скальпеля на ткань хвостового плавника под стереомикроскопом, затем верните устройство в сцену.
- Захватите изображение по каналу GFP (возбуждение 488 нм, излучение 510 нм) при комнатной температуре с интервалом кадров 5 мин в течение 24 ч.
- При необходимости отпустите эмбрионы для извлечения после визуализации с помощью мягкого отсасывания возле головки с помощью пипетки для переноса или вращая чашку.
Результаты
Для сравнения качества изображения, полученного с помощью лазерного сканирующего конфокального с помощью РЕДИС и без него, эмбрионы, экспрессирующие интенсиометрический кальциевый биосенсор GCaMP6f22,24 в наружном эпителиальном слое, окрашивали с помощью MemGlow 560 и визуализировали с помощью инвертированного лазерного сканирующего конфокального покрытия, охватывающего всю толщину складки хвостового плавника с интервалом 1 мин на кадр (видео 2). Без устройства (рис. 3A) образцы значительно дрейфовали и отображали артефакты полос, возникающие в результате ограничения Z-стека до 25 срезов для укладки, чтобы уложиться в указанное временное разрешение по сравнению с визуализацией с помощью устройства (рис. 3B). Кроме того, RADISH использовали для исследования кальциевых транзиентов сразу после ранения у эмбрионов, экспрессирующих Tg(krt4:Gal4, UAS:GCaMP6f) x (cdh1-dTomato)xt1821, выделяя эндогенный E-кадгерин красным цветом и цитоплазматический кальций в апикальном эпителии зеленым цветом. Эмбрионы ранили параллельно стенкам центральной камеры с помощью лезвия скальпеля (Рисунок 4А и Видео 3) или путем прямой лазерной абляции с помощью ИК-лазера (Рисунок 4В), а затем визуализировали через всю толщину складки хвостового плавника.
Чтобы продемонстрировать эффективность RADISH для долгосрочной визуализации, мы исследовали рекрутирование иммунных клеток к краю раны в течение 24 ч после ранения. Четыре эмбриона рыбок данио с 3 dpf, экспрессирующих Tol2(mpx:Dendra2) для маркировки нейтрофилов зеленогоцвета 23, были ранены путем пересечения хвоста и визуализировались в течение 24 часов подряд (рис. 5). Артефакты визуализации, обычно связанные с поздними эмбрионами с температурой от 3 до 4 dpf, такие как наклон и плавание, заметно отсутствовали (видео 4), и повторный рост тканей продолжался беспрепятственно во время эксперимента. Рекрутирование нейтрофилов к краю раны продолжается на протяжении всего изображения (рис. 5B), при этом большинство мигрирующих клеток покидают через 24 ч после ранения (рис. 5C), что согласуется с ожидаемым разрешением воспаления25,26.

Рисунок 1: Проектирование и использование устройства микрофлюидики из ламината ПЭТ (RADISH). (A) Схема, иллюстрирующая расположение и толщину отдельных слоев ПЭТ, сборку, а также монтаж и использование устройства. (B) Конечный продукт, установленный в вырезе 3/4 дюйма в тарелке диаметром 35 мм. (C) 3 эмбриона dpf, (D) 5 эмбрионов dpf, (E) 14 эмбрионов dpf, размещенных внутри устройства. Масштабные линейки = 1 000 μм (C,D,E). Сокращения: ПЭТ = полиэтилентерефталат; RADISH = ротационный ассистент для визуализации данио последующего заживления; DPF = дни после оплодотворения. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 2: Пошаговая фотоиллюстрация сборки ПЭТ-устройства. (А) Отдельные слои ПЭТ перед ламинированием. (Б) Слой ПЭТ крепится к покровному стеклу толщиной 25 мм с помощью офисной ленты. (C) Незавершенное устройство закреплено на пластиковой подложке для ламинирования. (D) Готовое устройство для изготовления ламината из ПЭТ. (E) Модифицированная 35-миллиметровая тарелка перед установкой устройства. (F) Готовое устройство. Аббревиатура: ПЭТ = полиэтилентерефталат. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Иллюстрация 3: Улучшенное качество конфокальных изображений с лазерным сканированием 3 эмбрионов dpf в дизайне RADISH. (A) Репрезентативное изображение эмбриона с 3 dpf Tg(krt4:Gal4, UAS:GCaMP6f), окрашенных MemGlow 560 без использования RADISH. (B) Репрезентативное изображение эмбриона Tg(krt4:Gal4, UAS:GCaMP6f), окрашенного MemGlow 560, установленным в RADISH. Масштабная линейка = 100 мкм. Сокращения: RADISH = ротационный ассистент для визуализации Данио последующего заживления; DPF = дни после оплодотворения. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
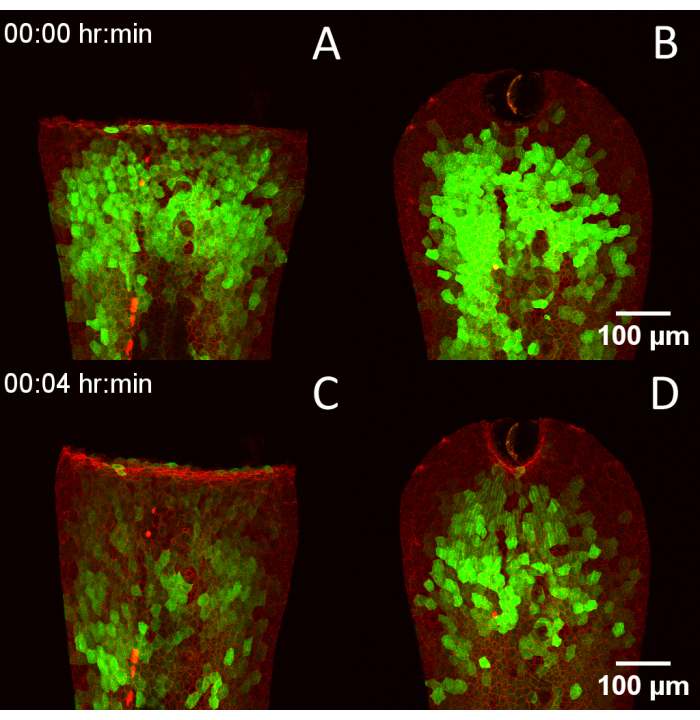
Рисунок 4: Совместимость конструкции RADISH с различными методами ранения. (A) 3 dpf Tg(krt4:Gal4, UAS:GCaMP6f) x (cdh1-dTomato)xt18 эмбрион ранен путем ручного пересечения хвостового плавника. (Б) Эмбрион ранен с помощью лазерной абляции. (К,Г) Те же эмбрионы через 4 минуты, демонстрируя прогрессирование кальциевых транзиентов после ранения. Масштабные линейки = 100 μм. Сокращения: RADISH = ротационный ассистент для визуализации Данио последующего заживления; DPF = дни после оплодотворения. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 5: Долгосрочное захват эмбрионов для визуализации миграции фагоцитов. (A) Tol2(mpx:Dendra2) эмбрионы сразу после ранения, и те же эмбрионы (B) через 25 минут, (C) через 12 часов и (D) через 24 часа. Масштабные линейки = 100 μм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Дополнительный файл 1: Векторные файлы и файлы PNG для проектирования устройств RADISH, как показано на рисунке 1A. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Видео 1: Светлопольное видео ручного пересечения хвостового плавника с использованием конструкции устройства RADISH. Аббревиатура: RADISH = ротационный ассистент для визуализации Данио последующего заживления. Пожалуйста, нажмите здесь, чтобы скачать это видео.
Видео 2: Сравнение несмонтированных и смонтированных 3 dpf Tg(krt4:Gal4, UAS:GCaMP6f) эмбрионов с рисунка 3, полученных со скоростью 1 кадр/мин. Пожалуйста, нажмите здесь, чтобы скачать это видео.
Видео 3: Транзиенты кальция в эмбрионах Tg(krt4:Gal4, UAS:GCaMP6f) x (cdh1-dTomato)xt18 , раненых с помощью пересечения скальпеля или лазерной абляции с рисунка 4, полученные со скоростью 1 кадр/мин. Пожалуйста, нажмите здесь, чтобы скачать это видео.
Видео 4: Долгосрочная визуализация рекрутирования лейкоцитов и регенерации хвостового плавника у эмбрионов Tol2(mpx:Dendra2). Сокращения: RADISH = ротационный ассистент для визуализации Данио последующего заживления; HPW = часы после ранения. Пожалуйста, нажмите здесь, чтобы скачать это видео.
Обсуждение
Основная предпосылка метода ламинирования ПЭТ заключается в снижении затрат и минимизации технических барьеров для входа по сравнению с традиционными способами создания микрофлюидных устройств, такими как мягкая литография или формование PDMS. Таким образом, единственными критическими шагами в этом протоколе являются точное выравнивание слоев ПЭТ во время ламинирования и гидроизоляция краев устройства после сборки. Все остальные части метода могут быть модифицированы в соответствии с экспериментальными потребностями (например, если требуется иммобилизация более молодых или более старых эмбрионов, толщина слоев ПЭТ может быть отрегулирована таким образом, чтобы соответственно сузить или расширить канал). Конструкции могут быть созданы в любой форме и ламинированы на любом материале основы при условии, что материал является термобезопасным и достаточно тонким, чтобы его можно было пропустить через ламинатор18,27. Поскольку листы ПЭТ разрезаются с помощью коммерчески доступных резаков, которые считывают двухмерные, а не трехмерные файлы изображений, проектирование и итерация любого конкретного устройства требуют только возможности манипулировать черно-белыми формами в программе редактирования изображений, что значительно снижает сложность. Такая гибкость в выборе программного обеспечения и коммерческая доступность используемых материалов представляют собой резкое увеличение доступности устройств микрофлюидики в целом, что позволяет использовать их в любой лаборатории или классе за первоначальные затраты менее 500 долларов США на момент написания этой статьи, по сравнению с более чем 2000 долларов США начальных затрат на оборудование для изготовления пресс-форм PDMS17.
Кроме того, время, необходимое для создания одного пригодного для использования устройства с использованием этого метода, значительно сокращается по сравнению с обычной мягкой литографией. Предполагая знакомство с необходимым программным обеспечением, одно уникальное микрофлюидное устройство из ламината ПЭТ может быть спроектировано, изготовлено и немедленно использовано за ~3 часа, включая время отверждения цианоакрилата. Итерация занимает еще меньше времени, в зависимости от масштаба необходимых правок в исходных проектных файлах, и несколько вариантов устройств могут быть выполнены параллельно с минимальными дополнительными затратами времени и без дополнительного оборудования. Несмотря на то, что устройства, созданные с использованием этого метода, менее долговечны, чем устройства, изготовленные с помощью PDMS, по целому ряду причин (включая разрушение адгезии и внутренние напряжения для форм с большим количеством слоев и длинными соотношениями сторон), их недорогая природа и масштабируемость изготовления означают, что их гораздо легче заменить. Поскольку коммерческие крафтовые резаки продаются с возможностью повторять один и тот же точный рез снова и снова, а ПЭТ не имеет срока годности, отдельные слои готовой конструкции могут быть предварительно подготовлены для сборки и использования в любой момент в будущем, что еще больше сокращает общее время.
Однако скорость и вариативность достигаются за счет точности. Основным ограничением ламинирования ПЭТ по сравнению с традиционным формованием PDMS является пространственное разрешение. Коммерческие крафтовые резаки часто борются с острыми углами на формах размером менее примерно 500 мкм, а листы для ламинирования ПЭТ недоступны при толщине менее 33 мкм (не считая толщины самого клея, которая не учитывается при измерении на упаковке), что значительно ограничивает масштаб, в котором может быть применен этот метод. Максимальное количество слоев также ограничено размерами ламинатора, которые могут варьироваться от производителя к производителю.
Окончательная версия протокола, включая вариации в технике регистрации и выравнивания, поставщиках материалов и программном обеспечении, во многом будет зависеть от предпочтений пользователей. Тем не менее, доступность метода и общая гибкость снижают стоимость адаптации. Отдельным пользователям рекомендуется повторять столько, сколько необходимо, чтобы адаптировать подход к своим уникальным потребностям.
Раскрытие информации
У авторов нет конфликта интересов, который можно было бы раскрыть.
Благодарности
Работа была поддержана финансированием исследований от Национальных институтов здравоохранения (R35GM119787 до QD). Эта работа основана на усилиях, поддержанных Институтом EMBRIO, контрактом NSF #2120200, Институтом интеграции биологии Национального научного фонда (NSF). Конфокальная визуализация была выполнена в Центре визуализации Пердью. Мы благодарим доктора Гуанцзюнь Чжана (Университет Пердью) за предоставление линии Tg(UAS:GCaMP6f). Мы благодарим доктора Дэвида Тобина (Университет Дьюка) за предоставление линии (cdh1-tdtomato)xt18.
Материалы
| Name | Company | Catalog Number | Comments |
| 25 mm diameter round coverglass #1 thickness | Chemglass Life Sciences | CLS-1760-025 | Base mounting material. Thickness was chosen based on the specifications of the microscope lens. |
| Adobe Illustrator v28.5 | Adobe | N/A | Vector editor for designing the device pattern. |
| Calcium Chloride Dihydrate | Fisher | C79 | For making E3 medium. |
| Design PNG Files (Online Mirror) | N/A | N/A | https://i.ibb.co/QPYj7BL/multipositionalv7-1.png https://i.ibb.co/FDpQYXc/multipositionalv7-2.png https://i.ibb.co/5TG4SB6/multipositionalv7-3.png |
| Design Space for Desktop v8.39 | Cricut | N/A | Proprietary software to drive the craft cutter. |
| Fusion Plus 7000L | GBC | 1703098 | Thermal laminator. This specific model was selected for quality of life features, such as maximum sheet stack size. |
| German Carbide Premium Blade | Cricut | 10396595 | Replacement blade for craft cutter. |
| Gray Basic Tool Set | Cricut | 10307854 | Tool set for weeding cuts, cleaning mats, and mounting PET sheets. Optional. |
| Magnesium Chloride Hexahydrate | Acros Organic | 223211000 | For making E3 medium. |
| Maker 3 | Cricut | 10669040 | Craft cutter. The Cricut Maker 3 was selected over the Silhouette Cameo 4 for software user friendliness, but any craft cutter capable of reading black and white images will work. |
| MemGlow 560 | Cytoskeleton | MG02-10 | Red live cell dye for cell membranes. No washing needed. Used in Figure 3. |
| No. 22 Carbon Scalpel Blade | Surgical Design | 22-079-697 | Scalpel blade for manual cut adjustments. Any similar craft knife (e.g., X-acto #2 knife) will also work. |
| Potassium Chloride | Fisher | BP366 | For making E3 medium. |
| Sodium Chloride | Fisher | BP358 | For making E3 medium. |
| StandardGrip Adhesive Cutting Mat | Cricut | 10138842 | Mounting mat for craft cutter. The LightGrip cutting mat will also work, but avoid the StrongGrip and FabricGrip cutting mats as the strength of the adhesive may warp the final cut during weeding and removal. Adhesive on mats will eventually wear out with continued use; replace mats as needed. |
| Stationery Tape 12 mm | Deli | 30014 | Office tape. Deli brand was chosen via testing for ease of removal after lamination. |
| Super glue, liquid | Loctite | 1364076 | Cyanoacrylate glue. Glue used must be liquid. Gel formulations will not sufficiently seal or waterproof device edges. |
| PET Thermal Laminating Pouches, 3 mil | Scotch | TP3854 | PET sheets with thermal adhesive. Sheets arrive as sandwiched pairs and should be separated before use. Cut with adhesive side facing down. |
| PET Thermal Laminating Pouches, 5 mil | Scotch | TP5854 | PET sheets with thermal adhesive. Sheets arrive as sandwiched pairs and should be separated before use. Cut with adhesive side facing down. |
| Tricaine (MS-222) | Syndel | IC10310680 | Fish anaesthetic. |
Ссылки
- De Oliveira, S., Rosowski, E. E., Huttenlocher, A. Neutrophil migration in infection and wound repair: going forward in reverse. Nat Rev Immunol. 16 (6), 378-391 (2016).
- Xu, S., Hsiao, T. I., Chisholm, A. D. The wounded worm. Worm. 1 (2), 134-138 (2012).
- Belacortu, Y., Paricio, N. Drosophila as a model of wound healing and tissue regeneration in vertebrates. Dev Dyn. 240 (11), 2379-2404 (2011).
- Yoo, S. K., Freisinger, C. M., LeBert, D. C., Huttenlocher, A. Early redox, Src family kinase, and calcium signaling integrate wound responses and tissue regeneration in zebrafish. J Cell Biol. 199 (2), 225-234 (2012).
- Kawakami, A., Fukazawa, T., Takeda, H. Early fin primordia of zebrafish larvae regenerate by a similar growth control mechanism with adult regeneration. Dev Dyn. 231 (4), 693-699 (2004).
- Gault, W. J., Enyedi, B., Niethammer, P. Osmotic surveillance mediates rapid wound closure through nucleotide release. J Cell Biol. 207 (6), 767-782 (2014).
- Huemer, K., et al. zWEDGI: Wounding and entrapment device for imaging live zebrafish larvae. Zebrafish. 14 (1), 42-50 (2017).
- Kaufmann, A., Mickoleit, M., Weber, M., Huisken, J. Multilayer mounting enables long-term imaging of zebrafish development in a light sheet microscope. Development. 139 (17), 3242-3247 (2012).
- Hirsinger, E., Steventon, B. A versatile mounting method for long term imaging of zebrafish development. J Vis Exp. (119), e55210 (2017).
- Wielhouwer, E. M., et al. Zebrafish embryo development in a microfluidic flow-through system. Lab Chip. 11 (10), 1815-1824 (2011).
- Khalili, A., Rezai, P. Microfluidic devices for embryonic and larval zebrafish studies. Brief Funct Genomics. 18 (6), 419-432 (2019).
- Choudhury, D., et al. Fish and Chips: a microfluidic perfusion platform for monitoring zebrafish development. Lab Chip. 12 (5), 892-900 (2012).
- Zhang, G., et al. An integrated microfluidic system for zebrafish larva organs injection. , 8563-8566 (2017).
- Erickstad, M., Hale, L. A., Chalasani, S. H., Groisman, A. A microfluidic system for studying the behavior of zebrafish larvae under acute hypoxia. Lab Chip. 15 (3), 857-866 (2015).
- Mani, K., Hsieh, Y. C., Panigrahi, B., Chen, C. Y. A noninvasive light driven technique integrated microfluidics for zebrafish larvae transportation. Biomicrofluidics. 12 (2), 021101 (2018).
- Lee, Y., Seo, H. W., Lee, K. J., Jang, J. W., Kim, S. A microfluidic system for stable and continuous EEG monitoring from multiple larval zebrafish. Sensors (Basel). 20 (20), 5903 (2020).
- Sonnen, K. F., Merten, C. A. Microfluidics as an emerging precision tool in developmental biology. Dev Cell. 48 (3), 293-311 (2019).
- Levis, M., et al. Microfluidics on the fly: Inexpensive rapid fabrication of thermally laminated microfluidic devices for live imaging and multimodal perturbations of multicellular systems. Biomicrofluidics. 13 (2), 024111 (2019).
- . E3 medium (for zebrafish embryos). Cold Spring Harbor Protocols. 2011 (10), (2011).
- Matthews, M., Varga, Z. M. Anesthesia and euthanasia in zebrafish. ILAR J. 53 (2), 192-204 (2012).
- Cronan, M. R., Tobin, D. M. Endogenous tagging at the cdh1 locus for live visualization of E-cadherin dynamics. Zebrafish. 16 (3), 324 (2019).
- Thiele, T. R., Donovan, J. C., Baier, H. Descending control of swim posture by a midbrain nucleus in zebrafish. Neuron. 83 (3), 679-691 (2014).
- Yoo, S. K., Huttenlocher, A. Spatiotemporal photolabeling of neutrophil trafficking during inflammation in live zebrafish. J Leukoc Biol. 89 (5), 661-667 (2011).
- Chen, T. W., et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499 (7458), 295-300 (2013).
- Li, L., Yan, B., Shi, Y. -. Q., Zhang, W. -. Q., Wen, Z. -. L. Live imaging reveals differing roles of macrophages and neutrophils during zebrafish tail fin regeneration. J Biol Chem. 287 (30), 25353-25360 (2012).
- Mathias, J. R., et al. Resolution of inflammation by retrograde chemotaxis of neutrophils in transgenic zebrafish. J Leukoc Biol. 80, 1281-1288 (2006).
- Levis, M., Ontiveros, F., Juan, J., Kavanagh, A., Zartman, J. J. Rapid fabrication of custom microfluidic devices for research and educational applications. J Vis Exp. 2019, (2019).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены