Method Article
Retinal Vaskülatürde Diyabete Bağlı Yapışık Lökositlerin Miktar Tayini
Bu Makalede
Özet
Retina vaskülatürünün duvarlarını ve yapışık lökositleri etiketlemek için bir yöntem gösteriyoruz. Bu yapışık lökositler daha sonra bir floresan mikroskobu altında bir inflamasyon parametresi veya bu inflamasyonun tedavilere yanıtı olarak sayılabilir.
Özet
Lökostasis, lökositlerin damar sisteminin lümen duvarına bağlanmasını ifade eder. Lökositlerin kan damarları duvarı ile bu etkileşimi, inflamasyonun karakteristiğidir ve diyabetik retinopati de dahil olmak üzere çeşitli doku ve hastalıklarda kılcal damar tıkanıklığı ile nedensel olarak bağlantılıdır.
Lökostasis yıllardır hiperlökositozun hayatı tehdit eden bir komplikasyonu olarak bildirilmiştir ve sadece klinik olarak teşhis edilebilir. Fenomenin önemi göz önüne alındığında, tezahürüne yol açan potansiyel mekanizma(lar)ı anlamak için yoğun araştırmalar yapılmıştır; Bununla birlikte, laboratuvar ortamlarında olayın ciddiyetini görselleştirmek ve ölçmek için altın standart bir teknik yoktur.
Aşağıda özetlenen yöntemde, damar sistemi başlangıçta kanı çıkarmak için bir tampon ile perfüze edilir ve daha sonra concanavalin A, açıkta kalan tüm hücre duvarlarına bağlandığı ve lökositlerin özellikle parlak boyanmasına neden olduğu damar sistemine perfüze edilir. Tüm bağlanmamış kan hücrelerini çıkarmak için perfüzyon başarılı olursa, kalan floresan etiketli lökositler vaskülatüre bağlanır ve mevcut herhangi bir floresan mikroskobu kullanılarak manuel olarak ölçülebilir.
Giriş
Lökositler (beyaz kan hücreleri, WBC'ler), kan akışkanlığının korunması ve trombüs çözünürlüğünün düzenlenmesi gibi vaskülatürün optimal fonksiyonunda önemli bir rol oynar1. Ayrıca, damar tıkanıklığına yol açan uzun süre damar sisteminin lümen duvarına yapışmak gibi bazı patolojik durumlarda, en azından geçici olarak, lökostasis 2,3 olarak bilinen bir fenomende kilit bir rol oynarlar.
Diyabetik retinopati, uzun süreli diyabetin en yaygın komplikasyonlarından biridir ve 20-75 yaş arası bireyler için ABD'de ve dünya çapında görme bozukluğu ve körlüğün önde gelen nedenlerinden biridir4. Retina vaskülatürünün yavaş ve ilerleyici dejenerasyonu, hastalığın erken evrelerinin klinik olarak anlamlı bir bileşenidir ve bazı hastalarda retinal neovaskülarizasyon ile sonuçlanan retinal iskemiye yol açar 5,6. Kümülatif kanıtlar, inflamasyonun retinopatinin7 gelişiminde önemli bir rol oynadığını ve löstazın subklinik intravasküler inflamatuar yanıt olarak kabul edildiğini göstermektedir. Lökostaz, diyabetin erken evrelerinde, saptanabilir herhangi bir klinik belirti gelişmeden çok önce ortaya çıkar 8,9,10. Diyabette retina damarlarının aylar ila yıllar boyunca yapışık lökositler tarafından tekrar tekrar tıkanması (kronik lökostasis) kılcal damarların damar tıkanıklığına ve dejenerasyonuna katkıda bulunabilir 11,12,13. Bu lökostasisin şiddeti patolojik öneme sahiptir ve hastalık sürecinin ciddiyetini izlemek veya araştırma ortamlarında bir tedavinin etkinliğini değerlendirmek için kullanılabilir.
Hiperglisemik mikroçevrenin lökostasis üzerindeki spesifik etkilerini daha fazla incelemek için in vitro modeller tasarlanmıştır. İzole retinal mikrovasküler endotel hücreleri, vasküler endotelyumu (damarların lümenini döşeyen hücre tek tabakası) çoğaltmak için 2 veya 3 boyutlu kültür modellerinde (çip üzerinde mikrovaskülatür14) büyütülebilir ve düzenlenebilir. Bununla birlikte, bu modellerin deneyler arası varyasyonu kullanımlarını sınırlar. İnsan retinal vaskülatüründe in vivo lökostasis çalışması hala sınırlıdır ve bu nedenle, retinal lökostasis hakkındaki mevcut bilgilerin çoğu diyabetik retinopatinin hayvan modellerinden elde edilmiştir13,15.
Bu raporun amacı, lökostasisin bir parametresi olarak retina vaskülatürüne bağlı lökositlerin miktar tayini için başka bir yerde16 açıklanan yöntemlere dayanan standart bir protokolü tanımlamaktır. Bu test, maligniteler 3,17,18,19 ve bazı bulaşıcı ve alerjik durumlar20 gibi lökostasis de sunan diğer vasküler hastalıkları incelemek için kullanılabilir. Bu protokol, herhangi bir temel araştırma laboratuvarında özel ekipmana ihtiyaç duymadan uygulanabilir. Aşağıda özetlenen yöntemde, damar sistemi başlangıçta kanı çıkarmak için tampon ile perfüze edilir ve daha sonra konkanavalin A, açıkta kalan tüm hücre duvarlarına bağlandığı ve özellikle lökositlerin parlak boyanmasına neden olduğu damar sistemine perfüze edilir 21,22,23. Tüm bağlanmamış kan hücrelerini çıkarmak için perfüzyon başarılı olursa, vaskülatüre bağlı kalan floresan etiketli lökositler, eldeki herhangi bir floresan mikroskobu kullanılarak manuel olarak ölçülebilir.
Protokol
Protokol, California Irvine Üniversitesi'ndeki Kurumsal Hayvan Bakımı ve Kullanımı Komitesi (IACUC) tarafından gözden geçirilmiş ve onaylanmıştır ve laboratuvar hayvanlarının bakımı ve kullanımı ile ilgili resmi düzenlemelere uygundur. Bu protokolde herhangi bir durma noktası yoktur. Fare başına ortalama süre 30 dakikadır.
1. Perfüzyon aşamasının hazırlanması
- Kullanmadan önce% 0.9 tuzlu su torbasını ve concanavalin A çözeltisini 37 °C'lik bir su banyosunda 20-30 dakika ısıtın.
NOT: Concanavalin A'yı ışığa maruz kalmaktan koruyun (folyo ile örtün). - İşlemin yapılacağı yüzeye kan ve sıvıların damlamasını önlemek için bir tepsi hazırlayın. Tepsinin üzerine, emici bir tezgah alt pedi veya herhangi bir emici malzeme ile kaplı bir ısıtma yastığı yerleştirin.
NOT: Amaç, işlem sırasında farenin vücudunun ısı kaybetmesini önlemektir, çünkü soğutma, perfüzyon sırasında kanın çıkarılmasını zorlaştırır.
2. Basınçlı demliğin kurulması
- % 0.9 salin torbasını, IV kateter setini, 4 valf vanasını ve gavaj iğnesini seri olarak bağlayın.
- %0.9 tuzlu su torbasını, ağ ile basınçlı demliğin hava kesesi arasına yerleştirin. Tuzlu su torbasını hava kesesinin arkasında bulunan kancaya asın. Basınçlı şişliği IV direğine asmak için IV kutup halkasını kullanın.
- Sistemin birkaç dakika açılmasına (çalışmasına) izin vererek tüm hava kabarcıklarının hatlarını ve portlarını temizleyin ve akış hızını 18-20 mL/dk24'e ayarlayın. Basınçlı demlik hava kesesini şişirmek için, vana kolunu açık vana havalandırmasına bakacak şekilde çevirin, ardından manometre istenen basıncı gösterene kadar şişirme ampulünü pompalayın. Her fareyi perfüze etmeden önce basıncı yeniden ayarlayın. Söndürmek için musluk kolunu düz bir şekilde şişirme ampulüne doğru çevirin.
NOT: %0,9 tuzlu su torbası yeniyse, genellikle 150 mmHg basınç istenen akış hızını sağlar; Bununla birlikte, basınçlı demlik markalarındaki farklılıklar ve %0.9 tuzlu su torbasının kullanım süresi boyunca basınç ampirik olarak ayarlanmalıdır. - Isıtılmış concanavalin A çözeltisi ile doldurulmuş 10 mL'lik bir şırıngayı 4 vanaya takın.
NOT: Şırıngayı ışığa maruz kalmaktan koruyun (folyo ile örtün).
3. Anestezi
- Ketamin intraperitoneal (IP) enjeksiyonu ile anestezi verin: Ksilazin; Fare cerrahisi / prosedürü için en yaygın kullanılan doz 100: 10 mg / kg vücut ağırlığı25'tir. Anesteziyi pedal refleksi ile değerlendirin (sert ayak parmağı tutam).
NOT: Bu doz, 45-60 dakikalık bir cerrahi anestezi süresi ile 4-6 dakikalık bir başlangıç sağlar. Anestezik kokteyl oda sıcaklığında en fazla 2 hafta saklanabilir.
4. Transkardiyal perfüzyon ve concanavalin A ile boyama
- Göğüs ve karın boşluğunun açığa çıkmasına izin vermek için fareyi sırtüstü pozisyonda perfüzyon aşamasına yerleştirin.
- Ksifoid sürecini görsel olarak tanımlayın ve baskın eldeki hemostat ile cildi sabitleyin ve kilitleyin. Kanama durdurucu sabitlendikten sonra, baskın olmayan elinize aktarın ve cildi kaldırın.
- Baskın elinizde makas kullanın ve dış karın duvarını ortaya çıkarmak için omurgaya 90°'lik bir açıyla bir deri parçası kesin.
- Ksifoid süreci ve göğüs kafesi artık görünür durumdayken, herhangi bir organı veya büyük damarı kesmekten kaçınmaya dikkat ederek karın duvarından iki taraflı olarak diseksiyon yapın.
- Diyafram artık görünür durumdayken, diyaframdan kalp ventriküllerini ve akciğerleri görselleştirin. Makasın ucunu kullanarak, herhangi bir organı veya büyük damarı kesmemeye dikkat ederek, omurgaya yakın yanlardan birinde diyaframı kesin.
NOT: Diyaframdaki bu "delik", negatif göğüs içi basıncı atmosferik basınçla dengeleyecek ve akciğerleri çökerten ve kalbi geri çeken, akciğerlere veya kalbe zarar vermeden diyaframın diseksiyonunu kolaylaştıran bir pnömotoraks oluşacaktır. - Bir göğüs "flebi" oluşturmak için kaburgalardan ve akciğerlere paralel olarak diseksiyona devam edin. Hemostatı serbest bırakın ve sagital düzlemde ksifoid sürecini kesin. Ksifoid işlemini manuel olarak nazikçe açın. Kalbin dört odacığını gözlemleyin.
- Baskın olmayan el ile ve forseps kullanarak, kalbi tepesine yakın bir yerde kavrayın. Baskın el ile gavaj iğnesini (IV kateterine bağlı) tutun ve kalbin tepesini delin. Sol ventrikülün tam delinmesini veya pulmoner vaskülatüre ulaşmasını ve ardından sistemik vaskülatürün zayıf perfüzyonunu önlemek için, gavaj iğnesinin top ucunun ucunun yerleşimini kontrol edin, bu da kalpten hafifçe çıkıntı yapan delinme bölgesinin kenarında olmalıdır. Gavaj iğnesini kavisli sivrisinek forseps kullanarak yerine sıkıştırın veya IV musluğunu manipüle ederken elinizle tutun.
- Muslukta% 0.9 saline kadar açın ve neredeyse aynı anda sağ ventrikülü makasla kesin; 2-3 dakika perfüs. Perfüzyon süresi boyunca, damar sisteminin bükülmesini azaltmak ve kalpten kan çıkışını artırmak için iğneyi nazikçe bir yandan diğer yana ve yukarı ve aşağı hareket ettirin.
- Tuzlu su ile perfüze ettikten sonra, tuzlu sudan gelen akışı kapatmak ve şırıngadan gavaj iğnesine akışa izin vermek için musluk kolunu çevirin. Concanavalin A çözeltisi ile sabit bir durum oranında elle perfüz. 10 mL concanavalin A çözeltisinin 30-35 saniye içinde dağıtıldığından emin olun.
- Concanavalin A ile perfüze ettikten sonra, şırıngadan gelen akışı kapatmak için valfi çevirin ve% 0.9 salinden tekrar gavaj iğnesine akışa izin verin. % 0.9 tuzlu su çözeltisi ile 2-3 dakika daha perfüz. Gavaj iğnesini kalpten çıkarın.
NOT: Bu protokolde önerilen konkanavalin A, floresein (yeşil) ile konjuge edilmiştir; bununla birlikte, diğer florokromlara bağlı concanavalin A da mevcuttur.
5. Taze retinanın enükleasyonu ve izolasyonu
- Fareyi yan çevirin ve baskın olmayan elinizi kullanarak işaret parmağını ve başparmağınızı sırasıyla üst ve alt göz kapaklarının üzerine yerleştirin. Göz kapaklarını ve cildi parmaklarınızla nazikçe geri çekin ve gözü proptote edin, böylece kısmen yuvadan çıkıntılı hale getirin.
- Göz dikilirken, baskın elinizde kavisli makas kullanın ve göz altına 45°'lik bir açıyla kepçe yapın. Kas ekini ve optik siniri kesin. Spatula ile aynı makası kullanarak, gözü küçük bir kaba veya doğrudan diseksiyon mikroskobunun aşamasına aktarın.
NOT: Bu adım sırasında gözün arkasını kesmemeye ve gözü çekmemeye dikkat edin. - Küreyi açmak için gözü bir diş mumunun üzerine yerleştirin. Diseksiyon mikroskobu altında ve baskın olmayan eli kullanarak, skleral kıvrımı veya hala bağlı olan kas kalıntılarını mikro forseps ile arka göze dışarıdan tutun ve gözü, kornea bir tarafa bakacak şekilde yönlendirin.
NOT: Küreyi açarken gözün hareket etmesini/kaymasını önlemek için, diş mumunun üzerine bir parça ıslak tüy bırakmayan doku yerleştirilebilir. - Teflon kaplı bir tıraş bıçağının keskin köşelerinden biri ile limbusun 1-2 mm arkasında ve ona paralel bir kesi yapın (kornea-sklera bileşkesi). Skleral kıvrımı veya kası mikro forseps ile tutun ve bıçağı minimum aşağı doğru kuvvetle limbus boyunca çekin. Ön segmenti (kornea, iris, lens ve vitreus) arka segmentten (göz kabı) tamamen ayırmak için usturayla kesmeye devam edin.
NOT: İleri geri testere yapmayın. - İkiye bölünmüş göz kabını PBS'li küçük bir Petri kabına aktarın.
NOT: Retinanın kağıt mendil ile temasından kaçının (adım 5.3'teki not), çünkü kağıda sıkıca yapışacak ve kurtarılması esasen imkansız hale gelecektir. - Mikro forseps ile bir skleral kıvrım veya skleranın dışında kalan kası tutun. Bir mikro spatula kullanarak göz kabının çevresindeki limbustaki tüm bağlantıları keserek retinayı skleradan tamamen ayırın. Mikro spatula ile retinayı skleradan çıkarın. Retina hala optik sinir tarafından skleraya bağlıysa, optik siniri kesmek için mikro makası retina ve sklera arasına kaydırın.
- Retinanın çevresindeki vitreus ve siliyer kas kalıntılarını çıkarın. İzole retinayı hemen bir miktar PBS ile bir slayta aktarın.
NOT: Araştırmacının tercihine bağlı olarak başka herhangi bir retina izolasyon tekniği kullanılabilir.
6. Retinanın düz montajı
- Sabitlenmemiş retinayı az miktarda PBS içeren bir slayt üzerine yerleştirin. Mikro spatulayı kullanarak, retinayı vitröz tarafı yukarı bakacak şekilde nazikçe yönlendirin. Retina içe doğru katlanmışsa, mikro spatula kullanılarak retina açılırken retinanın kenarlarını tutmak için mikro forseps kullanın.
- Retinaya düz durması için 4-5 radyal kesi yapın (yonca yaprağı deseni).
- Tüy bırakmayan bir doku kullanarak, PBS'nin fazlalığını retinadan kurutun.
NOT: Retinaya doku ile dokunmayın; aksi takdirde numune kaybolacaktır. Retinayı düz tutmak için lamel kayma arzu edilir.
7. Mikroskopi
NOT: Bu adım için GFP/FITC (480/530 nm) kanallı herhangi bir floresan mikroskobu kullanılabilir. Bu çalışma için, görüntü elde etmek için 488 kanallı referans mikroskop ve ilgili yazılımı kullandık.
- Yakın zamanda düz monte edilmiş retinayı mikroskop altında 100x büyütmede (10x objektif) gözlemleyin ve tüm dokuyu metodik olarak tarayarak (sağdan sola veya yukarıdan aşağıya) floresan etiketli lökositleri (manuel olarak) sayın.
NOT: Lökositler, yuvarlak veya oval bir şekil gösterebilen tek floresan noktalardır. 12-15 μm çapındadırlar ve retina kılcal damarlarından çıkıntı yapmazlar (yapı tamamen damarın lümeni tarafından sınırlandırılmıştır). - İstenen büyütme oranına sahip temsili görüntüler elde edin ve tercih edilen yazılımla (örneğin, ImageJ [Fiji]) görüntülerin son işlemesini gerçekleştirin.
- Sayıyı retina başına lökosit olarak ifade edin. Verileri ortalama ± standart sapmaya göre grafiklendirin.
Sonuçlar
İyi uygulanmış bir perfüzyon ve boyama protokolü, konkanavalin A ile tanımlanan tüm retina vaskülatürünü gösterecektir (Şekil 1). Farenin zayıf perfüzyonu, tüm vasküler ağacın etiketlenmesini ve ardından lümene yapışan lökositlerin analizini önler (Şekil 2), oysa bir şırınganın hızlı bir şekilde sıkılmasından (30-35 saniyeden az) kaynaklanan aşırı basınç, vasküler geçirgenliğe ve kan damarlarının patlamasına neden olabilir (Şekil 3). Ekstravaze konkanavalin A, dış yapıların yanlış etiketlenmesine neden olabilir ve bu da yapışık lökositlerin kafa karıştırıcı nicelleşmesine yol açabilir.
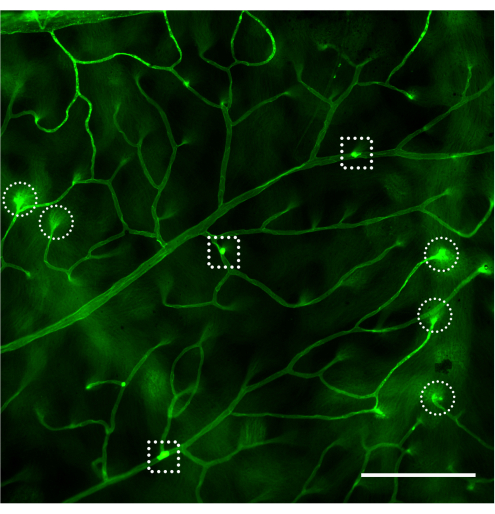
Retina vasküleratürünün değerlendirilmesi ve bağlı lökositlerin floresan mikroskobu ile miktar tayini, retinanın montajından hemen sonra yapılmalıdır (Şekil 4). Retinayı yüksek büyütme altında görüntülerken dikkatli olunmalıdır, çünkü kılcal damarlardaki kıvrımlar damar sistemine yapışık lökositler olarak etiketlenmiş gibi görünebilir (Şekil 4B, kesikli daire). Söz konusu alanı gözlemlerken mikroskobu yukarı ve aşağı odaklamak, genellikle lökostazın retinaya dalan bir damardan ayırt edilmesini sağlayacaktır. Kullanıcı, kullanılacak mikroskopta mevcut floresan küpü ile eşleşen concanavalin A'ya konjuge floroforu değiştirebilir/seçebilir. Diyabetik retinopatide lökostasis dramatik bir olay değildir ve araştırmacı yapışık lökositleri aramak için tüm retinayı tarayarak tüm vasküler ağacı değerlendirmelidir. Genellikle, diyabetik olmayan hayvanlarda retina başına 1-3 lökosit ve diyabetik hayvanlarda retina başına 3-12 lökosit bulunur ve istatistiksel olarak anlamlı farka ulaşmak için minimum örneklem büyüklüğü grup başına 10-12 hayvandır (Şekil 4A,B ve Şekil 5). Böyle bir fenotip göz önüne alındığında, yakın mesafede 2 veya daha fazla lökosit bulmak nadirdir (Şekil 4B, C). Aynı şey, sağlam bir lökostasis fenomeninin gözlendiği lipopolisakkarit (LPS) zorluğu gibi akut inflamasyon modelleri için de geçerli değildir (Şekil 4C ve Şekil 5). LPS meydan okuma modelinin ayrıntılı bir protokolü için 26'ya bakın.
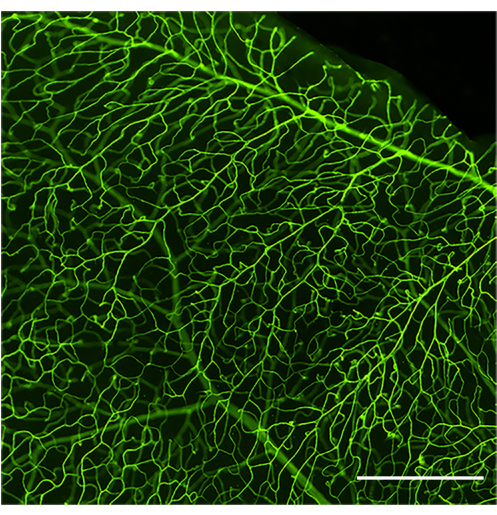
Şekil 1: İyi perfüze edilmiş ve boyanmış bir retina damar sisteminin temsili görüntüsü. Concanavalin A-FITC infüzyonundan sonra sağlıklı bir C57Bl / 6J faresinin (4 aylık) retina vaskülatürünün geniş alan görüntüsü. Concanavalin A-FITC, optimal bir perfüzyon elde edilirse toplam retinal vasküler ağı eşit şekilde boyar. Parlaklık ve kontrast için ayarlandıktan sonra görüntü RGB'ye dönüştürüldü. Ölçek çubuğu = 100 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
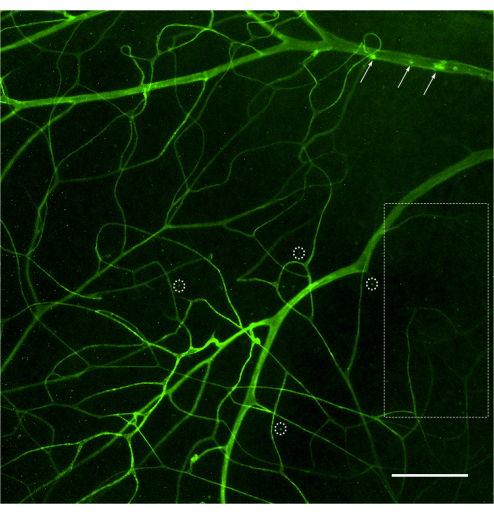
Şekil 2: Retina vaskülatürünün zayıf perfüzyonu ve boyanmasının temsili görüntüsü. Hayvanın zayıf perfüzyonu, concanavalin A'nın retina damarlarına sınırlı erişimine yol açabilir ve bu da retinal vasküler ağın yetersiz boyanmasına neden olabilir. Retinanın geniş alanları, bu vaskülatüre bağlı lökositlerin görselleştirilmesini sınırlayan lekelenme eksikliği (kesikli dikdörtgen) gösterecektir. Concanavalin A alan damarlar bağlı lökositleri (oklar) gösterebilir, ancak bunlar retinanın toplam sayısını temsil etmez. Bu meydana geldiğinde, numune atılmalıdır. Yetersiz belirtme, düşük kaliteli mikroskopi (bazı floresan sinyallerini algılamak için zorlanan kanal) nedeniyle yapay noktalamaya (kesikli daireler) de yol açabilir. Parlaklık ve kontrast için ayarlandıktan sonra görüntü RGB'ye dönüştürüldü. Ölçek çubuğu = 50 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Şekil 3: Retina kılcal damarlarının patlamasını gösteren temsili resim. Bir concanavalin A yükleme şırıngasının (30-35 saniyeden az) hızlı bir şekilde sıkılmasından kaynaklanan aşırı basınç, deneysel olarak indüklenen vasküler geçirgenliğe ve kan damarlarının patlamasına (kesikli daireler) neden olarak dış yapıların veya diğer artefaktların (kesikli kareler) etiketlenmesine yol açabilir. Parlaklık ve kontrast için ayarlandıktan sonra görüntü RGB'ye dönüştürüldü. Ölçek çubuğu = 50 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 4: Diyabetik olmayan, diyabetik ve LPS'ye meydan okuyan farelerde bükülme kılcal damar ve lökostas örnekleri. Concanavalin A-FITC infüzyonundan sonra C57Bl / 6J faresinde (4 aylık) retinal lökostas örnekleri. (A) Diyabetik olmayan farelerde lökostasis görülmez, ancak tüm retinanın taranmasından sonra retina damar sistemine bağlı 1-3 lökosit ile karşılaşmak nadir değildir (ok). (B) Diyabetik farelerde retina vaskülatürüne bağlı lökositler (subklinik inflamasyon modeli) 3 ila 12 arasında değişebilir ve yakın mesafede bağlı lökositlerin bulunması nadirdir (oklar). Çizgi çemberi ile çevrelenmiş yapı, retinaya dalan bir bükülme kılcal damar örneğidir. (C) LPS'li (akut inflamasyon modeli) zorlu fareler, her deneyde lökostasisin pozitif kontrolü olarak yapılabilir. Bu modelde, damar sistemine yakın bir yerde (oklar) bağlı birkaç lökosit bulmak yaygındır. Parlaklık ve kontrast için ayarlandıktan sonra görüntü RGB'ye dönüştürüldü. Ölçek çubuğu = 100 μm. Kısaltma: LPS = lipopolisakkarit. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
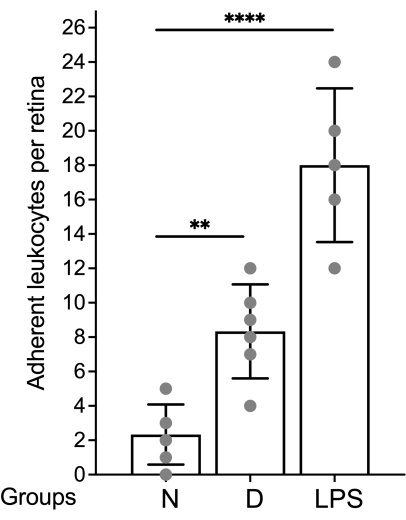
Şekil 5: Sonuçları raporlamak için temsili grafik. Lökosit sayısı retina başına ifade edilir ve veriler ortalama ve standart sapma kullanılarak grafiklendirilir. Kısaltmalar: N = diyabetik olmayan; D = diyabetik; LPS = lipopolisakkarit. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
İnsanlarda lökostas, hiperlökositoz (toplam lökosit (WBC) sayısı >100.000/μL) ile ilişkili semptom ve klinik bulguları ifade eder ve tıbbi bir acil durumdur20. Lökostasise yol açan mekanizma(lar) yoğun bir şekilde araştırılmaktadır. Bugüne kadar, insanlarda in vivo lökostasis çalışması henüz mümkün değildir ve araştırmacıların bu süreci anlamak için hayvan modellerine güvenmeleri gerekmektedir. Farklı hastalıklar löstazi ortaya çıkarır ve fenomeni ex vivo görselleştirmek için ayrıntılı bir protokole sahip olmak laboratuvardaki araştırmacılar için yararlı olabilir. Bu raporda sunulan protokol, retina vaskülatürünün incelenmesi için optimize edilmiştir; Bununla birlikte, Cremaster kasındaki damar sistemi gibi diğer uygun vasküler yatakların incelenmesi için ampirik olarak optimize edilebilir27.
Doğru yapıldığında, bu teknik tüm retina vasküler ağacının perfüzyonuna ve etiketlenmesine ve vasküler duvara yapışan lökositlerin etiketlenmesine ve miktarının belirlenmesine izin verir. Retina bu yöntem için özellikle uygundur, çünkü damar sistemi dokudaki tanımlanmış düzlemlerle sınırlıdır (damar sisteminin daha az düzenli olduğu çoğu dokunun aksine). Bu yöntem, şeffaf (retina) veya çok ince doku (cremaster kası27 gibi) kullanıldığında lekelenmemiş doku ile iyi bir kontrast verir. Kalın dokular veya bol miktarda miyelinli sinirlere veya diğer opak ve pigmentli hücrelere sahip dokular, bu yöntem kullanılarak değerlendirme için zayıf bölgelerdir.
Prosedürde kritik bir gereklilik, damar sisteminin iyi bir şekilde perfüzyonudur. Kalp hala pompalarken perfüzasyon, mikrovaskülatür sisteminin iyi bir şekilde perfüzyonunu ve etiketlenmesini kolaylaştırır. Zayıf vasküler perfüzyon genellikle vazokonstriksiyona yol açan soğuk sıvıların kullanılmasından veya perfüzyon iğnesinin veya forsepsin ağırlığı ve yerleşimi nedeniyle vaskülatürün bükülmesinden kaynaklanır. Perfüzasyon sırasında, perfüzyonun etkinliğine dair bazı ipuçları sağlayabilecekleri için işlem sırasında farklı organlara çok dikkat etmek önemlidir. Örneğin, iğne pulmoner ven içine sokulursa, akış başladığında akciğerler hemen dolar ve renk değiştirir (ağarma), bu da pulmoner ağaçtaki tüm sıvıların sekestrasyonu nedeniyle perfüzyonun optimal olmadığını düşündürür. Perfüzyon sırasında dilde, böbreklerde ve karaciğerde ağarma gözlenir, bu da optimal bir prosedür önerebilir; Bununla birlikte, bu organlar gözleri besleyen kan damarlarının akış aşağısındadır ve bu nedenle organların beyazlatılması vücuda iyi bir perfüzyonu garanti eder, ancak her zaman retinaya değil.
Perfüzyonu etkileyen tespit edilen diğer potansiyel problemler şunlardır: i) mikrodamarlara giren ve floresan boya ile perfüzyonu önleyen perfüzyon hattında sıkışan hava kabarcıkları; ii) Kalbe sokulan gavaj iğnesi aort arkına çok fazla uzatılırsa, sağ karotis arteri tıkamak ve böylece boyanın sağ retinaya akışını önlemek mümkündür; ve iii) perfüzyon çok güçlüyse, intravasküler basınçta ortaya çıkan artış, deneysel olarak indüklenen vasküler geçirgenliğe yol açabilir ve bazı lökositlerin mikrovasküler sistemde yapay olarak sıkışmasına neden olabilir. Deneysel olarak indüklenen vasküler geçirgenlik, mikroskop altında, damarın çevresindeki dokuda lokalize bir ekstravaze konkanavalin A patlaması olarak görselleştirilirken, patolojik vasküler geçirgenlik ince bir dağınık model sunar. İlk senaryoda, dış yapıların veya diğer artefaktların etiketlenmesi, yapışık lökositlerin nicelleştirilmesini potansiyel olarak karıştırabilir. Bu durumda gözlemci, histolojik olarak bir lökositi tanımlayan objektif göstergelere güvenmelidir: şekil, boyut ve lokalizasyon (bir damarın lümeninin içinde).
Diyabetik retinopati gibi aselüler (dejenere) kılcal damarları ortaya çıkaran patolojik durumlar bu tekniğin kullanımını engellemez. Dejenerasyonun erken evrelerindeki kılcal damarlar, endotelyumunu kaybetmiş ancak duvar hücreleri sağlam olanlar hala patentlidir, dejenerasyonun geç evresindeki kılcal damarlar ise artık patentli olmasalar da orijinal yerlerinde kalırlar (fokalize dejenerasyon) ve komşu damarlarda kayda değer değişiklikler gözlenmez 28. Her iki durum da çevredeki vaskülatür etiketlemesine ve lökostasisin değerlendirilmesine izin verir.
Retinanın izolasyonunda çok önemli bir adım, gözün arkasını kesmeden gözün enükleasyonudur. Optik sinir, retina katmanlarını ve nöronları vaskülarize eden gelen ve giden kan damarlarını içerdiğinden, optik sinirin göz küresine girişine çok yakın kesilmesi, retina vasküler ağacının çökmesini neredeyse garanti eder, bu da vaskülatürün optimal olmayan bir görünümüne ve ardından lökostasis fenomeninin analizine yol açar. Gözün ön segmentinin çıkarılması için kullanılan jiletlere ayrıca dikkat edilmelidir; Sık sık değiştirilmelidirler (ideal olarak 1-2 göz için bir tıraş bıçağı), çünkü kör bıçaklar kötü keser ve gözün ve retinanın çekilmesine ve çekilmesine neden olabilir, bu da damar sistemine zarar verir. Gözün ön segmenti çıkarılırken, limbusu keserken gözün döndürülmesi ve merceğin çıkarılması önerilir. Gözün ön segmentinin ilk çıkarılması, ıslak tüy bırakmayan kağıt üzerinde yapıldığında daha kolaydır; Bununla birlikte, ön segmentin çıkarılmasından hemen sonra kağıt çıkarılmalıdır, aksi takdirde yeni izole edilmiş retina kağıda yapışabilir ve geri kazanılamaz.
Bu protokolün çeşitli sınırlamaları olduğunu kabul ediyoruz. İlk olarak, ilk perfüzyon, vaskülatüre gevşek bir şekilde bağlı olan lökositleri çıkarabilir ve araştırmacının, aslında durum böyle olmasa da, lökostasis yokluğunu bildirmesine yol açabilir. Akut bir inflamasyon modeli26 gibi pozitif bir lökostasis kontrolünün dahil edilmesi, lökostasisin mevcut olduğunu göstererek perfüzyonun çok sert olmadığını belirlemeye yardımcı olabilir. İkincisi, eğitimli olmayan bir gözlemcinin, güçlü floresan yapının aslında bir artefakt değil, ilgilenilen hücre olup olmadığını belirlemesi zor olacaktır. Bu sorunun üstesinden gelmek için, araştırmacı lökositlerin şekline (damar sistemine ilk bağlanmada genellikle yuvarlak veya oval) ve boyutuna (12-15 μm) aşina olmalıdır29. Gözlemlenen yapının bir lökosit olup olmadığına dair şüphe varsa, tavsiye edilir ki bunu nicelemeye dahil etmeyin, ancak araştırmacı tahlile daha aşina hale geldiğinde son çağrıyı yapmalıdır. İdeal olarak, belirli bir yazılım kullanılarak otomatik miktar tayini, bağlı lökositlerin damar sistemine emek yoğun manuel miktar tayinini kolaylaştırabilir, ancak bilindiği kadarıyla, lökositler ve artefaktlar arasındaki ayrım ancak araştırmacının bilgisi ve deneyimi ile yapılabilir. Lökositozu otomatik veya yarı otomatik bir şekilde ölçmek için mevcut platformları geliştirmek veya optimize etmek, araştırılması gereken bir seçenektir.
Sonuç olarak, löstazın değerlendirilmesi için onaylanmış bu protokol, diyabetik retinopati ve diğer oküler ve oküler olmayan vasküler hastalıklar üzerinde çalışmalar yapan araştırmacılar ve yeni terapötik girişimleri test etmek için yararlı bir araç olabilir.
Açıklamalar
Yazarların beyan edebilecekleri herhangi bir çıkar çatışması yoktur.
Teşekkürler
Bu çalışma Ulusal Sağlık Enstitüleri (NIH) Hibeleri R01EY022938, R01EY022938-S1 ve K99EY034928 tarafından desteklenmiştir. Yazarlar, CWRU (P30EY11373) ve UCI (P30EY034070) Görsel Bilimler Araştırma Merkezi Çekirdeklerinin hizmetlerinin yanı sıra, Kaliforniya Üniversitesi, Irvine'deki Gavin Herbert Göz Enstitüsü'ne Körlüğü Önleme Araştırmaları'ndan sınırsız bir hibeden departman desteğini kabul eder.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 10 mL syringe | |||
| 4-way stopcock Luer lock I.V. line valve | Baxter | 2C6204 | |
| Concanavalin A solution | Vector | FL-1001 | Prepare in PBS 1 mg/mL |
| Dissecting tools set | Includes hemostats, scissors and forceps | ||
| FIJI | Software for image processing | ||
| Fluorescence microscope | Nikon | Eclipse Ni | |
| Forceps, Dumont #5, Biological grade tip | Electron Microscopy Sciences (EMS) | 72700-D | |
| Gavage Needle 1.25 mm OD barrel tip x 30 mm | Fine Science | 18060-20 | |
| Halstead Mosquito Forceps | Fisher Scientific | 13-812-10 | |
| I.V. Catheter set with regulating clamp 70 inches | Baxter | 2C5417s | |
| I.V. Pole | |||
| Lint free tissue | Kimpwipes is an option | ||
| Micro dissecting spring scissors, Vannas, 3 mm straight | ROBOZ | RS-5620 | |
| Micro spatula | Fine Science Tools (FST) | 10091-12 | |
| Nikon | NIS-Elements (AR 5.30.03 64-bit) | Software for image acquisition | |
| Petri dish (100 mmx15 mm) | Corning | 351029 | |
| Phosphate buffered saline (PBS) | |||
| Pink dental wax | Electron Microscopy Sciences (EMS) | 72670 | |
| Pressure infuser | Infusurge | 4010 | |
| Razor blades, GEM single edge stainless steel, Teflon coated | Electron Microscopy Sciences (EMS) | 71970 | |
| Saline 0.9%, veterinary grade, 1000 mL | Baxter | 04925-04-10 | |
| Small dissecting scissors, curved blunt end 22 mm | ROBOZ | RS 5983 |
Referanslar
- Swystun, L. L., Liaw, P. C. The role of leukocytes in thrombosis. Blood. 128 (6), 753-762 (2016).
- Barouch, F. C., et al. Integrin-mediated neutrophil adhesion and retinal leukostasis in diabetes. Invest Ophthalmol Vis Sci. 41 (5), 1153-1158 (2000).
- Macaron, W., Sargsyan, Z., Short, N. J. Hyperleukocytosis and leukostasis in acute and chronic leukemias. Leuk Lymphoma. 63 (8), 1780-1791 (2022).
- Kempen, J. H., et al. The prevalence of diabetic retinopathy among adults in the United States. Arch Ophthalmol. 122 (4), 552-563 (2004).
- Kohner, E. M. Diabetic retinopathy. Br Med Bull. 45 (1), 148-173 (1989).
- Aouiss, A., Anka Idrissi, D., Kabine, M., Zaid, Y. Update of inflammatory proliferative retinopathy: Ischemia, hypoxia and angiogenesis. Curr Res Transl Med. 67 (2), 62-71 (2019).
- Tsalamandris, S., et al. The role of inflammation in diabetes: Current concepts and future perspectives. Eur Cardiol. 14 (1), 50-59 (2019).
- Adamis, A. P. Is diabetic retinopathy an inflammatory disease. Br J Ophthalmol. 86 (4), 363-365 (2002).
- Joussen, A. M., et al. A central role for inflammation in the pathogenesis of diabetic retinopathy. FASEB J. 18 (12), 1450-1452 (2004).
- Serra, A. M., et al. CD11b+ bone marrow-derived monocytes are the major leukocyte subset responsible for retinal capillary leukostasis in experimental diabetes in mouse and express high levels of CCR5 in the circulation. Am J Pathol. 181 (2), 719-727 (2012).
- Kinukawa, Y., Shimura, M., Tamai, M. Quantifying leukocyte dynamics and plugging in retinal microcirculation of streptozotosin-induced diabetic rats. Curr Eye Res. 18 (1), 49-55 (1999).
- Linsenmeier, R. A., et al. Retinal hypoxia in long-term diabetic cats. Invest Ophthalmol Vis Sci. 39 (9), 1647-1657 (1998).
- Herdade, A. S., et al. Effects of diabetes on microcirculation and leukostasis in retinal and non-ocular tissues: Implications for diabetic retinopathy. Biomolecules. 10 (11), 1583 (2020).
- Oakley, J., et al. Incorporating hemoglobin levels to map leukostasis risk in acute leukemia using microvasculature-on-chip technologies. Blood. 136 (Suppl 1), 9-10 (2020).
- Miyamoto, K., et al. Prevention of leukostasis and vascular leakage in streptozotocin-induced diabetic retinopathy via intercellular adhesion molecule-1 inhibition. Proc Natl Acad Sci U S A. 96 (19), 10836-10841 (1999).
- Veenstra, A., et al. Diabetic retinopathy: Retina-specific methods for maintenance of diabetic rodents and evaluation of vascular histopathology and molecular abnormalities. Curr Protoc Mouse Biol. 5 (3), 247-270 (2015).
- Lester, T. J., Johnson, J. W., Cuttner, J. Pulmonary leukostasis as the single worst prognostic factor in patients with acute myelocytic leukemia and hyperleukocytosis. Am J Med. 79 (1), 43-48 (1985).
- Porcu, P., et al. Hyperleukocytic leukemias and leukostasis: a review of pathophysiology, clinical presentation and management. Leuk Lymphoma. 39 (1-2), 1-18 (2000).
- Giammarco, S., et al. Hyperleukocytosis and leukostasis: management of a medical emergency. Expert Rev Hematol. 10 (2), 147-154 (2017).
- Mank, V., Azhar, W., Brown, K. Leukocytosis. StatPearls. , (2024).
- Bernhard, W., Avrameas, S. Ultrastructural visualization of cellular carbohydrate components by means of concanavalin A. Exp Cell Res. 64 (1), 232-236 (1971).
- Oliver, J. M., Zurier, R. B., Berlin, R. D. Concanavalin a cap formation on polymorphonuclear leukocytes of normal and beige (chediak-higashi) mice. Nature. 253 (5491), 471-473 (1975).
- Pink, J. R., Hoessli, D., Tartakoff, A., Hooghe, R. Characterisation of Concanavalin A-binding glycoproteins from mouse splenic leukocytes by two-dimensional electrophoresis: preferential binding of incompletely glycosylated forms of H-2 antigen to the lectin. Mol Immunol. 20 (4), 491-497 (1983).
- Janssen, B., Debets, J., Leenders, P., Smits, J. Chronic measurement of cardiac output in conscious mice. Am J Physiol Regul Integr Comp Physiol. 282 (3), R928-R935 (2002).
- Flecknell, P. A., Flecknell, P. A. Anaesthesia of common laboratory species: Special considerations. Laboratory Animal Anaesthesia. , 181-241 (2009).
- Seemann, S., Zohles, F., Lupp, A. Comprehensive comparison of three different animal models for systemic inflammation. J Biomed Sci. 24 (1), 60 (2017).
- Lessieur, E. M., et al. ICAM-1 on the luminal surface of endothelial cells is induced to a greater extent in mouse retina than in other tissues in diabetes. Diabetologia. 65 (10), 1734-1744 (2022).
- Kuwabara, T., Cogan, D. G. Studies of retinal vascular patterns: I. Normal architecture. Arch Ophthalmol. 64, 904-911 (1960).
- Tigner, A., Ibrahim, S. A., Murray, I. V. Histology, white blood cell. StatPearls. , (2024).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır