Method Article
網膜血管系における糖尿病誘発性付着性白血球の定量化
要約
網膜血管系と付着性白血球の壁を標識する方法を示します。これらの付着性白血球は、炎症のパラメータまたはその炎症の治療法に対する反応として、蛍光顕微鏡でカウントできます。
要約
白血球症とは、血管系の管腔壁への白血球の付着を指します。この白血球と血管壁との相互作用は炎症の特徴であり、糖尿病性網膜症を含むさまざまな組織や疾患の毛細血管閉塞と因果関係があります。
白血球増加症は、生命を脅かす白血球増加症の合併症として何年も前から報告されており、臨床的にしか診断できません。この現象の重要性を考慮して、その発現につながる可能性のあるメカニズムを理解するために集中的な研究が行われてきました。しかし、実験室の設定では、イベントの深刻度を視覚化および定量化するためのゴールドスタンダードの手法はありません。
以下に要約する方法では、最初に血管系に緩衝液を注入して血液を除去し、次にコンカナバリンAを血管系に灌流して、露出したすべての細胞壁に結合し、白血球に特に明るい染色を引き起こします。結合していないすべての血液細胞を除去する灌流が成功した場合、蛍光標識された残りの白血球は血管系に結合し、利用可能な蛍光顕微鏡を使用して手動で定量できます。
概要
白血球(白血球、WBC)は、血液流動性の維持や血栓の分解能の調節など、血管系の最適な機能に重要な役割を果たします1。また、血管系の管腔壁に長時間付着し、少なくとも一時的には白血球安定症として知られる現象である血管閉塞を引き起こすなど、いくつかの病的状態でも重要な役割を果たします2,3。
糖尿病性網膜症は、長期糖尿病の最も一般的な合併症の1つであり、米国および世界中で20〜75歳の個人の視覚障害と失明の主な原因の1つです4。網膜血管系のゆっくりと進行性の変性は、疾患の初期段階の臨床的に意味のある要素であり、一部の患者では網膜虚血を引き起こし、その結果として網膜血管新生が行われます5,6。累積的な証拠は、炎症が網膜症の発症に重要な役割を果たしていることを示しており7、白血球減少症は無症候性の血管内炎症反応と考えられています。白血栓症は、糖尿病の初期段階で、検出可能な臨床症状が発症するかなり前に発生します8,9,10。糖尿病における付着性白血球による網膜血管の繰り返しの詰まり(慢性白血球症)は、毛細血管の血管閉塞および変性に寄与する可能性がある11,12,13。この白血球避縮の重症度は病理学的に重要であり、疾患プロセスの重症度を監視したり、研究環境での治療の有効性を評価したりするために使用できます。
高血糖微小環境が白血球うっ滞に及ぼす特異的な影響をさらに研究するために、in vitroモデルが設計されました。単離された網膜微小血管内皮細胞は、2Dまたは3D培養モデル(microvasculature-on-a-chip14)のいずれかで増殖および配置して、血管内皮(血管の内腔を舗装する細胞単層)を複製することができる。ただし、これらのモデルの実験的なバリエーションにより、その使用は制限されます。in vivo でのヒト網膜血管系における白血球感染の研究はまだ限られているため、網膜白血球感染に関する現在の知識のほとんどは、糖尿病性網膜症の動物モデルから得られています13,15。
このレポートの目的は、白血球うっ滞のパラメーターとして網膜血管系に付着した白血球を定量化するための、他の場所で説明されている方法16に基づく標準プロトコルを説明することです。このアッセイは、悪性腫瘍3,17,18,19およびいくつかの感染性およびアレルギー状態20など、白血球うっ滞を呈する他の血管疾患の研究に用いることができる。このプロトコルは、特殊な機器を必要とせずに、あらゆる基礎研究所で実装できます。以下に要約する方法では、血管系は最初に血液を除去するために緩衝液で灌流され、次に、コンカナバリンAが血管系に灌流され、そこで露出した全ての細胞壁に結合し、白血球の特に明るい染色を引き起こす21,22,23。結合していないすべての血液細胞を除去する灌流が成功した場合、血管系に結合した残りの蛍光標識白血球は、手元にある任意の蛍光顕微鏡を使用して手動で定量できます。
プロトコル
このプロトコルは、カリフォルニア大学アーバイン校の動物管理・使用委員会(IACUC)によって審査・承認されており、実験動物の世話と使用に関する政府の規制に準拠しています。このプロトコルには停止点はありません。マウスあたりの平均時間は30分です。
1. 灌流ステージの準備
- 0.9%生理食塩水バッグとコンカナバリンA溶液を37 °Cの水浴で20〜30分間温めてから使用してください。
注意: コンカナバリンAを光から保護します(ホイルで覆います)。 - 処置が行われる表面に滴り落ちる血液や液体を入れるためのトレイを設置します。トレイの上に、吸収性ベンチアンダーパッドまたは吸収性材料で覆われた加熱パッドを置きます。
注:目標は、冷却により灌流中に血液を除去するのがより困難になるため、処置中にマウスの体が熱を失うのを避けることです。
2.圧力注入器のセットアップ
- 0.9%生理食塩水の袋、I.V.カテーテルセット、4方向弁活栓、および強制針を直列に接続します。
- 0.9%生理食塩水バッグをネットと圧力注入器の空気袋の間に挿入します。生理食塩水バッグを気嚢の背面にあるフックに掛けます。IVポールループを使用して、IVポールに圧力注入器を吊るします。
- システムを数分間開いて(実行して)、流量を18〜20 mL / min24に設定して、すべての気泡のラインとポートをパージします。圧力注入器の気袋を膨らませるには、ストップコックハンドルを回して開いているストップコックベントの方を向いてから、圧力計が希望の圧力を示すまで膨張バルブをポンプで送ります。各マウスを灌流する前に、圧力を再調整してください。収縮させるには、ストップコックハンドルをインフレバルブに向かってまっすぐ下に回します。
注:0.9%生理食塩水バッグが新しい場合、通常150mmHgの圧力で目的の流量が得られます。ただし、圧力注入器のブランドや0.9%生理食塩水バッグの使用期間中の変動により、圧力は経験的に調整する必要があります。 - 温めたコンカナバリンA溶液を充填した10mLシリンジを4方向弁に取り付けます。
注意: シリンジを光にさらさないように保護します(ホイルで覆います)。
3.麻酔
- ケタミン:キシラジンの腹腔内(I.P.)注射により麻酔を送達します。マウスの手術/処置に最も広く使用されている用量は、100:10 mg / kg体重25です。ペダル反射(つま先をしっかりとつまむ)によって麻酔を評価します。
注:この用量は、45〜60分の外科的麻酔の持続時間で4〜6分の発症を提供します。麻酔カクテルは、室温で最大2週間保存できます。
4. コンカナバリンAによる経心灌流および染色
- マウスを仰臥位の灌流ステージに置き、胸腔と腹腔の露出を可能にします。
- 剣状突起を視覚的に識別し、止血剤を利き手に持って、皮膚を固定してロックします。止血剤が固定されたら、それを利き手ではない手に移し、皮膚を持ち上げます。
- 利き手でハサミを使用し、背骨に対して90°の角度で皮膚のパッチを切り取り、外腹壁を露出させます。
- 剣状突起と胸郭が見えてきたので、臓器や主要な血管を切らないように注意しながら、腹壁を両側に解剖します。
- 横隔膜が見えてきたら、横隔膜を通して心室と肺を視覚化します。はさみの先端を使用して、臓器や主要な血管を切らないように注意しながら、背骨に近い側面の1つの横隔膜を切り取ります。
注:横隔膜のこの「穴」は、負の胸腔内圧を大気圧と平衡化し、気胸が発生して肺が崩壊し、心臓が収縮し、肺や心臓を損傷することなく横隔膜の解剖が容易になります。 - 肋骨を通って肺と平行に解剖を続けて、胸の「フラップ」を作成します。止血剤を放出し、矢状面の剣状突起を切断します。剣状突起を手動で静かに大きく開きます。心臓の4つの部屋を観察してください。
- 利き手ではない手で鉗子を使用して、心臓の頂点近くをつかみます。利き手で、強制針(点滴カテーテルに取り付けられている)を持ち、心臓の頂点に穴を開けます。左心室の完全な穿孔または肺血管系に到達し、その後全身性血管系の灌流不良を避けるために、強制針のボール先端の端の配置を確認します。湾曲した蚊の鉗子を使用して強制針を所定の位置に固定するか、IVストップコックを操作しながら手で保持します。
- ストップコックを0.9%生理食塩水まで開き、ほぼ同時に、はさみで右心室を切り開きます。2〜3分間灌流します。灌流時間中は、針を左右および上下にゆっくりと動かして、血管系のねじれを減らし、心臓からの血液の排出を増やします。
- 生理食塩水で灌流した後、活栓のハンドルを回して生理食塩水からの流れを遮断し、注射器から強制針への流れを待ちます。コンカナバリンA溶液を定常状態の速度で手で灌流します。.10 mLのコンカナバリンA溶液が30〜35秒で分注されていることを確認します。.
- コンカナバリンAで ?? 流した後、バルブを回してシリンジからの流れを遮断し、0.9%生理食塩水から再び強制針への流れを待ちます。.0.9%生理食塩水でさらに2〜3分間灌流します。心臓から強制針を取り外します。
注:このプロトコルで提案されているコンカナバリンAは、フルオレセイン(緑)に結合しています。ただし、他の蛍光色素に結合したコンカナバリンAも利用可能です。
5. 新鮮網膜の核形成と分離
- マウスを横にして、利き手ではない方の手を使用して、人差し指と親指をそれぞれ上まぶたと下まぶたに置きます。まぶたと皮膚を指でそっと引っ込め、目をプロップトースして、眼窩から部分的に膨らむようにします。
- 目を支えた状態で、利き手で湾曲したハサミを使用し、目の下を45°の角度ですくい取ります。筋肉の付着部と視神経を切断します。ヘラと同じハサミを使用して、目を小さな容器に移すか、直接解剖顕微鏡のステージに移します。
注意: このステップ中に目の後ろを切り取らないように注意し、目を引っ張らないように注意してください。 - デンタルワックスに目を置いて、地球を開きます。解剖顕微鏡の下で、利き手ではない手を使用して、マイクロ鉗子で強膜のひだまたは後眼に外部に付着したままの筋肉の残骸を保持し、角膜が横を向くように眼の向きを合わせます。
注意: 地球儀を開くときに目が動いたり滑ったりするのを防ぐために、濡れた糸くずの出ない組織を歯科用ワックスの上に置くことができます。 - テフロンコーティングされたカミソリの刃の鋭い角の1つを使用して、リンバス(角膜-強膜接合部)の後ろに1〜2mmの切開を行います。マイクロ鉗子で強膜のひだまたは筋肉を保持し、最小限の下向きの力でブレードをリンバス全体に引き込みます。かみそりでカットを続けて、前眼部(角膜、虹彩、水晶体、硝子体)を後眼部(アイカップ)から完全に分離します。
注意: 前後に見ないでください。 - 二等分されたアイカップをPBS付きの小さなシャーレに移します。
注意: 網膜がティッシュペーパーに接触することは避けてください(手順5.3の注意)は、紙にしっかりとくっついて回復することが不可能になるためです。 - 強膜のひだまたは強膜の外側に残っている筋肉をマイクロ鉗子でつかみます。マイクロスパチュラを使用して、アイカップの周囲のリンバスのすべての接続を切断することにより、網膜を強膜から完全に切り離します。マイクロスパチュラで網膜を強膜からすくい取ります。網膜が視神経によって強膜に付着している場合は、網膜と強膜の間にマイクロハサミを滑り込ませて視神経を切断します。
- 網膜の周辺にある硝子体筋と毛様体筋の残骸をすべて取り除きます。分離された網膜を直ちにPBSのあるスライドに移します。
注:研究者の好みに応じて、他の網膜分離技術を使用できます。
6.網膜のフラットマウント
- 固定されていない網膜を少量のPBSでスライド上にレイアウトします。マイクロスパチュラを使用して、硝子体側を上にして網膜をそっと向けます。網膜が内側に折りたたまれている場合は、マイクロスパチュラを使用して網膜を広げている間、マイクロ鉗子を使用して網膜の端を保持します。
- 網膜に4〜5個の放射状に切り込みを入れて、網膜が平らになるようにします(クローバーの葉のパターン)。
- 糸くずの出ないティッシュを使用して、網膜から余分なPBSを乾かします。
注:組織で網膜に触れないでください。そうしないと、サンプルが失われます。網膜を平らに保つためには、カバースリップが望ましいです。
7. 顕微鏡検査
注:このステップには、GFP/FITC(480/530 nm)チャンネルを備えた任意の蛍光顕微鏡を使用できます。この研究では、488チャンネルの参照顕微鏡と画像取得用の関連ソフトウェアを使用しました。
- 最近フラットマウントされた網膜を顕微鏡下で100倍(対物レンズ10倍)で観察し、組織全体(右から左または上から下)を系統的にスキャンすることにより、蛍光標識された白血球(手動)をカウントします。
注:白血球は、円形または楕円形を示すことができる単一の蛍光ドットです。それらは直径12〜15μmであり、網膜毛細血管からはみ出していません(構造は血管の内腔によって完全に拘束されています)。 - 目的の倍率で代表的な画像を取得し、選択したソフトウェア(ImageJ [Fiji]など)で画像の後処理を実行します。
- 網膜あたりの白血球としてカウントを表します。データを平均±標準偏差でグラフ化します。
結果
適切に実行された灌流および染色プロトコルは、コンカナバリンAで描かれた完全な網膜血管系を示します(図1)。マウスの灌流が不十分な場合、血管ツリー全体の標識と、その後の内腔に付着した白血球の分析が妨げられます(図2)一方、注射器の急速な圧迫(30〜35秒未満)による過度の圧力は、血管透過性と血管の破裂を引き起こす可能性があります(図3)。血管外漏出したコンカナバリンAは、外部構造の誤った標識を引き起こし、付着性白血球の交絡定量につながる可能性があります。
網膜血管系の評価と、蛍光顕微鏡による付着白血球の定量化は、網膜を装着した直後に行う必要があります(図4)。高倍率で網膜を見るときは、毛細血管の曲がりが血管系に付着している白血球にラベル付けされているように見える可能性があるため、注意が必要です(図4B、破線の円)。問題の領域を観察しながら顕微鏡の焦点を上下に合わせると、通常、白血球固定と網膜に潜る血管を区別できます。ユーザーは、使用する顕微鏡で利用可能な蛍光キューブに一致するコンカナバリンAに結合した蛍光色素を変更/選択できます。糖尿病性網膜症の白血球増加症は劇的な出来事ではなく、研究者は付着性白血球を探すために網膜全体をスキャンすることにより、血管樹全体を評価する必要があります。通常、非糖尿病動物の網膜あたり1〜3個の白血球、糖尿病動物の網膜あたり3〜12個の白血球があり、統計的に有意な差に達するための最小サンプルサイズは、グループあたり10〜12匹です(図4A、B、および図5)。このような表現型を考えると、2つ以上の白血球が近接して見つかることはまれです(図4B、C)。同じことは、強力な白血球減少現象が観察されるリポ多糖(LPS)チャレンジのような炎症の急性モデルには当てはまりません(図4Cおよび図5)。LPSチャレンジモデルの詳細なプロトコルについては、26を参照してください。
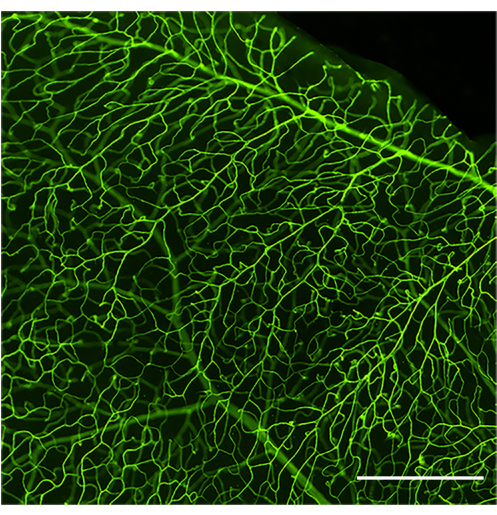
図1:よく灌流され染色された網膜血管系の代表的な画像。 健康なC57Bl/6Jマウス(生後4ヶ月)のコンカナバリンA-FITC注入後の網膜血管系の広視野画像。コンカナバリンA-FITCは、最適な ?? 流が達成された場合、網膜血管網全体を均一に染色します。.明るさとコントラストを調整した後、画像をRGBに変換しました。スケールバー = 100 μm。 この図の拡大版を表示するには、ここをクリックしてください。
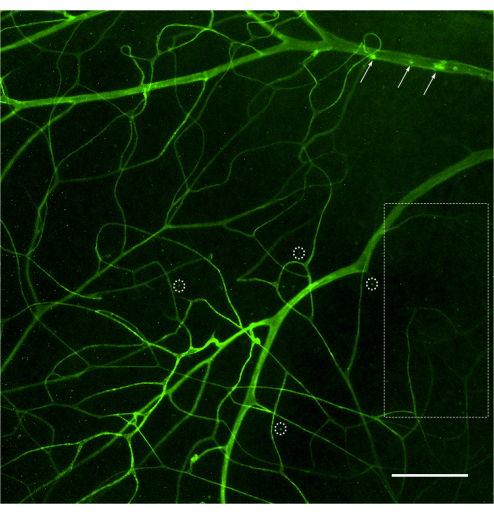
図2:網膜血管系の不良な灌流と染色の代表的な画像。 動物の灌流が不十分な場合、網膜血管へのコンカナバリンAへのアクセスが制限され、網膜血管網の染色が不十分になる可能性があります。.網膜の広範な領域は染色の欠如を示し(破線の長方形)、その血管系に付着した白血球の視覚化を制限します。コンカナバリンAを投与された血管は、付着した白血球(矢印)を示す場合がありますが、網膜の総数を表すものではありません。これが発生した場合、サンプルは廃棄する必要があります。また、記載が不十分な場合、低品質の顕微鏡検査(蛍光シグナルを検出するための強制チャネル)により、人為的な点状(破線の円)が発生する可能性もあります。明るさとコントラストを調整した後、画像をRGBに変換しました。スケールバー = 50 μm。 この図の拡大版を表示するには、ここをクリックしてください。
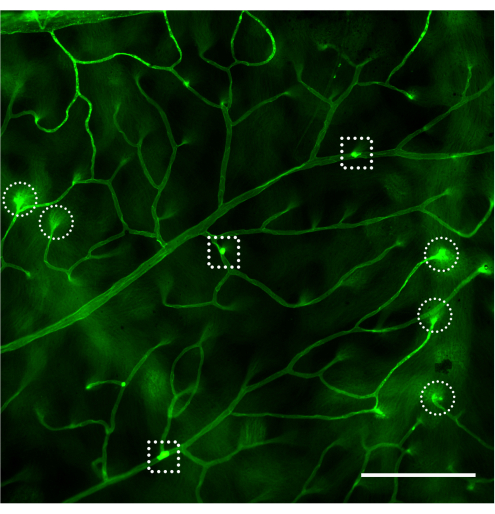
図3:網膜毛細血管の破裂を示す代表的な画像。 コンカナバリンAローディングシリンジ(30〜35秒未満)の急速な圧迫による過度の圧力は、実験的に誘発された血管透過性と血管の破裂(破線の円)を引き起こし、外部構造または他のアーティファクト(破線の正方形)のラベル付けにつながる可能性があります。明るさとコントラストを調整した後、画像をRGBに変換しました。スケールバー = 50 μm。 この図の拡大版を表示するには、ここをクリックしてください。

図4:非糖尿病、糖尿病、およびLPSチャレンジマウスにおける屈曲毛細血管および白血球減少の例。 コンカナバリンA-FITC注入後のC57Bl/6Jマウス(生後4ヶ月)における網膜白血球増加症の例。(A)非糖尿病マウスでは白血球うっ滞はみられませんが、網膜全体をスキャンした後、網膜血管系に付着した白血球が1〜3個現れることも珍しくありません(矢印)。(B)糖尿病マウスの網膜血管系に付着した白血球(無症候性炎症のモデル)は3〜12の範囲であり、付着した白血球が近接して見つかることはまれです(矢印)。破線の円で囲まれた構造は、屈曲した毛細血管が網膜に潜り込む例です。(C)LPS(急性炎症のモデル)を持つ挑戦的なマウスは、白血球うっ滞の陽性制御として各実験で行うことができます。このモデルでは、血管系に近接して付着したいくつかの白血球を見つけるのが一般的です(矢印)。明るさとコントラストを調整した後、画像はRGBに変換されました。スケールバー = 100 μm。略語:LPS =リポ多糖。 この図の拡大版を表示するには、ここをクリックしてください。
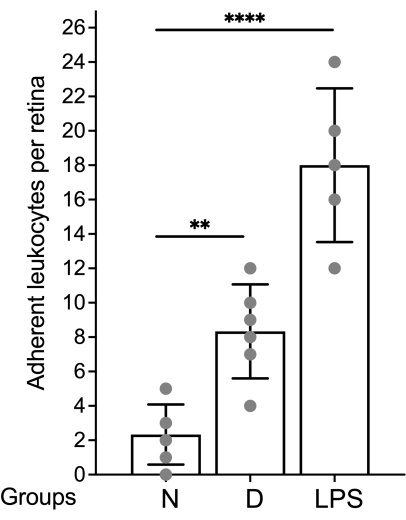
図5:結果を報告するための代表的なグラフ。 白血球数は網膜ごとに表され、データは平均と標準偏差を使用してグラフ化されます。略語:N =非糖尿病;D =糖尿病;LPS =リポ多糖類。 この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
ヒトの白血球減少症とは、白血球増加症に関連する症状と臨床所見を指し(総白血球(WBC)数>100,000/μL)であり、医療上の緊急事態です20。白血球減少症を引き起こすメカニズムは、現在集中的に研究されています。これまで、 ヒトの生体内で の白血球増殖の研究はまだ可能ではなく、研究者はこのプロセスを理解するために動物モデルに頼る必要があります。さまざまな疾患が白血球減少症を呈し、 ex vivo で現象を視覚化するための詳細なプロトコルを持つことは、研究室の研究者にとって有用です。このレポートで提示されたプロトコルは、網膜血管系の研究に最適化されています。しかし、それは、CremasterMuscle27の血管系のような他の適切な血管床の研究のために経験的に最適化することができる。
この手法を正しく実行すると、網膜血管ツリー全体の灌流と標識、および血管壁に付着する白血球の標識と定量が可能になります。網膜は、その血管系が組織内の定義された平面に制限されているため、この方法に特に適しています(血管系が整然としていないほとんどの組織とは異なります)。この方法は、透明組織(網膜)または非常に薄い組織(cremaster muscle27など)を使用する場合、未染色組織との良好なコントラストを与える。厚い組織、または有髄性神経または他の不透明で色素沈着した細胞が豊富な組織を有する組織は、この方法を使用して評価するには不十分な部位です。
この手順の重要な要件は、血管系の良好な灌流です。心臓がまだポンプを動かしている間に灌流すると、微小血管系の良好な灌流と標識が容易になります。血管灌流不良は、多くの場合、血管収縮につながる冷たい液体の使用、または灌流針または鉗子の重量と配置による血管系のねじれが原因です。灌流中は、灌流の効率の手がかりを提供できるため、手順中にさまざまな臓器に細心の注意を払うことが重要です。たとえば、針が肺静脈に挿入されると、流れが開始されるとすぐに肺が満たされて色が変わる(ブランチング)ため、肺樹内のすべての液体が隔離されるため、灌流が最適ではなくなることが示唆されています。灌流中に舌、腎臓、肝臓にブランチングが観察され、これが最適な手順を示唆している可能性があります。ただし、これらの臓器は目を供給する血管の下流にあるため、臓器のブランチングは体への良好な灌流を保証しますが、必ずしも網膜への灌流を保証するわけではありません。
灌流に影響を与えることが確認されている他の潜在的な問題は、i)灌流ラインに閉じ込められた気泡が微小血管に入り込み、蛍光色素による灌流を妨げる。ii)心臓に挿入された強制針が大動脈弓に伸びすぎている場合、右頸動脈を塞ぎ、それによって右網膜への色素の流れを防ぐことができる。iii)灌流が強すぎると、結果として生じる血管内圧の上昇により、実験的に誘発された血管透過性が引き起こされ、一部の白血球が微小血管系に人工的に閉じ込められる可能性があります。実験的に誘発された血管透過性は、血管の周囲組織における血管外漏出性コンカナバリンAの局所的なバーストとして顕微鏡下で視覚化されますが、病理学的血管透過性は微妙な拡散パターンを示します。最初のシナリオでは、外部構造やその他のアーティファクトの標識が発生し、接着性白血球の定量化が混乱する可能性があります。この状況では、観察者は、白血球を組織学的に定義する客観的な指標、すなわち形状、サイズ、および局在(血管の内腔内)に頼るべきです。
糖尿病性網膜症などの無細胞性(変性)毛細血管を示す病理学的状態は、この技術の使用を妨げるものではありません。変性の初期段階の毛細血管は、内皮を失ったが壁細胞が無傷であるものは、まだ特許であり、一方、変性後期の毛細血管は、もはや特許ではないが、元の部位に留まり(限局性変性)、隣接する血管 28に目立った変化は観察されない。 どちらの状況でも、周囲の血管系の標識と白血球うっ滞の評価が可能になります。
網膜の分離における重要なステップは、目の後ろを切り取らずに眼を摘出することです。視神経には、網膜層とニューロンを血管新生する血管の出入りが含まれているため、眼球への入り口に近すぎる視神経を切断すると、網膜血管樹が崩壊することがほぼ確実になり、血管系の最適でないビューとその後の白血球減少現象の分析につながります。目の前部切除に使用されるかみそりの刃には、さらに注意を払う必要があります。鈍い刃は切れ味が悪く、目や網膜を引っ張ったり引っ張ったりして血管系を損傷する可能性があるため、頻繁に交換する必要があります(理想的には1〜2個の目あたりのかみそりの刃)。目の前部を切除するときは、輪部を切って眼球を回転させ、水晶体を取り外すことをお勧めします。目の前部の最初の除去は、濡れた糸くずの出ない紙で行うと簡単です。ただし、前眼部を切除した直後に用紙を取り除かないと、新たに分離された網膜が用紙に付着して回復できなくなる可能性があります。
このプロトコルにはいくつかの制限があることを認識しています。まず、最初の灌流により、血管系に緩く付着している白血球が除去される可能性があり、実際にはそうではない可能性があるにもかかわらず、研究者は白血球感染の欠如を報告することになります。炎症の急性モデル26のような白血球うっ滞のポジティブコントロールを含めることは、白血球減少が存在することを示すことにより、灌流がそれほど厳しくなかったと判断するのに役立つ可能性がある。そして第二に、訓練を受けていない観察者にとって、強い蛍光構造が実際に目的の細胞であり、アーティファクトではないかどうかを判断することは困難です。この問題を克服するために、研究者は白血球の形状(通常は血管系への最初の付着時に円形または楕円形)とサイズ(12〜15μm)に精通する必要があります29。 観察された構造が白血球であるかどうか疑わしい場合は、定量に含めないことをお勧めしますが、研究者はアッセイに慣れてから最終的な決定を下す必要があります。理想的には、特定のソフトウェアを使用した自動定量化により、血管系に付着した白血球の手作業による定量化が容易になることが望ましいですが、知る限り、白血球と人工物の区別は、研究者の知識と経験によってのみ行うことができます。白血球増加症を自動または半自動の方法で定量化するための現在のプラットフォームを開発または最適化することは、検討すべき選択肢です。
結論として、白血球減少症の評価のためのこの検証済みのプロトコルは、糖尿病性網膜症やその他の眼および非眼血管疾患の研究を行う研究者や、新しい治療介入をテストするための有用なツールになる可能性があります。
開示事項
著者は、宣言する利益相反を持っていません。
謝辞
この研究は、国立衛生研究所(NIH)の助成金R01EY022938、R01EY022938-S1、およびK99EY034928の支援を受けました。著者らは、CWRU(P30EY11373)およびUCI(P30EY034070)Visual Science Research Center Coresのサービス、およびResearch to Prevent Blindnessからカリフォルニア大学アーバイン校のGavin Herbert Eye Instituteへの無制限の助成金による部門のサポートを認めています。
資料
| Name | Company | Catalog Number | Comments |
| 10 mL syringe | |||
| 4-way stopcock Luer lock I.V. line valve | Baxter | 2C6204 | |
| Concanavalin A solution | Vector | FL-1001 | Prepare in PBS 1 mg/mL |
| Dissecting tools set | Includes hemostats, scissors and forceps | ||
| FIJI | Software for image processing | ||
| Fluorescence microscope | Nikon | Eclipse Ni | |
| Forceps, Dumont #5, Biological grade tip | Electron Microscopy Sciences (EMS) | 72700-D | |
| Gavage Needle 1.25 mm OD barrel tip x 30 mm | Fine Science | 18060-20 | |
| Halstead Mosquito Forceps | Fisher Scientific | 13-812-10 | |
| I.V. Catheter set with regulating clamp 70 inches | Baxter | 2C5417s | |
| I.V. Pole | |||
| Lint free tissue | Kimpwipes is an option | ||
| Micro dissecting spring scissors, Vannas, 3 mm straight | ROBOZ | RS-5620 | |
| Micro spatula | Fine Science Tools (FST) | 10091-12 | |
| Nikon | NIS-Elements (AR 5.30.03 64-bit) | Software for image acquisition | |
| Petri dish (100 mmx15 mm) | Corning | 351029 | |
| Phosphate buffered saline (PBS) | |||
| Pink dental wax | Electron Microscopy Sciences (EMS) | 72670 | |
| Pressure infuser | Infusurge | 4010 | |
| Razor blades, GEM single edge stainless steel, Teflon coated | Electron Microscopy Sciences (EMS) | 71970 | |
| Saline 0.9%, veterinary grade, 1000 mL | Baxter | 04925-04-10 | |
| Small dissecting scissors, curved blunt end 22 mm | ROBOZ | RS 5983 |
参考文献
- Swystun, L. L., Liaw, P. C. The role of leukocytes in thrombosis. Blood. 128 (6), 753-762 (2016).
- Barouch, F. C., et al. Integrin-mediated neutrophil adhesion and retinal leukostasis in diabetes. Invest Ophthalmol Vis Sci. 41 (5), 1153-1158 (2000).
- Macaron, W., Sargsyan, Z., Short, N. J. Hyperleukocytosis and leukostasis in acute and chronic leukemias. Leuk Lymphoma. 63 (8), 1780-1791 (2022).
- Kempen, J. H., et al. The prevalence of diabetic retinopathy among adults in the United States. Arch Ophthalmol. 122 (4), 552-563 (2004).
- Kohner, E. M. Diabetic retinopathy. Br Med Bull. 45 (1), 148-173 (1989).
- Aouiss, A., Anka Idrissi, D., Kabine, M., Zaid, Y. Update of inflammatory proliferative retinopathy: Ischemia, hypoxia and angiogenesis. Curr Res Transl Med. 67 (2), 62-71 (2019).
- Tsalamandris, S., et al. The role of inflammation in diabetes: Current concepts and future perspectives. Eur Cardiol. 14 (1), 50-59 (2019).
- Adamis, A. P. Is diabetic retinopathy an inflammatory disease. Br J Ophthalmol. 86 (4), 363-365 (2002).
- Joussen, A. M., et al. A central role for inflammation in the pathogenesis of diabetic retinopathy. FASEB J. 18 (12), 1450-1452 (2004).
- Serra, A. M., et al. CD11b+ bone marrow-derived monocytes are the major leukocyte subset responsible for retinal capillary leukostasis in experimental diabetes in mouse and express high levels of CCR5 in the circulation. Am J Pathol. 181 (2), 719-727 (2012).
- Kinukawa, Y., Shimura, M., Tamai, M. Quantifying leukocyte dynamics and plugging in retinal microcirculation of streptozotosin-induced diabetic rats. Curr Eye Res. 18 (1), 49-55 (1999).
- Linsenmeier, R. A., et al. Retinal hypoxia in long-term diabetic cats. Invest Ophthalmol Vis Sci. 39 (9), 1647-1657 (1998).
- Herdade, A. S., et al. Effects of diabetes on microcirculation and leukostasis in retinal and non-ocular tissues: Implications for diabetic retinopathy. Biomolecules. 10 (11), 1583 (2020).
- Oakley, J., et al. Incorporating hemoglobin levels to map leukostasis risk in acute leukemia using microvasculature-on-chip technologies. Blood. 136 (Suppl 1), 9-10 (2020).
- Miyamoto, K., et al. Prevention of leukostasis and vascular leakage in streptozotocin-induced diabetic retinopathy via intercellular adhesion molecule-1 inhibition. Proc Natl Acad Sci U S A. 96 (19), 10836-10841 (1999).
- Veenstra, A., et al. Diabetic retinopathy: Retina-specific methods for maintenance of diabetic rodents and evaluation of vascular histopathology and molecular abnormalities. Curr Protoc Mouse Biol. 5 (3), 247-270 (2015).
- Lester, T. J., Johnson, J. W., Cuttner, J. Pulmonary leukostasis as the single worst prognostic factor in patients with acute myelocytic leukemia and hyperleukocytosis. Am J Med. 79 (1), 43-48 (1985).
- Porcu, P., et al. Hyperleukocytic leukemias and leukostasis: a review of pathophysiology, clinical presentation and management. Leuk Lymphoma. 39 (1-2), 1-18 (2000).
- Giammarco, S., et al. Hyperleukocytosis and leukostasis: management of a medical emergency. Expert Rev Hematol. 10 (2), 147-154 (2017).
- Mank, V., Azhar, W., Brown, K. Leukocytosis. StatPearls. , (2024).
- Bernhard, W., Avrameas, S. Ultrastructural visualization of cellular carbohydrate components by means of concanavalin A. Exp Cell Res. 64 (1), 232-236 (1971).
- Oliver, J. M., Zurier, R. B., Berlin, R. D. Concanavalin a cap formation on polymorphonuclear leukocytes of normal and beige (chediak-higashi) mice. Nature. 253 (5491), 471-473 (1975).
- Pink, J. R., Hoessli, D., Tartakoff, A., Hooghe, R. Characterisation of Concanavalin A-binding glycoproteins from mouse splenic leukocytes by two-dimensional electrophoresis: preferential binding of incompletely glycosylated forms of H-2 antigen to the lectin. Mol Immunol. 20 (4), 491-497 (1983).
- Janssen, B., Debets, J., Leenders, P., Smits, J. Chronic measurement of cardiac output in conscious mice. Am J Physiol Regul Integr Comp Physiol. 282 (3), R928-R935 (2002).
- Flecknell, P. A., Flecknell, P. A. Anaesthesia of common laboratory species: Special considerations. Laboratory Animal Anaesthesia. , 181-241 (2009).
- Seemann, S., Zohles, F., Lupp, A. Comprehensive comparison of three different animal models for systemic inflammation. J Biomed Sci. 24 (1), 60 (2017).
- Lessieur, E. M., et al. ICAM-1 on the luminal surface of endothelial cells is induced to a greater extent in mouse retina than in other tissues in diabetes. Diabetologia. 65 (10), 1734-1744 (2022).
- Kuwabara, T., Cogan, D. G. Studies of retinal vascular patterns: I. Normal architecture. Arch Ophthalmol. 64, 904-911 (1960).
- Tigner, A., Ibrahim, S. A., Murray, I. V. Histology, white blood cell. StatPearls. , (2024).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved