Method Article
Quantification des leucocytes adhérents induits par le diabète dans le système vasculaire rétinien
Dans cet article
Résumé
Nous démontrons une méthode pour marquer les parois du système vasculaire rétinien et des leucocytes adhérents. Ces leucocytes adhérents peuvent ensuite être comptés au microscope à fluorescence comme un paramètre de l’inflammation ou de la réponse de cette inflammation aux thérapies.
Résumé
La leucostasie fait référence à la fixation des leucocytes à la paroi luminale du système vasculaire. Cette interaction des leucocytes avec la paroi des vaisseaux sanguins est caractéristique de l’inflammation et a été liée de manière causale à l’occlusion capillaire dans une variété de tissus et de maladies, y compris la rétinopathie diabétique.
La leucostase est signalée depuis des années comme une complication potentiellement mortelle de l’hyperleucocytose et ne peut être diagnostiquée que cliniquement. Compte tenu de l’importance du phénomène, des recherches intensives ont été menées pour comprendre le(s) mécanisme(s) potentiel(s) qui conduisent à sa manifestation ; Cependant, il n’existe pas de technique de référence en laboratoire pour visualiser et quantifier la gravité de l’événement.
Dans la méthode résumée ci-dessous, le système vasculaire est d’abord perfusé avec un tampon pour éliminer le sang, puis la concanavaline A est perfusée dans le système vasculaire où elle se lie à toutes les parois cellulaires exposées et provoque une coloration particulièrement brillante des leucocytes. Si la perfusion pour éliminer toutes les cellules sanguines non liées a réussi, les leucocytes restants marqués par fluorescence sont liés au système vasculaire et ils peuvent être quantifiés manuellement à l’aide de n’importe quel microscope à fluorescence disponible.
Introduction
Les leucocytes (globules blancs, GB) jouent un rôle important dans le fonctionnement optimal du système vasculaire, comme le maintien de la fluidité sanguine et la régulation de la résolution du thrombus1. Ils jouent également un rôle clé dans certaines conditions pathologiques, telles que l’adhérence à la paroi luminale du système vasculaire pendant de longues périodes, entraînant une obstruction des vaisseaux, au moins temporairement, un phénomène connu sous le nom de leucostase 2,3.
La rétinopathie diabétique est l’une des complications les plus courantes du diabète à long terme et l’une des principales causes de déficience visuelle et de cécité aux États-Unis et dans le monde entier chez les personnes âgées de 20 à 75ans 4. La dégénérescence lente et progressive du système vasculaire rétinien est une composante cliniquement significative des premiers stades de la maladie, qui chez certains patients conduit à une ischémie rétinienne avec la néovascularisation rétinienne qui en résulte 5,6. Les preuves cumulatives indiquent que l’inflammation joue un rôle important dans le développement de la rétinopathie7, et la leucostase est considérée comme une réponse inflammatoire intravasculaire subclinique. La leucostase survient aux premiers stades du diabète, bien avant que des manifestations cliniques détectablesne se soient développées8,9,10. L’obstruction répétée des vaisseaux rétiniens par les leucocytes adhérents pendant des mois ou des années (leucostase chronique) dans le diabète pourrait contribuer à l’occlusion vasculaire et à la dégénérescence des capillaires 11,12,13. La gravité de cette leucostase a une signification pathologique et peut être utilisée pour surveiller la gravité du processus pathologique ou pour évaluer l’efficacité d’un traitement dans le cadre de la recherche.
Pour étudier plus en détail les effets spécifiques du microenvironnement hyperglycémique sur la leucostase, des modèles in vitro ont été conçus. Des cellules endothéliales microvasculaires rétiniennes isolées peuvent être cultivées et disposées dans des modèles de cultures 2D ou 3D (microvascularisation sur puce14) pour répliquer l’endothélium vasculaire (la monocouche cellulaire qui pave la lumière des vaisseaux). Cependant, la variation interexpérimentale de ces modèles limite leur utilisation. L’étude de la leucostase dans le système vasculaire rétinien humain in vivo est encore limitée et, par conséquent, la plupart des connaissances actuelles sur la leucostase rétinienne proviennent de modèles animaux de rétinopathie diabétique13,15.
L’objectif de ce rapport est de décrire un protocole standard basé sur les méthodes décrites ailleurs16 pour la quantification des leucocytes attachés au système vasculaire rétinien en tant que paramètre de la leucostase. Ce test peut être utilisé pour étudier d’autres maladies vasculaires qui présentent également une leucostase, telles que les tumeurs malignes 3,17,18,19 et certaines affections infectieuses et allergiques20. Ce protocole peut être mis en œuvre dans n’importe quel laboratoire de recherche fondamentale sans avoir besoin d’équipement spécialisé. Dans la méthode résumée ci-dessous, le système vasculaire est d’abord perfusé avec un tampon pour éliminer le sang, puis la concanavaline A est perfusée dans le système vasculaire où elle se lie à toutes les parois cellulaires exposées et provoque une coloration particulièrement brillante des leucocytes 21,22,23. Si la perfusion pour éliminer toutes les cellules sanguines non liées réussit, les leucocytes restants marqués par fluorescence qui sont liés au système vasculaire peuvent être quantifiés manuellement à l’aide de n’importe quel microscope à fluorescence disponible.
Protocole
Le protocole a été examiné et approuvé par l’Institutional Animal Care and Use Committee (IACUC) de l’Université de Californie à Irvine et est conforme aux réglementations gouvernementales concernant le soin et l’utilisation des animaux de laboratoire. Il n’y a pas de points d’arrêt dans ce protocole. Le temps moyen par souris est de 30 min.
1. Préparation de l’étape de perfusion
- Réchauffer le sachet de solution saline à 0,9 % et la solution de concanavalin A dans un bain-marie à 37 °C pendant 20 à30 minutes avant utilisation.
REMARQUE : Protégez le concanavalin A de l’exposition à la lumière (couvrez avec une feuille d’aluminium). - Installez un plateau pour contenir le sang et les liquides qui coulent sur la surface où la procédure aura lieu. Sur le dessus du plateau, placez un coussin chauffant recouvert d’un sous-coussin absorbant ou de tout autre matériau absorbant.
REMARQUE : L’objectif est d’éviter que le corps de la souris ne perde de la chaleur pendant la procédure, car le refroidissement rend plus difficile l’élimination du sang pendant la perfusion.
2. Configuration de l’infuseur à pression
- Connectez en série le sac de solution saline à 0,9 %, le kit de cathéter IV, un robinet d’arrêt de valve à 4 voies et l’aiguille de gavage.
- Insérez le sac de solution saline à 0,9 % entre le filet et la vessie d’air de l’infuseur de pression. Accrochez le sac salin au crochet situé à l’arrière de la vessie d’air. Utilisez la boucle de la perche IV pour accrocher l’infuseur de pression dans la perche IV.
- Purgez les conduites et les orifices de toutes les bulles d’air en laissant le système s’ouvrir (fonctionner) pendant quelques minutes et réglez le débit à 18-20 ml/min24. Pour gonfler la vessie d’air de l’infuseur de pression, tournez la poignée du robinet d’arrêt vers l’évent du robinet d’arrêt ouvert, puis pompez la poire de gonflage jusqu’à ce que le manomètre indique la pression souhaitée. Réajustez la pression avant de perfuser chaque souris. Pour dégonfler, tournez la poignée du robinet d’arrêt vers le bas vers l’ampoule de gonflage.
REMARQUE : Si le sac de solution saline à 0,9 % est neuf, une pression généralement de 150 mmHg fournit le débit souhaité ; Cependant, la pression doit être ajustée empiriquement en raison des variations entre les marques d’infuseurs de pression et sur la période d’utilisation du sac de solution saline à 0,9 %. - Fixez une seringue de 10 mL remplie d’une solution de concanavaline A réchauffée à la valve à 4 voies.
REMARQUE : Protégez la seringue de l’exposition à la lumière (couvrez d’une feuille d’aluminium).
3. Anesthésie
- Administrer l’anesthésie par injection intrapéritonéale (I.P.) de kétamine :xylazine ; La dose la plus largement utilisée pour la chirurgie/procédure de souris est de 100:10 mg/kg de poids corporel25. Évaluer l’anesthésie par réflexe de pédale (pincement ferme de l’orteil).
REMARQUE : Cette dose fournit un début de 4 à 6 minutes avec une durée de 45 à 60 minutes d’anesthésie chirurgicale. Le cocktail anesthésique peut être conservé à température ambiante pendant un maximum de 2 semaines.
4. Perfusion transcardique et coloration à la concanavaline A
- Placez la souris sur la platine de perfusion en position couchée pour permettre l’exposition de la cavité thoracique et abdominale.
- Identifiez visuellement le processus xiphoïde et, avec l’hémostat dans la main dominante, épinglez la peau et verrouillez-la. Une fois l’hémostat fixé, transférez-le dans la main non dominante et soulevez la peau.
- Utilisez des ciseaux dans la main dominante et coupez, à un angle de 90° par rapport à la colonne vertébrale, une partie de la peau pour révéler la paroi abdominale externe.
- Avec l’apophyse xiphoïde et la cage thoracique maintenant visibles, disséquez la paroi abdominale bilatéralement, en prenant soin d’éviter de couper des organes ou des vaisseaux majeurs.
- Avec le diaphragme maintenant visible, visualisez les ventricules cardiaques et les poumons à travers le diaphragme. À l’aide de la pointe des ciseaux, coupez à travers le diaphragme dans l’un des flancs, près de la colonne vertébrale, en prenant soin d’éviter de couper des organes ou des vaisseaux majeurs.
REMARQUE : Ce « trou » dans le diaphragme équilibrera la pression intrathoracique négative avec la pression atmosphérique, et un pneumothorax se produira qui effondrera les poumons et rétractera le cœur, facilitant la dissection du diaphragme sans endommager les poumons ou le cœur. - Continuez à disséquer à travers les côtes et parallèlement aux poumons pour créer un « lambeau » thoracique. Libérez l’hémostat et coupez le processus xiphoïde dans le plan sagittal. Ouvrez doucement le processus xiphoid manuellement. Observez les quatre cavités du cœur.
- Avec la main non dominante et à l’aide d’une pince, saisissez le cœur près de son sommet. Avec la main dominante, tenez l’aiguille de gavage (attachée au cathéter IV) et perforez l’apex du cœur. Pour éviter une perforation complète du ventricule gauche ou l’atteinte du système vasculaire pulmonaire puis une mauvaise perfusion du système vasculaire, vérifiez l’emplacement de l’extrémité de l’extrémité de la pointe de la boule de l’aiguille du gavage, qui doit se trouver au bord du site de ponction légèrement en saillie du cœur. Fixez l’aiguille de gavage en place à l’aide d’une pince à moustiques incurvée ou tenez-la simplement à la main tout en manipulant le robinet d’arrêt intraveineux.
- Ouvrez le robinet d’arrêt à la solution saline à 0,9 % et presque simultanément, ouvrez le ventricule droit avec des ciseaux ; perfuser pendant 2-3 min. Pendant le temps de perfusion, déplacez doucement l’aiguille d’un côté à l’autre et de haut en bas pour réduire le pliage du système vasculaire et augmenter la sortie du sang du cœur.
- Après avoir perfusé avec du sérum physiologique, tournez la poignée du robinet d’arrêt pour couper l’écoulement de la solution saline et permettre l’écoulement de la seringue vers l’aiguille du gavage. Perfuser à la main avec le concanavalin Une solution à un taux d’équilibre. S’assurer que les 10 mL de solution de concanavalin A sont distribués en 30 à 35 s.
- Après avoir perfusé avec la concanavaline A, tournez la valve pour couper l’écoulement de la seringue et permettre à nouveau l’écoulement de la solution saline à 0,9 % vers l’aiguille du gavage. Perfuser avec la solution saline à 0,9 % pendant 2 à 3 minutes supplémentaires. Retirez l’aiguille de gavage du cœur.
REMARQUE : La concanavaline A suggérée dans ce protocole est conjuguée à la fluorescéine (vert) ; cependant, le concanavalin A attaché à d’autres fluorochromes est également disponible.
5. Énucléation et isolement de la rétine fraîche
- Tournez la souris sur le côté et, à l’aide de la main non dominante, placez l’index et le pouce sur les paupières supérieure et inférieure, respectivement. Rétractez doucement les paupières et la peau avec les doigts et étalez l’œil, le faisant partiellement gonfler hors de l’orbite.
- Lorsque l’œil est allongé, utilisez des ciseaux incurvés dans la main dominante et ramassez-le sous l’œil à un angle de 45°. Coupez l’attache musculaire et le nerf optique. À l’aide des mêmes ciseaux qu’une spatule, transférez l’œil dans un petit récipient ou directement sur la platine du microscope de dissection.
REMARQUE : Veillez à ne pas couper l’arrière de l’œil et évitez de tirer l’œil pendant cette étape. - Placez l’œil sur une cire dentaire pour ouvrir le globe. Sous le microscope de dissection et à l’aide de la main non dominante, tenez le pli scléral ou les restes musculaires encore attachés à l’extérieur de l’œil postérieur à l’aide d’une micro-pince, et orientez l’œil de manière à ce que la cornée soit tournée vers le côté.
REMARQUE : Pour empêcher l’œil de bouger/glisser lors de l’ouverture du globe, un morceau de tissu humide non pelucheux peut être placé sur la cire dentaire. - Avec l’un des coins tranchants d’une lame de rasoir recouverte de téflon, faites une incision de 1 à 2 mm derrière et parallèlement au limbe (jonction cornée-sclérotique). Tenez le pli scléral ou le muscle à l’aide de la micro-pince et tirez la lame sur le limbe avec une force minimale vers le bas. Continuez à couper avec le rasoir pour séparer totalement le segment antérieur (cornée, iris, cristallin et vitré) du segment postérieur (œilleton).
REMARQUE : Ne sciez pas d’avant en arrière. - Transférez l’œilleton coupé en deux dans une petite boîte de Pétri avec du PBS.
REMARQUE : Évitez tout contact de la rétine avec le papier de soie (note à l’étape 5.3) car il collera étroitement au papier et deviendra essentiellement impossible à récupérer. - Saisissez un pli scléral ou le muscle restant à l’extérieur de la sclérotique à l’aide d’une micro-pince. Détachez complètement la rétine de la sclérotique en brisant toutes les connexions au niveau du limbe autour du périmètre de l’œilleton à l’aide d’une micro-spatule. Prélevez la rétine de la sclérotique à l’aide de la micro-spatule. Si la rétine est toujours attachée à la sclérotique par le nerf optique, glissez les micro-ciseaux entre la rétine et la sclérotique pour couper le nerf optique.
- Retirez tous les restes de muscle vitré et ciliaire à la périphérie de la rétine. Transférez immédiatement la rétine isolée sur une lame avec un peu de PBS.
REMARQUE : Toute autre technique d’isolement de la rétine peut être utilisée selon la préférence du chercheur.
6. Montage à plat de la rétine
- Disposez la rétine non fixée sur une lame avec une petite quantité de PBS. À l’aide de la micro-spatule, orientez doucement la rétine avec le côté vitré vers le haut. Si la rétine est repliée vers l’intérieur, utilisez une micro-pince pour maintenir les bords de la rétine pendant que la rétine est dépliée à l’aide de la micro-spatule.
- Faites 4 à 5 coupes radiales dans la rétine pour qu’elle soit à plat (motif trèfle).
- À l’aide d’un mouchoir non pelucheux, séchez l’excès de PBS loin de la rétine.
REMARQUE : Ne touchez pas la rétine avec le tissu ; Sinon, l’échantillon sera perdu. Le lamelle est souhaitable pour maintenir la rétine plate.
7. Microscopie
REMARQUE : Tout microscope à fluorescence doté d’un canal GFP/FITC (480/530 nm) peut être utilisé pour cette étape. Pour ce travail, nous avons utilisé le microscope référencé à 488 canaux et le logiciel associé pour l’acquisition d’images.
- Observez la rétine récemment montée à plat au microscope à un grossissement de 100x (objectif 10x) et comptez les leucocytes marqués par fluorescence (manuellement) en balayant méthodiquement l’ensemble du tissu (de droite à gauche ou de haut en bas).
REMARQUE : Les leucocytes sont des points fluorescents simples qui peuvent afficher une forme ronde ou ovale. Ils ont un diamètre de 12 à 15 m et ne dépassent pas des capillaires rétiniens (la structure est complètement contrainte par la lumière du vaisseau). - Acquérez des images représentatives avec le grossissement souhaité et effectuez le post-traitement des images avec le logiciel de votre choix (par exemple, ImageJ [Fidji]).
- Exprimez le nombre de leucocytes par rétine. Représenter graphiquement les données par moyenne ± écart-type.
Résultats
Un protocole de perfusion et de coloration bien exécuté montrera la vasculature rétinienne complète délimitée par la concanavaline A (Figure 1). Une mauvaise perfusion de la souris empêche le marquage de l’ensemble de l’arbre vasculaire et l’analyse ultérieure des leucocytes adhérents à la lumière (Figure 2), tandis qu’une pression excessive due à une pression rapide d’une seringue (moins de 30-35 s) peut provoquer une perméabilité vasculaire et un éclatement des vaisseaux sanguins (Figure 3). La concanavaline A extravasée peut provoquer un étiquetage erroné des structures externes, ce qui entraîne une quantification confondante des leucocytes adhérents.
L’évaluation du système vasculaire rétinien et la quantification des leucocytes attachés par microscopie à fluorescence doivent être effectuées immédiatement après le montage de la rétine (Figure 4). Il faut être prudent lorsque l’on observe la rétine sous un fort grossissement car les courbures des capillaires peuvent sembler être étiquetées comme des leucocytes adhérents au système vasculaire (Figure 4B, cercle pointillé). Focaliser le microscope de haut en bas tout en observant la zone en question permet généralement de différencier la leucostase d’un vaisseau plongeant dans la rétine. L’utilisateur peut changer/choisir le fluorophore conjugué à la concanavaline A qui correspond au cube de fluorescence disponible dans le microscope à utiliser. La leucostase dans la rétinopathie diabétique n’est pas un événement dramatique et le chercheur doit évaluer l’ensemble de l’arbre vasculaire en scannant l’ensemble de la rétine à la recherche de leucocytes adhérents. Habituellement, il y a 1 à 3 leucocytes par rétine chez les animaux non diabétiques et 3 à 12 leucocytes par rétine chez les animaux diabétiques, et la taille minimale de l’échantillon pour atteindre une différence statistiquement significative est de 10 à 12 animaux par groupe (figures 4A, B et 5). Compte tenu d’un tel phénotype, il est rare de trouver 2 leucocytes ou plus à proximité (Figure 4B,C). Il n’en va pas de même pour les modèles aigus d’inflammation tels que le défi du lipopolysaccharide (LPS) où un phénomène de leucostase robuste est observé (Figure 4C et Figure 5). Pour un protocole détaillé du modèle de provocation LPS, reportez-vous à la section 26.
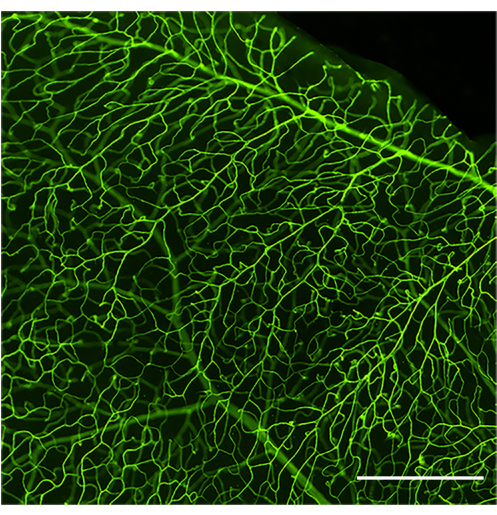
Figure 1 : Image représentative d’un système vasculaire rétinien bien perfusé et coloré. Image à grand champ du système vasculaire rétinien d’une souris C57Bl/6J saine (âgée de 4 mois) après perfusion de concanavalin A-FITC. Concanavalin A-FITC colore uniformément l’ensemble du réseau vasculaire rétinien si une perfusion optimale a été obtenue. Après avoir ajusté la luminosité et le contraste, l’image a été convertie en RVB. Barre d’échelle = 100 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
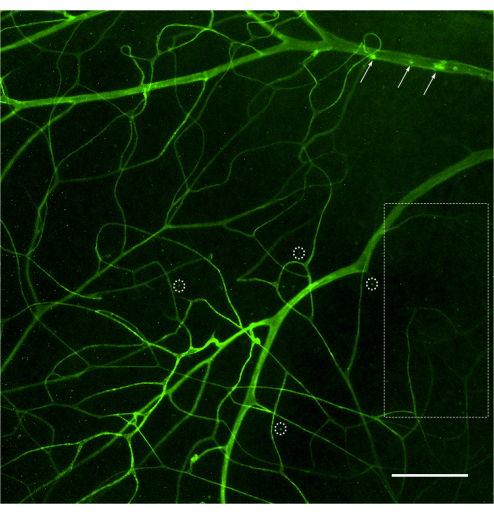
Figure 2 : Image représentative d’une mauvaise perfusion et d’une coloration du système vasculaire rétinien. Une mauvaise perfusion de l’animal peut entraîner un accès limité du concanavalin A aux vaisseaux rétiniens, ce qui entraîne une coloration déficiente du réseau vasculaire rétinien. De vastes zones de la rétine montreront un manque de coloration (rectangle pointillé), limitant la visualisation des leucocytes attachés à ce système vasculaire. Les vaisseaux qui ont reçu de la concanavine-A peuvent présenter des leucocytes attachés (flèches), mais ils ne représentent pas le nombre total de rétines. Lorsque cela se produit, l’échantillon doit être jeté. Une indication déficiente peut également conduire à un ponctué artificiel (cercles pointillés) en raison d’une microscopie de mauvaise qualité (canal forcé pour détecter un signal fluorescent). Après avoir ajusté la luminosité et le contraste, l’image a été convertie en RVB. Barre d’échelle = 50 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
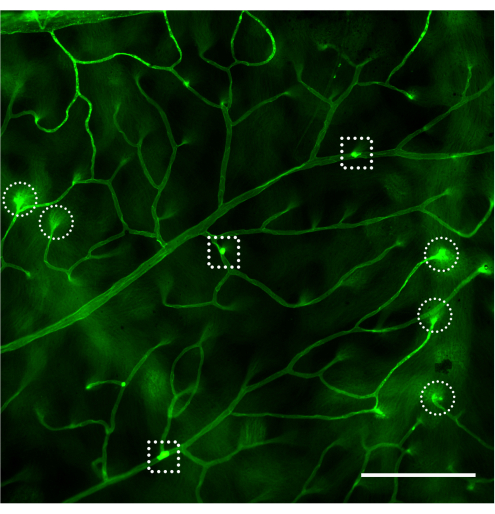
Figure 3 : Image représentative montrant l’éclatement des capillaires rétiniens. Une pression excessive due à une pression rapide d’une seringue de chargement A de concanavalin (moins de 30 à 35 s) peut provoquer une perméabilité vasculaire induite expérimentalement et un éclatement des vaisseaux sanguins (cercles en pointillés) conduisant à l’étiquetage de structures externes ou d’autres artefacts (carrés en pointillés). Après avoir ajusté la luminosité et le contraste, l’image a été convertie en RVB. Barre d’échelle = 50 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 4 : Exemples de flexion capillaire et de leucostase chez des souris non diabétiques, diabétiques et souffrant de LPS. Exemples de leucostase rétinienne chez la souris C57Bl/6J (âgée de 4 mois) après perfusion de concanavalin A-FITC. (A) Les souris non diabétiques ne présentent pas de leucostase, mais il n’est pas rare de rencontrer 1 à 3 leucocytes attachés au système vasculaire rétinien après un balayage de l’ensemble de la rétine (flèche). (B) Les leucocytes attachés au système vasculaire rétinien chez les souris diabétiques (modèle d’inflammation subclinique) peuvent varier de 3 à 12 et il est rare de trouver des leucocytes attachés à proximité immédiate (flèches). La structure enfermée dans le cercle du tiret est un exemple de capillaire plié plongeant dans la rétine. (C) Des souris présentant un LPS (modèle d’inflammation aiguë) peuvent être réalisées avec chaque expérience en tant que contrôle positif de la leucostase. Dans ce modèle, il est courant de trouver plusieurs leucocytes attachés au système vasculaire à proximité immédiate (flèches). Après avoir ajusté la luminosité et le contraste, l’image a été convertie en RVB. Barre d’échelle = 100 μm. Abréviation : LPS = lipopolysaccharide. Veuillez cliquer ici pour voir une version agrandie de cette figure.
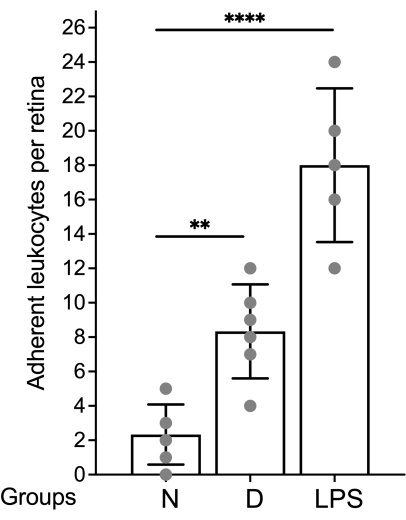
Figure 5 : Graphique représentatif pour rapporter les résultats. Le nombre de leucocytes est exprimé par rétine et les données sont représentées graphiquement à l’aide de la moyenne et de l’écart-type. Abréviations : N = non-diabétique ; D = diabétique ; LPS = lipopolysaccharide. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
La leucostasie chez l’homme fait référence aux symptômes et aux signes cliniques associés à l’hyperleucocytose (nombre total de leucocytes (GB) >100 000/μL) et constitue une urgence médicale20. Le ou les mécanismes qui conduisent à la leucostase font l’objet de recherches intensives. À ce jour, l’étude de la leucostase chez l’homme in vivo n’est pas encore possible et les chercheurs doivent s’appuyer sur des modèles animaux pour comprendre ce processus. Différentes maladies présentent la leucostase et disposer d’un protocole détaillé pour visualiser le phénomène ex vivo peut être utile pour les chercheurs en laboratoire. Le protocole présenté dans ce rapport a été optimisé pour l’étude du système vasculaire rétinien ; Cependant, il peut être optimisé empiriquement pour l’étude d’autres lits vasculaires appropriés tels que le système vasculaire dans le muscle crémaster27.
Lorsqu’elle est correctement réalisée, cette technique permet la perfusion et le marquage de l’ensemble de l’arbre vasculaire rétinien et le marquage et la quantification des leucocytes adhérant à la paroi vasculaire. La rétine est particulièrement adaptée à cette méthode car son système vasculaire est limité à des plans définis dans le tissu (contrairement à la plupart des tissus où le système vasculaire est moins ordonné). Cette méthode donne un bon contraste avec les tissus non colorés lors de l’utilisation de tissus transparents (rétine) ou très minces (comme le muscle crémaster27). Les tissus épais ou les tissus ayant des nerfs myélinisés abondants ou d’autres cellules opaques et pigmentées sont de mauvais sites pour l’évaluation à l’aide de cette méthode.
Une condition essentielle dans la procédure est une bonne perfusion du système vasculaire. La perfusion pendant que le cœur est encore en train de pomper facilite la bonne perfusion et le marquage de la microvascularisation. Une mauvaise perfusion vasculaire est souvent due à l’utilisation de liquides froids qui entraînent une vasoconstriction ou une flexion du système vasculaire due au poids et à l’emplacement de l’aiguille de perfusion ou de la pince. Bien que déroutant, il est important de porter une attention particulière aux différents organes pendant la procédure car ils peuvent fournir des indices sur l’efficacité de la perfusion. Par exemple, si l’aiguille est insérée dans la veine pulmonaire, les poumons se rempliront et changeront de couleur (blanchiment) immédiatement lorsque l’écoulement est commencé, ce qui suggère que la perfusion sera sous-optimale en raison de la séquestration de tous les liquides dans l’arbre pulmonaire. Un blanchiment est observé dans la langue, les reins et le foie pendant la perfusion, ce qui pourrait suggérer une procédure optimale ; Cependant, ces organes se trouvent en aval des vaisseaux sanguins qui alimentent les yeux et donc, le blanchiment des organes garantit une bonne perfusion à l’organisme mais pas toujours à la rétine.
D’autres problèmes potentiels qui ont été identifiés et qui ont un impact sur la perfusion sont : i) les bulles d’air piégées dans la ligne de perfusion qui pénètrent dans les microvaisseaux et empêchent la perfusion avec le colorant fluorescent ; ii) si l’aiguille de gavage insérée dans le cœur est prolongée trop loin dans l’arc aortique, il est possible de bloquer l’artère carotide droite, empêchant ainsi l’écoulement du colorant dans la rétine droite ; et iii) si la perfusion est trop forte, l’augmentation de la pression intravasculaire qui en résulte peut conduire à une perméabilité vasculaire induite expérimentalement et pourrait amener certains leucocytes à devenir piégés de manière artédientielle dans le système microvasculaire. La perméabilité vasculaire induite expérimentalement est visualisée au microscope sous la forme d’une rafale localisée de concanavaline A extravasée dans le tissu environnant du vaisseau, tandis que la perméabilité vasculaire pathologique présente un motif diffus subtil. Dans le premier scénario, le marquage de structures externes ou d’autres artefacts pourrait se produire, ce qui pourrait perturber la quantification des leucocytes adhérents. Dans ce cas, l’observateur doit se fier aux indicateurs objectifs qui définissent histologiquement un leucocyte : forme, taille et localisation (à l’intérieur de la lumière d’un vaisseau).
Les états pathologiques qui présentent des capillaires acellulaires (dégénérés) tels que la rétinopathie diabétique n’excluent pas l’utilisation de cette technique. Les capillaires aux premiers stades de la dégénérescence, ceux qui ont perdu l’endothélium mais les cellules murales sont intactes, sont encore patents, tandis que les capillaires au stade avancé de la dégénérescence, bien qu’ils ne soient plus patents, ils restent à leur site d’origine (dégénérescence focalisée) et des changements non appréciables sont observés dans les vaisseaux voisins 28. Les deux circonstances permettent l’étiquetage du système vasculaire environnant et l’évaluation de la leucostase.
Une étape cruciale dans l’isolement de la rétine est l’énucléation de l’œil sans couper l’arrière de l’œil. Comme le nerf optique contient les vaisseaux sanguins entrants et sortants qui vascularisent les couches rétiniennes et les neurones, sectionner le nerf optique trop près de son entrée dans le globe oculaire garantit presque l’effondrement de l’arbre vasculaire rétinien, conduisant à une vue sous-optimale du système vasculaire et à l’analyse ultérieure du phénomène de leucostase. Une attention particulière doit être accordée aux lames de rasoir utilisées pour l’ablation du segment antérieur de l’œil ; Ils doivent être changés fréquemment (idéalement une lame de rasoir pour 1 à 2 yeux) car les lames émoussées coupent mal et peuvent entraîner une traction et une traction de l’œil et de la rétine, ce qui endommagera à son tour le système vasculaire. Lors de l’ablation du segment antérieur de l’œil, il est suggéré de faire pivoter l’œil tout en coupant au niveau du limbe et de retirer le cristallin. L’ablation initiale du segment antérieur de l’œil est plus facile lorsqu’elle est effectuée sur du papier humide non pelucheux ; Cependant, le papier doit être retiré immédiatement après le retrait du segment antérieur, sinon la rétine fraîchement isolée pourrait se fixer au papier et ne pas pouvoir être récupérée.
Nous reconnaissons que ce protocole présente plusieurs limites. Tout d’abord, la perfusion initiale peut éliminer les leucocytes qui sont faiblement attachés au système vasculaire, ce qui amène le chercheur à signaler une absence de leucostase alors qu’en fait ce n’est peut-être pas le cas. L’inclusion d’un contrôle positif de la leucostase, comme un modèle aigu d’inflammation26, pourrait aider à déterminer que la perfusion n’était pas trop dure en montrant la présence d’une leucostase. Deuxièmement, il sera difficile pour un observateur non formé de déterminer si la structure fortement fluorescente est en fait la cellule d’intérêt et non un artefact. Pour surmonter ce problème, le chercheur doit se familiariser avec la forme (généralement ronde ou ovale à l’attache initiale au système vasculaire) et la taille (12 à 15 μm) des leucocytes29. S’il y a un doute sur le fait que la structure observée est ou n’est pas un leucocyte, il est conseillé de ne pas l’inclure dans la quantification, mais le chercheur doit prendre la décision finale une fois qu’il se familiarise avec le test. Idéalement, la quantification automatique à l’aide d’un logiciel spécifique pourrait faciliter la quantification manuelle à forte intensité de main-d’œuvre des leucocytes attachés au système vasculaire, cependant, jusqu’à ce que l’on sache, la distinction entre les leucocytes et les artefacts ne peut être faite que par les connaissances et l’expérience du chercheur. Le développement ou l’optimisation des plateformes actuelles pour quantifier la leucocytose de manière automatique ou semi-automatique est une option qui devrait être explorée.
En conclusion, ce protocole validé pour l’évaluation de la leucostase pourrait être un outil utile pour les chercheurs effectuant des études sur la rétinopathie diabétique et d’autres maladies vasculaires oculaires et non oculaires et pour tester de nouvelles interventions thérapeutiques.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à déclarer.
Remerciements
Ce travail a été soutenu par les subventions R01EY022938, R01EY022938-S1 et K99EY034928 des National Institutes of Health (NIH). Les auteurs remercient les services des noyaux de recherche en sciences visuelles de la CWRU (P30EY11373) et de l’UCI (P30EY034070), ainsi que le soutien ministériel d’une subvention sans restriction de Research to Prevent Blindness à l’Institut de l’œil Gavin Herbert de l’Université de Californie à Irvine.
matériels
| Name | Company | Catalog Number | Comments |
| 10 mL syringe | |||
| 4-way stopcock Luer lock I.V. line valve | Baxter | 2C6204 | |
| Concanavalin A solution | Vector | FL-1001 | Prepare in PBS 1 mg/mL |
| Dissecting tools set | Includes hemostats, scissors and forceps | ||
| FIJI | Software for image processing | ||
| Fluorescence microscope | Nikon | Eclipse Ni | |
| Forceps, Dumont #5, Biological grade tip | Electron Microscopy Sciences (EMS) | 72700-D | |
| Gavage Needle 1.25 mm OD barrel tip x 30 mm | Fine Science | 18060-20 | |
| Halstead Mosquito Forceps | Fisher Scientific | 13-812-10 | |
| I.V. Catheter set with regulating clamp 70 inches | Baxter | 2C5417s | |
| I.V. Pole | |||
| Lint free tissue | Kimpwipes is an option | ||
| Micro dissecting spring scissors, Vannas, 3 mm straight | ROBOZ | RS-5620 | |
| Micro spatula | Fine Science Tools (FST) | 10091-12 | |
| Nikon | NIS-Elements (AR 5.30.03 64-bit) | Software for image acquisition | |
| Petri dish (100 mmx15 mm) | Corning | 351029 | |
| Phosphate buffered saline (PBS) | |||
| Pink dental wax | Electron Microscopy Sciences (EMS) | 72670 | |
| Pressure infuser | Infusurge | 4010 | |
| Razor blades, GEM single edge stainless steel, Teflon coated | Electron Microscopy Sciences (EMS) | 71970 | |
| Saline 0.9%, veterinary grade, 1000 mL | Baxter | 04925-04-10 | |
| Small dissecting scissors, curved blunt end 22 mm | ROBOZ | RS 5983 |
Références
- Swystun, L. L., Liaw, P. C. The role of leukocytes in thrombosis. Blood. 128 (6), 753-762 (2016).
- Barouch, F. C., et al. Integrin-mediated neutrophil adhesion and retinal leukostasis in diabetes. Invest Ophthalmol Vis Sci. 41 (5), 1153-1158 (2000).
- Macaron, W., Sargsyan, Z., Short, N. J. Hyperleukocytosis and leukostasis in acute and chronic leukemias. Leuk Lymphoma. 63 (8), 1780-1791 (2022).
- Kempen, J. H., et al. The prevalence of diabetic retinopathy among adults in the United States. Arch Ophthalmol. 122 (4), 552-563 (2004).
- Kohner, E. M. Diabetic retinopathy. Br Med Bull. 45 (1), 148-173 (1989).
- Aouiss, A., Anka Idrissi, D., Kabine, M., Zaid, Y. Update of inflammatory proliferative retinopathy: Ischemia, hypoxia and angiogenesis. Curr Res Transl Med. 67 (2), 62-71 (2019).
- Tsalamandris, S., et al. The role of inflammation in diabetes: Current concepts and future perspectives. Eur Cardiol. 14 (1), 50-59 (2019).
- Adamis, A. P. Is diabetic retinopathy an inflammatory disease. Br J Ophthalmol. 86 (4), 363-365 (2002).
- Joussen, A. M., et al. A central role for inflammation in the pathogenesis of diabetic retinopathy. FASEB J. 18 (12), 1450-1452 (2004).
- Serra, A. M., et al. CD11b+ bone marrow-derived monocytes are the major leukocyte subset responsible for retinal capillary leukostasis in experimental diabetes in mouse and express high levels of CCR5 in the circulation. Am J Pathol. 181 (2), 719-727 (2012).
- Kinukawa, Y., Shimura, M., Tamai, M. Quantifying leukocyte dynamics and plugging in retinal microcirculation of streptozotosin-induced diabetic rats. Curr Eye Res. 18 (1), 49-55 (1999).
- Linsenmeier, R. A., et al. Retinal hypoxia in long-term diabetic cats. Invest Ophthalmol Vis Sci. 39 (9), 1647-1657 (1998).
- Herdade, A. S., et al. Effects of diabetes on microcirculation and leukostasis in retinal and non-ocular tissues: Implications for diabetic retinopathy. Biomolecules. 10 (11), 1583 (2020).
- Oakley, J., et al. Incorporating hemoglobin levels to map leukostasis risk in acute leukemia using microvasculature-on-chip technologies. Blood. 136 (Suppl 1), 9-10 (2020).
- Miyamoto, K., et al. Prevention of leukostasis and vascular leakage in streptozotocin-induced diabetic retinopathy via intercellular adhesion molecule-1 inhibition. Proc Natl Acad Sci U S A. 96 (19), 10836-10841 (1999).
- Veenstra, A., et al. Diabetic retinopathy: Retina-specific methods for maintenance of diabetic rodents and evaluation of vascular histopathology and molecular abnormalities. Curr Protoc Mouse Biol. 5 (3), 247-270 (2015).
- Lester, T. J., Johnson, J. W., Cuttner, J. Pulmonary leukostasis as the single worst prognostic factor in patients with acute myelocytic leukemia and hyperleukocytosis. Am J Med. 79 (1), 43-48 (1985).
- Porcu, P., et al. Hyperleukocytic leukemias and leukostasis: a review of pathophysiology, clinical presentation and management. Leuk Lymphoma. 39 (1-2), 1-18 (2000).
- Giammarco, S., et al. Hyperleukocytosis and leukostasis: management of a medical emergency. Expert Rev Hematol. 10 (2), 147-154 (2017).
- Mank, V., Azhar, W., Brown, K. Leukocytosis. StatPearls. , (2024).
- Bernhard, W., Avrameas, S. Ultrastructural visualization of cellular carbohydrate components by means of concanavalin A. Exp Cell Res. 64 (1), 232-236 (1971).
- Oliver, J. M., Zurier, R. B., Berlin, R. D. Concanavalin a cap formation on polymorphonuclear leukocytes of normal and beige (chediak-higashi) mice. Nature. 253 (5491), 471-473 (1975).
- Pink, J. R., Hoessli, D., Tartakoff, A., Hooghe, R. Characterisation of Concanavalin A-binding glycoproteins from mouse splenic leukocytes by two-dimensional electrophoresis: preferential binding of incompletely glycosylated forms of H-2 antigen to the lectin. Mol Immunol. 20 (4), 491-497 (1983).
- Janssen, B., Debets, J., Leenders, P., Smits, J. Chronic measurement of cardiac output in conscious mice. Am J Physiol Regul Integr Comp Physiol. 282 (3), R928-R935 (2002).
- Flecknell, P. A., Flecknell, P. A. Anaesthesia of common laboratory species: Special considerations. Laboratory Animal Anaesthesia. , 181-241 (2009).
- Seemann, S., Zohles, F., Lupp, A. Comprehensive comparison of three different animal models for systemic inflammation. J Biomed Sci. 24 (1), 60 (2017).
- Lessieur, E. M., et al. ICAM-1 on the luminal surface of endothelial cells is induced to a greater extent in mouse retina than in other tissues in diabetes. Diabetologia. 65 (10), 1734-1744 (2022).
- Kuwabara, T., Cogan, D. G. Studies of retinal vascular patterns: I. Normal architecture. Arch Ophthalmol. 64, 904-911 (1960).
- Tigner, A., Ibrahim, S. A., Murray, I. V. Histology, white blood cell. StatPearls. , (2024).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon