Method Article
Quantifizierung von Diabetes-induzierten adhärenten Leukozyten im retinalen Gefäßsystem
In diesem Artikel
Zusammenfassung
Wir demonstrieren eine Methode, um die Wände des retinalen Gefäßsystems und der adhärenten Leukozyten zu markieren. Diese adhärenten Leukozyten können dann unter einem Fluoreszenzmikroskop als Parameter der Entzündung oder der Reaktion dieser Entzündung auf Therapien gezählt werden.
Zusammenfassung
Unter Leukostase versteht man die Anheftung von Leukozyten an die luminale Wand des Gefäßsystems. Diese Wechselwirkung von Leukozyten mit der Wand der Blutgefäße ist charakteristisch für Entzündungen und wurde ursächlich mit dem Kapillarverschluss in einer Vielzahl von Geweben und Krankheiten, einschließlich der diabetischen Retinopathie, in Verbindung gebracht.
Die Leukostase wird seit Jahren als lebensbedrohliche Komplikation der Hyperleukozytose berichtet und kann nur klinisch diagnostiziert werden. Angesichts der Bedeutung des Phänomens wurden intensive Forschungen durchgeführt, um die möglichen Mechanismen zu verstehen, die zu seiner Manifestation führen. Es gibt jedoch keine Goldstandard-Technik im Labor, um die Schwere des Ereignisses zu visualisieren und zu quantifizieren.
Bei der unten zusammengefassten Methode wird das Gefäßsystem zunächst mit einem Puffer zur Blutentnahme perfundiert, und dann wird Concanavalin A in das Gefäßsystem perfundiert, wo es an alle freiliegenden Zellwände bindet und eine besonders helle Färbung der Leukozyten verursacht. Wenn die Perfusion zur Entfernung aller ungebundenen Blutzellen erfolgreich war, werden die verbleibenden fluoreszenzmarkierten Leukozyten an das Gefäßsystem gebunden und können mit jedem verfügbaren Fluoreszenzmikroskop manuell quantifiziert werden.
Einleitung
Leukozyten (weiße Blutkörperchen, Leukozyten) spielen eine wichtige Rolle bei der optimalen Funktion des Gefäßsystems, wie z. B. der Aufrechterhaltung der Blutfluidität und der Regulierung der Thrombusauflösung1. Sie spielen auch eine Schlüsselrolle bei einigen pathologischen Zuständen, wie z. B. dem Anhaften an der luminalen Wand des Gefäßsystems über längere Zeiträume, was zumindest vorübergehend zu einer Gefäßobstruktion führt, ein Phänomen, das als Leukostase bekannt ist 2,3.
Die diabetische Retinopathie ist eine der häufigsten Komplikationen bei Langzeitdiabetes und eine der Hauptursachen für Sehbehinderung und Blindheit in den USA und weltweit bei Personen im Alter von 20 bis 75 Jahren4. Die langsame und fortschreitende Degeneration der retinalen Gefäße ist ein klinisch bedeutsamer Bestandteil der Frühstadien der Erkrankung, der bei einigen Patienten zu einer retinalen Ischämie mit der daraus resultierenden retinalen Neovaskularisation führt 5,6. Kumulative Beweise deuten darauf hin, dass Entzündungen eine wichtige Rolle bei der Entwicklung der Retinopathie spielen7, und Leukostase wird als subklinische intravaskuläre Entzündungsreaktion angesehen. Leukostase tritt in den frühen Stadien des Diabetes auf, lange bevor sich nachweisbare klinische Manifestationen entwickelt haben 8,9,10. Das wiederholte Verstopfen der retinalen Gefäße durch adhärente Leukozyten über Monate bis Jahre (chronische Leukostase) bei Diabetes könnte zum Gefäßverschluss und zur Degeneration der Kapillaren beitragen 11,12,13. Der Schweregrad dieser Leukostase ist von pathologischer Bedeutung und kann zur Überwachung der Schwere des Krankheitsprozesses oder zur Bewertung der Wirksamkeit einer Therapie in Forschungsumgebungen verwendet werden.
Um die spezifischen Auswirkungen der hyperglykämischen Mikroumgebung auf die Leukostase weiter zu untersuchen, wurden in vitro Modelle entwickelt. Isolierte retinale mikrovaskuläre Endothelzellen können gezüchtet und entweder in 2- oder 3-D-Kulturmodellen (Mikrovaskulatur-on-a-Chip14) angeordnet werden, um das vaskuläre Endothel (die Zellmonoschicht, die das Lumen der Gefäße pflastert) zu replizieren. Die interexperimentelle Variation dieser Modelle schränkt jedoch ihre Verwendung ein. Die Untersuchung der Leukostase im menschlichen retinalen Gefäßsystem in vivo ist noch begrenzt, und daher stammt der größte Teil des aktuellen Wissens über die retinale Leukostase aus Tiermodellen der diabetischen Retinopathie13,15.
Das Ziel dieses Berichts ist es, ein Standardprotokoll zu beschreiben, das auf Methoden basiert, die an anderer Stelle16 beschrieben sind, zur Quantifizierung von an das retinale Gefäßsystem gebundenen Leukozyten als Parameter der Leukostase. Dieser Assay kann verwendet werden, um andere Gefäßerkrankungen zu untersuchen, die ebenfalls Leukostase aufweisen, wie z. B. Malignome 3,17,18,19 und einige infektiöse und allergische Erkrankungen 20. Dieses Protokoll kann in jedem Grundlagenforschungslabor implementiert werden, ohne dass spezielle Geräte erforderlich sind. Bei der unten zusammengefassten Methode wird das Gefäßsystem zunächst mit Puffer durchblutet, um Blut zu entfernen, und dann wird Concanavalin A in das Gefäßsystem perfundiert, wo es an alle freiliegenden Zellwände bindet und eine besonders helle Färbung der Leukozyten bewirkt 21,22,23. Gelingt die Perfusion, um alle ungebundenen Blutzellen zu entfernen, können die verbleibenden fluoreszenzmarkierten Leukozyten, die an das Gefäßsystem gebunden sind, mit jedem vorhandenen Fluoreszenzmikroskop manuell quantifiziert werden.
Protokoll
Das Protokoll wurde vom Institutional Animal Care and Use Committee (IACUC) an der University of California Irvine geprüft und genehmigt und entspricht den staatlichen Vorschriften bezüglich der Pflege und Verwendung von Labortieren. In diesem Protokoll gibt es keine Stopppunkte. Die durchschnittliche Zeit pro Maus beträgt 30 Minuten.
1. Vorbereitung der Perfusionsphase
- Erwärmen Sie den 0,9%igen Kochsalzbeutel und die Concanavallin A-Lösung in einem 37 °C warmen Wasserbad für 20-30 Minuten, bevor Sie es verwenden.
HINWEIS: Concanavalin A vor Lichteinwirkung schützen (mit Folie abdecken). - Stellen Sie eine Schale auf, in der Blut und Flüssigkeiten nicht auf die Oberfläche tropfen, an der der Eingriff stattfinden soll. Legen Sie ein Heizkissen auf das Tablett, das mit einer saugfähigen Bankunterlage oder einem anderen saugfähigen Material bedeckt ist.
HINWEIS: Ziel ist es, zu vermeiden, dass der Körper der Maus während des Eingriffs Wärme verliert, da die Kühlung die Blutentfernung während der Perfusion erschwert.
2. Einrichten des Drucksiebs
- Verbinden Sie den Beutel mit 0,9 % Kochsalzlösung, das IV-Katheterset, einen 4-Wege-Ventilhahn und die Sondennadel in Reihe.
- Führen Sie den 0,9%igen Kochsalzbeutel zwischen das Netz und die Luftblase des Drucksiebs ein. Hängen Sie den Kochsalzbeutel an den Haken auf der Rückseite der Luftblase. Verwenden Sie die I.V.-Polschlaufe, um den Druckinfuser in den IV-Pol einzuhängen.
- Spülen Sie die Leitungen und Anschlüsse von allen Luftblasen, indem Sie das System einige Minuten lang öffnen (laufen) lassen und die Durchflussrate auf 18-20 ml/min24 einstellen. Um die Druckluftblase des Druckhahns aufzublasen, drehen Sie den Absperrhahngriff in Richtung der geöffneten Absperrhahnentlüftung und pumpen Sie dann den Aufblaskolben, bis das Manometer den gewünschten Druck anzeigt. Stellen Sie den Druck vor der Perfusion jeder Maus neu ein. Drehen Sie zum Entleeren den Absperrhahngriff gerade nach unten in Richtung der Aufblasbirne.
HINWEIS: Wenn der 0,9%ige Kochsalzbeutel neu ist, liefert normalerweise ein Druck von 150 mmHg die gewünschte Durchflussrate; Der Druck sollte jedoch aufgrund von Schwankungen bei den Marken des Drucksiebs und über die Nutzungsdauer des 0,9%igen Kochsalzbeutels empirisch angepasst werden. - Setzen Sie eine 10-ml-Spritze, die mit erwärmter Concanavalin A-Lösung gefüllt ist, auf das 4-Wege-Ventil.
HINWEIS: Schützen Sie die Spritze vor Lichteinwirkung (Abdeckung mit Folie).
3. Anästhesie
- Verabreichen Sie die Anästhesie durch intraperitoneale (I.P.) Injektion von Ketamin:Xylazin; Die am weitesten verbreitete Dosis für Mausoperationen/-verfahren beträgt 100:10 mg/kg Körpergewicht25. Beurteilung der Anästhesie durch Pedalreflex (festes Einklemmen der Zehen).
HINWEIS: Diese Dosis bietet einen Wirkungseintritt von 4-6 Minuten mit einer Dauer von 45-60 Minuten für die chirurgische Anästhesie. Der Narkosecocktail kann maximal 2 Wochen bei Raumtemperatur gelagert werden.
4. Transkardiale Perfusion und Färbung mit Concanavalin A
- Platzieren Sie die Maus in Rückenlage auf der Perfusionsbühne, um die Freilegung der Brust- und Bauchhöhle zu ermöglichen.
- Identifizieren Sie visuell den Xiphoid-Prozess und stecken Sie mit dem Hämostaten in der dominanten Hand die Haut fest und verriegeln Sie sie. Sobald das Blutstillungsmittel befestigt ist, übertragen Sie es auf die nicht dominante Hand und heben Sie die Haut an.
- Verwenden Sie eine Schere in der dominanten Hand und schneiden Sie in einem 90°-Winkel zur Wirbelsäule ein Stück Haut ab, um die äußere Bauchdecke freizulegen.
- Wenn der Xiphoid-Prozess und der Brustkorb nun sichtbar sind, präparieren Sie die Bauchdecke beidseitig und achten Sie darauf, dass keine Organe oder großen Gefäße durchtrennt werden.
- Wenn das Zwerchfell nun sichtbar ist, visualisieren Sie die Herzventrikel und die Lunge durch das Zwerchfell. Schneiden Sie mit der Spitze der Schere das Zwerchfell in einer der Flanken in der Nähe der Wirbelsäule durch und achten Sie darauf, dass keine Organe oder großen Gefäße geschnitten werden.
HINWEIS: Dieses "Loch" im Zwerchfell gleicht den negativen intrathorakalen Druck mit dem atmosphärischen Druck aus, und es tritt ein Pneumothorax auf, der die Lunge kollabiert und das Herz zurückzieht, wodurch die Dissektion des Zwerchfells erleichtert wird, ohne die Lunge oder das Herz zu schädigen. - Fahren Sie mit dem Präparieren durch die Rippen und parallel zur Lunge fort, um einen Brustlappen zu erzeugen. Lösen Sie das Blutstillungsmittel und unterbrechen Sie den Xiphoid-Prozess in der Sagittalebene. Öffnen Sie den Xiphoid-Prozess manuell vorsichtig weit. Beobachte die vier Kammern des Herzens.
- Fassen Sie mit der nicht-dominanten Hand und mit einer Pinzette das Herz in der Nähe seiner Spitze. Halten Sie mit der dominanten Hand die Sondennadel (die am IV-Katheter befestigt ist) und punktieren Sie die Spitze des Herzens. Um eine vollständige Perforation des linken Ventrikels oder das Erreichen des Lungengefäßsystems und eine schlechte Durchblutung des systemischen Gefäßsystems zu vermeiden, überprüfen Sie die Platzierung des Endes der Kugelspitze der Sondennadel, die sich am Rand der Einstichstelle befinden sollte, die leicht aus dem Herzen herausragt. Klemmen Sie die Sondennadel mit einer gebogenen Mückenzange fest oder halten Sie sie einfach mit der Hand, während Sie den IV-Absperrhahn manipulieren.
- Öffnen Sie den Absperrhahn für die 0,9%ige Kochsalzlösung und schneiden Sie fast gleichzeitig den rechten Ventrikel mit einer Schere auf; Perfuse für 2-3 min. Bewegen Sie die Nadel während der Perfusionszeit vorsichtig von einer Seite zur anderen und auf und ab, um das Abknicken des Gefäßsystems zu verringern und den Blutaustritt aus dem Herzen zu erhöhen.
- Drehen Sie nach der Perfusion mit Kochsalzlösung den Absperrhahngriff, um den Fluss aus der Kochsalzlösung zu unterbrechen und den Fluss von der Spritze zur Sondennadel zu ermöglichen. Perfundierte von Hand mit der Concanavallin A-Lösung mit stationärer Geschwindigkeit. Stellen Sie sicher, dass die 10 ml Concanavallin A-Lösung in 30-35 s abgegeben werden.
- Drehen Sie nach der Perfusion mit Concanavalin A das Ventil, um den Fluss aus der Spritze zu unterbrechen und den Fluss von der 0,9%igen Kochsalzlösung zur Sondennadel wieder zuzulassen. Mit der 0,9%igen Kochsalzlösung für weitere 2-3 min perfundieren. Entfernen Sie die Sondennadel aus dem Herzen.
HINWEIS: Das in diesem Protokoll vorgeschlagene Concanavalin A ist an Fluorescein konjugiert (grün); Es ist jedoch auch Concanavalin A verfügbar, das an andere Fluorochrome gebunden ist.
5. Enukleation und Isolierung frischer Netzhaut
- Drehen Sie die Maus auf die Seite und legen Sie mit der nicht dominanten Hand den Zeigefinger und den Daumen auf das obere bzw. untere Augenlid. Ziehen Sie die Augenlider und die Haut vorsichtig mit den Fingern zurück und stützen Sie das Auge, so dass es sich teilweise aus der Augenhöhle wölbt.
- Während das Auge gestreckt ist, verwenden Sie eine gebogene Schere in der dominanten Hand und schöpfen Sie im 45°-Winkel unter das Auge. Den Muskelansatz und den Sehnerv durchtrennen. Übertragen Sie das Auge mit der gleichen Schere wie einen Spatel in ein kleines Gefäß oder direkt auf den Tisch des Präpariermikroskops.
HINWEIS: Achten Sie darauf, den Augenhintergrund nicht abzuschneiden, und vermeiden Sie es, während dieses Schritts an der Öse zu ziehen. - Legen Sie das Auge auf ein Zahnwachs, um die Kugel zu öffnen. Halten Sie unter dem Präpariermikroskop und mit der nichtdominanten Hand die Skleralfalte oder die Muskelreste, die noch extern am hinteren Auge befestigt sind, mit einer Mikrozange und richten Sie das Auge so aus, dass die Hornhaut zur Seite zeigt.
HINWEIS: Um zu verhindern, dass sich das Auge beim Öffnen des Globus bewegt/verrutscht, kann ein Stück nasses, fusselfreies Gewebe auf das Zahnwachs gelegt werden. - Machen Sie mit einer der scharfen Ecken einer teflonbeschichteten Rasierklinge einen Schnitt 1-2 mm hinter und parallel zum Limbus (Hornhaut-Sklera-Verbindung). Halten Sie die Skleralfalte oder den Muskel mit der Mikrozange fest und ziehen Sie die Klinge mit minimaler Kraft nach unten über den Limbus. Schneide weiter mit dem Rasierer, um den vorderen Augenabschnitt (Hornhaut, Iris, Linse und Glaskörper) vollständig vom hinteren Augenabschnitt (Augenmuschel) zu trennen.
HINWEIS: Sägen Sie nicht hin und her. - Übertragen Sie die halbierte Augenmuschel mit PBS in eine kleine Petrischale.
HINWEIS: Vermeiden Sie den Kontakt der Netzhaut mit dem Seidenpapier (Hinweis in Schritt 5.3), da es fest am Papier haftet und praktisch unmöglich wiederhergestellt werden kann. - Fassen Sie eine Sklerallete oder den verbleibenden Muskel an der Außenseite der Sklera mit einer Mikrozange. Löse die Netzhaut vollständig von der Sklera, indem du mit einem Mikrospatel alle Verbindungen am Limbus um den Umfang der Augenmuschel löst. Schöpfen Sie die Netzhaut mit dem Mikrospatel aus der Sklera heraus. Wenn die Netzhaut noch durch den Sehnerv mit der Sklera verbunden ist, schieben Sie die Mikroschere zwischen Netzhaut und Sklera, um den Sehnerv zu durchtrennen.
- Entfernen Sie alle Reste des Glaskörpers und der Ziliarmuskulatur in der Peripherie der Netzhaut. Übertragen Sie die isolierte Netzhaut sofort auf einen Objektträger mit etwas PBS.
HINWEIS: Jede andere Netzhautisolationstechnik kann je nach Vorliebe des Forschers verwendet werden.
6. Flache Befestigung der Netzhaut
- Lege die nicht fixierte Netzhaut mit einer kleinen Menge PBS auf einen Objektträger. Richten Sie die Netzhaut mit dem Mikrospatel vorsichtig mit der Glaskörperseite nach oben aus. Wenn die Netzhaut nach innen gefaltet ist, halten Sie die Ränder der Netzhaut mit einer Mikrozange fest, während die Netzhaut mit dem Mikrospatel entfaltet wird.
- Machen Sie 4-5 radiale Schnitte in die Netzhaut, so dass sie flach liegt (Kleeblattmuster).
- Trocknen Sie mit einem fusselfreien Tuch den Überschuss an PBS von der Netzhaut weg.
HINWEIS: Berühren Sie die Netzhaut nicht mit dem Gewebe; Andernfalls geht die Probe verloren. Deckglas ist wünschenswert, um die Netzhaut flach zu halten.
7. Mikroskopie
HINWEIS: Für diesen Schritt kann jedes Fluoreszenzmikroskop mit einem GFP/FITC-Kanal (480/530 nm) verwendet werden. Für diese Arbeit haben wir das referenzierte Mikroskop mit 488-Kanal und die zugehörige Software zur Bildaufnahme verwendet.
- Betrachten Sie die kürzlich flach montierte Netzhaut unter dem Mikroskop bei 100-facher Vergrößerung (10-faches Objektiv) und zählen Sie fluoreszenzmarkierte Leukozyten (manuell), indem Sie das gesamte Gewebe methodisch scannen (von rechts nach links oder von oben nach unten).
HINWEIS: Leukozyten sind einzelne fluoreszierende Punkte, die eine runde oder ovale Form aufweisen können. Sie haben einen Durchmesser von 12-15 μm und ragen nicht aus den Netzhautkapillaren heraus (die Struktur wird vollständig durch das Lumen des Gefäßes begrenzt). - Erfassen Sie repräsentative Bilder mit der gewünschten Vergrößerung und führen Sie eine Nachbearbeitung der Bilder mit der Software Ihrer Wahl durch (z. B. ImageJ [Fidschi]).
- Geben Sie die Anzahl als Leukozyten pro Netzhaut an. Stellen Sie die Daten anhand des Mittelwerts ± Standardabweichung grafisch dar.
Ergebnisse
Ein gut ausgeführtes Perfusions- und Färbeprotokoll zeigt das gesamte retinale Gefäßsystem, das mit Concanavalin A abgegrenzt ist (Abbildung 1). Eine schlechte Perfusion der Maus verhindert die Markierung des gesamten Gefäßbaums und die anschließende Analyse der am Lumen haftenden Leukozyten (Abbildung 2), während ein übermäßiger Druck durch einen schnellen Druck einer Spritze (weniger als 30-35 s) zu einer Gefäßpermeabilität und einem Platzen der Blutgefäße führen kann (Abbildung 3). Das extravasierte Concanavalin A kann zu einer Fehlmarkierung der äußeren Strukturen führen, was zu einer verwirrenden Quantifizierung der adhärenten Leukozyten führt.
Die Beurteilung des retinalen Gefäßsystems und die Quantifizierung der anhaftenden Leukozyten mittels Fluoreszenzmikroskopie sollte unmittelbar nach der Montage der Netzhaut erfolgen (Abbildung 4). Bei der Betrachtung der Netzhaut unter starker Vergrößerung ist Vorsicht geboten, da die Biegungen in den Kapillaren als markierte Leukozyten erscheinen können, die am Gefäßsystem haften (Abbildung 4B, gestrichelter Kreis). Das Auf- und Abschärfen des Mikroskops bei gleichzeitiger Beobachtung des betreffenden Bereichs ermöglicht in der Regel die Unterscheidung der Leukostase von einem Gefäß, das in die Netzhaut eintaucht. Der Benutzer kann das Fluorophor, das an Concanavals A konjugiert ist, so ändern/auswählen, dass es dem verfügbaren Fluoreszenzwürfel im zu verwendenden Mikroskop entspricht. Die Leukostase bei diabetischer Retinopathie ist kein dramatisches Ereignis, und der Forscher sollte den gesamten Gefäßbaum untersuchen, indem er die gesamte Netzhaut auf der Suche nach adhärenten Leukozyten absucht. In der Regel gibt es 1-3 Leukozyten pro Netzhaut von nicht-diabetischen Tieren und 3-12 Leukozyten pro Netzhaut von diabetischen Tieren, und so beträgt die Mindeststichprobengröße für das Erreichen einer statistisch signifikanten Differenz 10-12 Tiere pro Gruppe (Abbildung 4A, B und Abbildung 5). Angesichts eines solchen Phänotyps ist es ungewöhnlich, 2 oder mehr Leukozyten in unmittelbarer Nähe zu finden (Abbildung 4B,C). Das Gleiche gilt nicht für akute Entzündungsmodelle, wie z. B. bei der Lipopolysaccharid (LPS)-Challenge, bei der ein robustes Leukostase-Phänomen beobachtet wird (Abbildung 4C und Abbildung 5). Für ein detailliertes Protokoll des LPS-Challenge-Modells siehe 26.
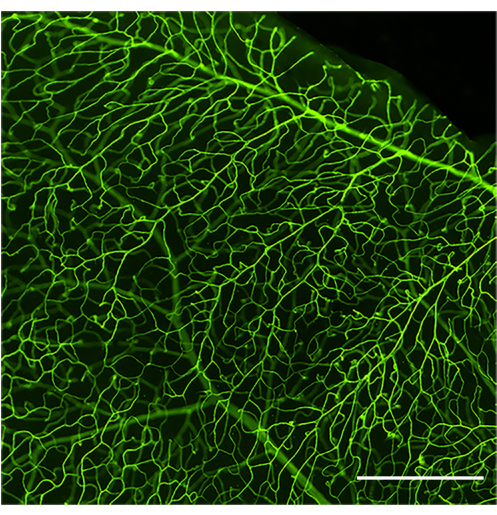
Abbildung 1: Repräsentatives Bild eines gut durchbluteten und gefärbten retinalen Gefäßsystems. Weitwinkelbild des retinalen Gefäßsystems einer gesunden C57Bl/6J-Maus (4 Monate alt) nach Infusion von Concanavals A-FITC. Concanavalin A-FITC färbt das gesamte retinale Gefäßnetz gleichmäßig, wenn eine optimale Perfusion erreicht wurde. Nach Anpassung von Helligkeit und Kontrast wurde das Bild in RGB umgewandelt. Maßstabsleiste = 100 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
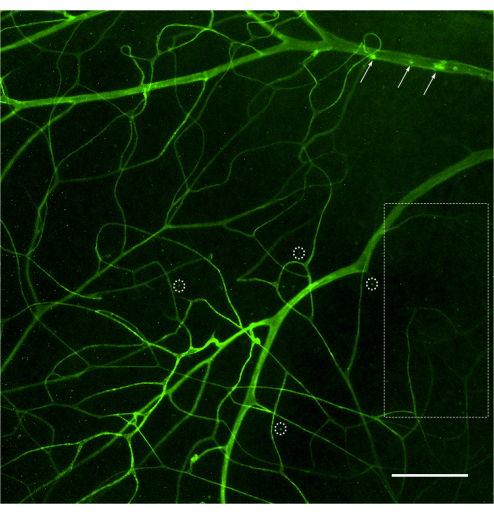
Abbildung 2: Repräsentatives Bild der schlechten Durchblutung und Färbung des retinalen Gefäßsystems. Eine schlechte Durchblutung des Tieres kann zu einem eingeschränkten Zugang des Concanavalin A zu den retinalen Gefäßen führen, was zu einer mangelhaften Färbung des retinalen Gefäßnetzwerks führt. Ausgedehnte Bereiche der Netzhaut weisen keine Verfärbung auf (gestricheltes Rechteck), was die Sichtbarkeit der anhaftenden Leukozyten zu diesem Gefäßsystem einschränkt. Gefäße, die Concanavalin A erhielten, können angehängte Leukozyten (Pfeile) aufweisen, aber sie repräsentieren nicht die Gesamtanzahl der Netzhaut. In diesem Fall sollte die Probe verworfen werden. Eine mangelhafte Aussage kann auch zu künstlichem Punktieren (gestrichelte Kreise) führen, da die Mikroskopie von geringer Qualität ist (erzwungener Kanal zur Erkennung eines Fluoreszenzsignals). Nach Anpassung von Helligkeit und Kontrast wurde das Bild in RGB umgewandelt. Maßstabsleiste = 50 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
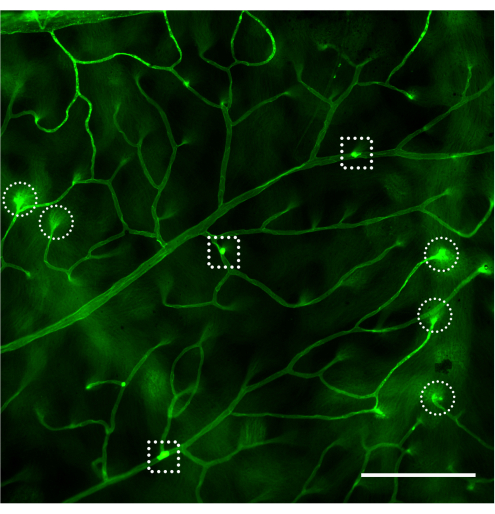
Abbildung 3: Repräsentatives Bild, das das Platzen der retinalen Kapillaren zeigt. Übermäßiger Druck durch schnelles Drücken einer Concanavalin A-Ladespritze (weniger als 30-35 s) kann zu einer experimentell induzierten Gefäßpermeabilität und einem Platzen der Blutgefäße (gestrichelte Kreise) führen, was zur Markierung äußerer Strukturen oder anderer Artefakte (gestrichelte Quadrate) führt. Nach Anpassung von Helligkeit und Kontrast wurde das Bild in RGB umgewandelt. Maßstabsleiste = 50 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 4: Beispiele für eine Biegekapillare und Leukostase bei nicht-diabetischen, diabetischen und LPS-geschädigten Mäusen. Beispiele für eine retinale Leukostase bei C57Bl/6J-Mäusen (im Alter von 4 Monaten) nach Infusion von Concanavals A-FITC. (A) Nicht-diabetische Mäuse zeigen keine Leukostase, aber es ist nicht ungewöhnlich, dass 1-3 Leukozyten an das retinale Gefäßsystem gebunden sind, nachdem die gesamte Netzhaut gescannt wurde (Pfeil). (B) Die an das retinale Gefäßsystem gebundenen Leukozyten bei diabetischen Mäusen (Modell einer subklinischen Entzündung) können zwischen 3 und 12 liegen, und es ist ungewöhnlich, angehängte Leukozyten in unmittelbarer Nähe zu finden (Pfeile). Die Struktur, die vom Strichkreis umschlossen ist, ist ein Beispiel für eine Biegekapillare, die in die Netzhaut eintaucht. (C) Die Herausgabe von Mäusen mit LPS (Modell der akuten Entzündung) kann mit jedem Experiment als Positivkontrolle der Leukostase durchgeführt werden. In diesem Modell ist es üblich, mehrere Leukozyten in unmittelbarer Nähe des Gefäßsystems zu finden (Pfeile). Nach Anpassung von Helligkeit und Kontrast wurde das Bild in RGB umgewandelt. Maßstabsleiste = 100 μm. Abkürzung: LPS = Lipopolysaccharid. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
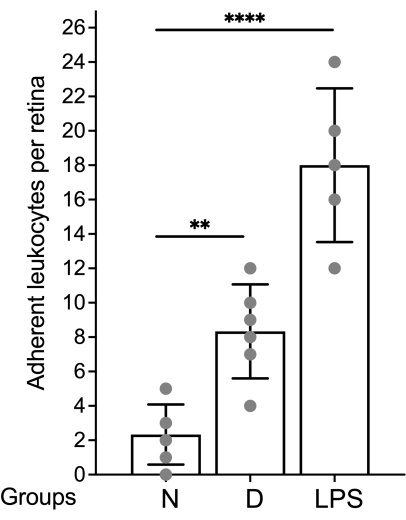
Abbildung 5: Repräsentatives Diagramm zum Melden der Ergebnisse. Die Leukozytenzahl wird pro Netzhaut ausgedrückt und die Daten werden anhand von Mittelwert und Standardabweichung grafisch dargestellt. Abkürzungen: N = nicht-diabetisch; D = Diabetiker; LPS = Lipopolysaccharid. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Leukostase beim Menschen bezieht sich auf Symptome und klinische Befunde im Zusammenhang mit Hyperleukozytose (Gesamtzahl der Leukozyten (WBCs) >100.000/μl) und ist ein medizinischer Notfall20. Der/die Mechanismus/die Mechanismen, die zur Leukostase führen, werden intensiv erforscht. Bisher ist es noch nicht möglich, die Leukostase beim Menschen in vivo zu untersuchen, und die Forscher müssen sich auf Tiermodelle verlassen, um diesen Prozess zu verstehen. Verschiedene Krankheiten stellen eine Leukostase dar, und ein detailliertes Protokoll zur Visualisierung des Phänomens ex vivo kann für Forscher im Labor nützlich sein. Das in diesem Bericht vorgestellte Protokoll wurde für die Untersuchung des retinalen Gefäßsystems optimiert. Es kann jedoch empirisch für die Untersuchung anderer geeigneter Gefäßbetten, wie z. B. des Gefäßsystems im Cremaster-Muskel27, optimiert werden.
Bei korrekter Anwendung ermöglicht diese Technik die Perfusion und Markierung des gesamten retinalen Gefäßbaums sowie die Markierung und Quantifizierung von Leukozyten, die an der Gefäßwand haften. Die Netzhaut eignet sich besonders gut für diese Methode, da ihr Gefäßsystem auf definierte Ebenen im Gewebe beschränkt ist (im Gegensatz zu den meisten Geweben, bei denen das Gefäßsystem weniger geordnet ist). Diese Methode bietet einen guten Kontrast zu ungefärbtem Gewebe, wenn transparentes (Netzhaut) oder sehr dünnes Gewebe (wie z. B. Cremaster-Muskel27) verwendet wird. Dickes Gewebe oder Gewebe mit reichlich myelinisierten Nerven oder anderen undurchsichtigen und pigmentierten Zellen sind schlechte Stellen für die Bewertung mit dieser Methode.
Eine entscheidende Voraussetzung für den Eingriff ist eine gute Durchblutung des Gefäßsystems. Die Perfusion, während das Herz noch pumpt, ermöglicht eine gute Durchblutung und Markierung der Mikrogefäße. Eine schlechte Gefäßperfusion ist oft auf die Verwendung von kalten Flüssigkeiten zurückzuführen, die zu einer Vasokonstriktion führen, oder auf ein Knicken des Gefäßsystems aufgrund des Gewichts und der Platzierung der Perfusionsnadel oder Pinzette. Während der Perfusion ist es wichtig, während des Eingriffs genau auf die verschiedenen Organe zu achten, da sie einige Hinweise auf die Effizienz der Perfusion geben können. Wenn zum Beispiel die Nadel in die Lungenvene eingeführt wird, füllt sich die Lunge und ändert sofort ihre Farbe (Blanchieren), wenn der Fluss gestartet wird, was darauf hindeutet, dass die Perfusion aufgrund der Sequestrierung aller Flüssigkeiten im Lungenbaum suboptimal ist. Während der Perfusion wird ein Blanchieren in der Zunge, den Nieren und der Leber beobachtet, was auf ein optimales Verfahren hindeuten könnte. Diese Organe sind jedoch den Blutgefäßen nachgeschaltet, die die Augen versorgen, und daher garantiert das Blanchieren der Organe eine gute Durchblutung des Körpers, aber nicht immer der Netzhaut.
Weitere potenzielle Probleme, die sich auf die Perfusion auswirken, sind: i) Luftblasen, die in der Perfusionslinie eingeschlossen sind und in die Mikrogefäße gelangen und die Perfusion mit dem Fluoreszenzfarbstoff verhindern; ii) Wenn die in das Herz eingeführte Sondennadel zu weit in den Aortenbogen hineinragt, ist es möglich, die rechte Halsschlagader zu blockieren und so den Fluss des Farbstoffs in die rechte Netzhaut zu verhindern; und iii) wenn die Perfusion zu stark ist, kann der daraus resultierende Anstieg des intravaskulären Drucks zu einer experimentell induzierten Gefäßpermeabilität führen und dazu führen, dass einige Leukozyten künstlich in den Mikrovaskulatur eingeschlossen werden. Die experimentell induzierte Gefäßpermeabilität wird unter dem Mikroskop als lokalisierter Ausbruch von extravasiertem Concanavalin A im umgebenden Gewebe des Gefäßes sichtbar, während die pathologische Gefäßpermeabilität ein subtiles diffuses Muster aufweist. Im ersten Szenario könnte es zu einer Markierung externer Strukturen oder anderer Artefakte kommen, die möglicherweise die Quantifizierung adhärenter Leukozyten verwirren. Unter diesen Umständen sollte sich der Beobachter auf die objektiven Indikatoren verlassen, die einen Leukozyten histologisch definieren: Form, Größe und Lokalisation (innerhalb des Lumens eines Gefäßes).
Pathologische Zustände, die azelluläre (degenerierte) Kapillaren aufweisen, wie z. B. die diabetische Retinopathie, schließen die Anwendung dieser Technik nicht aus. Kapillaren in frühen Stadien der Degeneration, d. h. solche, die das Endothel verloren haben, aber die Wandzellen intakt sind, sind noch offen, während Kapillaren im späten Stadium der Degeneration, obwohl sie nicht mehr offen sind, an ihrer ursprünglichen Stelle verbleiben (fokalisierte Degeneration) und in den benachbarten Gefäßen keine nennenswerten Veränderungen beobachtet werden 28. Beide Umstände erlauben die Markierung des umgebenden Gefäßsystems und die Beurteilung der Leukostase.
Ein entscheidender Schritt bei der Isolierung der Netzhaut ist die Enukleation des Auges, ohne den Augenhintergrund abzuschneiden. Da der Sehnerv die ein- und ausgehenden Blutgefäße enthält, die die Netzhautschichten und Neuronen vaskularisieren, ist eine Durchtrennung des Sehnervs zu nahe an seinem Eingang zum Augapfel fast garantiert, dass der retinale Gefäßbaum kollabiert, was zu einer suboptimalen Sicht auf das Gefäßsystem und der anschließenden Analyse des Leukostase-Phänomens führt. Besonderes Augenmerk sollte auf die Rasierklingen gelegt werden, die für die Entfernung des vorderen Augenabschnitts verwendet werden. Sie sollten häufig gewechselt werden (idealerweise eine Rasierklinge pro 1-2 Augen), da stumpfe Klingen schlecht schneiden und zu einem Ziehen und Zerren am Auge und an der Netzhaut führen können, was wiederum das Gefäßsystem schädigt. Bei der Entfernung des vorderen Augenabschnitts wird empfohlen, das Auge beim Schneiden am Limbus zu drehen und die Linse zu entfernen. Die anfängliche Entfernung des vorderen Augenabschnitts ist einfacher, wenn sie auf nassem, fusselfreiem Papier durchgeführt wird. Das Papier muss jedoch sofort nach der Entfernung des vorderen Augenabschnitts entfernt werden, da sich sonst die frisch isolierte Netzhaut an dem Papier festsetzen und nicht wiederhergestellt werden kann.
Wir erkennen an, dass dieses Protokoll mehrere Einschränkungen hat. Erstens kann die anfängliche Perfusion Leukozyten entfernen, die lose an das Gefäßsystem gebunden sind, was den Forscher dazu veranlasst, über das Fehlen von Leukostase zu berichten, obwohl dies in Wirklichkeit nicht der Fall ist. Die Einbeziehung einer positiven Kontrolle der Leukostase, wie z. B. eines akuten Entzündungsmodells26, könnte helfen, festzustellen, dass die Perfusion nicht zu hart war, indem gezeigt wird, dass eine Leukostase vorliegt. Und zweitens wird es für einen ungeübten Beobachter schwierig sein zu bestimmen, ob es sich bei der stark fluoreszierenden Struktur tatsächlich um die interessierende Zelle und nicht um ein Artefakt handelt. Um dieses Problem zu lösen, sollte sich der Forscher mit der Form (in der Regel rund oder oval bei der ersten Befestigung am Gefäßsystem) und der Größe (12–15 μm) der Leukozyten vertraut machen29. Wenn Zweifel bestehen, ob es sich bei der beobachteten Struktur um einen Leukozyten handelt oder nicht, ist es ratsam, sie nicht in die Quantifizierung einzubeziehen, aber der Forscher muss die endgültige Entscheidung treffen, sobald er sich mit dem Assay vertraut gemacht hat. Im Idealfall könnte die automatische Quantifizierung mit einer speziellen Software die arbeitsintensive manuelle Quantifizierung der an das Gefäßsystem gebundenen Leukozyten erleichtern, jedoch kann die Unterscheidung zwischen Leukozyten und Artefakten nur durch das Wissen und die Erfahrung des Forschers erfolgen. Die Entwicklung oder Optimierung aktueller Plattformen zur automatischen oder halbautomatischen Quantifizierung von Leukozytose ist eine Option, die untersucht werden sollte.
Zusammenfassend lässt sich sagen, dass dieses validierte Protokoll zur Bewertung der Leukostase ein nützliches Instrument für Forscher sein könnte, die Studien zur diabetischen Retinopathie und anderen okulären und nicht-okulären Gefäßerkrankungen durchführen, sowie zur Erprobung neuartiger therapeutischer Interventionen.
Offenlegungen
Die Autoren haben keine Interessenkonflikte anzugeben.
Danksagungen
Diese Arbeit wurde von den National Institutes of Health (NIH) Grants R01EY022938, R01EY022938-S1 und K99EY034928 unterstützt. Die Autoren danken für die Dienste der ICRU (P30EY11373) und UCI (P30EY034070) Visual Science Research Center Cores sowie für die Unterstützung der Abteilung durch einen uneingeschränkten Zuschuss von Research to Prevent Blindness an das Gavin Herbert Eye Institute an der University of California Irvine.
Materialien
| Name | Company | Catalog Number | Comments |
| 10 mL syringe | |||
| 4-way stopcock Luer lock I.V. line valve | Baxter | 2C6204 | |
| Concanavalin A solution | Vector | FL-1001 | Prepare in PBS 1 mg/mL |
| Dissecting tools set | Includes hemostats, scissors and forceps | ||
| FIJI | Software for image processing | ||
| Fluorescence microscope | Nikon | Eclipse Ni | |
| Forceps, Dumont #5, Biological grade tip | Electron Microscopy Sciences (EMS) | 72700-D | |
| Gavage Needle 1.25 mm OD barrel tip x 30 mm | Fine Science | 18060-20 | |
| Halstead Mosquito Forceps | Fisher Scientific | 13-812-10 | |
| I.V. Catheter set with regulating clamp 70 inches | Baxter | 2C5417s | |
| I.V. Pole | |||
| Lint free tissue | Kimpwipes is an option | ||
| Micro dissecting spring scissors, Vannas, 3 mm straight | ROBOZ | RS-5620 | |
| Micro spatula | Fine Science Tools (FST) | 10091-12 | |
| Nikon | NIS-Elements (AR 5.30.03 64-bit) | Software for image acquisition | |
| Petri dish (100 mmx15 mm) | Corning | 351029 | |
| Phosphate buffered saline (PBS) | |||
| Pink dental wax | Electron Microscopy Sciences (EMS) | 72670 | |
| Pressure infuser | Infusurge | 4010 | |
| Razor blades, GEM single edge stainless steel, Teflon coated | Electron Microscopy Sciences (EMS) | 71970 | |
| Saline 0.9%, veterinary grade, 1000 mL | Baxter | 04925-04-10 | |
| Small dissecting scissors, curved blunt end 22 mm | ROBOZ | RS 5983 |
Referenzen
- Swystun, L. L., Liaw, P. C. The role of leukocytes in thrombosis. Blood. 128 (6), 753-762 (2016).
- Barouch, F. C., et al. Integrin-mediated neutrophil adhesion and retinal leukostasis in diabetes. Invest Ophthalmol Vis Sci. 41 (5), 1153-1158 (2000).
- Macaron, W., Sargsyan, Z., Short, N. J. Hyperleukocytosis and leukostasis in acute and chronic leukemias. Leuk Lymphoma. 63 (8), 1780-1791 (2022).
- Kempen, J. H., et al. The prevalence of diabetic retinopathy among adults in the United States. Arch Ophthalmol. 122 (4), 552-563 (2004).
- Kohner, E. M. Diabetic retinopathy. Br Med Bull. 45 (1), 148-173 (1989).
- Aouiss, A., Anka Idrissi, D., Kabine, M., Zaid, Y. Update of inflammatory proliferative retinopathy: Ischemia, hypoxia and angiogenesis. Curr Res Transl Med. 67 (2), 62-71 (2019).
- Tsalamandris, S., et al. The role of inflammation in diabetes: Current concepts and future perspectives. Eur Cardiol. 14 (1), 50-59 (2019).
- Adamis, A. P. Is diabetic retinopathy an inflammatory disease. Br J Ophthalmol. 86 (4), 363-365 (2002).
- Joussen, A. M., et al. A central role for inflammation in the pathogenesis of diabetic retinopathy. FASEB J. 18 (12), 1450-1452 (2004).
- Serra, A. M., et al. CD11b+ bone marrow-derived monocytes are the major leukocyte subset responsible for retinal capillary leukostasis in experimental diabetes in mouse and express high levels of CCR5 in the circulation. Am J Pathol. 181 (2), 719-727 (2012).
- Kinukawa, Y., Shimura, M., Tamai, M. Quantifying leukocyte dynamics and plugging in retinal microcirculation of streptozotosin-induced diabetic rats. Curr Eye Res. 18 (1), 49-55 (1999).
- Linsenmeier, R. A., et al. Retinal hypoxia in long-term diabetic cats. Invest Ophthalmol Vis Sci. 39 (9), 1647-1657 (1998).
- Herdade, A. S., et al. Effects of diabetes on microcirculation and leukostasis in retinal and non-ocular tissues: Implications for diabetic retinopathy. Biomolecules. 10 (11), 1583 (2020).
- Oakley, J., et al. Incorporating hemoglobin levels to map leukostasis risk in acute leukemia using microvasculature-on-chip technologies. Blood. 136 (Suppl 1), 9-10 (2020).
- Miyamoto, K., et al. Prevention of leukostasis and vascular leakage in streptozotocin-induced diabetic retinopathy via intercellular adhesion molecule-1 inhibition. Proc Natl Acad Sci U S A. 96 (19), 10836-10841 (1999).
- Veenstra, A., et al. Diabetic retinopathy: Retina-specific methods for maintenance of diabetic rodents and evaluation of vascular histopathology and molecular abnormalities. Curr Protoc Mouse Biol. 5 (3), 247-270 (2015).
- Lester, T. J., Johnson, J. W., Cuttner, J. Pulmonary leukostasis as the single worst prognostic factor in patients with acute myelocytic leukemia and hyperleukocytosis. Am J Med. 79 (1), 43-48 (1985).
- Porcu, P., et al. Hyperleukocytic leukemias and leukostasis: a review of pathophysiology, clinical presentation and management. Leuk Lymphoma. 39 (1-2), 1-18 (2000).
- Giammarco, S., et al. Hyperleukocytosis and leukostasis: management of a medical emergency. Expert Rev Hematol. 10 (2), 147-154 (2017).
- Mank, V., Azhar, W., Brown, K. Leukocytosis. StatPearls. , (2024).
- Bernhard, W., Avrameas, S. Ultrastructural visualization of cellular carbohydrate components by means of concanavalin A. Exp Cell Res. 64 (1), 232-236 (1971).
- Oliver, J. M., Zurier, R. B., Berlin, R. D. Concanavalin a cap formation on polymorphonuclear leukocytes of normal and beige (chediak-higashi) mice. Nature. 253 (5491), 471-473 (1975).
- Pink, J. R., Hoessli, D., Tartakoff, A., Hooghe, R. Characterisation of Concanavalin A-binding glycoproteins from mouse splenic leukocytes by two-dimensional electrophoresis: preferential binding of incompletely glycosylated forms of H-2 antigen to the lectin. Mol Immunol. 20 (4), 491-497 (1983).
- Janssen, B., Debets, J., Leenders, P., Smits, J. Chronic measurement of cardiac output in conscious mice. Am J Physiol Regul Integr Comp Physiol. 282 (3), R928-R935 (2002).
- Flecknell, P. A., Flecknell, P. A. Anaesthesia of common laboratory species: Special considerations. Laboratory Animal Anaesthesia. , 181-241 (2009).
- Seemann, S., Zohles, F., Lupp, A. Comprehensive comparison of three different animal models for systemic inflammation. J Biomed Sci. 24 (1), 60 (2017).
- Lessieur, E. M., et al. ICAM-1 on the luminal surface of endothelial cells is induced to a greater extent in mouse retina than in other tissues in diabetes. Diabetologia. 65 (10), 1734-1744 (2022).
- Kuwabara, T., Cogan, D. G. Studies of retinal vascular patterns: I. Normal architecture. Arch Ophthalmol. 64, 904-911 (1960).
- Tigner, A., Ibrahim, S. A., Murray, I. V. Histology, white blood cell. StatPearls. , (2024).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten