Method Article
Quantificazione dei leucociti aderenti indotti dal diabete nella vascolarizzazione retinica
In questo articolo
Riepilogo
Dimostriamo un metodo per marcare le pareti del sistema vascolare retinico e i leucociti aderenti. Questi leucociti aderenti possono quindi essere contati al microscopio a fluorescenza come parametro dell'infiammazione o della risposta di tale infiammazione alle terapie.
Abstract
La leucostasi si riferisce all'attaccamento dei leucociti alla parete luminale del sistema vascolare. Questa interazione dei leucociti con la parete dei vasi sanguigni è caratteristica dell'infiammazione ed è stata causalmente collegata all'occlusione capillare in una varietà di tessuti e malattie, tra cui la retinopatia diabetica.
La leucostasi è stata segnalata per anni come una complicanza pericolosa per la vita dell'iperleucocitosi e può essere diagnosticata solo clinicamente. Data l'importanza del fenomeno, è stata condotta un'intensa ricerca per comprendere i potenziali meccanismi che portano alla sua manifestazione; Tuttavia, non esiste una tecnica gold standard in laboratorio per visualizzare e quantificare la gravità dell'evento.
Nel metodo riassunto di seguito, il sistema vascolare viene inizialmente perfuso con un tampone per rimuovere il sangue, quindi la concanavalina A viene perfusa nel sistema vascolare dove si lega a tutte le pareti cellulari esposte e provoca una colorazione particolarmente brillante dei leucociti. Se la perfusione per rimuovere tutte le cellule del sangue non legate ha avuto successo, i restanti leucociti marcati in fluorescenza vengono legati al sistema vascolare e possono essere quantificati manualmente utilizzando qualsiasi microscopio a fluorescenza disponibile.
Introduzione
I leucociti (globuli bianchi, globuli bianchi) svolgono un ruolo importante nella funzione ottimale del sistema vascolare, come il mantenimento della fluidità del sangue e la regolazione della risoluzione del trombo1. Svolgono anche un ruolo chiave in alcune condizioni patologiche, come l'adesione alla parete luminale del sistema vascolare per periodi di tempo prolungati che portano all'ostruzione dei vasi, almeno temporaneamente, fenomeno noto come leucostasi 2,3.
La retinopatia diabetica è una delle complicanze più comuni del diabete a lungo termine e una delle principali cause di disabilità visiva e cecità negli Stati Uniti e nel mondo per gli individuidi età compresa tra 20 e 75 anni. La degenerazione lenta e progressiva del sistema vascolare retinico è una componente clinicamente significativa delle prime fasi della malattia, che in alcuni pazienti porta all'ischemia retinica con la conseguente neovascolarizzazione retinica 5,6. L'evidenza cumulativa indica che l'infiammazione svolge un ruolo importante nello sviluppo della retinopatia7 e la leucostasi è considerata una risposta infiammatoria intravascolare subclinica. La leucostasi si verifica nelle prime fasi del diabete, ben prima che si siano sviluppate manifestazioni cliniche rilevabili 8,9,10. L'ostruzione ripetuta dei vasi retinici da parte di leucociti aderenti per mesi o anni (leucostasi cronica) nel diabete potrebbe contribuire all'occlusione vascolare e alla degenerazione dei capillari 11,12,13. La gravità di questa leucostasi è di importanza patologica e può essere utilizzata per monitorare la gravità del processo patologico o per valutare l'efficacia di una terapia in contesti di ricerca.
Per studiare ulteriormente gli effetti specifici del microambiente iperglicemico sulla leucostasi, sono stati progettati modelli in vitro. Le cellule endoteliali microvascolari retiniche isolate possono essere coltivate e disposte in modelli di colture 2 o 3D (microvascolarizzazione su chip14) per replicare l'endotelio vascolare (il monostrato cellulare che pavimenta il lume dei vasi). Tuttavia, la variazione intersperimentale di questi modelli ne limita l'uso. Lo studio della leucostasi nel sistema vascolare retinico umano in vivo è ancora limitato e, pertanto, la maggior parte delle attuali conoscenze sulla leucostasi retinica deriva da modelli animali di retinopatia diabetica13,15.
Lo scopo di questo rapporto è quello di descrivere un protocollo standard basato su metodi descritti altrove16 per la quantificazione dei leucociti attaccati al sistema vascolare retinico come parametro della leucostasi. Questo test può essere utilizzato per studiare altre malattie vascolari che presentano anche leucostasi, come i tumori maligni 3,17,18,19 e alcune condizioni infettive e allergiche20. Questo protocollo può essere implementato in qualsiasi laboratorio di ricerca di base senza la necessità di attrezzature specializzate. Nel metodo riassunto di seguito, il sistema vascolare viene inizialmente perfuso con tampone per rimuovere il sangue, quindi la concanavalina A viene perfusa nel sistema vascolare dove si lega a tutte le pareti cellulari esposte e provoca una colorazione particolarmente brillante dei leucociti 21,22,23. Se la perfusione per rimuovere tutte le cellule del sangue non legate ha successo, i restanti leucociti marcati in fluorescenza che sono legati al sistema vascolare possono essere quantificati manualmente utilizzando qualsiasi microscopio a fluorescenza a portata di mano.
Protocollo
Il protocollo è stato esaminato e approvato dall'Institutional Animal Care and Use Committee (IACUC) dell'Università della California di Irvine ed è conforme alle normative governative relative alla cura e all'uso degli animali da laboratorio. Non ci sono punti di arresto in questo protocollo. Il tempo medio per mouse è di 30 minuti.
1. Preparazione della fase di perfusione
- Riscaldare la sacca salina allo 0,9% e la soluzione di concanavalina A in un bagno d'acqua a 37 oC per 20-30 minuti prima dell'uso.
NOTA: Proteggere la concanavalina A dall'esposizione alla luce (coprire con un foglio). - Predisporre un vassoio per contenere il sangue e i liquidi che non gocciolano sulla superficie dove si svolgerà la procedura. Sopra il vassoio, posizionare un termoforo coperto con un sottoforo assorbente o qualsiasi materiale assorbente.
NOTA: L'obiettivo è evitare che il corpo del topo perda calore durante la procedura, perché il raffreddamento rende più difficile la rimozione del sangue durante la perfusione.
2. Impostazione dell'infusore a pressione
- Collegare in serie la sacca di soluzione fisiologica allo 0,9%, il set di cateteri per flebo, un rubinetto di arresto della valvola a 4 vie e l'ago per la sonda magnetica.
- Inserire la sacca di soluzione fisiologica allo 0,9% tra la rete e la camera d'aria dell'infusore a pressione. Appendere la sacca salina al gancio situato sul retro della camera d'aria. Utilizzare l'anello per asta per flebo per appendere l'infusore di pressione all'asta per flebo.
- Spurgare le linee e le porte da tutte le bolle d'aria lasciando il sistema aperto (in funzione) per un paio di minuti e impostare la portata a 18-20 mL/min24. Per gonfiare la camera d'aria dell'infusore di pressione, ruotare la maniglia del rubinetto in modo che punti verso lo sfiato del rubinetto aperto, quindi pompare il bulbo di gonfiaggio fino a quando il manometro indica la pressione desiderata. Regolare nuovamente la pressione prima di perfondere ciascun mouse. Per sgonfiare, ruotare la maniglia del rubinetto verso il basso verso il bulbo di gonfiaggio.
NOTA: Se la sacca salina allo 0,9% è nuova, di solito una pressione di 150 mmHg fornisce la portata desiderata; Tuttavia, la pressione deve essere regolata empiricamente a causa delle variazioni nelle marche di infusori a pressione e durante il periodo di utilizzo della sacca salina allo 0,9%. - Collegare una siringa da 10 ml riempita con una soluzione riscaldata di concanavalina A alla valvola a 4 vie.
NOTA: Proteggere la siringa dall'esposizione alla luce (coprire con un foglio).
3. Anestesia
- Erogare l'anestesia mediante iniezione intraperitoneale (I.P.) di Ketamina: Xilazina; La dose più utilizzata per la chirurgia/procedura sui topi è 100:10 mg/kg di peso corporeo25. Valutare l'anestesia con il riflesso del pedale (pizzicamento deciso delle dita).
NOTA: Questa dose fornisce un inizio di 4-6 minuti con una durata di 45-60 minuti di anestesia chirurgica. Il cocktail anestetico può essere conservato a temperatura ambiente per un massimo di 2 settimane.
4. Perfusione transcardica e colorazione con concanavalina A
- Posizionare il mouse sul tavolino di perfusione in posizione supina per consentire l'esposizione della cavità toracica e addominale.
- Identifica visivamente il processo xifoideo e, con l'emostatico nella mano dominante, appunta la pelle e bloccala. Una volta fissato l'emostato, trasferirlo sulla mano non dominante e sollevare la pelle.
- Usa le forbici nella mano dominante e taglia, con un angolo di 90° rispetto alla colonna vertebrale, una macchia di pelle per rivelare la parete addominale esterna.
- Con il processo xifoideo e la gabbia toracica ora visibili, sezionare bilateralmente la parete addominale, facendo attenzione a evitare di tagliare organi o vasi principali.
- Con il diaframma ora visibile, visualizza i ventricoli cardiaci e i polmoni attraverso il diaframma. Con la punta delle forbici, tagliare il diaframma in uno dei fianchi, vicino alla colonna vertebrale, facendo attenzione a non tagliare organi o vasi principali.
NOTA: Questo "foro" nel diaframma bilancerà la pressione intratoracica negativa con la pressione atmosferica e si verificherà uno pneumotorace che farà collassare i polmoni e ritrarrà il cuore, facilitando la dissezione del diaframma senza danneggiare i polmoni o il cuore. - Continua a sezionare attraverso le costole e parallelamente ai polmoni per creare un "lembo" toracico. Rilasciare l'emostatico e tagliare il processo xifoideo nel piano sagittale. Spalancare delicatamente il processo xifoideo manualmente. Osservate le quattro camere del cuore.
- Con la mano non dominante e usando il forcipe, afferra il cuore vicino al suo apice. Con la mano dominante, tenere l'ago della sonda gastrica (attaccato al catetere endovenoso) e perforare l'apice del cuore. Per evitare la perforazione completa del ventricolo sinistro o il raggiungimento della vascolarizzazione polmonare e quindi la scarsa perfusione della vascolarizzazione sistemica, controllare il posizionamento dell'estremità della punta sferica dell'ago della sonda gastrica, che dovrebbe trovarsi sul bordo del sito di puntura leggermente sporgente dal cuore. Bloccare l'ago della sonda in posizione utilizzando una pinza per zanzare curva o semplicemente tenerlo a mano mentre si manipola il rubinetto per flebo.
- Aprire il rubinetto allo 0,9% di soluzione salina e, quasi contemporaneamente, tagliare il ventricolo destro con le forbici; perfondere per 2-3 min. Durante il tempo di perfusione, muovere delicatamente l'ago da un lato all'altro e su e giù per ridurre l'attorcigliamento del sistema vascolare e aumentare l'uscita del sangue dal cuore.
- Dopo la perfusione con soluzione fisiologica, ruotare la maniglia del rubinetto per interrompere il flusso dalla soluzione fisiologica e consentire il flusso dalla siringa all'ago della sonda magnetica. Perfondere a mano con la soluzione di concanavalina A a una velocità di stato stazionario. Assicurarsi che i 10 mL di soluzione di concanavalina A vengano erogati in 30-35 s.
- Dopo la perfusione con concanavalina A, ruotare la valvola per interrompere il flusso dalla siringa e consentire nuovamente il flusso dalla soluzione fisiologica allo 0,9% all'ago della sonda gastrica. Versare con la soluzione salina allo 0,9% per altri 2-3 minuti. Rimuovere l'ago della sonda gastrica dal cuore.
NOTA: La concanavalina A suggerita in questo protocollo è coniugata alla fluoresceina (verde); tuttavia, è disponibile anche la concanavalina A attaccata ad altri fluorocromi.
5. Enucleazione e isolamento della retina fresca
- Gira il mouse su un lato e, usando la mano non dominante, posiziona l'indice e il pollice rispettivamente sulle palpebre superiori e inferiori. Ritrarre delicatamente le palpebre e la pelle con le dita e proptodare l'occhio, facendolo sporgere parzialmente dall'orbita.
- Mentre l'occhio è inclinato, usa le forbici curve nella mano dominante e raccogli sotto l'occhio con un angolo di 45°. Taglia l'attacco muscolare e il nervo ottico. Usando le stesse forbici di una spatola, trasferire l'occhio in un piccolo contenitore o direttamente sul tavolino del microscopio da dissezione.
NOTA: Fare attenzione a non tagliare la parte posteriore dell'occhio ed evitare di tirare l'occhio durante questo passaggio. - Posiziona l'occhio su una cera dentale per aprire il globo. Al microscopio da dissezione e utilizzando la mano non dominante, tenere la piega sclerale o i resti muscolari ancora attaccati esternamente all'occhio posteriore con una micro-pinza e orientare l'occhio in modo che la cornea sia rivolta di lato.
NOTA: Per evitare che l'occhio si muova/scivoli durante l'apertura del globo, è possibile posizionare un pezzo di tessuto bagnato e privo di lanugine sopra la cera dentale. - Con uno degli angoli acuti di una lametta rivestita in teflon, praticare un'incisione 1-2 mm dietro e parallela al limbus (giunzione cornea-sclera). Tenere la piega sclerale o il muscolo con le micro-pinze e tirare la lama attraverso il limbus con una forza minima verso il basso. Continua a tagliare con il rasoio per separare totalmente il segmento anteriore (cornea, iride, cristallino e vitreo) dal segmento posteriore (conchiglia oculare).
NOTA: Non segare avanti e indietro. - Trasferire l'oculare diviso in due in una piccola capsula di Petri con PBS.
NOTA: Evitare il contatto della retina con la carta velina (nota al punto 5.3) poiché si attaccherà saldamente alla carta e diventerà essenzialmente impossibile da recuperare. - Afferra una piega sclerale o il muscolo rimanente all'esterno della sclera con una micro-pinza. Staccare completamente la retina dalla sclera rompendo tutte le connessioni al limbus attorno al perimetro della conchiglia oculare utilizzando una microspatola. Estrarre la retina dalla sclera con la microspatola. Se la retina è ancora attaccata alla sclera dal nervo ottico, infilare le microforbici tra la retina e la sclera per tagliare il nervo ottico.
- Rimuovere eventuali residui di muscolo vitreo e ciliare nella periferia della retina. Trasferire immediatamente la retina isolata su un vetrino con un po' di PBS.
NOTA: Qualsiasi altra tecnica di isolamento della retina può essere utilizzata a seconda delle preferenze del ricercatore.
6. Montaggio piatto della retina
- Stendere la retina non fissata su un vetrino con una piccola quantità di PBS. Utilizzando la microspatola, orientare delicatamente la retina con il lato vitreo rivolto verso l'alto. Se la retina è piegata verso l'interno, usa una micro-pinza per tenere i bordi della retina mentre la retina viene aperta usando la micro-spatola.
- Fai 4-5 tagli radiali nella retina in modo che sia piatta (motivo a quadrifoglio).
- Utilizzando un fazzoletto privo di lanugine, asciugare l'eccesso di PBS lontano dalla retina.
NOTA: Non toccare la retina con il tessuto; In caso contrario, il campione andrà perso. Il vetrino coprioggetto è auspicabile per mantenere la retina piatta.
7. Microscopia
NOTA: Per questo passaggio è possibile utilizzare qualsiasi microscopio a fluorescenza con canale GFP/FITC (480/530 nm). Per questo lavoro, abbiamo utilizzato il microscopio di riferimento con 488 canali e il relativo software per l'acquisizione delle immagini.
- Osservare la retina montata di recente al microscopio con un ingrandimento di 100x (obiettivo 10x) e contare i leucociti marcati in fluorescenza (manualmente) scansionando metodicamente l'intero tessuto (da destra a sinistra o dall'alto verso il basso).
NOTA: I leucociti sono singoli punti fluorescenti che possono mostrare una forma rotonda o ovale. Hanno un diametro di 12-15 μm e non sporgono dai capillari retinici (la struttura è completamente vincolata dal lume del vaso). - Acquisire immagini rappresentative con l'ingrandimento desiderato ed eseguire la post-elaborazione delle immagini con il software scelto (ad esempio, ImageJ [Fiji]).
- Esprimere la conta in leucociti per retina. Rappresentare graficamente i dati in base alla media ± alla deviazione standard.
Risultati
Un protocollo di perfusione e colorazione ben eseguito mostrerà la vascolarizzazione retinica completa delineata con la concanavalina A (Figura 1). La scarsa perfusione del topo impedisce la marcatura dell'intero albero vascolare e la successiva analisi dei leucociti aderenti al lume (Figura 2), mentre un'eccessiva pressione dovuta a una rapida compressione di una siringa (inferiore a 30-35 s) può causare permeabilità vascolare e rottura dei vasi sanguigni (Figura 3). La concanavalina A stravasata può causare un'errata etichettatura delle strutture esterne, portando a una quantificazione confondente dei leucociti aderenti.
La valutazione della vascolarizzazione retinica e la quantificazione dei leucociti attaccati mediante microscopia a fluorescenza devono essere effettuate immediatamente dopo il montaggio della retina (Figura 4). Bisogna fare attenzione quando si osserva la retina ad alto ingrandimento perché le curve nei capillari possono sembrare leucociti etichettati come aderenti al sistema vascolare (Figura 4B, cerchio tratteggiato). Focalizzare il microscopio su e giù mentre si osserva l'area in questione di solito consente di differenziare la leucostasi da un vaso che si immerge nella retina. L'utente può cambiare/scegliere il fluoroforo coniugato alla concanavalina A che corrisponde al cubo di fluorescenza disponibile nel microscopio da utilizzare. La leucostasi nella retinopatia diabetica non è un evento drammatico e il ricercatore dovrebbe valutare l'intero albero vascolare scansionando l'intera retina alla ricerca di leucociti aderenti. Di solito, ci sono 1-3 leucociti per retina di animali non diabetici e 3-12 leucociti per retina di animali diabetici, e tale dimensione minima del campione per raggiungere una differenza statisticamente significativa è di 10-12 animali per gruppo (Figura 4A, B e Figura 5). Dato tale fenotipo, è raro trovare 2 o più leucociti nelle immediate vicinanze (Figura 4B, C). Lo stesso non vale per i modelli acuti di infiammazione come nella sfida del lipopolisaccaride (LPS) dove si osserva un robusto fenomeno di leucostasi (Figura 4C e Figura 5). Per un protocollo dettagliato del modello di challenge LPS fare riferimento al punto 26.
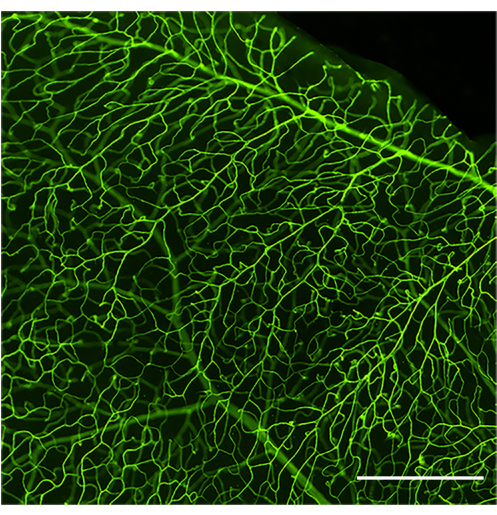
Figura 1: Immagine rappresentativa di un sistema vascolare retinico ben perfuso e colorato. Immagine ad ampio campo del sistema vascolare retinico di un topo sano C57Bl/6J (4 mesi di età) dopo l'infusione di concanavalina A-FITC. La concanavalina A-FITC colora uniformemente la rete vascolare retinica totale se è stata raggiunta una perfusione ottimale. Dopo aver regolato la luminosità e il contrasto, l'immagine è stata convertita in RGB. Barra di scala = 100 μm. Clicca qui per visualizzare una versione più grande di questa figura.
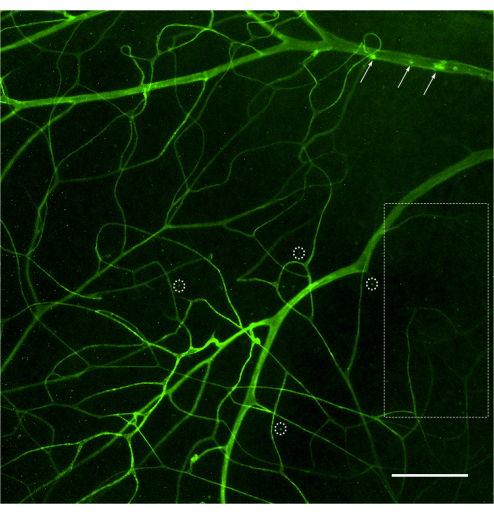
Figura 2: Immagine rappresentativa di scarsa perfusione e colorazione del sistema vascolare retinico. Una scarsa perfusione dell'animale potrebbe portare a un accesso limitato della concanavalina A ai vasi retinici, con conseguente colorazione carente della rete vascolare retinica. Aree estese della retina mostreranno una mancanza di colorazione (rettangolo tratteggiato), limitando la visualizzazione dei leucociti attaccati a quel sistema vascolare. I vasi che hanno ricevuto la concanavalina A potrebbero mostrare leucociti attaccati (frecce), ma non rappresentano la conta totale della retina. In questo caso, il campione deve essere scartato. Un'affermazione carente potrebbe anche portare a punteggiatura artificiosa (cerchi tratteggiati) a causa della microscopia di bassa qualità (canale forzato per rilevare un segnale fluorescente). Dopo aver regolato la luminosità e il contrasto, l'immagine è stata convertita in RGB. Barra di scala = 50 μm. Clicca qui per visualizzare una versione più grande di questa figura.
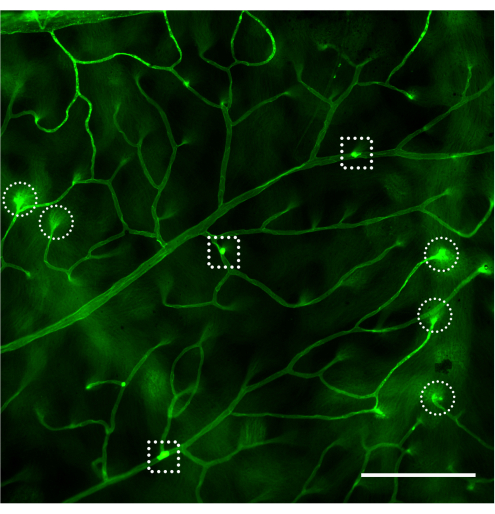
Figura 3: Immagine rappresentativa che mostra lo scoppio dei capillari retinici. Una pressione eccessiva dovuta a una rapida pressione di una siringa con caricamento A di concanavalina (inferiore a 30-35 s) può causare permeabilità vascolare indotta sperimentalmente e scoppio dei vasi sanguigni (cerchi tratteggiati) con conseguente marcatura di strutture esterne o altri artefatti (quadrati tratteggiati). Dopo aver regolato la luminosità e il contrasto, l'immagine è stata convertita in RGB. Barra di scala = 50 μm. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 4: Esempi di flessione capillare e leucostasi in topi non diabetici, diabetici e con LPS-challenged. Esempi di leucostasi retinica nel topo C57Bl/6J (4 mesi di età) dopo l'infusione di concanavalina A-FITC. (A) I topi non diabetici non mostrano leucostasi, ma non è raro incontrare 1-3 leucociti attaccati al sistema vascolare retinico dopo la scansione dell'intera retina (freccia). (B) I leucociti attaccati al sistema vascolare retinico nei topi diabetici (modello di infiammazione subclinica) potrebbero variare da 3 a 12 ed è raro trovare leucociti attaccati in stretta vicinanza (frecce). La struttura racchiusa nel cerchio del trattino è un esempio di curvatura capillare che si tuffa nella retina. (C) Il test di sfida sui topi con LPS (modello di infiammazione acuta) può essere effettuato con ogni esperimento come controllo positivo della leucostasi. In questo modello, è comune trovare diversi leucociti attaccati al sistema vascolare in stretta vicinanza (frecce). Dopo aver regolato la luminosità e il contrasto, l'immagine è stata convertita in RGB. Barra di scala = 100 μm. Abbreviazione: LPS = lipopolisaccaride. Clicca qui per visualizzare una versione più grande di questa figura.
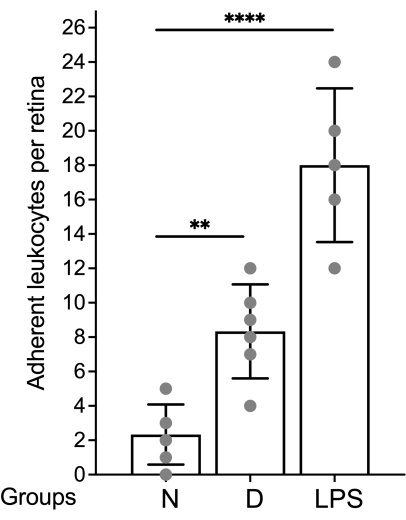
Figura 5: Grafico rappresentativo per riportare i risultati. La conta leucocitaria è espressa per retina e i dati sono rappresentati graficamente utilizzando la media e la deviazione standard. Abbreviazioni: N = non diabetico; D = diabetico; LPS = lipopolisaccaride. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
La leucostasi nell'uomo si riferisce ai sintomi e ai risultati clinici associati all'iperleucocitosi (conta totale dei leucociti (WBC) >100.000/μL) ed è un'emergenza medica20. I meccanismi che portano alla leucostasi sono oggetto di intensa ricerca. Ad oggi, lo studio della leucostasi nell'uomo in vivo non è ancora possibile e i ricercatori devono fare affidamento su modelli animali per comprendere questo processo. Diverse malattie presentano leucostasi e avere un protocollo dettagliato per visualizzare il fenomeno ex vivo può essere utile per i ricercatori in laboratorio. Il protocollo presentato in questo rapporto è stato ottimizzato per lo studio della vascolarizzazione retinica; Tuttavia, può essere ottimizzato empiricamente per lo studio di altri letti vascolari adatti come la vascolarizzazione nel muscolo cremaster27.
Se eseguita correttamente, questa tecnica consente la perfusione e la marcatura dell'intero albero vascolare retinico e la marcatura e la quantificazione dei leucociti aderenti alla parete vascolare. La retina è particolarmente adatta per questo metodo perché la sua vascolarizzazione è ristretta a piani definiti nel tessuto (a differenza della maggior parte dei tessuti in cui la vascolarizzazione è meno ordinata). Questo metodo offre un buon contrasto con il tessuto non colorato quando si utilizza un tessuto trasparente (retina) o molto sottile (come il muscolo cremastere27). I tessuti spessi o i tessuti con abbondanti nervi mielinizzati o altre cellule opache e pigmentate sono siti poveri per la valutazione con questo metodo.
Un requisito critico nella procedura è una buona perfusione del sistema vascolare. La perfusione mentre il cuore sta ancora pompando facilita una buona perfusione e l'etichettatura della microvascolarizzazione. La scarsa perfusione vascolare è spesso dovuta all'uso di liquidi freddi che portano alla vasocostrizione o all'attorcigliamento del sistema vascolare a causa del peso e del posizionamento dell'ago di perfusione o della pinza. Durante la perfusione, è importante prestare molta attenzione ai diversi organi durante la procedura poiché possono fornire alcuni indizi sull'efficienza della perfusione. Ad esempio, se l'ago viene inserito nella vena polmonare, i polmoni si riempiranno e cambieranno colore (sbiancando) immediatamente quando viene avviato il flusso, suggerendo che la perfusione sarà subottimale a causa del sequestro di tutti i liquidi nell'albero polmonare. Durante la perfusione si osserva uno sbiancamento nella lingua, nei reni e nel fegato, il che potrebbe suggerire una procedura ottimale; Tuttavia, questi organi si trovano a valle dei vasi sanguigni che irrorano gli occhi e quindi, lo sbiancamento degli organi garantisce una buona perfusione all'organismo ma non sempre alla retina.
Altri potenziali problemi che sono stati identificati che influiscono sulla perfusione sono: i) bolle d'aria intrappolate nella linea di perfusione che entrano nei microvasi e impediscono la perfusione con il colorante fluorescente; ii) se l'ago della sonda gastrica inserito nel cuore è esteso troppo in profondità nell'arco aortico, è possibile bloccare l'arteria carotide destra, impedendo così il flusso di colorante nella retina destra; e iii) se la perfusione è troppo forte, il conseguente aumento della pressione intravascolare può portare a permeabilità vascolare indotta sperimentalmente e potrebbe causare l'intrappolamento artefatto di alcuni leucociti nella microvascolarizzazione. La permeabilità vascolare indotta sperimentalmente viene visualizzata al microscopio come un'esplosione localizzata di concanavalina A stravasata nel tessuto circostante il vaso, mentre la permeabilità vascolare patologica presenta un sottile pattern diffuso. Nel primo scenario, potrebbe verificarsi l'etichettatura di strutture esterne o altri artefatti, potenzialmente confondendo la quantificazione dei leucociti aderenti. In questa circostanza l'osservatore dovrebbe affidarsi agli indicatori oggettivi che definiscono istologicamente un leucocita: forma, dimensione e localizzazione (all'interno del lume di un vaso).
Le condizioni patologiche che presentano capillari acellulari (degenerati) come la retinopatia diabetica non precludono l'uso di questa tecnica. I capillari nelle prime fasi di degenerazione, quelli che hanno perso l'endotelio ma le cellule murali sono intatte, sono ancora pervi, mentre i capillari in fase avanzata di degenerazione, sebbene non siano più pervi, rimangono nella loro sede originale (degenerazione focalizzata) e non si osservano cambiamenti apprezzabili nei vasi vicini 28. Entrambe le circostanze consentono l'etichettatura della vascolarizzazione circostante e la valutazione della leucostasi.
Un passaggio cruciale nell'isolamento della retina è l'enucleazione dell'occhio senza tagliare la parte posteriore dell'occhio. Poiché il nervo ottico contiene i vasi sanguigni in entrata e in uscita che vascolarizzano gli strati retinici e i neuroni, recidere il nervo ottico troppo vicino al suo ingresso nel bulbo oculare garantisce quasi che l'albero vascolare retinico collassi, portando a una visione non ottimale del sistema vascolare e alla successiva analisi del fenomeno della leucostasi. Particolare attenzione dovrebbe essere prestata alle lame di rasoio utilizzate per la rimozione del segmento anteriore dell'occhio; Dovrebbero essere cambiati frequentemente (idealmente una lama di rasoio ogni 1-2 occhi) perché le lame smussate tagliano male e potrebbero portare a tirare e tirare l'occhio e la retina, che a sua volta danneggerà il sistema vascolare. Quando si rimuove il segmento anteriore dell'occhio, si consiglia di ruotare l'occhio mentre si taglia il limbus e rimuovere la lente. La rimozione iniziale del segmento anteriore dell'occhio è più facile se eseguita su carta bagnata e priva di lanugine; Tuttavia, la carta deve essere rimossa immediatamente dopo la rimozione del segmento anteriore, altrimenti la retina appena isolata potrebbe attaccarsi alla carta e non può essere recuperata.
Riconosciamo che questo protocollo ha diverse limitazioni. In primo luogo, la perfusione iniziale può rimuovere i leucociti che sono attaccati in modo lasco al sistema vascolare, portando il ricercatore a segnalare un'assenza di leucostasi quando in realtà questo potrebbe non essere il caso. Includere un controllo positivo della leucostasi, come un modello acuto di infiammazione26, potrebbe aiutare a determinare che la perfusione non era troppo dura dimostrando che la leucostasi è presente. E in secondo luogo, sarà difficile per un osservatore non addestrato determinare se la struttura fortemente fluorescente è in realtà la cellula di interesse e non un artefatto. Per superare questo problema, il ricercatore dovrebbe familiarizzare con la forma (di solito rotonda o ovale all'attacco iniziale al sistema vascolare) e le dimensioni (12-15 μm) dei leucociti29. Se c'è il dubbio che la struttura osservata sia o non sia un leucocita, è consigliabile non includerlo nella quantificazione, ma il ricercatore deve fare la chiamata finale una volta acquisita maggiore familiarità con il test. Idealmente, la quantificazione automatica utilizzando un software specifico potrebbe facilitare la quantificazione manuale ad alta intensità di lavoro dei leucociti attaccati al sistema vascolare, tuttavia, fino a sapere, la distinzione tra leucociti e artefatti può essere fatta solo dalla conoscenza e dall'esperienza del ricercatore. Lo sviluppo o l'ottimizzazione delle attuali piattaforme per quantificare la leucocitosi in modo automatico o semiautomatico è un'opzione che dovrebbe essere esplorata.
In conclusione, questo protocollo convalidato per la valutazione della leucostasi potrebbe essere uno strumento utile per i ricercatori che eseguono studi sulla retinopatia diabetica e altre malattie vascolari oculari e non oculari e per testare nuovi interventi terapeutici.
Divulgazioni
Gli autori non hanno conflitti di interesse da dichiarare.
Riconoscimenti
Questo lavoro è stato supportato dalle sovvenzioni del National Institutes of Health (NIH) R01EY022938, R01EY022938-S1 e K99EY034928. Gli autori riconoscono i servizi del CWRU (P30EY11373) e dell'UCI (P30EY034070) Visual Science Research Centers, nonché il supporto dipartimentale da una sovvenzione illimitata di Research to Prevent Blindness al Gavin Herbert Eye Institute dell'Università della California Irvine.
Materiali
| Name | Company | Catalog Number | Comments |
| 10 mL syringe | |||
| 4-way stopcock Luer lock I.V. line valve | Baxter | 2C6204 | |
| Concanavalin A solution | Vector | FL-1001 | Prepare in PBS 1 mg/mL |
| Dissecting tools set | Includes hemostats, scissors and forceps | ||
| FIJI | Software for image processing | ||
| Fluorescence microscope | Nikon | Eclipse Ni | |
| Forceps, Dumont #5, Biological grade tip | Electron Microscopy Sciences (EMS) | 72700-D | |
| Gavage Needle 1.25 mm OD barrel tip x 30 mm | Fine Science | 18060-20 | |
| Halstead Mosquito Forceps | Fisher Scientific | 13-812-10 | |
| I.V. Catheter set with regulating clamp 70 inches | Baxter | 2C5417s | |
| I.V. Pole | |||
| Lint free tissue | Kimpwipes is an option | ||
| Micro dissecting spring scissors, Vannas, 3 mm straight | ROBOZ | RS-5620 | |
| Micro spatula | Fine Science Tools (FST) | 10091-12 | |
| Nikon | NIS-Elements (AR 5.30.03 64-bit) | Software for image acquisition | |
| Petri dish (100 mmx15 mm) | Corning | 351029 | |
| Phosphate buffered saline (PBS) | |||
| Pink dental wax | Electron Microscopy Sciences (EMS) | 72670 | |
| Pressure infuser | Infusurge | 4010 | |
| Razor blades, GEM single edge stainless steel, Teflon coated | Electron Microscopy Sciences (EMS) | 71970 | |
| Saline 0.9%, veterinary grade, 1000 mL | Baxter | 04925-04-10 | |
| Small dissecting scissors, curved blunt end 22 mm | ROBOZ | RS 5983 |
Riferimenti
- Swystun, L. L., Liaw, P. C. The role of leukocytes in thrombosis. Blood. 128 (6), 753-762 (2016).
- Barouch, F. C., et al. Integrin-mediated neutrophil adhesion and retinal leukostasis in diabetes. Invest Ophthalmol Vis Sci. 41 (5), 1153-1158 (2000).
- Macaron, W., Sargsyan, Z., Short, N. J. Hyperleukocytosis and leukostasis in acute and chronic leukemias. Leuk Lymphoma. 63 (8), 1780-1791 (2022).
- Kempen, J. H., et al. The prevalence of diabetic retinopathy among adults in the United States. Arch Ophthalmol. 122 (4), 552-563 (2004).
- Kohner, E. M. Diabetic retinopathy. Br Med Bull. 45 (1), 148-173 (1989).
- Aouiss, A., Anka Idrissi, D., Kabine, M., Zaid, Y. Update of inflammatory proliferative retinopathy: Ischemia, hypoxia and angiogenesis. Curr Res Transl Med. 67 (2), 62-71 (2019).
- Tsalamandris, S., et al. The role of inflammation in diabetes: Current concepts and future perspectives. Eur Cardiol. 14 (1), 50-59 (2019).
- Adamis, A. P. Is diabetic retinopathy an inflammatory disease. Br J Ophthalmol. 86 (4), 363-365 (2002).
- Joussen, A. M., et al. A central role for inflammation in the pathogenesis of diabetic retinopathy. FASEB J. 18 (12), 1450-1452 (2004).
- Serra, A. M., et al. CD11b+ bone marrow-derived monocytes are the major leukocyte subset responsible for retinal capillary leukostasis in experimental diabetes in mouse and express high levels of CCR5 in the circulation. Am J Pathol. 181 (2), 719-727 (2012).
- Kinukawa, Y., Shimura, M., Tamai, M. Quantifying leukocyte dynamics and plugging in retinal microcirculation of streptozotosin-induced diabetic rats. Curr Eye Res. 18 (1), 49-55 (1999).
- Linsenmeier, R. A., et al. Retinal hypoxia in long-term diabetic cats. Invest Ophthalmol Vis Sci. 39 (9), 1647-1657 (1998).
- Herdade, A. S., et al. Effects of diabetes on microcirculation and leukostasis in retinal and non-ocular tissues: Implications for diabetic retinopathy. Biomolecules. 10 (11), 1583 (2020).
- Oakley, J., et al. Incorporating hemoglobin levels to map leukostasis risk in acute leukemia using microvasculature-on-chip technologies. Blood. 136 (Suppl 1), 9-10 (2020).
- Miyamoto, K., et al. Prevention of leukostasis and vascular leakage in streptozotocin-induced diabetic retinopathy via intercellular adhesion molecule-1 inhibition. Proc Natl Acad Sci U S A. 96 (19), 10836-10841 (1999).
- Veenstra, A., et al. Diabetic retinopathy: Retina-specific methods for maintenance of diabetic rodents and evaluation of vascular histopathology and molecular abnormalities. Curr Protoc Mouse Biol. 5 (3), 247-270 (2015).
- Lester, T. J., Johnson, J. W., Cuttner, J. Pulmonary leukostasis as the single worst prognostic factor in patients with acute myelocytic leukemia and hyperleukocytosis. Am J Med. 79 (1), 43-48 (1985).
- Porcu, P., et al. Hyperleukocytic leukemias and leukostasis: a review of pathophysiology, clinical presentation and management. Leuk Lymphoma. 39 (1-2), 1-18 (2000).
- Giammarco, S., et al. Hyperleukocytosis and leukostasis: management of a medical emergency. Expert Rev Hematol. 10 (2), 147-154 (2017).
- Mank, V., Azhar, W., Brown, K. Leukocytosis. StatPearls. , (2024).
- Bernhard, W., Avrameas, S. Ultrastructural visualization of cellular carbohydrate components by means of concanavalin A. Exp Cell Res. 64 (1), 232-236 (1971).
- Oliver, J. M., Zurier, R. B., Berlin, R. D. Concanavalin a cap formation on polymorphonuclear leukocytes of normal and beige (chediak-higashi) mice. Nature. 253 (5491), 471-473 (1975).
- Pink, J. R., Hoessli, D., Tartakoff, A., Hooghe, R. Characterisation of Concanavalin A-binding glycoproteins from mouse splenic leukocytes by two-dimensional electrophoresis: preferential binding of incompletely glycosylated forms of H-2 antigen to the lectin. Mol Immunol. 20 (4), 491-497 (1983).
- Janssen, B., Debets, J., Leenders, P., Smits, J. Chronic measurement of cardiac output in conscious mice. Am J Physiol Regul Integr Comp Physiol. 282 (3), R928-R935 (2002).
- Flecknell, P. A., Flecknell, P. A. Anaesthesia of common laboratory species: Special considerations. Laboratory Animal Anaesthesia. , 181-241 (2009).
- Seemann, S., Zohles, F., Lupp, A. Comprehensive comparison of three different animal models for systemic inflammation. J Biomed Sci. 24 (1), 60 (2017).
- Lessieur, E. M., et al. ICAM-1 on the luminal surface of endothelial cells is induced to a greater extent in mouse retina than in other tissues in diabetes. Diabetologia. 65 (10), 1734-1744 (2022).
- Kuwabara, T., Cogan, D. G. Studies of retinal vascular patterns: I. Normal architecture. Arch Ophthalmol. 64, 904-911 (1960).
- Tigner, A., Ibrahim, S. A., Murray, I. V. Histology, white blood cell. StatPearls. , (2024).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon