Method Article
N-metil-N-nitrosourea ile İndüklenen Sıçan Retina Hasarının Örneklenmesi ve Patolojik Değişikliklerin Çok İndeksli Değerlendirilmesi
Bu Makalede
Özet
Bu protokol, sıçan retinal örneklemesi ve N-Metil-N-Nitrosourea'nın intraperitoneal enjeksiyonundan sonra retinadaki patolojik değişiklikleri ve apoptozu tespit etmek için hematoksilen-eozin boyama, TUNEL testi ve Western blot kullanımı için bir prosedürü tanımlar.
Özet
Retinopati, çoğu oküler hastalıkta ve diabetes mellitusun geç komplikasyonlarında görülebilir. Spesifik pigment epitel hücreleri ve optik hücrelerin hasar görmesi ve dejenerasyonu retinopatinin temel özellikleridir. Birçok geleneksel ilaç, retinopatinin tedavisinde önemli klinik etkinlik göstermiştir. Bir retinanın hızlı ve eksiksiz bir şekilde nasıl elde edileceği, retinopati tedavisi için geleneksel tıp araştırmalarında önemli bir adımdır. Bu çalışmada, N-metil-N-nitrosourea (MNU) ile indüklenen sıçanların retina hasarının örneklenmesi ve patolojik değişikliklerin çok indeksli değerlendirilmesi için standart ve uygulanabilir bir prosedür sağlamayı amaçladık. Sıçanlara retina hasarını indüklemek için bir kez intraperitoneal olarak 60 mg / kg MNU enjekte edildi ve retina örnekleri 7 gün sonra elde edildi. Ek olarak, retinal patolojik değişiklikleri değerlendirmek için hematoksilen-eozin boyaması yapıldı. Apoptoz oranı ve apoptoz proteininin TUNEL ve Western blot ile belirlenmesi. Retina örneklemesi ve patolojik değişikliklerin değerlendirilmesi için bu standartlaştırılmış protokoller, retinopati mekanizmasının araştırılmasında ve yeni ve etkili geleneksel bitkilerin keşfinde yardımcı olmaktadır.
Giriş
Retinitis pigmentosa (RP) kalıtsal ve kör edici bir retina hastalığıdır1. RP'nin görülme sıklığı 1/3500 ile 1/5000 arasındadır ve dünyada yaklaşık 2,5 milyon kişinin görme fonksiyonunu etkilemektedir. İnsanda görme bozukluğuna yol açan, tüm topluma önemli bir yük getiren en yaygın hastalıklardan biridir2. Hastalık, retina pigment epitel hücre fonksiyonunun kademeli kaybı ve fotoreseptörlerin ilerleyici apoptozu ile karakterizedir. Erken evrede, hastalar periferik görme alanı kusurları olarak ortaya çıkan ve sonunda merkezi görme kaybına yol açan gece körlüğü yaşarlar3. Bu nedenle, retinal fotoreseptör apoptozunun inhibisyonu, RP'nin önlenmesi ve tedavisi için önemli bir noktadır.
Retinal hücreli apoptoz, insan RP ve model hayvanların ortak bir özelliğidir4. Sıçanlarda 7 gün boyunca 60 mg / kg N-Metil-N-Nitrosourea (MNU) intraperitoneal enjeksiyonu, apoptozu ve retinal fotoreseptör hücrelerinin kaybını indükleyebilir ve RP 5,6'nın yaygın olarak kullanılan bir hayvan modelidir. Model hayvanlarda retina dokusunun patolojik yapısı, spesifik hücre apoptozu ve apoptozla ilişkili protein ekspresyonundaki değişikliklerin analiz edilmesi, insan RP ve tarama ilaçlarının patogenezinin incelenmesinde etkili deneysel veriler ve teorik destek sağlayabilir 7,8. Bu nedenle, retina örneklerinin kalitesi deneysel verilerin güvenilirliğini belirler. Bununla birlikte, oküler dokunun özelliği nedeniyle, sıçan retinasının nasıl elde edileceğine dair çok az rapor vardır9.
Bu makale, yukarıdaki eksikliklerin üstesinden gelmek için sıçanlarda retina örneklemesi için basit, hızlı, standartlaştırılmış ve uygulanabilir bir prosedür sunmaktadır. Sıçanlarda retina dokusu hasarı ve apoptozdaki patolojik değişiklikleri analiz etmek için hematoksilen-eozin boyaması (HE), terminal deoksinükleotidil transferaz aracılı deoksiuridin trifosfat-digoksigenin çentik-uç etiketleme (TUNEL) boyaması ve Western blot kullanılır. Tüm yöntemler, araştırma grubumuzun belirli operasyonel süreçlerle ilgili deneyiminden türetilmiştir.
Protokol
Tüm protokoller ve cerrahi prosedürler Ningxia Tıp Üniversitesi Etik Kurulu tarafından onaylanmıştır (Etik numarası: NO. 2020-Q066). 7-8 haftalık ve 200-220 g ağırlığındaki SPF Sprauge-Dawley (SD) erkek sıçanlar, SCXK (Ning) 2020-0001 hayvan lisans numarası ile Ningxia Tıp Üniversitesi'nden satın alındı. Tüm hayvanlar Ningxia Tıp Üniversitesi Laboratuvar Hayvanları Merkezinde yetiştirildi. Sıcaklık ve nem uygundu, gündüz-gece ışık döngüsü korundu ve yiyecek ve su serbest ve yeterliydi.
1. Ameliyat öncesi hazırlık
- Malzemelerin hazırlanması
- Sıçan plakaları, inhalasyon anestezi cihazları, gömülü kutular, donmuş saklama tüpleri, tek kullanımlık cerrahi eldivenler ve maskeler, geniş ağızlı şişeler, %4 paraformaldehit, buz paketleri, oftalmik makas, oftalmik cımbız, cerrahi bıçaklar ve bıçak sapları, 1,5 mL mikrosantrifüj tüpleri hazırlayın ve bunları önceden sterilize edin (bkz.
- Hayvan hazırlama
- 20 erkek SD sıçanı rastgele model grubuna (n = 10) ve kontrol grubuna (n = 10) bölün. Model sıçanlara intraperitoneal olarak 60 mg / kg MNU enjekte edin ve kontrol sıçanlarına aynı hacimde salin ile intraperitoneal olarak enjekte edin.
- Enjeksiyondan 7 gün sonra, fareleri aç ve örneklemeden önceki gece serbestçe içmelerine izin verin.
- Ertesi gün, sıçanı ameliyat masasına sırtüstü yatırın ve% 4 izofluran ve 2 L / dak oksijen kullanarak anestezi uygulamak için bir maske kullanın. Sıçanların tepkilerini gözlemlemek için ayağın merkezini sıkıştırarak anestezi derinliğini ölçün.
2. Protein faktörü tespiti için retina örneklemesi
- Sıçanın göz yuvasını sol elinizle sabitleyin ve oftalmik bükme forseps kullanarak sağ elinizle orta kuvvetle gözü çıkarın. Göz küresini soğuk bir cam tabağa sagital pozisyonda yerleştirin.
- Sol el göz küresini sabitlemek için oftalmik düz cımbız tutarken ve sağ el cerrahi bıçağı tutarken, lens bölgesinin yakınında 2 mm uzunlamasına bir kesi yapın.
- Kesi boyunca oftalmik makasla korneayı kesin ve lensi, vitreusu nazikçe soyun ve göz kapağını açıkta bırakın.
- Göz kabının altını 1,5 mL mikrosantrifüj tüpünün ucuna yerleştirin, göz kabını tüpün üzerine çevirin ve retinayı açığa çıkarın (retina soluk sarıdır).
- Oftalmik bükme cımbızıyla göz küresinin skleral duvarı boyunca tüm retinayı çıkarın, ardından donmuş bir tüpe koyun ve ileride kullanmak üzere sıvı nitrojen tankında saklayın (Şekil 1).
3. Patolojik inceleme ve spesifik hücre boyama için retina örneklemesi
- Sol elinizle, farenin gözünün köşesini kaldırmak için göz cımbızını kullanın. Sağ elinizle, farenin gözünün köşesi boyunca 4 mm'lik bir açıklık kesmek için cerrahi bir bıçak kullanın.
- Sol eldeki açıklıkta göz küresinin kenarını sıkıştırmak için göz cımbızını kullanın. Göz küresinin çevresindeki dokuları temizlemeye dikkat ederken, göz küresinin kenarı boyunca çevre dokuları kesmek için oftalmik makas kullanın.
- Göz küresinin arka kutbunda yer alan görme sinirinin etrafındaki dokuları cımbız ile ayırın, göz sinirini kesin ve korumaya dikkat edin. Ardından göz küresini çıkarın.
- Kalan kanı çıkarmak için çıkarılan göz küresini tuzlu suyla yıkayın, fazla suyu emmek için filtre kağıdına sarın ve soğuk kalay folyo üzerine yerleştirin.
- Gözü oftalmik cımbızla düzeltin. Cerrahi bir bıçakla kornea ve retinanın birleştiği yer boyunca 4 mm'lik uzunlamasına bir kesi yapın.
- Korneayı oftalmik makasla çıkarın, kesi boyunca dairesel bir kesim yapın ve lensi ve vitreus gövdesini nazikçe çıkarın.
- Optik sinirli kalan göz kapağını bir gömme kutusuna yerleştirin ve %4 paraformaldehit ile sabitleyin.
- Paraformaldehit ile sabitlenmiş numuneleri parafine gömün ve HE boyama ve TUNEL boyama7 için 4 μm'lik dilimler halinde kesin.
4. Sıçan retinasının HE boyanması
- Mum alma ve hidrasyon: Dilimleri 10 dakika ksilen içine yerleştirin, işlemi 10 dakika daha tekrarlayın, ardından 5 dakika mutlak etanol uygulayın, etanol işlemini 5 dakika daha tekrarlayın, ardından 5 dakika boyunca% 95 alkolde muamele edin, daha sonra% 85 alkolde 5 dakika ve son olarak 5 dakika% 75 alkolde.
- Hematoksilen boyama: Dilimi deiyonize su ile 5 dakika durulayın. 100 μL hematoksilen boyama solüsyonu kullanın ve 5 dakika boyayın, 5-10 saniye deiyonize su ile durulayın. 30 saniye boyunca 100 μL %1 hidroklorik asit etanol ekleyin, 20 dakika deiyonize su ile durulayın ve 1 dakika boyunca 100 μL %0.2 amonyaklı su ekleyin. Deiyonize su ile 5 dakika durulayın.
- Eozin boyama: 5 dakika boyunca lekelemek için 100 μL eozin boyama solüsyonu kullanın ve 30 saniye boyunca deiyonize su ile durulayın.
- Dehidrasyon ve sızdırmazlık: Dilimleri 5 dakika boyunca %70 alkole, ardından 5 dakika boyunca %85 alkole, ardından 5 dakika boyunca %90 alkole ve 5 dakika mutlak etanole batırın. Mutlak etanol işlemini 5 dakika daha tekrarlayın, ardından 5 dakika ksilene batırın ve işlemi 5 dakika daha tekrarlayın. Son olarak, dilimlerin yüzeyine yaklaşık 100 μL nötr reçine ekleyerek kapatın ve ardından bir kapak camı ile örtün.
- Slaytları görüntüleme: Lekeli dilimleri mikroskobun üzerine yerleştirin, görüntü net bir şekilde görünene kadar mikroskobun odağını ayarlayın, büyütmeyi 400x'e ayarlayın ve görüntüyü yakalayın.
- Toplam retina kalınlığını ve dış retina kalınlığını ölçün: Toplam retina kalınlığını ve dış retina kalınlığını (dış nükleer tabakanın ve fotoreseptör tabakasının kalınlığı) ölçün ve dış retina kalınlığı yüzdesini hesaplayın
Dış retina kalınlığı (%) = (dış retina kalınlığı / toplam retina kalınlığı) x 100.
5. Retinal fotoreseptör hücrelerin apoptoz oranının TUNEL yöntemi ile belirlenmesi
- Mum alma ve hidrasyon: Dilimleri 10 dakika ksile içine yerleştirin, işlemi 10 dakika daha tekrarlayın, ardından 5 dakika mutlak etanol içine koyun ve bu adımı 5 dakika daha tekrarlayın. 5 dakika boyunca %95 alkol, 5 dakika boyunca %90 alkol, 5 dakika boyunca %80 alkol, 5 dakika boyunca %70 alkol koyarak dehidrasyon yapın ve 5 dakika boyunca deiyonize su ile durulayın.
- % 0.85 sodyum klorür çözeltisi ile 5 dakika ve PBS ile 5 dakika durulayın. 15 dakika boyunca% 4 paraformaldehit kullanarak paraformaldehit ile sabitleyin. PBS ile 5 dakika durulayın ve işlemi 5 dakika daha tekrarlayın.
- İnkübasyon ve dengeleme7: Sindirim için 20 μg/mL proteinaz K çözeltisi ile 15 dakika inkübe edin, denge tamponunda 10 dakika dengeleyin ve rekombinant terminal deoksinükleidiltransferaz (rTdT) tamponu ile 37 ° C'de 60 dakika inkübe edin.
- Reaksiyonu durdurma: 15 dakika boyunca 100 μL standart sitrat çözeltisi (2x SSC çözeltisi) ekleyin. PBS ile 5 dakika durulayın ve işlemi 5 dakika daha tekrarlayın.
- Nükleer boya: 5 dakika boyunca 100 μL 4 ", 6-diamidin-2-fenindl (DAPI) reaktifi ekleyin. Deiyonize su ile 5 dakika yıkayın ve işlemi 5 dakika daha tekrarlayın.
- Mühür: Dilimlerin etrafındaki fazla ksileni silin ve dilimlerin yüzeyine yaklaşık 100 μL nötr reçine ekleyerek kapatın ve ardından bir kapak camı ile örtün.
- Mikroskopi: Lekeli dilimleri mikroskobun üzerine yerleştirin, net görünürlük için mikroskobun odağını ayarlayın, büyütmeyi 400x'e ayarlayın ve görüntüyü yakalayın. Standart bir floresan filtresi kullanarak 520 ± 20 nm'de yeşil floresansı gözlemleyin. Mavi DAPI'yi 460 nm'de gözlemleyin.
- Apoptoz oranını hesaplayın: dış retina çekirdek tabakasının yeşil floresan değerlerini ve mavi floresan değerlerini ölçün. Apoptoz oranını şu şekilde hesaplayın:
Apoptoz hücre hızı = yeşil floresan değeri/mavi floresan değeri x 100.
6. Batı lekesi analizi 10
- Lizis tamponu tedavisi: 50 μL soğuk lizis tamponu (5 μL fosfataz inhibitörü, 1 μL proteaz inhibitörü ve 5 μL 100 mM PMSF içeren 1 mL lizis tamponu) ile donmuş bir retinayı doğrayın ve homojenize edin.
- Bir buz banyosunda 5 saniye boyunca 28 kHz sonikasyona tabidir; 3x tekrarlayın. Hücresel kalıntıları gidermek için 4 °C'de 5 dakika boyunca 10.000 x g'da santrifüjleyin. Süpernatanı koruyun.
- em>6.3 Proteinin miktar tayini: Bir BCA protein tahlil reaktif kiti kullanarak protein konsantrasyonunu belirleyin.
- em>6.4 Elektroforez: 50 μg protein numunesi yükleyin ve %12 sodyum dodesil sülfat poliakrilamid jel elektroforezi (SDS-PAGE) üzerine ayırın.
- Membrana transfer: Elektroforetik bir transfer sistemi kullanarak PVDF membranlara elektroforetik olarak transfer.
- Zarları alt bölümlere ayırın: Zarları alt bölümlere ayırın ve ilgilenilen her proteini, β-aktin ve GAPDH'yi tek bir transferden analiz edin.
- Blokaj: Oda sıcaklığında %5 yağsız süt içeren TBST'de membranları 1 saat bloke edin.
- Birincil antikoru inkübe edin: Bölünmüş kaspaz-9 (1:200 seyreltme), bölünmüş kaspaz-3 (1:200 seyreltme), bölünmüş kaspaz-7 (1:200 seyreltme) ve β-aktin (1:1000 seyreltme) primer antikoru ile gece boyunca 4 ° C'de inkübe edin. Membranları TBST ile 5 dakika yıkayın, 3x tekrarlayın.
- İkinci antikoru inkübe edin: Yaban turpu peroksidaz konjuge ikincil antikorları (1:2000) ile oda sıcaklığında 2 saat inkübe edin. Membranları TBST ile 5 dakika yıkayın, 3x tekrarlayın.
- Pozlama: Western blot substratını kullanarak etiketli proteinleri görselleştirin ve son olarak, protein bantlarını otomatik pozlama modunda görselleştirmek için zarları açığa çıkarın.
- Protein bandı yoğunluğunu ölçerek protein içeriğini7 hesaplayın.
7. İstatistiksel analiz
- SPSS 19.0 yazılımını kullanarak verileri analiz edin ve ortalama ± standart sapma olarak sunun. Tek yönlü varyans analizini kullanarak gözlemlenen değerlerin istatistiksel analizlerini gerçekleştirin. İstatistiksel olarak anlamlı olarak p< 0.05'i alın.
Sonuçlar
HE boyamadan sonra, kontrol grubundaki sıçanların tüm retina katmanları net doku yapısına, düzenli hücre düzenlemesine ve düzgün boyamaya sahipken, model grubundaki sıçanların retinal yapısı önemli ölçüde hasar gördü, dış retina tabakası daha inceydi, dış nükleer tabaka neredeyse tamamen iç çekirdek tabakası ile bütünleşmişti, tabakadaki hücrelerin düzeni son derece düzensizdi, Hücre katmanlarının sayısı önemli ölçüde azaldı ve ışığa duyarlı hücre katmanının ve dış nükleer katmanın kalınlığı önemli ölçüde daha inceydi. Kontrol grubunda ve model grubunda dış retina tabakasının kalınlığı sırasıyla %48 ve %23 idi (p < 0.01; Şekil 2).
TUNEL yöntemi, kontrol grubunda apoptotik hücre tespit edilmediğini, ancak model grubundaki sıçanların dış nükleer tabakasında bazı apoptotik hücrelerin bulunduğunu gösterdi (p < 0.01) ve TUNEL-pozitif oranı %9.6 idi (Şekil 3).
Kaspaz protein ailesi, apoptozu gerçekleştiren ana ailelerden biridir. Bunlar arasında, bölünmüş kaspaz 3, bölünmüş kaspaz 7 ve bölünmüş kaspaz 9, hücre apoptozu7'yi değerlendirmek için kullanılan klasik göstergelerdir. Western blot sonuçları, kontrol grubu ile karşılaştırıldığında, model grubunun retinasında bölünmüş kaspaz 3, bölünmüş kaspaz 7 ve bölünmüş kaspaz 9 ekspresyonunun anlamlı olarak arttığını gösterdi (p<0.01; Şekil 4). Bu, MNU'nun retinada açıkça hücre apoptozuna neden olabileceğini gösterdi.

Şekil 1: Deneysel iş akışı. 7 gün boyunca (7d) intraperitoneal MNU enjeksiyonundan sonra, anestezi uygulanmış sıçanların retinası HE ve TUNEL boyaması için elde edildi. Kısaltmalar: MNU = N-metil-N-nitrosourea; HE = hematoksilen-eozin; TUNEL = terminal deoksinükleotidil transferaz aracılı deoksiuridin trifosfat-digoksigenin nick-end etiketleme. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: MNU enjeksiyonundan 7. günde temsili histopatolojik HE boyama görüntüleri. (A) MNU uygulamasından 7 gün (7 gün) sonra HE boyama. (B) Dış retina oranı. Veriler ortalama ± SD (n=6) olarak sunuldu. Gözlenen değerlerin istatistiksel analizleri tek yönlü varyans analizi kullanılarak yapılmıştır. ** P < 0.01'e karşı kontrol. Kısaltmalar: GCL = ganglion hücre tabakası; IPL = iç pleksiform tabaka; INL = çekirdek katmanı; OPL = dış pleksiform tabaka; ONL = dış nükleer katman; PRL = fotoreseptör tabakası; MNU = N-metil-N-nitrosourea; HE = hematoksilen-eozin. n = 6 olur. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 3: TUNEL testi, sıçanlarda MNU tarafından indüklenen fotoreseptör apoptozunu göstermektedir. (A) MNU enjeksiyonundan 7 gün (7 gün) sonra, MNU ile tedavi edilen sıçanlarda ONL'de TUNEL pozitif hücreler (yeşil) sunuldu. (B) TUNEL-pozitif oranı. Veriler ortalama ± SD (n=6) olarak sunuldu. Gözlenen değerlerin istatistiksel analizleri tek yönlü varyans analizi kullanılarak yapılmıştır. ** P < 0.01'e karşı kontrol. Kısaltmalar: GCL = ganglion hücre tabakası; IPL = iç pleksiform tabaka; INL = çekirdek katmanı; OPL = dış pleksiform tabaka; ONL = dış nükleer katman; PRL = fotoreseptör tabakası; MNU = N-metil-N-nitrosourea; TUNEL = terminal deoksinükleotidil transferaz aracılı deoksiuridin trifosfat-digoksigenin nick-end etiketleme. n = 6 olur. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
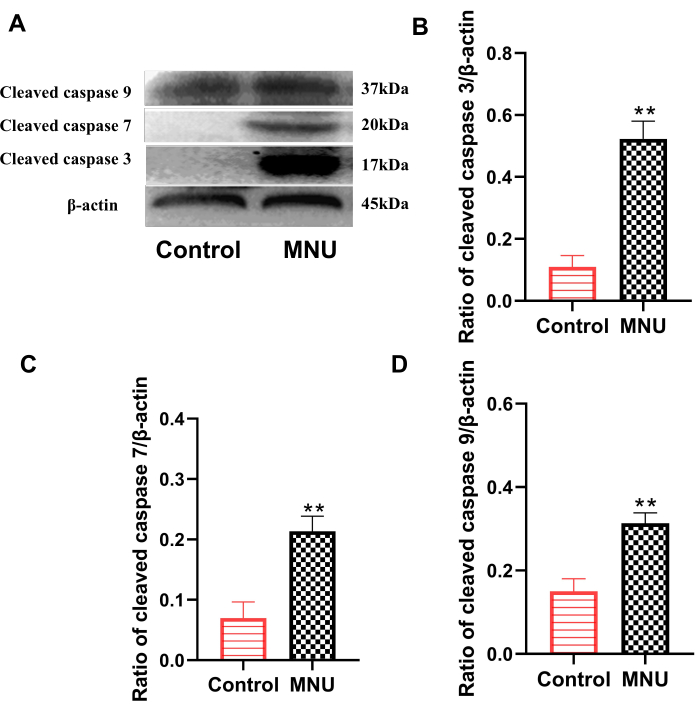
Şekil 4: MNU enjeksiyonundan sonraki 7. günde sıçan retinalarında parçalanmış kaspaz 3, bölünmüş kaspaz 7 ve bölünmüş kaspaz 9'un ekspresyonu. (A) Bölünmüş kaspaz ekspresyonu için temsili veriler. (B) Bölünmüş kaspaz 3/β-aktin oranı. (C) Bölünmüş kaspaz 7/β-aktin oranı. (D) Bölünmüş kaspaz 9/β-aktin oranı. Veriler ortalama ± SD (n=6) olarak sunuldu. Gözlenen değerlerin istatistiksel analizleri tek yönlü varyans analizi kullanılarak yapılmıştır. ** P < 0.01'e karşı kontrol. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
RP kliniklerde sık görülen bir retina hastalığıdır. RP'nin başlangıcı, şiddeti ve ilerlemesi genler ve genetik modlarla ilgilidir ve çevreden etkilenir 8,11. RP, ailesel RP ve sıklıkla RP'yi içerir ve ailesel RP hastaların yaklaşık %60'ını oluşturur. Aile genetik geçmişinin izlenmesi yoluyla, şimdiye kadar RP ile ilgili 83 gen tanımlanmışken, ara sıra RP yaklaşık %40'ını oluşturur, bu da bu tür bir hastanın aile öyküsü olmadığı ve düzensiz bir genetik paterne sahip olduğu anlamına gelir2. RP hastalarında görme fonksiyon kaybına neden olan retinal fotoreseptör hücrelerinin apoptozu genel bir kabul olmasına rağmen, RP'de fotoreseptör ölümünün altında yatan mekanizma tam olarak bilinmemektedir 12,13,14. Esas olarak vitrektomi sırasında elde edilen insan retina dokusuna sınırlı erişim nedeniyle, model hayvanlardan retina dokusunun çıkarılması, RP14,15'in temel araştırmalarında hala yaygın bir yöntemdir.
Retina, göz ampulünün iç tabakasında yer alan, vitreus boşluğu içeride ve koroid zarı dışa yakın olan şeffaf bir zardır. Retina öndeki tırtıklı kenardan başlar ve arkadaki optik diskte sona erer. Görme oluşumunun ilk kısmıdır16. Model hayvanların retina örnekleri esas olarak retinal PCR analizi, Western blot tespiti, patolojik doku yapısı gözlemi, immünohistokimyasal boyama, immünofloresan incelemesi, mikrovasküler yoğunluk değerlendirmesi, hücre izolasyonu ve kültür vb. için kullanılır.17,18. Farklı test indeksleri için retina örneklemesinin gereksinimleri farklıdır. Model hayvanlarda protein faktörü tespiti için retina örneklemesi ve parafine gömülü bölümler için retina örneklemesi, RP8 için ilaçların taranması için yaygın operasyonel tekniklerdir. Bununla birlikte, model hayvanın göz küresinin çok ince ve karmaşık yapısı nedeniyle, gözdeki enterferans yapan dokuların çıkarılması ve retina örneklerinin elde edilmesi işlemi karmaşıktır. Örnekleme işlemi sırasında retina dokusu kaybı, kontaminasyon, protein bozulması ve retina dekolmanı olabilir. Bu faktörler, retinal protein ekstraksiyonunun kalitesi ve miktarının yanı sıra kesit boyamanın etkisi ve deneysel göstergelerin tespit sonuçları üzerinde bir etkiye sahip olacaktır. Bu nedenle, uygun bir retina örnekleme prosedürüne ihtiyaç vardır.
Model hayvanlarda retina toplama tekniğini geliştirmek için kompleksi basitleştirmek ve hasadın temel bağlantısını kavramak çok önemlidir. Retinanın hızlı bir şekilde açığa çıkarılması ve retinanın mümkün olduğunca tamamen çıkarılması, model sıçanlarda protein faktörü tespiti için retina örneklemesinin temel adımlarıdır. Bu çalışmada, örnekleme süresinden tasarruf etmek için anesteziden hemen sonra göz küreleri çıkarıldı. Retinayı açığa çıkarmanın bir püf noktası, göz kabını 1.5 mL'lik bir tüp üzerinde çevirmektir, bu da uygun maliyetli ve pratiktir ve retinayı skleral duvardan tamamen soyabilir. Bu işlem prosedürü basit, hızlı, maliyet tasarrufu sağlayan ve deneysel personel işlem uygulamasına elverişlidir, bu nedenle 5 dakika içinde tamamlanabilir. Patolojik inceleme ve spesifik hücre boyama için retina örneklemesi sürecinde, retinanın tazeliğini ve yapısal bütünlüğünü korumak, yüksek kaliteli boyama elde etmek için önemli bir adımdır. Sol atriyumdan formaldehit ile perfüzyon ve ardından retinayı elde etmek, araştırmacıların sıklıkla kullandığı yöntemlerden biridir, ancak zaman alıcıdır ve formaldehit kötü kokar ve operatöre rahatsızlık verir19. Bu çalışmada göz küresinin etrafındaki doku, bütünlüğünü korumak için anestezi sonrası bir halka şeklinde ayrılır. Optik sinir kesildikten ve tutulduktan sonra, etrafındaki dokuyu göz küresinin arka kutbunda ayırın ve göz küresini çıkarın. Göz küresinin farklı kısımları optik sinir ile doğru bir şekilde yerleştirildi. Son olarak göz içeriğinin desteği ile kesi yapıldı, kornea bir halka şeklinde kesildi, lens ve vitreus soyuldu ve optik siniri bağlayan göz kapağı elde edildi (retina, göz kabının içindeki skleral duvarda bulunur). Bu süreçte, retinanın bütünlüğünü korumak için operasyon nazik olmalıdır. Operasyon prosedürü sadece malzeme toplama hızını büyük ölçüde artırmakla kalmaz, aynı zamanda göz küresinin tam normal yapısını ve şeklini koruyabilir ve göz küresini çıkardıktan sonra göz küresinin farklı kısımlarına doğru bir şekilde yerleştirilebilir. Ustaca bir operasyondan sonra operasyon 8 dakika içinde tamamlanabilir. Araştırma grubumuz yukarıdaki retinal örnekleme yöntemlerini kullanarak, nispeten ideal protein faktörü tespit sonuçları, HE boyama sonuçları ve TUNEL boyama sonuçları elde etti.
Mevcut retina örnekleme yönteminin bazı avantajları olmasına rağmen, yine de iyileştirilmesi gerekmektedir. Protein faktörü tespiti için retina örneklemesi sürecinde, retina açığa çıkarıldıktan sonra, bükme cımbızının destek noktasının sınırlı olması nedeniyle retina cımbız bükülerek alınırken eksik retina diseksiyonu veya kaybı riski de vardır. Bu nedenle, retina diseksiyonu için aletlerin geliştirilmesi gerekmektedir. Öte yandan, patolojik inceleme ve spesifik hücre boyama için retina ekstraksiyonu sürecinde, göz küresi izole edildikten sonra, lens ve vitreus sıyırma işlemi sırasında, gözden destek kaybı nedeniyle göz küresi duvarı çökecektir, bu da retina sıyrılmasına neden olmak kolaydır. Bu nedenle, işlemin hızlı, nazik ve uygun güçte olması ve operatörün sık sık pratik yapması gerekir. Bu nedenle, geleneksel tıbbın RP'ye karşı koruyucu etkisi ve mekanizması üzerine yapılan araştırmaları daha fazla teşvik etmek için retina örnekleme prosedürlerimizin hala iyileştirilmesi gerekmektedir.
Açıklamalar
Yazarların ifşa edecek hiçbir şeyi yok.
Teşekkürler
Bu çalışma, Ningxia Yüksek Öğretim Departmanı (NYG2022029) Bilimsel Araştırma Projesi tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Amersham Imager | GE | 680 | |
| Ammonium persulfate | Boster Biological Technology Co.,Ltd | A8090 | |
| Analytical Balance | Mettler Toledo | ME104E | |
| BCA protein quantization kit | Ken Gen Biotech. Co. Ltd | KGP902 | |
| cleaved caspase-3 antibody | Cell Signaling Technology | #9664 | |
| cleaved caspase-7 antibody | Cell Signaling Technology | #8438 | |
| cleaved caspase-9 antibody | Cell Signaling Technology | #9507 | |
| DeadEnd Fluorometric TUNEL System | Promega | G3250 | |
| Glycine | Boster Biological Technology Co.,Ltd | AR1200 | |
| Goat Anti-Rabbit IgG H&L (HRP) | Bioss Antibodies | bs-80295G-HRP | |
| Goat serum | Biosharp | BL210A | |
| High speed crusher | Thermo Fisher Scientific | AG22331 | |
| Immobilon-P SQ Transfer membranes | Merck Millipore. Ltd | ISEQ00010 | |
| Isoflurane | RWD Life Science | R510-22-10 | |
| Methanol | Chengdu Kelong Chemical Co., Ltd | 20230108 | |
| Microplate Reader | Thermo Fisher Scientific | 1510 | |
| Microscope | Olympus | IX73 | |
| Microscope slide | Citotest Labware Manufacturing Co., Ltd | 7105P-G | |
| Mini-PROTEAN Tetra | BIO-RAD | 1658001 | |
| N-Methyl-N-Nitrosourea | sigma-Aldrich | N4766–100G | |
| Oven | Shanghai Yuejin Medical Equipment Co., Ltd | DHG-8145 | |
| Page Pre-solution (30% ) | Doublehelix Biology Science and Technology Co.,Ltd | L3202A | |
| PageRuler Prestained Protein Ladder | Thermo Fisher Scientific | 26617 | |
| PBS buffer | Biosharp | G4202 | |
| SDS-PAGE Protein loading buffer (5×) | Beyotime Biotechnology | P0015 | |
| Skim milk powder | BioFroxx | 1172GR500 | |
| Sprague Dawley rats | Ningxia Medical University | SCXK (Ning) 2020-0001 | |
| TEMED | Boster Biological Technology Co.,Ltd | AR1165 | |
| Total protein extraction kit | Ken Gen Biotech. Co. Ltd | KGP2100 | |
| Trans-Blot Module | BIO-RAD | 1703935 | |
| Tris base | Boster Biological Technology Co.,Ltd | AR1162 | |
| Tweezer | Changde BKMAM Biotechnology Co., Ltd | 130302027 | |
| β-actin | Cell Signaling Technology | #4970 |
Referanslar
- Cehajic-Kapetanovic, J., et al. Association of a novel intronic variant in RPGR with hypomorphic phenotype of X-linked retinitis pigmentosa. JAMA Ophthalmol. 138 (11), 1151-1158 (2020).
- Pan, M. Y., et al. Mice deficient in UXT exhibit retinitis pigmentosa-like features via aberrant autophagy activation. Autophagy. 17 (8), 1873-1888 (2021).
- Xiong, Y. C., et al. 17β-Oestradiol attenuates the photoreceptor apoptosis in mice with retinitis pigmentosa by regulating N-myc downstream regulated gene 2 expression. Neuroscience. 452, 280-294 (2021).
- Zhang, S., et al. Müller cell regulated microglial activation and migration in rats with -Methyl--Nitrosourea-Induced retinal degeneration. Front Neurosci. 14, 606486 (2020).
- Karine, B., et al. Transferrin non-viral gene therapy for treatment of retinal degeneration. Pharmaceutics. 12 (9), 836 (2020).
- Yan, W. M., et al. Protection of retinal function and morphology in MNU-induced retinitis pigmentosa rats by ALDH2: an in-vivo study. BMC Ophthalmol. 20 (1), 55 (2020).
- Zhu, Y. F., et al. Lycium barbarum polysaccharides attenuates N-methy-N-nitrosourea-induced photoreceptor cell apoptosis in rats through regulation of poly (ADP-ribose) polymerase and caspase expression. J Ethnopharmacol. 191, 125-134 (2016).
- He, S. Q., et al. Effects and mechanisms of water-soluble Semen cassiae polysaccharide on retinitis pigmentosa in rats. Food Sci Technol. 40 (1), 84-88 (2020).
- Chen, Q., Cheng, Z. H., Hu, B. J. Current situation of vitreous and retinal related tissue specimens collection and application. Chinese J Ocular Fundus Dis. 36 (5), 396-399 (2020).
- Zhang, Y., et al. Salidroside modulates repolarization through stimulating Kv2.1 in rats. Eur J Pharmacol. 977, 176741 (2024).
- Deng, F. Y., Han, M. Y., Deng, T. T., Jin, M. Research progress of gene therapy for retinitis pigmentosa. Int Eye Sci. 21 (7), 1205-1208 (2021).
- Lin, B., Youdim, M. B. H. The protective, rescue and therapeutic potential of multi-target iron-chelators for retinitis pigmentosa. Free Radic Biol Med. 174, 1-11 (2021).
- Carullo, G., et al. Retinitis pigmentosa and retinal degenerations: deciphering pathways and targets for drug discovery and development. ACS Chem Neurosci. 11 (15), 2173-2191 (2020).
- Zhang, Z. J., et al. Quantification of microvascular change of retinal degeneration in Royal College of Surgeons rats using high-resolution spectral domain optical coherence tomography angiography. J Biomed Opt. 28 (10), 106001 (2023).
- Loiseau, A., Raîche-Marcoux, G., Maranda, C., Bertrand, N., Boisselier, E. Animal models in eye research: focus on corneal pathologies. Int J Mol Sci. 24 (23), 16661 (2023).
- Gregory-Evans, K. A review of diseases of the retina for neurologists. Handb Clin Neurol. 178, 1-11 (2021).
- Li, X. M., et al. Targeting long noncoding RNA-AQP4-AS1 for the treatment of retinal neurovascular dysfunction in diabetes mellitus. EBioMedicine. 77, 103857 (2022).
- Lee, D., et al. Retinal degeneration induced in a mouse model of ischemia-reperfusion injury and its management by pemafibrate treatment. FASEB J. 36 (9), e22497 (2022).
- Zhang, Q. L., Zhao, N., Li, Z. J. Effects of salidroside on retinopathy in diabetic rats based on COX-2/PGE2/VEGF pathway. J China Medical Uni. 52 (8), 731-935 (2023).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır