Method Article
Échantillonnage des lésions rétiniennes induites par le N-méthyl-N-nitrosourea chez le rat et évaluation multi-indices des changements pathologiques
Dans cet article
Résumé
Ce protocole décrit une procédure d’échantillonnage de la rétine chez le rat et l’utilisation de la coloration à l’hématoxyline-éosine, du dosage TUNEL et du transfert Western pour détecter les changements pathologiques et l’apoptose dans la rétine après l’injection intrapéritonéale de N-méthyl-N-nitrosourea.
Résumé
La rétinopathie peut être observée dans la plupart des maladies oculaires et les complications tardives du diabète sucré. Les cellules épithéliales pigmentaires spécifiques et les dommages et la dégénérescence des cellules optiques sont les principales caractéristiques de la rétinopathie. De nombreuses médecines traditionnelles ont montré une efficacité clinique substantielle dans le traitement de la rétinopathie. Comment obtenir une rétine rapidement et complètement est une étape clé dans la recherche en médecine traditionnelle pour le traitement de la rétinopathie. Dans cette étude, nous visons à fournir une procédure standardisée et exerçable pour l’échantillonnage des lésions de la rétine induites par la N-méthyl-N-nitrosourée (MNU) chez le rat et l’évaluation multi-indices des changements pathologiques. Des rats ont reçu une injection intrapéritonéale de 60 mg/kg de MNU pour induire des lésions de la rétine, et des échantillons de rétine ont été obtenus après 7 jours. De plus, nous avons effectué une coloration à l’hématoxyline-éosine pour évaluer les changements pathologiques rétiniens. Détermination du taux d’apoptose et de la protéine d’apoptose par TUNEL et Western blot. Ces protocoles normalisés pour l’échantillonnage de la rétine et l’évaluation des changements pathologiques sont utiles pour promouvoir l’exploration du mécanisme de la rétinopathie et la découverte de plantes traditionnelles nouvelles et efficaces.
Introduction
La rétinite pigmentaire (RP) est une maladie rétinienne héréditaire et cécitante1. L’incidence de la RP est comprise entre 1/3500 et 1/5000, affectant la fonction visuelle d’environ 2,5 millions de personnes dans le monde. C’est l’une des maladies les plus connues entraînant une déficience visuelle chez l’être humain, imposant un fardeau important à l’ensemble de la société2. La maladie se caractérise par la perte progressive de la fonction des cellules épithéliales pigmentaires rétiniennes et l’apoptose progressive des photorécepteurs. Au stade précoce, les patients présentent une cécité nocturne, qui se manifeste par des anomalies du champ visuel périphérique et conduit finalement à la perte de la vision centrale3. Par conséquent, l’inhibition de l’apoptose des photorécepteurs rétiniens est le point de repère pour la prévention et le traitement de la RP.
L’apoptose des cellules rétiniennes est une caractéristique commune de la RP humaine et des animaux modèles4. L’injection intrapéritonéale de 60 mg/kg de N-méthyl-N-nitrosourée (MNU) chez le rat pendant 7 jours peut induire l’apoptose et la perte de cellules photoréceptrices rétiniennes, et il s’agit d’un modèle animal couramment utilisé de RP 5,6. L’analyse des changements dans la structure pathologique, l’apoptose cellulaire spécifique et l’expression protéique liée à l’apoptose du tissu rétinien chez les animaux modèles peut fournir des données expérimentales efficaces et un soutien théorique dans l’étude de la pathogenèse de la RP humaine et le dépistage des médicaments 7,8. Par conséquent, la qualité des échantillons rétiniens détermine la fiabilité des données expérimentales. Cependant, en raison de la particularité du tissu oculaire, il existe très peu de rapports sur la façon d’obtenir la rétine du rat9.
Cet article fournit une procédure simple, rapide, standardisée et utilisable pour l’échantillonnage de la rétine chez le rat afin de surmonter les lacunes ci-dessus. La coloration à l’hématoxyline-éosine (HE), la coloration terminale à la désoxyuridine triphosphate-digoxigénine médiée par la désoxyuridine triphosphate-digoxigénine (TUNEL) et la coloration Western blot sont utilisées pour analyser les changements pathologiques dans les lésions tissulaires rétiniennes et l’apoptose chez les rats. Toutes les méthodes sont dérivées de l’expérience de notre groupe de recherche avec les processus opérationnels spécifiques.
Protocole
Tous les protocoles et procédures chirurgicales ont été approuvés par le Comité d’éthique de l’Université de médecine du Ningxia (numéro d’éthique : N° 2020-Q066). Des rats mâles SPF Sprauge-Dawley (SD), âgés de 7 à 8 semaines et pesant de 200 à 220 g, ont été achetés à l’Université de médecine du Ningxia avec le numéro d’homologation d’animal SCXK (Ning) 2020-0001. Tous les animaux ont été élevés dans le Centre des animaux de laboratoire de l’Université de médecine du Ningxia. La température et l’humidité étaient appropriées, le cycle de lumière jour-nuit était maintenu et la nourriture et l’eau étaient gratuites et suffisantes.
1. Préparation préopératoire
- Préparation des matériaux
- Préparez des plaques pour rats, des appareils d’anesthésie par inhalation, des boîtes intégrées, des tubes de stockage congelés, des gants et des masques chirurgicaux jetables, des flacons à large ouverture, du paraformaldéhyde à 4 %, des blocs réfrigérants, des ciseaux ophtalmiques, des pinces à épiler ophtalmiques, des lames chirurgicales et des manches de couteau, des tubes de microcentrifugation de 1,5 mL et stérilisez-les à l’avance (voir le tableau des matériaux).
- Préparation des animaux
- Divisez au hasard 20 rats SD mâles en groupe modèle (n = 10) et groupe témoin (n = 10). Injecter chez des rats modèles par voie intrapéritonéale avec 60 mg/kg de MNU et injecter chez des rats témoins par voie intrapéritonéale le même volume de solution saline.
- Après 7 jours d’injection, faites jeûner les rats et laissez-les boire librement la veille de l’échantillonnage.
- Le lendemain, placez le rat en décubitus dorsal sur la table d’opération et utilisez un masque pour administrer une anesthésie à 4 % d’isoflurane et 2 L/min d’oxygène. Mesurez la profondeur de l’anesthésie en pinçant le centre du pied pour observer les réactions des rats.
2. Prélèvement rétinien pour la détection du facteur protéique
- Fixez l’orbite du rat avec la main gauche et retirez l’œil avec une force modérée avec la main droite à l’aide d’une pince à flexion ophtalmique. Placez le globe oculaire en position sagittale dans un plat en verre froid.
- Avec la main gauche tenant une pince à épiler ophtalmique droite pour fixer le globe oculaire et la main droite tenant la lame chirurgicale, faites une incision longitudinale de 2 mm près du site du cristallin.
- Coupez la cornée avec les ciseaux ophtalmiques le long de l’incision et décollez doucement le cristallin, le vitré et exposez l’œilleton.
- Placez le bas de l’œilleton à l’extrémité du tube de microcentrifugation de 1,5 ml, tournez l’œilleton sur le tube et exposez la rétine (la rétine est jaune pâle).
- Retirez toute la rétine le long de la paroi sclérale du globe oculaire à l’aide d’une pince à épiler ophtalmique, puis placez-la dans un tube congelé et rangez-la dans un réservoir d’azote liquide pour une utilisation future (Figure 1).
3. Prélèvement rétinien pour l’examen pathologique et la coloration cellulaire spécifique
- Avec la main gauche, utilisez la pince à épiler pour soulever le coin de l’œil du rat. Avec la main droite, utilisez une lame chirurgicale pour découper une ouverture de 4 mm le long du coin de l’œil du rat.
- Utilisez la pince à épiler pour serrer le bord du globe oculaire au niveau de l’ouverture de la main gauche. Utilisez des ciseaux ophtalmiques pour couper les tissus environnants le long du bord du globe oculaire tout en faisant attention au nettoyage des tissus environnants du globe oculaire.
- Séparez les tissus autour du nerf optique au pôle postérieur du globe oculaire à l’aide d’une pince à épiler, coupez le nerf optique et faites attention à le préserver. Ensuite, retirez le globe oculaire.
- Lavez le globe oculaire retiré dans une solution saline pour éliminer tout sang restant, roulez-le sur du papier filtre pour absorber l’excès d’eau et placez-le sur du papier d’aluminium froid.
- Fixez l’œil avec une pince à épiler ophtalmique. Faites une incision longitudinale de 4 mm le long de la jonction de la cornée et de la rétine à l’aide d’une lame chirurgicale.
- Retirez la cornée avec des ciseaux ophtalmiques, faites une coupe circulaire le long de l’incision et retirez doucement le cristallin et le corps vitré.
- Placez l’œilleton restant avec un nerf optique dans une boîte d’enrobage et fixez-le dans du paraformaldéhyde à 4 %.
- Incorporez des échantillons fixés au paraformaldéhyde dans de la paraffine et coupez-les en tranches de 4 μm pour la coloration HE et la coloration TUNEL7.
4. Coloration HE de la rétine du rat
- Déparaffinage et hydratation : Placez les tranches dans du xylène pendant 10 min, répétez le processus pendant encore 10 min, suivi de l’éthanol absolu pendant 5 min, répétez le traitement à l’éthanol pendant encore 5 min, suivi d’un traitement à 95 % d’alcool pendant 5 min, puis à 85 % d’alcool pendant 5 min, et enfin à 75 % d’alcool pendant 5 min.
- Coloration à l’hématoxyline : Rincer la tranche à l’eau déminéralisée pendant 5 min. Utilisez 100 μL de solution de coloration à l’hématoxyline et colorez pendant 5 min, rincez à l’eau désionisée pendant 5 à 10 s. Ajouter 100 μL d’éthanol à 1 % d’acide chlorhydrique pendant 30 s, rincer à l’eau désionisée pendant 20 min et ajouter 100 μL d’eau ammoniacale à 0,2 % pendant 1 min. Rincer à l’eau déminéralisée pendant 5 min.
- Coloration à l’éosine : Utiliser 100 μL de solution de coloration à l’éosine pour colorer pendant 5 minutes et rincer à l’eau déminéralisée pendant 30 s.
- Déshydratation et scellement : Plongez les tranches dans de l’alcool à 70 % pendant 5 min, puis à 85 % d’alcool pendant 5 min, puis à 90 % d’alcool pendant 5 min et de l’éthanol absolu pendant 5 min. Répétez le traitement à l’éthanol absolu pendant encore 5 minutes, puis immergez-le dans le xylène pendant 5 minutes et répétez le processus pendant encore 5 minutes. Enfin, scellez en ajoutant environ 100 μL de résine neutre à la surface des tranches, puis couvrez-la d’un verre de protection.
- Imagerie des lames : Positionnez les tranches colorées sur le microscope, ajustez la mise au point du microscope jusqu’à ce que l’image soit clairement visible, réglez le grossissement à 400x et capturez l’image.
- Mesurer l’épaisseur totale de la rétine et l’épaisseur externe de la rétine : Mesurez l’épaisseur totale de la rétine et l’épaisseur externe de la rétine (épaisseur de la couche nucléaire externe et de la couche photoréceptrice) et calculez le pourcentage d’épaisseur externe de la rétine
Épaisseur externe de la rétine ( %) = (épaisseur externe de la rétine/épaisseur totale de la rétine) x 100.
5. Détermination du taux d’apoptose des cellules photoréceptrices rétiniennes avec la méthode TUNEL
- Déparaffinage et hydratation : Placez les tranches dans du xylène pendant 10 min, répétez le processus pendant encore 10 min, puis placez-les dans de l’éthanol absolu pendant 5 min, et répétez cette étape pendant encore 5 min. Effectuez la déshydratation en plaçant dans de l’alcool à 95 % pendant 5 min, de l’alcool à 90 % pendant 5 min, de l’alcool à 80 % pendant 5 min, de l’alcool à 70 % pendant 5 min et rincez à l’eau déminéralisée pendant 5 min.
- Rincer avec une solution de chlorure de sodium à 0,85 % pendant 5 min et du PBS pendant 5 min. Fixer avec du paraformaldéhyde en utilisant 4 % de paraformaldéhyde pendant 15 min. Rincez avec du PBS pendant 5 minutes et répétez l’opération pendant 5 minutes supplémentaires.
- Incubation et équilibre7 : Incuber avec une solution de protéinase K de 20 μg/mL pour la digestion pendant 15 min, équilibrer dans le tampon d’équilibre pendant 10 min et incuber avec un tampon de désoxynucléotidyltransférase terminale recombinante (rTdT) à 37 °C pendant 60 min.
- Arrêt de la réaction : Ajouter 100 μL de la solution étalon de citrate (2 solutions SSC) pendant 15 min. Rincez avec du PBS pendant 5 minutes et répétez l’opération pendant 5 minutes supplémentaires.
- Colorant nucléaire : Ajouter 100 μL de réactif 4 ′, 6-diamidine-2-phenindl (DAPI) pendant 5 min. Lavez à l’eau déminéralisée pendant 5 minutes et répétez le processus pendant encore 5 minutes.
- Sceller : Essuyez l’excès de xylène autour des tranches et scellez-les en ajoutant environ 100 μL de résine neutre à la surface des tranches, puis couvrez-la d’un verre de protection.
- Microscopie : placez les tranches colorées sur le microscope, ajustez la mise au point du microscope pour une visibilité claire, réglez le grossissement sur 400x et capturez l’image. Observez la fluorescence verte à 520 ± 20 nm à l’aide d’un filtre de fluorescence standard. Observez le DAPI bleu à 460 nm.
- Calculer le taux d’apoptose : mesurer les valeurs de fluorescence verte et les valeurs de fluorescence bleue de la couche externe du noyau rétinien. Calculer le taux d’apoptose comme suit :
Taux de cellules d’apoptose = valeur de fluorescence verte/valeur de fluorescence bleue x 100.
6. Analyse par transfert Western 10
- Traitement par tampon de lyse : Hacher et homogénéiser une rétine congelée avec 50 μL de tampon de lyse à froid (1 mL de tampon de lyse contenant 5 μL d’inhibiteur de phosphatase, 1 μL d’inhibiteur de protéase et 5 μL de 100 mM de PMSF).
- Soumis à une sonication de 28 kHz pendant 5 s sur un bain de glace ; Répétez 3 fois. Centrifuger à 4 °C pendant 5 min à 10 000 x g pour éliminer les débris cellulaires. Gardez le surnageant.
- em>6.3Quantification des protéines : Déterminer la concentration en protéines à l’aide d’un kit de réactifs de dosage des protéines BCA.
- em>6.4Électrophorèse : Charger un échantillon de protéines de 50 μg et le séparer par électrophorèse sur gel de polyacrylamide de dodécylsulfate de sodium à 12 % (SDS-PAGE).
- Transfert sur membrane : Transfert électrophorétique sur des membranes PVDF à l’aide d’un système de transfert électrophorétique.
- Subdiviser les membranes : Subdivisez les membranes et analysez chaque protéine d’intérêt, β-actine et GAPDH à partir d’un seul transfert.
- Blocage : Bloquer les membranes pendant 1 h dans du TBST contenant 5 % de lait écrémé à température ambiante.
- Incuber l’anticorps primaire : Incuber avec l’anticorps primaire de la caspase-9 clivée (dilution 1:200), de la caspase-3 clivée (dilution 1:200), de la caspase-7 clivée (dilution 1:200) et de la β-actine (dilution 1:1000) pendant la nuit à 4 °C. Lavez les membranes avec du TBST pendant 5 min, répétez 3 fois.
- Incuber le deuxième anticorps : Incuber avec des anticorps secondaires conjugués à la peroxydase de raifort (1:2000) pendant 2 h à température ambiante. Lavez les membranes avec du TBST pendant 5 min, répétez 3 fois.
- Exposition : Visualisez les protéines marquées à l’aide du substrat Western blot, et enfin, exposez les membranes pour visualiser les bandes protéiques en mode d’exposition automatique.
- Calculez la teneur en protéines7 en mesurant la densité de la bande protéique.
7. Analyse statistique
- Analysez les données à l’aide du logiciel SPSS 19.0 et présentez-les sous forme de moyenne ± d’écart-type. Effectuez des analyses statistiques des valeurs observées à l’aide de l’analyse de variance à un facteur. Prenons p< 0,05 comme statistiquement significatif.
Résultats
Après la coloration HE, toutes les couches rétiniennes des rats du groupe témoin avaient une structure tissulaire claire, une disposition ordonnée des cellules et une coloration uniforme, tandis que la structure rétinienne des rats du groupe modèle a été considérablement endommagée, la couche rétinienne externe était plus mince, la couche nucléaire externe était presque complètement intégrée à la couche centrale interne, la disposition des cellules dans la couche était extrêmement désordonnée. Le nombre de couches cellulaires a été considérablement réduit, et l’épaisseur de la couche cellulaire photosensible et de la couche nucléaire externe était nettement plus mince. L’épaisseur de la couche rétinienne externe dans le groupe témoin et le groupe modèle était de 48 % et 23 %, respectivement (p < 0,01 ; Figure 2).
La méthode TUNEL a montré qu’aucune cellule apoptotique n’a été détectée dans le groupe témoin, mais qu’il y avait des cellules apoptotiques dans la couche nucléaire externe des rats du groupe modèle (p < 0,01), et que le rapport TUNEL-positif était de 9,6 % (Figure 3).
La famille des protéines caspases est l’une des principales familles qui exécutent l’apoptose. Parmi eux, la caspase clivée 3, la caspase clivée 7 et la caspase clivée 9 sont des indicateurs classiques utilisés pour évaluer l’apoptose cellulaire7. Les résultats de l’étude Western blot ont montré que, par rapport au groupe témoin, l’expression de la caspase clivée 3, de la caspase clivée 7 et de la caspase clivée 9 dans la rétine du groupe modèle était significativement augmentée (p<0,01 ; Figure 4). Cela indique que le MNU peut clairement provoquer l’apoptose cellulaire dans la rétine.

Figure 1 : Le flux de travail expérimental. Après injection intrapéritonéale de MNU pendant 7 jours (7j), la rétine de rats anesthésiés a été obtenue pour la coloration HE et TUNEL. Abréviations : MNU = N-méthyl-N-nitrosourea ; HE = hématoxyline-éosine ; TUNEL = marquage terminal de la désoxyuridine triphosphate-digoxigénine médiée par la désoxynucléotidyltransférase. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Images représentatives de la coloration histopathologique de l’HE le jour 7 après l’injection de MNU. (A) Coloration de l’HE 7 jours (7j) après l’administration de la MNU. (B) Rapport rétinien externe. Les données sont présentées sous forme de moyenne ± ET (n = 6). Des analyses statistiques des valeurs observées ont été effectuées à l’aide d’une analyse unidirectionnelle de la variance. ** P < 0,01 vs contrôle. Abréviations : GCL = couche de cellules ganglionnaires ; IPL = couche plexiforme interne ; INL = la couche du noyau ; OPL = couche plexiforme externe ; ONL = couche nucléaire externe ; PRL = couche photoréceptrice ; MNU = N-méthyl-N-nitrosourea ; HE = hématoxyline-éosine. n = 6. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3 : Le test TUNEL montre l’apoptose des photorécepteurs induite par le MNU chez le rat. (A) À 7 jours (7j) après l’injection du MNU, des cellules positives au NTEL (vert) ont été présentées dans l’ONL chez les rats traités au MNU. (B) Rapport TUNEL-positif. Les données sont présentées sous forme de moyenne ± ET (n = 6). Des analyses statistiques des valeurs observées ont été effectuées à l’aide d’une analyse unidirectionnelle de la variance. ** P < 0,01 vs contrôle. Abréviations : GCL = couche de cellules ganglionnaires ; IPL = couche plexiforme interne ; INL = la couche du noyau ; OPL = couche plexiforme externe ; ONL = couche nucléaire externe ; PRL = couche photoréceptrice ; MNU = N-méthyl-N-nitrosourea ; TUNEL = marquage terminal de la désoxyuridine triphosphate-digoxigénine médiée par la désoxynucléotidyltransférase. n = 6. Veuillez cliquer ici pour voir une version agrandie de cette figure.
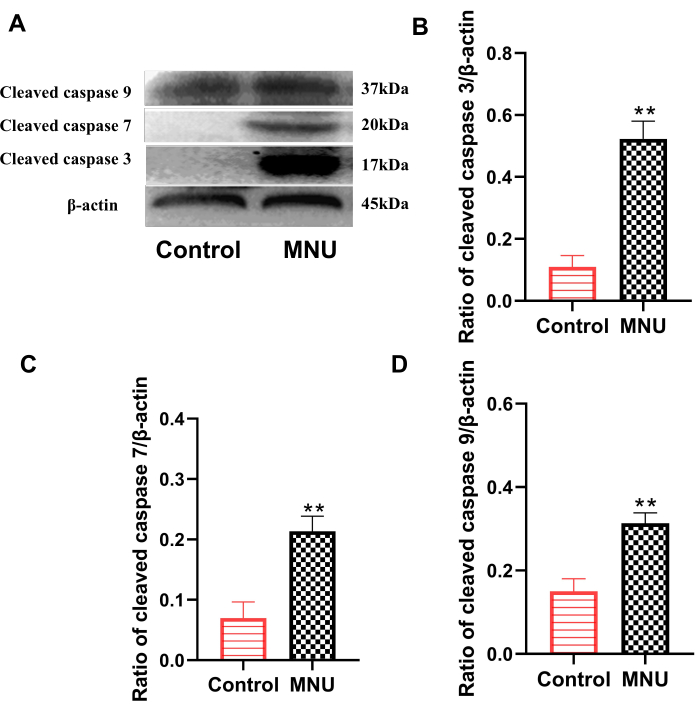
Figure 4 : Expression de la caspase clivée 3, de la caspase clivée 7 et de la caspase 9 clivée dans les rétines de rat au jour 7 après l’injection de MNU. (A) Données représentatives de l’expression de la caspase clivée. (B) Rapport de caspase clivée 3/β-actine. (C) Rapport de caspase clivée 7/β-actine. (D) Rapport de caspase clivée 9/β-actine. Les données sont présentées sous forme de moyenne ± ET (n = 6). Des analyses statistiques des valeurs observées ont été effectuées à l’aide d’une analyse unidirectionnelle de la variance. ** P < 0,01 vs contrôle. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
La RP est une maladie rétinienne courante dans les cliniques. L’apparition, la gravité et la progression de la RP sont liées aux gènes et aux modes génétiques et sont affectées par l’environnement 8,11. La RP comprend la RP familiale et la RP occasionnelle, dont la RP familiale représente environ 60 % des patients. En retraçant les antécédents génétiques familiaux, 83 gènes liés à la RP ont été identifiés jusqu’à présent, tandis que la RP occasionnelle représente environ 40 %, ce qui signifie que ce type de patient n’a pas d’antécédents familiaux et a un modèle génétique irrégulier2. Bien que l’apoptose des cellules photoréceptrices rétiniennes, provoquant la perte de la fonction visuelle chez les patients atteints de RP, soit une reconnaissance générale, le mécanisme sous-jacent de la mort des photorécepteurs dans la RP reste incertain 12,13,14. En raison de l’accès limité au tissu rétinien humain, qui est principalement obtenu lors de la vitrectomie, l’extraction de tissu rétinien à partir d’animaux modèles est encore une méthode courante dans la recherche fondamentale de RP14,15.
La rétine est une membrane transparente située dans la couche interne du bulbe de l’œil, avec la cavité vitrée à l’intérieur et la membrane choroïde près de l’extérieur. La rétine commence à partir du bord dentelé à l’avant et se termine au niveau du disque optique à l’arrière. C’est la partie initiale de la formation de la vision16. Les échantillons rétiniens d’animaux modèles sont principalement utilisés pour l’analyse PCR rétinienne, la détection par transfert Western, l’observation de la structure pathologique des tissus, la coloration immunohistochimique, l’examen par immunofluorescence, l’évaluation de la densité microvasculaire, l’isolement cellulaire et la culture, etc.17,18. Les exigences de l’échantillonnage rétinien pour différents indices de test sont différentes. L’échantillonnage rétinien pour la détection du facteur protéique chez les animaux modèles et l’échantillonnage rétinien pour les coupes enrobées de paraffine sont des techniques opérationnelles courantes pour le dépistage de la RP8. Cependant, en raison de la structure très fine et complexe du globe oculaire de l’animal modèle, le processus d’élimination des tissus interférents dans l’œil et d’obtention d’échantillons rétiniens est compliqué. Au cours du processus d’échantillonnage, il peut y avoir une perte de tissu rétinien, une contamination, une dégradation des protéines et un décollement de la rétine. Ces facteurs auront un impact sur la qualité et la quantité de l’extraction des protéines rétiniennes, ainsi que sur l’effet de la coloration en coupe et les résultats de détection des indicateurs expérimentaux. Par conséquent, une procédure de prélèvement rétinien appropriée est nécessaire.
Il est essentiel de simplifier le complexe et de saisir le maillon clé de la récolte afin d’améliorer la technique de récolte rétinienne chez les animaux modèles. L’exposition rapide de la rétine et l’ablation complète de la rétine dans la mesure du possible sont les étapes clés de l’échantillonnage rétinien pour la détection du facteur protéique chez le rat modèle. Dans cette étude, les globes oculaires ont été extraits directement après l’anesthésie pour économiser le temps d’échantillonnage. Une astuce pour exposer la rétine consiste à tourner l’œilleton sur un tube de 1,5 ml, ce qui était rentable et pratique et pouvait complètement décoller la rétine de la paroi sclérale. Cette procédure d’opération est simple, rapide, économique et propice à la pratique expérimentale de l’utilisation du personnel, de sorte qu’elle peut être réalisée en 5 min. Dans le processus d’échantillonnage de la rétine pour l’examen pathologique et la coloration cellulaire spécifique, le maintien de la fraîcheur et de l’intégrité structurelle de la rétine est une étape clé pour obtenir une coloration de haute qualité. La perfusion avec du formaldéhyde à partir de l’oreillette gauche, puis obtenir la rétine est l’une des méthodes que les chercheurs utilisent souvent, mais cela prend du temps, et le formaldéhyde sent mauvais et apporte de l’inconfort à l’opérateur. Dans cette étude, le tissu autour du globe oculaire est séparé en un anneau après l’anesthésie pour maintenir son intégrité. Une fois que le nerf optique a été coupé et conservé, séparez le tissu qui l’entoure au pôle postérieur du globe oculaire et retirez le globe oculaire. Différentes parties du globe oculaire ont été localisées avec précision avec le nerf optique. Enfin, avec le soutien du contenu de l’œil, l’incision a été pratiquée, la cornée a été coupée en anneau, le cristallin et le vitré ont été décollés et l’œilleton reliant le nerf optique a été obtenu (la rétine est située sur la paroi sclérale à l’intérieur de l’œilleton). Dans ce processus, l’opération doit être douce pour maintenir l’intégrité de la rétine. La procédure d’opération améliore non seulement considérablement la vitesse de collecte des matériaux, mais elle peut également maintenir la structure et la forme normales complètes du globe oculaire et peut être localisée avec précision dans les différentes parties du globe oculaire après avoir retiré le globe oculaire. Après une opération habile, l’opération peut être terminée en 8 min. En utilisant les méthodes d’échantillonnage rétinien ci-dessus, notre groupe de recherche a obtenu des résultats de détection du facteur protéique, des résultats de coloration HE et des résultats de coloration TUNEL relativement idéaux.
Bien que la méthode actuelle de prélèvement de la rétine présente certains avantages, elle doit encore être améliorée. Dans le processus d’échantillonnage rétinien pour la détection du facteur protéique, après l’exposition de la rétine, il existe également un risque de dissection rétinienne incomplète ou de perte lors de la prise de la rétine en pliant la pince à épiler en raison du point de support limité de la pince à épiler. Par conséquent, il est nécessaire d’améliorer les outils de dissection rétinienne. D’autre part, dans le processus d’extraction rétinienne pour l’examen pathologique et la coloration cellulaire spécifique, après avoir isolé le globe oculaire, pendant le processus de stripping du cristallin et du vitré, la paroi du globe oculaire s’effondrera en raison de la perte de soutien de l’œil, ce qui est facile à provoquer un stripping rétinien. Ainsi, l’opération doit être rapide, douce et d’une force appropriée, et l’opérateur doit s’entraîner fréquemment. Par conséquent, nos procédures de prélèvement rétinien doivent encore être améliorées afin de promouvoir davantage la recherche sur l’effet protecteur et le mécanisme de la médecine traditionnelle contre la RP.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Ce travail a été soutenu par le Projet de Recherche Scientifique du Département de l’Enseignement Supérieur du Ningxia (NYG2022029).
matériels
| Name | Company | Catalog Number | Comments |
| Amersham Imager | GE | 680 | |
| Ammonium persulfate | Boster Biological Technology Co.,Ltd | A8090 | |
| Analytical Balance | Mettler Toledo | ME104E | |
| BCA protein quantization kit | Ken Gen Biotech. Co. Ltd | KGP902 | |
| cleaved caspase-3 antibody | Cell Signaling Technology | #9664 | |
| cleaved caspase-7 antibody | Cell Signaling Technology | #8438 | |
| cleaved caspase-9 antibody | Cell Signaling Technology | #9507 | |
| DeadEnd Fluorometric TUNEL System | Promega | G3250 | |
| Glycine | Boster Biological Technology Co.,Ltd | AR1200 | |
| Goat Anti-Rabbit IgG H&L (HRP) | Bioss Antibodies | bs-80295G-HRP | |
| Goat serum | Biosharp | BL210A | |
| High speed crusher | Thermo Fisher Scientific | AG22331 | |
| Immobilon-P SQ Transfer membranes | Merck Millipore. Ltd | ISEQ00010 | |
| Isoflurane | RWD Life Science | R510-22-10 | |
| Methanol | Chengdu Kelong Chemical Co., Ltd | 20230108 | |
| Microplate Reader | Thermo Fisher Scientific | 1510 | |
| Microscope | Olympus | IX73 | |
| Microscope slide | Citotest Labware Manufacturing Co., Ltd | 7105P-G | |
| Mini-PROTEAN Tetra | BIO-RAD | 1658001 | |
| N-Methyl-N-Nitrosourea | sigma-Aldrich | N4766–100G | |
| Oven | Shanghai Yuejin Medical Equipment Co., Ltd | DHG-8145 | |
| Page Pre-solution (30% ) | Doublehelix Biology Science and Technology Co.,Ltd | L3202A | |
| PageRuler Prestained Protein Ladder | Thermo Fisher Scientific | 26617 | |
| PBS buffer | Biosharp | G4202 | |
| SDS-PAGE Protein loading buffer (5×) | Beyotime Biotechnology | P0015 | |
| Skim milk powder | BioFroxx | 1172GR500 | |
| Sprague Dawley rats | Ningxia Medical University | SCXK (Ning) 2020-0001 | |
| TEMED | Boster Biological Technology Co.,Ltd | AR1165 | |
| Total protein extraction kit | Ken Gen Biotech. Co. Ltd | KGP2100 | |
| Trans-Blot Module | BIO-RAD | 1703935 | |
| Tris base | Boster Biological Technology Co.,Ltd | AR1162 | |
| Tweezer | Changde BKMAM Biotechnology Co., Ltd | 130302027 | |
| β-actin | Cell Signaling Technology | #4970 |
Références
- Cehajic-Kapetanovic, J., et al. Association of a novel intronic variant in RPGR with hypomorphic phenotype of X-linked retinitis pigmentosa. JAMA Ophthalmol. 138 (11), 1151-1158 (2020).
- Pan, M. Y., et al. Mice deficient in UXT exhibit retinitis pigmentosa-like features via aberrant autophagy activation. Autophagy. 17 (8), 1873-1888 (2021).
- Xiong, Y. C., et al. 17β-Oestradiol attenuates the photoreceptor apoptosis in mice with retinitis pigmentosa by regulating N-myc downstream regulated gene 2 expression. Neuroscience. 452, 280-294 (2021).
- Zhang, S., et al. Müller cell regulated microglial activation and migration in rats with -Methyl--Nitrosourea-Induced retinal degeneration. Front Neurosci. 14, 606486 (2020).
- Karine, B., et al. Transferrin non-viral gene therapy for treatment of retinal degeneration. Pharmaceutics. 12 (9), 836 (2020).
- Yan, W. M., et al. Protection of retinal function and morphology in MNU-induced retinitis pigmentosa rats by ALDH2: an in-vivo study. BMC Ophthalmol. 20 (1), 55 (2020).
- Zhu, Y. F., et al. Lycium barbarum polysaccharides attenuates N-methy-N-nitrosourea-induced photoreceptor cell apoptosis in rats through regulation of poly (ADP-ribose) polymerase and caspase expression. J Ethnopharmacol. 191, 125-134 (2016).
- He, S. Q., et al. Effects and mechanisms of water-soluble Semen cassiae polysaccharide on retinitis pigmentosa in rats. Food Sci Technol. 40 (1), 84-88 (2020).
- Chen, Q., Cheng, Z. H., Hu, B. J. Current situation of vitreous and retinal related tissue specimens collection and application. Chinese J Ocular Fundus Dis. 36 (5), 396-399 (2020).
- Zhang, Y., et al. Salidroside modulates repolarization through stimulating Kv2.1 in rats. Eur J Pharmacol. 977, 176741 (2024).
- Deng, F. Y., Han, M. Y., Deng, T. T., Jin, M. Research progress of gene therapy for retinitis pigmentosa. Int Eye Sci. 21 (7), 1205-1208 (2021).
- Lin, B., Youdim, M. B. H. The protective, rescue and therapeutic potential of multi-target iron-chelators for retinitis pigmentosa. Free Radic Biol Med. 174, 1-11 (2021).
- Carullo, G., et al. Retinitis pigmentosa and retinal degenerations: deciphering pathways and targets for drug discovery and development. ACS Chem Neurosci. 11 (15), 2173-2191 (2020).
- Zhang, Z. J., et al. Quantification of microvascular change of retinal degeneration in Royal College of Surgeons rats using high-resolution spectral domain optical coherence tomography angiography. J Biomed Opt. 28 (10), 106001 (2023).
- Loiseau, A., Raîche-Marcoux, G., Maranda, C., Bertrand, N., Boisselier, E. Animal models in eye research: focus on corneal pathologies. Int J Mol Sci. 24 (23), 16661 (2023).
- Gregory-Evans, K. A review of diseases of the retina for neurologists. Handb Clin Neurol. 178, 1-11 (2021).
- Li, X. M., et al. Targeting long noncoding RNA-AQP4-AS1 for the treatment of retinal neurovascular dysfunction in diabetes mellitus. EBioMedicine. 77, 103857 (2022).
- Lee, D., et al. Retinal degeneration induced in a mouse model of ischemia-reperfusion injury and its management by pemafibrate treatment. FASEB J. 36 (9), e22497 (2022).
- Zhang, Q. L., Zhao, N., Li, Z. J. Effects of salidroside on retinopathy in diabetic rats based on COX-2/PGE2/VEGF pathway. J China Medical Uni. 52 (8), 731-935 (2023).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon