Method Article
N-甲基-N-亚硝基脲诱导大鼠视网膜损伤采样及病理变化多指标评价
摘要
该方案描述了大鼠视网膜取样的程序,并利用苏木精-伊红染色、TUNEL 测定和 Western blot 来检测腹膜内注射 N-甲基-N-亚硝基脲后视网膜的病理变化和细胞凋亡。
摘要
视网膜病变可见于大多数眼部疾病和糖尿病的晚期并发症。特异性色素上皮细胞和视细胞的损伤和变性是视网膜病变的主要特征。许多传统药物在治疗视网膜病变方面显示出巨大的临床疗效。如何快速、完整地获得视网膜是治疗视网膜病变的传统医学研究中的关键步骤。在这项研究中,我们旨在为 N-甲基-N-亚硝基脲 (MNU) 诱导的大鼠视网膜损伤采样和病理变化的多指标评估提供一种标准化且可执行的程序。大鼠腹膜内注射 60 mg/kg MNU 1 次,诱导视网膜损伤,7 天后获得视网膜标本。此外,我们进行了苏木精-伊红染色以评估视网膜病理变化。通过 TUNEL 和 Western blot 测定细胞凋亡率和细胞凋亡蛋白。这些用于视网膜取样和病理变化评估的标准化方案有助于促进视网膜病变机制的探索和新型有效传统草药的发现。
引言
视网膜色素变性 (RP) 是一种遗传性和致盲性视网膜疾病1。RP 的发病率在 1/3500 到 1/5000 之间,影响全球约 250 万人的视觉功能。它是导致人类视力障碍的最知名疾病之一,给整个社会带来了沉重的负担2。该病的特征是视网膜色素上皮细胞功能逐渐丧失和光感受器进行性凋亡。在早期,患者会出现夜盲症,表现为周边视野缺损,最终导致中央视力丧失3。因此,抑制视网膜光感受器凋亡是预防和治疗 RP 的重点。
视网膜细胞凋亡是人类 RP 和模式动物的常见特征4。大鼠腹腔注射 60 mg/kg N-甲基-N-亚硝基脲 (MNU) 7 天可诱导视网膜感光细胞凋亡和丢失,是 RP 5,6 常用的动物模型。分析模型动物病理结构、特异性细胞凋亡和视网膜组织凋亡相关蛋白表达的变化,可为研究人 RP 的发病机制和筛选药物提供有效的实验数据和理论支持7,8。因此,视网膜标本的质量决定了实验数据的可靠性。然而,由于眼组织的特殊性,关于如何获得大鼠视网膜9 的报道很少。
本文为克服上述缺点,为大鼠视网膜取样提供了一种简单、快速、标准化、可作的程序。苏木精-伊红染色 (HE)、末端脱氧核苷酸转移酶介导的三磷酸脱氧尿嘧啶-地高辛缺口末端标记 (TUNEL) 染色和 Western blot 分析大鼠视网膜组织损伤和细胞凋亡的病理变化。所有方法均源自我们研究小组在特定作流程方面的经验。
研究方案
所有方案和外科手术均经宁夏医科大学伦理委员会批准(伦理编号:NO. 2020-Q066)。SPF Sprauge-Dawley (SD) 雄性大鼠,年龄 7-8 周龄,体重 200-220 g,购自宁夏医科大学,动物许可证号为 SCXK(宁)2020-0001。所有动物均在宁夏医科大学实验动物中心饲养。温度和湿度适宜,保持了昼夜光照循环,食物和水免费充足。
1. 术前准备
- 材料准备
- 准备大鼠板、吸入麻醉装置、嵌入式盒子、冷冻储存管、一次性手术手套和口罩、广口瓶、4% 多聚甲醛、冰袋、眼科剪刀、眼科镊子、手术刀片和刀柄、1.5 mL 微量离心管并提前消毒(见 材料表)。
- 动物准备
- 将 20 只雄性 SD 大鼠随机分为模型组 (n=10) 和对照组 (n=10)。用 60 mg/kg MNU 腹膜内注射模型大鼠,用相同体积的生理盐水腹膜内注射对照大鼠。
- 注射 7 天后,让大鼠禁食,让它们在采样前一晚自由饮水。
- 第二天,将大鼠仰卧在手术台上,并使用面罩使用 4% 异氟醚和 2 L/min 氧气进行麻醉。通过捏住脚的中心来测量麻醉深度,以观察大鼠的反应。
2. 用于蛋白质因子检测的视网膜采样
- 用左手固定大鼠的眼窝,用右手用眼科弯曲镊子适度用力取出眼睛。将眼球置于冷玻璃盘中的矢状位置。
- 左手拿着眼科直镊子固定眼球,右手拿着手术刀片,在晶状体部位附近做一个 2 毫米的纵向切口。
- 用眼科剪刀沿切口切掉角膜,轻轻剥去晶状体、玻璃体,露出眼罩。
- 将眼杯底部放在 1.5 mL 微量离心管的尖端,将眼杯翻转到管上,露出视网膜(视网膜呈淡黄色)。
- 用眼科弯曲镊子沿眼球巩膜壁去除整个视网膜,然后将其放入冷冻管中并储存在液氮罐中以备将来使用(图 1)。
3. 用于病理检查和特异性细胞染色的视网膜取样
- 用左手,用眼镊提起大鼠的眼角。用右手,用手术刀片沿着大鼠的眼角切一个 4 毫米的开口。
- 用镊子夹住左手眼球开口处的眼球边缘。用眼用剪刀沿眼球边缘剪掉周围组织,同时注意清洁眼球周围组织。
- 用镊子将眼球后极视神经周围的组织分开,切断视神经,注意保存。然后,取出眼球。
- 用生理盐水清洗取出的眼球以去除任何残留的血液,将其滚动在滤纸上以吸收多余的水分,然后将其放在冷锡箔上。
- 用眼用镊子固定眼睛。用手术刀片沿着角膜和视网膜的交界处做一个 4 毫米的纵向切口。
- 用眼科剪刀去除角膜,沿着切口做一个圆周切割,轻轻去除晶状体和玻璃体。
- 将剩余的带有视神经的眼罩放入包埋盒中,并将其固定在 4% 多聚甲醛中。
- 将多聚甲醛固定的样品包埋在石蜡中,并切成 4 μm 切片用于 HE 染色和 TUNEL 染色7。
4. 大鼠视网膜 HE 染色
- 脱蜡和水合:将切片放入二甲苯中 10 分钟,再重复该过程 10 分钟,然后用无水乙醇处理 5 分钟,再重复乙醇处理 5 分钟,然后在 95% 酒精中处理 5 分钟,然后在 85% 酒精中处理 5 分钟,最后在 75% 酒精中处理 5 分钟。
- 苏木精染色:用去离子水冲洗切片 5 分钟。使用 100 μL 苏木精染色液染色 5 分钟,用去离子水冲洗 5-10 秒。加入 100 μL 1% 盐酸乙醇 30 秒,用去离子水冲洗 20 分钟,然后加入 100 μL 0.2% 氨水 1 分钟。用去离子水冲洗 5 分钟。
- 伊红染色:使用 100 μL 伊红染色液染色 5 分钟,然后用去离子水冲洗 30 秒。
- 脱水和密封:将切片浸入 70% 酒精中 5 分钟,然后浸入 85% 酒精中 5 分钟,然后浸入 90% 酒精中 5 分钟,然后浸入无水乙醇中 5 分钟。重复无水乙醇处理 5 分钟,然后浸入二甲苯中 5 分钟,再重复该过程 5 分钟。最后,通过在切片表面添加大约 100 μL 的中性树脂进行密封,然后用盖玻片覆盖。
- 玻片成像:将染色的切片放在显微镜上,调整显微镜的焦距直到图像清晰可见,将放大倍率设置为 400 倍,然后捕获图像。
- 测量视网膜总厚度和视网膜外层厚度:测量视网膜总厚度和视网膜外层厚度(外核层和感光层的厚度),并计算视网膜外层厚度百分比
视网膜外层厚度 (%) =(视网膜外层厚度/视网膜总厚度)x 100。
5. 用 TUNEL 法测定视网膜感光细胞凋亡率
- 脱蜡和水合:将切片放入二甲苯中 10 分钟,再重复该过程 10 分钟,然后放入无水乙醇中 5 分钟,再重复此步骤 5 分钟。将 95% 酒精放入 5 分钟、90% 酒精 5 分钟、80% 酒精 5 分钟、70% 酒精 5 分钟,然后用去离子水冲洗 5 分钟,进行脱水。
- 用 0.85% 氯化钠溶液冲洗 5 分钟,用 PBS 冲洗 5 分钟。使用 4% 多聚甲醛用多聚甲醛固定 15 分钟。用 PBS 冲洗 5 分钟,然后重复该过程 5 分钟。
- 孵育和平衡7:与 20 μg/mL 蛋白酶 K 溶液一起孵育消化 15 分钟,在平衡缓冲液中平衡 10 分钟,并与重组末端脱氧核苷酸转移酶 (rTdT) 缓冲液在 37 °C 下孵育 60 分钟。
- 终止反应:加入 100 μL 标准柠檬酸盐溶液(2x SSC 溶液),持续 15 分钟。用 PBS 冲洗 5 分钟,然后重复该过程 5 分钟。
- 细胞核染料:加入 100 μL 4 ′,6-二脒-2-苯吼 (DAPI) 试剂 5 分钟。用去离子水洗涤 5 分钟,然后重复该过程 5 分钟。
- 密封:擦去切片周围多余的二甲苯,并在切片表面加入约 100 μL 的中性树脂进行密封,然后用盖玻片盖住。
- 显微镜检查:将染色的切片放在显微镜上,调整显微镜的焦距以获得清晰的可见度,将放大倍率设置为 400 倍,然后捕获图像。使用标准荧光滤光片观察 520 ± 20 nm 处的绿色荧光。观察 460 nm 处的蓝色 DAPI。
- 计算细胞凋亡率:测量视网膜外核层的绿色荧光值和蓝色荧光值。计算细胞凋亡率为
细胞凋亡率 = 绿色荧光值/蓝色荧光值 x 100。
6. 蛋白质印迹分析 10
- 裂解缓冲液处理:用 50 μL 冷裂解缓冲液(1 mL 裂解缓冲液,含有 5 μL 磷酸酶抑制剂、1 μL 蛋白酶抑制剂和 5 μL 100 mM PMSF)切碎并匀浆一个冷冻视网膜。
- 在冰浴上进行 28 kHz 超声处理 5 秒;重复 3 次。在 4 °C 下以 10,000 x g 离心 5 分钟以去除细胞碎片。保留上清液。
- em>6.3蛋白质定量:使用 BCA 蛋白质测定试剂盒测定蛋白质浓度。
- em>6.4电泳:上样 50 μg 蛋白质样品,并在 12% 十二烷基硫酸钠聚丙烯酰胺凝胶电泳 (SDS-PAGE) 上分离。
- 转印到膜上:使用电泳转印系统电泳转印到 PVDF 膜上。
- 细分膜:细分膜,并通过单次转移分析每种目标蛋白、β-肌动蛋白和 GAPDH。
- 封闭:在室温下在含有 5% 脱脂牛奶的 TBST 中封闭膜 1 小时。
- 一抗孵育:与裂解的 caspase-9(1:200 稀释)、裂解的 caspase-3(1:200 稀释)、裂解的 caspase-7(1:200 稀释)和 β-肌动蛋白(1:1000 稀释)的一抗在 4 °C 下孵育过夜。 用 TBST 洗涤膜 5 分钟,重复 3 次。
- 孵育二抗:与辣根过氧化物酶偶联的二抗 (1:2000) 在室温下孵育 2 小时。用 TBST 洗涤膜 5 分钟,重复 3 次。
- 曝光:使用 Western 印迹底物可视化标记的蛋白质,最后,曝光膜以在自动曝光模式下可视化蛋白质条带。
- 通过测量蛋白质条带密度来计算蛋白质含量7 。
7. 统计分析
- 使用 SPSS 19.0 软件分析数据,并将其显示为平均值±标准差。使用单因子方差分析对观测值执行统计分析。以 p< 0.05 为统计显著性。
结果
HE染色后,对照组大鼠所有视网膜层组织结构清晰,细胞排列有序,染色均匀,而模型组大鼠视网膜结构明显受损,视网膜外层较薄,外核层几乎与内核层完全融合,层内细胞排列极为紊乱, 细胞层数显著减少,感光细胞层和外核层厚度显著变薄。对照组和模型组视网膜外层的厚度分别为 48% 和 23% (p < 0.01; 图 2)。
TUNEL 方法显示,对照组未检测到凋亡细胞,但模型组大鼠核外层存在一些凋亡细胞 (p < 0.01),TUNEL 阳性比值为 9.6%(图 3)。
caspase 蛋白家族是执行细胞凋亡的主要家族之一。其中,裂解的 caspase 3、cleaved caspase 7 和裂解的 caspase 9 是用于评估细胞凋亡的经典指标7。Western blot 结果显示,与对照组相比,模型组视网膜中裂解的 caspase 3、cleaved caspase 7 和 cleaved caspase 9 的表达显著升高 (p<0.01; 图 4)。这表明 MNU 可明显引起视网膜细胞凋亡。

图 1:实验工作流程。 腹腔注射 MNU 7 天 (7d) 后,获得麻醉大鼠视网膜进行 HE 和 TUNEL 染色。缩写:MNU = N-甲基-N-亚硝基脲;HE = 苏木精-伊红;TUNEL = 末端脱氧核苷酸转移酶介导的三磷酸脱氧尿嘧啶-地高辛缺口末端标记。 请单击此处查看此图的较大版本。

图 2:MNU 注射后第 7 天的代表性组织病理学 HE 染色图像。 (A) MNU 给药后 7 天 (7 d) 的 HE 染色。(B) 外视网膜比值。数据以 SD ±平均值表示 (n=6)。使用单因素方差分析对观测值进行统计分析。** p < 0.01 与对照组相比。缩写:GCL = 神经节细胞层;IPL = 内丛状层;INL = 内核层;OPL = 外丛状层;ONL = 外核层;PRL = 感光层;MNU = N-甲基-N-亚硝基脲;HE = 苏木精-伊红。n = 6。 请单击此处查看此图的较大版本。

图 3:TUNEL 测定显示 MNU 诱导大鼠光感受器凋亡。 (A) 在 MNU 注射后 7 天 (7 d),TUNEL 阳性细胞 (绿色) 出现在 MNU 处理大鼠的 ONL 中。(B) TUNEL 阳性比率。数据以 SD ±平均值表示 (n=6)。使用单因素方差分析对观测值进行统计分析。** p < 0.01 与对照组相比。缩写:GCL = 神经节细胞层;IPL = 内丛状层;INL = 内核层;OPL = 外丛状层;ONL = 外核层;PRL = 感光层;MNU = N-甲基-N-亚硝基脲;TUNEL = 末端脱氧核苷酸转移酶介导的三磷酸脱氧尿嘧啶-地高辛缺口末端标记。n = 6。 请单击此处查看此图的较大版本。
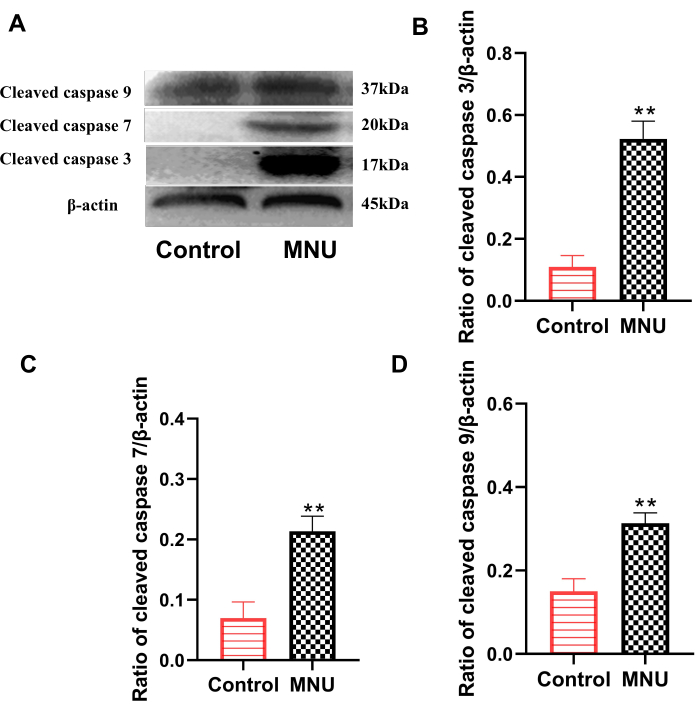
图 4:注射 MNU 后第 7 天大鼠视网膜中裂解的 caspase 3、cleaved caspase 7 和 cleaved caspase 9 的表达。 (A) 裂解的 caspase 表达的代表性数据。(B) 裂解的 caspase 3/β-肌动蛋白的比率。(C) 裂解的半胱天冬酶 7/β-肌动蛋白的比率。(D) 裂解的半胱天冬酶 9/β-肌动蛋白的比率。数据以 SD ±平均值表示 (n=6)。使用单因素方差分析对观测值进行统计分析。** p < 0.01 与对照组相比。 请单击此处查看此图的较大版本。
讨论
RP 是临床上常见的视网膜疾病。RP 的发作、严重程度和进展与基因和遗传模式有关,并受环境影响 8,11。RP 包括家族性 RP 和偶发性 RP,其中家族性 RP 约占患者的 60%。通过追溯家族遗传史,目前已鉴定出 83 个与 RP 相关的基因,偶发 RP 约占 40%,这意味着这类患者缺乏家族史,遗传模式不规则2。尽管视网膜感光细胞凋亡导致 RP 患者视觉功能丧失是一种普遍认识,但 RP 中光感受器死亡的潜在机制仍不清楚 12,13,14。由于主要在玻璃体切除术中获得的人类视网膜组织的获取受限,因此从模型动物中提取视网膜组织仍然是 RP 基础研究中的常见方法14,15。
视网膜是位于眼睛球内层的透明膜,玻璃体腔在内,脉络膜靠近外侧。视网膜从前面的锯齿状边缘开始,到后面的视盘结束。这是视觉形成16 的初始部分。模式动物的视网膜样本主要用于视网膜 PCR 分析、Western blot 检测、病理组织结构观察、免疫组化染色、免疫荧光检查、微血管密度评价、细胞分离和培养等17,18。不同检测指标对视网膜采样的要求不同。用于模型动物蛋白质因子检测的视网膜采样和石蜡包埋切片的视网膜采样是筛查 RP8 药物的常见作技术。然而,由于模型动物眼球的结构非常精细复杂,去除眼中干扰组织和获得视网膜标本的过程很复杂。在采样过程中,可能会出现视网膜组织丢失、污染、蛋白质降解和视网膜脱离。这些因素将对视网膜蛋白提取的质量和数量产生影响,以及切片染色的效果和实验指标的检测结果。因此,需要适当的视网膜取样程序。
为了提高模式动物的视网膜采集技术,简化复杂性并掌握采集的关键环节至关重要。视网膜的快速暴露和尽可能完全去除视网膜是模型大鼠蛋白质因子检测视网膜取样的关键步骤。在本研究中,麻醉后直接提取眼球,以节省采样时间。暴露视网膜的一个技巧是将眼罩翻转到 1.5 mL 的管子上,这既经济又实用,并且可以将视网膜从巩膜壁上完全剥离。该作程序简单、快速、节省成本,有利于实验人员作实践,因此可在 5 分钟内完成。在进行视网膜取样进行病理检查和特异性细胞染色的过程中,保持视网膜的新鲜度和结构完整性是获得高质量染色的关键步骤。从左心房灌注甲醛,然后获得视网膜是研究人员经常使用的方法之一,但这种方法很耗时,而且甲醛闻起来很臭,给作者带来不适19. 在这项研究中,麻醉后将眼球周围的组织分离成一个环,以保持其完整性。切开并保留视神经后,在眼球后极分离其周围的组织并取出眼球。眼球的不同部分与视神经准确定位。最后,在眼内容物的支持下,切开切口,将角膜切成一圈,剥离晶状体和玻璃体,获得连接视神经的眼罩(视网膜位于眼罩内的巩膜壁上)。在这个过程中,手术应该是轻柔的,以保持视网膜的完整性。该作程序不仅大大提高了采集材料的速度,而且还可以保持眼球的完整正常结构和形状,取出眼球后可以准确定位在眼球的不同部位。作熟练后,可在 8 分钟内完成手术。通过使用上述视网膜采样方法,我们研究小组获得了比较理想的蛋白质因子检测结果、HE 染色结果和 TUNEL 染色结果。
尽管目前的视网膜采样方法具有一些优点,但仍有待改进。在进行蛋白质因子检测的视网膜取样过程中,暴露视网膜后,由于弯曲镊子的支撑点有限,通过弯曲镊子取视网膜时也存在视网膜解剖不完全或丢失的风险。因此,有必要改进视网膜解剖的工具。另一方面,在进行视网膜摘取进行病理检查和特异性细胞染色的过程中,在分离眼球后,在晶状体和玻璃体剥离过程中,眼球壁会因失去眼睛的支撑而塌陷,容易引起视网膜剥离。因此,作需要快速、轻柔且具有适当的力度,并且作员需要经常练习。因此,我们的视网膜采样程序仍需改进,以更大程度地促进传统医学对 RP 的保护作用和机制的研究。
披露声明
作者没有什么可披露的。
致谢
这项工作得到了宁夏高等教育厅 (NYG2022029) 科研项目的支持。
材料
| Name | Company | Catalog Number | Comments |
| Amersham Imager | GE | 680 | |
| Ammonium persulfate | Boster Biological Technology Co.,Ltd | A8090 | |
| Analytical Balance | Mettler Toledo | ME104E | |
| BCA protein quantization kit | Ken Gen Biotech. Co. Ltd | KGP902 | |
| cleaved caspase-3 antibody | Cell Signaling Technology | #9664 | |
| cleaved caspase-7 antibody | Cell Signaling Technology | #8438 | |
| cleaved caspase-9 antibody | Cell Signaling Technology | #9507 | |
| DeadEnd Fluorometric TUNEL System | Promega | G3250 | |
| Glycine | Boster Biological Technology Co.,Ltd | AR1200 | |
| Goat Anti-Rabbit IgG H&L (HRP) | Bioss Antibodies | bs-80295G-HRP | |
| Goat serum | Biosharp | BL210A | |
| High speed crusher | Thermo Fisher Scientific | AG22331 | |
| Immobilon-P SQ Transfer membranes | Merck Millipore. Ltd | ISEQ00010 | |
| Isoflurane | RWD Life Science | R510-22-10 | |
| Methanol | Chengdu Kelong Chemical Co., Ltd | 20230108 | |
| Microplate Reader | Thermo Fisher Scientific | 1510 | |
| Microscope | Olympus | IX73 | |
| Microscope slide | Citotest Labware Manufacturing Co., Ltd | 7105P-G | |
| Mini-PROTEAN Tetra | BIO-RAD | 1658001 | |
| N-Methyl-N-Nitrosourea | sigma-Aldrich | N4766–100G | |
| Oven | Shanghai Yuejin Medical Equipment Co., Ltd | DHG-8145 | |
| Page Pre-solution (30% ) | Doublehelix Biology Science and Technology Co.,Ltd | L3202A | |
| PageRuler Prestained Protein Ladder | Thermo Fisher Scientific | 26617 | |
| PBS buffer | Biosharp | G4202 | |
| SDS-PAGE Protein loading buffer (5×) | Beyotime Biotechnology | P0015 | |
| Skim milk powder | BioFroxx | 1172GR500 | |
| Sprague Dawley rats | Ningxia Medical University | SCXK (Ning) 2020-0001 | |
| TEMED | Boster Biological Technology Co.,Ltd | AR1165 | |
| Total protein extraction kit | Ken Gen Biotech. Co. Ltd | KGP2100 | |
| Trans-Blot Module | BIO-RAD | 1703935 | |
| Tris base | Boster Biological Technology Co.,Ltd | AR1162 | |
| Tweezer | Changde BKMAM Biotechnology Co., Ltd | 130302027 | |
| β-actin | Cell Signaling Technology | #4970 |
参考文献
- Cehajic-Kapetanovic, J., et al. Association of a novel intronic variant in RPGR with hypomorphic phenotype of X-linked retinitis pigmentosa. JAMA Ophthalmol. 138 (11), 1151-1158 (2020).
- Pan, M. Y., et al. Mice deficient in UXT exhibit retinitis pigmentosa-like features via aberrant autophagy activation. Autophagy. 17 (8), 1873-1888 (2021).
- Xiong, Y. C., et al. 17β-Oestradiol attenuates the photoreceptor apoptosis in mice with retinitis pigmentosa by regulating N-myc downstream regulated gene 2 expression. Neuroscience. 452, 280-294 (2021).
- Zhang, S., et al. Müller cell regulated microglial activation and migration in rats with -Methyl--Nitrosourea-Induced retinal degeneration. Front Neurosci. 14, 606486 (2020).
- Karine, B., et al. Transferrin non-viral gene therapy for treatment of retinal degeneration. Pharmaceutics. 12 (9), 836 (2020).
- Yan, W. M., et al. Protection of retinal function and morphology in MNU-induced retinitis pigmentosa rats by ALDH2: an in-vivo study. BMC Ophthalmol. 20 (1), 55 (2020).
- Zhu, Y. F., et al. Lycium barbarum polysaccharides attenuates N-methy-N-nitrosourea-induced photoreceptor cell apoptosis in rats through regulation of poly (ADP-ribose) polymerase and caspase expression. J Ethnopharmacol. 191, 125-134 (2016).
- He, S. Q., et al. Effects and mechanisms of water-soluble Semen cassiae polysaccharide on retinitis pigmentosa in rats. Food Sci Technol. 40 (1), 84-88 (2020).
- Chen, Q., Cheng, Z. H., Hu, B. J. Current situation of vitreous and retinal related tissue specimens collection and application. Chinese J Ocular Fundus Dis. 36 (5), 396-399 (2020).
- Zhang, Y., et al. Salidroside modulates repolarization through stimulating Kv2.1 in rats. Eur J Pharmacol. 977, 176741 (2024).
- Deng, F. Y., Han, M. Y., Deng, T. T., Jin, M. Research progress of gene therapy for retinitis pigmentosa. Int Eye Sci. 21 (7), 1205-1208 (2021).
- Lin, B., Youdim, M. B. H. The protective, rescue and therapeutic potential of multi-target iron-chelators for retinitis pigmentosa. Free Radic Biol Med. 174, 1-11 (2021).
- Carullo, G., et al. Retinitis pigmentosa and retinal degenerations: deciphering pathways and targets for drug discovery and development. ACS Chem Neurosci. 11 (15), 2173-2191 (2020).
- Zhang, Z. J., et al. Quantification of microvascular change of retinal degeneration in Royal College of Surgeons rats using high-resolution spectral domain optical coherence tomography angiography. J Biomed Opt. 28 (10), 106001 (2023).
- Loiseau, A., Raîche-Marcoux, G., Maranda, C., Bertrand, N., Boisselier, E. Animal models in eye research: focus on corneal pathologies. Int J Mol Sci. 24 (23), 16661 (2023).
- Gregory-Evans, K. A review of diseases of the retina for neurologists. Handb Clin Neurol. 178, 1-11 (2021).
- Li, X. M., et al. Targeting long noncoding RNA-AQP4-AS1 for the treatment of retinal neurovascular dysfunction in diabetes mellitus. EBioMedicine. 77, 103857 (2022).
- Lee, D., et al. Retinal degeneration induced in a mouse model of ischemia-reperfusion injury and its management by pemafibrate treatment. FASEB J. 36 (9), e22497 (2022).
- Zhang, Q. L., Zhao, N., Li, Z. J. Effects of salidroside on retinopathy in diabetic rats based on COX-2/PGE2/VEGF pathway. J China Medical Uni. 52 (8), 731-935 (2023).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。