Method Article
דגימה של נזק ברשתית של חולדות הנגרמת על ידי N-methyl-N-nitrosourea, והערכה רב-אינדקסית של שינויים פתולוגיים
In This Article
Summary
פרוטוקול זה מתאר הליך לדגימת רשתית של חולדות ושימוש בצביעה של המטוקסילין-אאוזין, בדיקת TUNEL וכתם מערבי לאיתור שינויים פתולוגיים ואפופטוזיס ברשתית לאחר הזרקה תוך-צפקית של N-Methyl-N-Nitrosourea.
Abstract
ניתן להבחין ברטינופתיה ברוב מחלות העיניים ובסיבוכים המאוחרים של סוכרת. תאי האפיתל הפיגמנט הספציפיים והנזק והניוון של תאי הראייה הם המאפיינים העיקריים של רטינופתיה. תרופות מסורתיות רבות הראו יעילות קלינית משמעותית בטיפול ברטינופתיה. כיצד להשיג רשתית במהירות ובשלמות הוא שלב מפתח במחקר הרפואה המסורתית לטיפול ברטינופתיה. במחקר זה, אנו שואפים לספק הליך סטנדרטי וניתן להפעלה לדגימה של נזק לרשתית של חולדות המושרה על ידי N-methyl-N-nitrosourea (MNU) והערכה מרובת אינדקסים של שינויים פתולוגיים. לחולדות הוזרקו 60 מ"ג/ק"ג MNU תוך צפקי פעם אחת כדי לגרום נזק לרשתית, ודגימות רשתית התקבלו לאחר 7 ימים. בנוסף, ביצענו צביעת המטוקסילין-אאוזין כדי להעריך שינויים פתולוגיים ברשתית. קביעת שיעור האפופטוזיס וחלבון האפופטוזיס על ידי TUNEL וכתם מערבי. פרוטוקולים מתוקננים אלה לדגימת רשתית ולהערכת שינויים פתולוגיים מסייעים בקידום חקר מנגנון הרטינופתיה וגילוי צמחי מרפא מסורתיים חדשים ויעילים.
Introduction
רטיניטיס פיגמנטוזה (RP) היא מחלת רשתית תורשתית ומסנוורת1. שכיחות RP היא בין 1/3500 ל-1/5000, ומשפיעה על תפקוד הראייה של כ-2.5 מיליון אנשים בעולם. זוהי אחת המחלות הידועות ביותר המובילות ללקות ראייה בבני אדם, ומטילה נטל משמעותי על החברה כולה2. המחלה מאופיינת באובדן הדרגתי של תפקוד תאי האפיתל של פיגמנט הרשתית ואפופטוזיס מתקדם של קולטני האור. בשלב המוקדם, החולים חווים עיוורון לילה, המתבטא בפגמים בשדה הראייה ההיקפי ומוביל בסופו של דבר לאובדן הראייה המרכזית3. לכן, עיכוב אפופטוזיס של קולטני אור ברשתית הוא נקודת הציון למניעה וטיפול ב- RP.
אפופטוזיס של תאי רשתית הוא מאפיין נפוץ של RP אנושי וחיות מודל4. הזרקה תוך-צפקית של 60 מ"ג/ק"ג N-Methyl-N-Nitrosourea (MNU) בחולדות למשך 7 ימים עלולה לגרום לאפופטוזיס ולאובדן תאי קולטני אור ברשתית, וזהו מודל בעלי חיים נפוץ של RP 5,6. ניתוח השינויים במבנה הפתולוגי, אפופטוזיס תאים ספציפיים וביטוי חלבון הקשור לאפופטוזיס של רקמת הרשתית בחיות מודל יכול לספק נתונים ניסיוניים יעילים ותמיכה תיאורטית בחקר הפתוגנזה של RP אנושי ותרופות סקר 7,8. לכן, איכות דגימות הרשתית קובעת את מהימנות הנתונים הניסיוניים. עם זאת, בשל הייחודיות של רקמת העין, ישנם מעט מאוד דיווחים כיצד להשיג את רשתית החולדה9.
מאמר זה מספק הליך פשוט, מהיר, סטנדרטי וניתן להפעלה לדגימת רשתית בחולדות כדי להתגבר על החסרונות לעיל. צביעת המטוקסילין-אאוזין (HE), צביעת דאוקסיורידין טריפוספט-דיגוקסיגנין (TUNEL) בתיווך דאוקסי-נוקלאוטידיל טרנספראז (TUNEL), וכתם מערבי משמשים לניתוח השינויים הפתולוגיים בנזק לרקמת הרשתית ואפופטוזיס בחולדות. כל השיטות נגזרות מהניסיון של קבוצת המחקר שלנו עם התהליכים המבצעיים הספציפיים.
Protocol
כל הפרוטוקולים וההליכים הכירורגיים אושרו על ידי ועדת האתיקה של האוניברסיטה הרפואית נינגשיה (מספר אתיקה: NO. 2020-Q066). חולדות זכרות SPF Sprauge-Dawley (SD), בגילאי 7-8 שבועות ובמשקל 200-220 גרם, נרכשו מהאוניברסיטה הרפואית נינגשיה עם מספר רישיון בעל חיים SCXK (Ning) 2020-0001. כל החיות גודלו במרכז חיות המעבדה של האוניברסיטה הרפואית נינגשיה. הטמפרטורה והלחות היו מתאימות, מחזור האור יום-לילה נשמר, והמזון והמים היו בחינם ומספיקים.
1. הכנה טרום ניתוחית
- הכנת חומרים
- הכינו צלחות חולדות, מכשירי הרדמה באינהלציה, קופסאות משובצות, צינורות אחסון קפואים, כפפות ומסכות כירורגיות חד פעמיות, בקבוקים עם פה רחב, 4% פרפורמלדהיד, שקיות קרח, מספריים לעיניים, פינצטה עיניים, להבים כירורגיים וידיות סכינים, צינורות מיקרוצנטריפוגה של 1.5 מ"ל ועיקרו אותם מראש (ראה טבלת חומרים).
- הכנת בעלי חיים
- חלקו באופן אקראי 20 חולדות SD זכרים לקבוצת מודל (n=10) וקבוצת ביקורת (n=10). הזרקת חולדות מודל תוך צפקי עם 60 מ"ג/ק"ג MNU והזרקת חולדות ביקורת תוך צפקית עם אותו נפח של מי מלח.
- לאחר 7 ימים של הזרקה, צמו את החולדות ואפשרו להן לשתות בחופשיות בלילה שלפני הדגימה.
- למחרת, הניחו את החולדה על שולחן הניתוחים והשתמשו במסכה כדי לתת הרדמה באמצעות 4% איזופלורן ו-2 ליטר חמצן לדקה. מדוד את עומק ההרדמה על ידי צביטה במרכז כף הרגל כדי להתבונן בתגובות החולדות.
2. דגימת רשתית לזיהוי גורם חלבון
- תקן את ארובת העין של החולדה ביד שמאל והסר את העין בכוח מתון ביד ימין באמצעות מלקחיים לכיפוף עיניים. הנח את גלגל העין במצב סגיטלי בכלי זכוכית קר.
- כאשר יד שמאל מחזיקה פינצטה ישרה לעיניים כדי לתקן את גלגל העין ויד ימין מחזיקה את להב הניתוח, בצע חתך אורכי של 2 מ"מ ליד מקום העדשה.
- חותכים את הקרנית עם מספריים עיניים לאורך החתך, ומקלפים בעדינות את העדשה, הזגוגית וחושפים את העין.
- הניחי את החלק התחתון של גביעונית העין בקצה צינור המיקרו-צנטריפוגה בנפח 1.5 מ"ל, סובבי את גביעונית העין מעל הצינורית וחשפי את הרשתית (הרשתית צהובה קלושה).
- הסירו את כל הרשתית לאורך הדופן הסקלרלית של גלגל העין בעזרת פינצטה לכיפוף עיניים, ואז הניחו אותה בשפופרת קפואה ואחסנו אותה במיכל חנקן נוזלי לשימוש עתידי (איור 1).
3. דגימת רשתית לבדיקה פתולוגית וצביעה ספציפית של תאים
- ביד שמאל, השתמש בפינצטה כדי להרים את זווית עין החולדה. ביד ימין, השתמש בלהב כירורגי כדי לחתוך פתח של 4 מ"מ לאורך זווית העין של החולדה.
- השתמשו בפינצטה כדי להדק את קצה גלגל העין בפתח ביד שמאל. השתמש במספריים עיניים כדי לחתוך את הרקמות הסובבות לאורך קצה גלגל העין תוך שימת לב לניקוי הרקמות הסובבות את גלגל העין.
- הפרד את הרקמות סביב עצב הראייה בקוטב האחורי של גלגל העין בעזרת פינצטה, חתוך את עצב הראייה ושים לב לשימורו. לאחר מכן, הסר את גלגל העין.
- שטפו את גלגל העין שהוסר במי מלח כדי להסיר את שאריות הדם, גלגלו אותו על נייר פילטר לספיגת עודפי מים, והניחו אותו על נייר כסף קר.
- תקן את העין בפינצטה עיניים. בצע חתך אורכי של 4 מ"מ לאורך צומת הקרנית והרשתית בעזרת להב כירורגי.
- הסר את הקרנית בעזרת מספריים עיניים, בצע חתך עגול לאורך החתך והסר בעדינות את העדשה וגוף הזגוגית.
- הניחי את גביעונית העיניים שנותרה עם עצב ראייה בקופסת הטבעה וקבעו אותה ב-4% פרפורמלדהיד.
- הטמיעו דגימות קבועות פרפורמלדהיד בפרפין וחתכו לפרוסות של 4 מיקרומטר לצביעה HE וצביעה TUNEL7.
4. HE מכתים של רשתית חולדה
- הסרת שעווה והידרציה: מניחים את הפרוסות בקסילן למשך 10 דקות, חוזרים על התהליך למשך 10 דקות נוספות, ולאחר מכן אתנול מוחלט למשך 5 דקות, חוזרים על הטיפול באתנול למשך 5 דקות נוספות, ולאחר מכן טיפול ב-95% אלכוהול למשך 5 דקות, לאחר מכן ב-85% אלכוהול למשך 5 דקות, ולבסוף ב-75% אלכוהול למשך 5 דקות.
- מכתים המטוקסילין: שוטפים את הפרוסה במים נטולי יונים למשך 5 דקות. השתמש ב-100 מיקרוליטר של תמיסת צביעה והכתמה של המטוקסילין למשך 5 דקות, שטוף במים נטולי יונים למשך 5-10 שניות. הוסף 100 מיקרוליטר של אתנול חומצה הידרוכלורית 1% למשך 30 שניות, שטוף במים נטולי יונים למשך 20 דקות והוסף 100 מיקרוליטר של 0.2% מי אמוניה למשך דקה. שוטפים במים נטולי יונים למשך 5 דקות.
- צביעת אאוזין: השתמש ב-100 מיקרוליטר של תמיסת צביעת אאוזין כדי להכתים למשך 5 דקות ולשטוף במים נטולי יונים למשך 30 שניות.
- התייבשות ואיטום: טבלו את הפרוסות ב-70% אלכוהול למשך 5 דקות, לאחר מכן 85% אלכוהול למשך 5 דקות, ולאחר מכן 90% אלכוהול למשך 5 דקות, ואתנול מוחלט למשך 5 דקות. חזור על הטיפול באתנול המוחלט למשך 5 דקות נוספות, ולאחר מכן טבל בקסילן למשך 5 דקות, וחזור על התהליך למשך 5 דקות נוספות. לבסוף, אטמו על ידי הוספת כ-100 מיקרוליטר של שרף ניטרלי על פני הפרוסות ולאחר מכן כסו אותו בכוס כיסוי.
- הדמיית השקופיות: מקם את הפרוסות המוכתמות על המיקרוסקופ, כוונן את מיקוד המיקרוסקופ עד שהתמונה נראית בבירור, הגדר את ההגדלה על פי 400 וצלם את התמונה.
- מדוד את עובי הרשתית הכולל ואת עובי הרשתית החיצונית: מדוד את עובי הרשתית הכולל ואת עובי הרשתית החיצונית (עובי שכבת הגרעין החיצונית ושכבת קולטני האור), וחשב את אחוז עובי הרשתית החיצונית
עובי הרשתית החיצונית (%) = (עובי הרשתית החיצונית / עובי הרשתית הכולל) x 100.
5. קביעת קצב האפופטוזיס של תאי קולטני אור ברשתית בשיטת TUNEL
- הסרת שעווה ולחות: מניחים את הפרוסות בקסילן למשך 10 דקות, חוזרים על התהליך למשך 10 דקות נוספות, ואז מניחים באתנול מוחלט למשך 5 דקות, וחוזרים על שלב זה למשך 5 דקות נוספות. בצע התייבשות על ידי הכנסת 95% אלכוהול למשך 5 דקות, 90% אלכוהול למשך 5 דקות, 80% אלכוהול למשך 5 דקות, 70% אלכוהול למשך 5 דקות ושטיפה במים נטולי יונים למשך 5 דקות.
- יש לשטוף בתמיסת נתרן כלורי 0.85% למשך 5 דקות ו-PBS למשך 5 דקות. יש לתקן עם פרפורמלדהיד באמצעות 4% פרפורמלדהיד למשך 15 דקות. שוטפים עם PBS למשך 5 דקות, וחוזרים על התהליך למשך 5 דקות נוספות.
- דגירה ושיווי משקל7: דגירה עם תמיסת פרוטאינאז K של 20 מיקרוגרם/מ"ל לעיכול למשך 15 דקות, שיווי משקל במאגר שיווי המשקל למשך 10 דקות, ודגירה עם מאגר דאוקסינוקלאוטידילטרנספראז (rTdT) טרמינלי רקומביננטי ב-37 מעלות צלזיוס למשך 60 דקות.
- תגובת עצירה: הוסף 100 מיקרוליטר את תמיסת הציטראט הסטנדרטית (תמיסת SSC 2x) למשך 15 דקות. שוטפים עם PBS למשך 5 דקות, וחוזרים על התהליך למשך 5 דקות נוספות.
- צבע גרעיני: הוסף 100 מיקרוליטר 4 ′, מגיב 6-דיאמידין-2-פנינדל (DAPI) למשך 5 דקות. שוטפים במים נטולי יונים למשך 5 דקות, וחוזרים על התהליך למשך 5 דקות נוספות.
- חותם: נגב עודפי קסילן סביב הפרוסות, ואוטם על ידי הוספת כ-100 מיקרוליטר של שרף ניטרלי על פני הפרוסות, ולאחר מכן כסה אותו בכוס כיסוי.
- מיקרוסקופיה: הנח את הפרוסות המוכתמות על המיקרוסקופ, התאם את מיקוד המיקרוסקופ לנראות ברורה, הגדר את ההגדלה ל-400x וצלם את התמונה. התבונן בפלואורסצנטיות הירוקה ב-520 ±-20 ננומטר באמצעות מסנן פלואורסצנטי רגיל. שימו לב ל-DAPI הכחול ב-460 ננומטר.
- חשב את קצב האפופטוזיס: מדוד את ערכי הקרינה הירוקה וערכי הקרינה הכחולה של שכבת גרעין הרשתית החיצונית. חשב את שיעור האפופטוזיס כ
קצב תאים אפופטוזיס = ערך פלואורסצנטי ירוק / ערך פלואורסצנטי כחול x 100.
6. ניתוח כתמים מערביים 10
- טיפול במאגר ליזה: טחון והומוגניזציה של רשתית קפואה אחת עם 50 מיקרוליטר של מאגר ליזה קרה (1 מ"ל של מאגר ליזה המכיל 5 מיקרוליטר של מעכב פוספטאז, 1 מיקרוליטר של מעכב פרוטאז ו-5 מיקרוליטר של 100 מ"מ PMSF).
- בכפוף לסוניקציה של 28 קילו-הרץ למשך 5 שניות על אמבט קרח; חזור על הפעולה 3x. צנטריפוגה ב-4 מעלות צלזיוס למשך 5 דקות ב-10,000 x גרם להסרת פסולת תאית. שמור על הסופרנטנט.
- em>6.3כימות חלבון: קבע את ריכוז החלבון באמצעות ערכת ריאגנטים לבדיקת חלבון BCA.
- em>6.4אלקטרופורזה: טען 50 מיקרוגרם דגימת חלבון והפרד על 12% נתרן דודציל סולפט אלקטרופורזה של ג'ל פוליאקרילאמיד (SDS-PAGE).
- העברה לממברנה: העברה אלקטרופורטית לממברנות PVDF באמצעות מערכת העברה אלקטרופורטית.
- חלוקת משנה של ממברנות: חלוקת משנה של הממברנות, וניתוח כל חלבון מעניין, β-actin ו-GAPDH מהעברה אחת.
- חסימה: חסום את הממברנות למשך שעה אחת ב-TBST המכיל 5% חלב דל שומן בטמפרטורת החדר.
- דגירה של נוגדן ראשוני: דגירה עם נוגדן ראשוני של קספאז-9 שסוע (דילול של 1:200), קספאז-3 שסוע (דילול של 1:200), קספאז-7 שסוע (דילול של 1:200) ו-β-אקטין (דילול של 1:1000) למשך הלילה ב-4 מעלות צלזיוס. שוטפים את הממברנות עם TBST למשך 5 דקות, חוזרים על הפעולה 3x.
- דגירה של נוגדן שני: דגירה עם נוגדנים משניים מצומדים לחזרת פרוקסידאז (1:2000) למשך שעתיים בטמפרטורת החדר. שוטפים את הממברנות עם TBST למשך 5 דקות, חוזרים על הפעולה 3x.
- חשיפה: דמיין את החלבונים המסומנים באמצעות מצע כתם מערבי, ולבסוף, חשוף את הממברנות כדי לדמיין את רצועות החלבון במצב חשיפה אוטומטי.
- חשב את תכולת החלבון7 על ידי מדידת צפיפות רצועת החלבון.
7. ניתוח סטטיסטי
- לנתח את הנתונים באמצעות תוכנת SPSS 19.0 ולהציגם כממוצע ± סטיית תקן. לבצע ניתוחים סטטיסטיים של ערכים נצפים באמצעות ניתוח שונות חד כיווני. קח את p< 0.05 כמובהק סטטיסטית.
תוצאות
לאחר צביעת HE, לכל שכבות הרשתית של החולדות בקבוצת הביקורת היה מבנה רקמה ברור, סידור תאים מסודר וצביעה אחידה, בעוד שמבנה הרשתית של חולדות בקבוצת המודל נפגע משמעותית, שכבת הרשתית החיצונית הייתה דקה יותר, השכבה הגרעינית החיצונית השתלבה כמעט לחלוטין עם שכבת הליבה הפנימית, סידור התאים בשכבה היה מאוד לא מסודר. מספר שכבות התאים הצטמצם משמעותית, ועובי שכבת התא הרגישה לאור ושכבת הגרעין החיצונית היה דק משמעותית. עובי שכבת הרשתית החיצונית בקבוצת הביקורת ובקבוצת המודל היה 48% ו-23%, בהתאמה (p < 0.01; איור 2).
שיטת TUNEL הראתה שלא זוהו תאים אפופטוטיים בקבוצת הביקורת, אולם היו כמה תאים אפופטוטיים בשכבה הגרעינית החיצונית של חולדות בקבוצת המודל (p < 0.01), והיחס החיובי ל-TUNEL היה 9.6% (איור 3).
משפחת החלבונים קספאז היא אחת המשפחות העיקריות המבצעות אפופטוזיס. ביניהם, קספאז 3 שסוע, קספאז 7 שסוע וקספאז 9 שסוע הם אינדיקטורים קלאסיים המשמשים להערכת אפופטוזיס תאים7. תוצאות הכתם המערבי הראו כי בהשוואה לקבוצת הביקורת, הביטוי של קספאז 3 שסוע, קספאז 7 שסוע וקספאז 9 שסוע ברשתית של קבוצת המודל היה מוגבר באופן משמעותי (p<0.01; איור 4). זה הצביע על כך ש-MNU יכול לגרום בבירור לאפופטוזיס של תאים ברשתית.

איור 1: זרימת העבודה הניסיונית. לאחר הזרקה תוך-צפקית של MNU למשך 7 ימים (7 ד'), הושגה רשתית של חולדות מורדמות לצביעה HE ו-TUNEL. קיצורים: MNU = N-methyl-N-nitrosourea; HE = המטוקסילין-אאוזין; TUNEL = תיוג קצה ניק-קצה של דאוקסינוקלאוטידיל טרנספראז. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 2: תמונות צביעה היסטופתולוגיות מייצגות של HE ביום 7 לאחר הזרקת MNU. (A) צביעת HE ב-7 ימים (7d) לאחר מתן MNU. (ב) יחס רשתית חיצונית. הנתונים מוצגים כממוצע ± SD (n=6). ניתוחים סטטיסטיים של ערכים שנצפו בוצעו באמצעות ניתוח חד כיווני של שונות. ** P < 0.01 לעומת שליטה. קיצורים: GCL = שכבת תאי גנגליון; IPL = שכבת פרספקס פנימית; INL = שכבת הליבה; OPL = שכבת פרספקס חיצונית; ONL = שכבה גרעינית חיצונית; PRL = שכבת קולטני האור; MNU = N-methyl-N-nitrosourea; HE = המטוקסילין-אאוזין. n = 6. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 3: בדיקת TUNEL מראה אפופטוזיס של קולטני אור המושרה על ידי MNU בחולדות. (A) 7 ימים (7d) לאחר הזרקת MNU, תאים חיוביים ל-TUNEL (ירוק) הוצגו ב-ONL בחולדות שטופלו ב-MNU. (B) יחס חיובי ל-TUNEL. הנתונים מוצגים כממוצע ± SD (n=6). ניתוחים סטטיסטיים של ערכים שנצפו בוצעו באמצעות ניתוח חד כיווני של שונות. ** P < 0.01 לעומת שליטה. קיצורים: GCL = שכבת תאי גנגליון; IPL = שכבת פרספקס פנימית; INL = שכבת הליבה; OPL = שכבת פרספקס חיצונית; ONL = שכבה גרעינית חיצונית; PRL = שכבת קולטני האור; MNU = N-methyl-N-nitrosourea; TUNEL = תיוג קצה ניק-קצה של דאוקסינוקלאוטידיל טרנספראז. n = 6. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
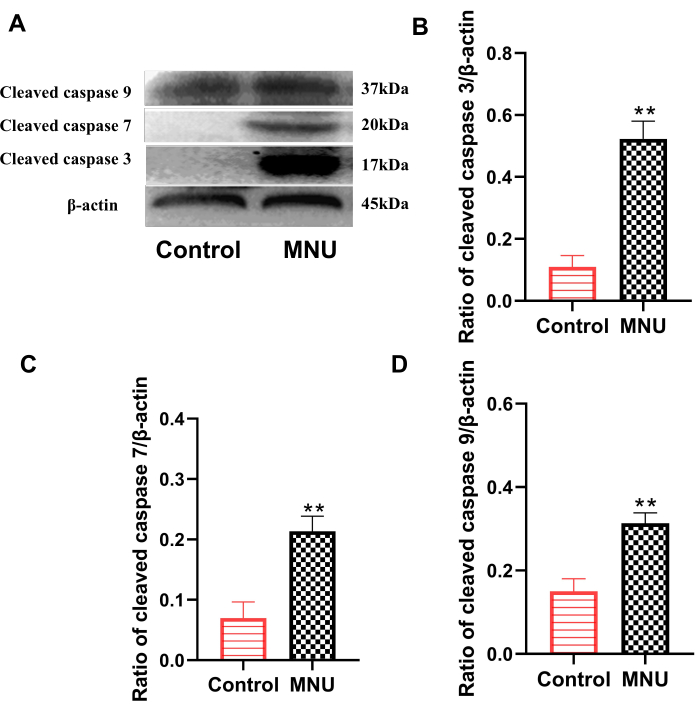
איור 4: ביטוי של קספאז 3 שסוע, קספאז 7 שסוע וקספאז 9 שסוע ברשתית חולדה ביום 7 לאחר הזרקת MNU. (A) נתונים מייצגים לביטוי קספאז שסוע. (ב) יחס של קספאז שסוע 3/β-אקטין. (ג) יחס של קספאז שסוע 7/β-אקטין. (ד) יחס של קספאז שסוע 9/β-אקטין. הנתונים מוצגים כממוצע ± SD (n=6). ניתוחים סטטיסטיים של ערכים שנצפו בוצעו באמצעות ניתוח חד כיווני של שונות. ** P < 0.01 לעומת שליטה. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
Discussion
RP היא מחלת רשתית שכיחה במרפאות. ההופעה, החומרה וההתקדמות של RP קשורים לגנים ולמצבים גנטיים ומושפעים מהסביבה 8,11. RP כולל RP משפחתי ו-RP מזדמן, מתוכם RP משפחתי מהווה כ-60% מהמטופלים. באמצעות מעקב אחר ההיסטוריה הגנטית המשפחתית, זוהו עד כה 83 גנים הקשורים ל-RP, בעוד ש-RP מזדמן מהווה כ-40%, מה שאומר שלסוג זה של מטופל אין היסטוריה משפחתית ויש לו דפוס גנטי לא סדיר2. למרות שאפופטוזיס של תאי קולטני אור ברשתית, הגורם לאובדן תפקוד הראייה בחולי RP הוא הכרה כללית, המנגנון הבסיסי של מוות קולטני אור ב-RP נותר לא ברור 12,13,14. בשל הגישה המוגבלת לרקמת רשתית אנושית, המתקבלת בעיקר במהלך כריתת זגוגית, מיצוי רקמת רשתית מחיות מודל הוא עדיין שיטה נפוצה במחקר הבסיסי של RP14,15.
הרשתית היא קרום שקוף הממוקם בשכבה הפנימית של פקעת העין, כאשר חלל הזגוגית בפנים וקרום הכורואיד קרוב כלפי חוץ. הרשתית מתחילה מהקצה המשונן מלפנים ומסתיימת בדיסק האופטי מאחור. זהו החלק הראשוני של היווצרות חזון16. דגימות רשתית של חיות מודל משמשות בעיקר לניתוח PCR ברשתית, זיהוי כתמים מערביים, תצפית על מבנה רקמות פתולוגי, צביעה אימונוהיסטוכימית, בדיקת אימונופלואורסצנטיות, הערכת צפיפות מיקרו-וסקולרית, בידוד תאים ותרבית וכו'.17,18. הדרישות של דגימת רשתית עבור מדדי בדיקה שונים שונות. דגימת רשתית לזיהוי גורמי חלבון בחיות מודל ודגימת רשתית לחלקים משובצים בפרפין הן טכניקות תפעוליות נפוצות לסינון תרופות ל-RP8. עם זאת, בשל המבנה העדין והמורכב מאוד של גלגל העין של חיית המודל, תהליך הסרת הרקמות המפריעות בעין והשגת דגימות רשתית הוא מסובך. במהלך תהליך הדגימה, ייתכנו אובדן רקמת רשתית, זיהום, פירוק חלבונים והיפרדות רשתית. לגורמים אלה תהיה השפעה על איכות וכמות מיצוי חלבון הרשתית, כמו גם על השפעת צביעת החתך ותוצאות הזיהוי של אינדיקטורים ניסיוניים. לכן יש צורך בהליך דגימת רשתית מתאים.
זה קריטי לפשט את המורכבות ולתפוס את החוליה העיקרית של הקטיף על מנת לשפר את הטכניקה של קצירת הרשתית בחיות מודל. חשיפה מהירה של הרשתית והסרה מלאה של הרשתית ככל האפשר הם שלבי המפתח של דגימת הרשתית לזיהוי גורם חלבון בחולדות מודל. במחקר זה, גלגלי העיניים חולצו ישירות לאחר ההרדמה כדי לחסוך את זמן הדגימה. טריק לחשיפת הרשתית הוא להפוך את גביעונית העין על צינור של 1.5 מ"ל, שהיה חסכוני ומעשי ויכול היה לקלף לחלוטין את הרשתית מדופן הסקלרל. הליך פעולה זה הוא פשוט, מהיר, חוסך עלויות ותורם לתרגול תפעול כוח האדם הניסיוני, כך שניתן להשלים אותו תוך 5 דקות. בתהליך של דגימת רשתית לבדיקה פתולוגית וצביעה ספציפית של תאים, שמירה על טריות ושלמות מבנית של הרשתית היא צעד מפתח להשגת צביעה איכותית. זלוף עם פורמלדהיד מהפרוזדור השמאלי ולאחר מכן השגת הרשתית היא אחת השיטות שחוקרים משתמשים בהן לעתים קרובות, אך היא גוזלת זמן, ופורמלדהיד מריח רע ומביא אי נוחות למפעיל19. במחקר זה, הרקמה סביב גלגל העין מופרדת לטבעת לאחר ההרדמה כדי לשמור על שלמותה. לאחר חיתוך ושמירה על עצב הראייה, הפרד את הרקמה סביבו בקוטב האחורי של גלגל העין והסר את גלגל העין. חלקים שונים של גלגל העין אותרו במדויק עם עצב הראייה. לבסוף, בתמיכת תוכן העין, בוצע החתך, חתכו את הקרנית בטבעת, קילפו את העדשה והזגוגית, והתקבלה העין המחברת את עצב הראייה (הרשתית ממוקמת על דופן הסקלר בתוך העין). בתהליך זה, הפעולה צריכה להיות עדינה כדי לשמור על שלמות הרשתית. הליך הניתוח לא רק משפר מאוד את מהירות איסוף החומרים, אלא הוא גם יכול לשמור על המבנה והצורה הרגילים של גלגל העין וניתן למקם אותו במדויק בחלקים השונים של גלגל העין לאחר הוצאת גלגל העין. לאחר פעולה מיומנת ניתן להשלים את הפעולה תוך 8 דקות. על ידי שימוש בשיטות דגימת הרשתית לעיל, קבוצת המחקר שלנו השיגה תוצאות אידיאליות יחסית לזיהוי גורם חלבון, תוצאות צביעת HE ותוצאות צביעת TUNEL.
למרות שלשיטת דגימת הרשתית הנוכחית יש כמה יתרונות, עדיין יש לשפר אותה. בתהליך של דגימת רשתית לזיהוי גורם חלבון, לאחר חשיפת הרשתית, קיים גם סיכון לדיסקציה או אובדן רשתית לא שלם בעת נטילת הרשתית על ידי כיפוף פינצטה בשל נקודת התמיכה המוגבלת של כיפוף פינצטה. לכן, יש צורך לשפר את הכלים לדיסקציה של הרשתית. לעומת זאת, בתהליך שאיבת רשתית לבדיקה פתולוגית וצביעת תאים ספציפיים, לאחר בידוד גלגל העין, בתהליך הפשטת העדשה והזגוגית, דופן גלגל העין תקרוס עקב אובדן תמיכה מהעין, מה שקל לגרום להפשטת רשתית. לפיכך, הפעולה צריכה להיות מהירה, עדינה ובעלת חוזק מתאים, והמפעיל צריך להתאמן לעתים קרובות. לכן, עדיין יש לשפר את הליכי דגימת הרשתית שלנו על מנת לקדם את המחקר על ההשפעה המגנה והמנגנון של הרפואה המסורתית נגד RP במידה רבה יותר.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
עבודה זו נתמכה על ידי פרויקט המחקר המדעי של המחלקה להשכלה גבוהה של נינגשיה (NYG2022029).
Materials
| Name | Company | Catalog Number | Comments |
| Amersham Imager | GE | 680 | |
| Ammonium persulfate | Boster Biological Technology Co.,Ltd | A8090 | |
| Analytical Balance | Mettler Toledo | ME104E | |
| BCA protein quantization kit | Ken Gen Biotech. Co. Ltd | KGP902 | |
| cleaved caspase-3 antibody | Cell Signaling Technology | #9664 | |
| cleaved caspase-7 antibody | Cell Signaling Technology | #8438 | |
| cleaved caspase-9 antibody | Cell Signaling Technology | #9507 | |
| DeadEnd Fluorometric TUNEL System | Promega | G3250 | |
| Glycine | Boster Biological Technology Co.,Ltd | AR1200 | |
| Goat Anti-Rabbit IgG H&L (HRP) | Bioss Antibodies | bs-80295G-HRP | |
| Goat serum | Biosharp | BL210A | |
| High speed crusher | Thermo Fisher Scientific | AG22331 | |
| Immobilon-P SQ Transfer membranes | Merck Millipore. Ltd | ISEQ00010 | |
| Isoflurane | RWD Life Science | R510-22-10 | |
| Methanol | Chengdu Kelong Chemical Co., Ltd | 20230108 | |
| Microplate Reader | Thermo Fisher Scientific | 1510 | |
| Microscope | Olympus | IX73 | |
| Microscope slide | Citotest Labware Manufacturing Co., Ltd | 7105P-G | |
| Mini-PROTEAN Tetra | BIO-RAD | 1658001 | |
| N-Methyl-N-Nitrosourea | sigma-Aldrich | N4766–100G | |
| Oven | Shanghai Yuejin Medical Equipment Co., Ltd | DHG-8145 | |
| Page Pre-solution (30% ) | Doublehelix Biology Science and Technology Co.,Ltd | L3202A | |
| PageRuler Prestained Protein Ladder | Thermo Fisher Scientific | 26617 | |
| PBS buffer | Biosharp | G4202 | |
| SDS-PAGE Protein loading buffer (5×) | Beyotime Biotechnology | P0015 | |
| Skim milk powder | BioFroxx | 1172GR500 | |
| Sprague Dawley rats | Ningxia Medical University | SCXK (Ning) 2020-0001 | |
| TEMED | Boster Biological Technology Co.,Ltd | AR1165 | |
| Total protein extraction kit | Ken Gen Biotech. Co. Ltd | KGP2100 | |
| Trans-Blot Module | BIO-RAD | 1703935 | |
| Tris base | Boster Biological Technology Co.,Ltd | AR1162 | |
| Tweezer | Changde BKMAM Biotechnology Co., Ltd | 130302027 | |
| β-actin | Cell Signaling Technology | #4970 |
References
- Cehajic-Kapetanovic, J., et al. Association of a novel intronic variant in RPGR with hypomorphic phenotype of X-linked retinitis pigmentosa. JAMA Ophthalmol. 138 (11), 1151-1158 (2020).
- Pan, M. Y., et al. Mice deficient in UXT exhibit retinitis pigmentosa-like features via aberrant autophagy activation. Autophagy. 17 (8), 1873-1888 (2021).
- Xiong, Y. C., et al. 17β-Oestradiol attenuates the photoreceptor apoptosis in mice with retinitis pigmentosa by regulating N-myc downstream regulated gene 2 expression. Neuroscience. 452, 280-294 (2021).
- Zhang, S., et al. Müller cell regulated microglial activation and migration in rats with -Methyl--Nitrosourea-Induced retinal degeneration. Front Neurosci. 14, 606486 (2020).
- Karine, B., et al. Transferrin non-viral gene therapy for treatment of retinal degeneration. Pharmaceutics. 12 (9), 836 (2020).
- Yan, W. M., et al. Protection of retinal function and morphology in MNU-induced retinitis pigmentosa rats by ALDH2: an in-vivo study. BMC Ophthalmol. 20 (1), 55 (2020).
- Zhu, Y. F., et al. Lycium barbarum polysaccharides attenuates N-methy-N-nitrosourea-induced photoreceptor cell apoptosis in rats through regulation of poly (ADP-ribose) polymerase and caspase expression. J Ethnopharmacol. 191, 125-134 (2016).
- He, S. Q., et al. Effects and mechanisms of water-soluble Semen cassiae polysaccharide on retinitis pigmentosa in rats. Food Sci Technol. 40 (1), 84-88 (2020).
- Chen, Q., Cheng, Z. H., Hu, B. J. Current situation of vitreous and retinal related tissue specimens collection and application. Chinese J Ocular Fundus Dis. 36 (5), 396-399 (2020).
- Zhang, Y., et al. Salidroside modulates repolarization through stimulating Kv2.1 in rats. Eur J Pharmacol. 977, 176741 (2024).
- Deng, F. Y., Han, M. Y., Deng, T. T., Jin, M. Research progress of gene therapy for retinitis pigmentosa. Int Eye Sci. 21 (7), 1205-1208 (2021).
- Lin, B., Youdim, M. B. H. The protective, rescue and therapeutic potential of multi-target iron-chelators for retinitis pigmentosa. Free Radic Biol Med. 174, 1-11 (2021).
- Carullo, G., et al. Retinitis pigmentosa and retinal degenerations: deciphering pathways and targets for drug discovery and development. ACS Chem Neurosci. 11 (15), 2173-2191 (2020).
- Zhang, Z. J., et al. Quantification of microvascular change of retinal degeneration in Royal College of Surgeons rats using high-resolution spectral domain optical coherence tomography angiography. J Biomed Opt. 28 (10), 106001 (2023).
- Loiseau, A., Raîche-Marcoux, G., Maranda, C., Bertrand, N., Boisselier, E. Animal models in eye research: focus on corneal pathologies. Int J Mol Sci. 24 (23), 16661 (2023).
- Gregory-Evans, K. A review of diseases of the retina for neurologists. Handb Clin Neurol. 178, 1-11 (2021).
- Li, X. M., et al. Targeting long noncoding RNA-AQP4-AS1 for the treatment of retinal neurovascular dysfunction in diabetes mellitus. EBioMedicine. 77, 103857 (2022).
- Lee, D., et al. Retinal degeneration induced in a mouse model of ischemia-reperfusion injury and its management by pemafibrate treatment. FASEB J. 36 (9), e22497 (2022).
- Zhang, Q. L., Zhao, N., Li, Z. J. Effects of salidroside on retinopathy in diabetic rats based on COX-2/PGE2/VEGF pathway. J China Medical Uni. 52 (8), 731-935 (2023).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved