Method Article
Отбор проб N-метил-N-нитрозурного повреждения сетчатки у крыс и многоиндексная оценка патологических изменений
В этой статье
Резюме
Этот протокол описывает процедуру забора образцов сетчатки крыс с использованием окрашивания гематоксилин-эозином, анализа TUNEL и вестерн-блоттинга для обнаружения патологических изменений и апоптоза в сетчатке после внутрибрюшинного введения N-метил-N-нитрозурии.
Аннотация
Ретинопатия может наблюдаться при большинстве глазных заболеваний и поздних осложнениях сахарного диабета. Специфические клетки пигментного эпителия, а также повреждение и дегенерация зрительных клеток являются основными признаками ретинопатии. Многие традиционные лекарственные средства показали значительную клиническую эффективность в лечении ретинопатии. Как быстро и полностью получить сетчатку глаза является ключевым этапом в исследованиях традиционной медицины для лечения ретинопатии. В этом исследовании мы стремимся предоставить стандартизированную и осуществимую процедуру отбора проб N-метил-N-нитрозомочевины (MNU), вызванного повреждением сетчатки крысы, и многоиндексной оценкой патологических изменений. Крысам вводили внутрибрюшинно 60 мг/кг MNU однократно, чтобы вызвать повреждение сетчатки, а образцы сетчатки были получены через 7 дней. Кроме того, мы проводили окрашивание гематоксилин-эозином для оценки патологических изменений сетчатки. Определение скорости апоптоза и белка апоптоза с помощью TUNEL и вестерн-блоттинга. Эти стандартизированные протоколы забора образцов сетчатки и оценки патологических изменений полезны для содействия изучению механизма ретинопатии и открытию новых и эффективных традиционных трав.
Введение
Пигментный ретинит (РП) является наследственным заболеванием сетчатки, приводящим к слепоте1. Частота возникновения РП составляет от 1/3500 до 1/5000, влияя на зрительную функцию около 2,5 миллионов человек в мире. Это одно из наиболее известных заболеваний, приводящее к ухудшению зрения у людей, налагающее значительное бремя на все общество2. Заболевание характеризуется постепенной потерей функции пигментных эпителиальных клеток сетчатки и прогрессирующим апоптозом фоторецепторов. На ранних стадиях у пациентов возникает куриная слепота, которая проявляется в виде дефектов периферического поля зрения и в конечном итоге приводит к потерецентрального зрения3. Таким образом, ингибирование апоптоза фоторецепторов сетчатки является ключевым направлением профилактики и лечения РП.
Апоптоз клеток сетчатки является общим признаком РП человека и модельных животных4. Внутрибрюшинное введение N-метил-N-нитрозомочевины (MNU) в дозу 60 мг/кг крысам в течение 7 дней может вызвать апоптоз и потерю фоторецепторных клеток сетчатки, и это широко используемая животная модель RP 5,6. Анализ изменений патологической структуры, специфического клеточного апоптоза и связанной с апоптозом экспрессии белка ткани сетчатки у модельных животных может обеспечить эффективные экспериментальные данные и теоретическую поддержку в изучении патогенеза РП человека и скрининговых препаратах 7,8. Таким образом, качество образцов сетчатки определяет достоверность экспериментальных данных. Однако, из-за особенностей глазной ткани, существует очень мало сообщений о том, как получить сетчатку глаза крысы9.
В этой статье представлена простая, быстрая, стандартизированная и работоспособная процедура забора образцов сетчатки у крыс для преодоления вышеуказанных недостатков. Для анализа патологических изменений в повреждении тканей сетчатки и апоптозе у крыс используются окрашивание гематоксилин-эозином (HE), опосредованное терминальной дезоксинуклеотидилтрансферазой дезоксиуридинтрифосфат-дигоксигенин ник-энд (TUNEL) и вестерн-блоттинг. Все методы основаны на опыте нашей исследовательской группы в конкретных операционных процессах.
протокол
Все протоколы и хирургические процедуры были одобрены Комитетом по этике Медицинского университета Нинся (номер этики: No 2020-Q066). Самцы крыс SPF Sprauge-Dawley (SD) в возрасте 7-8 недель и весом 200-220 г были приобретены в Медицинском университете Нинся с номером лицензии на животное SCXK (Ning) 2020-0001. Все животные были выращены в Центре лабораторных животных Медицинского университета Нинся. Температура и влажность были подходящими, световой цикл дня и ночи сохранялся, а пища и вода были бесплатными и достаточными.
1. Предоперационная подготовка
- Подготовка материалов
- Подготовьте крысиные пластины, аппараты для ингаляционной анестезии, встроенные коробки, замороженные пробирки для хранения, одноразовые хирургические перчатки и маски, бутылочки с широким горлышком, 4% параформальдегид, пакеты со льдом, офтальмологические ножницы, офтальмотерапевтический пинцет, хирургические лезвия и рукоятки ножей, микроцентрифужные пробирки объемом 1,5 мл и заранее простилизуйте их (см. Таблицу материалов).
- Подготовка животных
- Случайным образом разделите 20 самцов SD крыс на модельную группу (n=10) и контрольную группу (n=10). Модельным крысам внутрибрюшинно вводят 60 мг/кг MNU, а контрольным крысам внутрибрюшинно вводят тот же объем физиологического раствора.
- После 7 дней инъекции кормите крыс голоданием и дайте им свободно пить в ночь перед взятием образца.
- На следующий день положите крысу лежа на операционный стол и используйте маску для введения анестезии с использованием 4% изофлурана и 2 л/мин кислорода. Измерьте глубину анестезии, сжав центр стопы, чтобы наблюдать за реакцией крыс.
2. Забор проб сетчатки для определения белкового фактора
- Зафиксируйте глазницу крысы левой рукой и удалите глаз с умеренной силой правой рукой с помощью офтальмологических изгибающих щипцов. Поместите глазное яблоко в сагиттальное положение в холодную стеклянную посуду.
- Левой рукой держа офтальмологический прямой пинцет для фиксации глазного яблока, а правой рукой держите хирургическое лезвие, сделайте продольный разрез на 2 мм рядом с местом хрусталика.
- Отрежьте роговицу офтальмологическими ножницами вдоль разреза, аккуратно снимите хрусталик, стекловидное тело и обнажите наглазник.
- Поместите дно наглазника на кончик микроцентрифужной пробирки объемом 1,5 мл, поверните наглазник над трубкой и обнажите сетчатку (сетчатка имеет бледно-желтый цвет).
- Удалите всю сетчатку вдоль склеральной стенки глазного яблока с помощью офтальмологического гнущегося пинцета, затем поместите ее в замороженную пробирку и храните в резервуаре с жидким азотом для дальнейшего использования (рисунок 1).
3. Забор сетчатки для патологоанатомического исследования и специфического окрашивания клеток
- Левой рукой используйте пинцет для глаз, чтобы приподнять уголок глаза крысы. Правой рукой с помощью хирургического лезвия вырезайте отверстие диаметром 4 мм вдоль угла глаза крысы.
- С помощью пинцета для глаз зажмите край глазного яблока в отверстии в левой руке. С помощью офтальмологических ножниц отрежьте окружающие ткани по краю глазного яблока, уделяя при этом внимание очистке окружающих тканей глазного яблока.
- Отделите ткани вокруг зрительного нерва на заднем полюсе глазного яблока с помощью пинцета, перережьте зрительный нерв и обратите внимание на его сохранение. Затем удалите глазное яблоко.
- Промойте удаленное глазное яблоко в физрастворе, чтобы удалить остатки крови, прокатайте его на фильтровальной бумаге, чтобы впитать лишнюю воду, и положите на холодную фольгу.
- Зафиксируйте глаз с помощью офтальмологического пинцета. Хирургическим лезвием сделайте продольный разрез 4 мм вдоль стыка роговицы и сетчатки.
- Удалите роговицу офтальмологических ножницами, сделайте круговой надрез вдоль разреза, аккуратно удалите хрусталик и стекловидное тело.
- Поместите оставшийся наглазник со зрительным нервом в закладную коробку и зафиксируйте его в 4% параформальдегиде.
- Поместить в параформальдегид фиксированные образцы в парафин и нарезать на ломтики размером 4 мкм для окрашивания HE и окрашивания TUNEL7.
4. HE-окрашивание сетчатки глаза крысы
- Депарафинизация и гидратация: поместите ломтики в ксилол на 10 минут, повторите процесс еще 10 минут, затем абсолютный этанол в течение 5 минут, повторите обработку этанолом еще 5 минут, затем обработайте 95% спиртом в течение 5 минут, затем в 85% спирте на 5 минут и, наконец, в 75% спирте на 5 минут.
- Окрашивание гематоксилином: Промойте ломтик деионизированной водой в течение 5 минут. Используйте 100 μл раствора для окрашивания гематоксилина и окрашивайте в течение 5 минут, смывайте деионизированной водой в течение 5-10 секунд. Добавьте 100 μл 1% этанола соляной кислоты на 30 с, промойте деионизированной водой в течение 20 мин и добавьте 100 мкл 0,2% аммиачной воды на 1 мин. Смыть деионизированной водой в течение 5 минут.
- Окрашивание эозином: Используйте 100 мкл раствора для окрашивания эозина в течение 5 минут и прополощите деионизированной водой в течение 30 секунд.
- Обезвоживание и запечатывание: Погрузите ломтики в 70% спирт на 5 минут, затем в 85% спирт на 5 минут, затем 90% спирт на 5 минут и абсолютный этанол на 5 минут. Повторите обработку абсолютным этанолом еще 5 минут, затем погрузите в ксилол на 5 минут и повторяйте процесс еще 5 минут. Наконец, запечатайте, добавив примерно 100 мкл нейтральной смолы на поверхность ломтиков, а затем накройте ее покровным стеклом.
- Визуализация предметных стекол: расположите окрашенные срезы на микроскопе, отрегулируйте фокус микроскопа до тех пор, пока изображение не станет четко видимым, установите увеличение в 400x и сделайте снимок.
- Измерьте общую толщину сетчатки и внешнюю толщину сетчатки: Измерьте общую толщину сетчатки и внешнюю толщину сетчатки (толщину внешнего ядерного слоя и слоя фоторецептора), а также рассчитайте процент толщины наружной сетчатки
Толщина наружной сетчатки (%) = (толщина наружной сетчатки/общая толщина сетчатки) x 100.
5. Определение скорости апоптоза фоторецепторных клеток сетчатки методом TUNEL
- Депарафинизация и гидратация: поместите ломтики в ксилол на 10 минут, повторите процесс еще 10 минут, затем поместите в абсолютный этанол на 5 минут и повторяйте этот шаг еще 5 минут. Выполните обезвоживание, поместив 95% спирт на 5 минут, 90% спирт на 5 минут, 80% спирт на 5 минут, 70% спирт на 5 минут и промыть деионизированной водой в течение 5 минут.
- Промыть 0,85% раствором натрия хлорида в течение 5 мин и PBS в течение 5 мин. Закрепить параформальдегидом с использованием 4% параформальдегида на 15 минут. Промойте PBS в течение 5 минут, и повторяйте процесс еще 5 минут.
- Инкубация и равновесие7: Инкубировать с раствором протеиназы К 20 мкг/мл для разложения в течение 15 мин, уравновешивать в равновесном буфере в течение 10 мин и инкубировать с рекомбинантным концевым буфером дезоксинуклеотидилтрансферазы (rTdT) при 37 °C в течение 60 мин.
- Реакция остановки: Добавьте 100 μL в стандартный раствор цитрата (2x раствор SSC) в течение 15 минут. Промойте PBS в течение 5 минут, и повторяйте процесс еще 5 минут.
- Ядерный краситель: Добавить 100 μL 4', реагент 6-диамидин-2-фениндл (DAPI) в течение 5 мин. Промойте деионизированной водой в течение 5 минут, и повторите процесс еще 5 минут.
- Герметизация: Протрите излишки ксилола вокруг ломтиков и запечатайте, добавив примерно 100 мкл нейтральной смолы на поверхность ломтиков, а затем накройте ее покровным стеклом.
- Микроскопия: поместите окрашенные срезы на микроскоп, отрегулируйте фокус микроскопа для четкой видимости, установите увеличение до 400x и сделайте снимок. Наблюдайте за зеленой флуоресценцией на длине волны 520 ± 20 нм с помощью стандартного флуоресцентного фильтра. Обратите внимание на синий DAPI на длине волны 460 нм.
- Рассчитайте частоту апоптоза: измерьте значения зеленой флуоресценции и синей флуоресценции внешнего слоя ядра сетчатки. Рассчитайте частоту апоптоза следующим образом:
Частота апоптозных клеток = значение зеленой флуоресценции/значение синей флуоресценции x 100.
6. Вестерн-блоттинг 10
- Лечение лизисным буфером: измельчите и гомогенизируйте одну замороженную сетчатку 50 мкл холодного лизисного буфера (1 мл лизисного буфера, содержащего 5 мкл ингибитора фосфатазы, 1 мкл ингибитора протеазы и 5 мкл 100 мМ PMSF).
- При условии ультразвуковой обработки с частотой 28 кГц в течение 5 с на ледяной бане; Повторите 3 раза. Центрифугируйте при 4 °C в течение 5 минут при 10 000 x g для удаления клеточного мусора. Держите надосадочную жидкость.
- em>6.3Количественное определение белка: Определение концентрации белка с помощью набора реагентов для анализа белка BCA.
- em>6.4Электрофорез: Загрузить образец белка 50 мкг и разделить на 12% электрофорез полиакриламидного геля додецилсульфата натрия (SDS-PAGE).
- Перенос на мембрану: Электрофоретический перенос на мембраны из ПВДФ с использованием системы электрофоретического переноса.
- Подразделяйте мембраны: Подразделяйте мембраны и анализируйте каждый интересующий белок, β-актин и GAPDH из одного переноса.
- Блокировка: Заблокируйте мембраны на 1 ч в TBST, содержащем 5% обезжиренного молока комнатной температуры.
- Инкубация первичного антитела: инкубация с первичным антителом расщепленной каспазы-9 (разведение 1:200), расщепленной каспазы-3 (разведение 1:200), расщепленной каспазы-7 (разведение 1:200) и β-актина (разведение 1:1000) в течение ночи при 4 °C. Промойте мембраны с TBST в течение 5 минут, повторите 3 раза.
- Инкубируйте второе антитело: Инкубируйте с вторичными антителами, конъюгированными с пероксидазой хрена (1:2000) в течение 2 ч при комнатной температуре. Промойте мембраны с TBST в течение 5 минут, повторите 3 раза.
- Экспозиция: Визуализируйте меченые белки с помощью субстрата вестерн-блоттинга и, наконец, обнажите мембраны для визуализации белковых полос в автоматическом режиме экспозиции.
- Рассчитайте содержание белка7 , измерив плотность полосы белка.
7. Статистический анализ
- Проанализируйте данные с помощью программного обеспечения SPSS 19.0 и представьте их в виде среднего значения ± стандартного отклонения. Выполнение статистического анализа наблюдаемых значений с использованием одностороннего дисперсионного анализа. Примем p< 0,05 как статистически значимый.
Результаты
После окрашивания HE все слои сетчатки крыс контрольной группы имели четкую тканевую структуру, упорядоченное расположение клеток и равномерное окрашивание, при этом структура сетчатки крыс модельной группы была значительно повреждена, наружный слой сетчатки оказался тоньше, наружный ядерный слой был практически полностью интегрирован с внутренним стержневым слоем, расположение клеток в слое было крайне нарушено, Количество клеточных слоев было значительно уменьшено, а толщина фоточувствительного клеточного слоя и внешнего ядерного слоя стала значительно тоньше. Толщина наружного слоя сетчатки в контрольной и модельной группах составила 48% и 23% соответственно (p < 0,01; Рисунок 2).
Метод TUNEL показал, что в контрольной группе апоптотические клетки не были обнаружены, но в модельной группе было некоторое количество апоптотических клеток во внешнем ядерном слое крыс (p < 0,01), а положительное отношение TUNEL составило 9,6% (рис. 3).
Семейство белков каспаз является одним из основных семейств, осуществляющих апоптоз. Среди них расщепленная каспаза 3, расщепленная каспаза 7 и расщепленная каспаза 9 являются классическими индикаторами, используемыми для оценки клеточного апоптоза7. Результаты вестерн-блоттинга показали, что по сравнению с контрольной группой экспрессия расщепленной каспазы 3, расщепленной каспазы 7 и расщепленной каспазы 9 в сетчатке модельной группы была достоверно увеличена (p<0,01; Рисунок 4). Это указывает на то, что MNU может явно вызывать апоптоз клеток сетчатки.

Рисунок 1: Экспериментальный рабочий процесс. После внутрибрюшинного введения MNU в течение 7 дней (7d) была получена сетчатка сетчатки крыс, находящихся под наркозом, для окрашивания HE и TUNEL. Сокращения: MNU = N-метил-N-нитрозомочевина; HE = гематоксилин-эозин; TUNEL = терминальная дезоксинуклеотидилтрансфераза, опосредованная дезоксиуридинтрифосфат-дигоксигенином. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 2: Репрезентативные гистопатологические изображения окрашивания ПЭ на 7-й день после введения МНУ. (А) Окрашивание ПЭ через 7 дней (7d) после введения МНУ. (В) Соотношение наружной сетчатки. Данные представлены в виде среднего ± SD (n=6). Статистический анализ наблюдаемых значений был выполнен с использованием одностороннего дисперсионного анализа. ** p < 0,01 против контроля. Сокращения: GCL = слой ганглиозных клеток; IPL = внутренний плексиформный слой; INL = слой ядра; OPL = наружный плексиформный слой; ONL = внешний ядерный слой; PRL = фоторецепторный слой; MNU = N-метил-N-нитрозомочевина; HE = гематоксилин-эозин. n = 6. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 3: Анализ TUNEL показывает апоптоз фоторецепторов, индуцированный MNU у крыс. (A) Через 7 дней (7d) после введения MNU TUNEL-положительные клетки (зеленого цвета) были представлены в ONL у крыс, получавших MNU. (B) Положительное отношение TUNEL. Данные представлены в виде среднего ± SD (n=6). Статистический анализ наблюдаемых значений был выполнен с использованием одностороннего дисперсионного анализа. ** p < 0,01 против контроля. Сокращения: GCL = слой ганглиозных клеток; IPL = внутренний плексиформный слой; INL = слой ядра; OPL = наружный плексиформный слой; ONL = внешний ядерный слой; PRL = фоторецепторный слой; MNU = N-метил-N-нитрозомочевина; TUNEL = терминальная дезоксинуклеотидилтрансфераза, опосредованная дезоксиуридинтрифосфат-дигоксигенином. n = 6. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
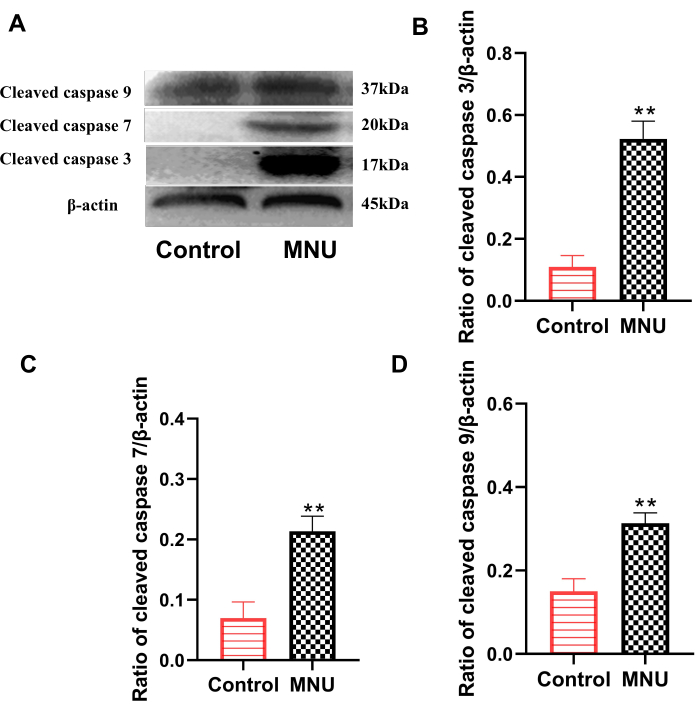
Рисунок 4: Экспрессия расщепленной каспазы 3, расщепленной каспазы 7 и расщепленной каспазы 9 в сетчатке крыс на 7-й день после введения MNU. (A) Репрезентативные данные по экспрессии расщепленной каспазы. (В) Соотношение расщепленных каспаз 3/β-актина. (В) Соотношение расщепленных каспаз 7/β-актин. (D) Соотношение расщепленных каспаз 9/β-актина. Данные представлены в виде среднего ± SD (n=6). Статистический анализ наблюдаемых значений был выполнен с использованием одностороннего дисперсионного анализа. ** p < 0,01 против контроля. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Обсуждение
РП является распространенным заболеванием сетчатки в клиниках. Начало, тяжесть и прогрессирование РП связаны с генами и генетическими модусами и зависят от окружающей среды 8,11. РП включает семейный РП и эпизодический РП, из которых семейный РП составляет около 60% пациентов. Путем отслеживания семейной генетической истории на сегодняшний день было идентифицировано 83 гена, связанных с РП, в то время как случайный РП составляет около 40%, что означает, что у этого типа пациентов отсутствует семейный анамнез и имеет нерегулярныйгенетический паттерн. Несмотря на то, что апоптоз фоторецепторных клеток сетчатки, вызывающий потерю зрительной функции у пациентов с РП, является общепризнанным, основной механизм гибели фоторецепторов при РП остается неясным 12,13,14. В связи с ограниченным доступом к ткани сетчатки человека, которая в основном получается при витрэктомии, экстракция ткани сетчатки от модельных животных до сих пор является распространенным методом в фундаментальных исследованиях РП14,15.
Сетчатка представляет собой прозрачную мембрану, расположенную во внутреннем слое глазной луковицы, со стекловидным телом внутри и сосудистой оболочкой, расположенной близко к внешней стороне. Сетчатка начинается от зубчатого края спереди и заканчивается у диска зрительного нерва сзади. Это начальная часть формирования видения16. Образцы сетчатки модельных животных в основном используются для ПЦР-анализа сетчатки, выявления вестерн-блоттинга, наблюдения патологической структуры тканей, иммуногистохимического окрашивания, иммунофлуоресцентного исследования, оценки плотности микрососудов, выделения и культивирования клеток и т.д.17,18. Требования к забору проб сетчатки для разных тестовых индексов различны. Отбор проб сетчатки для определения белкового фактора у модельных животных и отбор проб сетчатки для срезов с парафином являются распространенными операционными методами скрининга препаратов на RP8. Однако из-за очень тонкого и сложного строения глазного яблока модельного животного процесс удаления мешающих тканей в глазу и получения образцов сетчатки осложняется. В процессе забора проб может наблюдаться потеря ткани сетчатки, загрязнение, деградация белка и отслойка сетчатки. Эти факторы будут оказывать влияние на качество и количество экстракции белка сетчатки, а также на эффект окрашивания срезов и результаты определения экспериментальных показателей. Поэтому необходима соответствующая процедура забора образцов сетчатки.
Крайне важно упростить сложное и уловить ключевое звено сбора для того, чтобы усовершенствовать технику сбора сетчатки у модельных животных. Быстрое воздействие на сетчатку и полное удаление сетчатки, насколько это возможно, являются ключевыми этапами отбора проб сетчатки для определения белкового фактора у модельных крыс. В этом исследовании глазные яблоки извлекались непосредственно после анестезии, чтобы сэкономить время забора проб. Хитрость для обнажения сетчатки заключается в том, чтобы повернуть наглазник над трубкой объемом 1,5 мл, что было экономически выгодно и практично и могло полностью отслаить сетчатку от склеральной стенки. Эта процедура проста, быстра, экономична и способствует практике работы экспериментального персонала, поэтому ее можно завершить за 5 минут. В процессе забора образцов сетчатки для патологического исследования и специфического окрашивания клеток сохранение свежести и структурной целостности сетчатки является ключевым этапом для получения высококачественного окрашивания. Перфузия формальдегидом из левого предсердия с последующим получением сетчатки глаза – один из методов, который часто используют исследователи, но он трудоемкий, а формальдегид плохо пахнет и доставляет дискомфорт оператору. В этом исследовании ткань вокруг глазного яблока разделяется на кольцо после анестезии для поддержания его целостности. После того, как зрительный нерв был перерезан и сохранен, отделите ткани вокруг него на заднем полюсе глазного яблока и удалите глазное яблоко. Различные отделы глазного яблока были точно расположены вместе со зрительным нервом. Наконец, с опорой на содержимое глаза был сделан разрез, роговица была отрезана кольцом, хрусталик и стекловидное тело были отслалены, а также получена наглазница, соединяющая зрительный нерв (сетчатка расположена на склеральной стенке внутри наглазника). В этом процессе операция должна быть щадящей, чтобы сохранить целостность сетчатки. Процедура операции не только значительно улучшает скорость сбора материалов, но также может поддерживать полную нормальную структуру и форму глазного яблока и может быть точно локализована в различных частях глазного яблока после извлечения глазного яблока. После умелой операции операция может быть завершена за 8 минут. Используя вышеуказанные методы забора образцов сетчатки, наша исследовательская группа получила относительно идеальные результаты детекции белкового фактора, результаты окрашивания HE и результаты окрашивания TUNEL.
Несмотря на то, что существующий метод забора образцов сетчатки имеет некоторые преимущества, он все еще нуждается в совершенствовании. В процессе забора проб сетчатки для определения белкового фактора, после обнажения сетчатки, также существует риск неполного рассечения сетчатки или потери при взятии сетчатки путем сгибания пинцета из-за ограниченной точки опоры изгибающегося пинцета. Поэтому необходимо совершенствовать инструменты для диссекции сетчатки. С другой стороны, в процессе экстракции сетчатки для патологического исследования и специфического окрашивания клеток, после изоляции глазного яблока, в процессе стриппинга хрусталика и стекловидного тела, стенка глазного яблока разрушается из-за потери поддержки со стороны глаза, что легко вызвать стриппинг сетчатки. Таким образом, операция должна быть быстрой, щадящей и соответствующей силы, а оператор должен часто практиковаться. Таким образом, наши процедуры забора образцов сетчатки все еще нуждаются в совершенствовании, чтобы в большей степени способствовать исследованиям защитного эффекта и механизма традиционной медицины против РП.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Эта работа была поддержана Научно-исследовательским проектом Департамента высшего образования города Нинся (NYG2022029).
Материалы
| Name | Company | Catalog Number | Comments |
| Amersham Imager | GE | 680 | |
| Ammonium persulfate | Boster Biological Technology Co.,Ltd | A8090 | |
| Analytical Balance | Mettler Toledo | ME104E | |
| BCA protein quantization kit | Ken Gen Biotech. Co. Ltd | KGP902 | |
| cleaved caspase-3 antibody | Cell Signaling Technology | #9664 | |
| cleaved caspase-7 antibody | Cell Signaling Technology | #8438 | |
| cleaved caspase-9 antibody | Cell Signaling Technology | #9507 | |
| DeadEnd Fluorometric TUNEL System | Promega | G3250 | |
| Glycine | Boster Biological Technology Co.,Ltd | AR1200 | |
| Goat Anti-Rabbit IgG H&L (HRP) | Bioss Antibodies | bs-80295G-HRP | |
| Goat serum | Biosharp | BL210A | |
| High speed crusher | Thermo Fisher Scientific | AG22331 | |
| Immobilon-P SQ Transfer membranes | Merck Millipore. Ltd | ISEQ00010 | |
| Isoflurane | RWD Life Science | R510-22-10 | |
| Methanol | Chengdu Kelong Chemical Co., Ltd | 20230108 | |
| Microplate Reader | Thermo Fisher Scientific | 1510 | |
| Microscope | Olympus | IX73 | |
| Microscope slide | Citotest Labware Manufacturing Co., Ltd | 7105P-G | |
| Mini-PROTEAN Tetra | BIO-RAD | 1658001 | |
| N-Methyl-N-Nitrosourea | sigma-Aldrich | N4766–100G | |
| Oven | Shanghai Yuejin Medical Equipment Co., Ltd | DHG-8145 | |
| Page Pre-solution (30% ) | Doublehelix Biology Science and Technology Co.,Ltd | L3202A | |
| PageRuler Prestained Protein Ladder | Thermo Fisher Scientific | 26617 | |
| PBS buffer | Biosharp | G4202 | |
| SDS-PAGE Protein loading buffer (5×) | Beyotime Biotechnology | P0015 | |
| Skim milk powder | BioFroxx | 1172GR500 | |
| Sprague Dawley rats | Ningxia Medical University | SCXK (Ning) 2020-0001 | |
| TEMED | Boster Biological Technology Co.,Ltd | AR1165 | |
| Total protein extraction kit | Ken Gen Biotech. Co. Ltd | KGP2100 | |
| Trans-Blot Module | BIO-RAD | 1703935 | |
| Tris base | Boster Biological Technology Co.,Ltd | AR1162 | |
| Tweezer | Changde BKMAM Biotechnology Co., Ltd | 130302027 | |
| β-actin | Cell Signaling Technology | #4970 |
Ссылки
- Cehajic-Kapetanovic, J., et al. Association of a novel intronic variant in RPGR with hypomorphic phenotype of X-linked retinitis pigmentosa. JAMA Ophthalmol. 138 (11), 1151-1158 (2020).
- Pan, M. Y., et al. Mice deficient in UXT exhibit retinitis pigmentosa-like features via aberrant autophagy activation. Autophagy. 17 (8), 1873-1888 (2021).
- Xiong, Y. C., et al. 17β-Oestradiol attenuates the photoreceptor apoptosis in mice with retinitis pigmentosa by regulating N-myc downstream regulated gene 2 expression. Neuroscience. 452, 280-294 (2021).
- Zhang, S., et al. Müller cell regulated microglial activation and migration in rats with -Methyl--Nitrosourea-Induced retinal degeneration. Front Neurosci. 14, 606486 (2020).
- Karine, B., et al. Transferrin non-viral gene therapy for treatment of retinal degeneration. Pharmaceutics. 12 (9), 836 (2020).
- Yan, W. M., et al. Protection of retinal function and morphology in MNU-induced retinitis pigmentosa rats by ALDH2: an in-vivo study. BMC Ophthalmol. 20 (1), 55 (2020).
- Zhu, Y. F., et al. Lycium barbarum polysaccharides attenuates N-methy-N-nitrosourea-induced photoreceptor cell apoptosis in rats through regulation of poly (ADP-ribose) polymerase and caspase expression. J Ethnopharmacol. 191, 125-134 (2016).
- He, S. Q., et al. Effects and mechanisms of water-soluble Semen cassiae polysaccharide on retinitis pigmentosa in rats. Food Sci Technol. 40 (1), 84-88 (2020).
- Chen, Q., Cheng, Z. H., Hu, B. J. Current situation of vitreous and retinal related tissue specimens collection and application. Chinese J Ocular Fundus Dis. 36 (5), 396-399 (2020).
- Zhang, Y., et al. Salidroside modulates repolarization through stimulating Kv2.1 in rats. Eur J Pharmacol. 977, 176741 (2024).
- Deng, F. Y., Han, M. Y., Deng, T. T., Jin, M. Research progress of gene therapy for retinitis pigmentosa. Int Eye Sci. 21 (7), 1205-1208 (2021).
- Lin, B., Youdim, M. B. H. The protective, rescue and therapeutic potential of multi-target iron-chelators for retinitis pigmentosa. Free Radic Biol Med. 174, 1-11 (2021).
- Carullo, G., et al. Retinitis pigmentosa and retinal degenerations: deciphering pathways and targets for drug discovery and development. ACS Chem Neurosci. 11 (15), 2173-2191 (2020).
- Zhang, Z. J., et al. Quantification of microvascular change of retinal degeneration in Royal College of Surgeons rats using high-resolution spectral domain optical coherence tomography angiography. J Biomed Opt. 28 (10), 106001 (2023).
- Loiseau, A., Raîche-Marcoux, G., Maranda, C., Bertrand, N., Boisselier, E. Animal models in eye research: focus on corneal pathologies. Int J Mol Sci. 24 (23), 16661 (2023).
- Gregory-Evans, K. A review of diseases of the retina for neurologists. Handb Clin Neurol. 178, 1-11 (2021).
- Li, X. M., et al. Targeting long noncoding RNA-AQP4-AS1 for the treatment of retinal neurovascular dysfunction in diabetes mellitus. EBioMedicine. 77, 103857 (2022).
- Lee, D., et al. Retinal degeneration induced in a mouse model of ischemia-reperfusion injury and its management by pemafibrate treatment. FASEB J. 36 (9), e22497 (2022).
- Zhang, Q. L., Zhao, N., Li, Z. J. Effects of salidroside on retinopathy in diabetic rats based on COX-2/PGE2/VEGF pathway. J China Medical Uni. 52 (8), 731-935 (2023).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены