Method Article
Amostragem de danos na retina de ratos induzidos por N-metil-N-nitrosoureia e avaliação multiíndice de alterações patológicas
Neste Artigo
Resumo
Este protocolo descreve um procedimento para amostragem de retina em ratos e utilizando coloração de hematoxilina-eosina, ensaio TUNEL e Western blot para detectar alterações patológicas e apoptose na retina após injeção intraperitoneal de N-Metil-N-Nitrosourea.
Resumo
A retinopatia pode ser observada na maioria das doenças oculares e nas complicações tardias do diabetes mellitus. As células epiteliais pigmentares específicas e os danos e degeneração das células ópticas são as principais características da retinopatia. Muitos medicamentos tradicionais mostraram eficácia clínica substancial no tratamento da retinopatia. Como obter uma retina de forma rápida e completa é um passo fundamental na pesquisa da medicina tradicional para o tratamento da retinopatia. Neste estudo, pretendemos fornecer um procedimento padronizado e exercível para amostragem de danos na retina de ratos induzidos por N-metil-N-nitrosoureia (MNU) e avaliação multiíndice de alterações patológicas. Os ratos foram injetados por via intraperitoneal com 60 mg / kg de MNU uma vez para induzir danos à retina, e amostras de retina foram obtidas após 7 dias. Além disso, realizamos coloração de hematoxilina-eosina para avaliar alterações patológicas da retina. Determinação da taxa de apoptose e da proteína de apoptose por TUNEL e Western blot. Esses protocolos padronizados para amostragem de retina e avaliação de alterações patológicas são úteis para promover a exploração do mecanismo da retinopatia e a descoberta de ervas tradicionais novas e eficazes.
Introdução
A retinite pigmentosa (RP) é uma doença hereditária e ceganteda retina 1. A incidência de RP está entre 1/3500 e 1/5000, afetando a função visual de cerca de 2,5 milhões de pessoas no mundo. É uma das doenças mais conhecidas que levam à deficiência visual em seres humanos, impondo um fardo significativo a toda a sociedade2. A doença é caracterizada pela perda gradual da função das células epiteliais pigmentares da retina e pela apoptose progressiva dos fotorreceptores. No estágio inicial, os pacientes experimentam cegueira noturna, que se manifesta como defeitos no campo visual periférico e, eventualmente, leva à perda da visão central3. Portanto, a inibição da apoptose dos fotorreceptores retinianos é o ponto de referência para a prevenção e tratamento do FR.
A apoptose das células da retina é uma característica comum do RP humano e de animais modelo4. A injeção intraperitoneal de 60 mg/kg de N-metil-N-nitrosoureia (MNU) em ratos por 7 dias pode induzir apoptose e perda de células fotorreceptoras da retina, sendo um modelo animal comumente usado de RP 5,6. A análise das mudanças na estrutura patológica, apoptose celular específica e expressão proteica relacionada à apoptose do tecido retiniano em animais modelo pode fornecer dados experimentais eficazes e suporte teórico no estudo da patogênese do FR humano e drogas de triagem 7,8. Portanto, a qualidade das amostras de retina determina a confiabilidade dos dados experimentais. No entanto, devido à particularidade do tecido ocular, existem poucos relatos sobre como obter a retina de rato9.
Este artigo fornece um procedimento simples, rápido, padronizado e operável para amostragem de retina em ratos para superar as deficiências acima. A coloração de hematoxilina-eosina (HE), a coloração terminal mediada por desoxinucleotidil transferase de desoxiuridina trifosfato-digoxigenina (TUNEL) e o Western blot são usados para analisar as alterações patológicas no dano tecidual da retina e apoptose nos ratos. Todos os métodos são derivados da experiência do nosso grupo de pesquisa com os processos operacionais específicos.
Protocolo
Todos os protocolos e procedimentos cirúrgicos foram aprovados pelo Comitê de Ética da Universidade Médica de Ningxia (número de ética: NO. 2020-Q066). Ratos machos SPF Sprauge-Dawley (SD), com idade entre 7 e 8 semanas e pesando 200-220 g, foram adquiridos da Ningxia Medical University com o número de licença animal SCXK (Ning) 2020-0001. Todos os animais foram criados no Centro de Animais de Laboratório da Universidade Médica de Ningxia. A temperatura e a umidade eram adequadas, o ciclo de luz dia-noite era mantido e a comida e a água eram gratuitas e suficientes.
1. Preparo pré-operatório
- Preparação de materiais
- Prepare placas de ratos, dispositivos de anestesia inalatória, caixas embutidas, tubos de armazenamento congelados, luvas e máscaras cirúrgicas descartáveis, frascos de boca larga, paraformaldeído a 4%, compressas de gelo, tesouras oftálmicas, pinças oftálmicas, lâminas cirúrgicas e cabos de facas, tubos de microcentrífuga de 1,5 mL e esterilize-os com antecedência (ver Tabela de Materiais).
- Preparação animal
- Divida aleatoriamente 20 ratos SD machos em grupo modelo (n = 10) e grupo controle (n = 10). Injete 60 mg / kg de MNU em ratos modelo por via intraperitoneal e injete ratos controle por via intraperitoneal com o mesmo volume de solução salina.
- Após 7 dias de injeção, jejue os ratos e deixe-os beber livremente na noite anterior à amostragem.
- No dia seguinte, coloque o rato em decúbito dorsal na mesa cirúrgica e use uma máscara para administrar anestesia com isoflurano a 4% e oxigênio 2 L/min. Meça a profundidade da anestesia beliscando o centro do pé para observar as reações dos ratos.
2. Amostragem de retina para detecção de fator de proteína
- Fixe a órbita ocular do rato com a mão esquerda e remova o olho com força moderada com a mão direita usando uma pinça de flexão oftálmica. Coloque o globo ocular em uma posição sagital em um prato de vidro frio.
- Com a mão esquerda segurando uma pinça reta oftálmica para fixar o globo ocular e a mão direita segurando a lâmina cirúrgica, faça uma incisão longitudinal de 2 mm perto do local da lente.
- Corte a córnea com a tesoura oftálmica ao longo da incisão e retire suavemente a lente, o vítreo e a ocular exposta.
- Coloque a parte inferior da ocular na ponta do tubo de microcentrífuga de 1,5 mL, gire a ocular sobre o tubo e exponha a retina (a retina é amarela fraca).
- Remova toda a retina ao longo da parede escleral do globo ocular com uma pinça oftálmica dobrável, coloque-a em um tubo congelado e armazene-a em um tanque de nitrogênio líquido para uso futuro (Figura 1).
3. Amostragem de retina para exame patológico e coloração celular específica
- Com a mão esquerda, use a pinça para levantar o canto do olho do rato. Com a mão direita, use uma lâmina cirúrgica para cortar uma abertura de 4 mm ao longo do canto do olho do rato.
- Use a pinça para prender a borda do globo ocular na abertura da mão esquerda. Use uma tesoura oftálmica para cortar os tecidos circundantes ao longo da borda do globo ocular, prestando atenção à limpeza dos tecidos circundantes do globo ocular.
- Separe os tecidos ao redor do nervo óptico no pólo posterior do globo ocular com uma pinça, corte o nervo óptico e preste atenção para preservá-lo. Em seguida, remova o globo ocular.
- Lave o globo ocular removido em solução salina para remover o sangue restante, enrole-o em papel de filtro para absorver o excesso de água e coloque-o em papel alumínio frio.
- Fixe o olho com uma pinça oftálmica. Faça uma incisão longitudinal de 4 mm ao longo da junção da córnea e da retina com uma lâmina cirúrgica.
- Remova a córnea com uma tesoura oftálmica, faça um corte circular ao longo da incisão e remova suavemente o cristalino e o corpo vítreo.
- Coloque a ocular restante com um nervo óptico em uma caixa de incorporação e fixe-a em paraformaldeído a 4%.
- Incorpore amostras fixadas em paraformaldeído em parafina e corte em fatias de 4 μm para coloração HE e coloração TUNEL7.
4. Coloração HE da retina de rato
- Desparafinação e hidratação: Coloque as fatias em xileno por 10 min, repita o processo por mais 10 min, seguido de etanol absoluto por 5 min, repita o tratamento com etanol por mais 5 min, seguido de tratamento em álcool 95% por 5 min, depois em álcool 85% por 5 min e, finalmente, em álcool 75% por 5 min.
- Coloração de hematoxilina: Enxágue a fatia com água deionizada por 5 min. Use 100 μL de solução de coloração de hematoxilina e core por 5 min, enxágue com água deionizada por 5-10 s. Adicione 100 μL de etanol de ácido clorídrico a 1% por 30 s, enxágue com água deionizada por 20 min e adicione 100 μL de água com amônia a 0,2% por 1 min. Enxágüe com água deionizada por 5 min.
- Coloração de eosina: Use 100 μL de solução de coloração de eosina para corar por 5 min e enxágue com água deionizada por 30 s.
- Desidratação e vedação: Mergulhe as fatias em álcool 70% por 5 min, depois álcool 85% por 5 min, seguido de álcool 90% por 5 min e etanol absoluto por 5 min. Repita o tratamento com etanol absoluto por mais 5 min, depois mergulhe em xileno por 5 min e repita o processo por mais 5 min. Por fim, sele adicionando aproximadamente 100 μL de resina neutra à superfície das fatias e, em seguida, cubra-a com uma lamínula.
- Imagem das lâminas: Posicione as fatias coradas no microscópio, ajuste o foco do microscópio até que a imagem fique claramente visível, defina a ampliação em 400x e capture a imagem.
- Meça a espessura total da retina e a espessura externa da retina: Meça a espessura total da retina e a espessura externa da retina (espessura da camada nuclear externa e da camada fotorreceptora) e calcule a porcentagem de espessura externa da retina
Espessura externa da retina (%) = (espessura externa da retina/espessura total da retina) x 100.
5. Determinação da taxa de apoptose de células fotorreceptoras da retina com o método TUNEL
- Desparafinação e hidratação: Coloque as fatias em xileno por 10 min, repita o processo por mais 10 min, depois coloque em etanol absoluto por 5 min e repita esta etapa por mais 5 min. Realize a desidratação colocando álcool 95% por 5 min, álcool 90% por 5 min, álcool 80% por 5 min, álcool 70% por 5 min e enxágue com água deionizada por 5 min.
- Enxágüe com solução de cloreto de sódio a 0,85% por 5 min e PBS por 5 min. Fixe com paraformaldeído usando paraformaldeído a 4% por 15 min. Enxágue com PBS por 5 min e repita o processo por mais 5 min.
- Incubação e equilíbrio7: Incubar com solução de proteinase K 20 μg/mL para digestão por 15 min, equilibrar no tampão de equilíbrio por 10 min e incubar com tampão desoxinucleotidiltransferase terminal recombinante (rTdT) a 37 °C por 60 min.
- Reação de parada: Adicione 100 μL da solução padrão de citrato (2x solução SSC) por 15 min. Enxágue com PBS por 5 min e repita o processo por mais 5 min.
- Corante nuclear: Adicione 100 μL 4 ′, reagente 6-diamidina-2-fenindl (DAPI) por 5 min. Lave com água deionizada por 5 min e repita o processo por mais 5 min.
- Selar: Limpe o excesso de xileno ao redor das fatias e sele adicionando aproximadamente 100 μL de resina neutra à superfície das fatias e, em seguida, cubra-a com uma lamínula.
- Microscopia: Coloque as fatias coradas no microscópio, ajuste o foco do microscópio para uma visibilidade clara, defina a ampliação para 400x e capture a imagem. Observar a fluorescência verde a 520 ± 20 nm utilizando um filtro de fluorescência normalizado. Observe o DAPI azul a 460 nm.
- Calcule a taxa de apoptose: meça os valores de fluorescência verde e azul da camada externa do núcleo da retina. Calcule a taxa de apoptose como
Taxa de células de apoptose = valor de fluorescência verde/valor de fluorescência azul x 100.
6. Análise de Western blot 10
- Tratamento com tampão de lise: Pique e homogeneize uma retina congelada com 50 μL de tampão de lise fria (1 mL de tampão de lise contendo 5 μL de inibidor de fosfatase, 1 μL de inibidor de protease e 5 μL de 100 mM de PMSF).
- Sujeito a uma sonicação de 28 kHz por 5 s em banho de gelo; repita 3x. Centrifugue a 4 °C por 5 min a 10.000 x g para remover detritos celulares. Mantenha o sobrenadante.
- em>6.3Quantificação da proteína: Determinar a concentração de proteína utilizando um kit de reagentes para ensaio de proteína BCA.
- em>6.4Eletroforese: Carregar 50 μg de amostra de proteína e separar em eletroforese em gel de poliacrilamida de dodecil sulfato de sódio a 12% (SDS-PAGE).
- Transferência para a membrana: Transferência eletroforeticamente para membranas de PVDF usando um sistema de transferência eletroforética.
- Subdivida as membranas: Subdivida as membranas e analise cada proteína de interesse, β-actina e GAPDH a partir de uma única transferência.
- Bloqueio: Bloqueie as membranas por 1 h em TBST contendo 5% de leite desnatado à temperatura ambiente.
- Incubar anticorpo primário: Incubar com anticorpo primário de caspase-9 clivada (diluição 1:200), caspase-3 clivada (diluição 1:200), caspase-7 clivada (diluição 1:200) e β-actina (diluição 1:1000) durante a noite a 4 °C. Lave as membranas com TBST por 5 min, repita 3x.
- Incubar segundo anticorpo: Incubar com anticorpos secundários conjugados com peroxidase de rábano (1:2000) por 2 h à temperatura ambiente. Lave as membranas com TBST por 5 min, repita 3x.
- Exposição: Visualize as proteínas marcadas usando substrato de Western blot e, finalmente, exponha as membranas para visualizar as bandas de proteínas em um modo de exposição automática.
- Calcular o teor de proteínas7 medindo a densidade da banda de proteínas.
7. Análise estatística
- Analisar os dados utilizando o software SPSS 19.0 e apresentá-los como média ± desvio padrão. Realize análises estatísticas dos valores observados usando a análise de variância unidirecional. Tome p< 0,05 como estatisticamente significativo.
Resultados
Após a coloração HE, todas as camadas retinianas de ratos no grupo de controle tinham estrutura de tecido clara, arranjo celular ordenado e coloração uniforme, enquanto a estrutura retiniana de ratos no grupo modelo foi significativamente danificada, a camada retiniana externa era mais fina, a camada nuclear externa estava quase completamente integrada com a camada central interna, o arranjo das células na camada era extremamente desordenado, O número de camadas celulares foi significativamente reduzido e a espessura da camada celular fotossensível e da camada nuclear externa foi significativamente mais fina. A espessura da camada externa da retina no grupo controle e no grupo modelo foi de 48% e 23%, respectivamente (p < 0,01; Figura 2).
O método TUNEL mostrou que não foram detectadas células apoptóticas no grupo controle, mas havia algumas células apoptóticas na camada nuclear externa dos ratos no grupo modelo (p < 0,01), e a relação TUNEL-positivo foi de 9,6% (Figura 3).
A família de proteínas caspases é uma das principais famílias que executam a apoptose. Dentre eles, a caspase clivada 3, a caspase clivada 7 e a caspase clivada 9 são indicadores clássicos usados para avaliar a apoptose celular7. Os resultados do Western blot mostraram que, em comparação com o grupo controle, a expressão de caspase clivada 3, caspase clivada 7 e caspase clivada 9 na retina do grupo modelo foi significativamente aumentada (p<0,01; Figura 4). Isso indicou que o MNU pode causar claramente apoptose celular na retina.

Figura 1: O fluxo de trabalho experimental. Após injeção intraperitoneal de MNU por 7 dias (7d), a retina dos ratos anestesiados foi obtida para coloração HE e TUNEL. Abreviaturas: MNU = N-metil-N-nitrosourea; HE = hematoxilina-eosina; TUNEL = marcação terminal da extremidade em corte da desoxinucleotidil transferase mediada pela desoxiuridina trifosfato-digoxigenina. Clique aqui para ver uma versão maior desta figura.

Figura 2: Imagens histopatológicas representativas da coloração HE no dia 7 após a injeção de MNU. (A) Coloração HE em 7 dias (7d) após a administração de MNU. (B) Proporção retiniana externa. Os dados são apresentados como média ± DP (n=6). As análises estatísticas dos valores observados foram realizadas por meio de análise de variância unidirecional. ** p < 0,01 vs controle. Abreviaturas: GCL = camada de células ganglionares; IPL = camada plexiforme interna; INL = a camada do kernel; OPL = camada plexiforme externa; ONL = camada nuclear externa; PRL = camada fotorreceptora; MNU = N-metil-N-nitrosourea; HE = hematoxilina-eosina. n = 6. Clique aqui para ver uma versão maior desta figura.

Figura 3: O ensaio TUNEL mostra apoptose de fotorreceptores induzida por MNU em ratos. (A) Aos 7 dias (7d) após a injeção de MNU, células positivas para TUNEL (verde) foram apresentadas no ONL em ratos tratados com MNU. (B) Relação TUNEL-positiva. Os dados são apresentados como média ± DP (n=6). As análises estatísticas dos valores observados foram realizadas por meio de análise de variância unidirecional. ** p < 0,01 vs controle. Abreviaturas: GCL = camada de células ganglionares; IPL = camada plexiforme interna; INL = a camada do kernel; OPL = camada plexiforme externa; ONL = camada nuclear externa; PRL = camada fotorreceptora; MNU = N-metil-N-nitrosourea; TUNEL = marcação terminal da extremidade em corte da desoxinucleotidil transferase mediada pela desoxiuridina trifosfato-digoxigenina. n = 6. Clique aqui para ver uma versão maior desta figura.
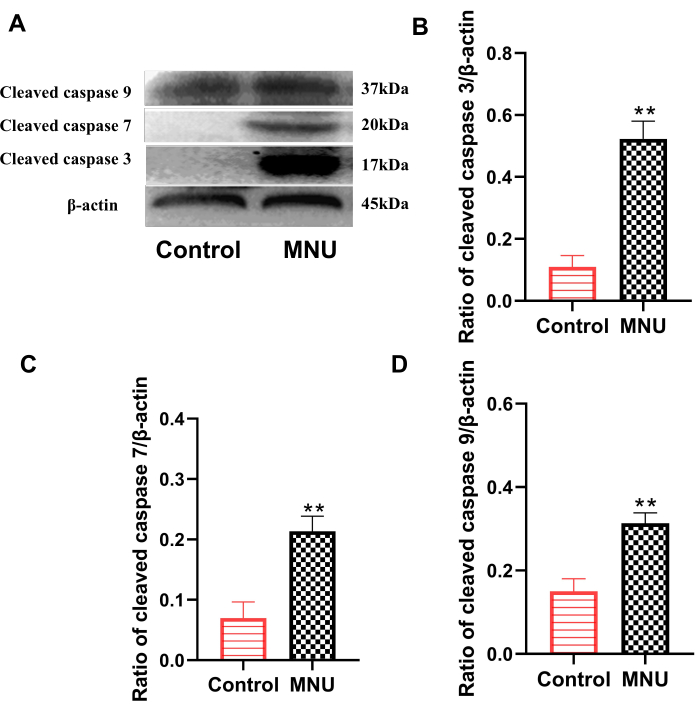
Figura 4: Expressão de caspase clivada 3, caspase clivada 7 e caspase clivada 9 em retinas de ratos no dia 7 após a injeção de MNU. (A) Dados representativos para a expressão de caspase clivada. (B) Proporção de caspase clivada 3/β-actina. (C) Proporção de caspase clivada 7/β-actina. (D) Proporção de caspase clivada 9/β-actina. Os dados são apresentados como média ± DP (n=6). As análises estatísticas dos valores observados foram realizadas por meio de análise de variância unidirecional. ** p < 0,01 vs controle. Clique aqui para ver uma versão maior desta figura.
Discussão
A RP é uma doença retiniana comum nas clínicas. O início, a gravidade e a progressão do FRy estão relacionados a genes e modos genéticos e são afetados pelo ambiente 8,11. A FR inclui FR familiar e FR ocasional, das quais a FR familiar é responsável por cerca de 60% dos pacientes. Por meio do rastreamento da história genética familiar, 83 genes relacionados ao RP foram identificados até o momento, enquanto o RP ocasional representa cerca de 40%, o que significa que esse tipo de paciente não tem histórico familiar e tem um padrão genético irregular2. Embora a apoptose das células fotorreceptoras da retina, causando a perda da função visual em pacientes com FRy, seja um reconhecimento geral, o mecanismo subjacente da morte dos fotorreceptores no FRy permanece obscuro 12,13,14. Devido ao acesso limitado ao tecido retiniano humano, que é obtido principalmente durante a vitrectomia, a extração de tecido retiniano de animais modelo ainda é um método comum na pesquisa básica de RP 14,15.
A retina é uma membrana transparente localizada na camada interna do bulbo do olho, com a cavidade vítrea interna e a membrana coróide próxima ao exterior. A retina começa na borda serrilhada na frente e termina no disco óptico na parte de trás. É a parte inicial da formação da visão16. Amostras de retina de animais modelo são usadas principalmente para análise de PCR da retina, detecção de Western blot, observação patológica da estrutura do tecido, coloração imuno-histoquímica, exame de imunofluorescência, avaliação da densidade microvascular, isolamento celular e cultura, etc.17,18. Os requisitos de amostragem de retina para diferentes índices de teste são diferentes. A amostragem de retina para detecção de fator de proteína em animais modelo e a amostragem de retina para seções embebidas em parafina são técnicas operacionais comuns para triagem de medicamentos para RP8. No entanto, devido à estrutura muito fina e complexa do globo ocular do animal modelo, o processo de remoção de tecidos interferentes no olho e obtenção de espécimes retinianos é complicado. Durante o processo de amostragem, pode haver perda de tecido retiniano, contaminação, degradação de proteínas e descolamento de retina. Esses fatores terão impacto na qualidade e quantidade da extração de proteínas da retina, bem como no efeito da coloração da seção e nos resultados de detecção de indicadores experimentais. Portanto, é necessário um procedimento apropriado de amostragem da retina.
É fundamental simplificar o complexo e compreender o elo chave da coleta para melhorar a técnica de coleta de retina em animais modelo. A exposição rápida da retina e a remoção completa da retina, tanto quanto possível, são as principais etapas da amostragem da retina para detecção do fator de proteína em ratos modelo. Neste estudo, os globos oculares foram extraídos diretamente após a anestesia para economizar tempo de amostragem. Um truque para expor a retina é girar a ocular sobre um tubo de 1,5 mL, que era econômico e prático e poderia descascar completamente a retina da parede escleral. Este procedimento de operação é simples, rápido, econômico e propício à prática experimental de operação de pessoal, para que possa ser concluído em 5 min. No processo de amostragem de retina para exame patológico e coloração celular específica, manter o frescor e a integridade estrutural da retina é uma etapa fundamental para obter uma coloração de alta qualidade. A perfusão com formaldeído do átrio esquerdo e a obtenção da retina é um dos métodos que os pesquisadores costumam usar, mas é demorada, e o formaldeído cheira mal e traz desconforto ao operador19. Neste estudo, o tecido ao redor do globo ocular é separado em um anel após a anestesia para manter sua integridade. Depois que o nervo óptico for cortado e retido, separe o tecido ao redor dele no pólo posterior do globo ocular e remova o globo ocular. Diferentes partes do globo ocular foram localizadas com precisão com o nervo óptico. Por fim, com o apoio do conteúdo ocular, foi feita a incisão, a córnea foi cortada em um anel, o cristalino e o vítreo foram retirados e a ocular que conecta o nervo óptico foi obtida (a retina está localizada na parede escleral dentro da ocular). Nesse processo, a operação deve ser suave para manter a integridade da retina. O procedimento de operação não apenas melhora muito a velocidade de coleta de materiais, mas também pode manter a estrutura e a forma normais completas do globo ocular e pode ser localizado com precisão nas diferentes partes do globo ocular após a retirada do globo ocular. Após uma operação habilidosa, a operação pode ser concluída em 8 min. Usando os métodos de amostragem de retina acima, nosso grupo de pesquisa obteve resultados de detecção de fator de proteína relativamente ideais, resultados de coloração HE e resultados de coloração TUNEL.
Embora o método atual de amostragem da retina tenha algumas vantagens, ele ainda precisa ser melhorado. No processo de amostragem da retina para detecção do fator de proteína, após a exposição da retina, também existe o risco de dissecção ou perda incompleta da retina ao retirar a retina por pinças de flexão devido ao ponto de suporte limitado das pinças de flexão. Portanto, é necessário aprimorar as ferramentas para a dissecção da retina. Por outro lado, no processo de extração da retina para exame patológico e coloração celular específica, após o isolamento do globo ocular, durante o processo de remoção do cristalino e do vítreo, a parede do globo ocular entrará em colapso devido à perda de suporte do olho, o que é fácil de causar remoção da retina. Assim, a operação precisa ser rápida, suave e de força adequada, e o operador precisa praticar com frequência. Portanto, nossos procedimentos de amostragem de retina ainda precisam ser aprimorados para promover a pesquisa sobre o efeito protetor e o mecanismo da medicina tradicional contra o RP em maior medida.
Divulgações
Os autores não têm nada a divulgar.
Agradecimentos
Este trabalho foi apoiado pelo Projeto de Pesquisa Científica do Departamento de Ensino Superior de Ningxia (NYG2022029).
Materiais
| Name | Company | Catalog Number | Comments |
| Amersham Imager | GE | 680 | |
| Ammonium persulfate | Boster Biological Technology Co.,Ltd | A8090 | |
| Analytical Balance | Mettler Toledo | ME104E | |
| BCA protein quantization kit | Ken Gen Biotech. Co. Ltd | KGP902 | |
| cleaved caspase-3 antibody | Cell Signaling Technology | #9664 | |
| cleaved caspase-7 antibody | Cell Signaling Technology | #8438 | |
| cleaved caspase-9 antibody | Cell Signaling Technology | #9507 | |
| DeadEnd Fluorometric TUNEL System | Promega | G3250 | |
| Glycine | Boster Biological Technology Co.,Ltd | AR1200 | |
| Goat Anti-Rabbit IgG H&L (HRP) | Bioss Antibodies | bs-80295G-HRP | |
| Goat serum | Biosharp | BL210A | |
| High speed crusher | Thermo Fisher Scientific | AG22331 | |
| Immobilon-P SQ Transfer membranes | Merck Millipore. Ltd | ISEQ00010 | |
| Isoflurane | RWD Life Science | R510-22-10 | |
| Methanol | Chengdu Kelong Chemical Co., Ltd | 20230108 | |
| Microplate Reader | Thermo Fisher Scientific | 1510 | |
| Microscope | Olympus | IX73 | |
| Microscope slide | Citotest Labware Manufacturing Co., Ltd | 7105P-G | |
| Mini-PROTEAN Tetra | BIO-RAD | 1658001 | |
| N-Methyl-N-Nitrosourea | sigma-Aldrich | N4766–100G | |
| Oven | Shanghai Yuejin Medical Equipment Co., Ltd | DHG-8145 | |
| Page Pre-solution (30% ) | Doublehelix Biology Science and Technology Co.,Ltd | L3202A | |
| PageRuler Prestained Protein Ladder | Thermo Fisher Scientific | 26617 | |
| PBS buffer | Biosharp | G4202 | |
| SDS-PAGE Protein loading buffer (5×) | Beyotime Biotechnology | P0015 | |
| Skim milk powder | BioFroxx | 1172GR500 | |
| Sprague Dawley rats | Ningxia Medical University | SCXK (Ning) 2020-0001 | |
| TEMED | Boster Biological Technology Co.,Ltd | AR1165 | |
| Total protein extraction kit | Ken Gen Biotech. Co. Ltd | KGP2100 | |
| Trans-Blot Module | BIO-RAD | 1703935 | |
| Tris base | Boster Biological Technology Co.,Ltd | AR1162 | |
| Tweezer | Changde BKMAM Biotechnology Co., Ltd | 130302027 | |
| β-actin | Cell Signaling Technology | #4970 |
Referências
- Cehajic-Kapetanovic, J., et al. Association of a novel intronic variant in RPGR with hypomorphic phenotype of X-linked retinitis pigmentosa. JAMA Ophthalmol. 138 (11), 1151-1158 (2020).
- Pan, M. Y., et al. Mice deficient in UXT exhibit retinitis pigmentosa-like features via aberrant autophagy activation. Autophagy. 17 (8), 1873-1888 (2021).
- Xiong, Y. C., et al. 17β-Oestradiol attenuates the photoreceptor apoptosis in mice with retinitis pigmentosa by regulating N-myc downstream regulated gene 2 expression. Neuroscience. 452, 280-294 (2021).
- Zhang, S., et al. Müller cell regulated microglial activation and migration in rats with -Methyl--Nitrosourea-Induced retinal degeneration. Front Neurosci. 14, 606486 (2020).
- Karine, B., et al. Transferrin non-viral gene therapy for treatment of retinal degeneration. Pharmaceutics. 12 (9), 836 (2020).
- Yan, W. M., et al. Protection of retinal function and morphology in MNU-induced retinitis pigmentosa rats by ALDH2: an in-vivo study. BMC Ophthalmol. 20 (1), 55 (2020).
- Zhu, Y. F., et al. Lycium barbarum polysaccharides attenuates N-methy-N-nitrosourea-induced photoreceptor cell apoptosis in rats through regulation of poly (ADP-ribose) polymerase and caspase expression. J Ethnopharmacol. 191, 125-134 (2016).
- He, S. Q., et al. Effects and mechanisms of water-soluble Semen cassiae polysaccharide on retinitis pigmentosa in rats. Food Sci Technol. 40 (1), 84-88 (2020).
- Chen, Q., Cheng, Z. H., Hu, B. J. Current situation of vitreous and retinal related tissue specimens collection and application. Chinese J Ocular Fundus Dis. 36 (5), 396-399 (2020).
- Zhang, Y., et al. Salidroside modulates repolarization through stimulating Kv2.1 in rats. Eur J Pharmacol. 977, 176741 (2024).
- Deng, F. Y., Han, M. Y., Deng, T. T., Jin, M. Research progress of gene therapy for retinitis pigmentosa. Int Eye Sci. 21 (7), 1205-1208 (2021).
- Lin, B., Youdim, M. B. H. The protective, rescue and therapeutic potential of multi-target iron-chelators for retinitis pigmentosa. Free Radic Biol Med. 174, 1-11 (2021).
- Carullo, G., et al. Retinitis pigmentosa and retinal degenerations: deciphering pathways and targets for drug discovery and development. ACS Chem Neurosci. 11 (15), 2173-2191 (2020).
- Zhang, Z. J., et al. Quantification of microvascular change of retinal degeneration in Royal College of Surgeons rats using high-resolution spectral domain optical coherence tomography angiography. J Biomed Opt. 28 (10), 106001 (2023).
- Loiseau, A., Raîche-Marcoux, G., Maranda, C., Bertrand, N., Boisselier, E. Animal models in eye research: focus on corneal pathologies. Int J Mol Sci. 24 (23), 16661 (2023).
- Gregory-Evans, K. A review of diseases of the retina for neurologists. Handb Clin Neurol. 178, 1-11 (2021).
- Li, X. M., et al. Targeting long noncoding RNA-AQP4-AS1 for the treatment of retinal neurovascular dysfunction in diabetes mellitus. EBioMedicine. 77, 103857 (2022).
- Lee, D., et al. Retinal degeneration induced in a mouse model of ischemia-reperfusion injury and its management by pemafibrate treatment. FASEB J. 36 (9), e22497 (2022).
- Zhang, Q. L., Zhao, N., Li, Z. J. Effects of salidroside on retinopathy in diabetic rats based on COX-2/PGE2/VEGF pathway. J China Medical Uni. 52 (8), 731-935 (2023).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados