Method Article
Fare Primer Kortikal Kültürlenmiş Nöronlarında Aksonal Yük Taşınımının Ölçülmesi
Bu Makalede
Özet
Mevcut protokol, aksonal taşıma için tüm analiz prosedürünü açıklamaktadır. Özellikle, duraklama hariç taşıma hızının hesaplanması ve açık erişimli yazılım "KYMOMAKER" kullanılarak görselleştirme yöntemi burada gösterilmektedir.
Özet
Nöronal hücreler, stereotipik olarak birkaç dendrit ve bir akson barındıran oldukça polarize hücrelerdir. Bir aksonun uzunluğu, motor proteinler tarafından verimli çift yönlü taşımayı gerektirir. Çeşitli raporlar, aksonal taşımadaki kusurların nörodejeneratif hastalıklarla ilişkili olduğunu öne sürmüştür. Ayrıca, çoklu motor proteinlerin koordinasyon mekanizması çekici bir konu olmuştur. Akson tek yönlü mikrotübüllere sahip olduğundan, hangi motor proteinlerin harekete dahil olduğunu belirlemek daha kolaydır. Bu nedenle, aksonal yükün taşınmasının altında yatan mekanizmaları anlamak, nörodejeneratif hastalıkların moleküler mekanizmasını ve motor proteinlerin düzenlenmesini ortaya çıkarmak için çok önemlidir. Burada, fare birincil kortikal nöronlarının kültürlenmesi, kargo proteinlerini kodlayan plazmitlerin transfeksiyonu ve duraklamaların etkisi olmadan yön ve hız analizleri dahil olmak üzere aksonal taşıma analizinin tüm sürecini tanıtıyoruz. Ayrıca, taşıma izlerini yönlerine göre vurgulamak ve aksonal taşımanın daha kolay görselleştirilmesini sağlamak için bir kymograf oluşturulmasını sağlayan açık erişimli yazılım "KYMOMAKER" tanıtıldı.
Giriş
Kinesin ailesi üyeleri ve sitoplazmik dynein, kargolarını taşımak için hücrelerdeki mikrotübüller boyunca hareket eden motor proteinlerdir1. Çoğu kinesin artı uca doğru hareket ederken, dynein bir mikrotübülün eksi ucuna doğru hareket eder. Nöronal aksonda yük taşımacılığının işlevleri ve mekanizmaları kapsamlı bir şekilde araştırılmıştır. Uzunlukları nedeniyle, aksonlar nöronların sağlığını korumak için stabil uzun mesafeli taşıma gerektirir. Mitokondri, otofagozomlar ve amiloid β protein öncüsü (APP) içeren veziküllerin taşınmasındaki kusurlar nörodejeneratif hastalıkların nedenleri olarak bildirilmiştir 2,3. Çok sayıda in vitro araştırma, motor proteinler tarafından koordineli taşınmanın altında yatan mekanizmaları ortaya çıkarmıştır ve saflaştırılmış motor proteinler ve mikrotübüller kullanılarak yapılan çeşitli çalışmalar, motor moleküllerin mikrotübüller boyunca nasıl hareket ettiğini ortaya çıkarmıştır 4,5. Tipik olarak, tek bir kargoda birden fazla motor bulunur6. Bununla birlikte, zıt motorların kargo taşımacılığının yönünü nasıl belirlediğine dair bazı modeller vardır. Biri "çağrışım/ayrışma modeli"; Bunda, tek yönlü taşıma sırasında kargo ile yalnızca tek yönlü motorlar ilişkilendirilir. İkincisinde, "koordinasyon modeli", her iki motor da aynı kargoya bağlanır ve motorun sadece bir tarafı etkinleştirilir. Üçüncü "halat çekme modelinde", kinesinler ve dyneinler arasındaki kuvvet dengesi taşıma yönünü belirler 7,8,9. Ek olarak, birkaç rapor, aktive edilmiş motor proteinlerin dengesinin ve sayısının, in vitro 8,10 kargo taşıma hızını etkilediğini öne sürmüştür.
Cevaplanmamış bir soru, kinesinlerin veya dyneinlerin bu aktivitelerinin canlı hücrelerde nasıl düzenlendiğidir. Önceki raporlar, aksonlarda mikrotübüllerin asetilasyonunu göstermiştir ve nörotrofik faktörler aksonal transportu arttırır11,12. Ayrıca, çeşitli kargo ve kargo adaptörleri, karşılık gelen şekillerde motor aktivatörleri olarak işlev görür13,14. Birçoğu taşıma veziküllerinin zarı ile ilişkilidir ve işlevleri, translasyon sonrası modifikasyonlar15 gibi sinyallerle düzenlenir. Bu nedenle, canlı hücrelerde taşıma yönünü ve hızını gözlemlemek, in vitro deneylerde kargo taşımacılığının moleküler düzenlemesi hakkında değerli bilgiler sunar. Aksonal taşımanın gözlemlenmesi, kinesin ve dynein bazlı taşımayı ayırt etmeyi sağlar. Aksonlar artı uçlu tek yönlü mikrotübülleri16 barındırdığından, kargo kinesinler tarafından anterograd olarak (yani soma'dan akson terminaline) ve dyneinler tarafından retrograd olarak (yani akson terminalinden soma'ya) taşınır.
Bu çalışmada, primer kültürlenmiş nöronlarda aksonal taşımayı gözlemlemek ve analiz etmek için bir yöntem tanımlanmıştır. Örnek olarak, membran proteinlerinin -APP, kalsintenin-1 / alcadein α (Alcα) ve kalsintenin-3 / alcadein β (Alcβ) içeren veziküllerin aksonal taşınmasını gözlemleme prosedürü açıklanmaktadır. Her ikisi de kinesin-1 17,18,19 tarafından taşınmasına rağmen, APP içeren veziküllerin anterograd taşınmasının, Alcα içeren veziküllerinkinden önemli ölçüde daha hızlı olduğu bilinmektedir. Önceki raporlarda, hızı ölçmek için çeşitli yöntemler kullanılmıştır. En değişken adım, taşıma sırasındaki duraklamaların ele alınmasıdır. Canlı hücrelerde, taşıma bazen mikrotübüller boyunca engeller tarafından engellenir; Bununla birlikte, motorlar duraklama olsun veya olmasın bir bölgeyi atlayabilir20. Daha uzun bir gözlem süresi boyunca hızın hesaplanması, duraklamadan etkilenebilir ve bu da daha yavaş bir hız tahminine neden olabilir. Burada, motorların fiziksel duraklamasının etkisini dışlamak için bölümlere ayrılmış (200 ms) bir süre boyunca hareket kullanan bir yöntem açıklanmaktadır. Son olarak, "KYMOMAKER"21 adlı açık erişimli (yalnızca Windows) bir yazılım programı tanıtıldı. Kymograflar, veziküler taşımayı görselleştirmek için yaygın olarak kullanılır ve bir film gerektirmeden her bir yükün taşıma yönünü görselleştirmek için kullanışlıdır. Yazılım, görüntülerin döndürülmesi sırasında birden çok kez tek boyutlu bir Watershed algoritması uygulayarak hızlandırılmış filmlerden kymograflar oluşturur. Bu, elde edilen kymograph'ın ince yapıları verimli ve kolay bir şekilde göstermesini sağlar. Ayrıca KYMOMAKER, parkurları yönlerine göre otomatik olarak algılar ve vurgular ve anlaşılması kolay diyagramların oluşturulmasını sağlar.
Protokol
Deneyler, Hokkaido Üniversitesi Hayvan Çalışmaları Komitesi tarafından ARRIVE (Hayvan Araştırmaları: İn Vivo Deneylerin Raporlanması) yönergelerine uygun olarak onaylandı. Bu çalışma için dişi C57BL / 6J fareleri (gebe, 15.5 gün) kullanıldı.
1. Fare birincil kortikal kültürlenmiş nöronlarının hazırlanması
- 0.1 M Tris (tris (hidroksimetil) aminometan) -HCl (pH 8.5) içinde 0.1 mg / mL poli-L-Lizin 8 oyuklu (No.1.0) cam tabanlı bir odaya ekleyin (bkz. Hazneyi 37 °C'lik bir inkübatörde en az 1 saat inkübe edin.
- Hazneyi en az üç kez sterilize su ile durulayın ve bir doku kültürü başlığında havayla kurutun.
- Gebe fareleri 15.5 günde servikal çıkık veya kurumsal olarak onaylanmış düzenlemelere uyarak sakit edin.
- Embriyoları içeren rahim boynuzunu sıkıştırın, tüm rahim boynuzlarını makas kullanarak izole edin ve buz üzerinde soğuk fosfat tamponlu tuzlu suya (PBS) batırın.
- Soğuk PBS'de, keskin cımbız kullanarak embriyoları izole edin ve embriyolardaki tüm amniyotik zarları çıkarın.
- Embriyoları tekrar taze soğuk PBS ile yıkayın.
NOT: Her izolasyon adımında, mümkün olduğunca fazla kanı yıkayın ve damarlara veya embriyolara zarar vermediğinizden emin olun. - Işık mikroskobu altında soğuk bir Petri kabında sterilize edilmiş bir gazlı bez üzerine bir embriyo yerleştirin.
- Beyni izole edin. Kavisli keskin cımbızın ucunu kullanarak embriyonun kafasını, derisini ve kafatasını kesin. Beynin üst ve yan kısımlarını ortaya çıkarmak için cildi ve kafatasını çıkarın.
- Cımbızın kavisli kısmını kullanarak tüm beyni çıkarın ve buz gibi soğuk 1x Hanks'in dengeli tuz çözeltisi (HBSS; 10 mM HEPES [pH 7.6], 5.3 mM KCl, 0.44 mM KH2PO4, 140 mM NaCl, 4.2 mM NaHCO3, 0.34 mM Na2HPO4, 39 mM D-glikoz, ve 0.5 μg / mL gentamisin; Malzeme Tablosuna bakınız).
- Gerekli sayıda beyin elde edilene kadar 1.7-1.9 adımlarını tekrarlayın.
NOT: Tipik olarak, beyin başına 5 x 106 ila 2 x 107 hücre elde edilebilir. - Soğuk 1x HBSS'de cımbız kullanarak korteks22'yi beyinden ayırın ve meninksleri korteksten yırtın.
- Korteksi soğuk 1x HBSS içeren yeni bir Petri kabına aktarın. Cerrahi bıçaklar kullanarak korteksi ikiye veya üçe bölün.
- Uç kesimli 1.000 μL uçlar kullanarak korteksi 15 mL'lik bir santrifüj tüpüne aktarın ve fazla 1x HBSS'yi çıkarın.
- 5 mL papain seyreltik çözeltisi (5 mg / mL D-glikoz, 0.2 mg / mL sığır serum albümini ve 0.2 mg / mL L-sistein 1x PBS'de; embriyo başına 100 ünite papain ve 200 μg deoksiribonükleaz I (DNaz I) ekleyin ve 37 ° C'lik bir su banyosunda 15 dakika inkübe edin. İnkübasyon sırasında her 5 dakikada bir tüpü ters çevirin.
NOT: Papainin papain seyreltik çözeltisi içinde ön inkübasyonu önerilir. 37 ° C'lik bir su banyosunda 5 dakika inkübe edin, ardından DNase I ekleyin. - Çözümü atın. 1x HBSS'ye 2 mL %20 ısıyla inaktive edilmiş at serumu (Malzeme Tablosuna bakınız) ekleyin. 1 dakika inkübe edin.
- Çözümü atın. Dokuyu 4 mL 1x HBSS ile iki kez durulayın.
- Çözümü atın. Kaplama ortamının embriyosu başına 0.5 mL ekleyin (% 2 B-27 takviyesi, 4 mM Glutamax,% 5 ısıyla inaktive edilmiş at serumu ve% 1x penisilin-streptomisin içeren nörobazal ortam; Malzeme Tablosuna bakınız).
NOT: 1.14-1.17 adımları sırasında, kesilen korteks parçaları onsuz tüpün dibine çöktüğü için santrifüjlemeye gerek yoktur. Aspiratör kullanmayın ve parçaları emmeyin. - 1.000 μL'lik bir kesik uç veya 10 mL pipetle 5 ila 10 kez çok nazikçe yeniden süspanse edin.
- 1.000 μL'lik bir uçla 10 kez çok nazikçe yeniden süspanse edin.
- Oda sıcaklığında (20-25 ° C) 250 × g'da 3 dakika santrifüjleyin.
- Süpernatanı çıkarın ve 10 kez 1.000 μL'lik bir uç kullanarak kaplama ortamının embriyosu başına 0.5 mL ile çok nazikçe yeniden süspanse edin.
- 50 mL'lik bir santrifüj tüpüne 40 μm'lik bir hücre süzgeci yerleştirin, ardından hücre süspansiyonunu yerçekimi akışıyla süzün. Filtrelenmiş hücre süspansiyonunu tüpte toplayın.
- Hücreleri ve plakayı, uygun hacimde kaplama ortamı ile 2 ×10 4 ila 5 ×10 4 hücre /cm2'de odalara sayın. Yoğunluğun bir örneği Ek Şekil 1'de gösterilmiştir.
- Gün içinde vitro (Böl.) 2'de, ortamın yarısını kültür ortamı (% 2 B-27 takviyesi, 4 mM Glutamax ve 1x penisilin-streptomisin içeren nörobazal ortam) ile değiştirin ve 5 μM 5-floro-2-deoksiüridin ekleyin (bkz.
- 4. Bölümden sonra, ortamın yarısını her 2 veya 3 günde bir kültür ortamıyla değiştirin.
2. Plazmitlerin kalsiyum fosfat yöntemi kullanılarak birincil kültürlenmiş nörona transfeksiyonu
NOT: Belirtilen hacimler, 8 oyuklu cam tabanlı bir haznede 0,8cm2'lik bir kuyu içindir (bkz. Malzeme Tablosu).
- 200 ng ila 2 μg bir plazmidi (pCAGGS'de APP-EGFP, pcDNA3.118'de Alcα-EGFP veya pcDNA3.1'de Alcβ-EGFP; bkz. Ek Tablo 1) floresan etiketli bir proteini, 6.2 μL 2 M CaCl2 ve sterilize edilmiş suyu kodlayarak 50 μL DNA / CaCl2 çözeltisi hazırlayın.
- 50 μL 2x HEPES tamponlu salin (HBS) yeni santrifüj tüplerine alın.
- 2x HBS çözeltisine 6.2 μL DNA / CaCl2 çözeltisi ekleyin. 10 kez pipetleyerek nazikçe karıştırın.
- Tüm DNA/CaCl2 çözeltisi aktarılana kadar adım 2.3'ü tekrarlayın.
- Oda sıcaklığında 15 dakika inkübe edin.
- Kültür ortamını cam tabanlı haznede toplayın ve antibiyotiksiz taze kültür ortamı ile değiştirin.
NOT: Toplanan besiyerini adım 2.10'a kadar hücre kültürü inkübatöründe tutun. - Nöronlara damla damla her kuyu başına 50 μL DNA / CaCl2 / HBS karışımı ekleyin. 1 saat boyunca kültür.
- Kuluçka sırasında, 37 ° C'de% 10 CO2 inkübatöre DMEM (Dulbecco'nun modifiye edilmiş Eagle's medium) / Ham's F-12 media içeren bir Petri kabı yerleştirerek asitlendirilmiş ortam hazırlayın.
- Transfeksiyonu takiben 1 saat inkübe ettikten sonra, birincil nöronları DMEM / Ham'ın F-12'si (asitleştirilmiş ortam) ile 3 kez durulayın.
- Ortamı, yarı toplanmış ortam ve yarı taze kültür ortamının bir karışımıyla değiştirin. 37 ° C ve% 5 CO2'de mikroskopi ile gözlemlenene kadar kültür.
3. Aksonal taşınımın gözlemlenmesi
- TIRF (toplam iç yansıma) mikroskobu (Malzeme Tablosuna bakınız) ile donatılmış odayı 37 °C'de önceden inkübe edin.
- CO2 kontrolörü donatılmışsa, kültür ortamı %5 CO2 altında gözlem ortamı olarak kullanılabilir. Donanımlı değilse, ortamı 15 mM Glutamax ve% 4 B-27 takviyesi ile birlikte verilen Leibovitz L-27 (malzeme tablosuna bakınız) gibi pH stabil bir ortamla değiştirin.
- Kesilmiş bir hücre bulun, ardından bir akson tanımlayın. Lazer tamamen yansıtılana kadar lazerin geliş açısını artırın. Ardından, aksondaki tüm veziküller görüntülenene kadar açıyı azaltın (pseudo-TIRF). 150 kare (30 sn) için 200 ms pozlama süresine sahip görüntüler elde edin.
NOT: Bu deneyde, tüm akson veziküllerini yakalamak için pseud-TIRF aydınlatması kullanıldı. Yüksek hızlı yakalama sistemleri ile donatılmış diğer mikroskoplar kullanılabilir.
NOT: Dosya adında her seferinde aksonun yönünü kaydedin. İlk akson segmentinin veya terminal akson alanının alanı gözlemden kaçınıldı.
4. Görüntü işleme
- Alınan görüntüleri MetaMorph yazılımını kullanarak açın (bkz.
- Araç çubuğunu açın > Mesafeyi ölç > kalibre et. "Tüm açık görüntülere uygula" seçeneğini etkinleştirin ve bir pikselin gerçek mesafesini girin.
- Araç çubuğunu açın > Görüntüle > Döndür. "Tüm uçaklar" onay kutusunu etkinleştirin. Akson yatay ve akson terminaline doğru yön sağa doğru olacak şekilde döndürün.
- Bölgeler > Araç çubuğunu açın > Bölgeler oluşturun. Kırpma için bölgenin boyutunu ayarlayın ve Oluştur'a tıklayın. Analiz için görüntüde görünen çerçeveyi akson alanına yerleştirin. Oluşturulan görüntü dizisini yığın dosyası olarak kaydedin.
NOT: Odaklanmamış akson veya kalıntı içermeyen alanları seçin. - Araç çubuğunu > Grafikleri > Görüntüle'yi açın. Ölçek çubuğunu damgalamak için Kalibrasyon çubuğu'nu seçin. Görüntülere zaman damgası eklemek için Veri/Zaman'ı seçin. "Tüm uçaklar"ı etkinleştirin. Nesneleri uygun alana taşıyın ve damgaya tıklayın.
- Film yapmak > Yığın > Araç çubuğunu açın. Uygun kare hızını girin ve AVI'yi seçin. Yeni bir dosya olarak kaydedin.
5. KYMOMAKER kullanarak bir kymograf çizmek ve izleri tespit etmek
- KYMOMAKER'ı indirin ( Malzeme Tablosuna bakın) ve KYMOMAKER klasöründe "Kymoanalysis.exe" dosyasını açın.
- Ana pencereleri göstermek için "kymoAnalysis.exe" açın (Şekil 1A). Dosya > Yükle'yi seçin ve oluşturulan AVI filmini açın. Bir "Önizleme" penceresi görünecektir (Şekil 1B).
- Kymograph Oluştur sekmesinin > kırpma bölümünde, kırpma için piksel numaralarını girin. Kırpma, kolay ayarlamaya izin vermek için hemen "Önizleme" penceresine yansıtılır (Şekil 1C). Ölçek çubuğunun ve zaman damgasının tamamının kaldırıldığını onaylayın.
- Kymografı oluşturmak için Oluştur düğmesine tıklayın (Şekil 1C). KYMOMAKER, "Önizleme" penceresinde her y eksenindeki en parlak pikseli algılar. Kymografı Dosya aracılığıyla kaydedin > Normal Kymograf > kaydedin.
- Kymograftaki düşük yoğunluklu izleri tespit etmek için Rotasyonel Kymograf'a tıklayın. "Rotasyonel Kymograf" bölümündeki sayıyı ayarlayın ve rotasyonel kymografa tıklayarak sonucu görüntüleyin (Şekil 1D).
NOT: "Dönme (derece)", Dönme Havzası algoritması21 için derecenin aralığıdır. Örneğin, 10°, Havza algoritmasının her 10°'de bir 36 kez gerçekleştirildiği ve sonuçların daha sonra "Rotasyonel Havza" penceresinde birleştirildiği anlamına gelir. - Kymograftaki anterograd ve retrograd izleri tespit etmek için, Algılama sekmesinde > Hedef bölümünde, Rotasyonel Kymograf oluşturulmamışsa orijinali seçin. Döndürme'yi seçerek, oluşturulan Dönme Havzası'nın izleri algılamak için kullanıldığından emin olun. "Algılama Yöntemi"nde Havza'yı seçin. İzleri otomatik olarak algılamak için Algıla düğmesine tıklayın.
NOT: Algılanan izler "Çalışıyor" penceresinde çizilir. "Maskeleme" özelliğini açmak, orijinal kymograf üzerinde izler çizer. - Algılama ve Filtreleme > Hız bölümüne bir sayı girerek anterograd > retrograd izleri tespit edin (Şekil 1E,F). 0,4 ila 7,0 μm/sn girerek anterograd izleri tespit edin. -0,4 ila -7,0 μm/s girerek retrograd izleri tespit edin.
NOT: En düşük hız ayarı, veziküllerin hareketsiz durumunun tanımına bağlıdır. Adım 6.7'ye bakın. - Dosyaları kaydedin.
6. Hızın belirlenmesi
- MetaMorph yazılımını açın.
NOT: ImageJ'deki "manuel izleme" eklentisi de hızları aynı şekilde hesaplayabilir. - Adım 4.4'te oluşturulan dosyayı açın. Kalibrasyonun görüntülere uyarlandığından emin olun.
- Araç çubuğunu > Uygulamalar > İzleme Noktaları'nı açın. Parça Ekle'ye tıklayın. Anterograd veya retrograd olarak taşınan hareketli bir vezikül bulun. Ardından, taşıma sona erene kadar tıklayarak vezikülü takip edin. Bitti'ye tıklayın.
- Tüm veziküller izlenene kadar adım 6.3'ü tekrarlayın.
- Bir CSV dosyasını açmak için günlüğü aç'a tıklayın. Ardından, CSV dosyasındaki verileri göstermek için günlük dosyasına tıklayın.
- CSV dosyasını kaydedin.
- Duraklamadan etkilenmeyen segmentli hızı hesaplamak için, "hız" sütununda 0,37 μm/s veya daha düşük hesaplanan hızları kaldırın.
NOT: Veziküller anormal difüzyonla çok kısa sürede hareket edebilir ve motor proteinler23 tarafından işlenmezler. Bu hareketlerin motor tahrikli hızların hesaplanmasına dahil edilmesini önlemek için, bu protokoldeki en düşük hız (1 piksel/200 ms) hesaplamadan çıkarılır. - Her beş karede bir segmentli ortalama hızı hesaplayın (toplam 1 s). Beşten az kare kaldıysa hızın son kısmını atın.
- Tüm ortalama hızları tek bir koşuldan birleştirin. Hız dağılımını görselleştirmeye yardımcı olmak için histogramlar oluşturun.
Sonuçlar
E15.5 fare korteksinden alınan birincil kültürlenmiş nöronlar, tarif edildiği gibi cam tabanlı bir tabakta kültürlendi. Örnek olarak, APP-EGFP, Alcα-EGFP veya Alcβ-EGFP, birincil kortikal nöronlarda eksprese edildi. APP ve Alcα'nın aksonda kinesin-1 2,17 ile taşındığı bilinmektedir. APP, adaptör protein JIP1 (JNK etkileşimli protein 1) aracılığıyla kinesin-1 ile ilişkilendirilirken, Alcα çift W-asidik motifleri aracılığıyla doğrudan bağlanır. Alcβ, Alcadein ailesinin bir üyesidir ve sadece bir W-asidik motifivardır 24. Her protein Div. 5 nöronlarına transfekte edildi ve transfeksiyondan 14-16 saat sonra TIRF mikroskobu kullanılarak her 200 ms'de bir görüntüler elde edildi. APP-EGFP, Alcα-EGFP veya Alcβ-EGFP (sırasıyla Ek Filmler 1-3) ile transfekte edilen nöronlarda aksonlarda birkaç hareketli vezikül gözlendi.
KYMOMAKER kullanılarak, Alcβ-EGFP için kymograflar, Rotasyonel Havza algoritması ile ve bu algoritma olmadan oluşturuldu (sırasıyla Şekil 1C,D). Ayrıca, KYMOMAKER, orijinal ve Watershed kymograflarından anterograd ve retrograd yönlerde izlerin çıkarılmasını sağlamıştır (Şekil 1E,F). Her iki kimografide de önemli izler tespit edildi. Orijinal yöntemle karşılaştırıldığında, Watershed algoritmasının uygulanması, düşük yoğunluklu izlerin daha iyi tespit edilmesini sağladı (Şekil 1F).
Her bir nörondaki veziküllerin hızları izlendi ve tarif edildiği gibi hesaplandı. APP-EGFP'nin hızı 3,05 ± 1,03 μm/s idi, bu da önceki sonuçlarlatutarlıdır 18,19. Alcα-EGFP, kinesin-1'in bildirilen hızıyla tutarlı olarak, APP'den önemli ölçüde daha yavaş olan 1.89 ± 0.77 μm / s hızında taşındı. Alcβ-EGFP'nin taşıma hızı 2.68 ± 1.07 μm/s idi, bu da Alcα ve APP'nin hızları arasında kaldı. Histogramlar, dağılımdaki farklılıkları göstermek için 0.2 μm/sn kutu genişliği kullanılarak oluşturuldu. Ayrıca, KYMOMAKER ile oluşturulan kymografları kullanarak taşıma yönünün nispi oranını hesapladık (Şekil 2A,B). Her üç protein de ağırlıklı olarak anterograd yönde taşındı (Şekil 2C).

Şekil 1: KYMOMAKER kullanarak algılama yönteminin iş akışı. (A) KYMOMAKER için ana pencerelerin ayarlanması. (B) Elde edilen film KYMOMAKER'da açıldı ve akson içermeyen alan "kırpılarak" çıkarıldı. (C) Oluştur'a tıklandığında orijinal kymograf oluşturuldu. (D) Rotasyonel Kymograf'a tıklamak yeni bir "Rotasyonel Kymograf" penceresi açtı ve algılama parametreleri (A)'daki üst iletişim kutusunda değiştirilebilir. (E) (C)'deki kimografiden her anterograd veya retrograd iz tespit edildi. Algılama parametreleri, (A) içindeki alt iletişim kutusunda değiştirilebilir. (F) (D)'den tespit edilen izler. Ölçek çubukları = 5 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
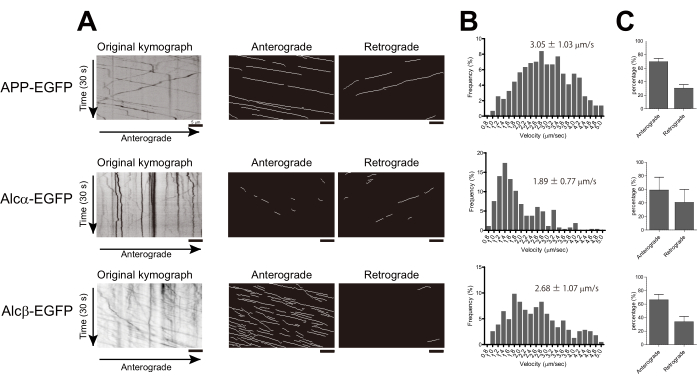
Şekil 2: Kinesin-1 ile taşınan veziküller için hız ve yönün hesaplanması. APP-EGFP, Alcα-EGFP veya Alcβ-EGFP, fare primer kortikal kültürlenmiş nöronlarının 4-6 bölümüne transfekte edildi ve aksonların görüntüleri transfeksiyondan 14-18 saat sonra elde edildi. (A) Aksonal transportun kymografları KYMOMAKER kullanılarak oluşturuldu. Solda: orijinal kymograf; orta: anterograd izler; Sağ: retrograd izler. (B) Anterograd taşıma hızının histogramları gösterilmiştir (APP-EGFP için n = 583, Alcβ-EGFP için n = 388, iki bağımsız deneyden Alcα-EGFP için n = 264.). Ortalama ± SD histogramlarda gösterilir. (C) Her bir yönde taşınan izlerin yüzdeleri gösterilir (her çubuk, her biri 6-10 hücre içeren bağımsız deneylerden elde edilen ortalama ± SD. n = 2'yi gösterir). Ölçek çubukları = 5 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Ek Şekil 1: Cam tabanlı çanak üzerinde birincil kültürlenmiş nöronun kültür yoğunluğu. Div. 1 fare birincil kortikal kültürlenmiş nöronlarının diferansiyel girişim kontrastı (DIC) görüntüsü, adım 1.23'teki gibi kaplanmıştır. Ölçek çubuğu = 50 μm. Bu Dosyayı indirmek için lütfen buraya tıklayın.
Ek Tablo 1: Bu protokolde kullanılan plazmitlerin yapıları. Bu dosyayı indirmek için lütfen buraya tıklayın.
Ek Film 1: APP-EGFP'nin aksonal taşınması. Film 30 saniye boyunca her 200 ms'de bir çekildi. Ölçek çubuğu = 5 μm. Bu Filmi indirmek için lütfen buraya tıklayın.
Ek Film 2: Alcα-EGFP'nin aksonal taşınması. Film 30 saniye boyunca her 200 ms'de bir çekildi. Ölçek çubuğu = 5 μm. Bu Filmi indirmek için lütfen buraya tıklayın.
Ek Film 3: Alcβ -EGFP'nin aksonal taşınması. Film 30 saniye boyunca her 200 ms'de bir çekildi. Ölçek çubuğu = 5 μm. Bu Filmi indirmek için lütfen buraya tıklayın.
Tartışmalar
Segmentli hızın hesaplanmasını ve kimografların oluşturulmasını içeren aksonal taşıma için bir analiz yöntemi açıklanmaktadır. Transfeksiyon adımı sırasında kritik bir adım, kültürlenmiş nöronların sağlığını korumaktır. Jiang ve Chen29 tarafından tarif edilen transfeksiyon yöntemi, küçük değişikliklerle takip edildi. DNA / CaCl2 çözeltisinin ve 2x HBS'nin nazikçe karıştırılması, çökeltilerin boyutunu azaltarak transfeksiyon verimliliğini artırdı. Çökeltilerin hücrelere zarar vermesini önlemek için, hücreler asitleştirilmiş bir ortamla durulandı. İnkübasyon olmadan hızlı durulamalar (iki veya üç kez), hücrelerden çökelmeyi gidermek için yeterliydi. Burada, kültürlenmiş birincil nöronu kullandık; Farelerde siyatik sinirlerde taşımanın konfokal mikroskopi ile gözlemlenebileceğini belirtmekte fayda var in vivo cerrahi26 ile, ve multifoton mikroskobunun son zamanlardaki gelişimi, fare beyinlerinde aksonal taşınmanın gözlemlenmesini sağlamıştır27.
Kimograflar, aksonal taşınmanın hızını ve yönünü görselleştirmek için yaygın olarak kullanılmaktadır. Fiji eklentisi KymographBuilder da dahil olmak üzere kymograf yapmak için çeşitli araçlar vardır. KymoAnalyzer veya Kymolyzer gibi bazıları, yarı manuel olarak atanan parçalardan parametreleri hesaplayabilir28,29. KYMOMAKER yazılımı izlerin atamasını değiştiremese de,21 yön başına izlerin kolay görselleştirilmesi avantajına sahiptir. Kırpma işlemini yönetir, algılama parametrelerini ayarlayarak kymograflar oluşturur ve izleri, talimatlara göre otomatik olarak çıkarır. Rotasyonel Havza yönteminin kullanılması, ince yapıların tespit edilmesini sağlar. İzlerin çoğu tespit edilebilse de, özellikle izlerin kesiştiği yerlerde, iki izin bağımsız mı yoksa geçici olarak bağlantısız mı olduğunu belirlemek zordu. Ayrıca, KYMOMAKER her bir izlemenin parametresinin hesaplanması için kullanılmaz. Anterograd ve retrograd iz sayımları için, tespit edilen izleri kırmızı çizgilerle maskeleyen "Kymograph" penceresinin kullanılması önerilir.
Bu hesaplama yöntemi, öngörülemeyen duraklamaların canlı hücreler üzerindeki etkisini dışlama avantajına sahiptir. Duraklamalar, diğer motorlar ve kargo gibi fiziksel engellerden ve tau20,30 gibi mikrotübül ile ilişkili proteinlerden kaynaklanabilir. Taşıma hızının hesaplanması çeşitli prosedürler kullanılarak gerçekleştirildi. Tipik olarak, duraklama da dahil olmak üzere taşınan mesafeyi belirlemek için daha uzun (birkaç saniyeden fazla) süreler kullanılır. Bununla birlikte, segmentlere ayrılmış (200 ms) periyotları kullanan bu protokol, hesaplamadaki duraklamaları daha verimli bir şekilde tanımlayabilir ve kaldırabilir. Bazı durumlarda, kargo hızı, ilgili motor proteinlerin farklı tiplerini veya durumlarını yansıtabilen Alcβ'daki durum gibi iki veya üç tepeli bir dağılım gösterdi. Bu nedenle, hızların dağılımını görselleştirmek için bir histogram oluşturulması önerilir ve bu daha doğru hesaplama yöntemi, tepe hızlarının daha net bir şekilde tahmin edilmesine katkıda bulunabilir.
Açıklamalar
Yazarların ifşa edecek hiçbir şeyi yok.
Teşekkürler
Bu çalışma KAKENHI (22K15270, Genç Bilim İnsanları için Yardım Hibesi) ve YS için Akiyama Yaşam Bilimleri Vakfı tarafından desteklenmiştir. Hokkaido Üniversitesi İleri Yaşam Bilimleri Fakültesi, Moleküler Hücre Dinamiği Laboratuvarı'ndan Dr. Masataka Kinjo ve Dr. Akira Kitamura'ya, araştırmaya büyük ölçüde yardımcı olan kritik girdi ve uzmanlık sağladıkları için şükranlarımızı sunarız. TIRF mikroskobu ile yapılan gözlem, Hokkaido Üniversitesi İleri Yaşam Bilimleri Fakültesi, Moleküler Hücre Dinamiği Laboratuvarı'na kurulan cihaz kullanılarak gerçekleştirildi. Araç, Hokkaido Üniversitesi, Yaratıcı Araştırma Kurumu, Küresel Tesis Merkezi (AP-100138) tarafından yönetilen Açık Tesis sistemine kayıtlıdır. Kyushu Üniversitesi, Bilgi Bilimleri ve Elektrik Mühendisliği Fakültesi, İleri Bilgi Teknolojileri Bölümü, İnsan Arayüzü Laboratuvarı'ndan Dr. Seiichi Uchida'ya Fukuoka Japonya'ya Kymomaker uygulaması ile yapılan montaj için teşekkür ederiz. Demans için İleri Önleme ve Araştırma Laboratuvarı, Farmasötik Bilimler Enstitüsü, Hokkaido Üniversitesi, Japan Medical Leaf co., Ltd. tarafından desteklenmektedir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 5-Fluoro-2-deoxyuridine | Sigma-Aldrich | F0503 | |
| Apo TIRF 100x/1.49 OIL | Nikon | ||
| B-27 Supplement (50x), serum free | Thermo fischer scientific | 17504044 | |
| Bovine serum albumin | Wako | 013-25773 | |
| CalPhos Mammalian Transfection Kit | Takara | 631312 | |
| Cell strainer 40 µm Nylon | Falcon | 352340 | |
| CoolSNAP HQ | Photometrics | ||
| Deoxyribonuclease I | Sigma-Aldrich | DN-25 | |
| D-Glucose | Wako | 041-00595 | |
| DMEM/Ham’s F-12 | Wako | 042-30555 | |
| Dumont No. 7 forceps | Dumont | No.7 | |
| Feather surgical blade | Feather | No.11 | |
| Feather surgical blade handle | Feather | No. 3 | |
| Gentamicin | Wako | 079-02973 | |
| Gentamicin Sulfate | Wako | 075-04913 | |
| GlutaMAX Supplement | Thermo fischer scientific | 35050061 | |
| HEPES | DOJINDO | 342-01375 | |
| Horse Serum, heat inactivated | Thermo fischer scientific | 26050088 | |
| KCl | Wako | 163-03545 | |
| KH2PO4 | Wako | 169-04245 | |
| KYMOMAKER | http://www.pharm.hokudai.ac.jp/shinkei/Kymomaker.html | ||
| L-15 Medium (Leibovitz) | Sigma-Aldrich | L5520 | |
| MetaMorph version 6.2r1 | Metamorph | ||
| Na2HPO4 | Wako | 197-02865 | |
| NaCl | Wako | 197-01667 | |
| NaHCO3 | Wako | 191-01305 | |
| Neurobasal Medium | Thermo fischer scientific | 21103049 | |
| Nikon ECLIPSE TE 2000-E | Nikon | ||
| Nunc Lab-Tek 8 well Chambered Coverglass | Thermo fischer scientific | 155411 | |
| Papain | Worthington | LS003126 | |
| Penicillin-Streptomycin (10,000 U/mL) | Thermo Fisher Scientific | 15140122 | |
| Poly-L-lysine hydrobromide | Sigma-Aldrich | P2636-500MG | |
| Trizma base | Merck | T1194-10PAK | solved with water to make 0.1 M Tris-HCl (pH.8.5) |
Referanslar
- Hirokawa, N., Noda, Y., Tanaka, Y., Niwa, S. Kinesin superfamily motor proteins and intracellular transport. Nature Reviews Molecular Cell Biology. 10 (10), 682-696 (2009).
- Stokin, G. B., et al. Axonopathy and transport deficits early in the pathogenesis of Alzheimer's diseases. Science. 307 (5713), 1282-1288 (2005).
- Guo, W., Stoklund Dittlau, K., vanden Bosch, L. Axonal transport defects and neurodegeneration: Molecular mechanisms and therapeutic implications. Seminars in Cell & Developmental Biology. 99, 133-150 (2020).
- Svoboda, K., Schmidt, C. F., Schnapp, B. J., Block, S. M. Direct observation of kinesin stepping by optical trapping interferometry. Nature. 365 (6448), 721-727 (1993).
- Carter, N. J., Cross, R. A. Mechanics of the kinesin step. Nature. 435 (7040), 308-312 (2005).
- Welte, M. A. Bidirectional transport along microtubules. Current Biology. 14 (13), R525-R537 (2004).
- Hendricks, A. G., et al. Motor coordination via a tug-of-war mechanism drives bidirectional vesicle transport. Current Biology. 20 (8), 697-702 (2010).
- Rezaul, K., et al. Engineered tug-of-war between kinesin and dynein controls direction of microtubule based transport in vivo. Traffic. 17 (5), 475-486 (2016).
- Encalada, S. E., Goldstein, L. S. B. Biophysical challenges to axonal transport: motor-cargo deficiencies and neurodegeneration. Annual Review of Biophysics. 43, 141-169 (2014).
- Monzon, G. A., et al. Stable tug-of-war between kinesin-1 and cytoplasmic dynein upon different ATP and roadblock concentrations. Journal of Cell Science. 133 (22), 226248(2020).
- Guo, W., et al. HDAC6 inhibition reverses axonal transport defects in motor neurons derived from FUS-ALS patients. Nature Communications. 8 (1), 861(2017).
- Tosolini, A. P., et al. BDNF-dependent modulation of axonal transport is selectively impaired in ALS. Acta Neuropathologica Communications. 10 (1), 121(2022).
- Verhey, K. J., Hammond, J. W. Traffic control: regulation of kinesin motors. Nature Reviews Molecular Cell Biology. 10 (11), 765-777 (2009).
- Fu, M. M., Holzbaur, E. L. F. Integrated regulation of motor-driven organelle transport by scaffolding proteins. Trends in Cell Biology. 24 (10), 564-574 (2014).
- Kumari, D., Ray, K. Phosphoregulation of kinesins involved in long-range intracellular transport. Frontiers in Cell and Developmental Biology. 10, 873164(2022).
- Wai Yau, K., et al. Cellular/molecular dendrites in vitro and in vivo contain microtubules of opposite polarity and axon formation correlates with uniform plus-end-out microtubule orientation. The Journal of Neuroscience. 36 (4), 1071-1085 (2016).
- Araki, Y., et al. The novel cargo Alcadein induces vesicle association of kinesin-1 motor components and activates axonal transport. The EMBO Journal. 26 (6), 1475-1486 (2007).
- Sobu, Y., et al. Phosphorylation of multiple sites within an acidic region of Alcadein α is required for kinesin-1 association and Golgi exit of Alcadein α cargo. Molecular Biology of the Cell. 28 (26), 3844-3856 (2017).
- Tsukamoto, M., et al. The cytoplasmic region of the amyloid β-protein precursor (APP) is necessary and sufficient for the enhanced fast velocity of APP transport by kinesin-1. FEBS Letters. 592 (16), 2716-2724 (2018).
- Ferro, L. S., Can, S., Turner, M. A., Elshenawy, M. M., Yildiz, A. Kinesin and dynein use distinct mechanisms to bypass obstacles. eLife. 8, e48629(2019).
- Chiba, K., Shimada, Y., Kinjo, M., Suzuki, T., Uchida, S. Simple and direct assembly of kymographs from movies using KYMOMAKER. Traffic. 15 (1), 1-11 (2014).
- Xu, S. -Y., Wu, Y. -M., Ji, Z., Gao, X. -Y., Pan, S. -Y. A modified technique for culturing primary fetal rat cortical neurons. Journal of Biomedicine and Biotechnology. 2012, 803930(2012).
- Han, D., et al. Deciphering anomalous heterogeneous intracellular transport with neural networks. eLife. 9, e52224(2020).
- Araki, Y., et al. Novel cadherin-related membrane proteins, Alcadeins, enhance the X11-like protein-mediated stabilization of amyloid beta-protein precursor metabolism. The Journal of Biological Chemistry. 278 (49), 49448-49458 (2003).
- Jiang, M., Chen, G. High Ca2+-phosphate transfection efficiency in low-density neuronal cultures. Nature Protocols. 1 (2), 695-700 (2006).
- Tosolini, A. P., Villarroel-Campos, D., Schiavo, G., Sleigh, J. N. Expanding the toolkit for in vivo imaging of axonal transport. Journal of Visualized Experiments. (178), e63471(2021).
- Takihara, Y., et al. In vivo imaging of axonal transport of mitochondria in the diseased and aged mammalian CNS. Proceedings of the National Academy of Sciences. 112 (33), 10515-10520 (2015).
- Neumann, S., Chassefeyre, R., Campbell, G. E., Encalada, S. E. KymoAnalyzer: a software tool for the quantitative analysis of intracellular transport in neurons. Traffic. 18 (1), 71-88 (2017).
- Basu, H., Ding, L., Pekkurnaz, G., Cronin, M., Kymolyzer Schwarz, T. L. a semi-autonomous kymography tool to analyze intracellular motility. Current Protocols in Cell Biology. 87 (1), 107(2020).
- Dixit, R., Ross, J. L., Goldman, Y. E., Holzbaur, E. L. F. Differential regulation of dynein and kinesin motor proteins by tau. Science. 319 (5866), 1086-1089 (2008).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır