Method Article
マウス初代皮質培養ニューロンにおける軸索カーゴ輸送の測定
要約
本プロトコルは、軸索輸送のための分析の全手順を説明しています。特に、一時停止を含まない輸送速度の計算方法と、オープンアクセスソフトウェア「KYMOMAKER」を用いた可視化手法を紹介します。
要約
ニューロン細胞は、ステレオタイプ的にいくつかの樹状突起と軸索を宿す高度に分極した細胞です。軸索の長さは、モータータンパク質による効率的な双方向輸送を必要とします。軸索輸送の欠陥が神経変性疾患と関連していることが示唆されている。また、複数のモータータンパク質が協調するメカニズムも魅力的なトピックでした。軸索には一方向の微小管があるため、どのモータータンパク質が運動に関与しているかを簡単に判断できます。したがって、軸索カーゴの輸送の根底にあるメカニズムを理解することは、神経変性疾患の分子メカニズムを明らかにし、モータータンパク質の制御に不可欠です。ここでは、マウス初代皮質ニューロンの培養、カーゴタンパク質をコードするプラスミドのトランスフェクション、一時停止の影響を受けない指向性解析と速度解析など、軸索輸送解析の全プロセスを紹介します。さらに、オープンアクセスソフトウェア「KYMOMAKER」を導入し、キモグラフを生成して輸送痕跡をその方向に応じて強調表示し、軸索輸送の可視化を容易にします。
概要
キネシンファミリーのメンバーと細胞質ダイニンは、細胞内の微小管に沿って移動してカーゴを輸送するモータータンパク質です1。ほとんどのキネシンはプラス端に向かって移動しますが、ダイニンは微小管のマイナス端に向かって移動します。ニューロン軸索における貨物輸送の機能とメカニズムは、広く研究されてきました。軸索はその長さのため、ニューロンの健康を維持するために安定した長距離輸送を必要とします。ミトコンドリア、オートファゴソーム、およびアミロイドβタンパク質前駆体(APP)を含む小胞の輸送の欠陥が神経変性疾患の原因として報告されています2,3。数多くのin vitro研究により、モータータンパク質による協調輸送のメカニズムが明らかになり、精製されたモータータンパク質や微小管を用いた様々な研究により、モーター分子が微小管に沿ってどのように移動するかが明らかになった4,5。典型的には、複数のモータが単一の貨物6に関与している。ただし、反対側のモーターが貨物輸送の方向を決定する方法には、いくつかのモデルがあります。1つは「関連付け/解離モデル」です。この場合、一方向の輸送中に貨物に関連付けられているのは一方向モーターのみです。2つ目の「コーディネーションモデル」では、両方のモーターを同じ貨物に取り付け、モーターの片側のみが作動します。第3の「綱引きモデル」では、キネシンとダイニンの間の力バランスが輸送の方向を決定する7,8,9。さらに、いくつかの報告では、活性化されたモータータンパク質のバランスと数がin vitroでの貨物輸送の速度に影響を与えることが示唆されています8,10。
未解決の問題は、キネシンまたはダイニンのこれらの活性が生細胞内でどのように制御されているかです。以前の報告では、軸索の微小管のアセチル化が示されており、神経栄養因子は軸索輸送を促進します11,12。また、様々なタイプのカーゴおよびカーゴアダプターは、対応する方法でモーターアクティベーターとして機能する13,14。多くは輸送小胞の膜に関連しており、その機能は翻訳後修飾などのシグナルによって調節されている15。したがって、生細胞内の輸送方向と輸送速度を観察することは、in vitro実験における貨物輸送の分子制御に関する貴重な洞察を提供します。軸索輸送の観察により、キネシンベースの輸送とダイニンベースの輸送を区別することができます。軸索はプラスエンドの一方向微小管16を抱いているため、貨物はキネシンによって順行性(すなわち、体細胞から軸索末端へ)に輸送され、ダイニンによって逆行性(すなわち、軸索末端から体細胞へ)輸送される。
本研究では、初代培養ニューロンにおける軸索輸送を観察・解析する方法について述べる。一例として、膜タンパク質の軸索輸送を観察する手順について説明すると、APP、カルシンテニン-1/アルカデインα(Alcα)、およびカルシンテニン-3/アルカデインβ(Alcβ)を含む小胞が記載されています。APP含有小胞の順行性輸送は、Alcα含有小胞のそれよりもかなり速いことが知られているが、両者はキネシン-1 17,18,19によって輸送される。以前のレポートでは、速度を測定するためにいくつかの方法が使用されてきました。最も変動しやすいステップは、輸送中の一時停止の処理です。生細胞では、微小管に沿った障害物によって輸送が妨げられることがあります。ただし、モータは、一時停止20の有無にかかわらず領域をバイパスすることができる。より長い観測時間での速度の計算は、一時停止の影響を受け、速度推定が遅くなる可能性があります。ここでは、モータの物理的な一時停止の影響を排除するために、セグメント化された(200ミリ秒)期間にわたる移動を使用する方法が説明されています。最後に、「KYMOMAKER」21と呼ばれるオープンアクセス(Windowsのみ)のソフトウェアプログラムを紹介します。キモグラフは、小胞輸送を可視化するために広く使用されており、動画を必要とせずに各貨物の輸送方向を視覚化するのに有用です。このソフトウェアは、画像の回転中に1次元の流域アルゴリズムを複数回適用することにより、タイムラプス動画からキモグラフを生成します。これにより、得られたキモグラフは、効率的かつ容易に微細な構造を示すことができます。さらに、KYMOMAKERは軌跡をその方向に応じて自動的に検出してハイライトし、わかりやすい図の作成を可能にします。
プロトコル
この実験は、ARRIVE(Animal Research: Reporting of In Vivo Experiments)ガイドラインに基づき、北海道大学動物研究委員会によって承認されました。本研究では、雌のC57BL/6Jマウス(妊娠15.5日)を使用しました。
1. マウス初代皮質培養ニューロンの作製
- 0.1 mL のポリ-L-リジンを 0.1 M Tris(トリス(ヒドロキシメチル)アミノメタン)-HCl(pH 8.5)に 8 ウェル(No.1.0)ガラス底チャンバーに添加します( 材料表を参照)。チャンバーを37°Cのインキュベーターで最低1時間インキュベートします。
- チャンバーを滅菌水で最低3回すすぎ、組織培養フードで風乾します。
- 子宮頸部脱臼によって、または制度的に承認された規制に従って、15.5日で妊娠マウスを犠牲にします。
- 胚を含む子宮角をつまみ、はさみを使用して子宮角全体を分離し、氷上の冷たいリン酸緩衝生理食塩水(PBS)に浸します。
- 冷たいPBSでは、鋭利なピンセットを使用して胚を分離し、胚からすべての羊膜を取り除きます。
- 胚を新鮮な冷たいPBSで再度洗います。
注:各分離ステップでは、できるだけ多くの血液を洗い流し、血管や胚を傷つけないように注意してください。 - 胚を冷たいペトリ皿の滅菌したガーゼに光学顕微鏡下で置きます。
- 脳を分離します。湾曲した鋭いピンセットの先端を使用して、胚の頭の皮膚と頭蓋骨を切断します。皮膚と頭蓋骨を切除して、脳の上部と側面を露出させます。
- ピンセットの湾曲部分を使用して脳全体をすくい取り、氷冷した1xハンクス平衡塩溶液(HBSS;10 mM HEPES [pH 7.6]、5.3 mM KCl、0.44 mM KH2PO4、140 mM NaCl、4.2 mM NaHCO3、0.34 mM Na2HPO4、39 mM D-グルコース、 および0.5μg/mLのゲンタマイシン。 資料の表を参照)。
- 必要な数のブレインが得られるまで、手順1.7〜1.9を繰り返します。
注:通常、脳あたり5 x 106 〜2 x 107 細胞を得ることができます。 - 冷たい1x HBSSでピンセットを使用して皮質22 を脳から分離し、皮質から髄膜を剥がします。
- 皮質を冷たい1x HBSSを含む新しいシャーレに移します。外科用ブレードを使用して、皮質を半分または3分の1に切ります。
- チップカット1,000 μLチップを使用して皮質を15 mL遠心チューブに移し、余分な1x HBSSを取り除きます。
- 胚100ユニットと200 μgのデオキシリボヌクレアーゼI(DNase I)を5 mLのパパイン希釈溶液(5 mg/mL D-グルコース、0.2 mg/mLウシ血清アルブミン、および0.2 mg/mL L-システイン1x PBS溶液中)で希釈した胚1個につき100 μgを加え、37°Cの水浴で15分間インキュベートします。インキュベーション中は5分ごとにチューブを反転させます。
注:パパイン希釈溶液でのパパインのプレインキュベーションが推奨されます。.37°Cの水浴中で5分間インキュベートし、DNase Iを添加します。 - 解決策を破棄します。20%熱不活化ウマ血清( 材料表を参照)を1x HBSSに2mL加えます。.1分間インキュベートします。
- 解決策を破棄します。4mLの1x HBSSで組織を2回すすいでください。
- 解決策を破棄します。プレーティング培地(2% B-27サプリメント、4 mMグルタマックス、5%熱不活化ウマ血清、および1xペニシリン-ストレプトマイシンを含む神経基礎培地)の胚あたり0.5 mLを添加します。
注:ステップ1.14-1.17では、切断された皮質片がチューブの底に沈むため、遠心分離は必要ありません。吸引器を使用したり、破片を吸い上げたりしないでください。 - 1,000 μLチップまたは10 mLピペットをカットして、非常に穏やかに再懸濁します。
- 1,000 μLのチップで10回、非常に穏やかに再懸濁します。
- 250 × g 、室温(20-25°C)で3分間遠心分離します。
- 上清を取り除き、1,000 μLのチップを使用して、プレーティング培地の胚あたり0.5 mLで非常に穏やかに再懸濁します。
- 50 mLの遠心チューブに40 μmの細胞ストレーナーを置き、重力流によって細胞懸濁液をろ過します。ろ過した細胞懸濁液をチューブに集めます。
- 細胞とプレートを2 ×10 4 〜5 × 104 細胞/cm2でチャンバーにカウントし、適切な量のめっき培地を使用します。密度の例を 補足図1に示します。
- Day-in-vitro(Div.)2で、培地の半分を培地(2% B-27サプリメント、4 mMグルタマックス、および1xペニシリン-ストレプトマイシンを含む神経基礎培地)に交換し、5 μMの5-フルオロ-2-デオキシウリジンを加えます( 材料の表を参照)。
- Div.4以降は、2〜3日ごとに培地の半分を培地と交換してください。
2. リン酸カルシウム法による初代培養ニューロンへのプラスミドのトランスフェクション
注:記載されている容量は、8ウェルガラス底チャンバー内の0.8 cm2 ウェル用です( 材料の表を参照)。
- 200 ng〜2 μgのプラスミド(pCAGGSのAPP-EGFP、pcDNA3.118のAlcα-EGFP、またはpcDNA3.1のAlcβ-EGFP;補足表1を参照)をコードする蛍光タグ付きタンパク質、6.2 μLの2 M CaCl2、および滅菌水を混合して、50 μLのDNA/CaCl2溶液を調製します。
- 50 μL の 2x HEPES 緩衝生理食塩水 (HBS) を新しい遠心チューブに分注します。
- 6.2 μL の DNA/CaCl2 溶液を 2x HBS 溶液に加えます。ピペッティングで10回やさしく混ぜます。
- すべてのDNA/CaCl2 溶液が移管されるまで、ステップ2.3を繰り返します。
- 室温で15分間インキュベートします。
- ガラス底のチャンバーに培地を回収し、抗生物質を含まない新鮮な培地と交換します。
注:収集した培地は、ステップ2.10まで細胞培養インキュベーターに保管してください。 - DNA/CaCl2/HBS混合物50 μLをウェルごとにニューロンに滴下します。1時間培養します。
- インキュベーション中に、DMEM(ダルベッコの改変イーグル培地)/ハムのF-12培地を含むシャーレを37°Cの10%CO2 インキュベーターに入れて酸性化培地を調製します。
- トランスフェクション後1時間インキュベートした後、DMEM/HamのF-12(酸性化培地)で初代ニューロンを3回すすぎます。
- 培地を、半分採取した培地と半分新鮮な培地の混合物と交換します。37°Cおよび5%CO2の顕微鏡観察まで培養します。
3. 軸索輸送の観察
- TIRF(全内部反射率)顕微鏡( 材料の表を参照)を備えたチャンバーを37°Cでプレインキュベートします。
- CO2コントローラーが装備されている場合、培養液は5%CO2以下の観察培地として使用できます。装備されていない場合は、4 mMグルタマックスと2%B-27サプリメントが付属しているLeibovitz L-15(材料表を参照)などのpH安定な培地と交換してください。
- トランスフェクションされた細胞を見つけ、軸索を同定します。レーザーが完全に反射するまで、レーザーの入射角を大きくします。次に、軸索内のすべての小胞が視覚化されるまで角度を小さくします(疑似TIRF)。露光時間が 200 ミリ秒、150 フレーム (30 秒) で画像を取得します。
注:この実験では、pseud-TIRF照明を使用して、すべての軸索小胞を捕捉しました。その他、高速捕捉システムを搭載した顕微鏡も使用可能です。
注:ファイル名には毎回軸索の方向を記録してください。最初の軸索セグメントまたは末端軸索領域の領域は、観察から回避されました。
4. 画像処理
- 取得した画像をMetaMorphソフトウェアで開きます( 材料表を参照)。
- ツールバーを開きます > 測定 > 距離を調整します。「開いているすべての画像に適用」を有効にし、ピクセルの実際の距離を入力します。
- ツールバー>ディスプレイ>回転を開きます。「すべての平面」のチェックボックスを有効にします。軸索が水平になり、軸索終末に向かう方向が右になるように回転させます。
- ツールバー>リージョン>リージョンの作成を開きます。クリッピングの領域のサイズを設定し、[作成]をクリックします。画像に表示されるフレームを軸索領域に配置して分析します。生成された画像シーケンスをスタックファイルとして保存します。
注意: 焦点が合っていない軸索や破片が含まれていない領域を選択します。 - ツールバー>ディスプレイ>グラフィックを開きます。[キャリブレーションバー]を選択して、スケールバーをスタンプします。[データ/時刻] を選択して、画像にタイムスタンプを追加します。「すべての平面」を有効にします。オブジェクトを適切なスペースに移動し、スタンプをクリックします。
- ツールバーを開きます>スタック>ムービーを作成します。適切なフレームレートを入力し、AVIを選択します。新しいファイルとして保存します。
5. KYMOMAKERを使用したキモグラフの描画とトレースの検出
- KYMOMAKERをダウンロードし( 資料表参照)、KYMOMAKERフォルダ内の「Kymoanalysis.exe」を開いてください。
- 「kymoAnalysis.exe」を開いてメインウィンドウを表示します(図1A)。 [ファイル] > [読み込み ] を選択し、作成した AVI ムービーを開きます。「プレビュー」ウィンドウが表示されます(図1B)。
- [Generate Kymograph] タブの [トリミング] セクションで、トリミング>ピクセル番号を入力します。トリミングはすぐに「プレビュー」ウィンドウに反映されるため、簡単に調整できます(図1C)。縮尺記号とタイム スタンプ全体が削除されたことを確認します。
- Generateボタンをクリックして、キモグラフを生成します(図1C)。KYMOMAKERは、「プレビュー」ウィンドウの各y軸内で最も明るいピクセルを検出します。[ファイル] > [通常のキモグラフ>保存] を使用してキモグラフを保存します。
- キモグラフ内の低強度トレースを検出するには、 Rotational Kymographをクリックします。「Rotational Kymograph」セクションの数値を調整し、 回転キモグラフ をクリックして結果を表示します(図1D)。
注:「回転(度)」は、回転流域アルゴリズム21の度の間隔です。たとえば、10° は、Watershed アルゴリズムが 10° ごとに 36 回実行され、その結果が [Rotational Watershed] ウィンドウで結合されることを意味します。 - キモグラフで順行性および逆行性のトレースを検出するには、[ 検出 ]タブ> [ターゲット ]セクションで、回転キモグラフが生成されていない場合は [オリジナル ]を選択します。 [回転] を選択して、作成した回転流域がトレースの検出に使用されることを確認します。「検出方法」で 流域 を選択します。 [検出 ]ボタンをクリックすると、トレースが自動的に検出されます。
注:検出されたトレースは、「作業中」ウィンドウに描画されます。「マスキング」をオンにすると、元のキモグラフにトレースが描画されます。 - [ Detection > Filtering > Velocity ]セクションに番号を入力して、順行性および逆行性のトレースを検出します(図1E、F)。0.4〜7.0μm / sを入力して順行性トレースを検出します。-0.4〜-7.0μm/sを入力して逆行性トレースを検出します。
注意: 最低速度の設定は、小胞の不動状態の定義によって異なります。ステップ 6.7 を参照してください。 - ファイルを保存します。
6. 速度の決定
- MetaMorphソフトウェアを開きます。
注:ImageJの「手動追跡」プラグインも同じ方法で速度を計算できます。 - 手順4.4で作成したファイルを開きます。キャリブレーションが画像に適合していることを確認します。
- ツールバー>アプリ>トラックポイントを開きます。[トラックの追加]をクリックします。順行性または逆行性に輸送された移動小胞を見つけます。次に、トランスポートが終了するまでクリックして小胞を追跡します。「完了」をクリックします。
- すべての小胞が追跡されるまで、手順6.3を繰り返します。
- [ログを開く]をクリックして、CSVファイルを開きます。次に、ログファイルをクリックして、CSVファイルにデータを表示します。
- CSV ファイルを保存します。
- 一時停止の影響を受けずにセグメント化された速度を計算するには、「速度」列で計算された速度0.37μm/s以下を削除します。
注:小胞は異常な拡散によって非常に短時間で移動することができ、それらはモータータンパク質23によって処理されない。これらのモーションをモーター駆動速度の計算に含めないように、このプロトコルの最低速度 (1 ピクセル/200 ミリ秒) は計算から削除されます。 - セグメント化された平均速度を 5 フレームごと (合計 1 秒) で計算します。残りフレームが 5 フレーム未満の場合は、速度の最後の部分を破棄します。
- 1つの条件からすべての平均速度を組み合わせます。ヒストグラムを生成して、速度の分布を視覚化します。
結果
E15.5マウス皮質からの初代培養ニューロンを、記載したようにガラス底皿で培養した。一例として、APP-EGFP、Alcα-EGFP、またはAlcβ-EGFPが一次皮質ニューロンに発現しました。APPとAlcαは、キネシン-1 2,17によって軸索に輸送されることが知られています。APPはアダプタータンパク質JIP1(JNK相互作用タンパク質1)を介してキネシン-1と会合し、Alcαは二重のW酸性モチーフを介して直接結合します。Alcβはアルカデインファミリーの一員であり、W-酸性モチーフ24を1つだけ持っています。各タンパク質をDiv.5ニューロンにトランスフェクションし、トランスフェクション後14-16時間後にTIRF顕微鏡を用いて200msごとに画像を取得しました。APP-EGFP、Alcα-EGFP、またはAlcβ-EGFPのいずれかをトランスフェクトしたニューロンでは、軸索内のいくつかの移動小胞が観察されました(それぞれ補足動画1-3)。
KYMOMAKERを使用して、Alcβ-EGFPのキモグラフを回転流域アルゴリズムの有無で生成しました(それぞれ図1C、D)。さらに、KYMOMAKERは、元のキモグラフと流域キモグラフから順行性および逆行性の痕跡を抽出することを可能にしました(図1E、F)。主要な痕跡は両方のキモグラフで検出されました。元の方法と比較して、Watershedアルゴリズムを適用すると、低強度のトレースをより適切に検出できました(図1F)。
各ニューロンの小胞の速度を追跡し、説明に従って計算した。APP-EGFPの速度は3.05±1.03μm/sであり、これは以前の結果18,19と一致しています。Alcα-EGFPは1.89±0.77μm/sの速度で輸送されましたが、これはAPPよりもかなり遅く、キネシン-1の報告された速度と一致していました。Alcβ-EGFPの輸送速度は2.68±1.07μm/sで、Alcαの速度とAPPの速度の中間に位置し、0.2μm/sのビン幅を使用してヒストグラムを生成し、分布の違いを示しました。さらに、KYMOMAKERで生成したキモグラフを用いて、輸送方向の相対比率を計算しました(図2A,B)。3つのタンパク質はすべて、主に順行性方向に輸送されました(図2C)。

図1:KYMOMAKERを用いた検出方法のワークフロー(A) KYMOMAKERのメインウィンドウの設定。(B)取得した動画をKYMOMAKERで開き、軸索が入らなかった部分を「トリミング」で除去しました。(C) generateをクリックすると、元のキモグラフが生成されました。(D) Rotational Kymograph をクリックすると、新しい「Rotational Kymograph」ウィンドウが開き、(A)の上部ダイアログボックスで検出パラメータを変更できるようになりました。(E)各順行性または逆行性のトレースは、(C)のキモグラフから検出されました。検出パラメータは、(A)の下部のダイアログボックスで変更できます。(F)(D)から検出されたトレース。スケールバー = 5 μm. この図の拡大版を表示するには、ここをクリックしてください。
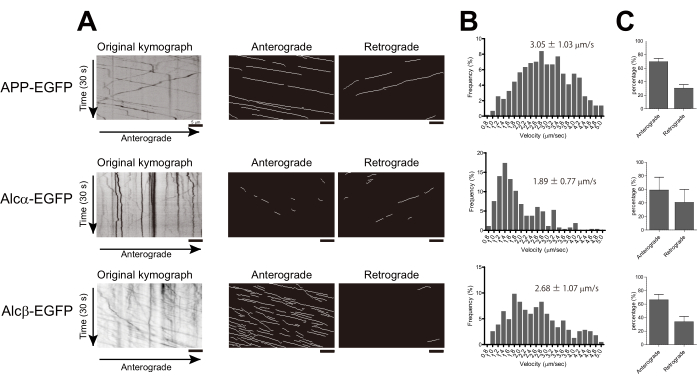
図2:キネシン-1輸送小胞の速度と方向の計算。 APP-EGFP、Alcα-EGFP、またはAlcβ-EGFPをマウス初代皮質培養ニューロンのDiv.4-6にトランスフェクションし、トランスフェクションの14-18時間後に軸索の画像を取得しました。(A)軸索輸送のキモグラフは、KYMOMAKERを使用して作成しました。左:オリジナルのキモグラフ。中央:前向性の痕跡。右:逆行性の痕跡。(B)前行性輸送の速度のヒストグラムが示されています(2つの独立した実験から、APP-EGFPはn=583、Alcβ-EGFPはn=388、Alcα-EGFPはn=264)。平均±SDはヒストグラムに表示されます。(C)各方向に輸送されたトレースの割合が示されています(各バーは、それぞれが6〜10個の細胞を含む独立した実験からの平均±SD.n = 2を示しています)。スケールバー = 5 μm. この図の拡大版を表示するには、ここをクリックしてください。
補足図1:ガラス底皿上の初代培養ニューロンの培養密度。 ステップ1.23のように、Div.1マウスの一次皮質培養ニューロンの微分干渉コントラスト(DIC)画像。スケールバー = 50 μm. このファイルをダウンロードするには、ここをクリックしてください。
補足表1:このプロトコルで使用されるプラスミドの構造。このファイルをダウンロードするには、ここをクリックしてください。
補足動画1:APP-EGFPの軸索輸送 このムービーは、200 ミリ秒ごとに 30 秒間撮影されました。スケールバー = 5 μm. この動画をダウンロードするには、ここをクリックしてください。
補足動画2:Alcα-EGFPの軸索輸送。 このムービーは、200 ミリ秒ごとに 30 秒間撮影されました。スケールバー = 5 μm. この動画をダウンロードするには、ここをクリックしてください。
補足動画3:Alcβ-EGFPの軸索輸送。 このムービーは、200 ミリ秒ごとに 30 秒間撮影されました。スケールバー = 5 μm. この動画をダウンロードするには、ここをクリックしてください。
ディスカッション
軸索輸送の解析方法が説明されており、これにはセグメント化された速度の計算とキモグラフの生成が含まれます。トランスフェクションステップにおける重要なステップは、培養ニューロンの健康を維持することです。Jiang と Chen29 によって記載されたトランスフェクション法に、若干の変更を加えました。DNA/CaCl2 溶液と2x HBSを穏やかに混合すると、沈殿物のサイズが小さくなり、トランスフェクションの効率が向上しました。沈殿物が細胞に損傷を与えるのを防ぐために、細胞は酸性化した培地ですすがれました。インキュベーションを伴わない迅速なすすぎ(2〜3回)は、細胞から沈殿物を除去するのに十分でした。ここでは、培養された初代ニューロンを使用しました。マウスの坐骨神経の輸送は、手術を伴う in vivo での共焦点顕微鏡法によって観察することができ26、近年の多光子顕微鏡法の発展により、マウスの脳における軸索輸送の観察が可能になったことは特筆すべきである27。
キモグラフは、軸索輸送の速度と方向を視覚化するために広く使用されています。キモグラフを作成するためのさまざまなツールがあり、その中にはフィジーのプラグインKymographBuilderも含まれています。KymoAnalyzerやKymolyzerなどの一部のトラックは、半手動で割り当てられたトラックからパラメータを計算できます28,29。KYMOMAKERソフトウェアは、トレースの割り当てを変更することはできないが、方向21ごとのトレースの可視化が容易であるという利点を有する。トリミングプロセスを管理し、検出パラメータを調整してキモグラフを生成し、方向によってトレースを自動的に抽出します。回転流域法を使用すると、微細な構造物を検出できます。ほとんどのトレースは検出できましたが、特にトレースが交差する場所で、2つのトレースが独立しているのか一時的に切断されているのかを判断するのは困難でした。また、各トレースのパラメータの計算にはKYMOMAKERは使用されません。順行性および逆行性のトレースカウントについては、検出されたトレースを赤い線でマスクする「キモグラフ」ウィンドウを使用することをお勧めします。
この計算方法には、生細胞に対する予測不可能な一時停止の影響を排除できるという利点があります。一時停止は、他のモーターや貨物などの物理的な障害物や、タウ20,30などの微小管関連タンパク質によって引き起こされることがあります。輸送速度の計算は、いくつかの手順を使用して実行されました。通常、より長い (数秒を超える) 期間を使用して、一時停止を含む転送距離が決定されます。ただし、セグメント化された(200ミリ秒)周期を使用すると、このプロトコルは計算から一時停止をより効率的に特定して削除できます。場合によっては、Alcβの場合のように、貨物速度は2つまたは3つのピーク分布を示し、これは関与するモータータンパク質の種類またはステータスの違いを反映している可能性があります。したがって、速度の分布を視覚化するにはヒストグラムを生成することが推奨され、このより正確な計算方法は、ピーク速度のより明確な推定に貢献できます。
開示事項
著者は何も開示していません。
謝辞
本研究は、科学研究費補助金 (22K15270) および公益財団法人秋山生命科学振興財団 YSの支援を受けて行われました。北海道大学大学院先端生命科学研究院分子細胞動態研究室の金城正隆博士と北村晃博士には、研究に多大な貢献をしてくださった方々に多大なるご意見とご協力をいただき、誠にありがとうございました。TIRF顕微鏡による観察は、北海道大学大学院先端生命科学研究院分子細胞動態学研究室に設置された装置を用いて行いました。本装置は、北海道大学創造研究機構グローバルファシリティセンターが運営するオープンファシリティシステム(AP-100138)に登録されています。九州大学電気工学部情報科学部先端情報工学科ヒューマンインタフェース研究室の内田誠一博士に、Kymomakerアプリケーションとの組み立てについて感謝いたします。北海道大学大学院薬学研究科認知症予防学講座は、株式会社日本メディカルリーフの助成を受けています。
資料
| Name | Company | Catalog Number | Comments |
| 5-Fluoro-2-deoxyuridine | Sigma-Aldrich | F0503 | |
| Apo TIRF 100x/1.49 OIL | Nikon | ||
| B-27 Supplement (50x), serum free | Thermo fischer scientific | 17504044 | |
| Bovine serum albumin | Wako | 013-25773 | |
| CalPhos Mammalian Transfection Kit | Takara | 631312 | |
| Cell strainer 40 µm Nylon | Falcon | 352340 | |
| CoolSNAP HQ | Photometrics | ||
| Deoxyribonuclease I | Sigma-Aldrich | DN-25 | |
| D-Glucose | Wako | 041-00595 | |
| DMEM/Ham’s F-12 | Wako | 042-30555 | |
| Dumont No. 7 forceps | Dumont | No.7 | |
| Feather surgical blade | Feather | No.11 | |
| Feather surgical blade handle | Feather | No. 3 | |
| Gentamicin | Wako | 079-02973 | |
| Gentamicin Sulfate | Wako | 075-04913 | |
| GlutaMAX Supplement | Thermo fischer scientific | 35050061 | |
| HEPES | DOJINDO | 342-01375 | |
| Horse Serum, heat inactivated | Thermo fischer scientific | 26050088 | |
| KCl | Wako | 163-03545 | |
| KH2PO4 | Wako | 169-04245 | |
| KYMOMAKER | http://www.pharm.hokudai.ac.jp/shinkei/Kymomaker.html | ||
| L-15 Medium (Leibovitz) | Sigma-Aldrich | L5520 | |
| MetaMorph version 6.2r1 | Metamorph | ||
| Na2HPO4 | Wako | 197-02865 | |
| NaCl | Wako | 197-01667 | |
| NaHCO3 | Wako | 191-01305 | |
| Neurobasal Medium | Thermo fischer scientific | 21103049 | |
| Nikon ECLIPSE TE 2000-E | Nikon | ||
| Nunc Lab-Tek 8 well Chambered Coverglass | Thermo fischer scientific | 155411 | |
| Papain | Worthington | LS003126 | |
| Penicillin-Streptomycin (10,000 U/mL) | Thermo Fisher Scientific | 15140122 | |
| Poly-L-lysine hydrobromide | Sigma-Aldrich | P2636-500MG | |
| Trizma base | Merck | T1194-10PAK | solved with water to make 0.1 M Tris-HCl (pH.8.5) |
参考文献
- Hirokawa, N., Noda, Y., Tanaka, Y., Niwa, S. Kinesin superfamily motor proteins and intracellular transport. Nature Reviews Molecular Cell Biology. 10 (10), 682-696 (2009).
- Stokin, G. B., et al. Axonopathy and transport deficits early in the pathogenesis of Alzheimer's diseases. Science. 307 (5713), 1282-1288 (2005).
- Guo, W., Stoklund Dittlau, K., vanden Bosch, L. Axonal transport defects and neurodegeneration: Molecular mechanisms and therapeutic implications. Seminars in Cell & Developmental Biology. 99, 133-150 (2020).
- Svoboda, K., Schmidt, C. F., Schnapp, B. J., Block, S. M. Direct observation of kinesin stepping by optical trapping interferometry. Nature. 365 (6448), 721-727 (1993).
- Carter, N. J., Cross, R. A. Mechanics of the kinesin step. Nature. 435 (7040), 308-312 (2005).
- Welte, M. A. Bidirectional transport along microtubules. Current Biology. 14 (13), R525-R537 (2004).
- Hendricks, A. G., et al. Motor coordination via a tug-of-war mechanism drives bidirectional vesicle transport. Current Biology. 20 (8), 697-702 (2010).
- Rezaul, K., et al. Engineered tug-of-war between kinesin and dynein controls direction of microtubule based transport in vivo. Traffic. 17 (5), 475-486 (2016).
- Encalada, S. E., Goldstein, L. S. B. Biophysical challenges to axonal transport: motor-cargo deficiencies and neurodegeneration. Annual Review of Biophysics. 43, 141-169 (2014).
- Monzon, G. A., et al. Stable tug-of-war between kinesin-1 and cytoplasmic dynein upon different ATP and roadblock concentrations. Journal of Cell Science. 133 (22), 226248(2020).
- Guo, W., et al. HDAC6 inhibition reverses axonal transport defects in motor neurons derived from FUS-ALS patients. Nature Communications. 8 (1), 861(2017).
- Tosolini, A. P., et al. BDNF-dependent modulation of axonal transport is selectively impaired in ALS. Acta Neuropathologica Communications. 10 (1), 121(2022).
- Verhey, K. J., Hammond, J. W. Traffic control: regulation of kinesin motors. Nature Reviews Molecular Cell Biology. 10 (11), 765-777 (2009).
- Fu, M. M., Holzbaur, E. L. F. Integrated regulation of motor-driven organelle transport by scaffolding proteins. Trends in Cell Biology. 24 (10), 564-574 (2014).
- Kumari, D., Ray, K. Phosphoregulation of kinesins involved in long-range intracellular transport. Frontiers in Cell and Developmental Biology. 10, 873164(2022).
- Wai Yau, K., et al. Cellular/molecular dendrites in vitro and in vivo contain microtubules of opposite polarity and axon formation correlates with uniform plus-end-out microtubule orientation. The Journal of Neuroscience. 36 (4), 1071-1085 (2016).
- Araki, Y., et al. The novel cargo Alcadein induces vesicle association of kinesin-1 motor components and activates axonal transport. The EMBO Journal. 26 (6), 1475-1486 (2007).
- Sobu, Y., et al. Phosphorylation of multiple sites within an acidic region of Alcadein α is required for kinesin-1 association and Golgi exit of Alcadein α cargo. Molecular Biology of the Cell. 28 (26), 3844-3856 (2017).
- Tsukamoto, M., et al. The cytoplasmic region of the amyloid β-protein precursor (APP) is necessary and sufficient for the enhanced fast velocity of APP transport by kinesin-1. FEBS Letters. 592 (16), 2716-2724 (2018).
- Ferro, L. S., Can, S., Turner, M. A., Elshenawy, M. M., Yildiz, A. Kinesin and dynein use distinct mechanisms to bypass obstacles. eLife. 8, e48629(2019).
- Chiba, K., Shimada, Y., Kinjo, M., Suzuki, T., Uchida, S. Simple and direct assembly of kymographs from movies using KYMOMAKER. Traffic. 15 (1), 1-11 (2014).
- Xu, S. -Y., Wu, Y. -M., Ji, Z., Gao, X. -Y., Pan, S. -Y. A modified technique for culturing primary fetal rat cortical neurons. Journal of Biomedicine and Biotechnology. 2012, 803930(2012).
- Han, D., et al. Deciphering anomalous heterogeneous intracellular transport with neural networks. eLife. 9, e52224(2020).
- Araki, Y., et al. Novel cadherin-related membrane proteins, Alcadeins, enhance the X11-like protein-mediated stabilization of amyloid beta-protein precursor metabolism. The Journal of Biological Chemistry. 278 (49), 49448-49458 (2003).
- Jiang, M., Chen, G. High Ca2+-phosphate transfection efficiency in low-density neuronal cultures. Nature Protocols. 1 (2), 695-700 (2006).
- Tosolini, A. P., Villarroel-Campos, D., Schiavo, G., Sleigh, J. N. Expanding the toolkit for in vivo imaging of axonal transport. Journal of Visualized Experiments. (178), e63471(2021).
- Takihara, Y., et al. In vivo imaging of axonal transport of mitochondria in the diseased and aged mammalian CNS. Proceedings of the National Academy of Sciences. 112 (33), 10515-10520 (2015).
- Neumann, S., Chassefeyre, R., Campbell, G. E., Encalada, S. E. KymoAnalyzer: a software tool for the quantitative analysis of intracellular transport in neurons. Traffic. 18 (1), 71-88 (2017).
- Basu, H., Ding, L., Pekkurnaz, G., Cronin, M., Kymolyzer Schwarz, T. L. a semi-autonomous kymography tool to analyze intracellular motility. Current Protocols in Cell Biology. 87 (1), 107(2020).
- Dixit, R., Ross, J. L., Goldman, Y. E., Holzbaur, E. L. F. Differential regulation of dynein and kinesin motor proteins by tau. Science. 319 (5866), 1086-1089 (2008).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved