Method Article
Mesure du transport de la cargaison axonale dans les neurones corticaux primaires cultivés de souris
Dans cet article
Résumé
Le présent protocole décrit l’ensemble de la procédure d’analyse pour le transport axonal. En particulier, le calcul de la vitesse de transport, sans compter la pause, et la méthode de visualisation à l’aide du logiciel en libre accès « KYMOMAKER » sont présentés ici.
Résumé
Les cellules neuronales sont des cellules hautement polarisées qui hébergent de manière stéréotypée plusieurs dendrites et un axone. La longueur d’un axone nécessite un transport bidirectionnel efficace par les protéines motrices. Divers rapports ont suggéré que des défauts dans le transport axonal sont associés à des maladies neurodégénératives. De plus, le mécanisme de coordination de plusieurs protéines motrices a été un sujet intéressant. Étant donné que l’axone a des microtubules unidirectionnels, il est plus facile de déterminer quelles protéines motrices sont impliquées dans le mouvement. Par conséquent, la compréhension des mécanismes sous-jacents au transport de la cargaison axonale est cruciale pour découvrir le mécanisme moléculaire des maladies neurodégénératives et la régulation des protéines motrices. Ici, nous présentons l’ensemble du processus d’analyse du transport axonal, y compris la culture des neurones corticaux primaires de souris, la transfection des plasmides codant pour les protéines de cargaison et les analyses directionnelles et de vitesse sans effet de pause. De plus, le logiciel en libre accès « KYMOMAKER » est introduit, qui permet de générer un kymographe pour mettre en évidence les traces de transport en fonction de leur direction et permettre une visualisation plus facile du transport axonal.
Introduction
Les membres de la famille des kinésines et la dynéine cytoplasmique sont des protéines motrices qui se déplacent le long des microtubules dans les cellules pour transporter leur cargaison1. La plupart des kinésines se déplacent vers l’extrémité positive, tandis que la dynéine se déplace vers l’extrémité négative d’un microtubule. Les fonctions et les mécanismes du transport de marchandises dans l’axone neuronal ont été étudiés de manière approfondie. En raison de leur longueur, les axones ont besoin d’un transport stable sur de longues distances pour maintenir la santé des neurones. Des défauts dans le transport des mitochondries, des autophagosomes et des vésicules contenant le précurseur de la protéine β amyloïde (APP) ont été signalés comme causes de maladies neurodégénératives 2,3. De nombreuses études in vitro ont révélé les mécanismes sous-jacents au transport coordonné par les protéines motrices, et diverses études utilisant des protéines motrices et des microtubules purifiés ont révélé comment les molécules motrices se déplacent le long des microtubules 4,5. En règle générale, plusieurs moteurs sont impliqués dans une seule cargaison6. Cependant, il existe des modèles de la façon dont les moteurs opposés déterminent la direction du transport de marchandises. L’un est le « modèle d’association/dissociation » ; Dans ce cas, seuls des moteurs unidirectionnels sont associés à la cargaison lors du transport unidirectionnel. Dans le second, le « modèle de coordination », les deux moteurs sont attachés à la même cargaison, et un seul côté du moteur est activé. Dans le troisième modèle de tir à la corde, l’équilibre de force entre les kinésines et les dynéines détermine la direction du transport 7,8,9. De plus, plusieurs rapports ont suggéré que l’équilibre et le nombre de protéines motrices activées influencent la vitesse du transport de marchandises in vitro 8,10.
Une question sans réponse est de savoir comment ces activités des kinésines ou des dynéines sont régulées dans les cellules vivantes. Des rapports antérieurs ont montré l’acétylation des microtubules dans les axones, et les facteurs neurotrophiques améliorent le transport axonal11,12. En outre, divers types de cargaison et d’adaptateurs de cargaison fonctionnent comme des activateurs de moteur de manière correspondante13,14. Beaucoup sont associés à la membrane des vésicules de transport, et leurs fonctions sont régulées par des signaux tels que les modifications post-traductionnelles15. Par conséquent, l’observation de la direction et de la vitesse de transport dans les cellules vivantes offre des informations précieuses sur la régulation moléculaire du transport de marchandises dans des expériences in vitro. L’observation du transport axonal permet de distinguer le transport basé sur la kinésine et la dynéine. Parce que les axones hébergent des microtubules unidirectionnels16, la cargaison est transportée antérograde (c’est-à-dire du soma à la terminaison axonale) par les kinésines et rétrograde (c’est-à-dire de la terminaison axonale au soma) par les dynéines.
Dans la présente étude, une méthode d’observation et d’analyse du transport axonal dans les neurones primaires en culture est décrite. À titre d’exemple, la procédure d’observation du transport axonal des protéines membranaires-APP, de la calsynténine-1/alcadéine α (Alcα) et de la calsynténine-3/alcadéine β (Alcβ) - contenant des vésicules est décrite. Il est connu que le transport antérograde des vésicules contenant de l’APP est considérablement plus rapide que celui des vésicules contenant de l’Alcα, bien que les deux soient transportées par la kinésine-1 17,18,19. Dans les rapports précédents, plusieurs méthodes ont été utilisées pour mesurer la vitesse. L’étape la plus variable est la gestion des pauses pendant le transport. Dans les cellules vivantes, le transport est parfois entravé par des obstacles le long des microtubules ; Cependant, les moteurs peuvent contourner une région avec ou sans pause20. Le calcul de la vitesse sur une période d’observation plus longue peut être affecté par la pause, ce qui peut entraîner une estimation plus lente de la vitesse. Ici, une méthode est décrite en utilisant le mouvement sur une période segmentée (200 ms) pour exclure l’effet de la pause physique des moteurs. Enfin, un logiciel en libre accès (Windows uniquement) appelé « KYMOMAKER »21 est introduit. Les kymographes sont largement utilisés pour visualiser le transport vésiculaire et sont utiles pour visualiser la direction de transport de chaque cargaison sans nécessiter de film. Le logiciel génère des kymographes à partir de films en accéléré en appliquant un algorithme unidimensionnel de Watershed plusieurs fois pendant la rotation des images. Cela permet au kymographe résultant de montrer des structures fines de manière efficace et facile. De plus, KYMOMAKER détecte et met automatiquement en évidence les sentiers en fonction de leur direction et permet de créer des diagrammes faciles à comprendre.
Protocole
Les expériences ont été approuvées par le Comité d’études animales de l’Université d’Hokkaido, conformément aux directives ARRIVE (Animal Research : Reporting of In Vivo Experiments). Des souris femelles C57BL/6J (gestantes, 15,5 jours) ont été utilisées pour la présente étude.
1. Préparation de neurones corticaux primaires cultivés de souris
- Ajouter 0,1 mg/mL de poly-L-lysine dans 0,1 M de Tris (tris(hydroxyméthyl)aminométhane)-HCl (pH 8,5) dans une chambre à fond de verre à 8 puits (n° 1.0) (voir le tableau des matériaux). Incuber la chambre dans un incubateur à 37 °C pendant au moins 1 h.
- Rincez la chambre à l’eau stérilisée au moins trois fois et séchez-la à l’air libre dans une hotte de culture de tissus.
- Sacrifiez les souris enceintes à 15,5 jours par luxation cervicale ou en suivant les réglementations approuvées par l’institution.
- Pincez la corne utérine contenant les embryons, isolez toutes les cornes utérines à l’aide de ciseaux et plongez-les dans une solution saline froide tamponnée au phosphate (PBS) sur de la glace.
- Dans le PBS froid, isolez les embryons à l’aide d’une pince à épiler pointue et retirez toutes les membranes amniotiques des embryons.
- Lavez à nouveau les embryons avec du PBS frais et froid.
REMARQUE : Lors de chaque étape d’isolement, lavez autant de sang que possible et assurez-vous de ne pas endommager les vaisseaux ou les embryons. - Placez un embryon sur une gaze stérilisée dans une boîte de Pétri froide sous microscopie optique.
- Isolez le cerveau. Coupez la tête, la peau et le crâne de l’embryon à l’aide de la pointe d’une pince à épiler pointue et incurvée. Retirez la peau et le crâne pour exposer le haut et les côtés du cerveau.
- Prélevez tout le cerveau à l’aide de la partie incurvée de la pince à épiler et plongez-le dans une boîte de Pétri contenant 1x la solution saline équilibrée de Hanks glacée (HBSS ; 10 mM HEPES [pH 7,6], 5,3 mM KCl, 0,44 mM KH2PO4, 140 mM NaCl, 4,2 mM NaHCO3, 0,34 mM Na2HPO4, 39 mM D-glucose, et 0,5 μg/mL de gentamicine ; voir la table des matériaux).
- Répétez les étapes 1.7-1.9 jusqu’à ce que le nombre requis de cerveaux soit obtenu.
REMARQUE : En règle générale, 5 x 106 à 2 x 107 cellules par cerveau peuvent être obtenues. - Séparez le cortex22 du cerveau à l’aide d’une pince à épiler dans un HBSS froid et arrachez les méninges du cortex.
- Transférez le cortex dans une nouvelle boîte de Pétri contenant 1x HBSS froid. Coupez le cortex en deux ou en trois à l’aide de lames chirurgicales.
- Transférez le cortex dans un tube à centrifuger de 15 ml à l’aide d’embouts de 1 000 μL coupés et retirez l’excédent 1x HBSS.
- Ajouter 100 unités de papaïne et 200 μg de désoxyribonucléase I (DNase I) dilués avec 5 mL de solution diluée de papaïne (5 mg/mL de D-glucose, 0,2 mg/mL d’albumine sérique bovine et 0,2 mg/mL de L-cystéine dans 1x PBS ; voir le tableau des matériaux) par embryon, et incuber dans un bain-marie à 37 °C pendant 15 min. Retournez le tube toutes les 5 min pendant l’incubation.
REMARQUE : La préincubation de la papaïne dans une solution diluée de papaïne est recommandée. Incuber 5 min dans un bain-marie à 37 °C, puis ajouter la DNase I. - Jetez la solution. Ajouter 2 ml de sérum de cheval inactivé à 20 % par la chaleur (voir le tableau des matériaux) dans 1x HBSS. Incuber pendant 1 min.
- Jetez la solution. Rincez le mouchoir avec 4 ml de 1x HBSS deux fois.
- Jetez la solution. Ajouter 0,5 mL par embryon de milieu de placage (milieu neurobasal contenant 2 % de supplément de B-27, 4 mM de Glutamax, 5 % de sérum de cheval inactivé par la chaleur et 1 x pénicilline-streptomycine ; voir le tableau des matériaux).
REMARQUE : Au cours des étapes 1.14 à 1.17, aucune centrifugation n’est nécessaire car les morceaux de cortex coupés coulent au fond du tube sans elle. N’utilisez pas d’aspirateur et n’aspirez pas les morceaux. - Remettre en suspension très doucement à l’aide d’une pointe coupée de 1 000 μL ou d’une pipette de 10 ml 5 à 10 fois.
- Remettez en suspension très doucement avec un embout de 1 000 μL 10 fois.
- Centrifuger à 250 × g à température ambiante (20-25 °C) pendant 3 min.
- Retirer le surnageant et le remettre en suspension très doucement avec 0,5 mL par embryon de milieu de placage à l’aide d’une pointe de 1 000 μL 10 fois.
- Placez une crépine de cellule de 40 μm sur un tube à centrifuger de 50 mL, puis filtrez la suspension de cellule par écoulement par gravité. Récupérez la suspension cellulaire filtrée dans le tube.
- Comptez les cellules et la plaque dans les chambres à raison de 2 × 104 à 5 × 104 cellules/cm2, avec un volume approprié de milieu de placage. La figure supplémentaire 1 donne un exemple de la densité.
- Au jour in vitro (division 2), remplacer la moitié du milieu par un milieu de culture (milieu neurobasal contenant 2 % de supplément de B-27, 4 mM de glutamax et 1 x pénicilline-streptomycine) et ajouter 5 μM de 5-fluoro-2-désoxyuridine (voir le tableau des matériaux).
- Après la division 4, remplacer la moitié du milieu par un milieu de culture tous les 2 ou 3 jours.
2. Transfection de plasmides dans un neurone primaire cultivé à l’aide de la méthode du phosphate de calcium
REMARQUE : Les volumes mentionnés sont pour un puits de0,8 cm 2 dans une chambre à fond de verre à 8 puits (voir le tableau des matériaux).
- Préparez 50 μL de solution d’ADN/CaCl2 en mélangeant 200 ng à 2 μg d’un plasmide (APP-EGFP dans pCAGGS, Alcα-EGFP dans pcDNA3.118 ou Alcβ-EGFP dans pcDNA3.1 ; voir le tableau supplémentaire 1) codant pour une protéine marquée en fluorescence, 6,2 μL de 2 M de CaCl2 et de l’eau stérilisée.
- Aliquote 50 μL de solution saline tamponnée HEPES (HBS) dans de nouveaux tubes à centrifuger.
- Ajouter 6,2 μL de solution d’ADN/CaCl2 dans une solution HBS 2x. Mélangez doucement en pipetant 10 fois.
- Répétez l’étape 2.3 jusqu’à ce que toute la solution d’ADN/CaCl2 ait été transférée.
- Incuber à température ambiante pendant 15 min.
- Récupérez le milieu de culture dans la chambre à fond de verre et remplacez-le par un milieu de culture frais sans antibiotiques.
REMARQUE : Conservez le milieu collecté dans l’incubateur de culture cellulaire jusqu’à l’étape 2.10. - Ajouter 50 μL du mélange ADN/CaCl2/HBS par puits goutte à goutte dans les neurones. Culture pendant 1 h.
- Pendant l’incubation, préparez le milieu acidifié en plaçant une boîte de Pétri contenant du DMEM (milieu d’Eagle modifié de Dulbecco)/du milieu F-12 de Ham dans un incubateur à 10 % de CO2 à 37 °C.
- Après l’incubation pendant 1 h suivant la transfection, rincer les neurones primaires avec le F-12 (milieu acidifié) de DMEM/Ham 3 fois.
- Remplacer le milieu par un mélange de milieux à moitié collectés et à moitié frais. Culture jusqu’à observation par microscopie à 37 °C et 5 % de CO2.
3. Observation du transport axonal
- Préincuber la chambre équipée d’une microscopie TIRF (réflectance interne totale) (voir tableau des matériaux) à 37 °C.
- Si le contrôleur de CO2 est équipé, le milieu de culture peut être utilisé comme milieu d’observation à moins de 5 % de CO2. S’il n’en est pas équipé, remplacez le milieu par un milieu au pH stable, tel que le Leibovitz L-15 (voir tableau des matériaux), fourni avec 4 mM de Glutamax et 2 % de supplément B-27.
- Trouvez une cellule transfectée, puis identifiez un axone. Augmentez l’angle d’incidence du laser jusqu’à ce que le laser soit complètement réfléchi. Ensuite, diminuez l’angle jusqu’à ce que toutes les vésicules de l’axone soient visualisées (pseudo-TIRF). Acquérez des images avec un temps d’exposition de 200 ms pour 150 images (30 s).
REMARQUE : Dans cette expérience, l’éclairage pseud-TIRF a été utilisé pour capturer toutes les vésicules axonales. D’autres microscopes équipés de systèmes de capture à grande vitesse peuvent être utilisés.
REMARQUE : Enregistrez la direction de l’axone à chaque fois dans le nom du fichier. L’aire du segment axonal initial ou de l’aire de l’axone terminal a été évitée de l’observation.
4. Traitement d’image
- Ouvrez les images acquises à l’aide du logiciel MetaMorph (voir Table des matériaux).
- Ouvrez la barre d’outils > Mesurer > Calibrer la distance. Activez « Appliquer à toutes les images ouvertes » et entrez la distance réelle d’un pixel.
- Ouvrez la barre d’outils > Afficher > Pivoter. Cochez la case « tous les plans ». Tournez de manière à ce que l’axone soit horizontal et que la direction vers la terminaison de l’axone soit vers la droite.
- Ouvrez la barre d’outils > Régions > Créer des régions. Définissez la taille de la région pour le découpage et cliquez sur Créer. Placez le cadre qui apparaît sur l’image sur la zone axonale pour l’analyse. Enregistrez la séquence d’images générée en tant que fichier de pile.
REMARQUE : Sélectionnez des zones qui ne contiennent pas d’axones ou de débris non focalisés. - Ouvrez la barre d’outils > Afficher > graphiques. Sélectionnez Barre d’étalonnage pour tamponner la barre d’échelle. Sélectionnez Données/Heure pour ajouter un horodatage aux images. Activez « tous les plans ». Déplacez les objets dans l’espace approprié et cliquez sur tamponner.
- Ouvrez la barre d’outils > Empiler > Réaliser un film. Entrez la fréquence d’images appropriée et sélectionnez AVI. Enregistrez-le en tant que nouveau fichier.
5. Dessin d’un kymographe et détection de traces à l’aide de KYMOMAKER
- Téléchargez KYMOMAKER (voir Tableau des matériaux) et ouvrez « Kymoanalysis.exe » dans le dossier KYMOMAKER.
- Ouvrez « kymoAnalysis.exe » pour afficher les fenêtres principales (Figure 1A). Sélectionnez Fichier > Charger et ouvrez le film AVI créé. Une fenêtre « Aperçu » s’affiche (Figure 1B).
- Dans l’onglet Générer Kymograph > section de découpage , saisissez les numéros de pixel pour le découpage. Le découpage est immédiatement répercuté dans la fenêtre « Aperçu » pour permettre un réglage facile (Figure 1C). Vérifiez que la barre d’échelle et l’horodatage ont été supprimés.
- Cliquez sur le bouton Générer pour générer le kymographe (Figure 1C). KYMOMAKER détecte le pixel le plus brillant dans chaque axe y dans la fenêtre « Aperçu ». Enregistrez le kymographe via Fichier > Enregistrer > kymographe normal.
- Pour détecter les traces de faible intensité dans le kymographe, cliquez sur Kymographe rotationnel. Ajustez le nombre dans la section « Kymographe de rotation » et affichez le résultat en cliquant sur le kymographe de rotation (Figure 1D).
REMARQUE : « Rotation (degré) » est l’intervalle du degré pour l’algorithme de bassin versantrotationnel 21. Par exemple, 10° signifie que l’algorithme de bassin versant est exécuté toutes les 10° 36 fois, et que les résultats sont ensuite combinés dans la fenêtre « Bassin versant de rotation ». - Pour détecter les traces antérogrades et rétrogrades dans le kymographe, dans l’onglet Détection > section Cible , sélectionnez original si le kymographe rotationnel n’a pas été généré. Assurez-vous qu’en sélectionnant Rotation, le bassin versant de rotation créé est utilisé pour détecter les traces. Sélectionnez Bassin versant dans « Méthode de détection ». Cliquez sur le bouton Détecter pour détecter automatiquement les traces.
REMARQUE : Les traces détectées sont dessinées dans la fenêtre « Travail ». L’activation de « Masking » dessine des traces sur le kymographe original. - Détectez les traces antérogrades et rétrogrades en entrant un nombre dans la section Détection > filtrage > vitesse (Figure 1E,F). Détectez les traces antérogrades en saisissant 0,4 à 7,0 μm/s. Détectez les traces rétrogrades en saisissant −0,4 à −7,0 μm/s.
REMARQUE : Le réglage de la vitesse la plus basse dépend de la définition d’une condition immobile des vésicules. Voir l’étape 6.7. - Enregistrez les fichiers.
6. Détermination du vecteur vitesse
- Ouvrez le logiciel MetaMorph.
REMARQUE : Le plugin « suivi manuel » d’ImageJ peut également calculer les vitesses de la même manière. - Ouvrez le fichier créé à l’étape 4.4. Assurez-vous que le calibrage est adapté aux images.
- Ouvrez la barre d’outils > Applications > Suivre des points. Cliquez sur Ajouter une piste. Trouvez une vésicule en mouvement qui a été transportée antérogradement ou rétrogradement. Ensuite, suivez la vésicule en cliquant jusqu’à ce que le transport se termine. Cliquez sur Terminé.
- Répétez l’étape 6.3 jusqu’à ce que toutes les vésicules aient été suivies.
- Cliquez sur ouvrir le journal pour ouvrir un fichier CSV. Ensuite, cliquez sur le fichier journal pour afficher les données dans le fichier CSV.
- Enregistrez le fichier CSV.
- Pour calculer la vitesse segmentée non affectée par la pause, supprimez les vitesses calculées de 0,37 μm/s ou moins dans la colonne « vitesse ».
REMARQUE : Les vésicules peuvent se déplacer très rapidement par diffusion anormale, et elles ne sont pas traitées par les protéines motrices23. Pour éviter d’inclure ces mouvements dans le calcul des vitesses entraînées par le moteur, la vitesse la plus basse (1 pixel/200 ms) de ce protocole est supprimée du calcul. - Calculez la vitesse moyenne segmentée toutes les cinq images (soit un total de 1 s). Jetez la dernière partie de la vélocité s’il reste moins de cinq images.
- Combinez toutes les vitesses moyennes d’une seule condition. Générez des histogrammes pour aider à visualiser la distribution des vitesses.
Résultats
Les neurones primaires cultivés du cortex de souris E15.5 ont été cultivés dans une boîte à fond de verre comme décrit. À titre d’exemple, APP-EGFP, Alcα-EGFP ou Alcβ-EGFP ont été exprimés dans les neurones corticaux primaires. On sait que l’APP et l’Alcα sont transportés dans l’axone par la kinésine-1 2,17. L’APP s’associe à la kinésine-1 via la protéine adaptatrice JIP1 (protéine interagissant avec JNK 1), tandis que l’Alcα se lie directement via ses motifs doubles W-acides. Alcβ est un membre de la famille des Alcadein et n’a qu’un seul motif W-acide24. Chaque protéine a été transfectée à des neurones de division 5, et des images ont été acquises toutes les 200 ms à l’aide de la microscopie TIRF 14 à 16 h après la transfection. Plusieurs vésicules mobiles dans les axones ont été observées dans les neurones transfectés avec APP-EGFP, Alcα-EGFP ou Alcβ-EGFP (films supplémentaires 1-3, respectivement).
À l’aide de KYMOMAKER, des kymographes pour Alcβ-EGFP ont été générés avec et sans l’algorithme de bassin versant rotationnel (figures 1C et D, respectivement). De plus, KYMOMAKER a permis d’extraire des traces dans les directions antérogrades et rétrogrades à partir des kymographes originaux et des kymographes de bassin versant (Figure 1E,F). Des traces importantes ont été détectées dans les deux kymographes. Par rapport à la méthode originale, l’application de l’algorithme de bassin versant a permis une meilleure détection des traces de faible intensité (Figure 1F).
Les vitesses des vésicules dans chaque neurone ont été suivies et calculées comme décrit. La vitesse de l’APP-EGFP était de 3,05 ± 1,03 μm/s, ce qui est cohérent avec les résultats précédents 18,19. L’alcα-EGFP a été transporté à une vitesse de 1,89 ± 0,77 μm/s, ce qui était considérablement plus lent que l’APP, ce qui correspond à la vitesse rapportée de la kinésine-1. La vitesse de transport d’Alcβ-EGFP était de 2,68 ± 1,07 μm/s, ce qui se situait entre les vitesses d’Alcα et d’APP. Des histogrammes ont été générés en utilisant une largeur de bac de 0,2 μm/s pour montrer les différences de distribution. De plus, nous avons calculé le rapport relatif de la direction de transport à l’aide des kymographes générés avec KYMOMAKER (Figure 2A,B). Les trois protéines ont été principalement transportées dans la direction antérograde (figure 2C).

Figure 1 : Flux de travail de la méthode de détection à l’aide de KYMOMAKER. (A) Réglage des fenêtres principales pour KYMOMAKER. (B) Le film obtenu a été ouvert dans KYMOMAKER, et la zone qui ne contenait pas l’axone a été supprimée par « rognage ». (C) En cliquant sur générer, le kymographe original a été généré. (D) En cliquant sur Kymographe rotatif, une nouvelle fenêtre « Kymographe rotatif » s’ouvrait, et les paramètres de détection pouvaient être modifiés dans la boîte de dialogue supérieure en (A). (E) Chaque trace antérograde ou rétrograde a été détectée à partir du kymographe en (C). Les paramètres de détection peuvent être modifiés dans la boîte de dialogue inférieure en (A). (F) Traces détectées à partir de (D). Barres d’échelle = 5 μm. Veuillez cliquer ici pour voir une version plus grande de cette figure.
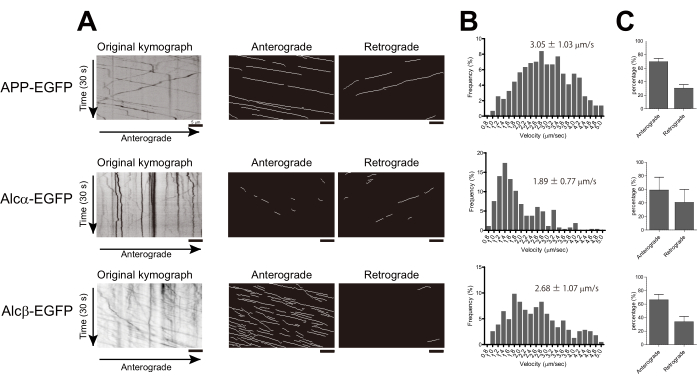
Figure 2 : Calcul de la vitesse et de la direction des vésicules transportées par la kinésine-1. APP-EGFP, Alcα-EGFP ou Alcβ-EGFP ont été transfectés dans les divisions 4 à 6 des neurones corticaux primaires cultivés de souris, et les images des axones ont été acquises après 14 à 18 h de transfection. (A) Des kymographes du transport axonal ont été générés à l’aide de KYMOMAKER. À gauche : kymographe original ; milieu : traces antérogrades ; à droite : traces rétrogrades. (B) Des histogrammes de la vitesse de transport antérograde sont présentés (n = 583 pour APP-EGFP, n = 388 pour Alcβ-EGFP, n = 264 pour Alcα-EGFP à partir de deux expériences indépendantes.). La ± moyenne de l’écart-type est indiquée sur les histogrammes. (C) Les pourcentages de traces qui ont été transportées dans chaque direction sont indiqués (chaque barre montre la moyenne ± ET. n = 2 d’expériences indépendantes, chacune contenant 6 à 10 cellules). Barres d’échelle = 5 μm. Veuillez cliquer ici pour voir une version plus grande de cette figure.
Figure supplémentaire 1 : Densité de culture du neurone primaire cultivé sur une parabole à fond de verre. Image à contraste interférentiel différentiel (CID) des neurones corticaux primaires cultivés de souris de la division 1, comme à l’étape 1.23. Barre d’échelle = 50 μm. Veuillez cliquer ici pour télécharger ce fichier.
Tableau supplémentaire 1 : Les constructions des plasmides utilisés dans ce protocole. Veuillez cliquer ici pour télécharger ce fichier.
Vidéo supplémentaire 1 : Transport axonal de l’APP-EGFP. Le film a été tourné toutes les 200 ms pendant 30 s. Barre d’échelle = 5 μm. Veuillez cliquer ici pour télécharger ce film.
Vidéo supplémentaire 2 : Transport axonal de l’Alcα-EGFP. Le film a été tourné toutes les 200 ms pendant 30 s. Barre d’échelle = 5 μm. Veuillez cliquer ici pour télécharger ce film.
Vidéo supplémentaire 3 : Transport axonal d’Alcβ-EGFP. Le film a été tourné toutes les 200 ms pendant 30 s. Barre d’échelle = 5 μm. Veuillez cliquer ici pour télécharger ce film.
Discussion
Une méthode d’analyse du transport axonal est décrite, qui comprend le calcul de la vitesse segmentée et la génération de kymographes. Une étape critique de l’étape de transfection est le maintien de la santé des neurones en culture. La méthode de transfection décrite par Jiang et Chen29 a été suivie avec des modifications mineures. Le mélange doux de la solution d’ADN/CaCl2 et de 2x HBS a augmenté l’efficacité de la transfection en réduisant la taille des précipitations. Pour éviter que les précipitations n’endommagent les cellules, les cellules ont été rincées avec un milieu acidifié. Des rinçages rapides (deux ou trois fois) sans incubation ont suffi à évacuer les précipitations des cellules. Ici, nous avons utilisé le neurone primaire cultivé ; Il convient de mentionner que le transport chez les nerfs sciatiques de souris peut être observé par microscopie confocale in vivo avec chirurgie26, et le développement récent de la microscopie multiphotonique a permis l’observation du transport axonal dans le cerveau des souris27.
Les kymographes sont largement utilisés pour visualiser la vitesse et la direction du transport axonal. Il existe différents outils pour créer des kymographs, dont le plugin Fiji KymographBuilder. Certains d’entre eux, comme KymoAnalyzer ou Kymolyzer, peuvent calculer les paramètres des pistes attribuées semi-manuellement28,29. Bien que le logiciel KYMOMAKER ne puisse pas modifier l’attribution des traces, il présente l’avantage de visualiser facilement les traces par direction21. Il gère le processus de rognage, génère des kymographes en ajustant les paramètres de détection et extrait automatiquement les traces par direction. L’utilisation de la méthode Rotational Watershed permet de détecter des structures fines. Bien que la plupart des traces aient pu être détectées, il était difficile de déterminer si deux pistes étaient indépendantes ou temporairement déconnectées, en particulier là où les traces se croisaient. De plus, KYMOMAKER n’est pas utilisé pour le calcul du paramètre de chaque trace. Pour les comptages de traces antérogrades et rétrogrades, il est recommandé d’utiliser la fenêtre « Kymograph », qui masque les traces détectées par des lignes rouges.
Cette méthode de calcul a l’avantage d’exclure l’effet des pauses imprévisibles sur les cellules vivantes. Les pauses peuvent être causées par des obstacles physiques, tels que d’autres moteurs et marchandises, et des protéines associées aux microtubules, telles que tau20,30. Le calcul de la vitesse de transport a été effectué à l’aide de plusieurs procédures. En règle générale, des périodes plus longues (plus de quelques secondes) sont utilisées pour déterminer la distance transportée, y compris la pause. Cependant, en utilisant des périodes segmentées (200 ms), ce protocole peut identifier et supprimer plus efficacement les pauses du calcul. Dans certains cas, la vitesse de la cargaison a montré une distribution à deux ou trois pics, comme dans le cas d’Alcβ, qui peut refléter les différents types ou statuts des protéines motrices impliquées. Ainsi, il est recommandé de générer un histogramme pour visualiser la distribution des vitesses, et cette méthode de calcul plus précise peut contribuer à une estimation plus claire des vitesses de pointe.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Ce travail a été soutenu par KAKENHI (22K15270, Grant-in-Aid for Young Scientists) et la Fondation Akiyama pour les sciences de la vie pour YS. Nous tenons à exprimer notre gratitude au Dr Masataka Kinjo et au Dr Akira Kitamura, Laboratoire de dynamique cellulaire moléculaire, Faculté des sciences de la vie avancées, Université d’Hokkaido, pour avoir fourni une contribution et une expertise essentielles qui ont grandement aidé la recherche. L’observation par microscopie TIRF a été réalisée à l’aide de l’instrument installé au Laboratoire de dynamique cellulaire moléculaire de la Faculté des sciences de la vie avancées de l’Université d’Hokkaido. L’instrument est enregistré dans le système Open Facility géré par le Global Facility Center, Creative Research Institution, Hokkaido University (AP-100138). Nous remercions le Dr Seiichi Uchida, Laboratoire d’interface humaine, Département des technologies de l’information avancées, Faculté des sciences de l’information et de génie électrique, Université de Kyushu, Fukuoka Japon, pour l’assemblage avec l’application Kymomaker. Le Laboratoire avancé de prévention et de recherche sur la démence de l’École supérieure des sciences pharmaceutiques de l’Université d’Hokkaido est soutenu par Japan Medical Leaf co., Ltd.
matériels
| Name | Company | Catalog Number | Comments |
| 5-Fluoro-2-deoxyuridine | Sigma-Aldrich | F0503 | |
| Apo TIRF 100x/1.49 OIL | Nikon | ||
| B-27 Supplement (50x), serum free | Thermo fischer scientific | 17504044 | |
| Bovine serum albumin | Wako | 013-25773 | |
| CalPhos Mammalian Transfection Kit | Takara | 631312 | |
| Cell strainer 40 µm Nylon | Falcon | 352340 | |
| CoolSNAP HQ | Photometrics | ||
| Deoxyribonuclease I | Sigma-Aldrich | DN-25 | |
| D-Glucose | Wako | 041-00595 | |
| DMEM/Ham’s F-12 | Wako | 042-30555 | |
| Dumont No. 7 forceps | Dumont | No.7 | |
| Feather surgical blade | Feather | No.11 | |
| Feather surgical blade handle | Feather | No. 3 | |
| Gentamicin | Wako | 079-02973 | |
| Gentamicin Sulfate | Wako | 075-04913 | |
| GlutaMAX Supplement | Thermo fischer scientific | 35050061 | |
| HEPES | DOJINDO | 342-01375 | |
| Horse Serum, heat inactivated | Thermo fischer scientific | 26050088 | |
| KCl | Wako | 163-03545 | |
| KH2PO4 | Wako | 169-04245 | |
| KYMOMAKER | http://www.pharm.hokudai.ac.jp/shinkei/Kymomaker.html | ||
| L-15 Medium (Leibovitz) | Sigma-Aldrich | L5520 | |
| MetaMorph version 6.2r1 | Metamorph | ||
| Na2HPO4 | Wako | 197-02865 | |
| NaCl | Wako | 197-01667 | |
| NaHCO3 | Wako | 191-01305 | |
| Neurobasal Medium | Thermo fischer scientific | 21103049 | |
| Nikon ECLIPSE TE 2000-E | Nikon | ||
| Nunc Lab-Tek 8 well Chambered Coverglass | Thermo fischer scientific | 155411 | |
| Papain | Worthington | LS003126 | |
| Penicillin-Streptomycin (10,000 U/mL) | Thermo Fisher Scientific | 15140122 | |
| Poly-L-lysine hydrobromide | Sigma-Aldrich | P2636-500MG | |
| Trizma base | Merck | T1194-10PAK | solved with water to make 0.1 M Tris-HCl (pH.8.5) |
Références
- Hirokawa, N., Noda, Y., Tanaka, Y., Niwa, S. Kinesin superfamily motor proteins and intracellular transport. Nature Reviews Molecular Cell Biology. 10 (10), 682-696 (2009).
- Stokin, G. B., et al. Axonopathy and transport deficits early in the pathogenesis of Alzheimer's diseases. Science. 307 (5713), 1282-1288 (2005).
- Guo, W., Stoklund Dittlau, K., vanden Bosch, L. Axonal transport defects and neurodegeneration: Molecular mechanisms and therapeutic implications. Seminars in Cell & Developmental Biology. 99, 133-150 (2020).
- Svoboda, K., Schmidt, C. F., Schnapp, B. J., Block, S. M. Direct observation of kinesin stepping by optical trapping interferometry. Nature. 365 (6448), 721-727 (1993).
- Carter, N. J., Cross, R. A. Mechanics of the kinesin step. Nature. 435 (7040), 308-312 (2005).
- Welte, M. A. Bidirectional transport along microtubules. Current Biology. 14 (13), R525-R537 (2004).
- Hendricks, A. G., et al. Motor coordination via a tug-of-war mechanism drives bidirectional vesicle transport. Current Biology. 20 (8), 697-702 (2010).
- Rezaul, K., et al. Engineered tug-of-war between kinesin and dynein controls direction of microtubule based transport in vivo. Traffic. 17 (5), 475-486 (2016).
- Encalada, S. E., Goldstein, L. S. B. Biophysical challenges to axonal transport: motor-cargo deficiencies and neurodegeneration. Annual Review of Biophysics. 43, 141-169 (2014).
- Monzon, G. A., et al. Stable tug-of-war between kinesin-1 and cytoplasmic dynein upon different ATP and roadblock concentrations. Journal of Cell Science. 133 (22), 226248(2020).
- Guo, W., et al. HDAC6 inhibition reverses axonal transport defects in motor neurons derived from FUS-ALS patients. Nature Communications. 8 (1), 861(2017).
- Tosolini, A. P., et al. BDNF-dependent modulation of axonal transport is selectively impaired in ALS. Acta Neuropathologica Communications. 10 (1), 121(2022).
- Verhey, K. J., Hammond, J. W. Traffic control: regulation of kinesin motors. Nature Reviews Molecular Cell Biology. 10 (11), 765-777 (2009).
- Fu, M. M., Holzbaur, E. L. F. Integrated regulation of motor-driven organelle transport by scaffolding proteins. Trends in Cell Biology. 24 (10), 564-574 (2014).
- Kumari, D., Ray, K. Phosphoregulation of kinesins involved in long-range intracellular transport. Frontiers in Cell and Developmental Biology. 10, 873164(2022).
- Wai Yau, K., et al. Cellular/molecular dendrites in vitro and in vivo contain microtubules of opposite polarity and axon formation correlates with uniform plus-end-out microtubule orientation. The Journal of Neuroscience. 36 (4), 1071-1085 (2016).
- Araki, Y., et al. The novel cargo Alcadein induces vesicle association of kinesin-1 motor components and activates axonal transport. The EMBO Journal. 26 (6), 1475-1486 (2007).
- Sobu, Y., et al. Phosphorylation of multiple sites within an acidic region of Alcadein α is required for kinesin-1 association and Golgi exit of Alcadein α cargo. Molecular Biology of the Cell. 28 (26), 3844-3856 (2017).
- Tsukamoto, M., et al. The cytoplasmic region of the amyloid β-protein precursor (APP) is necessary and sufficient for the enhanced fast velocity of APP transport by kinesin-1. FEBS Letters. 592 (16), 2716-2724 (2018).
- Ferro, L. S., Can, S., Turner, M. A., Elshenawy, M. M., Yildiz, A. Kinesin and dynein use distinct mechanisms to bypass obstacles. eLife. 8, e48629(2019).
- Chiba, K., Shimada, Y., Kinjo, M., Suzuki, T., Uchida, S. Simple and direct assembly of kymographs from movies using KYMOMAKER. Traffic. 15 (1), 1-11 (2014).
- Xu, S. -Y., Wu, Y. -M., Ji, Z., Gao, X. -Y., Pan, S. -Y. A modified technique for culturing primary fetal rat cortical neurons. Journal of Biomedicine and Biotechnology. 2012, 803930(2012).
- Han, D., et al. Deciphering anomalous heterogeneous intracellular transport with neural networks. eLife. 9, e52224(2020).
- Araki, Y., et al. Novel cadherin-related membrane proteins, Alcadeins, enhance the X11-like protein-mediated stabilization of amyloid beta-protein precursor metabolism. The Journal of Biological Chemistry. 278 (49), 49448-49458 (2003).
- Jiang, M., Chen, G. High Ca2+-phosphate transfection efficiency in low-density neuronal cultures. Nature Protocols. 1 (2), 695-700 (2006).
- Tosolini, A. P., Villarroel-Campos, D., Schiavo, G., Sleigh, J. N. Expanding the toolkit for in vivo imaging of axonal transport. Journal of Visualized Experiments. (178), e63471(2021).
- Takihara, Y., et al. In vivo imaging of axonal transport of mitochondria in the diseased and aged mammalian CNS. Proceedings of the National Academy of Sciences. 112 (33), 10515-10520 (2015).
- Neumann, S., Chassefeyre, R., Campbell, G. E., Encalada, S. E. KymoAnalyzer: a software tool for the quantitative analysis of intracellular transport in neurons. Traffic. 18 (1), 71-88 (2017).
- Basu, H., Ding, L., Pekkurnaz, G., Cronin, M., Kymolyzer Schwarz, T. L. a semi-autonomous kymography tool to analyze intracellular motility. Current Protocols in Cell Biology. 87 (1), 107(2020).
- Dixit, R., Ross, J. L., Goldman, Y. E., Holzbaur, E. L. F. Differential regulation of dynein and kinesin motor proteins by tau. Science. 319 (5866), 1086-1089 (2008).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon