Method Article
מדידת הובלת מטען אקסונלי בתאי עצב מתורבתים ראשוניים בקליפת המוח של עכברים
In This Article
Summary
הפרוטוקול הנוכחי מתאר את כל הליך הניתוח להובלה אקסונלית. בפרט, חישוב מהירות ההובלה, לא כולל ההשהיה, ושיטת ההדמיה באמצעות תוכנת גישה פתוחה "KYMOMAKER" מוצגים כאן.
Abstract
תאים עצביים הם תאים מקוטבים מאוד המכילים באופן סטריאוטיפי מספר דנדריטים ואקסון. אורכו של אקסון מחייב הובלה דו-כיוונית יעילה על ידי חלבונים מוטוריים. דיווחים שונים הציעו כי פגמים בהובלה אקסונלית קשורים למחלות ניווניות. כמו כן, מנגנון התיאום של חלבונים מוטוריים מרובים היה נושא אטרקטיבי. מכיוון שלאקסון יש מיקרו-צינורות חד-כיווניים, קל יותר לקבוע אילו חלבונים מוטוריים מעורבים בתנועה. לכן, הבנת המנגנונים העומדים בבסיס הובלת מטען אקסונלי היא חיונית לחשיפת המנגנון המולקולרי של מחלות נוירודגנרטיביות ולוויסות חלבונים מוטוריים. כאן, אנו מציגים את כל התהליך של ניתוח הובלה אקסונלית, כולל תרבית של נוירונים ראשוניים בקליפת המוח של עכבר, טרנספקציה של פלסמידים המקודדים חלבוני מטען, וניתוחי כיוון ומהירות ללא השפעת הפסקות. בנוסף, הוצגה תוכנת הגישה הפתוחה "KYMOMAKER", המאפשרת יצירת קימוגרף כדי להדגיש עקבות הובלה בהתאם לכיוונם ולאפשר הדמיה קלה יותר של הובלה אקסונלית.
Introduction
בני משפחת קינסין ודינין ציטופלזמי הם חלבונים מוטוריים הנעים לאורך המיקרו-צינורות בתאים כדי להעביר את המטען שלהם1. רוב הקינזינים נעים לכיוון הקצה החיובי, בעוד שדיניין נע לכיוון הקצה המינוס של מיקרו-צינורית. הפונקציות והמנגנונים של הובלת מטען באקסון העצבי נחקרו בהרחבה. בגלל אורכם, אקסונים דורשים הובלה יציבה למרחקים ארוכים כדי לשמור על בריאות הנוירונים. פגמים בהובלת מיטוכונדריה, אוטופאגוזומים ושלפוחיות המכילות מבשר חלבון β עמילואיד (APP) דווחו כגורמים למחלות ניווניות 2,3. מחקרים רבים במבחנה חשפו את המנגנונים העומדים בבסיס הובלה מתואמת על ידי חלבונים מוטוריים, ומחקרים שונים המשתמשים בחלבונים מוטוריים מטוהרים ומיקרו-צינורות חשפו כיצד מולקולות מוטוריות נעות לאורך מיקרו-צינורות 4,5. בדרך כלל, מספר מנועים מעורבים במטען יחיד6. עם זאת, ישנם כמה דגמים לאופן שבו המנועים המנוגדים קובעים את כיוון הובלת המטענים. האחד הוא "מודל האסוציאציה/דיסוציאציה"; בכך, רק מנועים חד כיווניים קשורים למטען במהלך ההובלה החד-כיוונית. בשני, "מודל הקואורדינציה", שני המנועים מחוברים לאותו מטען, ורק צד אחד של המנוע מופעל. ב"מודל משיכת החבל" השלישי, מאזן הכוחות בין קינזינים לדיניינים קובע את כיוון התחבורה 7,8,9. בנוסף, מספר דיווחים הציעו כי האיזון ומספר החלבונים המוטוריים המופעלים משפיעים על מהירות הובלת המטען במבחנה 8,10.
שאלה ללא תשובה היא כיצד פעילויות אלה של קינזינים או דינינים מווסתות בתאים חיים. דיווחים קודמים הראו אצטילציה של מיקרו-צינורות באקסונים, וגורמים נוירוטרופיים משפרים את ההובלה האקסונלית11,12. כמו כן, סוגים שונים של מתאמי מטען ומטען מתפקדים כמפעילי מנוע בדרכים מתאימות13,14. רבים קשורים לקרום שלפוחיות ההובלה, ותפקידיהם מוסדרים על ידי אותות כגון שינויים לאחר תרגום15. לכן, התבוננות בכיוון ומהירות ההובלה בתאים חיים מציעה תובנה חשובה לגבי הוויסות המולקולרי של הובלת מטענים בניסויי מבחנה. התצפית על הובלה אקסונלית מאפשרת להבחין בין הובלה מבוססת קינזין לדינין. מכיוון שאקסונים מכילים מיקרו-צינורות חד-כיווניים פלוס16, המטען מועבר אנטרוגרדית (כלומר, סומה למסוף האקסון) על ידי קינזינים ולאחור (כלומר, מסוף אקסון לסומה) על ידי דינינים.
במחקר הנוכחי מתוארת שיטה להתבוננות וניתוח הובלה אקסונלית בנוירונים מתורבתים ראשוניים. כדוגמה, מתואר ההליך להתבוננות בהובלה האקסונלית של חלבוני ממברנה-APP, קלסינטנין-1/אלקדין α (Alcα), ושלפוחיות המכילות קלסינטנין-3/אלקדין β (Alcβ). ידוע כי ההובלה האנטרוגרדית של שלפוחיות המכילות APP מהירה משמעותית מזו של שלפוחיות המכילות Alcα, אם כי שתיהן מועברות על ידי קינזין-1 17,18,19. בדוחות קודמים נעשה שימוש במספר שיטות למדידת מהירות. השלב המשתנה ביותר הוא טיפול בהפסקות במהלך ההובלה. בתאים חיים, ההובלה מעוכבת לפעמים על ידי מכשולים לאורך המיקרו-צינורות; עם זאת, מנועים יכולים לעקוף אזור עם או בלי הפסקה20. חישוב המהירות על פני זמן תצפית ארוך יותר עשוי להיות מושפע מההפסקה, מה שעלול לגרום להערכת מהירות איטית יותר. כאן, מתוארת שיטה המשתמשת בתנועה על פני תקופה מפולחת (200 אלפיות השנייה) כדי לא לכלול את השפעת ההפסקה הפיזית של מנועים. לבסוף, מוצגת תוכנה בגישה פתוחה (Windows בלבד) בשם "KYMOMAKER"21. קימוגרפים נמצאים בשימוש נרחב להמחשת הובלה שלפוחית והם שימושיים להמחשת כיוון ההובלה של כל מטען ללא צורך בסרט. התוכנה מייצרת קימוגרפים מסרטי זמן-lapse על ידי יישום אלגוריתם פרשת מים חד מימדי מספר פעמים במהלך סיבוב התמונות. זה מאפשר לקימוגרף המתקבל להציג מבנים עדינים ביעילות ובקלות. יתר על כן, KYMOMAKER מזהה ומדגיש שבילים באופן אוטומטי בהתאם לכיוונם ומאפשר יצירת דיאגרמות קלות להבנה.
Protocol
הניסויים אושרו על ידי הוועדה למחקרים בבעלי חיים של אוניברסיטת הוקאידו, בהתאם להנחיות ARRIVE (מחקר בבעלי חיים: דיווח על ניסויים in vivo). נקבות עכברי C57BL/6J (בהריון, 15.5 ימים) שימשו למחקר הנוכחי.
1. הכנת נוירונים מתורבתים ראשוניים בקליפת המוח של עכברים
- הוסף 0.1 מ"ג/מ"ל של פולי-L-ליזין ב-0.1 M Tris (tris(hydroxymethyl)aminomethane)-HCl (pH 8.5) לתוך תא תחתית זכוכית עם 8 בארות (מס' 1.0) (ראה טבלת חומרים). דגרו את החדר בחממה של 37 מעלות צלזיוס למשך שעה לפחות.
- שוטפים את החדר במים מעוקרים לפחות שלוש פעמים ומייבשים באוויר במכסה המנוע לתרבית רקמות.
- להקריב את העכברים ההרים בגיל 15.5 יום על ידי פריקת צוואר הרחם, או על פי תקנות שאושרו על ידי המוסד.
- צבטו את קרן הרחם המכילה את העוברים, בודדו את כל קרני הרחם בעזרת מספריים וטבלו אותן במי מלח קרים עם פוספט (PBS) על קרח.
- ב- PBS קר יש לבודד את העוברים באמצעות פינצטה חדה ולהוציא את כל קרומי השפיר מהעוברים.
- שטפו את העוברים שוב עם PBS קר טרי.
הערה: במהלך כל שלב בידוד, שטפו כמה שיותר דם והקפידו לא לפגוע בכלי הדם או בעוברים. - מניחים עובר על גזה מעוקרת בצלחת פטרי קרה תחת מיקרוסקופ אור.
- בודד את המוח. חותכים את עור הראש והגולגולת של העובר בעזרת קצה פינצטה חדה ומעוקלת. הסר את העור והגולגולת כדי לחשוף את החלק העליון והצדדים של המוח.
- הוציאו את כל המוח באמצעות החלק המעוקל של הפינצטה וטבלו אותו בצלחת פטרי המכילה תמיסת מלח מאוזנת של הנקס (HBSS; 10 מ"מ HEPES [pH 7.6], 5.3 מ"מ KCl, 0.44 מ"מ KH2PO4, 140 מ"מ NaCl, 4.2 מ"מ NaHCO3, 0.34 מ"מ Na2HPO4, 39 מ"מ D-גלוקוז, ו-0.5 מיקרוגרם/מ"ל גנטמיצין; ראה טבלת חומרים).
- חזור על שלבים 1.7-1.9 עד לקבלת מספר המוחות הנדרש.
הערה: בדרך כלל, ניתן להשיג 5 x 106 עד 2 x 107 תאים למוח. - הפרד את קליפת המוח22 מהמוח באמצעות פינצטה ב-HBSS קר 1x וקרע את קרומי המוח מקליפת המוח.
- העבירו את קליפת המוח לצלחת פטרי חדשה המכילה 1x HBSS קר. חותכים את קליפת המוח לשניים או לשליש באמצעות להבים כירורגיים.
- העבירו את קליפת המוח לצינור צנטריפוגה של 15 מ"ל באמצעות קצות של 1,000 מיקרוליטר חתוכים בקצה והסירו עודף 1x HBSS.
- יש להוסיף 100 יחידות פפאין ו-200 מיקרוגרם דאוקסיריבונוקלאז I (DNase I) מדולל ב-5 מ"ל תמיסת פפאין מדוללת (5 מ"ג/מ"ל D-גלוקוז, 0.2 מ"ג/מ"ל אלבומין בסרום בקר ו-0.2 מ"ג/מ"ל L-ציסטאין ב-1x PBS; ראה טבלת חומרים) לכל עובר, ולדגור באמבט מים של 37 מעלות צלזיוס למשך 15 דקות. הפוך את הצינור כל 5 דקות במהלך הדגירה.
הערה: מומלץ דגירה מוקדמת של פפאין בתמיסה מדוללת פפאין. דגירה למשך 5 דקות באמבט מים של 37 מעלות צלזיוס, ולאחר מכן הוסף DNase I. - השליכו את הפתרון. הוסף 2 מ"ל של 20% סרום סוס מומת בחום (ראה טבלת חומרים) ב-1x HBSS. דגירה למשך דקה.
- השליכו את הפתרון. שוטפים את הרקמה עם 4 מ"ל של 1x HBSS פעמיים.
- השליכו את הפתרון. הוסף 0.5 מ"ל לכל עובר של מדיום ציפוי (מדיום נוירובזאלי המכיל 2% תוסף B-27, 4 מ"מ גלוטמקס, 5% סרום סוסים מומת בחום ו-1x פניצילין-סטרפטומיצין; ראה טבלת חומרים).
הערה: במהלך שלבים 1.14-1.17, אין צורך בצנטריפוגה מכיוון שחלקי קליפת המוח החתוכים שוקעים לתחתית הצינור בלעדיה. אל תשתמש בשואב, ואל תשאב את החלקים. - יש להשעות בעדינות רבה בעזרת קצה חתוך של 1,000 מיקרוליטר או פיפטה של 10 מ"ל 5 עד 10 פעמים.
- השעו בעדינות רבה עם קצה של 1,000 מיקרוליטר 10 פעמים.
- צנטריפוגה בטמפרטורה של 250 × גרם בטמפרטורת החדר (20-25 מעלות צלזיוס) למשך 3 דקות.
- הסר את הסופרנטנט והשהה מחדש בעדינות רבה עם 0.5 מ"ל לעובר של מדיום ציפוי באמצעות קצה של 1,000 מיקרוליטר 10 פעמים.
- הנח מסננת תאים של 40 מיקרומטר על צינור צנטריפוגה של 50 מ"ל, ולאחר מכן סנן את מתלה התא על ידי זרימת כוח הכבידה. אסוף את תרחיף התאים המסונן בצינור.
- ספרו את התאים והצלחת לתאים ב-2 × 104 עד 5 × 104 תאים / ס"מ2, עם נפח מתאים של מדיום ציפוי. דוגמה לצפיפות מוצגת באיור משלים 1.
- ביום במבחנה (Div.) 2, החלף מחצית מהמדיום במדיום תרבית (מדיום נוירו-בזאלי המכיל 2% תוסף B-27, 4 מ"מ גלוטמקס ו-1x פניצילין-סטרפטומיצין) והוסף 5 מיקרומטר של 5-פלואורו-2-דאוקסיורידין (ראה טבלת חומרים).
- לאחר Div. 4, החלף מחצית מהמדיום במדיום תרבית כל יומיים או שלושה.
2. טרנספקציה של פלסמידים לנוירון מתורבת ראשוני בשיטת סידן פוספט
הערה: הכרכים שהוזכרו מיועדיםלבאר של 0.8 ס"מ 2 בתא עם תחתית זכוכית בת 8 בארות (ראה טבלת חומרים).
- הכן 50 מיקרוליטר של תמיסת DNA/CaCl2 על ידי ערבוב של 200 ננוגרם עד 2 מיקרוגרם של פלסמיד (APP-EGFP ב-pCAGGS, Alcα-EGFP ב-pcDNA3.118, או Alcβ-EGFP ב-pcDNA3.1; ראה טבלה משלימה 1) מקודד חלבון מתויג פלואורסצנטי, 6.2 מיקרוליטר של 2 M CaCl2, ומים מעוקרים.
- הכניסו 50 מיקרוליטר של 2x תמיסת מלח חוצצת HEPES (HBS) לתוך צינורות צנטריפוגות חדשים.
- הוסף 6.2 μL של תמיסת DNA/CaCl2 לפתרון HBS 2x. יש לערבב בעדינות על ידי פיפטינג 10 פעמים.
- חזור על שלב 2.3 עד שכל תמיסת ה-DNA/CaCl2 הועברה.
- דגירה בטמפרטורת החדר למשך 15 דקות.
- אוספים את מדיום התרבות בתא תחתית הזכוכית ומחליפים אותו במדיום תרבית טרי ללא אנטיביוטיקה.
הערה: שמור את המדיום שנאסף בחממת תרבית התאים עד שלב 2.10. - הוסף 50 מיקרוליטר מתערובת ה-DNA/CaCl2/HBS לכל באר טיפתית לנוירונים. תרבות למשך שעה.
- במהלך הדגירה, הכינו מדיום מחומצן על ידי הנחת צלחת פטרי המכילה DMEM (מדיום הנשר המותאם של דולבקו)/מדיה F-12 של האם בחממה של 10% CO2 בטמפרטורה של 37 מעלות צלזיוס.
- לאחר הדגירה במשך שעה אחת לאחר הטרנספקציה, שטפו את הנוירונים הראשוניים עם F-12 (מדיום מחומצן) של DMEM/Ham 3 פעמים.
- החלף את המדיה בתערובת של מדיה שנאספה למחצה ומדיה תרבותית חצי טרייה. תרבית עד לתצפית במיקרוסקופיה ב-37 מעלות צלזיוס ו-5% CO2.
3. תצפית על הובלה אקסונלית
- דגרו מראש את החדר המצויד במיקרוסקופ TIRF (החזר פנימי כולל) (ראה טבלת חומרים) ב-37 מעלות צלזיוס.
- אם בקר CO2 מצויד, מדיום התרבות יכול לשמש כאמצעי תצפית מתחת ל-5% CO2. אם הוא אינו מצויד, החלף את המדיום במדיום יציב pH, כגון Leibovitz L-15 (ראה טבלת חומרים), המסופק עם 4 מ"מ Glutamax ותוסף B-27 2%.
- מצא תא שעבר טרנספטציה, ואז זהה אקסון. הגדל את זווית האירוע של הלייזר עד שהלייזר משתקף לחלוטין. לאחר מכן, הקטינו את הזווית עד שכל השלפוחיות באקסון יוצגו באופן חזותי (פסאודו-TIRF). השג תמונות עם זמן חשיפה של 200 אלפיות השנייה עבור 150 פריימים (30 שניות).
הערה: בניסוי זה, נעשה שימוש בתאורת פסאוד-TIRF כדי ללכוד את כל שלפוחיות האקסון. ניתן להשתמש במיקרוסקופים אחרים המצוידים במערכות לכידה במהירות גבוהה.
הערה: רשום את כיוון האקסון בכל פעם בשם הקובץ. האזור של קטע האקסון הראשוני או אזור האקסון הסופי נמנע מהתצפית.
4. עיבוד תמונה
- פתח את התמונות שנרכשו באמצעות תוכנת MetaMorph (ראה טבלת חומרים).
- פתח את סרגל הכלים > מדוד > כיול מרחק. הפעל את "החל על כל התמונות הפתוחות" והזן את המרחק בפועל של פיקסל.
- פתח את סרגל הכלים > הצג > סובב. הפעל את תיבת הסימון עבור "כל המישורים". סובב כך שהאקסון יהיה אופקי והכיוון לכיוון מסוף האקסון יהיה ימינה.
- פתח את סרגל הכלים > אזורים > צור אזורים. הגדר את גודל האזור לחיתוך ולחץ על צור. מקם את המסגרת המופיעה בתמונה באזור האקסון לצורך ניתוח. שמרו את רצף התמונות שנוצר כקובץ אוסף.
הערה: בחר אזורים שאינם מכילים אקסונים לא ממוקדים או פסולת. - פתח את סרגל הכלים > הצג גרפיקה >. בחר סרגל כיול כדי להחתים את סרגל קנה המידה. בחר נתונים/שעה כדי להוסיף חותמת זמן לתמונות. הפעל את "כל המישורים". העבר את האובייקטים לשטח המתאים ולחץ על חותמת.
- פתחו את סרגל הכלים > 'ערימה > צרו סרטון'. הזן את קצב הפריימים המתאים ובחר AVI. שמור אותו כקובץ חדש.
5. ציור קימוגרף ואיתור עקבות באמצעות KYMOMAKER
- הורד את KYMOMAKER (ראה טבלת חומרים) ופתח את "Kymoanalysis.exe" בתיקיית KYMOMAKER.
- פתח את "kymoAnalysis.exe" כדי להציג את החלונות הראשיים (איור 1A). בחר קובץ > טען ופתח את סרט ה-AVI שנוצר. יופיע חלון "תצוגה מקדימה" (איור 1B).
- במקטע צור קימוגרף > חיתוך , הזן את מספרי הפיקסלים לחיתוך. החיתוך בא לידי ביטוי מיד בחלון "תצוגה מקדימה" כדי לאפשר התאמה קלה (איור 1C). ודא שכל סרגל קנה המידה וחותמת הזמן הוסרו.
- לחץ על כפתור צור כדי ליצור את הקימוגרף (איור 1C). KYMOMAKER מזהה את הפיקסל הבהיר ביותר בכל ציר y בחלון "תצוגה מקדימה". שמור את הקימוגרף באמצעות קובץ > שמור > קימוגרף רגיל.
- כדי לזהות את העקבות בעוצמה נמוכה בקימוגרף, לחץ על קימוגרף סיבובי. התאימו את המספר בקטע "קימוגרף סיבובי" וצפו בתוצאה על ידי לחיצה על הקימוגרף הסיבובי (איור 1D).
הערה: "סיבוב (מעלות)" הוא מרווח המעלה עבור אלגוריתם פרשת המים הסיבובית21. לדוגמה, 10° פירושו שאלגוריתם פרשת המים מבוצע כל 10° 36 פעמים, ולאחר מכן התוצאות משולבות בחלון "פרשת מים סיבובית". - כדי לזהות את העקבות האנטרוגרדיות והנסיגות בקימוגרף, בכרטיסייה זיהוי > במקטע יעד , בחר מקור אם הקימוגרף הסיבובי לא נוצר. ודא שעל ידי בחירת סיבוב, פרשת המים הסיבובית שנוצרה משמשת לזיהוי עקבות. בחר קו פרשת מים ב"שיטת זיהוי". לחץ על כפתור זיהוי כדי לזהות עקבות באופן אוטומטי.
הערה: עקבות שזוהו מצוירים בחלון "עובד". הפעלת "מיסוך" מושכת עקבות על הקימוגרף המקורי. - זהה את העקבות האנטרוגרדיות והנסיגות על ידי הזנת מספר בקטע זיהוי > סינון > מהירות (איור 1E,F). זיהוי עקבות אנטרוגרדיות על ידי הזנת 0.4 עד 7.0 מיקרומטר לשנייה. זיהוי עקבות לאחור על ידי הזנת -0.4 עד -7.0 מיקרומטר לשנייה.
הערה: ההגדרה למהירות הנמוכה ביותר תלויה בהגדרה של מצב לא נייד של שלפוחית. ראה שלב 6.7. - שמור את הקבצים.
6. קביעת המהירות
- פתח את תוכנת MetaMorph.
הערה: התוסף "מעקב ידני" ב-ImageJ יכול גם לחשב את המהירויות באותן דרכים. - פתח את הקובץ שנוצר בשלב 4.4. ודא שהכיול מותאם לתמונות.
- פתח את סרגל הכלים > אפליקציות > נקודות מעקב. לחץ על הוסף רצועה. מצא שלפוחית נעה שהועברה לפני או לאחור. לאחר מכן, עקוב אחר השלפוחית על-ידי לחיצה עד לסיום התעבורה. לחץ על סיום.
- חזור על שלב 6.3 עד למעקב אחר כל השלפוחיות.
- לחץ על יומן פתוח כדי לפתוח קובץ CSV. לאחר מכן, לחץ על קובץ היומן כדי להציג נתונים בקובץ ה-CSV.
- שמור את קובץ ה- CSV.
- כדי לחשב מהירות מפולחת שאינה מושפעת מההפסקה, הסר מהירויות מחושבות של 0.37 מיקרומטר לשנייה ומטה בעמודת "מהירות".
הערה: שלפוחיות יכולות לנוע זמן קצר מאוד על ידי דיפוזיה חריגה, והן אינן מעובדות על ידי חלבונים מוטוריים23. כדי להימנע מהכללת תנועות אלו מחישוב מהירויות מונעות מנוע, המהירות הנמוכה ביותר (1 פיקסל/200 אלפיות השנייה) בפרוטוקול זה מוסרת מהחישוב. - חשב את המהירות הממוצעת המפולחת כל חמש פריימים (סה"כ 1 שניות). השלך את החלק האחרון של המהירות אם נותרו פחות מחמש פריימים.
- שלב את כל המהירויות הממוצעות ממצב אחד. צור היסטוגרמות כדי לעזור להמחיש את התפלגות המהירויות.
תוצאות
נוירונים מתורבתים ראשוניים מקליפת העכבר E15.5 תורבבו בצלחת עם תחתית זכוכית כמתואר. לדוגמה, APP-EGFP, Alcα-EGFP או Alcβ-EGFP באו לידי ביטוי בתאי העצב הראשוניים בקליפת המוח. ידוע כי APP ו-Alcα מועברים באקסון על ידי קינזין-1 2,17. APP מתקשר לקינזין-1 באמצעות חלבון המתאם JIP1 (חלבון אינטראקציה JNK 1), בעוד ש-Alcα נקשר ישירות באמצעות המוטיבים החומציים הכפולים שלו. Alcβ הוא בן למשפחת Alcadein ויש לו רק מוטיב W-חומצי אחד24. כל חלבון הועבר לתאי עצב Div. 5, והתמונות נרכשו כל 200 אלפיות השנייה באמצעות מיקרוסקופ TIRF 14-16 שעות לאחר הטרנספקציה. מספר שלפוחיות נעות באקסונים נצפו בתאי עצב שהועברו עם APP-EGFP, Alcα-EGFP או Alcβ-EGFP (סרטים משלימים 1-3, בהתאמה).
באמצעות KYMOMAKER, קימוגרפים עבור Alcβ-EGFP נוצרו עם ובלי אלגוריתם פרשת המים הסיבובית (איור 1C,D, בהתאמה). יתר על כן, KYMOMAKER איפשר חילוץ עקבות בכיוונים אנטרוגרדיים ונסיגתיים מהקימוגרפים המקוריים וקו פרשת המים (איור 1E,F). עקבות עיקריים התגלו בשני הקימוגרפים. בהשוואה לשיטה המקורית, יישום אלגוריתם פרשת המים איפשר זיהוי טוב יותר של עקבות בעוצמה נמוכה (איור 1F).
מהירויות השלפוחיות בכל תא עצב היו במעקב וחושבו כמתואר. המהירות של APP-EGFP הייתה 3.05 ±-1.03 מיקרומטר לשנייה, מה שעולה בקנה אחד עם התוצאות הקודמות 18,19. Alcα-EGFP הועבר במהירות של 1.89 ±-0.77 מיקרומטר לשנייה, שהייתה איטית משמעותית מ-APP, בהתאם למהירות המדווחת של קינזין-1. מהירות ההובלה של Alcβ-EGFP הייתה 2.68 ±-1.07 מיקרומטר לשנייה, שנפלה בין המהירויות של Alcα ו-APP. היסטוגרמות נוצרו באמצעות רוחב סל של 0.2 מיקרומטר לשנייה כדי להראות הבדלים בהתפלגות. יתר על כן, חישבנו את היחס היחסי של כיוון ההובלה באמצעות הקימוגרפים שנוצרו עם KYMOMAKER (איור 2A,B). כל שלושת החלבונים הועברו בעיקר בכיוון האנטרוגרדי (איור 2C).

איור 1: זרימת העבודה של שיטת הזיהוי באמצעות KYMOMAKER. (א) הגדרת החלונות הראשיים עבור KYMOMAKER. (B) הסרט שהושג נפתח ב-KYMOMAKER, והאזור שלא הכיל את האקסון הוסר על ידי "חיתוך". (C) על ידי לחיצה על יצירה, נוצר הקימוגרף המקורי. (ד) לחיצה על קימוגרף סיבובי פתחה חלון חדש של "קימוגרף סיבובי", וניתן היה לשנות את פרמטרי הזיהוי בתיבת הדו-שיח העליונה ב-(A). (E) כל עקבה אנטרוגרדית או נסיגה זוהתה מהקימוגרף ב-(C). ניתן לשנות את פרמטרי הזיהוי בתיבת הדו-שיח התחתונה ב-(A). (F) עקבות שזוהו מ-(D). פסי קנה מידה = 5 מיקרומטר. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
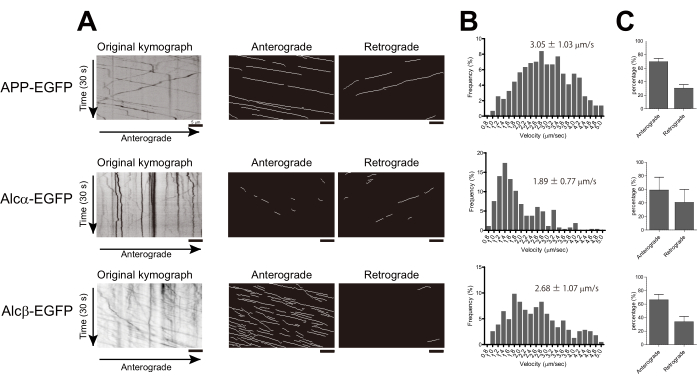
איור 2: חישוב מהירות וכיוון עבור שלפוחיות מועברות קינזין-1. APP-EGFP, Alcα-EGFP או Alcβ-EGFP הועברו ל-Div. 4-6 של נוירונים מתורבתים ראשוניים בקליפת המוח של העכבר, ותמונות האקסונים נרכשו לאחר 14-18 שעות של טרנספקציה. (A) קימוגרפים של הובלה אקסונלית נוצרו באמצעות KYMOMAKER. משמאל: קימוגרף מקורי; באמצע: עקבות אנטרוגרדיות; מימין: עקבות לאחור. (B) מוצגות היסטוגרמות של מהירות ההובלה האנטרוגרדית (n = 583 עבור APP-EGFP, n = 388 עבור Alcβ-EGFP, n = 264 עבור Alcα-EGFP משני ניסויים בלתי תלויים). ממוצע ± SD מוצג בהיסטוגרמות. (C) אחוזי העקבות שהועברו לכל כיוון מוצגים (כל עמודה מראה ממוצע ± SD. n = 2 מניסויים בלתי תלויים, שכל אחד מהם מכיל 10-6 תאים). פסי קנה מידה = 5 מיקרומטר. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
איור משלים 1: צפיפות תרבית של נוירון מתורבת ראשוני על צלחת תחתית זכוכית. תמונת ניגודיות הפרעות דיפרנציאלית (DIC) של נוירונים מתורבתים ראשוניים בקליפת המוח של עכבר Div. 1 מצופה, כמו בשלב 1.23. סרגל קנה מידה = 50 מיקרומטר. אנא לחץ כאן להורדת קובץ זה.
טבלה משלימה 1: המבנים של פלסמידים המשמשים בפרוטוקול זה. אנא לחץ כאן להורדת קובץ זה.
סרטון משלים 1: הובלה אקסונלית של APP-EGFP. הסרט צולם כל 200 אלפיות השנייה במשך 30 שניות. סרגל קנה מידה = 5 מיקרומטר. אנא לחץ כאן להורדת סרט זה.
סרט משלים 2: הובלה אקסונלית של Alcα-EGFP. הסרט צולם כל 200 אלפיות השנייה במשך 30 שניות. סרגל קנה מידה = 5 מיקרומטר. אנא לחץ כאן להורדת סרט זה.
סרט משלים 3: הובלה אקסונלית של Alcβ -EGFP. הסרט צולם כל 200 אלפיות השנייה במשך 30 שניות. סרגל קנה מידה = 5 מיקרומטר. אנא לחץ כאן להורדת סרט זה.
Discussion
מתוארת שיטת ניתוח להובלה אקסונלית, הכוללת חישוב מהירות מפולחת ויצירת קימוגרפים. שלב קריטי במהלך שלב הטרנספקציה הוא שמירה על בריאותם של נוירונים מתורבתים. שיטת הטרנספקציה שתוארה על ידי ג'יאנג וצ'ן29 לוותה בשינויים קלים. ערבוב עדין של תמיסת ה-DNA/CaCl2 ו-2x HBS הגדיל את יעילות הטרנספקציה על ידי הקטנת גודל המשקעים. כדי למנוע מהמשקעים לפגוע בתאים, התאים נשטפו במדיום מחומצן. שטיפות מהירות (פעמיים או שלוש) ללא דגירה הספיקו כדי להסיר משקעים מהתאים. כאן, השתמשנו בתא העצב הראשוני המתורבת; ראוי להזכיר כי ניתן לצפות בהובלה בעצבים סיאטיים בעכברים על ידי מיקרוסקופיה קונפוקלית in vivo עם ניתוח26, והפיתוח האחרון של מיקרוסקופיה מולטיפוטונית איפשר תצפית על הובלה אקסונלית במוחות עכברים27.
קימוגרפים נמצאים בשימוש נרחב כדי להמחיש את המהירות והכיוון של הובלה אקסונלית. ישנם כלים שונים ליצירת קימוגרפים, כולל התוסף פיג'י KymographBuilder. חלקם, כמו KymoAnalyzer או Kymolyzer, יכולים לחשב את הפרמטרים ממסלולים שהוקצו באופן ידנילמחצה 28,29. למרות שתוכנת KYMOMAKER אינה יכולה לשנות את הקצאת העקבות, יש לה את היתרון של הדמיה קלה של עקבות לכל כיוון21. הוא מנהל את תהליך החיתוך, מייצר קימוגרפים על ידי התאמת פרמטרי זיהוי ומחלץ עקבות באופן אוטומטי לפי כיוונים. שימוש בשיטת פרשת המים הסיבובית מאפשר איתור מבנים עדינים. אף על פי שניתן היה לזהות את רוב העקבות, קשה לקבוע אם שתי עקבות היו עצמאיות או מנותקות זמנית, במיוחד במקומות שבהם הצטלבו עקבות. יתר על כן, KYMOMAKER אינו משמש לחישוב הפרמטר של כל עקבה. לספירת עקבות אנטרוגרדית ונסיגה, מומלץ להשתמש בחלון "קימוגרף", המסווה את העקבות שזוהו בקווים אדומים.
לשיטת חישוב זו יש יתרון בכך שהיא לא כוללת את ההשפעה של הפסקות בלתי צפויות על תאים חיים. הפסקות יכולות להיגרם על ידי מכשולים פיזיים, כגון מנועים ומטען אחרים, וחלבונים הקשורים למיקרו-צינוריות, כגון טאו20,30. חישוב מהירות ההובלה בוצע באמצעות מספר נהלים. בדרך כלל, פרקי זמן ארוכים יותר (יותר מכמה שניות) משמשים לקביעת מרחק ההובלה, כולל ההשהיה. עם זאת, באמצעות תקופות מפולחות (200 אלפיות השנייה), פרוטוקול זה יכול לזהות ולהסיר הפסקות מהחישוב בצורה יעילה יותר. במקרים מסוימים, מהירות המטען הראתה התפלגות של שתיים או שלוש שיאים, כמו המקרה ב-Alcβ, שעשויה לשקף את הסוגים או הסטטוסים השונים של חלבונים מוטוריים מעורבים. לפיכך, מומלץ ליצור היסטוגרמה כדי להמחיש את התפלגות המהירויות, ושיטת חישוב מדויקת יותר זו יכולה לתרום להערכה ברורה יותר של מהירויות השיא.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
עבודה זו נתמכה על ידי KAKENHI (22K15270, מענק סיוע למדענים צעירים) וקרן אקיאמה למדעי החיים עבור YS. ברצוננו להביע את תודתנו לד"ר מסאטקה קינג'ו ולד"ר אקירה קיטאמורה, המעבדה לדינמיקה מולקולרית של התא, הפקולטה למדעי החיים המתקדמים, אוניברסיטת הוקאידו על מתן קלט ומומחיות קריטיים שסייעו רבות למחקר. התצפית במיקרוסקופ TIRF בוצעה באמצעות המכשיר שהותקן במעבדה לדינמיקה מולקולרית של התא, הפקולטה למדעי החיים המתקדמים, אוניברסיטת הוקאידו. המכשיר רשום במערכת Open Facility המנוהלת על ידי מרכז המתקנים הגלובלי, מכון המחקר היצירתי, אוניברסיטת הוקאידו (AP-100138). אנו מודים לד"ר Seiichi Uchida, מעבדת ממשק אנושי, המחלקה לטכנולוגיית מידע מתקדמת, הפקולטה למדעי המידע והנדסת חשמל, אוניברסיטת קיושו, פוקואוקה, יפן, על ההרכבה עם האפליקציה Kymomaker. מעבדת מניעה ומחקר מתקדמת לדמנציה, בית הספר לתארים מתקדמים למדעי התרופות, אוניברסיטת הוקאידו נתמכת על ידי Japan Medical Leaf co., Ltd.
Materials
| Name | Company | Catalog Number | Comments |
| 5-Fluoro-2-deoxyuridine | Sigma-Aldrich | F0503 | |
| Apo TIRF 100x/1.49 OIL | Nikon | ||
| B-27 Supplement (50x), serum free | Thermo fischer scientific | 17504044 | |
| Bovine serum albumin | Wako | 013-25773 | |
| CalPhos Mammalian Transfection Kit | Takara | 631312 | |
| Cell strainer 40 µm Nylon | Falcon | 352340 | |
| CoolSNAP HQ | Photometrics | ||
| Deoxyribonuclease I | Sigma-Aldrich | DN-25 | |
| D-Glucose | Wako | 041-00595 | |
| DMEM/Ham’s F-12 | Wako | 042-30555 | |
| Dumont No. 7 forceps | Dumont | No.7 | |
| Feather surgical blade | Feather | No.11 | |
| Feather surgical blade handle | Feather | No. 3 | |
| Gentamicin | Wako | 079-02973 | |
| Gentamicin Sulfate | Wako | 075-04913 | |
| GlutaMAX Supplement | Thermo fischer scientific | 35050061 | |
| HEPES | DOJINDO | 342-01375 | |
| Horse Serum, heat inactivated | Thermo fischer scientific | 26050088 | |
| KCl | Wako | 163-03545 | |
| KH2PO4 | Wako | 169-04245 | |
| KYMOMAKER | http://www.pharm.hokudai.ac.jp/shinkei/Kymomaker.html | ||
| L-15 Medium (Leibovitz) | Sigma-Aldrich | L5520 | |
| MetaMorph version 6.2r1 | Metamorph | ||
| Na2HPO4 | Wako | 197-02865 | |
| NaCl | Wako | 197-01667 | |
| NaHCO3 | Wako | 191-01305 | |
| Neurobasal Medium | Thermo fischer scientific | 21103049 | |
| Nikon ECLIPSE TE 2000-E | Nikon | ||
| Nunc Lab-Tek 8 well Chambered Coverglass | Thermo fischer scientific | 155411 | |
| Papain | Worthington | LS003126 | |
| Penicillin-Streptomycin (10,000 U/mL) | Thermo Fisher Scientific | 15140122 | |
| Poly-L-lysine hydrobromide | Sigma-Aldrich | P2636-500MG | |
| Trizma base | Merck | T1194-10PAK | solved with water to make 0.1 M Tris-HCl (pH.8.5) |
References
- Hirokawa, N., Noda, Y., Tanaka, Y., Niwa, S. Kinesin superfamily motor proteins and intracellular transport. Nature Reviews Molecular Cell Biology. 10 (10), 682-696 (2009).
- Stokin, G. B., et al. Axonopathy and transport deficits early in the pathogenesis of Alzheimer's diseases. Science. 307 (5713), 1282-1288 (2005).
- Guo, W., Stoklund Dittlau, K., vanden Bosch, L. Axonal transport defects and neurodegeneration: Molecular mechanisms and therapeutic implications. Seminars in Cell & Developmental Biology. 99, 133-150 (2020).
- Svoboda, K., Schmidt, C. F., Schnapp, B. J., Block, S. M. Direct observation of kinesin stepping by optical trapping interferometry. Nature. 365 (6448), 721-727 (1993).
- Carter, N. J., Cross, R. A. Mechanics of the kinesin step. Nature. 435 (7040), 308-312 (2005).
- Welte, M. A. Bidirectional transport along microtubules. Current Biology. 14 (13), R525-R537 (2004).
- Hendricks, A. G., et al. Motor coordination via a tug-of-war mechanism drives bidirectional vesicle transport. Current Biology. 20 (8), 697-702 (2010).
- Rezaul, K., et al. Engineered tug-of-war between kinesin and dynein controls direction of microtubule based transport in vivo. Traffic. 17 (5), 475-486 (2016).
- Encalada, S. E., Goldstein, L. S. B. Biophysical challenges to axonal transport: motor-cargo deficiencies and neurodegeneration. Annual Review of Biophysics. 43, 141-169 (2014).
- Monzon, G. A., et al. Stable tug-of-war between kinesin-1 and cytoplasmic dynein upon different ATP and roadblock concentrations. Journal of Cell Science. 133 (22), 226248(2020).
- Guo, W., et al. HDAC6 inhibition reverses axonal transport defects in motor neurons derived from FUS-ALS patients. Nature Communications. 8 (1), 861(2017).
- Tosolini, A. P., et al. BDNF-dependent modulation of axonal transport is selectively impaired in ALS. Acta Neuropathologica Communications. 10 (1), 121(2022).
- Verhey, K. J., Hammond, J. W. Traffic control: regulation of kinesin motors. Nature Reviews Molecular Cell Biology. 10 (11), 765-777 (2009).
- Fu, M. M., Holzbaur, E. L. F. Integrated regulation of motor-driven organelle transport by scaffolding proteins. Trends in Cell Biology. 24 (10), 564-574 (2014).
- Kumari, D., Ray, K. Phosphoregulation of kinesins involved in long-range intracellular transport. Frontiers in Cell and Developmental Biology. 10, 873164(2022).
- Wai Yau, K., et al. Cellular/molecular dendrites in vitro and in vivo contain microtubules of opposite polarity and axon formation correlates with uniform plus-end-out microtubule orientation. The Journal of Neuroscience. 36 (4), 1071-1085 (2016).
- Araki, Y., et al. The novel cargo Alcadein induces vesicle association of kinesin-1 motor components and activates axonal transport. The EMBO Journal. 26 (6), 1475-1486 (2007).
- Sobu, Y., et al. Phosphorylation of multiple sites within an acidic region of Alcadein α is required for kinesin-1 association and Golgi exit of Alcadein α cargo. Molecular Biology of the Cell. 28 (26), 3844-3856 (2017).
- Tsukamoto, M., et al. The cytoplasmic region of the amyloid β-protein precursor (APP) is necessary and sufficient for the enhanced fast velocity of APP transport by kinesin-1. FEBS Letters. 592 (16), 2716-2724 (2018).
- Ferro, L. S., Can, S., Turner, M. A., Elshenawy, M. M., Yildiz, A. Kinesin and dynein use distinct mechanisms to bypass obstacles. eLife. 8, e48629(2019).
- Chiba, K., Shimada, Y., Kinjo, M., Suzuki, T., Uchida, S. Simple and direct assembly of kymographs from movies using KYMOMAKER. Traffic. 15 (1), 1-11 (2014).
- Xu, S. -Y., Wu, Y. -M., Ji, Z., Gao, X. -Y., Pan, S. -Y. A modified technique for culturing primary fetal rat cortical neurons. Journal of Biomedicine and Biotechnology. 2012, 803930(2012).
- Han, D., et al. Deciphering anomalous heterogeneous intracellular transport with neural networks. eLife. 9, e52224(2020).
- Araki, Y., et al. Novel cadherin-related membrane proteins, Alcadeins, enhance the X11-like protein-mediated stabilization of amyloid beta-protein precursor metabolism. The Journal of Biological Chemistry. 278 (49), 49448-49458 (2003).
- Jiang, M., Chen, G. High Ca2+-phosphate transfection efficiency in low-density neuronal cultures. Nature Protocols. 1 (2), 695-700 (2006).
- Tosolini, A. P., Villarroel-Campos, D., Schiavo, G., Sleigh, J. N. Expanding the toolkit for in vivo imaging of axonal transport. Journal of Visualized Experiments. (178), e63471(2021).
- Takihara, Y., et al. In vivo imaging of axonal transport of mitochondria in the diseased and aged mammalian CNS. Proceedings of the National Academy of Sciences. 112 (33), 10515-10520 (2015).
- Neumann, S., Chassefeyre, R., Campbell, G. E., Encalada, S. E. KymoAnalyzer: a software tool for the quantitative analysis of intracellular transport in neurons. Traffic. 18 (1), 71-88 (2017).
- Basu, H., Ding, L., Pekkurnaz, G., Cronin, M., Kymolyzer Schwarz, T. L. a semi-autonomous kymography tool to analyze intracellular motility. Current Protocols in Cell Biology. 87 (1), 107(2020).
- Dixit, R., Ross, J. L., Goldman, Y. E., Holzbaur, E. L. F. Differential regulation of dynein and kinesin motor proteins by tau. Science. 319 (5866), 1086-1089 (2008).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved