Method Article
Medindo o transporte de carga axonal em neurônios cultivados corticais primários de camundongos
Neste Artigo
Resumo
O presente protocolo descreve todo o procedimento de análise do transporte axonal. Em particular, o cálculo da velocidade de transporte, sem incluir a pausa, e o método de visualização usando o software de acesso aberto "KYMOMAKER" são mostrados aqui.
Resumo
As células neuronais são células altamente polarizadas que abrigam estereotipadamente vários dendritos e um axônio. O comprimento de um axônio requer transporte bidirecional eficiente por proteínas motoras. Vários relatos sugeriram que defeitos no transporte axonal estão associados a doenças neurodegenerativas. Além disso, o mecanismo de coordenação de múltiplas proteínas motoras tem sido um tópico atraente. Como o axônio possui microtúbulos unidirecionais, é mais fácil determinar quais proteínas motoras estão envolvidas no movimento. Portanto, entender os mecanismos subjacentes ao transporte de carga axonal é crucial para descobrir o mecanismo molecular de doenças neurodegenerativas e a regulação de proteínas motoras. Aqui, apresentamos todo o processo de análise do transporte axonal, incluindo a cultura de neurônios corticais primários de camundongos, transfecção de plasmídeos que codificam proteínas de carga e análises direcionais e de velocidade sem o efeito de pausas. Além disso, é introduzido o software de acesso aberto "KYMOMAKER", que permite a geração de um quimógrafo para destacar traços de transporte de acordo com sua direção e permitir uma visualização mais fácil do transporte axonal.
Introdução
Os membros da família da cinesina e a dineína citoplasmática são proteínas motoras que se movem ao longo dos microtúbulos das células para transportar sua carga1. A maioria das cinesinas se move em direção à extremidade positiva, enquanto a dineína se move em direção à extremidade negativa de um microtúbulo. As funções e mecanismos de transporte de carga no axônio neuronal foram investigados extensivamente. Devido ao seu comprimento, os axônios requerem transporte estável de longa distância para manter a saúde dos neurônios. Defeitos no transporte de mitocôndrias, autofagossomos e vesículas contendo precursor da proteína β amilóide (APP) têm sido relatados como causas de doenças neurodegenerativas 2,3. Numerosas investigações in vitro revelaram os mecanismos subjacentes ao transporte coordenado por proteínas motoras, e vários estudos usando proteínas motoras purificadas e microtúbulos descobriram como as moléculas motoras se movem ao longo dos microtúbulos 4,5. Normalmente, vários motores estão envolvidos em uma única carga6. No entanto, existem alguns modelos de como os motores opostos determinam a direção do transporte de carga. Um é o "modelo de associação/dissociação"; Neste, apenas motores unidirecionais estão associados à carga durante o transporte unidirecional. No segundo, o "modelo de coordenação", ambos os motores são acoplados à mesma carga e apenas um lado do motor é ativado. No terceiro "modelo de cabo de guerra", o equilíbrio de forças entre cinesinas e dineínas determina a direção do transporte 7,8,9. Além disso, vários relatos têm sugerido que o balanço e o número de proteínas motoras ativadas influenciam a velocidade de transporte de carga in vitro 8,10.
Uma questão sem resposta é como essas atividades de cinesinas ou dineínas são reguladas nas células vivas. Relatos anteriores mostraram acetilação de microtúbulos em axônios e fatores neurotróficos aumentam o transporte axonal11,12. Além disso, vários tipos de carga e adaptadores de carga funcionam como ativadores motores de maneiras correspondentes13,14. Muitos estão associados à membrana das vesículas de transporte, e suas funções são reguladas por sinais como modificações pós-traducionais15. Portanto, observar a direção e a velocidade do transporte em células vivas oferece informações valiosas sobre a regulação molecular do transporte de carga em experimentos in vitro. A observação do transporte axonal permite distinguir entre o transporte baseado em cinesina e dineína. Como os axônios abrigam microtúbulos unidirecionais mais extremos16, a carga é transportada anterógrada (ou seja, soma para o terminal do axônio) por cinesinas e retrógrada (ou seja, terminal do axônio para soma) por dineínas.
No presente estudo, é descrito um método para observar e analisar o transporte axonal em neurônios primários cultivados. Como exemplo, o procedimento para observar o transporte axonal de proteínas de membrana - APP, calsintenina-1 / alcadeína α (Alcα) e calsintenina-3 / alcadeína β (Alcβ) - é descrito. Sabe-se que o transporte anterógrado de vesículas contendo APP é consideravelmente mais rápido do que o de vesículas contendo Alcα, embora ambas sejam transportadas por cinesina-1 17,18,19. Em relatórios anteriores, vários métodos foram usados para medir a velocidade. A etapa mais variável é o manuseio de pausas durante o transporte. Nas células vivas, o transporte às vezes é dificultado por obstáculos ao longo dos microtúbulos; no entanto, os motores podem contornar uma região com ou sem pausa20. O cálculo da velocidade em um tempo de observação mais longo pode ser afetado pela pausa, o que pode resultar em uma estimativa de velocidade mais lenta. Aqui, um método é descrito usando o movimento em um período segmentado (200 ms) para excluir o efeito da pausa física dos motores. Finalmente, um programa de software de acesso aberto (somente Windows) chamado "KYMOMAKER"21 é introduzido. Os quimógrafos são amplamente utilizados para visualizar o transporte vesicular e são úteis para visualizar a direção do transporte de cada carga sem a necessidade de um filme. O software gera quimógrafos a partir de filmes com lapso de tempo aplicando um algoritmo de bacia hidrográfica unidimensional várias vezes durante a rotação das imagens. Isso permite que o quimógrafo resultante mostre estruturas finas de forma eficiente e fácil. Além disso, o KYMOMAKER detecta e destaca automaticamente as trilhas de acordo com sua direção e permite a criação de diagramas fáceis de entender.
Protocolo
Os experimentos foram aprovados pelo Comitê de Estudos Animais da Universidade de Hokkaido, seguindo as diretrizes ARRIVE (Animal Research: Reporting of In Vivo Experiments). Camundongos C57BL/6J fêmeas (prenhes, 15,5 dias) foram utilizados para o presente estudo.
1. Preparação de neurônios primários cultivados corticais de camundongos
- Adicione 0,1 mg / mL de poli-L-lisina em 0,1 M Tris (tris (hidroximetil) aminometano) -HCl (pH 8,5) em uma câmara de fundo de vidro de 8 poços (No.1.0) (consulte a Tabela de Materiais). Incubar a câmara numa incubadora a 37 °C durante um mínimo de 1 h.
- Enxágue a câmara com água esterilizada no mínimo três vezes e seque ao ar em uma capa de cultura de tecidos.
- Sacrifique os camundongos prenhes em 15,5 dias por luxação cervical ou seguindo os regulamentos aprovados institucionalmente.
- Aperte o corno uterino contendo os embriões, isole todos os cornos uterinos usando uma tesoura e mergulhe-os em solução salina tamponada com fosfato frio (PBS) no gelo.
- Na PBS fria, isole os embriões usando uma pinça afiada e remova todas as membranas amnióticas dos embriões.
- Lave os embriões novamente com PBS fresco e frio.
NOTA: Durante cada etapa de isolamento, lave o máximo de sangue possível e certifique-se de não danificar os vasos ou embriões. - Coloque um embrião em uma gaze esterilizada em uma placa de Petri fria sob microscopia de luz.
- Isole o cérebro. Corte a pele da cabeça e o crânio do embrião usando a ponta de uma pinça curva e afiada. Remova a pele e o crânio para expor a parte superior e os lados do cérebro.
- Retire todo o cérebro usando a parte curva da pinça e mergulhe-o em uma placa de Petri contendo 1x solução salina balanceada de Hanks gelada (HBSS; 10 mM HEPES [pH 7,6], 5,3 mM KCl, 0,44 mM KH2PO4, 140 mM NaCl, 4,2 mM NaHCO3, 0,34 mM Na2HPO4, 39 mM D-glicose, e 0,5 μg/mL de gentamicina; ver Tabela de Materiais).
- Repita as etapas 1.7-1.9 até que o número necessário de cérebros seja obtido.
NOTA: Normalmente, 5 x 106 a 2 x 107 células por cérebro podem ser obtidas. - Separe o córtex22 do cérebro usando uma pinça em HBSS frio 1x e arranque as meninges do córtex.
- Transfira o córtex para uma nova placa de Petri contendo 1x HBSS frio. Corte o córtex ao meio ou em terços usando lâminas cirúrgicas.
- Transfira o córtex para um tubo de centrífuga de 15 mL usando pontas de 1.000 μL cortadas na ponta e remova o excesso de 1x HBSS.
- Adicione 100 unidades de papaína e 200 μg de desoxirribonuclease I (DNase I) diluída com 5 mL de solução diluída de papaína (5 mg / mL de D-glicose, 0,2 mg / mL de albumina de soro bovino e 0,2 mg / mL de L-cisteína em 1x PBS; ver Tabela de Materiais) por embrião e incube em banho-maria a 37 ° C por 15 min. Inverta o tubo a cada 5 minutos durante a incubação.
NOTA: Recomenda-se a pré-incubação da papaína em solução diluída de papaína. Incubar durante 5 min num banho-maria a 37 °C e, em seguida, adicionar DNase I. - Descarte a solução. Adicione 2 mL de soro de cavalo inativado por calor a 20% (consulte a Tabela de Materiais) em 1x HBSS. Incubar por 1 min.
- Descarte a solução. Enxágue o tecido com 4 mL de 1x HBSS duas vezes.
- Descarte a solução. Adicione 0,5 mL por embrião de meio de plaqueamento (meio neurobasal contendo 2% de suplemento de B-27, 4 mM de Glutamax, 5% de soro de cavalo inativado pelo calor e 1x penicilina-estreptomicina; ver Tabela de Materiais).
NOTA: Durante as etapas 1.14-1.17, nenhuma centrifugação é necessária, pois os pedaços do córtex cortado afundam no fundo do tubo sem ela. Não use um aspirador e não aspire as peças. - Ressuspenda muito suavemente com uma ponta cortada de 1.000 μL ou pipeta de 10 mL 5 a 10 vezes.
- Ressuspenda muito suavemente com uma ponta de 1.000 μL 10 vezes.
- Centrifugue a 250 × g à temperatura ambiente (20-25 °C) por 3 min.
- Remova o sobrenadante e ressuspenda muito suavemente com 0,5 mL por embrião de meio de plaqueamento usando uma ponta de 1.000 μL 10 vezes.
- Coloque um filtro de células de 40 μm em um tubo de centrífuga de 50 mL e, em seguida, filtre a suspensão da célula por fluxo por gravidade. Recolha a suspensão de células filtradas no tubo.
- Contar as células e a placa para as câmaras a 2 × 104 a 5 × 104 células/cm2, com um volume adequado de meio de plaqueamento. Um exemplo da densidade é mostrado na Figura Suplementar 1.
- No dia in vitro (Div.) 2, substitua metade do meio por meio de cultura (meio neurobasal contendo 2% de suplemento de B-27, 4 mM de Glutamax e 1x penicilina-estreptomicina) e adicione 5 μM de 5-fluoro-2-desoxiuridina (ver Tabela de Materiais).
- Após a Div. 4, substitua metade do meio por meio de cultura a cada 2 ou 3 dias.
2. Transfecção de plasmídeos para neurônio primário cultivado usando o método de fosfato de cálcio
NOTA: Os volumes mencionados são para um poçode 0,8 cm 2 em uma câmara de fundo de vidro de 8 poços (ver Tabela de Materiais).
- Prepare 50 μL de solução de DNA / CaCl2 misturando 200 ng a 2 μg de um plasmídeo (APP-EGFP em pCAGGS, Alcα-EGFP em pcDNA3.118 ou Alcβ-EGFP em pcDNA3.1; ver Tabela Suplementar 1) codificando uma proteína marcada com fluorescência, 6,2 μL de 2 M CaCl2 e água esterilizada.
- Alíquota de 50 μL de solução salina tamponada com HEPES 2x (HBS) em novos tubos de centrífuga.
- Adicione 6,2 μL de solução de DNA/CaCl2 à solução 2x HBS. Misture delicadamente pipetando 10 vezes.
- Repita a etapa 2.3 até que toda a solução de DNA/CaCl2 tenha sido transferida.
- Incubar à temperatura ambiente durante 15 min.
- Recolher o meio de cultura na câmara com fundo de vidro e substituí-lo por meio de cultura fresco sem antibióticos.
NOTA: Mantenha o meio coletado na incubadora de cultura de células até a etapa 2.10. - Adicione 50 μL da mistura DNA / CaCl2 / HBS por poço gota a gota aos neurônios. Cultura por 1 h.
- Durante a incubação, preparar o meio acidificado colocando uma placa de Petri contendo o meio DMEM (meio de Eagle modificado de Dulbecco)/F-12 de Ham numa incubadora de CO2 a 10% a 37 °C.
- Após incubação por 1 h após a transfecção, enxágue os neurônios primários com DMEM/Ham's F-12 (meio acidificado) 3 vezes.
- Substitua o meio por uma mistura de meio meio coletado e meio de cultura meio fresco. Cultura até observação por microscopia a 37 °C e 5% de CO2.
3. Observação do transporte axonal
- Pré-incubar a câmara equipada com microscopia TIRF (reflectância interna total) (ver Tabela de Materiais) a 37 °C.
- Se o controlador de CO2 estiver equipado, o meio de cultura pode ser usado como meio de observação abaixo de 5% de CO2. Se não estiver equipado, substitua o meio por um meio de pH estável, como Leibovitz L-15 (ver Tabela de materiais), fornecido com 4 mM de Glutamax e 2% de suplemento de B-27.
- Encontre uma célula transfectada e, em seguida, identifique um axônio. Aumente o ângulo de incidência do laser até que o laser seja completamente refletido. Em seguida, diminua o ângulo até que todas as vesículas do axônio sejam visualizadas (pseudo-TIRF). Adquira imagens com um tempo de exposição de 200 ms para 150 quadros (30 seg.).
NOTA: Neste experimento, a iluminação pseudônimo-TIRF foi usada para capturar todas as vesículas axônicas. Outros microscópios equipados com sistemas de captura de alta velocidade podem ser usados.
NOTA: Registre a direção do axônio todas as vezes no nome do arquivo. A área do segmento axonal inicial ou área terminal do axônio foi evitada da observação.
4. Processamento de imagem
- Abra as imagens adquiridas usando o software MetaMorph (consulte a Tabela de Materiais).
- Abra a barra de ferramentas > Medir > Calibrar distância. Ative "aplicar a todas as imagens abertas" e insira a distância real de um pixel.
- Abra a barra de ferramentas > Exibir > Girar. Ative a caixa de seleção "todos os planos". Gire para que o axônio fique na horizontal e a direção em direção ao terminal do axônio seja para a direita.
- Abra a barra de ferramentas > Regiões > Criar regiões. Defina o tamanho da região para recorte e clique em Criar. Coloque o quadro que aparece na imagem na área do axônio para análise. Salve a sequência de imagens gerada como um arquivo de pilha.
NOTA: Selecione áreas que não contenham axônios ou detritos desfocados. - Abra a barra de ferramentas > Exibir > Gráficos. Selecione Barra de calibração para carimbar a barra de escala. Selecione Dados/Hora para adicionar um carimbo de data/hora às imagens. Habilite "todos os planos". Mova os objetos para o espaço apropriado e clique em carimbo.
- Abra a barra de ferramentas > Empilhar > Criar filme. Insira a taxa de quadros apropriada e selecione AVI. Salve-o como um novo arquivo.
5. Desenhando um quimógrafo e detectando traços usando o KYMOMAKER
- Baixe o KYMOMAKER (consulte Tabela de Materiais) e abra "Kymoanalysis.exe" na pasta KYMOMAKER.
- Abra "kymoAnalysis.exe" para mostrar as janelas principais (Figura 1A). Selecione Arquivo > Carregar e abra o filme AVI criado. Uma janela "Preview" aparecerá (Figura 1B).
- Na guia Gerar Quimógrafo > seção de corte , insira os números de pixel para aparar. O corte é imediatamente refletido na janela "Preview" para permitir um ajuste fácil (Figura 1C). Confirme se toda a barra de escala e o carimbo de data/hora foram removidos.
- Clique no botão Gerar para gerar o quimógrafo (Figura 1C). O KYMOMAKER detecta o pixel mais brilhante dentro de cada eixo y na janela "Visualizar". Salve o quimógrafo via arquivo > salve > quimógrafo normal.
- Para detectar os traços de baixa intensidade no quimógrafo, clique em Quirógrafo Rotacional. Ajuste o número na seção "Quimógrafo rotacional" e visualize o resultado clicando no quimógrafo rotacional (Figura 1D).
NOTA: "Rotação (grau)" é o intervalo do grau para o algoritmo da Bacia Hidrográfica Rotacional21. Por exemplo, 10° significa que o algoritmo Watershed é executado a cada 10° 36 vezes, e os resultados são então combinados na janela "Rotational Watershed". - Para detectar os traços anterógrados e retrógrados no quimógrafo, na guia Detecção > seção Alvo , selecione original se o Quimógrafo rotacional não tiver sido gerado. Certifique-se de que, ao selecionar Rotação, a Bacia hidrográfica rotacional criada seja usada para detectar traços. Selecione Bacia hidrográfica em "Método de detecção". Clique no botão Detectar para detectar rastreamentos automaticamente.
NOTA: Os traços detectados são desenhados na janela "Trabalhando". Ativar o "Masking" desenha traços no quimógrafo original. - Detecte os traços anterógrados e retrógrados inserindo um número na seção Detecção > Filtragem > Velocidade (Figura 1E, F). Detecte traços anterógrados inserindo 0,4 a 7,0 μm/s. Detecte traços retrógrados inserindo −0,4 a −7,0 μm/s.
NOTA: A configuração para a velocidade mais baixa depende da definição de uma condição imóvel das vesículas. Consulte a etapa 6.7. - Salve os arquivos.
6. Determinando a velocidade
- Abra o software MetaMorph.
NOTA: O plug-in "rastreamento manual" no ImageJ também pode calcular as velocidades da mesma maneira. - Abra o arquivo criado na etapa 4.4. Certifique-se de que a calibração esteja adaptada às imagens.
- Abra a barra de ferramentas > Aplicativos > Pontos de controle. Clique em Adicionar faixa. Encontre uma vesícula em movimento que foi transportada anterógrada ou retrógrada. Em seguida, rastreie a vesícula clicando até que o transporte termine. Clique em Concluído.
- Repita a etapa 6.3 até que todas as vesículas tenham sido rastreadas.
- Clique em abrir log para abrir um arquivo CSV. Em seguida, clique no arquivo de log para mostrar os dados no arquivo CSV.
- Salve o arquivo CSV.
- Para calcular a velocidade segmentada não afetada pela pausa, remova as velocidades calculadas de 0,37 μm/s ou menos na coluna "velocidade".
NOTA: As vesículas podem se mover muito em breve por difusão anômala e não são processadas por proteínas motoras23. Para evitar a inclusão desses movimentos no cálculo das velocidades acionadas pelo motor, a velocidade mais baixa (1 pixel/200 ms) neste protocolo é removida do cálculo. - Calcule a velocidade média segmentada a cada cinco quadros (um total de 1 s). Descarte a última parte da velocidade se restarem menos de cinco quadros.
- Combine todas as velocidades médias de uma condição. Gere histogramas para ajudar a visualizar a distribuição de velocidades.
Resultados
Os neurônios primários cultivados do córtex de camundongo E15.5 foram cultivados em um prato com fundo de vidro, conforme descrito. Por exemplo, APP-EGFP, Alcα-EGFP ou Alcβ-EGFP foram expressos nos neurônios corticais primários. Sabe-se que APP e Alcα são transportados no axônio pela cinesina-1 2,17. A APP se associa à cinesina-1 por meio da proteína adaptadora JIP1 (proteína 1 que interage com JNK), enquanto a Alcα se liga diretamente por meio de seus motivos ácidos W duplos. Alcβ é um membro da família Alcadein e tem apenas um motivo W-ácido24. Cada proteína foi transfectada para neurônios Div. 5, e as imagens foram adquiridas a cada 200 ms usando microscopia TIRF 14-16 h após a transfecção. Várias vesículas em movimento nos axônios foram observadas em neurônios transfectados com APP-EGFP, Alcα-EGFP ou Alcβ-EGFP (Filmes Suplementares 1-3, respectivamente).
Usando o KYMOMAKER, os quimógrafos para Alcβ-EGFP foram gerados com e sem o algoritmo Rotacional da Bacia Hidrográfica (Figura 1C,D, respectivamente). Além disso, o KYMOMAKER permitiu a extração de traços nas direções anterógrada e retrógrada dos quimógrafos originais e da bacia hidrográfica (Figura 1E,F). Traços importantes foram detectados em ambos os quimógrafos. Em comparação com o método original, a aplicação do algoritmo Watershed permitiu uma melhor detecção de traços de baixa intensidade (Figura 1F).
As velocidades das vesículas em cada neurônio foram rastreadas e calculadas conforme descrito. A velocidade do APP-EGFP foi de 3,05 ± 1,03 μm/s, o que é consistente com resultados anteriores18,19. Alcα-EGFP foi transportado a uma velocidade de 1,89 ± 0,77 μm / s, que foi consideravelmente mais lenta que a APP, consistente com a velocidade relatada da cinesina-1. A velocidade de transporte de Alcβ-EGFP foi de 2,68 ± 1,07 μm/s, que ficou entre as velocidades de Alcα e APP. Os histogramas foram gerados usando uma largura de compartimento de 0,2 μm/s para mostrar diferenças na distribuição. Além disso, calculamos a razão relativa da direção de transporte usando os quimógrafos gerados com o KYMOMAKER (Figura 2A,B). Todas as três proteínas foram predominantemente transportadas na direção anterógrada ( Figura 2C ).

Figura 1: Fluxo de trabalho do método de detecção usando KYMOMAKER. (A) Configurando as janelas principais para KYMOMAKER. (B) O filme obtido foi aberto no KYMOMAKER, e a área que não continha o axônio foi removida por "corte". (C) Ao clicar em gerar, o quimógrafo original foi gerado. (D) Clicar em Timógrafo Rotacional abriu uma nova janela "Quimógrafo Rotacional" e os parâmetros de detecção podem ser alterados na caixa de diálogo superior em (A). (E) Cada traço anterógrado ou retrógrado foi detectado a partir do quimógrafo em (C). Os parâmetros de detecção podem ser alterados na caixa de diálogo inferior em (A). (F) Traços detectados em (D). Barras de escala = 5 μm. Clique aqui para ver uma versão ampliada desta figura.
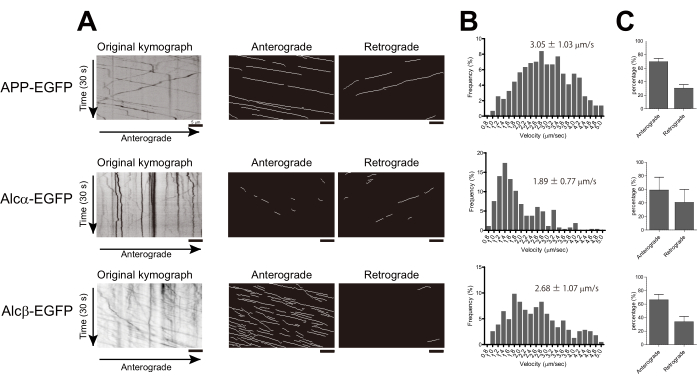
Figura 2: Cálculo da velocidade e direção das vesículas transportadas pela cinesina-1. APP-EGFP, Alcα-EGFP ou Alcβ-EGFP foram transfectados para Div. 4-6 de neurônios corticais primários cultivados em camundongos, e as imagens dos axônios foram adquiridas após 14-18 h de transfecção. (A) Os quimógrafos de transporte axonal foram gerados usando o KYMOMAKER. Esquerda: quimógrafo original; médio: traços anterógrados; Direita: traços retrógrados. (B) Histogramas da velocidade de transporte anterógrado são mostrados (n = 583 para APP-EGFP, n = 388 para Alcβ-EGFP, n = 264 para Alcα-EGFP de dois experimentos independentes.). O ± médio é mostrado nos histogramas. (C) As porcentagens de traços que foram transportados em cada direção são mostradas (cada barra mostra ± média DP. n = 2 de experimentos independentes, cada um contendo 6-10 células). Barras de escala = 5 μm. Clique aqui para ver uma versão ampliada desta figura.
Figura suplementar 1: Densidade de cultura do neurônio cultivado primário no prato de fundo de vidro. Imagem de contraste de interferência diferencial (DIC) de neurônios cultivados corticais primários de camundongos Div. 1 plaqueados, como na etapa 1.23. Barra de escala = 50 μm. Clique aqui para baixar este arquivo.
Tabela Suplementar 1: As construções de plasmídeos usadas neste protocolo. Clique aqui para baixar este arquivo.
Filme Suplementar 1: Transporte axonal de APP-EGFP. O filme foi feito a cada 200 ms por 30 s. Barra de escala = 5 μm. Clique aqui para descarregar este filme.
Filme Suplementar 2: Transporte axonal de Alcα-EGFP. O filme foi feito a cada 200 ms por 30 s. Barra de escala = 5 μm. Clique aqui para descarregar este filme.
Filme Suplementar 3: Transporte axonal de Alcβ-EGFP. O filme foi feito a cada 200 ms por 30 s. Barra de escala = 5 μm. Clique aqui para descarregar este filme.
Discussão
É descrito um método de análise para transporte axonal, que inclui o cálculo da velocidade segmentada e a geração de quimógrafos. Uma etapa crítica durante a etapa de transfecção é manter a saúde dos neurônios cultivados. O método de transfecção descrito por Jiang e Chen29 foi seguido com pequenas modificações. A mistura suave da solução de DNA/CaCl2 e 2x HBS aumentou a eficiência da transfecção reduzindo o tamanho das precipitações. Para evitar que as precipitações danifiquem as células, as células foram enxaguadas com um meio acidificado. Enxágues rápidos (duas ou três vezes) sem incubação foram suficientes para remover a precipitação das células. Aqui, usamos o neurônio primário cultivado; Vale ressaltar que o transporte em nervos ciáticos de camundongos pode ser observado por microscopia confocal in vivo com cirurgia26, e o recente desenvolvimento da microscopia multifotônica permitiu a observação do transporte axonal em cérebros de camundongos27.
Os quimógrafos são amplamente utilizados para visualizar a velocidade e a direção do transporte axonal. Existem várias ferramentas para fazer kymographs, incluindo o plugin Fiji KymographBuilder. Alguns deles, como KymoAnalyzer ou Kymolyzer, podem calcular os parâmetros a partir de trilhas atribuídas semi-manualmente28,29. Embora o software KYMOMAKER não possa modificar a atribuição de traços, ele tem a vantagem de facilitar a visualização de traços por direção21. Ele gerencia o processo de corte, gera quimógrafos ajustando os parâmetros de detecção e extrai automaticamente os traços por direções. O uso do método da Bacia Hidrográfica Rotacional permite a detecção de estruturas finas. Embora a maioria dos traços pudesse ser detectada, era difícil determinar se dois traços eram independentes ou temporariamente desconectados, especialmente onde os traços se cruzavam. Além disso, o KYMOMAKER não é usado para o cálculo do parâmetro de cada traço. Para contagens de traços anterógrados e retrógrados, recomenda-se usar a janela "Kymograph", que mascara os traços detectados com linhas vermelhas.
Este método de cálculo tem a vantagem de excluir o efeito de pausas imprevisíveis nas células vivas. As pausas podem ser causadas por obstáculos físicos, como outros motores e cargas, e proteínas associadas aos microtúbulos, como tau20,30. O cálculo da velocidade de transporte foi realizado por meio de diversos procedimentos. Normalmente, períodos mais longos (mais do que alguns segundos) são usados para determinar a distância transportada, incluindo a pausa. No entanto, usando períodos segmentados (200 ms), esse protocolo pode identificar e remover pausas do cálculo com mais eficiência. Em alguns casos, a velocidade de carga mostrou uma distribuição de dois ou três picos, como no caso de Alcβ, que pode refletir os diferentes tipos ou status das proteínas motoras envolvidas. Assim, a geração de um histograma é recomendada para visualizar a distribuição das velocidades, e esse método de cálculo mais preciso pode contribuir para uma estimativa mais clara das velocidades de pico.
Divulgações
Os autores não têm nada a divulgar.
Agradecimentos
Este trabalho foi apoiado por KAKENHI (22K15270, Grant-in-Aid for Young Scientists) e pela Akiyama Life Science Foundation for YS. Gostaríamos de expressar nossa gratidão ao Dr. Masataka Kinjo e ao Dr. Akira Kitamura, Laboratório de Dinâmica Celular Molecular, Faculdade de Ciências Avançadas da Vida, Universidade de Hokkaido, por fornecer informações críticas e conhecimentos que ajudaram muito na pesquisa. A observação com microscopia TIRF foi realizada usando o instrumento instalado no Laboratório de Dinâmica Celular Molecular da Faculdade de Ciências Avançadas da Vida da Universidade de Hokkaido. O Instrumento está registrado no sistema Open Facility gerenciado pelo Global Facility Center, Creative Research Institution, Hokkaido University (AP-100138). Agradecemos ao Dr. Seiichi Uchida, Laboratório de Interface Humana, Departamento de Tecnologia da Informação Avançada, Faculdade de Ciências da Informação e Engenharia Elétrica, Universidade de Kyushu, Fukuoka Japão, pela montagem com o aplicativo Kymomaker. O Laboratório Avançado de Prevenção e Pesquisa para Demência, Escola de Pós-Graduação em Ciências Farmacêuticas, Universidade de Hokkaido é apoiado pela Japan Medical Leaf co., Ltd.
Materiais
| Name | Company | Catalog Number | Comments |
| 5-Fluoro-2-deoxyuridine | Sigma-Aldrich | F0503 | |
| Apo TIRF 100x/1.49 OIL | Nikon | ||
| B-27 Supplement (50x), serum free | Thermo fischer scientific | 17504044 | |
| Bovine serum albumin | Wako | 013-25773 | |
| CalPhos Mammalian Transfection Kit | Takara | 631312 | |
| Cell strainer 40 µm Nylon | Falcon | 352340 | |
| CoolSNAP HQ | Photometrics | ||
| Deoxyribonuclease I | Sigma-Aldrich | DN-25 | |
| D-Glucose | Wako | 041-00595 | |
| DMEM/Ham’s F-12 | Wako | 042-30555 | |
| Dumont No. 7 forceps | Dumont | No.7 | |
| Feather surgical blade | Feather | No.11 | |
| Feather surgical blade handle | Feather | No. 3 | |
| Gentamicin | Wako | 079-02973 | |
| Gentamicin Sulfate | Wako | 075-04913 | |
| GlutaMAX Supplement | Thermo fischer scientific | 35050061 | |
| HEPES | DOJINDO | 342-01375 | |
| Horse Serum, heat inactivated | Thermo fischer scientific | 26050088 | |
| KCl | Wako | 163-03545 | |
| KH2PO4 | Wako | 169-04245 | |
| KYMOMAKER | http://www.pharm.hokudai.ac.jp/shinkei/Kymomaker.html | ||
| L-15 Medium (Leibovitz) | Sigma-Aldrich | L5520 | |
| MetaMorph version 6.2r1 | Metamorph | ||
| Na2HPO4 | Wako | 197-02865 | |
| NaCl | Wako | 197-01667 | |
| NaHCO3 | Wako | 191-01305 | |
| Neurobasal Medium | Thermo fischer scientific | 21103049 | |
| Nikon ECLIPSE TE 2000-E | Nikon | ||
| Nunc Lab-Tek 8 well Chambered Coverglass | Thermo fischer scientific | 155411 | |
| Papain | Worthington | LS003126 | |
| Penicillin-Streptomycin (10,000 U/mL) | Thermo Fisher Scientific | 15140122 | |
| Poly-L-lysine hydrobromide | Sigma-Aldrich | P2636-500MG | |
| Trizma base | Merck | T1194-10PAK | solved with water to make 0.1 M Tris-HCl (pH.8.5) |
Referências
- Hirokawa, N., Noda, Y., Tanaka, Y., Niwa, S. Kinesin superfamily motor proteins and intracellular transport. Nature Reviews Molecular Cell Biology. 10 (10), 682-696 (2009).
- Stokin, G. B., et al. Axonopathy and transport deficits early in the pathogenesis of Alzheimer's diseases. Science. 307 (5713), 1282-1288 (2005).
- Guo, W., Stoklund Dittlau, K., vanden Bosch, L. Axonal transport defects and neurodegeneration: Molecular mechanisms and therapeutic implications. Seminars in Cell & Developmental Biology. 99, 133-150 (2020).
- Svoboda, K., Schmidt, C. F., Schnapp, B. J., Block, S. M. Direct observation of kinesin stepping by optical trapping interferometry. Nature. 365 (6448), 721-727 (1993).
- Carter, N. J., Cross, R. A. Mechanics of the kinesin step. Nature. 435 (7040), 308-312 (2005).
- Welte, M. A. Bidirectional transport along microtubules. Current Biology. 14 (13), R525-R537 (2004).
- Hendricks, A. G., et al. Motor coordination via a tug-of-war mechanism drives bidirectional vesicle transport. Current Biology. 20 (8), 697-702 (2010).
- Rezaul, K., et al. Engineered tug-of-war between kinesin and dynein controls direction of microtubule based transport in vivo. Traffic. 17 (5), 475-486 (2016).
- Encalada, S. E., Goldstein, L. S. B. Biophysical challenges to axonal transport: motor-cargo deficiencies and neurodegeneration. Annual Review of Biophysics. 43, 141-169 (2014).
- Monzon, G. A., et al. Stable tug-of-war between kinesin-1 and cytoplasmic dynein upon different ATP and roadblock concentrations. Journal of Cell Science. 133 (22), 226248(2020).
- Guo, W., et al. HDAC6 inhibition reverses axonal transport defects in motor neurons derived from FUS-ALS patients. Nature Communications. 8 (1), 861(2017).
- Tosolini, A. P., et al. BDNF-dependent modulation of axonal transport is selectively impaired in ALS. Acta Neuropathologica Communications. 10 (1), 121(2022).
- Verhey, K. J., Hammond, J. W. Traffic control: regulation of kinesin motors. Nature Reviews Molecular Cell Biology. 10 (11), 765-777 (2009).
- Fu, M. M., Holzbaur, E. L. F. Integrated regulation of motor-driven organelle transport by scaffolding proteins. Trends in Cell Biology. 24 (10), 564-574 (2014).
- Kumari, D., Ray, K. Phosphoregulation of kinesins involved in long-range intracellular transport. Frontiers in Cell and Developmental Biology. 10, 873164(2022).
- Wai Yau, K., et al. Cellular/molecular dendrites in vitro and in vivo contain microtubules of opposite polarity and axon formation correlates with uniform plus-end-out microtubule orientation. The Journal of Neuroscience. 36 (4), 1071-1085 (2016).
- Araki, Y., et al. The novel cargo Alcadein induces vesicle association of kinesin-1 motor components and activates axonal transport. The EMBO Journal. 26 (6), 1475-1486 (2007).
- Sobu, Y., et al. Phosphorylation of multiple sites within an acidic region of Alcadein α is required for kinesin-1 association and Golgi exit of Alcadein α cargo. Molecular Biology of the Cell. 28 (26), 3844-3856 (2017).
- Tsukamoto, M., et al. The cytoplasmic region of the amyloid β-protein precursor (APP) is necessary and sufficient for the enhanced fast velocity of APP transport by kinesin-1. FEBS Letters. 592 (16), 2716-2724 (2018).
- Ferro, L. S., Can, S., Turner, M. A., Elshenawy, M. M., Yildiz, A. Kinesin and dynein use distinct mechanisms to bypass obstacles. eLife. 8, e48629(2019).
- Chiba, K., Shimada, Y., Kinjo, M., Suzuki, T., Uchida, S. Simple and direct assembly of kymographs from movies using KYMOMAKER. Traffic. 15 (1), 1-11 (2014).
- Xu, S. -Y., Wu, Y. -M., Ji, Z., Gao, X. -Y., Pan, S. -Y. A modified technique for culturing primary fetal rat cortical neurons. Journal of Biomedicine and Biotechnology. 2012, 803930(2012).
- Han, D., et al. Deciphering anomalous heterogeneous intracellular transport with neural networks. eLife. 9, e52224(2020).
- Araki, Y., et al. Novel cadherin-related membrane proteins, Alcadeins, enhance the X11-like protein-mediated stabilization of amyloid beta-protein precursor metabolism. The Journal of Biological Chemistry. 278 (49), 49448-49458 (2003).
- Jiang, M., Chen, G. High Ca2+-phosphate transfection efficiency in low-density neuronal cultures. Nature Protocols. 1 (2), 695-700 (2006).
- Tosolini, A. P., Villarroel-Campos, D., Schiavo, G., Sleigh, J. N. Expanding the toolkit for in vivo imaging of axonal transport. Journal of Visualized Experiments. (178), e63471(2021).
- Takihara, Y., et al. In vivo imaging of axonal transport of mitochondria in the diseased and aged mammalian CNS. Proceedings of the National Academy of Sciences. 112 (33), 10515-10520 (2015).
- Neumann, S., Chassefeyre, R., Campbell, G. E., Encalada, S. E. KymoAnalyzer: a software tool for the quantitative analysis of intracellular transport in neurons. Traffic. 18 (1), 71-88 (2017).
- Basu, H., Ding, L., Pekkurnaz, G., Cronin, M., Kymolyzer Schwarz, T. L. a semi-autonomous kymography tool to analyze intracellular motility. Current Protocols in Cell Biology. 87 (1), 107(2020).
- Dixit, R., Ross, J. L., Goldman, Y. E., Holzbaur, E. L. F. Differential regulation of dynein and kinesin motor proteins by tau. Science. 319 (5866), 1086-1089 (2008).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados