Method Article
İnsan Doğal Öldürücü Hücre Reseptörü-Ligand Repertuarının Profillenmesi
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Burada, iki tamamlayıcı kütle sitometrisi (CyTOF) paneli tasarlıyoruz ve viral enfeksiyonların ortamında doğal öldürücü hücre reseptörünü ve ligand repertuarını profillemek amacıyla bir CyTOF boyama protokolünü optimize ediyoruz.
Özet
Doğal öldürücü (NK) hücreler, viral enfeksiyonlara ilk yanıt verenler arasındadır. NK hücrelerinin viral olarak enfekte olmuş hücreleri hızlı bir şekilde tanıma ve öldürme yeteneği, germ hattı kodlu inhibitör ve aktive edici reseptörlerin ekspresyonu ile düzenlenir. Bu reseptörlerin aynı kökenli ligandları tarafından hedef hücreler üzerindeki angajmanı, hücreler arası etkileşimin NK hücre öldürmesine yol açıp açmayacağını belirler. Bu protokol, iki tamamlayıcı kütle sitometrisi (CyTOF) panelinin tasarımını ve optimizasyonunu detaylandırır. Bir panel, reseptör ekspresyonuna dayalı olarak NK hücrelerini fenotiplemek için tasarlanmıştır. Diğer panel, çeşitli bağışıklık hücresi alt kümelerinde NK hücre reseptörleri için bilinen ligandların ekspresyonunu sorgulamak için tasarlanmıştır. Birlikte, bu iki panel, insan NK hücre reseptörü-ligand repertuarının profillenmesine izin verir. Ayrıca, bu protokol aynı zamanda CyTOF için numuneleri boyama sürecini de detaylandırır. Bu süreç, gelişmiş tekrarlanabilirlik ve standardizasyon için optimize edilmiştir. CyTOF'un bir avantajı, araştırmacıların NK hücre reseptörü-ligand repertuarının genişliğini yakalamasına olanak tanıyan, minimum sinyal örtüşmesi ile her panelde 40'tan fazla işaretleyiciyi ölçme yeteneğidir. Paladyum barkodlama ayrıca numuneler arası varyasyonun yanı sıra reaktif tüketimini de azaltarak numunelerin her bir panelle paralel olarak boyanmasını kolaylaştırır. Bu protokolün sınırlamaları arasında CyTOF'un nispeten düşük verimi ve analizden sonra hücrelerin kurtarılamaması yer alır. Bu paneller, dang virüsü, insan immün yetmezlik virüsü (HIV) ve grip dahil olmak üzere akut ve kronik viral enfeksiyonlardan muzdarip hastalardan alınan klinik örneklerin analizi için tasarlanmıştır. Bununla birlikte, insan NK hücre reseptörü-ligand repertuarını araştırmak için herhangi bir ortamda kullanılabilirler. Daha da önemlisi, bu yöntemler gelecekteki CyTOF panellerinin tasarımına ve yürütülmesine geniş çapta uygulanabilir.
Giriş
Doğal öldürücü (NK) hücreler, birincil rolü kötü huylu, enfekte veya başka bir şekilde stresli hücreleri hedeflemek ve öldürmek olan doğuştan gelen bağışıklık hücreleridir. IFNγ ve TNFα gibi sitokinlerin salgılanması ve sitotoksik aktiviteleri sayesinde, NK hücreleri ayrıca patojenlere ve malignitelere karşı adaptif bağışıklık tepkisini de şekillendirebilir. NK yanıtına kısmen, potansiyel hedef hücreler üzerinde eksprese edilen sayısız ligandı bağlayan germ hattı kodlu inhibitör ve aktive edici reseptörlerin kombinatoryal sinyalizasyonu aracılık eder. Birkaç NK hücre reseptörü, düzenli olarak tanımlanan yeni reseptör-ligand çiftleri ile birden fazla liganda sahiptir.
NK hücrelerinin, stresli hücrelere hızlı bir şekilde yanıt verme yeteneklerinin viral yayılmayı sınırlayabileceği veya NK hücresinden kaçınma stratejilerinin geliştirilmesini teşvik edebileceği viral enfeksiyonlar bağlamında incelenmesine özel bir ilgi vardır. NK hücre biyolojisine olan bu ilgi, araştırmacıların NK hücrelerinin tümör immünosürveyansında ve tümör mikroçevresindekiler rolünü araştırdıkları kanser immünoterapisi alanına kadar uzanmaktadır1. Bununla birlikte, NK hücresi-hedef hücre etkileşimlerinin profilini çıkarma yeteneği, insan NK hücrelerinin 30'dan fazla reseptörü eksprese edebilmesi ve bunun da 30'dan fazla bilinen ligand ile etkileşime girebilmesi nedeniyle karmaşıktır2. Bu nedenle, çoklu NK hücre reseptörlerinin ve bunların akraba ligandlarının eşzamanlı tespiti, NK fonksiyonunu kontrol eden reseptör-ligand etkileşimlerinin karmaşıklığını yakalamak için gereklidir. Sonuç olarak, tek hücre düzeyinde 40'tan fazla markörün aynı anda tespit edilmesini sağlayan kütle sitometrisine (CyTOF) döndük. Amacımız, NK hücre reseptörü-ligand repertuarının profilini çıkarmak için iki CyTOF paneli oluşturmaktı. Ayrıca klinik numunelerin etkili bir şekilde işlenmesi ve boyanması için bir protokol tasarlamak istedik. Klinik insan örnekleri, vücudun viral enfeksiyona nasıl tepki verdiği hakkında zengin bilgiler sağlar. Bu nedenle, daha iyi standardizasyon, daha iyi geri kazanım, daha az reaktif tüketimi ve sınırlı parti etkileri için NK hücre reseptörlerinin ve bunların aynı kökenli ligandlarının ekspresyonunu paralel olarak araştırmak için bu protokolü geliştirdik.
İnsan NK hücrelerinin fenotipini karakterize etmek için tasarlanmış çeşitli akış sitometri panelleri daha önceyayınlanmıştır 3,4,5,6,7,8. Bu panellerin çoğu, reseptör-ligand repertuarının genişliğini yakalama yetenekleri bakımından sınırlıdır ve yalnızca sınırlı bir işaretleyici seçiminin tespit edilmesine izin verir. Ayrıca, bu paneller florokromlar arasındaki sinyal örtüşmesi ile sınırlıdır. CyTOF, uçuş zamanı kütle spektrometresi ile okunan metal izotoplarına konjuge antikorlar kullanır ve böylece kanallar arasındaki yayılmayı önemli ölçüde azaltır.
Bizim gibi, diğer araştırmacılar da NK hücreleri 9,10,11,12,13,14'ü incelemek için CyTOF'a başvurdular, ancak genellikle daha az NK hücre markörü vardı, bu da fenotipleme derinliğini azaltıyor. Bu gruplar tarafından kullanılan genel boyama protokolleri bizimkine benzer olsa da, bazı önemli farklılıklar vardır. Diğer protokoller, araştırmacılar sadece bu alt küme13,14 ile ilgilenseler de, boyamadan önce NK hücrelerinin izole edilmesini içermez. NK hücrelerinin periferik kan mononükleer hücrelerinin (PBMC'ler) sadece% 5-20'sini oluşturduğu göz önüne alındığında, izole edilmiş NK hücreleri yerine tüm PBMC'lerin boyanması, toplanan olayların çoğunun NK hücreleri olmayacağı anlamına gelir. Bu, ilgilenilen alt kümede oluşturulan veri miktarını azaltır ve makine zamanının verimsiz kullanımına neden olur. Ek olarak, bu panellerin çoğu, öldürücü Ig benzeri reseptörler (KIR'ler), NKG2A/C/D ve doğal sitotoksisite reseptörleri (NKp30, NKp44 ve NKp46) gibi NK hücre reseptörlerinin ekspresyonunu sorgularken, bu belirteçlerin ekspresyonu, ilgili ligandlarının ekspresyonu hakkında veri olmaması nedeniyle daha geniş bir bağlama yerleştirilmemiştir. Sonuç olarak, CyTOF yoluyla NK hücrelerini araştırmak için daha önce yayınlanmış bu yöntemler, izolasyonda kullanılan geniş NK hücre fenotiplemesi için yeterli olsa da, NK hücre aktivitesinin kapsamlı bir resmini sağlayamazlar. Bu bizi burada açıklanan yöntemlerin en büyük avantajına getiriyor, bu da bu noktaya kadar NK hücre reseptörleri için ligandların ekspresyonunu keşfetmeye odaklanan yayınlanmış bir akış sitometrisi veya CyTOF panelinin olmamasıdır. Daha da önemlisi, ligand panelimiz, her deneyin benzersiz ihtiyaçlarına uygun işaretleyicilerin eklenmesine izin vermek için birkaç açık kanala sahiptir.
CyTOF'un ana sınırlamalarından birinin, analizden sonra numunenin geri kazanılamaması olduğu göz önüne alındığında, bu yöntem, ek deneyler yapmakla ilgilendikleri sınırlı numuneye sahip araştırmacılar için uygun olmayabilir. Ek olarak, CyTOF'un düşük verim doğası, başlangıç hücre sayısı düşükse üretilen verilerin düşük kalitede olacağı anlamına gelir. Bu iki sınırlama dışında, bu yöntem NK hücreleri ve hedef hücreler arasındaki reseptör-ligand etkileşimlerini araştırmak için herhangi bir ortamda iyi performans gösterecektir.
Protokol
Anonimleştirilmiş sağlıklı yetişkin PBMC'ler, Stanford Kan Merkezi'nden satın alınan lökoredüksiyon sistem odalarından elde edildi. Kimliği gizlenmiş sağlıklı pediatrik donörlerden ve pediatrik akut dang hastalarından elde edilen PBMC'ler, Panama City, Panama'daki Gorgas Memorial Sağlık Araştırmaları Enstitüsü'nden ve Sağlık Bakanlığı'na ait hastanelerden, Panama City'deki Sosyal Güvenlik Sisteminden ve banliyö bölgelerinden elde edildi. Dang humması çalışma protokolü, Hospital del Niño'nun IRB'si (CBIHN-M-0634) tarafından onaylandı, daha sonra ICGES, CSS, Santo Tomas Hastanesi ve Stanford Üniversitesi komiteleri tarafından onaylandı. Antiretroviral tedavi gören HIV ile enfekte hastalardan alınan PBMC'ler ACTG çalışması A5321'den elde edildi.
1. Antikor etiketleme, panel hazırlama ve depolama
- Metal izotopları ile antikor etiketleme
NOT: Boyamanın deneyler arası standardizasyonunu artırmak için, her bir antikor için birden fazla konjugasyon yapılması ve ardından ürünlerin aşağıda açıklandığı gibi uzun süreli depolama için tek bir ana karışımda birleştirilmesi önerilir.- Konjugasyondan önce 280 nm'de absorbansı ölçerek her bir antikorun konsantrasyonunu belirleyin. Bu protokol için kullanılan antikorlar ticari olarak temin edilebilir ve Malzeme Tablosunda listelenen satıcılardan satın alınmıştır.
- Üreticinin talimatlarına göre ticari olarak temin edilebilen antikor etiketleme kitlerini kullanarak antikorları metal izotoplarla etiketleyin. Her reaksiyon için 100 μg antikor kullanın.
- 280 nm'de absorbansı ölçerek geri kazanılan antikorun nihai konsantrasyonunu belirleyin. Antikorları kısa süreli olarak 4 °C'de saklayın.
- Antikor titrasyonları
NOT: CyTOF teknolojisi, çevresel metallerden gelen potansiyel kirletici sinyallere karşı çok hassastır. Bu nedenle, kullanılan tüm tamponlar/reaktifler ultra saf su ile hazırlanmalı ve hiç sabunla yıkanmamış plastik veya cam kaplarda saklanmalıdır.- Çözülecek PBMC'lerin şişesi başına 9 mL ılık, tam RPMI (RPMI 1640, %10 FBS, %1 L-glutamin, %1 penisilin / streptomisin) ve 20 μL benzonaz içeren her donör için santrifüj tüpleri hazırlayın. PBMC'leri bir su banyosunda çözdürün ve tüplere ekleyin.
NOT: Benzonaz, parçalanmış hücrelerden elde edilen serbest DNA'dan viskoziteyi ve arka planı azaltır. - Oda sıcaklığında 300 x g'da 5 dakika santrifüjleyin. PBMC'leri 5 mL tam RPMI ortamında yeniden askıya alın ve sayın.
- Her panel titrasyonu için, yuvarlak tabanlı 96 oyuklu bir plakanın 6 oyuğunda (her titre için bir kuyucuk ve lekelenmemiş için bir kuyucuk) 2-4 milyon PBMC/kuyucuk plakalayın. Plakayı oda sıcaklığında 600 x g'da 3 dakika santrifüjleyin. Süpernatanı çıkarmak için plakayı hafifçe vurun. Her kuyucuğu 200 μL CyPBS'de yeniden süspanse edin.
- Aşağıda açıklandığı gibi sisplatin canlılık boyaması gerçekleştirin.
NOT: Sisplatin, kütle sitometrisinde canlı hücreleri ölü hücrelerden ayırt etmek için kullanılır.- 100 μL'lik 25 μM sisplatin stoğundaki hücreleri yeniden süspanse edin. Oda sıcaklığında 1 dakika inkübe edin.
- Her kuyucuğa 100 μL FBS ekleyerek ve karıştırarak sisplatin reaksiyonunu söndürün. Plakayı santrifüjleyin ve hafifçe vurun.
NOT: Sonraki tüm santrifüj adımlarını 4 °C'de gerçekleştirin. - Hücreleri 200 μL CyFACS ile iki kez yıkayın (% 0.1 BSA,% 0.05 sodyum azid içeren ultra saf suda ağır metal kirleticileri içermeyen 1x PBS). Her seferinde plakayı santrifüjleyin ve hafifçe vurun.
- Yüzey antikor panelini aşağıda açıklandığı gibi titre edin.
NOT: NK yüzey paneli ve ligand paneli için ayrı ana karışımlar yapılmalıdır.- CyFACS kullanarak 10 μg/mL konsantrasyonda tüm yüzey antikorlarının ana karışımını yapın. Aşağıdaki konsantrasyonları elde etmek için CyFACS kullanarak seri 1: 2 seyreltmeler yapın: 10, 5, 2.5, 1.25 ve 0.625 μg / mL.
- Antikor kokteyllerini, boyamadan önce 3 dakika boyunca 10.600 x g'da bir santrifüj filtre ünitesinden (0.1 μm gözenek boyutu) süzün.
- Kaplanmış hücreleri, ilgili titrede 50 μL yüzey antikor kokteyli içinde yeniden süspanse edin. CyFACS'ta lekelenmemiş kuyuyu yeniden askıya alın. 4 °C'de 30 dakika inkübe edin.
- Hücreleri 150 μL CyFACS ile yıkayın. Plakayı santrifüjleyin ve hafifçe vurun.
- Hücreleri 200 μL CyFACS ile yıkayın. Plakayı santrifüjleyin ve hafifçe vurun.
- CyPBS'de her bir oyuğu 100 μL %2 paraformaldehit (PFA) içinde yeniden süspanse ederek hücrelerin fiksasyonunu gerçekleştirin. Plakayı oda sıcaklığında karanlıkta 20 dakika inkübe edin. Hücreleri 100 μL CyFACS ile yıkayın. 700 x g'da 5 dakika santrifüjleyin.
DİKKAT: PFA'nın kanserin yanı sıra genetik kusurlara da neden olduğundan şüphelenilmektedir. Ek olarak, gözlerle, ciltle temas etmesi veya solunması zararlıdır. İyi havalandırma sağlayarak, hazneyi dikkatli bir şekilde açarak ve aerosol oluşumunu önleyerek uygun şekilde kullanın.
NOT: Sonraki tüm santrifüj dönüşleri, 4 ° C'de 5 dakika boyunca 700 x g'de gerçekleştirilir. - Ultra saf suda seyreltilmiş 200 μL 1x Geçirgenleştirme Tamponu (Perm tamponu) içinde yeniden süspanse ederek hücreleri geçirgen hale getirin. Plakayı santrifüjleyin ve hafifçe vurun. Hücreleri 200 μL Perma tamponu ile yıkayın. Plakayı santrifüjleyin ve hafifçe vurun.
NOT: Perma tamponunda inkübasyon gerekli değildir. - Hücre içi antikor paneli titrasyonu
- Perm Buffer kullanarak 10 μg/mL konsantrasyonda tüm hücre içi antikorların ana karışımını yapın. Aşağıdaki konsantrasyonları elde etmek için Perm Buffer kullanarak seri 1: 2 seyreltmeler yapın: 10, 5, 2.5, 1.25 ve 0.625 μg / mL.
- Antikor kokteyllerini, boyamadan önce 3 dakika boyunca 10.600 x g'da bir santrifüj filtre ünitesinden (0.1 μm gözenek boyutu) süzün.
- Kaplanmış hücreleri, ilgili titrede 50 μL hücre içi antikor kokteyli içinde yeniden süspanse edin. Lekelenmemiş kuyuyu Perm Tamponunda yeniden süspanse edin. 4 °C'de 45 dakika inkübe edin.
NOT: Hücre içi bir panel titre edilmeyecekse, kuyucukları 50 μL Perm tamponunda yeniden süspanse edin. - Hücreleri 150 μL Perma tamponu ile yıkayın. Plakayı santrifüjleyin ve hafifçe vurun.
- Hücreleri 200 μL Perma tamponu ile yıkayın. Plakayı santrifüjleyin ve hafifçe vurun.
- Hücreleri 200 μL CyFACS ile iki kez yıkayın. Plakayı santrifüjleyin ve hafifçe vurun.
- DNA interkalatör boyama
NOT: İnterkalatör, hücresel nükleik aside bağlanır ve kütle sitometrisinde çekirdekli hücreleri tanımlamak için kullanılır.- CyPBS ve% 2 PFA'da 1: 10.000 seyreltilmiş 200 μL interkalatör içindeki hücreleri yeniden askıya alın. Plakayı gece boyunca 4 °C'de inkübe edin.
- Gerekirse plakaları 4 °C'de parafin film ile kaplı olarak bir haftaya kadar saklayın.
NOT: Sonraki tüm santrifüj adımlarını 700 °C'de 5 dakika boyunca 4 x g'da gerçekleştirin. - Numuneleri CyTOF üzerinde çalıştırmadan önce, parafin filmi plakadan çıkarın ve 700 ° C'de 5 dakika boyunca 4 x g'da santrifüjleyin. Plakayı hafifçe vurun. Hücreleri 200 μL CyFACS ile bir kez yıkayın. Plakayı santrifüjleyin ve hafifçe vurun.
- Hücreleri 200 μL ultra saf su ile üç kez yıkayın. Plakayı santrifüjleyin ve hafifçe vurun. Hücreleri 200 μL ultra saf suda yeniden süspanse edin. Numuneyi çalıştırmadan hemen önce, ultra saf suda 1x konsantrasyona seyreltilmiş normalizasyon boncuklarında konsantrasyonu yaklaşık 6 x10 5 hücre/mL'ye ayarlayın.
- Örnekleri CyTOF'ta çalıştırın.
- Verileri analiz edin ve görsel değerlendirmeye dayalı olarak en yüksek sinyal yoğunluğu ve pozitif ve negatif popülasyonlar arasında en iyi ayrım ile sonuçlanan en düşük antikor titresini seçerek her antikor için uygun titreleri seçin.
NOT: NK ve ligand panelleri için titrasyonlar sırasıyla Şekil 1 ve Şekil 2'de gösterilmiştir. Pozitif ve negatif popülasyonlar arasında net bir ayrım tanımlanmazsa, titreler hem pozitif hem de negatif hücre popülasyonlarının tanımlanmasına izin vermek için birden fazla hücre tipinde veya hücre hatlarında değerlendirilebilir. - Antikor paneli saklama
- Titre edilmiş antikorları bir ana karışımda birleştirin ve steril bir 0,1 μm şırınga filtre ünitesinden süzün. NK yüzey paneli, NK hücre içi panel ve ligand paneli için ayrı ana karışımlar yapılmalıdır.
- Panellerin uzun süreli depolanması için kabul edilebilir iki seçenekten birini izleyin:
- Ana karışımı liyofilizasyon için üçüncü taraf bir şirkete gönderin. Bu yöntem NK paneli için kullanılır. Kurum içinde konjuge edilmeyen antikorlar, liyofilizasyon sürecine müdahale eden antikor stabilizatörünün varlığı nedeniyle liyofilize edilemez. Bu antikorlar lekelenme günü panele eklenir.
- Her bir ana karışımdan 50 μL alikot yapmak için bir tekrarlayıcı pipet kullanın ve bunları -80 °C'de saklayın.
- Çözülecek PBMC'lerin şişesi başına 9 mL ılık, tam RPMI (RPMI 1640, %10 FBS, %1 L-glutamin, %1 penisilin / streptomisin) ve 20 μL benzonaz içeren her donör için santrifüj tüpleri hazırlayın. PBMC'leri bir su banyosunda çözdürün ve tüplere ekleyin.
2. Boyama protokolü
- Periferik kan mononükleer hücrelerini (PBMC'ler) adım 1.2.1 ve 1.2.2'de açıklandığı gibi çözün. 15 mL'lik bir santrifüj tüpünde ligand panel boyama için en az 1 milyon PBMC ayırın. NK hücre izolasyonu sırasında bu PBMC'leri buz üzerinde tutun.
- NK hücre izolasyonu
NOT: Aşağıdaki NK hücre izolasyon adımları, belirli bir satıcının protokolünün değiştirilmiş bir sürümüdür. Bununla birlikte, NK hücrelerinin manyetik tabanlı negatif seçimini gerçekleştiren herhangi bir kit veya protokol uygun bir alternatif olacaktır. Ek olarak, bu protokol tüm PBMC'lerden NK hücrelerinin fenotiplenmesi için de uygun olduğundan bu adım isteğe bağlıdır.- Kalan PBMC'leri 450 x g'da 5 dakika döndürün. Hücre peletini 10 7 toplam hücre başına 40 μL MACS tamponunda (PBS,%0.5 BSA, 2 mM EDTA) yeniden süspanse edin.
- Toplam 107 hücre başına 10 μL NK hücresi Biotin-Antikor Kokteyli ekleyin. İyice karıştırın ve buz üzerinde 5 dakika inkübe edin.
- 107 toplam hücre başına 30 μL MACS tamponu ve 107 toplam hücre başına 20 μL NK hücre Mikro Boncuk Kokteyli ekleyin. İyice karıştırın ve buz üzerinde 10 dakika inkübe edin.
- 500 μL MACS tamponu ile durulayarak elüsyon kolonlarını hazırlayın. 15 mL toplama tüplerine 2 mL soğuk tam RPMI ekleyin.
- Hacmi 500 μL'ye çıkarmak için hücre içeren tüplere MACS tamponu ekleyin. 500 μL'lik hacmin tamamını hazırlanan elüsyon kolonuna pipetleyin. Tüpü başka bir 500 μL MACS tamponu ile durulayın ve kolona aktarın.
- Akış durduktan sonra, elüsyon kolonunu 500 μL MACS tamponu ile iki kez durulayın. Akış durduktan sonra NK hücrelerini sayın.
- Plaka ve yıkama hücreleri.
- İzole edilmiş NK hücrelerini ve PBMC'leri oda sıcaklığında 300 x g'da 10 dakika santrifüjleyin. CyPBS'de 5 milyon hücre / mL konsantrasyonda hücreleri yeniden süspanse edin (ultra saf suda ağır metal kirleticileri olmadan 1x PBS). U tabanlı, 96 oyuklu bir plakadaki plaka hücreleri.
NOT: NK hücre panelinin her bir alikotu 3 milyona kadar hücreyi lekeleyebilir. Boyamadan önce altı ayrı NK hücre numunesi barkodlanıyor ve havuzlanıyorsa, toplam NK hücresi sayısı 3 milyonu geçmemelidir. Ligand paneli, numune başına 6 milyona kadar PBMC'yi lekeleyebilir. Boyamadan önce altı ayrı numune barkodlanıyor ve bir araya getiriliyorsa, toplam PBMC sayısı 6 milyonu geçmemelidir. - Santrifüj plakası 600 x g'da oda sıcaklığında 3 dakika. Süpernatanı çıkarmak için plakayı hafifçe vurun.
NOT: Sonraki tüm santrifüj dönüşlerini 600 x g'da 3 adım 2.7'ye kadar gerçekleştirin. - Hücreleri 200 μL CyPBS'de yeniden süspanse edin. Plakayı santrifüjleyin ve hafifçe vurun.
- İzole edilmiş NK hücrelerini ve PBMC'leri oda sıcaklığında 300 x g'da 10 dakika santrifüjleyin. CyPBS'de 5 milyon hücre / mL konsantrasyonda hücreleri yeniden süspanse edin (ultra saf suda ağır metal kirleticileri olmadan 1x PBS). U tabanlı, 96 oyuklu bir plakadaki plaka hücreleri.
- Adım 1.2.4'te açıklandığı gibi sisplatin canlılık boyamasını gerçekleştirin.
- Barkodlama boyama
NOT: Bu paneller, toplu etkileri en aza indirmek ve hücre geri kazanımını en üst düzeye çıkarmak için canlı sabitlenmemiş hücreler üzerinde modifiye edilmiş dörtte iki, Paladyum bazlı barkodlama yöntemi ile birlikte kullanılır15. Ancak, kaliteli veri elde etmek için barkodlama gerekli olmadığından bu adım isteğe bağlıdır.- Her bir kuyucuğu 50 μL'lik ilgili önceden karıştırılmış barkodda yeniden süspanse edin ve 4 ° C'de 30 dakika inkübe edin. Hücreleri 150 μL CyFACS ile yıkayın. Plakayı santrifüjleyin ve hafifçe vurun.
- Hücreleri 200 μL CyFACS ile iki kez yıkayın. Plakayı santrifüjleyin ve hafifçe vurun. Tüm kuyucukları 30 μL CyFACS'ta yeniden askıya alın. Benzersiz barkodlarla boyanmış altı adede kadar hücre kuyusunu tek bir kuyuda birleştirin ve plakanın santrifüjlenmesini ve hafifçe vurulmasını gerçekleştirin.
- Yüzey boyama
- Yüzey NK panel liyosferini 50 μL CyFACS'ta (anti-CD16, anti-HLA-DR, anti-LILRB1) ek yüzey antikorları ile çözün. -80 ° C'de saklanan ligand panelini çözün ve bir mini santrifüj kullanarak tüpü döndürün. Ek ligand panel yüzey işaretleyicilerinde ani artış (anti-CD16, anti-CD19).
NOT: Daha önce filtrelenmemiş herhangi bir antikor kokteyli (yani, liyofilizasyon veya dondurmadan önce), boyamadan önce 3 dakika boyunca 10.600 x g'de bir santrifüj filtre ünitesinden (0.1 μm gözenek boyutu) süzülmelidir. - Her bir kuyucuğu ilgili panelin 50 μL'sinde yeniden askıya alın. 4 °C'de 30 dakika inkübe edin. Hücreleri 150 μL CyFACS ile yıkayın. Plakayı santrifüjleyin ve hafifçe vurun. Hücreleri tekrar 200 μL CyFACS ile yıkayın. Plakayı santrifüjleyin ve hafifçe vurun.
- Yüzey NK panel liyosferini 50 μL CyFACS'ta (anti-CD16, anti-HLA-DR, anti-LILRB1) ek yüzey antikorları ile çözün. -80 ° C'de saklanan ligand panelini çözün ve bir mini santrifüj kullanarak tüpü döndürün. Ek ligand panel yüzey işaretleyicilerinde ani artış (anti-CD16, anti-CD19).
- Hücreleri adım 1.2.6'da açıklandığı gibi düzeltin.
NOT: Sonraki tüm santrifüj dönüşlerini 700 °C'de 5 dakika boyunca 4 x g'da gerçekleştirin. - Hücreleri adım 1.2.7'de açıklandığı gibi geçirgen hale getirin.
- Hücre içi lekelenme
- Hücre içi NK panel liyosferini 50 μL Perm tamponunda çözün. İstenirse PBMC örnekleri için hücre içi bir antikor kokteyli hazırlayın.
NOT: Daha önce filtrelenmemiş herhangi bir antikor kokteyli (yani, liyofilizasyon veya dondurmadan önce), boyamadan önce 3 dakika boyunca 10.600 x g'de bir santrifüj filtre ünitesinden (0.1 μm gözenek boyutu) süzülmelidir. - İlgili hücre içi panellerin 50 μL'sindeki kuyuları yeniden askıya alın. Ligand yüzey paneli ile birlikte bir hücre içi panel kullanılmıyorsa, PBMC kuyularını 50 μL Perm tamponunda yeniden süspanse edin. 4 °C'de 45 dakika inkübe edin.
- Hücreleri 150 μL Perma tamponu ile yıkayın. Santrifüj ve fiske plakası. Hücreleri 200 μL Perma tamponu ile yıkayın. Plakayı santrifüjleyin ve hafifçe vurun.
- Hücreleri 200 μL CyFACS ile iki kez yıkayın. Plakayı santrifüjleyin ve hafifçe vurun.
- Hücre içi NK panel liyosferini 50 μL Perm tamponunda çözün. İstenirse PBMC örnekleri için hücre içi bir antikor kokteyli hazırlayın.
- DNA interkalatör boyama. Adım 1.2.9.1'de açıklandığı gibi DNA interkalatör boyamayı gerçekleştirin. Plakayı gece boyunca 4 °C'de inkübe edin.
NOT: İnterkalatör, hücresel nükleik aside bağlanır ve kütle sitometrisinde çekirdekli hücreleri tanımlamak için kullanılır. Plakalar parafin film ile kaplı olarak 4 °C'de bir haftaya kadar saklanabilir. - Numuneleri CyTOF'ta çalıştırmadan önce, hücreleri 1.2.9.3 ve 1.2.9.4 adımlarında açıklandığı gibi yıkayın.
- Örnekleri CyTOF'ta çalıştırın.
Sonuçlar
Antikorlar, üreticinin talimatlarına göre, ticari olarak temin edilebilen etiketleme kitleri kullanılarak metal izotoplarına konjuge edildi. Antikor klonları, bu panelde kullanılmadan önce akış sitometrisi ve kütle sitometrisi ile doğrulandı. Literatürün gözden geçirilmesine ve antikor mevcudiyetine dayalı olarak ilk klon listesi seçildi. NK hücre reseptörleri için bazı ligandların ekspresyon seviyeleri, sağlıklı PBMC'lerde düşüktür veya tespit edilemez. Bu nedenle, bazı antikorlar için pozitif boyama, sağlıklı PBMC'ler, kronik miyeloid lösemi K562 hücreleri, akut lenfoblastik lösemi NALM6 hücreleri veya B hücreli akut lenfoblastik lösemi 697 hücrelerinin boyanmasıyla doğrulanmıştır (Ek Şekil 1). Yeterli bir leke üretmeyen veya çok pahalı olan NK hücre paneli için seçilen klonlar, Ek Tablo 1'de detaylandırıldığı ve Ek Şekil 2'de gösterildiği gibi farklı olanlarla değiştirildi.
Bu paneller için antikorlarla metal-izotop eşleşmesi, Takahashi ve ark.16 tarafından belirtilen prensipler kullanılarak gerçekleştirildi. Soy belirteçleri orta ila yüksek yoğunluktaydı. Sonuç olarak, esas olarak düşük ve orta duyarlılıklı kitlelere konjuge edildiler ve yüksek duyarlılıklı kütleleri daha loş olarak ifade edilen belirteçlere karşı antikorlara konjugasyon için kullanılabilir hale getirdiler. Bolluk duyarlılığı (M ± 1 kanama) veya oksidasyon (M + 16 kanama) sorunlarını tespit etmek için halka açık bir panel tasarım yazılımı kullanıldı ve antikor-metal çiftleri buna göre yeniden atandı. Ek olarak, sinyal yoğunluklarında belirtilen minimum farklılıklarla farklı metaller üzerinde birkaç işaretleyici konjuge edildi (Ek Tablo 2 ve Ek Şekil 3). NK ve ligand panelleri için antikor-metal eşleşmeleri ve klon bilgileri sırasıyla Tablo 1 ve Tablo 2'de listelenmiştir.
Ev içi konjuge antikorlar, PBMC'ler üzerinde beş farklı titrede titre edildi: 0.625, 1.25, 2.5, 5 ve 10 μg / mL. En yüksek sinyal yoğunluğu ve pozitif ve negatif popülasyonlar arasında en iyi ayrım ile sonuçlanan en düşük antikor titresi, görsel değerlendirmeye dayalı olarak seçildi. NK ve ligand panelleri için titrasyonlar sırasıyla Şekil 1 ve Şekil 2'de gösterilmiştir. Bazı belirteçler için, işaretleyicinin loş bir şekilde ifade edilmesi veya evrensel olarak pozitif olması nedeniyle pozitif ve negatif popülasyonlar arasında net bir ayrım tanımlanmamıştır. Bu antikorlar için en doğru çalışma seyreltmesini belirlemek için, titreler, hem pozitif hem de negatif hücre popülasyonlarının tanımlanmasına izin vermek için çoklu hücre tiplerinde (PBMC'ler, T hücreleri, B hücreleri veya NK hücreleri) veya hücre dizilerinde değerlendirildi (Ek Şekil 4). Her bir belirteç için boyama indeksi (SI) hesaplanmamıştır, çünkü bu metrik CyTOF verileri17,18 için geçerli değildir.
Burada anlatılan paneller örnek barkodlama ile uyumlu olacak şekilde tasarlanmıştır. CyTOF için çeşitli barkodlama yöntemleri mevcuttur. En yaygın olarak kullanılanlar, barkodlamadan önce sabitleme gerektiren, ticari olarak temin edilebilen Paladyum bazlı bir kit ve Mei ve ark.15 tarafından açıklanan ve canlı hücrelerin barkodlanmasına izin veren CD45 tabanlı barkodlama yöntemidir. Hangi barkodlama yönteminin ihtiyaçlarımıza en uygun olduğunu değerlendirmek için, NK hücre panelinin erken bir versiyonunda fiksasyondan sonra NK hücre işaretleyici boyamanın stabilitesini test ettik (Ek Şekil 5). NK hücre belirteçlerinin çoğunun ekspresyonunun fiksasyondan etkilendiğini bulduk. Sonuç olarak, canlı hücreler15 üzerinde modifiye edilmiş dörtte iki, CD45 tabanlı bir barkodlama yöntemi kullanmaya karar verdik. Bu barkodlama yöntemi 102Pd, 104Pd, 106Pd ve 108Pd kullanır ve orijinal olarak Mei ve diğerleri tarafından açıklanan ve 104Pd, 106Pd, 108Pd, 110Pd, 113In ve 115In kullanan altıdan üçü yönteminden farklıdır. İndiyum kanalları, 115In-CD3'ten gelen sinyale müdahale ettikleri için barkodlama şemamıza dahil edilmedi. 110Pd, sırasıyla NK hücre ve ligand panellerinde HLA-DR Qdot ve CD19 Qdot'tan gelen sinyale müdahale ettiği için dahil edilmedi.
Boyamadan önce NK hücre saflaştırmasını önermemize rağmen, NK hücre paneli, tüm PBMC'lerden NK hücrelerinin fenotiplenmesine izin verecek şekilde tasarlanmıştır. NK hücre geçit stratejimizin bir örneği, sağlıklı bir donörden alınan PBMC'ler kullanılarak Şekil 3A'da gösterilmektedir. NK belirteçlerinin her biri için boyama ve kapılar, Şekil 3B'de sağlıklı, izole edilmiş NK hücreleri üzerinde gösterilmiştir. Ligand paneli, tüm PBMC'lerde NK hücre ligandlarının ekspresyonunu tespit etmek için tasarlanmıştır. Şekil 4A , sağlıklı bir donörden alınan PBMC'lerde CD4+ T hücrelerini, CD8+ T hücrelerini, NK hücrelerini, monositleri ve CD19+ B hücrelerini tanımlamak için kullanılan geçit stratejisini göstermektedir. Her ligand için temsili boyama örnekleri, akut dang hastalarından ve virolojik olarak baskılanmış HIV ile enfekte bireylerden alınan PBMC'ler kullanılarak Şekil 4B'de gösterilmektedir.
Zaman içinde panel stabilitesini sağlamak için protokolümüz iki olası seçenek içerir: üçüncü taraf bir şirket aracılığıyla tek kullanımlık boncuklara liyofilizasyon veya önceden hazırlanmış alikotların -80 °C'de dondurulması. Bu protokol için NK paneli liyofilize edildi ve ligand paneli donduruldu. Her iki yöntem de klinik numuneler üzerinde her bir panel kullanılmadan önce doğrulanmıştır.
Paneldeki her bir antikorun birden fazla konjugasyonunu gerçekleştirerek bir ana karışımdan NK panelinin 700'den fazla reaksiyonunu ürettik. Her konjuge antikorun doğrulanması ve titrasyonundan sonra, antikorlar bir ana karışımda birleştirildi, steril bir 0.1 μm şırınga filtre ünitesinden süzüldü ve liyofilizasyon için üçüncü taraf bir şirkete gönderildi. Biri yüzey boyama ve diğeri hücre içi boyama için olmak üzere iki set tek lekeli liyosfer yapıldı. Kurum içinde konjuge olmayan antikorlar (HLA-DR ve CD16), liyofilizasyon sürecine müdahale eden antikor stabilizatörünün varlığı nedeniyle liyosfere eklenemedi. Bu antikorlar lekelenme günü panele eklenir. Liyofilizasyon öncesi ve sonrası elde edilen lekeler arasında bir karşılaştırma Ek Şekil 6'da gösterilmiştir. Başlangıçta liyosferlerde kullanılan LILRB1 antikorunun klonu, yeterince güçlü bir leke üretmedi (Ek Tablo 1 ve Ek Şekil 2). Daha sonra daha iyi bir klon tanımlandı, konjuge edildi ve boyama gününde panele eklendi (Tablo 1). Lyopsterlerde kullanılan KIR2DS2 poliklonal antikorun, liyofilizasyondan sonra spesifik olmayan bir leke oluşturduğu not edilmiştir ve sonraki analizler için kullanılmasını önermiyoruz (Ek Tablo 1 ve Ek Şekil 2). Hücre içi lekelerin çoğu, liyofilizasyonu takiben yoğunlukta hafifçe artmıştır (Ek Şekil 6).
Ligand panel ana karışımının -80 °C'de depolanmasından önce iki farklı saklama koşulunu test ettik. Bu panelin daha küçük bir ana karışımını hazırladık ve alikotları -80 °C'de ve sıvı nitrojen içinde yaklaşık iki ay boyunca sakladık. İki ay sonra, tüm PBMC'leri donmuş alikotlarla lekeledik. Boyamayı, yeni hazırlanmış panel ile boyanmış aynı donörden alınan PBMC'lerinkiyle karşılaştırdık (Ek Şekil 7). -80 ° C'de ve sıvı nitrojende depolamanın çoğu işaretleyici için sinyal yoğunluğunu değiştirmediğini bulduk. Aslında, anti-pan HLA sınıf I, anti-CD7, anti-CD4, anti-HLA-Bw4, anti-CD14, anti-CD11b ve anti-LFA-3'ün sinyal yoğunluğu, özellikle -80 °C'de saklanan numuneler söz konusu olduğunda, donma sonrasında daha yüksektir. Anti-LLT-1, anti-Nektin-1, anti-MICA/B, anti-DR4/5, anti-ULBP-1,2,5,6, anti-Nektin-2, anti-CD155 ve anti-B7-H6 sinyal yoğunluklarının donmadan etkilenip etkilenmediğini belirleyemedik, çünkü sağlıklı PBMC'ler bu belirteçlerin yüksek seviyelerini ifade etmemektedir. Bununla birlikte, bu belirteçlerin hücre hatları üzerinde doğrulanması (Ek Şekil 1), -80 ° C'de depolanan konjuge antikorlar kullanılarak gerçekleştirildi. Sonuç olarak, donmanın önemli bir sinyal kaybına yol açmadığından emindik. Sinyal yoğunluğu beş belirteç için donma üzerine azaldı: anti-CD8, anti-ICAM-1, anti-CCR2, anti-CD33 ve anti-CD56. Bununla birlikte, tüm bu durumlarda, pozitif ve negatif popülasyonlar arasındaki net ayrım devam etmiştir. Metal konjuge antikorların 4 ° C'de uzun süre stabil olmadığı göz önüne alındığında, panel stabilitesini uzun süre korumak için dondurma gerekliydi ve bir belirteç alt kümesinde boyama yoğunluğundaki azalmaya rağmen, yeterli boyama ayrımını koruyabildik. Daha da önemlisi, anti-CD8, anti-CCR2 ve anti-CD56'nın sinyal yoğunluğu kaybı, sıvı nitrojen içinde saklanan numunelerde -80 °C'de depolananlara kıyasla daha fazlaydı. Bu verilere dayanarak paneli -80 °C'de saklamaya karar verdik.
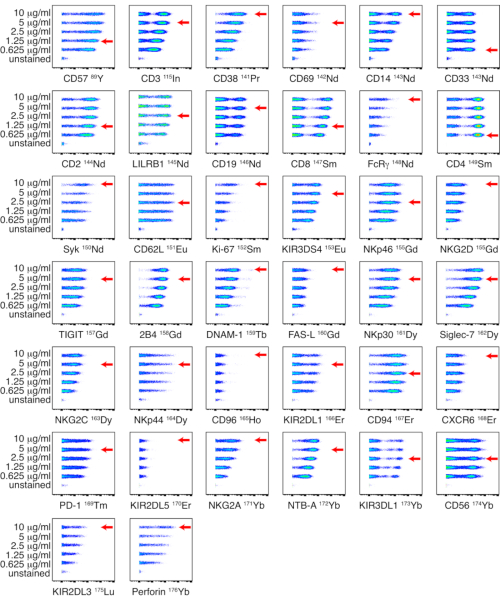
Şekil 1: NK paneli için kurum içi konjuge antikor-metal konjugatlarının titrasyonu. Kurum içi konjuge antikorların titrasyonları, sağlıklı bir donörden alınan PBMC'ler üzerinde beş farklı konsantrasyon kullanılarak gerçekleştirildi: 0.625, 1.25, 2.5, 5 ve 10 μg/mL. Anti-CD3, anti-CD14, anti-CD33, anti-CD19, anti-PD-1 ve anti-CD56 titreleri canlı hücreler üzerinde geçit yapılarak belirlendi. Anti-CD4 ve anti-CD8 titreleri, T hücreleri üzerinde geçit ile belirlendi. Kalan antikorlar için titreler, NK hücreleri üzerinde geçit ile belirlendi. NKp44 istirahat eden NK hücrelerinde eksprese edilmediğinden, IL-2 ile uyarılan PBMC'lerde titreler belirlendi ve NK hücreleri üzerinde gösterildi. Kırmızı oklar, her antikor için seçilen titreyi gösterir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: Kurum içi konjuge ligand panel antikorlarının titrasyonu. Kurum içi konjuge antikorların titrasyonları, sağlıklı bir donörden alınan PBMC'ler üzerinde beş farklı konsantrasyon kullanılarak gerçekleştirildi: 0.625, 1.25, 2.5, 5 ve 10 μg/mL. Anti-HLA-DR, anti-ICAM-1, anti-CCR2, anti-CD14, anti-CD11b ve anti-LFA-3 titreleri CD3-CD7- hücreleri üzerinde geçit yapılarak belirlendi. Anti-CD3, anti-pan HLA sınıf I, anti-CD7, anti-CD48, anti-LLT-1, anti-HLA-C,E, anti-HLA-E, anti-FasR, anti-Nektin-1, anti-MICA/MICB, anti-DR4/DR5, anti-ULBP-1,2,5,6, anti-Nektin-2, anti-CD155, anti-HLA-Bw4, anti-HLA-Bw6, anti-CD33, anti-CD56 ve anti-B7-H6 titreleri canlı hücreler üzerinde geçit yapılarak belirlendi. Anti-CD4 ve anti-CD8 titreleri, CD3 + hücreleri üzerinde geçit yapılarak belirlendi. Kırmızı oklar, her antikor için seçilen titreyi gösterir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
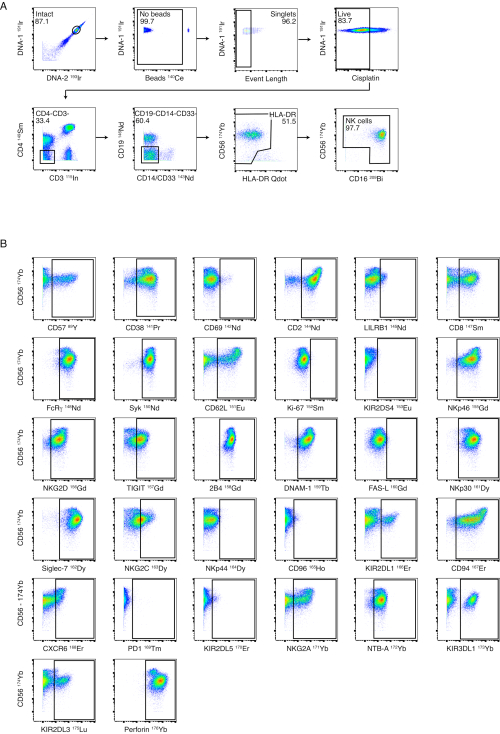
Şekil 3: NK panel geçit stratejisi ve performansı. (A) Sağlıklı bir donörde tüm PBMC'lerden NK hücrelerine seri negatif geçit gösterilmiştir. Sağlam, boncuk ve olay uzunluğundaki kapılar, tek hücrelere başarılı bir şekilde geçit sağlar. Sisplatin boyaması Canlı/Ölü boyama olarak yapıldı. T hücreleri ve B hücreleri CD3 ve CD19 kullanılarak dışlandı. Monositler, CD4 ve CD14/CD33 üzerinde negatif geçit ile ve CD56-/HLA-DRparlak hücrelerin daha fazla negatif geçitleme ile dışlandı. CD56 ve CD16, NK hücrelerinin farklı alt kümelerini tanımlamak için kullanıldı (CD56parlak, CD56dim ve CD56-). (B) Manyetik boncuk izolasyonu ile saflaştırılmış bir sağlıklı donörden alınan NK hücreleri üzerindeki NK hücre reseptörlerinin ekspresyon örnekleri. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 4: Ligand panel kapıları ve performansı. (A) Normalizasyon, kalibrasyon boncuğunun çıkarılması ve debarkodlamayı takiben sağlıklı bir donörden türetilen PBMC'lerden ana bağışıklık hücresi alt kümelerinin geçitlenmesi. (B) NK hücre reseptörleri için ligandların yanı sıra canlı PBMC'lerde birkaç miyeloid markörün ekspresyonu. Nektin-1 ve B7-H6 dışındaki tüm ligandlar için boyama, akut dang hastalarından alınan PBMC'lerde gösterilmiştir. Nektin-1 ve B7-H6 için boyama, virolojik olarak baskılanmış HIV ile enfekte bireylerden alınan PBMC'lerde gösterilmiştir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Ek Şekil 1: Hücre hatları üzerindeki ligand paneli için antikor klonlarının doğrulanması. Sağlıklı PBMC'lerde düşük seviyelerde eksprese edilen NK hücre reseptörleri için ligandlara karşı antikorlar, hücre hatlarının boyanmasıyla doğrulandı. Kronik miyeloid lösemi K562 hücreleri anti-ICAM-1, anti-MICA/MICB, anti-DR4/DR5, anti-ULBP-1,2,5,6, anti-Nektin-2, anti-CD155 ve anti-B7-H6 ile boyandı. Akut lenfoblastik lösemi NALM6 hücreleri anti-LLT-1 ve B hücreli akut lenfoblastik lösemi 697 hücre anti-Nektin-1 ile boyandı. Sağlıklı PBMC'lerde lekelenmeyi gösteren nokta grafikleri ve histogramlar mavi renktedir. İlgili hücre çizgisinde lekelenmeyi gösteren nokta çizimleri ve histogramlar kırmızı renktedir. Belirli bir işaretleyici için pozitif olan ilgili hücre hattının hücrelerinin yüzdesi sağlanır. Bu dosyayı indirmek için lütfen buraya tıklayın.
Ek Şekil 2: Antikor klonlarının doğrulanması. (A) En iyi özgüllüğe sahip klonu tanımlamak için sağlıklı donörlerde farklı antikor klonları test edildi. NK hücrelerinde 2B4, CXCR6, KIR2DS4, NKG2A ve TIGIT gösterilir. CD56 ve LILRB1 canlı hücrelerde gösterilir. (B) KIR2DS2 antikor klonu, liyofilizasyondan sonra spesifik olmayan bir leke gösterdi. Aynı donör üzerinde bir boyama örneği, liyofilizasyon öncesi ve sonrası sağlanır. Bu dosyayı indirmek için lütfen buraya tıklayın.
Ek Şekil 3: Antikor/metal çiftlerinin optimizasyonu. Sağlıklı donörlerden PBMC'lerin boyanması gösterilmiştir. (A) Panel için test edilen antikor/metal çiftleri. (B) Panelde kullanılan antikor/metal çiftleri. LILRB1 ve PD1 canlı hücrelerde gösterilir. Diğer tüm belirteçler NK hücrelerinde gösterilir. Bu dosyayı indirmek için lütfen buraya tıklayın.
Ek Şekil 4: Loş eksprese edilen ve çoğunlukla pozitif NK hücre belirteçlerinin titrasyonu. Net bir pozitif ve negatif popülasyon göstermeyen NK hücre belirteçlerine karşı antikorlar için titreler, hem NK hücrelerinde (kırmızı) hem de sağlıklı donörlerden B hücrelerinde (mavi) veya PBMC'lerde (gri) değerlendirildi. Oklar, her antikor için seçilen titreyi gösterir. Bu dosyayı indirmek için lütfen buraya tıklayın.
Ek Şekil 5: Barkodlama protokolünün optimizasyonu. Epitop stabilitesi, sağlıklı bir donörden alınan PBMC'lerde% 2 paraformaldehit ile fiksasyondan önce ve sonra test edildi. (A) CD3, CD14 ve CD56 boyaması (kırmızı) ve (mavi) fiksasyon öncesi benzerdi, CD4 ve CD16 boyaması fiksasyondan önemli ölçüde etkilendi. (B) CD2, CD38, KIR3DL2, CD62L, KIR2DS4, NKp46, NKG2C, NKp30, NKG2D, KIR3DL1, TIGIT, KIR2DL1, KIR2DL3 ve NTB-A dahil olmak üzere birçok NK hücre markörü fiksasyondan etkilenmiştir. Bu dosyayı indirmek için lütfen buraya tıklayın.
Ek Şekil 6: Liyofilizasyondan sonra panel stabilitesinin doğrulanması. Kurum içi antikor konjugatlarının stabilitesi, aynı kan bankası donöründen alınan PBMC'lerin liyofilizasyon öncesi (mavi) ve liyofilizasyon sonrası (kırmızı) boyanmasıyla doğrulandı. Canlı hücrelerde anti-CD3, anti-CD14, anti-CD33, anti-CD19, anti-PD-1, anti-CD56 lekeleri gösterilir. Anti-CD4 ve anti-CD8, CD3 + hücrelerinde gösterilir. Kalan antikorlar için titreler, Şekil 1'de gösterilen geçit şemasına göre kapılı NK hücreleri üzerinde gösterilmiştir. Özellikle, anti-KIR2DS2, liyofilizasyondan sonra spesifik olmayan bir şekilde lekelenir ve bu nedenle sonraki analizler için kullanılmamıştır. Bu dosyayı indirmek için lütfen buraya tıklayın.
Ek Şekil 7: -80 °C'de ligand panel stabilitesinin teyidi. Kurum içi antikor konjugatlarının stabilitesi, aynı donörden alınan sağlıklı PBMC'lerin -80 ° C'de veya sıvı nitrojen içinde depolandıktan sonra taze hazırlanmış bir ana karışım ve aynı karışım ile boyanmasıyla doğrulandı. CD3-CD7- hücrelerinde anti-HLA-DR, anti-ICAM-1 ve anti-LFA-3 boyaması gösterilmiştir. Canlı hücrelerde anti-CD3, anti-pan HLA sınıf I, anti-CD7, anti-CD48, anti-LLT-1 anti-HLA-E, anti-FasR, anti-Nektin-1, anti-MICA/B, anti-DR4/5, anti-ULBP-1,2,5,6, anti-Nektin-2, anti-CD155, anti-HLA-Bw4, anti-HLA-Bw6 ve anti-B7-H6 boyama gösterilir. CD3 + hücrelerinde anti-CD8 ve anti-CD4 boyaması gösterilmiştir. CD3-CD7-CD14+ hücrelerinde anti-HLA-C,E, anti-CCR2, anti-CD11b ve anti-CD33 boyaması gösterilmiştir. CD3-CD7-CD33+ hücrelerde anti-CD14 boyama, CD3-CD7+CD14-HLA-DR- hücrelerinde anti-CD56 boyanması gösterildi. Yeni hazırlanmış panel ile lekelenmeyi gösteren histogramlar kırmızı renktedir. Yaklaşık iki ay boyunca -80 ° C'de saklandıktan sonra panel ile lekelenmeyi gösteren histogramlar mavi renktedir. Yaklaşık iki ay boyunca sıvı nitrojen (LN2) içinde depolandıktan sonra panel ile lekelenmeyi gösteren histogramlar yeşil renktedir. Numuneler boyandı ve farklı günlerde çalıştırıldı. Dosyalar normalleştirildi ve boncuklar premessa paketi kullanılarak çıkarıldı. Bu dosyayı indirmek için lütfen buraya tıklayın.
| Özgüllüğü | Klon | İzotop | Amaç | Yüzey/Hücre İçi |
| CD57 Serisi | HCD57 Serisi | 89Y | Olgunluk/Hafıza | yüzey |
| CD45 Serisi | HI30 Serisi | 102Pd, 104pd, 106pd, 108pd | Barkodlama | yüzey |
| HLA-DR (Radyo Frekansı) | Tü36 Tezli Yüksek Lisans | Qdot 655 (112 cd-114cd) | Aktivasyon/Köken | yüzey |
| CD3 (İngilizce) | UCHT (Türkçe) | 115İçinde | T hücresi soyu | yüzey |
| CD38 Serisi | HIT2 Serisi | 141Pr | Aktivasyon İşaretçisi | yüzey |
| CD69 Serisi | FN50 Serisi | 142Nd | Aktivasyon İşaretçisi | yüzey |
| CD33 Serisi | WM53 Serisi | 143Nd | Monosit soyu | yüzey |
| CD14 Serisi | M5E5 Serisi | 143Nd | Miyeloid soy | yüzey |
| CD2 (İngilizce) | RPA-2.10 Serisi | 144Nd | Etkinleştirme/Olgunluk | yüzey |
| LILRB1 | MAB20172 | 145Nd | İnhibitör Reseptör | yüzey |
| CD19 Serisi | HIB19 Serisi | 146Nd | B hücre soyu | yüzey |
| CD8 Serisi | SK1 Serisi | 147Sm | T hücresi soyu ve NK hücresi Aktivasyonu/Olgunluğu | yüzey |
| FcRg | poliklonal | 148Nd | Olgunluk/Uyarlanabilir | hücre içi |
| CD4 (İngilizce) | SK3 Serisi | 149Sm | T hücresi soyu | yüzey |
| Syk | 4D10.2 | 150Nd | Sinyal | hücre içi |
| CD62L | DREG-56 Serisi | 151AB | Etkinleştirme | yüzey |
| Ki-67 Uçağı | Ki-67 Uçağı | 152Sm | Çoğalması | hücre içi |
| KIR2DS4 | 179315 | 153AB | Reseptörün Aktive Edilmesi | yüzey |
| NKp46 | 9.00E+02 | 155Gd | Reseptörün Aktive Edilmesi | yüzey |
| NKG2D | 1D11 | 156Gd | Reseptörün Aktive Edilmesi | yüzey |
| TIJIT | 741182 | 157Gd | İnhibitör Reseptör | yüzey |
| 2B4 Serisi | C1.7 Serisi | 158Gd | Reseptörün Aktive Edilmesi | yüzey |
| DNAM-1 (DNAM-1) | DX11 Serisi | 159TB | Reseptörün Aktive Edilmesi | yüzey |
| FAS-L | NOK-1 (NOK-1) | 160Gd | Apoptoz | yüzey |
| NKp30 Serisi | P30-15 Serisi | 161Dy | Reseptörün Aktive Edilmesi | yüzey |
| Siglec-7 | S7.7 | 162Dy | İnhibitör Reseptör | yüzey |
| NKG2C | 134522 | 163Dy | Olgunluk/Hafıza | yüzey |
| NKp44 | P44-8 Serisi | 164Dy | Reseptörün Aktive Edilmesi | yüzey |
| CD96 Serisi | NK92.39 | 165HO | NKG2 Ko-reseptörü | yüzey |
| KIR2DL1/KIR2DS5 | 143211 | 166Er | İnhibitör Reseptör | yüzey |
| CD94 Serisi | DX22 Serisi | 167Er | Reseptörün Aktive Edilmesi | yüzey |
| CXCR6 Serisi | K041E5 Serisi | 168Er | Bellek | yüzey |
| PD1 (PD1) | EH12.2H7 | 169Tm | İnhibitör Reseptör | yüzey |
| KIR2DL5 | YUKARI-R1 | 170Er | İnhibitör Reseptör | yüzey |
| NKG2A Serisi | 131411 | 171Yb | İnhibitör Reseptör | yüzey |
| NTB-A | NT-7 Serisi | 172TB | Reseptörün Aktive Edilmesi | yüzey |
| KIR3DL1 | DX-9 Serisi | 173Yb | İnhibitör Reseptör | yüzey |
| CD56 Serisi | NCAM16.2 (İngilizce) | 174Yb | NK hücre soyu | yüzey |
| KIR2DL3 | 180701 | 175Lu | İnhibitör Reseptör | yüzey |
| Perforin | B-D48 Serisi | 176Yb | Sitolitik Protein | hücre içi |
| DNA-1/DNA-2 | NA | 191Ir/193Ir | Çekirdekli hücreler | yüzey |
| Sisplatin | NA | 194pt/195puan | Canlılık | yüzey |
| CD16 Serisi | 3G8 Serisi | 209Biseksüel | FcgRIII reseptörü | yüzey |
Tablo 1: NK paneli. İşaretleyiciler, konjuge edildikleri metalin izotopik kütlesine göre sıralanır. 191Ir/193Ir, nükleik asit interkalatörünün doğal bolluğudur. 194Pt/195Pt, sisplatinin doğal bolluğudur.
| Özgüllüğü | Klon | İzotop | Amaç | Yüzey/Hücre İçi |
| HLA-DR (Radyo Frekansı) | L243 Serisi | 89Y | Antijen sunan hücreler, aktivasyon belirteci | yüzey |
| CD45 Serisi | HI30 Serisi | 102Pd, 104pd, 106pd, 108pd | Barkodlama | yüzey |
| CD19 Serisi | SJ25-C1 Serisi | Qdot 655 (112 cd-114cd) | Soy | yüzey |
| CD3 (İngilizce) | UCHT1 | 115İçinde | Soy | yüzey |
| Pan HLA sınıf I | W6/32 Serisi | 143Nd | KIR ligandları | yüzey |
| CD7 Serisi | CD7-6B7 Serisi | 144Nd | Soy | yüzey |
| CD8 Serisi | SK1 Serisi | 145Nd | Soy | yüzey |
| CD48 Serisi | BJ40 Serisi | 146Nd | 2B4 ligandı | yüzey |
| İKAM-1 | HA58 Serisi | 148Nd | LFA-1 ligandı | yüzey |
| LLT-1 Serisi | 402659 | 149Sm | CD161 ligandı | yüzey |
| CD4 (İngilizce) | Tamam4 | 151AB | Soy | yüzey |
| HLA-C,E | DT9 Serisi | 153AB | KIR ligandları | yüzey |
| CCR2 Serisi | K036C2 Serisi | 154Sm | Monosit fonksiyonel işaretleyici | yüzey |
| HLA-E Serisi | 3D12 | 155Gd | NKG2A/CD94 ve NKG2C/CD94 ligandı | yüzey |
| Fas (CD95) | DX2 Serisi | 156Gd | FasL reseptörü | yüzey |
| Nektin-1 | R1.302 Serisi | 157Gd | CD96 ligandı | yüzey |
| MICA/B | 159227/236511 | 158Gd | NKG2D ligandları | yüzey |
| DR4/5 Serisi | DJR1 / DJR2-2 | 159TB | TRAIL reseptörleri | yüzey |
| ULBP-1/2,5,6 | 170818/165903 | 161Dy | NKG2D ligandları | yüzey |
| Nektin-2 | TX31 Serisi | 164Dy | DNAM-1, TIGIT ve CD96 ligandı | yüzey |
| CD155 Serisi | SKII.4 | 165HO | DNAM-1, TIGIT ve CD96 ligandı | yüzey |
| HLA-BW4 Serisi | REA274 Serisi | 166Er | KIR3DL1 ligandı | yüzey |
| HLA-BW6 Serisi | REA143 Serisi | 168Er | KIR boş alel | yüzey |
| CD14 Serisi | M5E2 Serisi | 169Tm | Soy | yüzey |
| CD11b | ICRF44 Tezli Yüksek Lisans | 170Er | Soy | yüzey |
| LFA-3 Serisi | TS2/9 Serisi | 171Yb | CD2 ligandı | yüzey |
| CD33 Serisi | WM53 Serisi | 172Yb | Soy | yüzey |
| CD56 Serisi | NCAM16.2 (İngilizce) | 174Yb | Soy | yüzey |
| B7-H6 arası | 875001 | 176Yb | NKp30 ligandı | yüzey |
| DNA-1/DNA-2 | NA | 191Ir/193Ir | Çekirdekli hücreler | yüzey |
| Sisplatin | NA | 194pt/195puan | Canlılık | yüzey |
| CD16 Serisi | 3G8 Serisi | 209Biseksüel | Soy | yüzey |
Tablo 2: Ligand paneli. İşaretleyiciler, konjuge edildikleri metalin izotopik kütlesine göre sıralanır. 191Ir/193Ir, nükleik asit interkalatörünün doğal bolluğudur. 194Pt/195Pt, sisplatinin doğal bolluğudur.
| Özgüllüğü | Klon | Satıcı | Katalog Numarası | Yüzey/ Hücre İçi | Notlar |
| 2B4 Serisi | 2-69 | BD Biyolojik Bilimler | 550814 | yüzey | Geliştirilmiş boyama ile doğrulanan yeni klon |
| CD56 Serisi | N901 Serisi | Beckman Coulter'ın fotoğrafı. | 6602705 | yüzey | Geliştirilmiş boyama ile doğrulanan yeni klon |
| CXCR6 Serisi | 56811 | Ar-Ge Sistemleri | MAB699 Serisi | yüzey | Yeni klon daha düşük maliyetle doğrulandı |
| KIR2DS2 | poliklonal | Abcam Belediyesi | ab175486 (İngilizce) | yüzey | Liyofilizasyondan sonra spesifik olmayan lekelenme kaydedildi - analizler için kullanılmaz |
| KIR2DS4 | FES172 Serisi | Beckman Coulter'ın fotoğrafı. | A60796 Serisi | yüzey | Geliştirilmiş boyama/daha düşük maliyetle doğrulanan yeni klon |
| LILRB1 | GHI/75 | Biyoefsane | 333702 | yüzey | Geliştirilmiş boyama ile doğrulanan yeni klon |
| NKG2A Serisi | Z199 Serisi | Beckman Coulter'ın fotoğrafı. | IM2750 Serisi | yüzey | Yeni klon daha düşük maliyetle doğrulandı |
| TIJIT | MBSA43 | Thermo Fisher Bilimsel | 16-9500-82 | yüzey | Yeni klon doğrulandı |
Ek Tablo 1: NK hücre paneli için test edilmiş, ancak kullanılmayan antikorlar.
| İzotop | Özgüllüğü | Klon | Satıcı | Katalog Numarası | Yüzey/ Hücre İçi |
| 143Nd | NKG2C | 134522 | Ar-Ge sistemleri | MAB1381 | yüzey |
| 145Nd | CD38 Serisi | HIT2 Serisi | Biyoefsane | 303502 | yüzey |
| 146Nd | CD8 Serisi | SK1 Serisi | Biyoefsane | 344702 | yüzey |
| 149Sm | CD2 (İngilizce) | RPA-2.10 Serisi | Biyoefsane | 300202 | yüzey |
| 151AB | Siglec-7 | S7.7 | Biyoefsane | 347702 | yüzey |
| 154Sm | LILRB1 | 292319 | Ar-Ge sistemleri | MAB20172 | yüzey |
| 163Dy | KIR3DL1 | DX-9 Serisi | BD biyolojik bilimler | 555964 | yüzey |
| 168Er | CD62L | DREG-56 Serisi | Biyoefsane | 304802 | yüzey |
| 171Yb | PD1 (PD1) | EH12.2H7 | Biyoefsane | 329902 | yüzey |
| 176Yb | CD69 Serisi | EH12.2H7 | Biyoefsane | 329902 | yüzey |
Ek Tablo 2: Farklı bir antikor/metal eşleşmesi ile test edilen NK hücre paneli için antikorlar.
Tartışmalar
Burada, NK hücre reseptörü-ligand repertuarının profilini çıkarmayı amaçlayan iki tamamlayıcı CyTOF panelinin tasarımını ve uygulamasını açıklıyoruz. Bu protokol, kaliteli veri elde etmek için kritik olan birkaç adım içerir. CyTOF, antikorlar19 için etiket probları olarak florokromlar yerine ağır metal iyonları kullanır. Bu nedenle bu teknoloji, çevresel metallerden20 gelen potansiyel kirletici sinyallere tabidir. Potansiyel metal safsızlık kaynakları arasında laboratuvar bulaşık sabunu (baryum) ve laboratuvar tamponları (cıva, kurşun, kalay) bulunur. Bu nedenle, tüm tamponların ultra saf su ile hazırlanması ve tüm reaktiflerin hiç sabunla yıkanmamış plastik veya cam kaplarda saklanması tavsiye edilir. Bu protokoldeki bir diğer kritik adım, Fienberg ve ark.21 tarafından tarif edildiği gibi sisplatin bazlı bir yöntem kullanan canlılık boyasıdır. Bu yöntem, sisplatinin tercihen canlı olmayan hücreleri etiketlediği bir dakikalık bir inkübasyon adımını içerir. Sisplatin boyaması FBS yokluğunda yapılmalıdır. Sonuç olarak, hücreler boyamadan önce CyPBS ile iyice yıkanmalıdır. Ek olarak, canlı hücrelerin hedef dışı boyanmasını önlemek için, sisplatin boyasının tam olarak bir dakika sonra FBS ile söndürülmesi gerekir. Bu protokol, maksimum hücre geri kazanımı ve boyama performansı için optimize edilmiştir. Bu nedenle fiksasyon ve geçirgenlik aşamaları da önemlidir. Çeşitli fiksasyon ve geçirgenlik reaktifleri CyTOF ile uyumludur. Bununla birlikte, %2 PFA ile fiksasyonun ve ardından Malzeme Tablosunda ayrıntıları verilen spesifik bir geçirgenlik tamponu ile geçirgenleştirmenin maksimum hücre geri kazanımı ile sonuçlandığını bulduk. Bu geçici bir geçirgenleştirme yöntemi olduğundan, yeterli antikor penetrasyonunu sağlamak için geçirgenleştirme tamponunda hücre içi boyama yapılması gerekir. Hücrelerin ayrıca, bağlanmamış antikorları uzaklaştırmak için hücre içi boyamayı takiben geçirgenlik tamponu ile iyice yıkanması gerekir.
Bu protokol birkaç olası değişikliğe izin verir. Burada ayrıntıları verilen CyTOF panelleri, ek işaretleyiciler içerecek veya mevcut olanları değiştirecek şekilde özelleştirilebilir. Özellikle, ligand paneli, panel tasarımında esneklik sağlamak için birkaç açık kanal ile tasarlanmıştır. Panelde yapılacak herhangi bir değişiklik veya ekleme, ek sorun giderme gerektirebilir. Özellikle, herhangi bir antikor/metal izotop çifti, mevcut kanallara herhangi bir sinyal yayılması sorununu önlemek için yukarıda açıklandığı gibi kapsamlı bir şekilde doğrulanmalıdır. Bu paneller aynı zamanda numune barkodlama ile uyumlu olacak şekilde tasarlanmıştır. Barkodlama, reaktif tüketimini en aza indirirken parti etkileri ve numuneden numuneye taşıma olasılığını azaltır22. Barkodlama tipik olarak genel olarak veri kalitesinin artmasına neden olsa da, bu adım kaliteli CyTOF verilerinin elde edilmesi için gerekli değildir ve tamamen atlanabilir. Benzer şekilde, boyamadan önce NK hücre saflaştırmasını önermemize rağmen, NK hücre paneli, tüm PBMC'lerden alınan NK hücrelerinin fenotiplemesi ile uyumludur.
Bu yöntemin bazı sınırlamaları vardır. CyTOF'un doğası gereği düşük verim doğası nedeniyle, bu yöntem düşük hücre sayısına sahip numuneler için uygun değildir. Bu tür numunelerin analiz için yeterli kalitede veri vermesi olası değildir. Ek olarak, bu panellerin NK hücre-hedef hücre etkileşimlerini sorgulamak için özel olarak tasarlandığı göz önüne alındığında, CD8 + T hücreleri ve miyeloid hücreler gibi diğer hücre tipleri arasındaki etkileşimleri değerlendirme yetenekleri sınırlıdır. Benzer şekilde, bu paneller doğrudan ex vivo immünofenotipleme için tasarlanmıştır ve sitokin stimülasyonu gibi aktive edici koşullar altında kullanım için test edilmemiş veya doğrulanmamıştır. Ayrıca, bu paneller NK hücre reseptörleri ve ligandlarının kapsamlı bir listesini kapsamasına rağmen, tamamen kapsamlı değildirler ve alan sınırlamaları nedeniyle potansiyel olarak önemli birkaç belirteç dahil edilmemiştir. Bu belirteçlerden bazıları, bunlarla sınırlı olmamak üzere, NK panelinde KLRG1, CRACC, TIM-3, LAIR-1 ve ligand panelinde PD-L1'i içerir. Son olarak, NK hücre belirteçlerinin epitoplarının çoğunun fiksasyondan etkilendiği göz önüne alındığında, bu yöntem sabit numunelerde kullanım için uygun değildir.
Burada açıklanan protokolün diğer yöntemlere kıyasla önemli faydaları vardır. Diğer gruplar, NK hücreleri 3,4,5,6,7,8,23'ün incelenmesini amaçlayan akış sitometri panellerini tanımlamıştır. Akış sitometrisi ile karşılaştırıldığında, CyTOF kullanımı, florofor kompanzasyonu ile ilgili sorunları ortadan kaldırarak çok sayıda markörün aynı anda tespit edilmesine olanak tanır. Diğerleri deNK hücreleri 9,10,11,12,13,14'ü incelemek için CyTOF panelleri geliştirmiş olsa da, burada hem NK hücre reseptörlerinin hem de ligandlarının ekspresyonunu sorgulayan iki tamamlayıcı CyTOF panelinin kullanımını açıklıyoruz, bu nedenle NK hücre fonksiyonunun daha ayrıntılı bir resmini sunuyoruz.
Grubumuz, sağlıklı donörlerde ve HIV enfeksiyonu ve dang virüsü enfeksiyonu dahil olmak üzere çeşitli hastalık ortamlarında insan NK hücre yanıtını karakterize etmek için bu protokolü ve bu panellerden birini veya her ikisini kullanmıştır 24,25,26,27,28. Viral enfeksiyonları incelemek amacıyla tasarlanmış olmalarına rağmen, bu paneller, kapladıkları proteinlerin nefesi göz önüne alındığında, diğer koşullarda NK hücrelerinin incelenmesine kendilerini ödünç verir. Aslında, grubumuz bu panelleri immün yetmezlik ve multipl skleroz 25,27,29,30 ve insanlaştırılmış farelerde31,32 NK hücre reseptörü-ligand repertuarını karakterize etmek için de kullandı. Bu nedenle, bu panellerin kullanımı diğer bağlamlara genişletilebilir. Örneğin, kanser ortamında rol oynayan birçok NK hücre reseptörü ve akraba ligandları bu panellere dahil edilmiştir, bu da bu panelleri NK hücrelerinin anti-tümör yanıtındaki rolü üzerine gelecekteki çalışmalar için mükemmel araçlar haline getirir. Daha geniş anlamda, CyTOF panellerinin seri üretimi ve depolanması ile numunelerin paralel işlenmesi için protokolümüz, herhangi bir CyTOF panelinin yürütülmesine ve uygulanmasına uygulanabilir.
Açıklamalar
Yazarların ifşa edecek hiçbir şeyi yok.
Teşekkürler
Yazarlar, bu panele katkıda bulunan Blish Laboratuvarı'nın tüm mevcut ve eski üyelerine teşekkür eder. AIDS Klinik Araştırmalar Grubu ve ACTG A5321 ekibinin yanı sıra Gorgas Memorial Sağlık Araştırmaları Enstitüsü'nden Dr. Sandra López-Vergès ve Davis Beltrán'a numune kürlemesi için teşekkür ederiz. Son olarak, Michael Leipold, Holden Maecker ve Stanford İnsan Bağışıklık İzleme Merkezi'ne Helios makinelerini kullandıkları için teşekkür ederiz. Bu çalışma NIH U19AI057229, NIH R21 AI135287, NIH R21 AI130532, NIH DP1 DA046089 ve Burroughs Wellcome Fund Araştırmacıları tarafından Enfeksiyon Hastalıklarının Patogenezinde #1016687 CB, NIH Ruth L. Kirschstein Kurumsal Ulusal Araştırma Hizmeti Ödülü T32 AI007502, TL1 TR001084 ve NIH/NIAID K08 AI138640 EV, Ulusal Bilim Vakfı Lisansüstü Araştırma Bursu DGE-1656518 JM ve NIH eğitim hibesi T32-AI-007290 (PI Olivia Martinez) tarafından desteklenmiştir. ACTG çalışması, AI-68634 (İstatistik ve Veri Yönetim Merkezi), UM1-A1-26617, AI-131798 ve AI-68636 (ACTG) tarafından hibe desteği aldı. CB, Stanford Anne Çocuk Sağlığı Araştırma Enstitüsü'nden Pediatrik Translasyonel Tıp alanında Tashia ve John Morgridge Fakültesi Araştırmacısı ve Chan Zuckerberg Biohub'ın Araştırmacısıdır.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 89Y | Sigma-Aldrich | 204919 | |
| 102-Palladium nitrate | Trace Sciences International | Special Order | |
| 104-Palladium nitrate | Trace Sciences International | Special Order | |
| 106-Palladium nitrate | Trace Sciences International | Special Order | |
| 108-Palladium nitrate | Trace Sciences International | Special Order | |
| 115In | Trace Sciences International | Special Order | |
| 141Pr | Fluidigm | 201141A | |
| 142Nd | Fluidigm | 201142A | |
| 143Nd | Fluidigm | 201143A | |
| 144Nd | Fluidigm | 201144A | |
| 145Nd | Fluidigm | 201145A | |
| 146Nd | Fluidigm | 201146A | |
| 147Sm | Fluidigm | 201147A | |
| 148Nd | Fluidigm | 201148A | |
| 149Sm | Fluidigm | 201149A | |
| 150Nd | Fluidigm | 201150A | |
| 151Eu | Fluidigm | 201151A | |
| 152Sm | Fluidigm | 201152A | |
| 153Eu | Fluidigm | 201153A | |
| 154Sm | Fluidigm | 201154A | |
| 155Gd | Fluidigm | 201155A | |
| 156Gd | Fluidigm | 201156A | |
| 157Gd | Trace Sciences International | N/A | |
| 158Gd | Fluidigm | 201158A | |
| 159Tb | Fluidigm | 201159A | |
| 160Gd | Fluidigm | 201160A | |
| 161Dy | Fluidigm | 201161A | |
| 162Dy | Fluidigm | 201162A | |
| 163Dy | Fluidigm | 201163A | |
| 164Dy | Fluidigm | 201164A | |
| 165Ho | Fluidigm | 201165A | |
| 166Er | Fluidigm | 201166A | |
| 167Er | Fluidigm | 201167A | |
| 168Er | Fluidigm | 201168A | |
| 169Tm | Fluidigm | 201169A | |
| 170Er | Fluidigm | 201170A | |
| 171Yb | Fluidigm | 201171A | |
| 172Yb | Fluidigm | 201172A | |
| 173Yb | Fluidigm | 201173A | |
| 174Yb | Fluidigm | 201174A | |
| 175Lu | Fluidigm | 201175A | |
| 176Yb | Fluidigm | 201176A | |
| 209Bi anti-CD16 | Fluidigm | 3209002B | Clone 3G8. Used at a 1:50 dilution. |
| 697 cells | Creative Bioarray | CSC-C0217 | |
| Amicon Ultra Centrifugal Filter Units 0.5 with Ultracel-30 Membrane, 30 kDa | Millipore | UFC503096 | |
| Anhydrous acetonitrile | Fisher Scientific | BP1165-50 | |
| anti-2B4 | Biolegend | 329502 | Clone C1.7. |
| anti-B7-H6 | R&D Systems | MAB7144 | Clone 875001. |
| anti-CCR2 | Biolegend | 357202 | Clone K036C2. |
| anti-CD2 | Biolegend | 300202 | Clone RPA-2.10. |
| anti-CD3 | Biolegend | 300402 | Clone UCHT1. |
| anti-CD4 | Biolegend | 317402 | Clone OKT4. |
| anti-CD4 | Biolegend | 344602 | Clone SK3. |
| anti-CD7 | Biolegend | 343102 | Clone CD7-6B7. |
| anti-CD8 | Biolegend | 344702 | Clone SK1. |
| anti-CD11b | Biolegend | 301302 | Clone ICRF44. |
| anti-CD14 | Biolegend | 301802 | Clone M5E2. |
| anti-CD19 | Biolegend | 302202 | Clone HIB19. |
| anti-CD33 | Biolegend | 303402 | Clone WM53. |
| anti-CD38 | Biolegend | 303502 | Clone HIT2. |
| anti-CD48 | Biolegend | 336702 | Clone BJ40. |
| anti-CD56 | BD Pharmingen | 559043 | Clone NCAM16.2. |
| anti-CD57 | Biolegend | 322302 | Clone HCD57. |
| anti-CD62L | Biolegend | 304802 | Clone DREG-56. |
| anti-CD69 | Biolegend | 310902 | Clone FN50. |
| anti-CD94 | Biolegend | 305502 | Clone DX22. |
| anti-CD95 | Biolegend | 305602 | Clone DX2. |
| anti-CD155 | Biolegend | 337602 | Clone SKII.4. |
| anti-CXCR6 | Biolegend | 356002 | Clone K041E5. |
| anti-DNAM-1 | BD Biosciences | 559787 | Clone DX11. |
| anti-DR4 | Biolegend | 307202 | Clone DJR1. |
| anti-DR5 | Biolegend | 307302 | Clone DJR2-2. |
| anti-FAS-L | Biolegend | 306402 | Clone NOK-1. |
| anti-FcRg | Millipore | 06-727 | Polyclonal antibody. |
| anti-HLA-C,E | Millipore | MABF233 | Clone DT9. |
| anti-HLA-Bw4 | Miltenyi Biotec | Special Order | Clone REA274. |
| anti-HLA-Bw6 | Miltenyi Biotec | 130-124-530 | Clone REA143. |
| anti-HLA-DR | Biolegend | 307602 | Clone L243. |
| anti-HLA-E | Biolegend | 342602 | Clone 3D12. |
| anti-ICAM-1 | Biolegend | 353102 | Clone HA58. |
| anti-Ki-67 | Biolegend | 350502 | Clone Ki-67. |
| anti-KIR2DL1/KIR2DS5 | R&D Systems | MAB1844 | Clone 143211. |
| anti-KIR2DL3 | R&D Systems | MAB2014 | Clone 180701. |
| anti-KIR2DL5 | Miltenyi Biotec | 130-096-200 | Clone UP-R1. |
| anti-KIR2DS4 | R&D Systems | MAB1847 | Clone 179315. |
| anti-KIR3DL1 | BD Biosciences | 555964 | Clone DX-9. |
| anti-LFA-3 | Biolegend | 330902 | Clone TS2/9. |
| anti-LILRB1 | R&D Systems | 292319 | Clone MAB20172. |
| anti-LLT-1 | R&D Systems | AF3480 | Clone 402659. |
| anti-MICA | R&D Systems | MAB1300-100 | Clone 159227. |
| anti-MICB | R&D Systems | MAB1599-100 | Clone 236511. |
| anti-Nectin-1 | Biolegend | 340402 | Clone R1.302. |
| anti-Nectin-2 | Biolegend | 337402 | Clone TX31. |
| anti-NKG2A | R&D Systems | MAB1059 | Clone 131411. |
| anti-NKG2C | R&D Systems | MAB1381 | Clone 134522. |
| anti-NKG2D | Biolegend | 320802 | Clone 1D11. |
| anti-NKp30 | Biolegend | 325202 | Clone P30-15. |
| anti-NKp44 | Biolegend | 325102 | Clone P44-8. |
| anti-NKp46 | Biolegend | 331902 | Clone 9E2. |
| anti-NTB-A | Biolegend | 317202 | Clone NT-7. |
| anti-Pan HLA class I | Biolegend | 311402 | Clone W6/32. |
| anti-PD1 | Biolegend | 329902 | Clone EH12.2H7. |
| anti-Perforin | Abcam | ab47225 | Clone B-D48. |
| anti-Siglec-7 | Biolegend | 347702 | Clone S7.7. |
| anti-Syk | Biolegend | 644302 | Clone 4D10.2. |
| anti-TACTILE | Biolegend | 338402 | Clone NK92.39. |
| anti-TIGIT | R&D Systems | MAB7898 | Clone 741182. |
| anti-ULBP-1 | R&D Systems | MAB1380-100 | Clone 170818. |
| anti-ULBP-2, 5, 6 | R&D Systems | MAB1298-100 | Clone 165903. |
| Antibody Stabilizer | Candor Bioscience | 131 050 | |
| Benzonase Nuclease | Millipore | 70664 | |
| Bond-Breaker TCEP Solution | Thermo Fisher Scientific | 77720 | |
| Bovine Serum Albumin solution | Sigma-Aldrich | A9576 | |
| Calcium chloride dihydrate (CaCl2+2H2O) | Sigma-Aldrich | 223506-25G | |
| Cis-Platinum(II)diamine dichloride (cisplatin) | Enzo Life Sciences | ALX-400-040-M250 | A 100 mM stock solution was prepared in DMSO and divided into 25 µL aliquots. Used at a 25 µM dilution for live/dead stain. Signal appears in 194Pt and 195Pt channels. |
| DMSO | Sigma-Aldrich | D2650 | |
| eBioscience Permeabilization Buffer | Thermo Fisher Scientific | 00-8333-56 | |
| EDTA (0.5 M) | Hoefer | GR123-100 | A double-concentrated HEPES buffer with EDTA was made according to the following recipe: 1.3 g NaCl (Thermo Fisher Scientific), 27 mg CaCl2+2H2O (Sigma-Aldrich), 23 mg MgCl2 (Sigma-Aldrich), 83.6 mg KH2PO4 (Thermo Fisher Scientific), 4 mL of 1M HEPES (Thermo Fisher Scientific), 2 mL of 0.5M EDTA (Hoefer, Holliston, MA, USA), and 100mL H2O. The pH of this double-concentrated HEPES buffer was adjusted to a pH of 7.3 using 1M HCl and 1M NaOH. |
| EQ Four Element Calibration Beads | Fluidigm | 201078 | |
| Fetal Bovine Serum | Thermo Fisher Scientific | N/A | |
| Helios mass cytometer | Fluidigm | N/A | |
| HEPES (1M) | Thermo Fisher Scientific | 15630080 | |
| HyClone Antibiotic/Antimycotic Solution (Pen/Strep/Fungiezone) solution | Fisher Scientific | SV3007901 | |
| Iridium - 191Ir/193Ir intercalator | DVS Sciences (Fluidigm) | 201192B | Used at a 1:10000 dilution. |
| Isothiocyanobenzyl-EDTA (ITCB-EDTA) | Dojindo Molecular Technologies, Inc. | M030-10 | Diluted to 1.25 mg/mL in anhydrous acetonitrile. |
| K562 cells | American Type Culture Collection (ATCC) | ATCC CCL-243 | |
| L-Glutamine (200 mM) | Thermo Fisher Scientific | SH30034 | |
| Magnesium chloride (MgCl2) | Sigma-Aldrich | 208337-100G | |
| Maxpar X8 Antibody Labeling Kits | Fluidigm | N/A | No catalog number as kits come with metals. |
| Millex-VV Syringe Filter Unit, 0.1 µm | Millipore | SLVV033RS | |
| Milli-Q Advantage A10 Water Purification System | Millipore | Z00Q0V0WW | |
| MS Columns | Miltenyi Biotec | ||
| NALM6 cells | American Type Culture Collection (ATCC) | ATCC CRL-3273 | |
| Nanosep Centrifugal Devices with Omega Membrane 3K | Pall Corporation | OD003C35 | |
| NK Cell Isolation Kit, human | Miltenyi Biotec | 130-092-657 | |
| Paraformaldehyde (16%) | Electron Microscopy Sciences | 15710 | |
| PBS | Thermo Fisher Scientific | 10010023 | |
| Potassium Phosphate Monobasic (KH2PO4) | Fisher Scientific | MP021954531 | |
| Qdot 655 anti-CD19 | Thermo Fisher Scientific | Q10179 | Clone SJ25-C1. Used at a 1:50 dilution. Signal appears in 112Cd-114Cd channels. |
| Qdot 655 anti-HLA-DR | Thermo Fisher Scientific | Q22158 | Clone Tü36. Used at a 1:200 dilution. |
| Rockland PBS | Rockland Immunochemicals, Inc. | MB-008 | Used to make CyPBS (10X Rockland PBS diluted to 1X in Milli-Q water) and CyFACS buffers (10X Rockland PBS diluted to 1X in Milli-Q water with 0.1% BSA and 0.05% sodium azide). Buffers were sterile-filtered through a 0.22 µM filter and sotred at 4°C in Stericup bottles. |
| RPMI 1640 | Thermo Fisher Scientific | 21870092 | |
| Sodium azide (NaN3) | Sigma-Aldrich | S2002 | |
| Sodium chloride (NaCl) | Fisher Scientific | S271-500 | |
| Stericup Quick Release-GP Sterile Vacuum Filtration System | Millipore Sigma | S2GPU10RE | |
| Tuning solution | Fluidigm | 201072 | |
| Washing solution | Fluidigm | 201070 |
Referanslar
- Shimasaki, N., Jain, A., Campana, D. NK cells for cancer immunotherapy. Nature Reviews. Drug Discovery. 19 (3), 200-218 (2020).
- Vivier, E., Tomasello, E., Baratin, M., Walzer, T., Ugolini, S. Functions of natural killer cells. Nature Immunology. 9 (5), 503-510 (2008).
- Eller, M. A., Currier, J. R. OMIP-007: phenotypic analysis of human natural killer cells. Cytometry. Part A: The Journal of the International Society for Analytical Cytology. 81 (6), 447-449 (2012).
- Mahnke, Y. D., Beddall, M. H., Roederer, M. OMIP-029: Human NK-cell phenotypization. Cytometry. Part A: The Journal of the International Society for Analytical Cytology. 87 (11), 986-988 (2015).
- Hammer, Q., Romagnani, C. OMIP-039: Detection and analysis of human adaptive NKG2C + natural killer cells : Detection of Human Adaptive NKG2C + NK Cells. Cytometry. 91 (10), 997-1000 (2017).
- Liechti, T., Roederer, M. OMIP-058: 30-Parameter flow cytometry panel to characterize iNKT, NK, unconventional and conventional T cells. Cytometry. 95 (9), 946-951 (2019).
- Béziat, V., et al. NK cell responses to cytomegalovirus infection lead to stable imprints in the human KIR repertoire and involve activating KIRs. Blood. 121 (14), 2678-2688 (2013).
- Pfefferle, A., et al. Intra-lineage plasticity and functional reprogramming maintain natural killer cell repertoire diversity. Cell Reports. 29 (8), 2284-2294 (2019).
- Barcenilla, H., Åkerman, L., Pihl, M., Ludvigsson, J., Casas, R. Mass cytometry identifies distinct subsets of regulatory T cells and Natural killer cells associated with high risk for Type 1 diabetes. Frontiers in Immunology. 10, 982(2019).
- Kurioka, A., et al. CD161 defines a functionally distinct subset of pro-inflammatory Natural killer cells. Frontiers in Immunology. 9, 486(2018).
- Romee, R., et al. Cytokine-induced memory-like natural killer cells exhibit enhanced responses against myeloid leukemia. Science Translational Medicine. 8 (357), (2016).
- Shinko, D., et al. Mass cytometry reveals a sustained reduction in CD16+ Natural killer cells following chemotherapy in colorectal cancer patients. Frontiers in Immunology. 10, 2584(2019).
- Pohlmeyer, C. W., et al. Identification of NK cell subpopulations that differentiate HIV-infected subject cohorts with diverse levels of virus control. Journal of Virology. 93 (7), 01790(2019).
- Palgen, J. -L., et al. NK cell immune responses differ after prime and boost vaccination. Journal of Leukocyte Biology. 105 (5), 1055-1073 (2019).
- Mei, H. E., Leipold, M. D., Schulz, A. R. Barcoding of live human peripheral blood mononuclear cells for multiplexed mass cytometry. The Journal of Immunology. 194 (4), 2022-2031 (2015).
- Takahashi, C., et al. Mass cytometry panel optimization through the designed distribution of signal interference. Cytometry. Part A: The Journal of the International Society for Analytical Cytology. 91 (1), 39-47 (2017).
- Baumgart, S., Peddinghaus, A., Schulte-Wrede, U., Mei, H. E., Grützkau, A. OMIP-034: Comprehensive immune phenotyping of human peripheral leukocytes by mass cytometry for monitoring immunomodulatory therapies. Cytometry. Part A: The Journal of the International Society for Analytical Cytology. 91 (1), 34-38 (2017).
- Leipold, M. D. Another step on the path to mass cytometry standardization. Cytometry. Part A: The Journal of the International Society for Analytical Cytology. 87 (5), 380-382 (2015).
- Bendall, S. C., et al. Single-cell mass cytometry of differential immune and drug responses across a human hematopoietic continuum. Science. 332 (6030), 687-696 (2011).
- Leipold, M. D., Newell, E. W., Maecker, H. T. Multiparameter phenotyping of human PBMCs using mass cytometry. Methods in Molecular Biology. 1343, 81-95 (2015).
- Fienberg, H. G., Simonds, E. F., Fantl, W. J., Nolan, G. P., Bodenmiller, B. A platinum-based covalent viability reagent for single-cell mass cytometry. Cytometry. Part A: The Journal of the International Society for Analytical Cytology. 81 (6), 467-475 (2012).
- Zivanovic, N., Jacobs, A., Bodenmiller, B. A practical guide to multiplexed mass cytometry. Current Topics in Microbiology and Immunology. 377, 95-109 (2014).
- Béziat, V., Hilton, H. G., Norman, P. J., Traherne, J. A. Deciphering the killer-cell immunoglobulin-like receptor system at super-resolution for natural killer and T-cell biology. Immunology. 150 (3), 248-264 (2017).
- Wilk, A. J., et al. Charge-altering releasable transporters enable specific phenotypic manipulation of resting primary natural killer cells. BioRxiv. , 970491(2020).
- Vendrame, E., et al. TIGIT is upregulated by HIV-1 infection and marks a highly functional adaptive and mature subset of natural killer cells. AIDS. 34 (6), 801-813 (2020).
- Zhao, N. Q., et al. Natural killer cell phenotype is altered in HIV-exposed seronegative women. PloS One. 15 (9), 0238347(2020).
- McKechnie, J. L., et al. HLA upregulation during dengue virus infection suppresses the natural killer cell response. Frontiers in Cellular and Infection Microbiology. 9, 268(2019).
- McKechnie, J. L., et al. Mass cytometry analysis of the NK cell receptor-ligand repertoire reveals unique differences between dengue-infected children and adults. ImmunoHorizons. 4 (10), 634-647 (2020).
- Ranganath, T., et al. Characterization of the impact of daclizumab beta on circulating natural killer cells by mass cytometry. Frontiers in immunology. 11, 714(2020).
- Fernandez, I. Z., et al. A novel human IL2RB mutation results in T and NK cell--driven immune dysregulation. The Journal of Experimental Medicine. 216 (6), 1255-1267 (2019).
- Herndler-Brandstetter, D., et al. Humanized mouse model supports development, function, and tissue residency of human natural killer cells. Proceedings of the National Academy of Sciences. 114 (45), 9626-9634 (2017).
- Nikzad, R., et al. Human natural killer cells mediate adaptive immunity to viral antigens. Science Immunology. 4 (35), (2019).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır