Method Article
ヒトナチュラルキラー細胞受容体-リガンドレパートリーのプロファイリング
* これらの著者は同等に貢献しました
要約
ここでは、2つの相補的マスサイトメトリー(CyTOF)パネルを設計し、ウイルス感染の設定におけるナチュラルキラー細胞受容体とリガンドレパートリーのプロファイリングを目的として、CyTOF染色プロトコルを最適化します。
要約
ナチュラルキラー(NK)細胞は、ウイルス感染に対する最初の応答者の1つです。NK細胞がウイルス感染細胞を迅速に認識して殺す能力は、生殖細胞系にコードされた阻害性および活性化受容体の発現によって制御されています。これらの受容体が標的細胞に同族のリガンドを結合させることで、細胞間相互作用がNK細胞の死滅につながるかどうかが決まります。このプロトコールでは、2つの相補型マスサイトメトリー(CyTOF)パネルの設計と最適化について詳しく説明します。1つのパネルは、受容体発現に基づいてNK細胞を表現型決定するために設計されました。もう1つのパネルは、いくつかの免疫細胞サブセット上のNK細胞受容体の既知のリガンドの発現を調べるために設計されました。これら2つのパネルを組み合わせることで、ヒトNK細胞受容体リガンドのレパートリーのプロファイリングが可能になります。さらに、このプロトコルでは、CyTOFのサンプルを染色するプロセスについても詳しく説明しています。このプロセスは、再現性と標準化を向上させるために最適化されています。CyTOFの利点は、各パネルの40を超えるマーカーを最小限のシグナルオーバーラップで測定できるため、研究者はNK細胞受容体リガンドのレパートリーの幅を捉えることができることです。また、パラジウムバーコード化により、サンプル間のばらつきや試薬の消費量が減少するため、各パネルを並行してサンプルを染色しやすくなります。このプロトコルの限界には、CyTOFのスループットが比較的低いことや、解析後に細胞を回収できないことなどがあります。これらのパネルは、デング熱ウイルス、ヒト免疫不全ウイルス(HIV)、インフルエンザなどの急性および慢性ウイルス感染症に罹患した患者の臨床サンプルの分析用に設計されました。しかし、ヒトNK細胞受容体リガンドのレパートリーを調べるために、どのような状況でも利用することができます。重要なことは、これらの手法は、将来のCyTOFパネルの設計と実行に広く適用できることです。
概要
ナチュラルキラー(NK)細胞は、悪性細胞、感染細胞、またはその他のストレスを受けた細胞を標的にして殺す主な役割を持つ自然免疫細胞です。NK細胞は、IFNγやTNFαなどのサイトカインの分泌や細胞傷害活性を通じて、病原体や悪性腫瘍に対する適応免疫応答を形成することもできます。NK応答は、生殖細胞系にコードされる抑制性受容体と活性化受容体の組み合わせシグナル伝達によって部分的に媒介され、潜在的な標的細胞に発現する無数のリガンドに結合します。いくつかのNK細胞受容体は複数のリガンドを持ち、新しい受容体-リガンドペアが定期的に同定されています。
NK細胞をウイルス感染の状況で研究することには特に関心があり、ストレスを受けた細胞に迅速に応答するNK細胞の能力がウイルスの拡散を制限したり、NK細胞回避戦略の開発を促進したりする可能性があります。NK細胞生物学へのこの関心は、研究者が腫瘍免疫監視および腫瘍微小環境におけるNK細胞の役割を調査しているがん免疫療法の分野にまで及びます1。しかし、ヒトNK細胞は30以上の受容体を発現し、さらに30以上の既知のリガンドと相互作用することができるという事実により、NK細胞と標的細胞の相互作用をプロファイリングする能力は複雑になります2。したがって、複数のNK細胞受容体とその同族リガンドを同時に検出することは、NK機能を制御する受容体-リガンド相互作用の複雑さを捉えるために必要です。そこで、シングルセルレベルで40種類以上のマーカーを同時に検出できるマスサイトメトリー(CyTOF)に切り替えました。私たちの目標は、NK細胞受容体リガンドのレパトアをプロファイリングするための2つのCyTOFパネルを作成することでした。また、臨床サンプルの効果的な処理と染色のためのプロトコルを設計したいと考えていました。臨床ヒトサンプルは、ウイルス感染に対する体内の反応に関する豊富な情報を提供します。したがって、このプロトコルは、NK細胞受容体とその同族リガンドの発現を並行して調査し、標準化の向上、回収率の向上、試薬消費量の削減、およびバッチ効果の制限を目的として開発されました。
ヒトNK細胞の表現型を特徴付けるために設計されたいくつかのフローサイトメトリーパネルが以前に発表されています3,4,5,6,7,8。これらのパネルのほとんどは、受容体リガンドのレパートリーの幅を捉える能力に限界があり、限られたマーカーの選択しか検出できません。さらに、これらのパネルは、蛍光色素間の信号の重なりによって制限されます。CyTOFは、金属同位体に結合した抗体を使用し、飛行時間型質量分析法によって読み出されるため、チャネル間のスピルオーバーが大幅に減少します。
私たちと同様に、他の研究者もCyTOFを使用してNK細胞9,10,11,12,13,14を研究していますが、一般的にNK細胞マーカーが少ないため、表現型の深さが減少します。これらのグループが使用する一般的な染色プロトコルは当社のものと似ていますが、いくつかの重要な違いがあります。他のプロトコルでは、研究者がそのサブセット13,14にのみ関心を持っているにもかかわらず、染色前にNK細胞を単離することは含まれていません。NK細胞が末梢血単核細胞(PBMC)の5〜20%しか占めていないことを考えると、単離されたNK細胞ではなくPBMC全体を染色すると、収集されたイベントのほとんどがNK細胞ではなくなります。これにより、対象のサブセットで生成されるデータの量が減り、マシン時間の使用が非効率的になります。さらに、これらのパネルの多くは、キラーIg様受容体(KIR)、NKG2A/C/D、および天然の細胞毒性受容体(NKp30、NKp44、およびNKp46)などのNK細胞受容体の発現を調査していますが、これらのマーカーの発現は、それぞれのリガンドの発現に関するデータがないため、より広範な文脈に当てはめられていません。したがって、CyTOFを介してNK細胞を調査するこれらの以前に発表された方法は、単独で使用される広範なNK細胞表現型には十分ですが、NK細胞活性の包括的な画像を提供することはできません。このことから、ここで説明した方法の大きな利点は、これまでNK細胞受容体のリガンドの発現を探ることに焦点を当てたフローサイトメトリーやCyTOFパネルが発表されていないことです。重要なことは、当社のリガンドパネルには、各実験の固有のニーズに合わせてマーカーを追加できるように、いくつかのオープンチャネルがあることです。
CyTOFの主な制限の1つは、分析後にサンプルを回収できないことであることを考えると、この方法は、追加の実験を行うことに関心のあるサンプルが限られている研究者には適していない可能性があります。さらに、CyTOFの低スループットの性質は、セルの開始数が少ない場合、生成されるデータの品質が低くなることを意味します。これら2つの制限を除けば、この方法は、NK細胞と標的細胞との間の受容体-リガンド相互作用を研究するためのあらゆる設定で優れた性能を発揮します。
プロトコル
匿名化された健康な成人PBMCは、スタンフォード血液センターから購入した白血球減少システムチャンバーから入手しました。匿名化された健康な小児ドナーおよび小児急性デング熱患者からのPBMCは、パナマシティのGorgas Memorial Institute of Health Studiesおよび保健省に属する病院、パナマシティの社会保障制度、および郊外から入手しました。デング熱研究プロトコルは、Hospital del NiñoのIRB(CBIHN-M-0634)によって承認され、その後、ICGES、CSS、Santo Tomas Hospital、およびStanford Universityの委員会によって承認されました。抗レトロウイルス治療を受けているHIV感染患者からのPBMCは、ACTG研究A5321から得られました。
1. 抗体の標識、パネル調製、保管
- 金属同位体による抗体標識
注:染色の実験間の標準化を促進するために、以下に説明するように、各抗体に対して複数の標識を行い、その後、製品を単一のマスターミックスに結合して長期保存することをお勧めします。- 標識前に280 nmで吸光度を測定することにより、各抗体の濃度を測定します。このプロトコールに使用された抗体は市販されており、 材料表に記載されているベンダーから購入しました。
- 市販の抗体標識キットを使用して、製造元の指示に従って金属同位体で抗体を標識します。各反応に100 μgの抗体を使用してください。
- 回収した抗体の最終濃度は、280 nmの吸光度を測定して測定します。抗体は4°Cで短期保存してください。
- 抗体滴定
注:CyTOFテクノロジーは、環境金属からの潜在的な汚染信号に非常に敏感です。したがって、使用するすべてのバッファー/試薬は、超純水で調製し、石鹸で洗浄したことのないプラスチックまたはガラス容器に保管する必要があります。- 解凍する PBMC のバイアルあたり 9 mL の温かい完全な RPMI (RPMI 1640、10% FBS、1% L-グルタミン、1% ペニシリン/ストレプトマイシン) と 20 μL のベンゾナーゼを含む各ドナーの遠心分離チューブを準備します。PBMCを水浴で解凍し、チューブに加えます。
注:ベンゾナーゼは、溶解した細胞からの遊離DNAから粘度とバックグラウンドを減少させます。 - 300 x g 、室温で5分間遠心分離します。PBMCを5 mLの完全RPMI培地に再懸濁し、カウントします。
- 各パネル滴定について、丸底96ウェルプレート(各力価に1ウェル、未染色に1ウェル)の6ウェルに2〜400万PBMC/ウェルをプレート化します。プレートを600 x g で室温で3分間遠心分離します。プレートをフリックして上澄み物を取り除きます。各ウェルを200 μLのCyPBSに再懸濁します。
- 以下に説明するようにシスプラチン生存率染色を行います。
注:シスプラチンは、マスサイトメトリーで生細胞と死細胞を区別するために使用されます。- 細胞を100 μLの25 μMシスプラチンストックに再懸濁します。室温で1分間インキュベートします。
- シスプラチン反応をクエンチするには、各ウェルに100 μLのFBSを添加して混合します。プレートを遠心分離してフリックします。
注:その後のすべての遠心分離ステップを4°Cで実行します。 - 200 μL の CyFACS (重金属汚染物質を含まない 1x PBS、0.1% BSA、0.05% アジ化ナトリウム含有超純水溶液) で細胞を 2 回洗浄します。毎回プレートを遠心分離してフリックします。
- 表面抗体パネルを下記のように滴定します。
注:NK表面パネルとリガンドパネルには、別々のマスターミックスを作成する必要があります。- CyFACSを使用して、すべての表面抗体を10 μg/mLの濃度でマスターミックスします。最終容量は150 μLを目標に、CyFACSを使用して1:2の連続希釈を行い、10、5、2.5、1.25、0.625 μg/mLの濃度を得ます。
- 抗体カクテルを遠心フィルターユニット(孔径0.1 μm)で10,600 x g で3分間染色する前にろ過します。
- めっきした細胞を50 μLの表面抗体カクテルにそれぞれの力価で再懸濁します。未染色の井戸をCyFACSに再懸濁します。4°Cで30分間インキュベートします。
- 細胞を150 μLのCyFACSで洗浄します。プレートを遠心分離してフリックします。
- 細胞を200 μLのCyFACSで洗浄します。プレートを遠心分離してフリックします。
- CyPBS中の2%パラホルムアルデヒド(PFA)の100μLに各ウェルを再懸濁することにより、細胞の固定を行います。プレートを室温で暗所で20分間インキュベートします。細胞を100 μLのCyFACSで洗浄します。700 x g で5分間遠心分離します。
注意:PFAは、がんだけでなく遺伝的欠陥を引き起こすと疑われています。また、目や皮膚に触れたり、吸い込んだりすると有害です。換気を良くし、容器を慎重に開き、エアロゾルの形成を防ぐことにより、適切に取り扱ってください。
注:その後のすべての遠心分離機のスピンは、700 x g で4°Cで5分間実行されます。 - 超純水で希釈した1x Permeabilization Buffer(Perm buffer)200 μLに再懸濁することにより、細胞を透過処理します。プレートを遠心分離してフリックします。細胞を200 μLのPermバッファーで洗浄します。プレートを遠心分離してフリックします。
注:Permバッファーでのインキュベーションは必要ありません。 - 細胞内抗体パネル滴定
- Perm Bufferを使用して、10 μg/mLの濃度ですべての細胞内抗体のマスターミックスを作成します。最終容量は150 μLを目標に、Perm Bufferを使用して1:2の希釈液を連続して行い、10、5、2.5、1.25、0.625 μg/mLの濃度を得ます。
- 抗体カクテルを遠心フィルターユニット(孔径0.1 μm)で10,600 x g で3分間染色する前にろ過します。
- 播種した細胞を50 μLの細胞内抗体カクテルにそれぞれの力価で再懸濁します。未染色のウェルをPerm Bufferに再懸濁します。4°Cで45分間インキュベートします。
注:細胞内パネルを滴定しない場合は、50 μLのPermバッファーにウェルを再懸濁します。 - 細胞を150 μLのPermバッファーで洗浄します。プレートを遠心分離してフリックします。
- 細胞を200 μLのPermバッファーで洗浄します。プレートを遠心分離してフリックします。
- 細胞を200 μLのCyFACSで2回洗浄します。プレートを遠心分離してフリックします。
- DNAインターカレーター染色
注:インターカレーターは細胞核酸に結合し、マスサイトメトリーで有核細胞を同定するために使用されます。- CyPBSおよび2% PFAで1:10,000に希釈した200 μLのインターカレーターに細胞を再懸濁します。プレートを4°Cで一晩インキュベートします。
- 必要に応じて、プレートをパラフィンフィルムで覆った4°Cで最大1週間保存してください。
注:その後のすべての遠心分離ステップを700 x g で4°Cで5分間実行します。 - CyTOFでサンプルを泳動する前に、パラフィンフィルムをプレートから取り出し、700 x g で4°Cで5分間遠心分離します。 プレートをフリックします。細胞を200 μLのCyFACSで1回洗浄します。プレートを遠心分離してフリックします。
- 細胞を200μLの超純水で3回洗浄します。プレートを遠心分離してフリックします。細胞を200 μLの超純水に再懸濁します。サンプルを泳動する直前に、超純水で1倍の濃度に希釈したノーマライゼーションビーズの濃度を約6 x 105 細胞/mLに調整します。
- CyTOFでサンプルを実行します。
- データを解析し、最も低い抗体価を選択することで、各抗体に適切な力価を選択します。これにより、シグナル強度が最も高く、視覚的評価に基づいて陽性集団と陰性集団が最適に分離されます。
注:NKパネルとリガンドパネルの滴定をそれぞれ 図1 と 図2 に示します。陽性集団と陰性集団の明確な区別が特定されない場合は、複数の細胞タイプまたは細胞株で力価を評価して、陽性細胞集団と陰性細胞集団の両方を同定することができます。 - 抗体パネル保管
- 滴定した抗体をマスターミックスに組み合わせ、滅菌済みの0.1 μmシリンジフィルターユニットでろ過します。NK表面パネル、NK細胞内パネル、およびリガンドパネルに対して別々のマスターミックスを作成する必要があります。
- パネルの長期保管には、次の2つの許容可能なオプションのいずれかに従ってください。
- マスターミックスを第三者企業に送って凍結乾燥してもらいます。この方法は、NKパネルに使用されます。社内で標識されていない抗体は、抗体安定剤が存在するため、凍結乾燥プロセスを妨げるため、凍結乾燥できません。これらの抗体は、染色日にパネルに添加されます。
- リピーターピペットを使用して、各マスターミックスの50 μLアリコートを作成し、-80°Cで保存します。
- 解凍する PBMC のバイアルあたり 9 mL の温かい完全な RPMI (RPMI 1640、10% FBS、1% L-グルタミン、1% ペニシリン/ストレプトマイシン) と 20 μL のベンゾナーゼを含む各ドナーの遠心分離チューブを準備します。PBMCを水浴で解凍し、チューブに加えます。
2. 染色プロトコール
- ステップ1.2.1および1.2.2で説明されているように、末梢血単核細胞(PBMC)を解凍します。15 mLの遠心分離チューブでリガンドパネル染色用に少なくとも100万個のPBMCを確保します。これらのPBMCは、NK細胞の単離中は氷上に置いてください。
- NK細胞の単離
注:以下のNK細胞単離手順は、特定のベンダーのプロトコルの修正版です。しかし、NK細胞の磁気ベースのネガティブセレクションを行う任意のキットまたはプロトコルが適切な代替手段となるでしょう。さらに、このプロトコルはPBMC全体からのNK細胞の表現型解析にも適しているため、このステップはオプションです。- 残りのPBMCを450 x g で5分間回転させます。細胞ペレットを、全細胞107 個あたり40 μLのMACSバッファー(PBS、0.5% BSA、2 mM EDTA)に再懸濁します。
- NK細胞ビオチン抗体カクテル10 μLを全細胞7 個あたり10 μL加えます。よく混ぜて、氷上で5分間インキュベートします。
- 合計107 細胞あたり30 μLのMACSバッファーを、合計7 細胞あたり20 μLのNK細胞MicroBead Cocktailを添加します。よく混ぜ合わせ、氷上で10分間インキュベートします。
- 溶出カラムは、500 μL の MACS バッファーですすいで調製します。2 mLのコールドコンプリートRPMIを15 mLコレクションチューブに加えます。
- 細胞を含むチューブにMACSバッファーを添加して、容量を最大500 μLにし、調製した溶出カラムに500 μLの全容量をピペットで移します。さらに500 μLのMACSバッファーでチューブを洗い流し、カラムに移します。
- 流れが止まったら、溶出カラムを500 μL MACSバッファーで2回すすぎます。フローが停止したら、NK細胞をカウントします。
- 細胞をプレート化して洗浄します。
- 単離されたNK細胞およびPBMCを300 x g 、室温で10分間遠心分離します。CyPBS(超純水中に重金属汚染物質を含まない1x PBS)に500万細胞/mLの濃度で細胞を再懸濁します。U底の96ウェルプレートにセルをプレート化。
注:NK細胞パネルの各アリコートは、最大300万個の細胞を染色できます。染色前に6つのNK細胞サンプルをバーコード化し、プールする場合、NK細胞の総数は300万を超えないようにする必要があります。リガンドパネルは、サンプルあたり最大600万個のPBMCを染色できます。染色前に6つのサンプルをバーコード化してプールする場合、PBMCの総数は600万を超えないようにする必要があります。 - プレートを600 x g 、室温で3分間遠心分離します。プレートをフリックして上澄み液を取り除きます。
注:ステップ2.7まで、その後のすべての遠心分離スピンを600 x g で3分間実行します。 - 細胞を200 μLのCyPBSに再懸濁します。プレートを遠心分離してフリックします。
- 単離されたNK細胞およびPBMCを300 x g 、室温で10分間遠心分離します。CyPBS(超純水中に重金属汚染物質を含まない1x PBS)に500万細胞/mLの濃度で細胞を再懸濁します。U底の96ウェルプレートにセルをプレート化。
- ステップ1.2.4で説明したようにシスプラチン生存率染色を行います。
- バーコード染色
注:これらのパネルは、バッチ効果を最小限に抑え、細胞回収を最大化するために、未固定の生細胞に対して修正されたTwo-of-4、パラジウムベースのバーコード法と組み合わせて使用されます15。ただし、高品質のデータを取得するためにバーコード化は必要ないため、この手順はオプションです。- 各ウェルを50 μLのそれぞれのプレミックスバーコードに再懸濁し、4°Cで30分間インキュベートします。細胞を150 μLのCyFACSで洗浄します。プレートを遠心分離してフリックします。
- 細胞を200 μLのCyFACSで2回洗浄します。プレートを遠心分離してフリックします。すべてのウェルを30 μLのCyFACSに再懸濁します。独自のバーコードで染色した細胞の最大6ウェルを1つのウェルに結合し、遠心分離とプレートのフリックを行います。
- 表面染色
- 表面NKパネル液楼を50 μLのCyFACSに溶解し、追加の表面抗体(抗CD16、抗HLA-DR、抗LILRB1)を添加します。-80°Cで保存した配位子パネルを解凍し、ミニ遠心分離機を使用してチューブをスピンダウンします。追加のリガンドパネル表面マーカー(抗CD16、抗CD19)のスパイク。
注:以前にろ過されていない抗体カクテル(凍結乾燥または凍結前)は、染色前に遠心フィルターユニット(孔径0.1 μm)で10,600 x g で3分間ろ過する必要があります。 - 各ウェルを各パネルの50 μLに再懸濁します。4°Cで30分間インキュベートします。細胞を150 μLのCyFACSで洗浄します。プレートを遠心分離してフリックします。細胞を200μLのCyFACSで再度洗浄します。プレートを遠心分離してフリックします。
- 表面NKパネル液楼を50 μLのCyFACSに溶解し、追加の表面抗体(抗CD16、抗HLA-DR、抗LILRB1)を添加します。-80°Cで保存した配位子パネルを解凍し、ミニ遠心分離機を使用してチューブをスピンダウンします。追加のリガンドパネル表面マーカー(抗CD16、抗CD19)のスパイク。
- ステップ 1.2.6 で説明したようにセルを修正します。
注:その後のすべての遠心分離スピンを700 x g で5分間、4°Cで実行します。 - ステップ1.2.7で説明したように細胞を透過処理します。
- 細胞内染色
- 細胞内NKパネルリオスフェアを50μLのPermバッファーに溶解します。必要に応じて、PBMCサンプル用の細胞内抗体カクテルを調製します。
注:以前にろ過されていない抗体カクテル(凍結乾燥または凍結前)は、染色前に遠心フィルターユニット(孔径0.1 μm)で10,600 x g で3分間ろ過する必要があります。 - ウェルを50 μLのそれぞれの細胞内パネルに再懸濁します。細胞内パネルをリガンド表面パネルと組み合わせて使用しない場合は、PBMCウェルを50 μLのPermバッファーに再懸濁します。4°Cで45分間インキュベートします。
- 細胞を150 μLのPermバッファーで洗浄します。遠心分離機とフリックプレート。細胞を200 μLのPermバッファーで洗浄します。プレートを遠心分離してフリックします。
- 細胞を200 μLのCyFACSで2回洗浄します。プレートを遠心分離してフリックします。
- 細胞内NKパネルリオスフェアを50μLのPermバッファーに溶解します。必要に応じて、PBMCサンプル用の細胞内抗体カクテルを調製します。
- DNAインターカレーター染色。ステップ1.2.9.1で説明したようにDNAインターカレーター染色を行います。プレートを4°Cで一晩インキュベートします。
注:インターカレーターは細胞核酸に結合し、マスサイトメトリーで有核細胞を同定するために使用されます。プレートは、パラフィンフィルムで覆って4°Cで最大1週間保存できます。 - CyTOFでサンプルを実行する前に、ステップ1.2.9.3および1.2.9.4の説明に従って細胞を洗浄します。
- CyTOFでサンプルを実行します。
結果
抗体は、製造元の指示に従って、市販の標識キットを使用して金属同位体に結合しました。抗体クローンは、このパネルで使用する前に、フローサイトメトリーおよびマスサイトメトリーによって検証されました。クローンの初期リストは、文献のレビューと抗体の利用可能性に基づいて選択した。NK細胞受容体の一部のリガンドの発現レベルは、健康なPBMCでは低いか検出できません。したがって、一部の抗体の陽性染色は、健康なPBMC、慢性骨髄性白血病K562細胞、急性リンパ芽球性白血病NALM6細胞、またはB細胞急性リンパ芽球性白血病697細胞を染色することにより検証されました(補足図1)。NK細胞パネル用に選択されたクローンのうち、十分な染色を生じなかった、または高すぎるクローンは、 補足表1 に詳述され、 補足図2に示されているように、異なるクローンに置き換えられました。
これらのパネルに対する抗体との金属同位体対析は、Takahashi et al.16によって概説された原理を用いて行われました。系統マーカーは中程度から高強度であった。その結果、主に低感度および中感度の質量に標識され、より薄暗く発現するマーカーに対する抗体への標識に利用できる高感度の質量が残されました。一般に公開されているパネルデザイナーソフトウェアを使用して、存在量感度(M ± 1ブリード)または酸化(M + 16ブリード)の問題を検出し、それに応じて抗体と金属のペアを再割り当てしました。さらに、いくつかのマーカーを異なる金属に結合させ、シグナル強度に最小限の差が認められました(補足表2 および 補足図3)。NKパネルとリガンドパネルの抗体と金属のペア、およびクローン情報をそれぞれ 表1 と 表2 に示します。
社内標識抗体は、PBMC上で0.625、1.25、2.5、5、10 μg/mLの5つの異なる力価で滴定しました。最も低い抗体価により、シグナル強度が最も高く、陽性集団と陰性集団の最適な分離が得られたものを、目視評価に基づいて選択しました。NKパネルとリガンドパネルの滴定をそれぞれ図1と図2に示します。特定のマーカーでは、マーカーがぼんやりと表されているか、普遍的に陽性であるため、陽性集団と陰性集団の明確な区別は特定されませんでした。これらの抗体の最も正確な使用希釈率を決定するために、複数の細胞タイプ(PBMC、T細胞、B細胞、またはNK細胞)または細胞株で力価を評価し、陽性細胞集団と陰性細胞集団の両方を同定できるようにしました(補足図4)。各マーカーの染色指数(SI)は、この指標がCyTOFデータ17,18に適用されないため、計算されませんでした。
ここで説明するパネルは、サンプルのバーコード化に対応するように設計されています。CyTOFにはいくつかのバーコード方法があります。最も一般的に使用されるのは、バーコード化の前に固定が必要な市販のパラジウムベースのキットと、Meiら15によって記載されたCD45ベースのバーコード化法であり、これにより生細胞のバーコード化が可能になります。どのバーコード法が私たちのニーズに最も適しているかを評価するために、NK細胞パネルの初期バージョンで固定後のNK細胞マーカー染色の安定性をテストしました(補足図5)。その結果、NK細胞マーカーの大部分の発現が固定によって影響を受けることがわかりました。その結果、我々は、生細胞15に対して、修正された4つのうちの2つ、CD45ベースのバーコード法を使用することを決定した。このバーコード法は 、102Pd、 104Pd、 106Pd、および 108Pdを使用し、 104Pd、 106Pd、 108Pd、 110Pd、 113In、および 115Inを使用したMeiらによって最初に記載された3 of 6の方法とは異なります。インジウムチャネルは、 115In-CD3からのシグナルに干渉するため、バーコードスキームには含まれていませんでした。 110名Pdは、HLA-DR QdotおよびCD19 QdotからのシグナルをそれぞれNK細胞およびリガンドパネルに干渉するため、含まれていませんでした。
染色前にNK細胞を精製することをお勧めしますが、NK細胞パネルは、PBMC全体からNK細胞の表現型解析を可能にするように設計されています。当社のNK細胞ゲーティング戦略の一例を、健康なドナーのPBMCを使用した 図3A に示します。各NKマーカーの染色とゲートは、健康な単離されたNK細胞に 図3Bで示されています。リガンドパネルは、PBMC全体におけるNK細胞リガンドの発現を検出するように設計されています。 図4A は、健康なドナーからPBMC中のCD4+ T細胞、CD8+ T細胞、NK細胞、単球、およびCD19+ B細胞を同定するために使用されるゲーティング戦略を示しています。各リガンドの代表的な染色例を、急性デング熱患者およびウイルス学的に抑制されたHIV感染者のPBMCを使用した 図4B に示します。
パネルの長期にわたる安定性を確保するために、当社のプロトコルには、サードパーティ企業による凍結乾燥によるシングルユースビーズへの凍結、または既製のアリコートの-80°Cでの凍結という2つのオプションが含まれています。 このプロトコールでは、NKパネルを凍結乾燥し、リガンドパネルを凍結しました。どちらの方法も、各パネルを臨床サンプルに使用する前にバリデーションされています。
1つのマスターミックスからNKパネルの700回以上の反応を作製し、パネル内の各抗体を複数回結合させました。各標識抗体の検証と滴定後、抗体をマスターミックスに混合し、滅菌済みの0.1 μmシリンジフィルターユニットでろ過した後、凍結乾燥のために第三者企業に送られました。2セットの単一染色リオスフェアを作製し、1つは表面染色用、もう1つは細胞内染色用としました。社内で標識されていない抗体(HLA-DRおよびCD16)は、抗体安定剤の存在により凍結乾燥プロセスを妨げるため、凍結圏に添加できませんでした。これらの抗体は、染色日にパネルに添加されます。凍結乾燥前と凍結乾燥後に得られた染色の比較を 補足図6に示します。リヨスフェアで最初に使用されたLILRB1抗体のクローンは、十分に強い染色を生じませんでした(補足表1 および 補足図2)。その後、染色の日に、より優れたクローンを同定し、標識し、パネルに追加しました(表1)。lyopsheresで使用されたKIR2DS2ポリクローナル抗体は、凍結乾燥後に非特異的な染色を生成することが指摘されており、その後の分析での使用は推奨しません(補足表1 および 補足図2)。ほとんどの細胞内染色は、凍結乾燥後に強度がわずかに増加しました(補足図6)。
配位子パネルマスターミックスを-80°Cで保存する前に、2つの異なる保存条件をテストしました。このパネルの小さなマスターミックスを調製し、アリコートを-80°Cおよび液体窒素で約2か月間保存しました。2か月後、PBMC全体を凍結アリコートで染色しました。この染色を、新たに調製したパネルで染色した同じドナー由来のPBMCの染色と比較しました(補足図7)。-80°Cで保存し、液体窒素中で保存しても、ほとんどのマーカーでシグナル強度は変化しないことがわかりました。実際、抗パンHLAクラスI、抗CD7、抗CD4、抗HLA-Bw4、抗CD14、抗CD11b、および抗LFA-3の信号強度は、特に-80°Cで保存されたサンプルの場合、凍結時に高くなります。 抗LLT-1、抗ネクチン-1、抗MICA/B、抗DR4/5、抗ULBP-1,2,5,6、抗ネクチン-2、抗CD155、抗B7-H6のシグナル強度が凍結の影響を受けたかどうかは、健康なPBMCでは高濃度のマーカーを発現しないため、判断できなかった。ただし、細胞株上のこれらのマーカーの検証(補足図1)は、-80°Cで保存された標識抗体を使用して実行されました。 したがって、フリーズによって信号が著しく失われることはないと確信していました。5つのマーカー(抗CD8、抗ICAM-1、抗CCR2、抗CD33、および抗CD56)の凍結時に信号強度が減少した。しかし、これらすべての場合において、陽性集団と陰性集団の間には明確な分離が残っていました。金属標識抗体は4°Cで長期間安定していないため、パネルの安定性を長期間維持するためには凍結が必要であり、一部のマーカーでは染色強度が低下したにもかかわらず、十分な染色分離を保持することができました。重要なことに、抗CD8、抗CCR2、および抗CD56のシグナル強度の損失は、-80°Cで保存されたサンプルと比較して、液体窒素で保存されたサンプルの方が大きかった。 このデータに基づいて、パネルを-80°Cで保存することにしました。
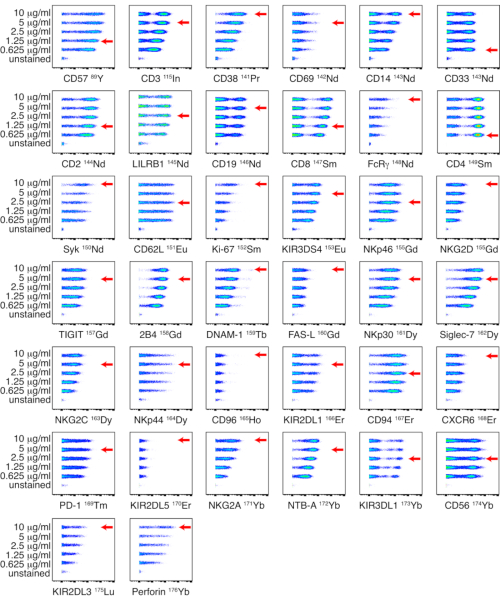
図1:NKパネル用社内標識抗体-金属標識の滴定。 健康なドナーから採取したPBMCに対して、0.625、1.25、2.5、5、10 μg/mLの5種類の濃度を用いて、社内標識抗体の滴定を行いました。抗CD3、抗CD14、抗CD33、抗CD19、抗PD-1、および抗CD56の力価は、生細胞のゲーティングによって決定されました。抗CD4および抗CD8の力価は、T細胞上でのゲーティングによって決定されました。残りの抗体の力価は、NK細胞にゲーティングすることによって決定しました。NKp44は休止NK細胞では発現しないため、IL-2で刺激したPBMCで力価を決定し、NK細胞で示しました。赤い矢印は、各抗体に選択された力価を示しています。この図の拡大版を表示するには、ここをクリックしてください。

図2:社内標識リガンドパネル抗体の滴定。健康なドナーから採取したPBMCに対して、0.625、1.25、2.5、5、10 μg/mLの5種類の濃度を用いて、社内標識抗体の滴定を行いました。抗HLA-DR、抗ICAM-1、抗CCR2、抗CD14、抗CD11b、および抗LFA-3の力価は、CD3-CD7-細胞のゲーティングによって決定されました。抗CD3、抗PAN型HLAクラスI、抗CD7、抗CD48、抗LLT-1、抗HLA-C,E、抗HLA-E、抗FasR、抗ネクチン-1、抗MICA/MICB、抗DR4/DR5、抗ULBP-1,2,5,6、抗ネクチン-2、抗CD155、抗HLA-Bw4、抗HLA-Bw6、抗CD33、抗CD56、および抗B7-H6の力価を、生細胞にゲーティングして決定した。抗CD4および抗CD8の力価は、CD3+細胞のゲーティングによって決定されました。赤い矢印は、各抗体に選択された力価を示しています。この図の拡大版を表示するには、ここをクリックしてください。
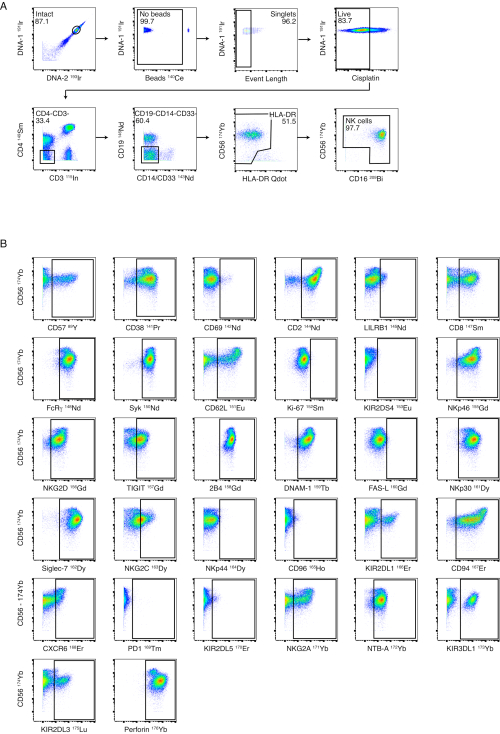
図3:NKパネルゲーティング戦略と性能 (A)健康なドナーにおいて、PBMC全体からNK細胞への連続ネガティブゲーティングが示されています。インタクトゲート、ビーズゲート、イベントレングスゲートにより、単一細胞へのゲート化が成功します。シスプラチン染色は、Live/Dead染色として行いました。T細胞およびB細胞は、CD3およびCD19を用いて除外した。単球は、CD4およびCD14/CD33に対するネガティブゲーティング、およびCD56-/HLA-DRブライト セルに対するさらなるネガティブゲーティングによって除外された。CD56とCD16を使用して、NK細胞の異なるサブセット(CD56bright、CD56dim 、CD56-)を同定しました。(B)磁気ビーズ分離によって精製された1人の健康なドナーからのNK細胞に対するNK細胞受容体の発現の例。 この図の拡大版を表示するには、ここをクリックしてください。

図4:リガンドパネルのゲーティングと性能(A)正常化、キャリブレーションビーズの除去、およびバーコード解除後の健康なドナーに由来するPBMCからの主要な免疫細胞サブセットのゲーティング。(B)NK細胞受容体のリガンドの発現、および生きたPBMC上のいくつかの骨髄マーカー Nectin-1およびB7-H6を除くすべてのリガンドの染色は、急性デング熱患者のPBMCで示されています。ネクチン-1およびB7-H6の染色は、ウイルス学的に抑制されたHIV感染者のPBMCで示されています。この図の拡大版を表示するには、ここをクリックしてください。
補足図1:細胞株上のリガンドパネルに対する抗体クローンの検証。 健康なPBMCで低レベルで発現するNK細胞受容体のリガンドに対する抗体を、細胞株の染色により検証しました。慢性骨髄性白血病K562細胞を抗ICAM-1、抗MICA/MICB、抗DR4/DR5、抗ULBP-1,2,5,6、抗ネクチン-2、抗CD155、および抗B7-H6で染色した。急性リンパ芽球性白血病NALM6細胞を抗LLT-1で染色し、B細胞急性リンパ芽球性白血病697細胞を抗ネクチン-1で染色した。健康なPBMCの染色を示すドットプロットとヒストグラムは青色です。それぞれの細胞株の染色を示すドットプロットとヒストグラムは赤で示しています。所与のマーカーに対して陽性である各細胞株の細胞の割合が示される。このファイルをダウンロードするには、ここをクリックしてください。
補足図2:抗体クローンの検証。 (A)健康なドナーでさまざまな抗体クローンを試験し、最も特異性の高いクローンを同定しました。2B4、CXCR6、KIR2DS4、NKG2A、TIGITがNK細胞上に示されています。CD56とLILRB1は生細胞上に示されています。(B)KIR2DS2抗体クローンは、凍結乾燥後に非特異的な染色を示した。同じドナーでの染色の例は、凍結乾燥前および凍結乾燥後に提供されます。このファイルをダウンロードするには、ここをクリックしてください。
補足図3:抗体/金属ペアの最適化。 健康なドナーからのPBMCの染色が示されています。(A)パネルについて試験された抗体/金属ペア。(B)パネルに使用されている抗体/金属のペア。LILRB1とPD1は生細胞上に示されています。他のすべてのマーカーはNKセルに表示されます。このファイルをダウンロードするには、ここをクリックしてください。
補足図4:薄暗く発現し、ほとんどが陽性のNK細胞マーカーの滴定。 NK細胞マーカーに対する抗体の力価は、明確な陽性および陰性の集団を示さなかったNK細胞(赤)と、健康なドナーのB細胞(青)またはPBMC(灰色)の両方で評価されました。矢印は、各抗体に選択された力価を示しています。このファイルをダウンロードするには、ここをクリックしてください。
補足図5:バーコードプロトコルの最適化。 エピトープの安定性は、健康なドナーからのPBMCに2%パラホルムアルデヒドを固定する前後に試験しました。(A)CD3、CD14、CD56の染色は、固定前(赤)と(青)の固定後とで類似しており、CD4とCD16の染色は固定によって有意に影響を受けた。(B)CD2、CD38、KIR3DL2、CD62L、KIR2DS4、NKp46、NKG2C、NKp30、NKG2D、KIR3DL1、TIGIT、KIR2DL1、KIR2DL3、NTB-Aなど、多くのNK細胞マーカーが固定の影響を受けました。このファイルをダウンロードするには、ここをクリックしてください。
補足図6:凍結乾燥後のパネルの安定性の確認。 社内抗体コンジュゲートの安定性は、凍結乾燥前(青)と凍結乾燥後(赤)で同じ血液バンクドナーのPBMCを染色することで確認されました。生細胞上には、抗CD3、抗CD14、抗CD33、抗CD19、抗PD-1、抗CD56の染色が示されています。抗CD4および抗CD8はCD3+ 細胞に示されています。残りの抗体の力価は、 図1に示すゲーティングスキームに従ってゲーティングされたNK細胞上に示されています。特に、抗KIR2DS2は凍結乾燥後に非特異的に染色されるため、その後の分析には使用されていません。このファイルをダウンロードするには、ここをクリックしてください。
補足図7:-80°Cでのリガンドパネルの安定性の確認。社内抗体コンジュゲートの安定性は、同じドナー由来の健康なPBMCを新たに調製したマスターミックスで染色し、-80°Cまたは液体窒素で保存した後に同じミックスで染色することで確認しました。抗HLA-DR、抗ICAM-1、および抗LFA-3染色は、CD3-CD7-細胞で示されています。生細胞では、抗CD3、抗PAN型HLAクラスI、抗CD7、抗CD48、抗LLT-1、抗HLA-E、抗FasR、抗ネクチン-1、抗MICA/B、抗DR4/5、抗ULBP-1,2,5,6、抗ネクチン-2、抗CD155、抗HLA-Bw4、抗HLA-Bw6、および抗B7-H6染色が示されています。抗CD8および抗CD4染色は、CD3+細胞で示されています。抗HLA-C、E、抗CCR2、抗CD11b、および抗CD33の染色は、CD3-CD7-CD14+細胞で示されています。抗CD14染色はCD3-CD7-CD33+細胞に、抗CD56染色はCD3-CD7+CD14-HLA-DR細胞に示されています。新たに調製したパネルによる染色を示すヒストグラムは赤で示されています。-80°Cで約2ヶ月間保存した後のパネルによる染色を示すヒストグラムは青色です。液体窒素(LN2)で約2ヶ月間保存した後のパネルによる染色を示すヒストグラムは緑色です。サンプルを染色し、異なる日に分析しました。ファイルは正規化され、ビーズはpremessaパッケージを使用して除去されました。このファイルをダウンロードするには、ここをクリックしてください。
| 特異 性 | クローン | 同位元素 | 目的 | 表面/細胞内 |
| CD57 | HCD57 | 89名Y | 成熟度/記憶力 | 表面 |
| CD45の | ハイ30 | 102名PD、 104PD、 106PD、 108PD | バーコード | 表面 |
| HLA-DRの | Tü36 | Qdot® 655 (112 CD-114CD) | アクティベーション/リネージ | 表面 |
| CD3 | UCHTの | 115名で | T細胞系譜 | 表面 |
| CD38の | HIT2 | 141名PRの | アクティベーションマーカー | 表面 |
| CD69の | FN50の | 142名Ndの | アクティベーションマーカー | 表面 |
| CD33 | WM53の | 143名Ndの | 単球系統 | 表面 |
| CD14 | M5E5の | 143名Ndの | 骨髄系譜 | 表面 |
| CD2の | RPA-2.10 | 144名Ndの | アクティベーション/成熟度 | 表面 |
| LILRB1 | MAB20172 | 145名Ndの | 抑制性受容体 | 表面 |
| CD19の | HIB19 | 146名Ndの | B細胞系譜 | 表面 |
| CD8 | SK1の | 147名SMの | T細胞系譜とNK細胞の活性化・成熟 | 表面 |
| FcRgの | ポリクローナル | 148名Ndの | 成熟度/適応性 | 細胞 |
| CD4の | SK3の | 149名SMの | T細胞系譜 | 表面 |
| サイク | 4D10.2 | 150名Ndの | シグナリング | 細胞 |
| CD62L | DREG-56 | 151名欧州 | アクティベーション | 表面 |
| キ-67 | キ67 | 152名SMの | 増殖 | 細胞 |
| KIR2DS4 | 179315 | 153名欧州 | 活性化受容体 | 表面 |
| NKp46 | 9.00E+02 | 155名GDの | 活性化受容体 | 表面 |
| NKG2Dの | 1D11 | 156名GDの | 活性化受容体 | 表面 |
| ティギット | 741182 | 157名GDの | 抑制性受容体 | 表面 |
| 2B4の | C1.7 | 158名GDの | 活性化受容体 | 表面 |
| DNAM-1 | DX11の | 159名TBの | 活性化受容体 | 表面 |
| FAS-L | ノック-1 | 160名GDの | アポトーシス | 表面 |
| NKp30 | P30-15 | 161名ディ | 活性化受容体 | 表面 |
| シグレック-7 | S7.7 | 162名ディ | 抑制性受容体 | 表面 |
| NKG2Cの | 134522 | 163名ディ | 成熟度/記憶力 | 表面 |
| NKp44 | P44-8 | 164名ディ | 活性化受容体 | 表面 |
| CD96の | NK92.39 | 165名HO | NKG2コレセプター | 表面 |
| KIR2DL1/KIR2DS5 | 143211 | 166名人 | 抑制性受容体 | 表面 |
| CD94の | DX22の | 167名人 | 活性化受容体 | 表面 |
| CXCR6の | K041E5 | 168名人 | 記憶 | 表面 |
| PD1の | EH12.2H7 | 169名ティム | 抑制性受容体 | 表面 |
| KIR2DL5 | UP-R1 | 170名人 | 抑制性受容体 | 表面 |
| NKG2Aの | 131411 | 171名イブ | 抑制性受容体 | 表面 |
| NTB-Aの | NT-7 | 172名TBの | 活性化受容体 | 表面 |
| KIR3DL1 | DX-9 | 173名イブ | 抑制性受容体 | 表面 |
| CD56の | NCAM16.2の | 174名イブ | NK細胞系譜 | 表面 |
| KIR2DL3 | 180701 | 175名ルー | 抑制性受容体 | 表面 |
| パーフォリン | B型-D48型 | 176名イブ | 細胞溶解性タンパク質 | 細胞 |
| DNA-1/DNA-2 | NAの | 191名Ir/193IR | 有核細胞 | 表面 |
| シスプラチン | NAの | 194名Pt/195Pt | 生存 率 | 表面 |
| CD16 | 3G8の | 209名ビ | FcgRIII受容体 | 表面 |
表1:NKパネル。 マーカーは、それらが結合された金属の同位体質量に従って順序付けられます。 191名Ir/193Irは、核酸インターカレーターの自然な存在量です。 194名Pt/195Ptはシスプラチンの自然な豊富さです。
| 特異 性 | クローン | 同位元素 | 目的 | 表面/細胞内 |
| HLA-DRの | L243 | 89名Y | 抗原提示細胞、活性化マーカー | 表面 |
| CD45の | ハイ30 | 102名PD、 104PD、 106PD、 108PD | バーコード | 表面 |
| CD19の | SJ25-C1型 | Qdot® 655 (112 CD-114CD) | 血筋 | 表面 |
| CD3 | UCHT1の | 115名で | 血筋 | 表面 |
| パンHLAクラスI | W6/32 | 143名Ndの | KIR配位子 | 表面 |
| CD7 | CD7-6B7 | 144名Ndの | 血筋 | 表面 |
| CD8 | SK1の | 145名Ndの | 血筋 | 表面 |
| CD48の | BJ40 | 146名Ndの | 2B4リガンド | 表面 |
| ICAM-1 | ハ58 | 148名Ndの | LFA-1リガンド | 表面 |
| LLT-1の | 402659 | 149名SMの | CD161リガンド | 表面 |
| CD4の | OKT4の | 151名欧州 | 血筋 | 表面 |
| HLA-C,E | DT9の | 153名欧州 | KIR配位子 | 表面 |
| CCR2 | K036C2の | 154名SMの | 単球機能マーカー | 表面 |
| HLA-E | 3D12 | 155名GDの | NKG2A/CD94およびNKG2C/CD94リガンド | 表面 |
| FAS(CD95) | DX2の | 156名GDの | FasL受容体 | 表面 |
| ネクチン-1 | R1.302 | 157名GDの | CD96リガンド | 表面 |
| MICA/Bの | 159227/236511 | 158名GDの | NKG2D配位子 | 表面 |
| DR4/5 | DJR1/DJR2-2 | 159名TBの | TRAIL受容体 | 表面 |
| ULBP-1/2,5,6 | 170818/165903 | 161名ディ | NKG2D配位子 | 表面 |
| ネクチン-2 | TX31の | 164名ディ | DNAM-1、TIGIT、CD96リガンド | 表面 |
| CD155 | SKII.4 | 165名HO | DNAM-1、TIGIT、CD96リガンド | 表面 |
| HLA-BW4の | レア274 | 166名人 | KIR3DL1リガンド | 表面 |
| HLA-BW6の | レア143 | 168名人 | KIRヌル対立遺伝子 | 表面 |
| CD14 | M5E2の | 169名ティム | 血筋 | 表面 |
| CD11bの | ICRF44の | 170名人 | 血筋 | 表面 |
| LFA-3 | TS2/9 | 171名イブ | CD2リガンド | 表面 |
| CD33 | WM53の | 172名イブ | 血筋 | 表面 |
| CD56の | NCAM16.2の | 174名イブ | 血筋 | 表面 |
| B7-H6 | 875001 | 176名イブ | NKp30配位子 | 表面 |
| DNA-1/DNA-2 | NAの | 191名Ir/193IR | 有核細胞 | 表面 |
| シスプラチン | NAの | 194名Pt/195Pt | 生存 率 | 表面 |
| CD16 | 3G8の | 209名ビ | 血筋 | 表面 |
表2:配位子パネル。 マーカーは、それらが結合された金属の同位体質量に従って順序付けられます。 191名Ir/193Irは、核酸インターカレーターの自然な存在量です。 194名Pt/195Ptはシスプラチンの自然な豊富さです。
| 特異 性 | クローン | 売り手 | カタログ番号 | 表面/ 細胞内 | 筆記 |
| 2B4の | 2-69 | BDバイオサイエンス | 550814 | 表面 | 改良された染色でバリデーションされた新しいクローン |
| CD56の | N901の | ベックマン・コールター | 6602705 | 表面 | 改良された染色でバリデーションされた新しいクローン |
| CXCR6の | 56811 | R&Dシステム | マブ699 | 表面 | 新しいクローンを低コストで検証 |
| KIR2DS2 | ポリクローナル | アブカム | ab175486 | 表面 | 凍結乾燥後に認められた非特異的染色 - 分析には使用されません |
| KIR2DS4 | FES172 | ベックマン・コールター | A60796 (英語) | 表面 | 新規クローンは、染色の改善/低コストでバリデーションされています。 |
| LILRB1 | GHI/75 | バイオレジェンド | 333702 | 表面 | 改良された染色でバリデーションされた新しいクローン |
| NKG2Aの | Z199 | ベックマン・コールター | IM2750 | 表面 | 新しいクローンを低コストで検証 |
| ティギット | MBSA43の | サーモフィッシャーサイエンティフィック | 16-9500-82 | 表面 | 新しいクローンの検証 |
補足表1:NK細胞パネル用の抗体で、試験されたが使用されていないもの。
| 同位元素 | 特異 性 | クローン | 売り手 | カタログ番号 | 表面/ 細胞内 |
| 143名Ndの | NKG2Cの | 134522 | 研究開発体制 | MAB1381 | 表面 |
| 145名Ndの | CD38の | HIT2 | バイオレジェンド | 303502 | 表面 |
| 146名Ndの | CD8 | SK1の | バイオレジェンド | 344702 | 表面 |
| 149名SMの | CD2の | RPA-2.10 | バイオレジェンド | 300202 | 表面 |
| 151名欧州 | シグレック-7 | S7.7 | バイオレジェンド | 347702 | 表面 |
| 154名SMの | LILRB1 | 292319 | 研究開発体制 | MAB20172 | 表面 |
| 163名ディ | KIR3DL1 | DX-9 | BDバイオサイエンス | 555964 | 表面 |
| 168名人 | CD62L | DREG-56 | バイオレジェンド | 304802 | 表面 |
| 171名イブ | PD1の | EH12.2H7 | バイオレジェンド | 329902 | 表面 |
| 176名イブ | CD69の | EH12.2H7 | バイオレジェンド | 329902 | 表面 |
補足表2:異なる抗体/金属ペアで試験したNK細胞パネル用の抗体。
ディスカッション
ここでは、NK細胞受容体-リガンドレパートリーのプロファイリングを目的とした2つの相補型CyTOFパネルの設計と応用について説明します。このプロトコルには、高品質のデータを取得するために重要ないくつかの手順が含まれています。CyTOFは、抗体の標識プローブとして、蛍光色素ではなく重金属イオンを使用します19。したがって、この技術は、環境金属20からの潜在的な汚染信号の影響を受けやすい。金属不純物の潜在的な発生源には、実験室の食器用洗剤(バリウム)や実験室の緩衝液(水銀、鉛、スズ)が含まれます。このため、すべてのバッファーは超純水で調製し、すべての試薬は石鹸で洗浄したことのないプラスチックまたはガラス容器に保管することをお勧めします。このプロトコルのもう1つの重要なステップは、Fienbergら21によって記述されているシスプラチンベースの方法を使用する生存率染色です。この方法には、1分間のインキュベーションステップが含まれ、その間にシスプラチンは非生細胞を優先的に標識します。シスプラチン染色は、FBSの非存在下で行う必要があります。したがって、細胞を染色する前にCyPBSで十分に洗浄する必要があります。さらに、生細胞のオフターゲット染色を避けるために、シスプラチン染色は正確に1分後にFBSで消光する必要があります。このプロトコルは、細胞の回収と染色性能を最大限に高めるために最適化されています。したがって、固定と透過化のステップも重要です。いくつかの固定試薬および透過化試薬は、CyTOFに適合します。しかし、2% PFA で固定した後、 材料表に詳述されている特定の透過化バッファーで透過処理すると、細胞回収率が最大になることがわかりました。これは一過性の透過性法であるため、十分な抗体浸透度を確保するために、透過化バッファーで細胞内染色を行う必要があります。また、細胞内染色後には、細胞を透過化バッファーで十分に洗浄し、結合していない抗体を除去する必要があります。
このプロトコルでは、いくつかの可能な変更が可能です。ここで説明するCyTOFパネルは、追加のマーカーを含めたり、既存のマーカーを置き換えたりするようにカスタマイズできます。特に、リガンドパネルは、パネル設計の柔軟性を可能にするために、いくつかのオープンチャネルで設計されました。パネルの変更や追加を行うと、追加のトラブルシューティングが必要になる場合があります。特に、抗体/金属同位体のペアは、既存のチャネルへのシグナルのスピルオーバーの問題を回避するために、上記のように徹底的にバリデーションする必要があります。これらのパネルは、サンプルバーコードにも対応できるように設計されています。バーコード化は、試薬の消費を最小限に抑えながら、バッチ効果やサンプル間のキャリーオーバーの可能性を減らします22。通常、バーコード化によりデータ品質が全体的に向上しますが、このステップは高品質のCyTOFデータを取得するために必要ではなく、完全にスキップできます。同様に、染色前にNK細胞を精製することをお勧めしますが、NK細胞パネルは、PBMC全体からのNK細胞の表現型決定に適合します。
この方法にはいくつかの制限があります。CyTOFは本質的に低スループットであるため、この方法は細胞数が少ないサンプルには適していません。このようなサンプルでは、分析に十分な品質のデータが得られる可能性は低いです。さらに、これらのパネルはNK細胞と標的細胞の相互作用を調べるために特別に設計されているため、CD8+ T細胞や骨髄系細胞などの他の細胞タイプ間の相互作用を評価する能力には限界があります。同様に、これらのパネルは直接 ex vivo 免疫表現型解析用に設計されており、サイトカイン刺激などの活性化条件下での使用については試験または検証されていません。さらに、これらのパネルはNK細胞受容体とリガンドの包括的なリストをカバーしていますが、完全に網羅しているわけではなく、スペースの制限により、いくつかの潜在的に重要なマーカーは含まれていませんでした。これらのマーカーには、NKパネルのKLRG1、CRACC、TIM-3、LAIR-1、リガンドパネルのPD-L1などがありますが、これらに限定されません。最後に、この方法は、NK細胞マーカーのエピトープの大部分が固定の影響を受けるため、固定サンプルでの使用には適していません。
ここで説明するプロトコルは、他の方法と比較して大きな利点があります。他のグループは、NK細胞の研究を目的としたフローサイトメトリーパネルについて説明しています3、4、5、6、7、8、23。フローサイトメトリーと比較して、CyTOFを使用すると、蛍光色素の補償に関連する問題が排除され、多数のマーカーを同時に検出できます。NK細胞9,10,11,12,13,14を研究するためにCyTOFパネルを開発したものもありますが、ここでは、NK細胞受容体とそのリガンドの両方の発現を調べる2つの相補的なCyTOFパネルの使用について説明し、NK細胞の機能をより詳細に把握することができます。
私たちのグループは、このプロトコルとこれらのパネルの一方または両方を使用して、健康なドナー、およびHIV感染やデングウイルス感染24、25、26、27、28などのさまざまな疾患環境でのヒトNK細胞応答を特徴付けました。ウイルス感染を研究する目的で設計されているにもかかわらず、これらのパネルは、それらがカバーするタンパク質の息吹を考えると、他の条件でのNK細胞の研究に役立ちます。実際、私たちのグループは、免疫不全および多発性硬化症の患者25,27,29,30、およびヒト化マウス31,32のNK細胞受容体リガンドレパートリーを特徴付けるためにもこれらのパネルを使用しました。そのため、これらのパネルの使用は他のコンテキストに拡張できます。例えば、がんの発生に関与するNK細胞受容体や同族リガンドが多数含まれているため、これらのパネルは、抗腫瘍応答におけるNK細胞の役割に関する将来の研究のための優れたツールとなっています。より広くは、CyTOFパネルの大量生産と保管、およびサンプルの並列処理に関する当社のプロトコルは、あらゆるCyTOFパネルの実行とアプリケーションに適用できます。
開示事項
著者は何も開示していません。
謝辞
著者は、このパネルに貢献したBlish Laboratoryの現在および以前のメンバー全員に感謝します。AIDS Clinical Trials GroupとACTG A5321チーム、サンプルキュレーションにご協力いただいたGorgas Memorial Institute for Health StudiesのSandra López-Vergès博士とDavis Beltrán氏に感謝いたします。最後に、Heliosマシンを使用してくださったMichael Leipold氏、Holden Maecker氏、Stanford Human Immune Monitoring Centerに感謝します。この研究は、NIH U19AI057229、NIH R21 AI135287、NIH R21 AI130532、NIH DP1 DA046089、Burroughs Wellcome Fund Investigators in the Pathogenesis of Infectious Diseases #1016687からCB、NIH Ruth L. Kirschstein Institutional National Research Service Award T32 AI007502、TL1 TR001084、NIH/NIAID K08 AI138640 to EV、National Science Foundation Graduate Research Fellowship DGE-1656518 to JM、NIH training grant T32-AI-007290 (PI Olivia Martinez) の支援を受けました。ACTG研究は、AI-68634(統計データ管理センター)、UM1-A1-26617、AI-131798、およびAI-68636(ACTG)から助成金を受けました。CBは、スタンフォード母子健康研究所の小児トランスレーショナル医学のタシア・アンド・ジョン・モーリッジ・ファカルティ・スカラーであり、チャン・ザッカーバーグ・バイオハブの研究者です。
資料
| Name | Company | Catalog Number | Comments |
| 89Y | Sigma-Aldrich | 204919 | |
| 102-Palladium nitrate | Trace Sciences International | Special Order | |
| 104-Palladium nitrate | Trace Sciences International | Special Order | |
| 106-Palladium nitrate | Trace Sciences International | Special Order | |
| 108-Palladium nitrate | Trace Sciences International | Special Order | |
| 115In | Trace Sciences International | Special Order | |
| 141Pr | Fluidigm | 201141A | |
| 142Nd | Fluidigm | 201142A | |
| 143Nd | Fluidigm | 201143A | |
| 144Nd | Fluidigm | 201144A | |
| 145Nd | Fluidigm | 201145A | |
| 146Nd | Fluidigm | 201146A | |
| 147Sm | Fluidigm | 201147A | |
| 148Nd | Fluidigm | 201148A | |
| 149Sm | Fluidigm | 201149A | |
| 150Nd | Fluidigm | 201150A | |
| 151Eu | Fluidigm | 201151A | |
| 152Sm | Fluidigm | 201152A | |
| 153Eu | Fluidigm | 201153A | |
| 154Sm | Fluidigm | 201154A | |
| 155Gd | Fluidigm | 201155A | |
| 156Gd | Fluidigm | 201156A | |
| 157Gd | Trace Sciences International | N/A | |
| 158Gd | Fluidigm | 201158A | |
| 159Tb | Fluidigm | 201159A | |
| 160Gd | Fluidigm | 201160A | |
| 161Dy | Fluidigm | 201161A | |
| 162Dy | Fluidigm | 201162A | |
| 163Dy | Fluidigm | 201163A | |
| 164Dy | Fluidigm | 201164A | |
| 165Ho | Fluidigm | 201165A | |
| 166Er | Fluidigm | 201166A | |
| 167Er | Fluidigm | 201167A | |
| 168Er | Fluidigm | 201168A | |
| 169Tm | Fluidigm | 201169A | |
| 170Er | Fluidigm | 201170A | |
| 171Yb | Fluidigm | 201171A | |
| 172Yb | Fluidigm | 201172A | |
| 173Yb | Fluidigm | 201173A | |
| 174Yb | Fluidigm | 201174A | |
| 175Lu | Fluidigm | 201175A | |
| 176Yb | Fluidigm | 201176A | |
| 209Bi anti-CD16 | Fluidigm | 3209002B | Clone 3G8. Used at a 1:50 dilution. |
| 697 cells | Creative Bioarray | CSC-C0217 | |
| Amicon Ultra Centrifugal Filter Units 0.5 with Ultracel-30 Membrane, 30 kDa | Millipore | UFC503096 | |
| Anhydrous acetonitrile | Fisher Scientific | BP1165-50 | |
| anti-2B4 | Biolegend | 329502 | Clone C1.7. |
| anti-B7-H6 | R&D Systems | MAB7144 | Clone 875001. |
| anti-CCR2 | Biolegend | 357202 | Clone K036C2. |
| anti-CD2 | Biolegend | 300202 | Clone RPA-2.10. |
| anti-CD3 | Biolegend | 300402 | Clone UCHT1. |
| anti-CD4 | Biolegend | 317402 | Clone OKT4. |
| anti-CD4 | Biolegend | 344602 | Clone SK3. |
| anti-CD7 | Biolegend | 343102 | Clone CD7-6B7. |
| anti-CD8 | Biolegend | 344702 | Clone SK1. |
| anti-CD11b | Biolegend | 301302 | Clone ICRF44. |
| anti-CD14 | Biolegend | 301802 | Clone M5E2. |
| anti-CD19 | Biolegend | 302202 | Clone HIB19. |
| anti-CD33 | Biolegend | 303402 | Clone WM53. |
| anti-CD38 | Biolegend | 303502 | Clone HIT2. |
| anti-CD48 | Biolegend | 336702 | Clone BJ40. |
| anti-CD56 | BD Pharmingen | 559043 | Clone NCAM16.2. |
| anti-CD57 | Biolegend | 322302 | Clone HCD57. |
| anti-CD62L | Biolegend | 304802 | Clone DREG-56. |
| anti-CD69 | Biolegend | 310902 | Clone FN50. |
| anti-CD94 | Biolegend | 305502 | Clone DX22. |
| anti-CD95 | Biolegend | 305602 | Clone DX2. |
| anti-CD155 | Biolegend | 337602 | Clone SKII.4. |
| anti-CXCR6 | Biolegend | 356002 | Clone K041E5. |
| anti-DNAM-1 | BD Biosciences | 559787 | Clone DX11. |
| anti-DR4 | Biolegend | 307202 | Clone DJR1. |
| anti-DR5 | Biolegend | 307302 | Clone DJR2-2. |
| anti-FAS-L | Biolegend | 306402 | Clone NOK-1. |
| anti-FcRg | Millipore | 06-727 | Polyclonal antibody. |
| anti-HLA-C,E | Millipore | MABF233 | Clone DT9. |
| anti-HLA-Bw4 | Miltenyi Biotec | Special Order | Clone REA274. |
| anti-HLA-Bw6 | Miltenyi Biotec | 130-124-530 | Clone REA143. |
| anti-HLA-DR | Biolegend | 307602 | Clone L243. |
| anti-HLA-E | Biolegend | 342602 | Clone 3D12. |
| anti-ICAM-1 | Biolegend | 353102 | Clone HA58. |
| anti-Ki-67 | Biolegend | 350502 | Clone Ki-67. |
| anti-KIR2DL1/KIR2DS5 | R&D Systems | MAB1844 | Clone 143211. |
| anti-KIR2DL3 | R&D Systems | MAB2014 | Clone 180701. |
| anti-KIR2DL5 | Miltenyi Biotec | 130-096-200 | Clone UP-R1. |
| anti-KIR2DS4 | R&D Systems | MAB1847 | Clone 179315. |
| anti-KIR3DL1 | BD Biosciences | 555964 | Clone DX-9. |
| anti-LFA-3 | Biolegend | 330902 | Clone TS2/9. |
| anti-LILRB1 | R&D Systems | 292319 | Clone MAB20172. |
| anti-LLT-1 | R&D Systems | AF3480 | Clone 402659. |
| anti-MICA | R&D Systems | MAB1300-100 | Clone 159227. |
| anti-MICB | R&D Systems | MAB1599-100 | Clone 236511. |
| anti-Nectin-1 | Biolegend | 340402 | Clone R1.302. |
| anti-Nectin-2 | Biolegend | 337402 | Clone TX31. |
| anti-NKG2A | R&D Systems | MAB1059 | Clone 131411. |
| anti-NKG2C | R&D Systems | MAB1381 | Clone 134522. |
| anti-NKG2D | Biolegend | 320802 | Clone 1D11. |
| anti-NKp30 | Biolegend | 325202 | Clone P30-15. |
| anti-NKp44 | Biolegend | 325102 | Clone P44-8. |
| anti-NKp46 | Biolegend | 331902 | Clone 9E2. |
| anti-NTB-A | Biolegend | 317202 | Clone NT-7. |
| anti-Pan HLA class I | Biolegend | 311402 | Clone W6/32. |
| anti-PD1 | Biolegend | 329902 | Clone EH12.2H7. |
| anti-Perforin | Abcam | ab47225 | Clone B-D48. |
| anti-Siglec-7 | Biolegend | 347702 | Clone S7.7. |
| anti-Syk | Biolegend | 644302 | Clone 4D10.2. |
| anti-TACTILE | Biolegend | 338402 | Clone NK92.39. |
| anti-TIGIT | R&D Systems | MAB7898 | Clone 741182. |
| anti-ULBP-1 | R&D Systems | MAB1380-100 | Clone 170818. |
| anti-ULBP-2, 5, 6 | R&D Systems | MAB1298-100 | Clone 165903. |
| Antibody Stabilizer | Candor Bioscience | 131 050 | |
| Benzonase Nuclease | Millipore | 70664 | |
| Bond-Breaker TCEP Solution | Thermo Fisher Scientific | 77720 | |
| Bovine Serum Albumin solution | Sigma-Aldrich | A9576 | |
| Calcium chloride dihydrate (CaCl2+2H2O) | Sigma-Aldrich | 223506-25G | |
| Cis-Platinum(II)diamine dichloride (cisplatin) | Enzo Life Sciences | ALX-400-040-M250 | A 100 mM stock solution was prepared in DMSO and divided into 25 µL aliquots. Used at a 25 µM dilution for live/dead stain. Signal appears in 194Pt and 195Pt channels. |
| DMSO | Sigma-Aldrich | D2650 | |
| eBioscience Permeabilization Buffer | Thermo Fisher Scientific | 00-8333-56 | |
| EDTA (0.5 M) | Hoefer | GR123-100 | A double-concentrated HEPES buffer with EDTA was made according to the following recipe: 1.3 g NaCl (Thermo Fisher Scientific), 27 mg CaCl2+2H2O (Sigma-Aldrich), 23 mg MgCl2 (Sigma-Aldrich), 83.6 mg KH2PO4 (Thermo Fisher Scientific), 4 mL of 1M HEPES (Thermo Fisher Scientific), 2 mL of 0.5M EDTA (Hoefer, Holliston, MA, USA), and 100mL H2O. The pH of this double-concentrated HEPES buffer was adjusted to a pH of 7.3 using 1M HCl and 1M NaOH. |
| EQ Four Element Calibration Beads | Fluidigm | 201078 | |
| Fetal Bovine Serum | Thermo Fisher Scientific | N/A | |
| Helios mass cytometer | Fluidigm | N/A | |
| HEPES (1M) | Thermo Fisher Scientific | 15630080 | |
| HyClone Antibiotic/Antimycotic Solution (Pen/Strep/Fungiezone) solution | Fisher Scientific | SV3007901 | |
| Iridium - 191Ir/193Ir intercalator | DVS Sciences (Fluidigm) | 201192B | Used at a 1:10000 dilution. |
| Isothiocyanobenzyl-EDTA (ITCB-EDTA) | Dojindo Molecular Technologies, Inc. | M030-10 | Diluted to 1.25 mg/mL in anhydrous acetonitrile. |
| K562 cells | American Type Culture Collection (ATCC) | ATCC CCL-243 | |
| L-Glutamine (200 mM) | Thermo Fisher Scientific | SH30034 | |
| Magnesium chloride (MgCl2) | Sigma-Aldrich | 208337-100G | |
| Maxpar X8 Antibody Labeling Kits | Fluidigm | N/A | No catalog number as kits come with metals. |
| Millex-VV Syringe Filter Unit, 0.1 µm | Millipore | SLVV033RS | |
| Milli-Q Advantage A10 Water Purification System | Millipore | Z00Q0V0WW | |
| MS Columns | Miltenyi Biotec | ||
| NALM6 cells | American Type Culture Collection (ATCC) | ATCC CRL-3273 | |
| Nanosep Centrifugal Devices with Omega Membrane 3K | Pall Corporation | OD003C35 | |
| NK Cell Isolation Kit, human | Miltenyi Biotec | 130-092-657 | |
| Paraformaldehyde (16%) | Electron Microscopy Sciences | 15710 | |
| PBS | Thermo Fisher Scientific | 10010023 | |
| Potassium Phosphate Monobasic (KH2PO4) | Fisher Scientific | MP021954531 | |
| Qdot 655 anti-CD19 | Thermo Fisher Scientific | Q10179 | Clone SJ25-C1. Used at a 1:50 dilution. Signal appears in 112Cd-114Cd channels. |
| Qdot 655 anti-HLA-DR | Thermo Fisher Scientific | Q22158 | Clone Tü36. Used at a 1:200 dilution. |
| Rockland PBS | Rockland Immunochemicals, Inc. | MB-008 | Used to make CyPBS (10X Rockland PBS diluted to 1X in Milli-Q water) and CyFACS buffers (10X Rockland PBS diluted to 1X in Milli-Q water with 0.1% BSA and 0.05% sodium azide). Buffers were sterile-filtered through a 0.22 µM filter and sotred at 4°C in Stericup bottles. |
| RPMI 1640 | Thermo Fisher Scientific | 21870092 | |
| Sodium azide (NaN3) | Sigma-Aldrich | S2002 | |
| Sodium chloride (NaCl) | Fisher Scientific | S271-500 | |
| Stericup Quick Release-GP Sterile Vacuum Filtration System | Millipore Sigma | S2GPU10RE | |
| Tuning solution | Fluidigm | 201072 | |
| Washing solution | Fluidigm | 201070 |
参考文献
- Shimasaki, N., Jain, A., Campana, D. NK cells for cancer immunotherapy. Nature Reviews. Drug Discovery. 19 (3), 200-218 (2020).
- Vivier, E., Tomasello, E., Baratin, M., Walzer, T., Ugolini, S. Functions of natural killer cells. Nature Immunology. 9 (5), 503-510 (2008).
- Eller, M. A., Currier, J. R. OMIP-007: phenotypic analysis of human natural killer cells. Cytometry. Part A: The Journal of the International Society for Analytical Cytology. 81 (6), 447-449 (2012).
- Mahnke, Y. D., Beddall, M. H., Roederer, M. OMIP-029: Human NK-cell phenotypization. Cytometry. Part A: The Journal of the International Society for Analytical Cytology. 87 (11), 986-988 (2015).
- Hammer, Q., Romagnani, C. OMIP-039: Detection and analysis of human adaptive NKG2C + natural killer cells : Detection of Human Adaptive NKG2C + NK Cells. Cytometry. 91 (10), 997-1000 (2017).
- Liechti, T., Roederer, M. OMIP-058: 30-Parameter flow cytometry panel to characterize iNKT, NK, unconventional and conventional T cells. Cytometry. 95 (9), 946-951 (2019).
- Béziat, V., et al. NK cell responses to cytomegalovirus infection lead to stable imprints in the human KIR repertoire and involve activating KIRs. Blood. 121 (14), 2678-2688 (2013).
- Pfefferle, A., et al. Intra-lineage plasticity and functional reprogramming maintain natural killer cell repertoire diversity. Cell Reports. 29 (8), 2284-2294 (2019).
- Barcenilla, H., Åkerman, L., Pihl, M., Ludvigsson, J., Casas, R. Mass cytometry identifies distinct subsets of regulatory T cells and Natural killer cells associated with high risk for Type 1 diabetes. Frontiers in Immunology. 10, 982(2019).
- Kurioka, A., et al. CD161 defines a functionally distinct subset of pro-inflammatory Natural killer cells. Frontiers in Immunology. 9, 486(2018).
- Romee, R., et al. Cytokine-induced memory-like natural killer cells exhibit enhanced responses against myeloid leukemia. Science Translational Medicine. 8 (357), (2016).
- Shinko, D., et al. Mass cytometry reveals a sustained reduction in CD16+ Natural killer cells following chemotherapy in colorectal cancer patients. Frontiers in Immunology. 10, 2584(2019).
- Pohlmeyer, C. W., et al. Identification of NK cell subpopulations that differentiate HIV-infected subject cohorts with diverse levels of virus control. Journal of Virology. 93 (7), 01790(2019).
- Palgen, J. -L., et al. NK cell immune responses differ after prime and boost vaccination. Journal of Leukocyte Biology. 105 (5), 1055-1073 (2019).
- Mei, H. E., Leipold, M. D., Schulz, A. R. Barcoding of live human peripheral blood mononuclear cells for multiplexed mass cytometry. The Journal of Immunology. 194 (4), 2022-2031 (2015).
- Takahashi, C., et al. Mass cytometry panel optimization through the designed distribution of signal interference. Cytometry. Part A: The Journal of the International Society for Analytical Cytology. 91 (1), 39-47 (2017).
- Baumgart, S., Peddinghaus, A., Schulte-Wrede, U., Mei, H. E., Grützkau, A. OMIP-034: Comprehensive immune phenotyping of human peripheral leukocytes by mass cytometry for monitoring immunomodulatory therapies. Cytometry. Part A: The Journal of the International Society for Analytical Cytology. 91 (1), 34-38 (2017).
- Leipold, M. D. Another step on the path to mass cytometry standardization. Cytometry. Part A: The Journal of the International Society for Analytical Cytology. 87 (5), 380-382 (2015).
- Bendall, S. C., et al. Single-cell mass cytometry of differential immune and drug responses across a human hematopoietic continuum. Science. 332 (6030), 687-696 (2011).
- Leipold, M. D., Newell, E. W., Maecker, H. T. Multiparameter phenotyping of human PBMCs using mass cytometry. Methods in Molecular Biology. 1343, 81-95 (2015).
- Fienberg, H. G., Simonds, E. F., Fantl, W. J., Nolan, G. P., Bodenmiller, B. A platinum-based covalent viability reagent for single-cell mass cytometry. Cytometry. Part A: The Journal of the International Society for Analytical Cytology. 81 (6), 467-475 (2012).
- Zivanovic, N., Jacobs, A., Bodenmiller, B. A practical guide to multiplexed mass cytometry. Current Topics in Microbiology and Immunology. 377, 95-109 (2014).
- Béziat, V., Hilton, H. G., Norman, P. J., Traherne, J. A. Deciphering the killer-cell immunoglobulin-like receptor system at super-resolution for natural killer and T-cell biology. Immunology. 150 (3), 248-264 (2017).
- Wilk, A. J., et al. Charge-altering releasable transporters enable specific phenotypic manipulation of resting primary natural killer cells. BioRxiv. , 970491(2020).
- Vendrame, E., et al. TIGIT is upregulated by HIV-1 infection and marks a highly functional adaptive and mature subset of natural killer cells. AIDS. 34 (6), 801-813 (2020).
- Zhao, N. Q., et al. Natural killer cell phenotype is altered in HIV-exposed seronegative women. PloS One. 15 (9), 0238347(2020).
- McKechnie, J. L., et al. HLA upregulation during dengue virus infection suppresses the natural killer cell response. Frontiers in Cellular and Infection Microbiology. 9, 268(2019).
- McKechnie, J. L., et al. Mass cytometry analysis of the NK cell receptor-ligand repertoire reveals unique differences between dengue-infected children and adults. ImmunoHorizons. 4 (10), 634-647 (2020).
- Ranganath, T., et al. Characterization of the impact of daclizumab beta on circulating natural killer cells by mass cytometry. Frontiers in immunology. 11, 714(2020).
- Fernandez, I. Z., et al. A novel human IL2RB mutation results in T and NK cell--driven immune dysregulation. The Journal of Experimental Medicine. 216 (6), 1255-1267 (2019).
- Herndler-Brandstetter, D., et al. Humanized mouse model supports development, function, and tissue residency of human natural killer cells. Proceedings of the National Academy of Sciences. 114 (45), 9626-9634 (2017).
- Nikzad, R., et al. Human natural killer cells mediate adaptive immunity to viral antigens. Science Immunology. 4 (35), (2019).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved