Method Article
التنميط لمستقبلات الخلايا القاتلة الطبيعية البشرية - ذخيرة الترابط
* These authors contributed equally
In This Article
Summary
نقوم هنا بتصميم لوحتين تكميليتين لقياس الكتلة الخلوية (CyTOF) وتحسين بروتوكول تلطيخ CyTOF بهدف تحديد ملامح مستقبلات الخلايا القاتلة الطبيعية وذخيرة الترابط في وضع الالتهابات الفيروسية.
Abstract
الخلايا القاتلة الطبيعية (NK) هي من بين أول المستجيبين للعدوى الفيروسية. يتم تنظيم قدرة الخلايا القاتلة الطبيعية على التعرف بسرعة على الخلايا المصابة بالفيروسات وقتلها من خلال تعبيرها عن المستقبلات المثبطة والمنشطة المشفرة بالخط الجرثومي. يحدد تعشيق هذه المستقبلات بواسطة الروابط المماثلة على الخلايا المستهدفة ما إذا كان التفاعل بين الخلايا سيؤدي إلى قتل الخلايا القاتلة الطبيعية. يوضح هذا البروتوكول بالتفصيل تصميم وتحسين لوحتين تكميليتين لقياس الكتلة الخلوية (CyTOF). تم تصميم لوحة واحدة للنمط الظاهري لخلايا NK بناء على تعبير المستقبلات. تم تصميم اللوحة الأخرى لاستجواب التعبير عن الروابط المعروفة لمستقبلات الخلايا القاتلة الطبيعية في العديد من مجموعات الخلايا المناعية. تسمح هاتان اللوحان معا بتنميط ذخيرة مستقبلات الخلايا القاتلة الطبيعية البشرية. علاوة على ذلك ، يوضح هذا البروتوكول أيضا تفاصيل العملية التي نقوم من خلالها بتلطيخ عينات CyTOF. تم تحسين هذه العملية لتحسين قابلية التكرار والتوحيد القياسي. تتمثل إحدى مزايا CyTOF في قدرتها على قياس أكثر من 40 علامة في كل لوحة ، مع الحد الأدنى من تداخل الإشارة ، مما يسمح للباحثين بالتقاط اتساع ذخيرة مستقبلات الخلايا القاتلة الطبيعية. يقلل الترميز الشريطي للبلاديوم أيضا من التباين بين العينات ، وكذلك استهلاك الكواشف ، مما يسهل تلطيخ العينات مع كل لوحة بالتوازي. تشمل قيود هذا البروتوكول الإنتاجية المنخفضة نسبيا ل CyTOF وعدم القدرة على استعادة الخلايا بعد التحليل. تم تصميم هذه اللوحات لتحليل العينات السريرية من المرضى الذين يعانون من عدوى فيروسية حادة ومزمنة ، بما في ذلك فيروس حمى الضنك وفيروس نقص المناعة البشرية (HIV) والإنفلونزا. ومع ذلك ، يمكن استخدامها في أي مكان للتحقيق في ذخيرة مستقبلات الخلايا القاتلة الطبيعية البشرية. الأهم من ذلك ، يمكن تطبيق هذه الأساليب على نطاق واسع على تصميم وتنفيذ لوحات CyTOF المستقبلية.
Introduction
الخلايا القاتلة الطبيعية (NK) هي خلايا مناعية فطرية يتمثل دورها الأساسي في استهداف وقتل الخلايا الخبيثة أو المصابة أو المجهدة بطريقة أخرى. من خلال إفراز السيتوكينات مثل IFNγ و TNFα ، بالإضافة إلى نشاطها السام للخلايا ، يمكن للخلايا القاتلة الطبيعية أيضا تشكيل الاستجابة المناعية التكيفية لمسببات الأمراض والأورام الخبيثة. يتم التوسط في استجابة NK جزئيا عن طريق الإشارات الاندماجية للمستقبلات المثبطة والمنشطة المشفرة بالخط الجرثومي ، والتي تربط عددا لا يحصى من الروابط المعبر عنها على الخلايا المستهدفة المحتملة. تحتوي العديد من مستقبلات الخلايا القاتلة الطبيعية على أكثر من رابط واحد مع تحديد أزواج جديدة من المستقبلات والترابط بانتظام.
هناك اهتمام خاص بدراسة الخلايا القاتلة الطبيعية في سياق الالتهابات الفيروسية ، حيث قد تؤدي قدرتها على الاستجابة السريعة للخلايا المجهدة إلى الحد من انتشار الفيروس أو تعزيز تطوير استراتيجيات التهرب من الخلايا القاتلة الطبيعية. يمتد هذا الاهتمام ببيولوجيا الخلايا القاتلة الطبيعية إلى مجال العلاج المناعي للسرطان حيث يبحث الباحثون في دور الخلايا القاتلة الطبيعية في المراقبة المناعية للورم وفي البيئة المكروية للورم1. ومع ذلك ، فإن القدرة على تحديد تفاعلات الخلايا المستهدفة لخلية NK معقدة بسبب حقيقة أن الخلايا البشرية يمكن أن تعبر عن أكثر من 30 مستقبلا والتي بدورها يمكن أن تتفاعل مع أكثر من 30 رابطامعروفا 2. لذلك ، فإن الكشف المتزامن لمستقبلات الخلايا القاتلة الطبيعية المتعددة والروابط المماثلة لها ضروري لالتقاط تعقيد تفاعلات المستقبل والترابط التي تتحكم في وظيفة NK. وبالتالي ، لجأنا إلى القياس الخلوي الكتلي (CyTOF) ، والذي يسمح بالكشف المتزامن لأكثر من 40 علامة على مستوى الخلية الواحدة. كان هدفنا هو إنشاء لوحتين من CyTOF لتعريف ذخيرة مستقبلات الخلايا القاتلة الطبيعية. أردنا أيضا تصميم بروتوكول للمعالجة الفعالة وتلوين العينات السريرية. توفر العينات البشرية السريرية ثروة من المعلومات حول كيفية استجابة الجسم للعدوى الفيروسية. لذلك ، قمنا بتطوير هذا البروتوكول للتحقيق في التعبير عن مستقبلات الخلايا القاتلة الطبيعية والروابط المماثلة لها بالتوازي من أجل توحيد أفضل ، وتحسين الانتعاش ، وتقليل استهلاك الكاشف ، وتأثيرات الدفعات المحدودة.
تم نشر العديد من لوحات قياس التدفق الخلوي المصممة لتوصيف النمط الظاهري لخلايا NK البشرية سابقا3،4،5،6،7،8. معظم هذه الألواح محدودة في قدرتها على التقاط اتساع ذخيرة المستقبلات والترابط ، مما يسمح فقط باكتشاف مجموعة محدودة من العلامات. علاوة على ذلك ، فإن هذه اللوحات محدودة بتداخل الإشارة بين الفلوروكروم. يستخدم CyTOF أجساما مضادة مترافقة مع النظائر المعدنية ، والتي تتم قراءتها بواسطة قياس الطيف الكتلي لوقت الرحلة ، مما يقلل بشكل كبير من الامتداد بين القنوات.
مثلنا ، لجأ باحثون آخرون إلى CyTOF لدراسة الخلايا القاتلة الطبيعية9،10،11،12،13،14 ، على الرغم من وجود عدد أقل من علامات الخلايا القاتلة الطبيعية بشكل عام ، مما يقلل من عمق التنميط الظاهري. في حين أن بروتوكولات التلوين العامة التي تستخدمها هذه المجموعات مماثلة لبروتوكولاتنا ، إلا أن هناك بعض الاختلافات الرئيسية. لا تتضمن البروتوكولات الأخرى عزل الخلايا القاتلة الطبيعية قبل التلوين على الرغم من أن الباحثين مهتمون فقط بهذه المجموعة الفرعية13،14. بالنظر إلى أن الخلايا القاتلة الطبيعية تشكل فقط 5-20٪ من خلايا الدم المحيطية أحادية النواة (PBMCs) ، فإن تلطيخ PBMCs الكاملة بدلا من الخلايا القاتلة الطبيعية المعزولة يعني أن معظم الأحداث التي تم جمعها لن تكون خلايا NK. هذا يقلل من كمية البيانات التي تم إنشاؤها على المجموعة الفرعية ذات الاهتمام ويؤدي إلى الاستخدام غير الفعال لوقت الماكينة. بالإضافة إلى ذلك ، في حين أن العديد من هذه اللوحات تستجوب التعبير عن مستقبلات الخلايا القاتلة مثل المستقبلات الشبيهة ب Ig القاتلة (KIRs) و NKG2A / C / D ومستقبلات السمية الخلوية الطبيعية (NKp30 و NKp44 و NKp46) ، لا يتم وضع التعبير عن هذه العلامات في سياق أوسع بسبب عدم وجود بيانات حول التعبير عن الروابط الخاصة بها. وبالتالي ، في حين أن هذه الطرق المنشورة سابقا للتحقيق في خلايا NK عبر CyTOF كافية للتنميط الظاهري للخلايا القاتلة الطبيعية ، المستخدمة بمعزل عن بعضها البعض ، إلا أنها لا تستطيع تقديم صورة شاملة لنشاط الخلايا القاتلة الطبيعية. يقودنا هذا إلى الميزة الرئيسية للطرق الموضحة هنا ، وهي أنه حتى هذه اللحظة لا يوجد قياس التدفق الخلوي المنشور أو لوحات CyTOF التي تركز على استكشاف التعبير عن الروابط لمستقبلات الخلايا القاتلة الطبيعية. الأهم من ذلك ، أن لوحة الترابط الخاصة بنا تحتوي على العديد من القنوات المفتوحة للسماح بإضافة علامات لتناسب الاحتياجات الفريدة لكل تجربة.
بالنظر إلى أن أحد القيود الرئيسية ل CyTOF هو عدم القدرة على استعادة العينة بعد التحليل ، فقد لا تكون هذه الطريقة مناسبة للباحثين الذين لديهم عينات محدودة يهتمون بها بإجراء تجارب إضافية. بالإضافة إلى ذلك ، تعني طبيعة الإنتاجية المنخفضة ل CyTOF أن البيانات التي تم إنشاؤها ستكون ذات جودة رديئة إذا كان عدد الخلايا منخفضا. باستثناء هذين القيدين ، ستعمل هذه الطريقة بشكل جيد في أي إعداد للتحقيق في تفاعلات المستقبلات والترابط بين الخلايا القاتلة الطبيعية والخلايا المستهدفة.
Protocol
تم الحصول على PBMCs البالغين الأصحاء مجهولي المصدر من غرف نظام تقليل الصبغة التي تم شراؤها من مركز ستانفورد للدم. تم الحصول على PBMCs من متبرعين أصحاء من الأطفال ومرضى حمى الضنك الحادة لدى الأطفال من معهد جورجاس التذكاري للدراسات الصحية في مدينة بنما ، بنما والمستشفيات التابعة لوزارة الصحة ، ونظام الضمان الاجتماعي في مدينة بنما ، ومناطق الضواحي. تمت الموافقة على بروتوكول دراسة حمى الضنك من قبل IRB لمستشفى ديل نينيو (CBIHN-M-0634) ، ثم تمت الموافقة عليه من قبل لجان ICGES و CSS ومستشفى سانتو توماس وجامعة ستانفورد. تم الحصول على PBMCs من المرضى المصابين بفيروس العوز المناعي البشري الذين يتلقون العلاج المضاد للفيروسات القهقرية من دراسة ACTG A5321.
1. وضع العلامات على الأجسام المضادة ، وإعداد اللوحة ، والتخزين
- وضع العلامات على الأجسام المضادة بالنظائر المعدنية
ملاحظة: لزيادة التوحيد القياسي بين التجارب للتلوين ، يوصى بإجراء اقترانات متعددة لكل جسم مضاد ثم دمج المنتجات في مزيج رئيسي واحد للتخزين طويل الأجل كما هو موضح أدناه.- حدد تركيز كل جسم مضاد عن طريق قياس الامتصاص عند 280 نانومتر قبل الاقتران. الأجسام المضادة المستخدمة لهذا البروتوكول متاحة تجاريا وتم شراؤها من البائعين المدرجين في جدول المواد.
- قم بتسمية الأجسام المضادة بالنظائر المعدنية باستخدام مجموعات ملصقات الأجسام المضادة المتوفرة تجاريا وفقا لتعليمات الشركة المصنعة. استخدم 100 ميكروغرام من الجسم المضاد لكل تفاعل.
- حدد التركيز النهائي للجسم المضاد المسترد عن طريق قياس الامتصاص عند 280 نانومتر. تخزين الأجسام المضادة على المدى القصير عند 4 درجات مئوية.
- معايرة الأجسام المضادة
ملاحظة: تقنية CyTOF حساسة للغاية للإشارات الملوثة المحتملة من المعادن البيئية. لذلك ، يجب تحضير جميع المخازن المؤقتة / الكواشف المستخدمة بالماء عالي النقاء وتخزينها في عبوات بلاستيكية أو زجاجية لم يتم غسلها بالصابون.- إعداد أنابيب الطرد المركزي لكل متبرع تحتوي على 9 مل من RPMI الدافئ الكامل (RPMI 1640 ، 10٪ FBS ، 1٪ L-glutamine ، 1٪ بنسلين / ستربتومايسين) و 20 ميكرولتر من البنزوناز لكل قارورة من PBMCs المراد إذابتها. قم بإذابة PBMCs في حمام مائي وأضفها إلى الأنابيب.
ملاحظة: يقلل البنزوناز من اللزوجة والخلفية من الحمض النووي الحر من الخلايا المحللة. - جهاز طرد مركزي عند 300 × جم في درجة حرارة الغرفة لمدة 5 دقائق. قم بإعادة تعليق PBMCs في 5 مل من وسائط RPMI الكاملة والعد.
- لكل معايرة بالتحليل الحجمي ، قم بوضع 2-4 ملايين PBMCs / بئر في 6 آبار من صفيحة مستديرة القاع ذات 96 بئرا (بئر واحد لكل عيار وواحد غير ملطخ). جهاز الطرد المركزي للوحة عند 600 × جم في درجة حرارة الغرفة لمدة 3 دقائق. انقر فوق اللوحة لإزالة المادة الطافية. أعد تعليق كل بئر في 200 ميكرولتر من CyPBS.
- قم بإجراء تلطيخ جدوى سيسبلاتين كما هو موضح أدناه.
ملاحظة: يستخدم سيسبلاتين للتمييز بين الخلايا الحية والميتة في قياس الكتلة الخلوية.- قم بتعليق الخلايا في 100 ميكرولتر من مخزون سيسبلاتين 25 ميكرومتر. احتضن في درجة حرارة الغرفة لمدة 1 دقيقة.
- قم بإخماد تفاعل السيسبلاتين بإضافة 100 ميكرولتر من FBS إلى كل بئر والخلط. جهاز طرد مركزي ونقر اللوحة.
ملاحظة: قم بتنفيذ جميع خطوات الطرد المركزي اللاحقة عند 4 درجات مئوية. - اغسل الخلايا مرتين ب 200 ميكرولتر من CyFACS (1x PBS بدون ملوثات المعادن الثقيلة في ماء فائق النقاء مع 0.1٪ BSA ، 0.05٪ أزيد الصوديوم). جهاز طرد مركزي ونفض الغبار على اللوحة في كل مرة.
- قم بمعايرة لوحة الأجسام المضادة السطحية كما هو موضح أدناه.
ملاحظة: يجب عمل خلطات رئيسية منفصلة للوحة سطح NK ولوحة الترابط.- قم بعمل مزيج رئيسي من جميع الأجسام المضادة السطحية بتركيز 10 ميكروغرام / مل باستخدام CyFACS. استهدف الحجم النهائي 150 ميكرولتر. قم بعمل تخفيفات تسلسلية 1: 2 باستخدام CyFACS ، للحصول على التركيزات التالية: 10 و 5 و 2.5 و 1.25 و 0.625 ميكروغرام / مل.
- قم بتصفية كوكتيلات الأجسام المضادة من خلال وحدة مرشح الطرد المركزي (حجم المسام 0.1 ميكرومتر) عند 10,600 × جم لمدة 3 دقائق قبل التلوين.
- أعد تعليق الخلايا المطلية في 50 ميكرولتر من كوكتيل الأجسام المضادة السطحية عند العيار المعني. أعد تعليق البئر غير الملوثة في CyFACS. احتضان عند 4 درجات مئوية لمدة 30 دقيقة.
- اغسل الخلايا ب 150 ميكرولتر من CyFACS. جهاز طرد مركزي ونقر اللوحة.
- اغسل الخلايا ب 200 ميكرولتر من CyFACS. جهاز طرد مركزي ونقر اللوحة.
- قم بتثبيت الخلايا عن طريق إعادة تعليق كل بئر في 100 ميكرولتر من 2٪ بارافورمالدهيد (PFA) في CyPBS. احتضن الطبق في درجة حرارة الغرفة في الظلام لمدة 20 دقيقة. اغسل الخلايا ب 100 ميكرولتر من CyFACS. جهاز طرد مركزي بحجم 700 × جم لمدة 5 دقائق.
تنبيه: يشتبه في أن PFA يسبب عيوبا وراثية وكذلك السرطان. بالإضافة إلى ذلك ، فهو ضار إذا لامس العينين أو الجلد أو تم استنشاقه تعامل بشكل مناسب عن طريق ضمان التهوية الجيدة ، وفتح الوعاء بعناية ، ومنع تكون الهباء الجوي.
ملاحظة: يتم إجراء جميع دورات أجهزة الطرد المركزي اللاحقة عند 700 × جم لمدة 5 دقائق عند 4 درجات مئوية. - نفاذية الخلايا عن طريق إعادة تعليق 200 ميكرولتر من 1x النفاذية العازلة (المخزن المؤقت بيرم) المخفف في ماء فائق النقاء. جهاز طرد مركزي ونقر اللوحة. اغسل الخلايا ب 200 ميكرولتر من المحلول المؤقت بيرم. جهاز طرد مركزي ونقر اللوحة.
ملاحظة: الحضانة في المخزن المؤقت Perm ليست ضرورية. - معايرة لوحة الأجسام المضادة داخل الخلايا
- اصنع مزيجا رئيسيا من جميع الأجسام المضادة داخل الخلايا بتركيز 10 ميكروغرام / مل باستخدام Perm Buffer. اهدف إلى حجم نهائي يبلغ 150 ميكرولتر. قم بعمل تخفيفات تسلسلية 1: 2 باستخدام Perm Buffer للحصول على التركيزات التالية: 10 و 5 و 2.5 و 1.25 و 0.625 ميكروغرام / مل.
- قم بتصفية كوكتيلات الأجسام المضادة من خلال وحدة مرشح الطرد المركزي (حجم المسام 0.1 ميكرومتر) عند 10,600 × جم لمدة 3 دقائق قبل التلوين.
- أعد تعليق الخلايا المطلية في 50 ميكرولتر من كوكتيل الأجسام المضادة داخل الخلايا عند العيار المعني. أعد تعليق البئر غير الملوثة في Perm Buffer. احتضان عند 4 درجات مئوية لمدة 45 دقيقة.
ملاحظة: إذا لم يتم معايرة اللوحة داخل الخلايا ، فأعد تعليق الآبار في 50 ميكرولتر من المخزن المؤقت بيرم. - اغسل الخلايا ب 150 ميكرولتر من المخزن المؤقت بيرم. جهاز طرد مركزي ونقر اللوحة.
- اغسل الخلايا ب 200 ميكرولتر من المحلول المؤقت بيرم. جهاز طرد مركزي ونقر اللوحة.
- اغسل الخلايا مرتين ب 200 ميكرولتر من CyFACS. جهاز طرد مركزي ونقر اللوحة.
- تلطيخ الحمض النووي
ملاحظة: يرتبط Intercalator بالحمض النووي الخلوي ويستخدم لتحديد الخلايا المنواة في قياس الكتلة الخلوية.- أعد تعليق الخلايا في 200 ميكرولتر من intercalator مخفف 1: 10,000 في CyPBS و 2٪ PFA. احتضان الطبق طوال الليل عند 4 درجات مئوية.
- قم بتخزين الأطباق ، إذا لزم الأمر ، على حرارة 4 درجات مئوية مغطاة بغشاء البارافين لمدة تصل إلى أسبوع.
ملاحظة: قم بتنفيذ جميع خطوات أجهزة الطرد المركزي اللاحقة عند 700 × جم لمدة 5 دقائق عند 4 درجات مئوية. - قبل تشغيل العينات على CyTOF ، قم بإزالة فيلم البارافين من اللوحة وجهاز الطرد المركزي عند 700 × جم لمدة 5 دقائق عند 4 درجات مئوية. انقر فوق اللوحة. اغسل الخلايا مرة واحدة باستخدام 200 ميكرولتر من CyFACS. جهاز طرد مركزي ونقر اللوحة.
- اغسل الخلايا ثلاث مرات ب 200 ميكرولتر من الماء فائق النقاء. جهاز طرد مركزي ونقر اللوحة. أعد تعليق الخلايا في 200 ميكرولتر من الماء فائق النقاء. مباشرة قبل تشغيل العينة ، اضبط التركيز على حوالي 6 × 105 خلايا / مل في حبات التطبيع المخففة إلى تركيز 1x في الماء عالي النقاء.
- قم بتشغيل العينات على CyTOF.
- قم بتحليل البيانات واختيار العيارات المناسبة لكل جسم مضاد عن طريق اختيار أقل عيار للأجسام المضادة مما ينتج عنه أعلى شدة إشارة وأفضل فصل بين المجموعات السكانية الإيجابية والسلبية بناء على التقييم البصري.
ملاحظة: يتم عرض المعايرة بالتحليل الحجمي للوحتين NK واللوحين الترابط في الشكل 1 والشكل 2 على التوالي. إذا لم يتم تحديد تمييز واضح بين المجموعات السكانية الإيجابية والسلبية، فيمكن تقييم العيارات على أنواع متعددة من الخلايا أو على خطوط الخلايا، للسماح بتحديد مجموعات الخلايا الإيجابية والسلبية. - تخزين لوحة الأجسام المضادة
- اجمع بين الأجسام المضادة الممعايرة في مزيج رئيسي وقم بالتصفية من خلال وحدة فلتر حقنة معقمة 0.1 ميكرومتر. يجب عمل خلطات رئيسية منفصلة للوحة سطح NK ، واللوحة داخل الخلايا NK ، ولوحة الترابط.
- لتخزين الألواح على المدى الطويل ، اتبع أحد الخيارين المقبولين:
- أرسل المزيج الرئيسي إلى شركة خارجية للتجميد بالتجميد. يتم إستخدام هذه الطريقة للوحة NK. لا يمكن تجميد الأجسام المضادة غير المترافقة في المنزل ، بسبب وجود مثبت الأجسام المضادة ، مما يتداخل مع عملية التجميد بالتجميد. تضاف هذه الأجسام المضادة إلى اللوحة في يوم التلوين.
- استخدم ماصة مكرر لعمل 50 ميكرولتر من كل مزيج رئيسي وتخزينها عند -80 درجة مئوية.
- إعداد أنابيب الطرد المركزي لكل متبرع تحتوي على 9 مل من RPMI الدافئ الكامل (RPMI 1640 ، 10٪ FBS ، 1٪ L-glutamine ، 1٪ بنسلين / ستربتومايسين) و 20 ميكرولتر من البنزوناز لكل قارورة من PBMCs المراد إذابتها. قم بإذابة PBMCs في حمام مائي وأضفها إلى الأنابيب.
2. بروتوكول تلطيخ
- قم بإذابة خلايا الدم المحيطية أحادية النواة (PBMCs) كما هو موضح في الخطوتين 1.2.1 و 1.2.2. خصص ما لا يقل عن 1 مليون PBMCs لتلوين لوحة الترابط في أنبوب طرد مركزي سعة 15 مل. احتفظ ب PBMCs هذه على الجليد أثناء عزل الخلايا القاتلة الطبيعية.
- عزل الخلايا القاتلة الطبيعية
ملاحظة: خطوات عزل الخلايا القاتلة الطبيعية التالية هي نسخة معدلة من بروتوكول مورد معين. ومع ذلك ، فإن أي مجموعة أو بروتوكول يقوم باختيار سلبي مغناطيسي لخلايا NK سيكون بديلا مناسبا. بالإضافة إلى ذلك ، هذه الخطوة اختيارية لأن هذا البروتوكول مناسب أيضا للتنميط الظاهري لخلايا NK من PBMCs بأكملها.- قم بتدوير PBMCs المتبقية عند 450 × جم لمدة 5 دقائق. أعد تعليق حبيبات الخلية في 40 ميكرولتر من المخزن المؤقت MACS (PBS ، 0.5٪ BSA ، 2 ملي مولار EDTA) لكل 107 خلايا إجمالية.
- أضف 10 ميكرولتر من كوكتيل البيوتين والأجسام المضادة للخلايا القاتلة الطبيعية لكل 107 خلايا إجمالية. تخلط جيدا وتحتضن لمدة 5 دقائق على الثلج.
- أضف 30 ميكرولتر من المخزن المؤقت MACS لكل 10 7خلايا إجمالية و 20 ميكرولتر من كوكتيل MicroBead للخلايا القاتلة الطبيعية لكل 107 خلايا إجمالية. تخلط جيدا وتحتضن لمدة 10 دقائق على الثلج.
- قم بإعداد أعمدة الشطف عن طريق الشطف ب 500 ميكرولتر من المخزن المؤقت MACS. أضف 2 مل من RPMI الكامل البارد إلى أنابيب تجميع 15 مل.
- أضف المخزن المؤقت MACS إلى الأنابيب التي تحتوي على خلايا لرفع الحجم إلى 500 ميكرولتر. اشطف الأنبوب ب 500 ميكرولتر أخرى من المخزن المؤقت MACS وانقله إلى العمود.
- بعد توقف التدفق ، اشطف عمود الشطف باستخدام 500 ميكرولتر من MACS المخزن المؤقت مرتين. بعد توقف التدفق ، عد الخلايا القاتلة الطبيعية.
- لوحة وغسل الخلايا.
- عزلت أجهزة الطرد المركزي الخلايا القاتلة الطبيعية و PBMCs عند 300 × جم في درجة حرارة الغرفة لمدة 10 دقائق. قم بتعليق الخلايا بتركيز 5 ملايين خلية/مل في CyPBS (1x PBS بدون ملوثات المعادن الثقيلة في المياه فائقة النقاء). خلايا الصفيحة في صفيحة U ذات قاع 96 بئر.
ملاحظة: يمكن لكل حصة من لوحة الخلايا القاتلة الطبيعية أن تلطخ ما يصل إلى 3 ملايين خلية. إذا تم ترميز ست عينات من الخلايا القاتلة الطبيعية وتجميعها قبل تلطيخها ، فيجب ألا يتجاوز العدد الإجمالي الإجمالي لخلايا NK 3 ملايين. يمكن للوحة الترابط تلطيخ ما يصل إلى 6 ملايين PBMCs لكل عينة. إذا تم ترميز ست عينات فردية وتجميعها قبل تلطيخها ، فيجب ألا يتجاوز العدد الإجمالي الإجمالي لثنائيات PBMCs 6 ملايين. - لوحة الطرد المركزي عند 600 × جم في درجة حرارة الغرفة لمدة 3 دقائق. انقر فوق اللوحة لإزالة المادة الطافية.
ملاحظة: قم بإجراء جميع دورات أجهزة الطرد المركزي اللاحقة عند 600 × جم لمدة 3 دقائق حتى الخطوة 2.7. - أعد تعليق الخلايا في 200 ميكرولتر من CyPBS. جهاز طرد مركزي ونقر اللوحة.
- عزلت أجهزة الطرد المركزي الخلايا القاتلة الطبيعية و PBMCs عند 300 × جم في درجة حرارة الغرفة لمدة 10 دقائق. قم بتعليق الخلايا بتركيز 5 ملايين خلية/مل في CyPBS (1x PBS بدون ملوثات المعادن الثقيلة في المياه فائقة النقاء). خلايا الصفيحة في صفيحة U ذات قاع 96 بئر.
- قم بإجراء تلطيخ جدوى سيسبلاتين كما هو موضح في الخطوة 1.2.4.
- تلطيخ الباركود
ملاحظة: تستخدم هذه اللوحات جنبا إلى جنب مع طريقة ترميز شريطية معدلة من اثنين من أربعة قائمة على البلاديوم على الخلايا الحية غير الثابتة لتقليل تأثيرات الدفعات وزيادة استعادة الخلية15. ومع ذلك ، فإن هذه الخطوة اختيارية لأن الترميز الشريطي ليس ضروريا للحصول على بيانات عالية الجودة.- أعد تعليق كل بئر في 50 ميكرولتر من الباركود المخلوط مسبقا واحتضانه عند 4 درجات مئوية لمدة 30 دقيقة. اغسل الخلايا ب 150 ميكرولتر من CyFACS. جهاز طرد مركزي ونقر اللوحة.
- اغسل الخلايا مرتين ب 200 ميكرولتر من CyFACS. جهاز طرد مركزي ونقر اللوحة. أعد تعليق جميع الآبار في 30 ميكرولتر من CyFACS. اجمع ما يصل إلى ستة آبار من الخلايا الملطخة برموز شريطية فريدة في بئر واحد وقم بإجراء الطرد المركزي ونقر اللوحة.
- تلطيخ السطح
- قم بإذابة الغلاف الليوسفير للوحة NK السطحي في 50 ميكرولتر من CyFACS مع الأجسام المضادة السطحية الإضافية (مضاد ل CD16 ، مضاد HLA-DR ، مضاد ل LILRB1). قم بإذابة الجليد في لوحة الترابط المخزنة عند -80 درجة مئوية وقم بتدوير الأنبوب باستخدام جهاز طرد مركزي صغير. ارتفاع في علامات سطح لوحة الترابط الإضافية (مضاد ل CD16 ، مضاد ل CD19).
ملاحظة: يجب ترشيح أي كوكتيل أجسام مضادة لم يتم ترشيحه مسبقا (أي قبل التجميد أو التجميد) من خلال وحدة مرشح الطرد المركزي (حجم المسام 0.1 ميكرومتر) عند 10,600 × جم لمدة 3 دقائق قبل التلوين. - أعد تعليق كل بئر في 50 ميكرولتر من اللوحة المعنية. احتضان عند 4 درجات مئوية لمدة 30 دقيقة. اغسل الخلايا ب 150 ميكرولتر من CyFACS. جهاز طرد مركزي ونقر اللوحة. اغسل الخلايا مرة أخرى ب 200 ميكرولتر من CyFACS. جهاز طرد مركزي ونقر اللوحة.
- قم بإذابة الغلاف الليوسفير للوحة NK السطحي في 50 ميكرولتر من CyFACS مع الأجسام المضادة السطحية الإضافية (مضاد ل CD16 ، مضاد HLA-DR ، مضاد ل LILRB1). قم بإذابة الجليد في لوحة الترابط المخزنة عند -80 درجة مئوية وقم بتدوير الأنبوب باستخدام جهاز طرد مركزي صغير. ارتفاع في علامات سطح لوحة الترابط الإضافية (مضاد ل CD16 ، مضاد ل CD19).
- إصلاح الخلايا كما هو موضح في الخطوة 1.2.6.
ملاحظة: قم بإجراء جميع دورات أجهزة الطرد المركزي اللاحقة عند 700 × جم لمدة 5 دقائق عند 4 درجات مئوية. - تخلل الخلايا كما هو موضح في الخطوة 1.2.7.
- تلطيخ داخل الخلايا
- قم بإذابة الطبقة الليوسفيرية للوحة NK داخل الخلايا في 50 ميكرولتر من المخزن المؤقت بيرم. قم بإعداد كوكتيل الأجسام المضادة داخل الخلايا لعينات PBMC إذا رغبت في ذلك.
ملاحظة: يجب ترشيح أي كوكتيل أجسام مضادة لم يتم ترشيحه مسبقا (أي قبل التجميد أو التجميد) من خلال وحدة مرشح الطرد المركزي (حجم المسام 0.1 ميكرومتر) عند 10,600 × جم لمدة 3 دقائق قبل التلوين. - أعد تعليق الآبار في 50 ميكرولتر من الألواح داخل الخلايا المعنية. إذا لم يتم استخدام لوحة داخل الخلايا جنبا إلى جنب مع لوحة سطح الترابط ، فقم بإعادة تعليق آبار PBMC في 50 ميكرولتر من المخزن المؤقت Perm. احتضان عند 4 درجات مئوية لمدة 45 دقيقة.
- اغسل الخلايا ب 150 ميكرولتر من المخزن المؤقت بيرم. جهاز طرد مركزي ولوحة نفض الغبار اغسل الخلايا ب 200 ميكرولتر من المحلول المؤقت بيرم. جهاز طرد مركزي ونقر اللوحة.
- اغسل الخلايا مرتين ب 200 ميكرولتر من CyFACS. جهاز طرد مركزي ونقر اللوحة.
- قم بإذابة الطبقة الليوسفيرية للوحة NK داخل الخلايا في 50 ميكرولتر من المخزن المؤقت بيرم. قم بإعداد كوكتيل الأجسام المضادة داخل الخلايا لعينات PBMC إذا رغبت في ذلك.
- تلطيخ الحمض النووي. قم بإجراء تلطيخ محترم الحمض النووي كما هو موضح في الخطوة 1.2.9.1. احتضان الطبق طوال الليل عند 4 درجات مئوية.
ملاحظة: يرتبط Intercalator بالحمض النووي الخلوي ويستخدم لتحديد الخلايا المنواة في قياس الكتلة الخلوية. يمكن تخزين الأطباق مغطاة بغشاء البارافين لمدة تصل إلى أسبوع عند 4 درجات مئوية. - قبل تشغيل العينات على CyTOF ، اغسل الخلايا كما هو موضح في الخطوتين 1.2.9.3 و 1.2.9.4.
- قم بتشغيل العينات على CyTOF.
النتائج
تم اقتران الأجسام المضادة مع النظائر المعدنية باستخدام مجموعات الملصقات المتاحة تجاريا ، وفقا لتعليمات الشركة المصنعة. تم التحقق من صحة استنساخ الأجسام المضادة عن طريق قياس التدفق الخلوي وقياس الكتلة الخلوية قبل استخدامها في هذه اللوحة. تم اختيار قائمة أولية من المستنسخة بناء على مراجعة الأدبيات وتوافر الأجسام المضادة. مستويات التعبير عن بعض الروابط لمستقبلات الخلايا القاتلة الطبيعية منخفضة أو لا يمكن اكتشافها على PBMCs السليمة. لذلك ، تم التحقق من صحة التلوين الإيجابي لبعض الأجسام المضادة عن طريق تلطيخ PBMCs السليمة ، أو خلايا سرطان الدم النخاعي المزمن K562 ، أو خلايا ابيضاض الدم الليمفاوي الحاد NALM6 ، أو خلايا ابيضاض الدم الليمفاوي الحاد للخلايا البائية 697 خلية (الشكل التكميلي 1). تم استبدال المستنسخة المختارة للوحة الخلايا القاتلة الطبيعية والتي لم تنتج بقعة كافية أو كانت باهظة الثمن بأخرى مختلفة ، كما هو مفصل في الجدول التكميلي 1 والموضحة في الشكل التكميلي 2.
تم إجراء إقران النظائر المعدنية مع الأجسام المضادة لهذه الألواح باستخدام المبادئ التي حددها Takahashi et al.16. كانت علامات النسب متوسطة إلى عالية الكثافة. وبالتالي ، تم اقترانها بشكل أساسي مع كتل منخفضة ومتوسطة الحساسية تاركة كتل عالية الحساسية متاحة للاقتران مع الأجسام المضادة ضد علامات معتمة التعبير على. تم استخدام برنامج مصمم لوحة متاح للجمهور للكشف عن مشكلات حساسية الوفرة (نزيف M ± 1) أو الأكسدة (نزيف M + 16) وأعيد تعيين أزواج الأجسام المضادة والمعادن وفقا لذلك. بالإضافة إلى ذلك ، تم اقتران العديد من العلامات على معادن مختلفة مع الحد الأدنى من الاختلافات التي لوحظت في شدة الإشارة (الجدول التكميلي 2 والشكل التكميلي 3). يتم سرد أزواج الأجسام المضادة والمعادن ومعلومات الاستنساخ لألواح NK و ligand في الجدول 1 والجدول 2 على التوالي.
تم معايرة الأجسام المضادة المترافقة الداخلية على PBMCs بخمسة عيار مختلفة: 0.625 و 1.25 و 2.5 و 5 و 10 ميكروغرام / مل. تم اختيار أدنى عيار للأجسام المضادة مما أدى إلى أعلى شدة إشارة وأفضل فصل بين المجموعات السكانية الإيجابية والسلبية بناء على التقييم البصري. يتم عرض المعايرة بالتحليل الحجمي للوحتين NK واللوحين الترابط في الشكل 1 والشكل 2 على التوالي. بالنسبة لبعض العلامات ، لم يتم تحديد تمييز واضح بين المجموعات السكانية الإيجابية والسلبية ، نظرا لأن العلامة معبرا بشكل خافت أو إيجابية عالميا. لتحديد التخفيف الأكثر دقة لهذه الأجسام المضادة ، تم تقييم العيارات على أنواع متعددة من الخلايا (PBMCs ، أو الخلايا التائية ، أو الخلايا البائية ، أو الخلايا القاتلة الطبيعية) ، أو على خطوط الخلايا ، للسماح بتحديد مجموعات الخلايا الإيجابية والسالبة (الشكل التكميلي 4). لم يتم حساب مؤشر التلوين (SI) لكل علامة لأن هذا المقياس لا ينطبق على بيانات CyTOF17،18.
تم تصميم اللوحات الموضحة هنا لتكون متوافقة مع ترميز الشريط العينة. هناك العديد من طرق الترميز الشريطي المتاحة ل CyTOF. الأكثر استخداما هي مجموعة قائمة على البلاديوم متوفرة تجاريا ، والتي تتطلب التثبيت قبل الترميز الشريطي ، وطريقة الترميز الشريطي المستندة إلى CD45 التي وصفها Mei et al.15 ، والتي تسمح بالترميز الشريطي للخلايا الحية. لتقييم طريقة الترميز الشريطي التي تناسب احتياجاتنا بشكل أفضل ، اختبرنا استقرار تلطيخ علامة الخلايا القاتلة الطبيعية بعد التثبيت في إصدار مبكر من لوحة الخلايا القاتلة الطبيعية (الشكل التكميلي 5). وجدنا أن التعبير عن غالبية علامات الخلايا القاتلة الطبيعية تأثر بالتثبيت. وبالتالي ، قررنا استخدام طريقة تشفير شريطي معدلة من اثنين من أربعة ، قائمة على CD45 على الخلايا الحية15. تستخدم طريقة الترميز الشريطي هذه 102Pd و 104Pd و 106Pd و 108Pd ، وتختلف عن طريقة ثلاثة من ستة التي وصفها في الأصل Mei et al. ، والتي استخدمت 104Pd و 106Pd و 108Pd و 110Pd و 113In و 115In. لم يتم تضمين قنوات الإنديوم في مخطط الترميز الشريطي الخاص بنا ، لأنها تداخلت مع الإشارة من 115In-CD3. 110لم يتم تضمين Pd لأنه تداخل مع الإشارة من HLA-DR Qdot و CD19 Qdot في خلية NK ولوحات الترابط ، على التوالي.
على الرغم من أننا نوصي بتنقية الخلايا القاتلة الطبيعية قبل التلوين ، إلا أن لوحة الخلايا القاتلة الطبيعية مصممة للسماح بالتنميط الظاهري لخلايا NK من PBMCs الكاملة. يظهر مثال على استراتيجية بوابات الخلايا القاتلة الطبيعية الخاصة بنا في الشكل 3 أ باستخدام PBMCs من متبرع سليم. يتم عرض تلطيخ وبوابات كل من علامات NK على خلايا NK السليمة والمعزولة في الشكل 3 ب. تم تصميم لوحة الترابط للكشف عن التعبير عن روابط الخلايا القاتلة الطبيعية على PBMCs بأكملها. يوضح الشكل 4 أ استراتيجية البوابات المستخدمة لتحديد خلايا CD4 + T وخلايا CD8 + T والخلايا NK والخلايا الوحيدة وخلايا CD19 + B في PBMCs من متبرع سليم. تظهر أمثلة تلطيخ تمثيلية لكل ليجند في الشكل 4 ب باستخدام PBMCs من مرضى حمى الضنك الحادة والأفراد المصابين بفيروس نقص المناعة البشرية الذين تم قمعهم فيروسيا.
لضمان استقرار اللوحة بمرور الوقت ، يتضمن بروتوكولنا خيارين محتملين: التجميد من خلال شركة خارجية إلى خرز يستخدم مرة واحدة أو تجميد الحصص المعدة مسبقا عند -80 درجة مئوية. بالنسبة لهذا البروتوكول ، تم تجميد لوحة NK ، وتم تجميد لوحة الترابط. تم التحقق من صحة كلتا الطريقتين قبل استخدام كل لوحة على العينات السريرية.
أنتجنا أكثر من 700 تفاعل للوحة NK من مزيج رئيسي واحد عن طريق إجراء اقترانات متعددة لكل جسم مضاد في اللوحة. بعد التحقق من صحة كل جسم مضاد مترافق ومعايرة بالتحليل الحجمي ، تم دمج الأجسام المضادة في مزيج رئيسي ، وتمت ترشيحها من خلال وحدة مرشح حقنة معقمة 0.1 ميكرومتر ، وإرسالها إلى شركة خارجية للتجميد بالتجميد. تم صنع مجموعتين من الغلاف الليوسفير أحادي البقعة ، واحدة لتلوين السطح ، والأخرى للتلوين داخل الخلايا. لا يمكن إضافة الأجسام المضادة غير المترافقة داخليا (HLA-DR و CD16) إلى الغلاف الليوسفير ، بسبب وجود مثبت الأجسام المضادة ، والذي يتداخل مع عملية التجميد بالتجميد. تضاف هذه الأجسام المضادة إلى اللوحة في يوم التلوين. تظهر مقارنة بين البقع التي تم الحصول عليها قبل وبعد التجميد في الشكل التكميلي 6. لم ينتج عن استنساخ الجسم المضاد LILRB1 المستخدم في البداية في الغلاف الليوسفير بقعة قوية بما فيه الكفاية (الجدول التكميلي 1 والشكل التكميلي 2). تم تحديد استنساخ أفضل لاحقا واقترافه وإضافته إلى اللوحة في يوم التلوين (الجدول 1). لوحظ أن الجسم المضاد متعدد النسيلة KIR2DS2 المستخدم في lyopsheres ينتج صبغة غير محددة بعد التجفيد ولا نوصي باستخدامه في التحليلات اللاحقة (الجدول التكميلي 1 والشكل التكميلي 2). زادت شدة معظم البقع داخل الخلايا بشكل طفيف بعد التجميد (الشكل التكميلي 6).
قبل تخزين المزيج الرئيسي للوحة الترابط عند -80 درجة مئوية ، اختبرنا شرطين مختلفين للتخزين. قمنا بإعداد مزيج رئيسي أصغر من هذه اللوحة وقمنا بتخزين الحصص عند -80 درجة مئوية وفي النيتروجين السائل لمدة شهرين تقريبا. بعد شهرين قمنا بتلطيخ PBMCs بأكملها بالحصص المجمدة. قارنا تلطيخ بتلطيخ PBMCs من نفس المتبرع الملطخ باللوحة المعدة حديثا (الشكل التكميلي 7). وجدنا أن التخزين عند -80 درجة مئوية وفي النيتروجين السائل لا يغير شدة الإشارة لمعظم العلامات. في الواقع ، تكون شدة إشارة الفئة الأولى المضادة للعموم HLA ، ومضادة ل CD7 ، ومضادة ل CD4 ، ومضادة HLA-Bw4 ، ومضادة ل CD14 ، ومضادة ل CD11b ، ومضادة ل LFA-3 أعلى عند التجميد ، خاصة في حالة العينات المخزنة عند -80 درجة مئوية. لم نتمكن من تحديد ما إذا كانت شدة إشارة anti-LLT-1 ، وanti-Nectin-1 ، وanti-MICA / B ، وanti-DR4 / 5 ، وanti-ULBP-1،2،5،6 ، وanti-Nectin-2 ، وanti-CD155 ، وanti-B7-H6 قد تأثرت بالتجميد ، نظرا لحقيقة أن PBMCs السليمة لا تعبر عن مستويات عالية من هذه العلامات. ومع ذلك ، تم إجراء التحقق من صحة هذه العلامات على خطوط الخلايا (الشكل التكميلي 1) باستخدام الأجسام المضادة المترافقة المخزنة عند -80 درجة مئوية. وبالتالي ، كنا واثقين من أن التجميد لم ينتج عنه فقدان كبير للإشارة. انخفضت شدة الإشارة عند التجميد لخمس علامات: anti-CD8 ، وanti-ICAM-1 ، وanti-CCR2 ، وanti-CD33 ، وanti-CD56. ومع ذلك، في جميع هذه الحالات، لا يزال الفصل الواضح بين السكان الإيجابيين والسلبيين قائما. بالنظر إلى أن الأجسام المضادة المترافقة بالمعدن ليست مستقرة عند 4 درجات مئوية لفترات طويلة من الزمن ، كان التجميد ضروريا للحفاظ على استقرار اللوحة على المدى الطويل ، وعلى الرغم من انخفاض شدة التلوين في مجموعة فرعية من العلامات ، تمكنا من الاحتفاظ بفصل تلطيخ كاف. الأهم من ذلك ، أن فقدان شدة إشارة anti-CD8 و anti-CCR2 و anti-CD56 كان أكبر في العينات المخزنة في النيتروجين السائل مقارنة بتلك المخزنة عند -80 درجة مئوية. بناء على هذه البيانات ، قررنا تخزين اللوحة عند -80 درجة مئوية.
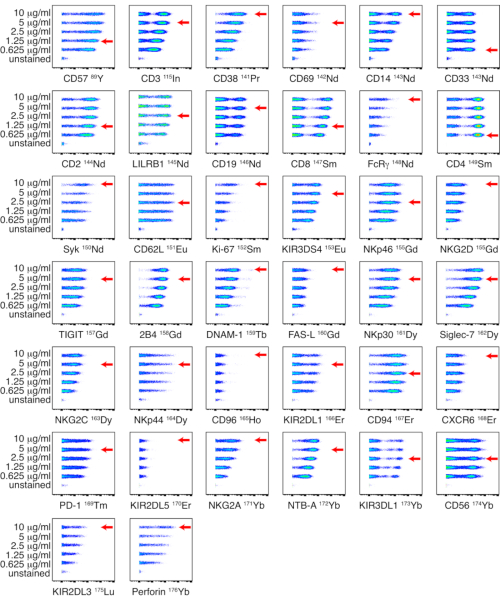
الشكل 1: معايرة الأجسام المضادة المترافقة الداخلية للوحة NK. تم إجراء معايرة الأجسام المضادة المترافقة داخليا على PBMCs من متبرع سليم باستخدام خمسة تركيزات مختلفة: 0.625 و 1.25 و 2.5 و 5 و 10 ميكروغرام / مل. تم تحديد عيار مضاد CD3 ، ومضاد CD14 ، ومضاد CD33 ، ومضاد CD19 ، ومضاد PD-1 ، ومضاد CD56 عن طريق البوابات على الخلايا الحية. تم تحديد عيار مضادات CD4 ومضاد CD8 عن طريق البوابات على الخلايا التائية. تم تحديد عيار الأجسام المضادة المتبقية عن طريق البوابات على الخلايا القاتلة الطبيعية. نظرا لعدم التعبير عن NKp44 على الخلايا القاتلة الطبيعية المريحة ، فقد تم تحديد العيارات على PBMCs المحفزة باستخدام IL-2 وعرضت على الخلايا القاتلة الطبيعية. تشير الأسهم الحمراء إلى العيار المحدد لكل جسم مضاد. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: معايرة الأجسام المضادة للوحة الترابط المترافقة الداخلية. تم إجراء معايرة الأجسام المضادة المترافقة داخليا على PBMCs من متبرع سليم باستخدام خمسة تركيزات مختلفة: 0.625 و 1.25 و 2.5 و 5 و 10 ميكروغرام / مل. تم تحديد عيار مضادات HLA-DR ، ومضاد ICAM-1 ، ومضاد CCR2 ، ومضاد CD14 ، ومضاد CD11b ، ومضاد LFA-3 عن طريق البوابات على خلايا CD3-CD7. تم تحديد عيار مضاد CD3 ، ومضاد HLA من الفئة الأولى ، ومضاد ل CD7 ، ومضاد ل CD48 ، ومضاد ل LLT-1 ، ومضاد ل HLA-C ، E ، ومضاد HLA-E ، ومضاد ل FasR ، ومضاد ل Nectin-1 ، ومضاد ل MICA / MICB ، ومضاد ل DR4 / DR5 ، ومضاد ULBP-1،2،5،6 ، ومضاد ل Nectin-2 ، ومضاد ل CD155 ، ومضاد ل HLA-Bw4 ، ومضاد ل HLA-Bw6 ، ومضاد ل CD33 ، ومضاد CD56 ، ومضاد B7-H6 عن طريق البوابات على الخلايا الحية. تم تحديد عيار مضاد CD4 ومضاد CD8 عن طريق البوابات على خلايا CD3 +. تشير الأسهم الحمراء إلى العيار المحدد لكل جسم مضاد. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
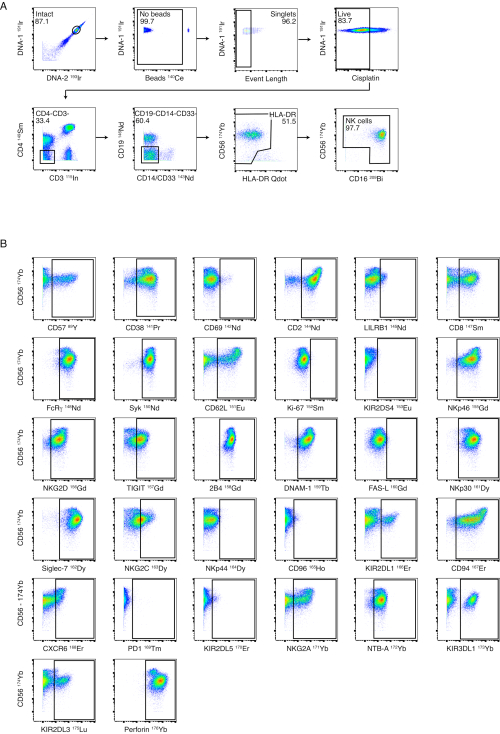
الشكل 3: استراتيجية وأداء بوابات لوحة NK. (أ) تظهر البوابات السلبية التسلسلية من PBMCs بأكملها إلى الخلايا القاتلة الطبيعية في متبرع سليم. تضمن البوابات السليمة والخرزية وطول الحدث بوابات ناجحة للخلايا المفردة. تم إجراء تلطيخ سيسبلاتين كبقعة حية / ميتة. تم استبعاد الخلايا التائية والخلايا البائية باستخدام CD3 و CD19. تم استبعاد الخلايا الوحيدة عن طريق البوابات السلبية على CD4 و CD14 / CD33 وعن طريق المزيد من البوابات السلبية للخلاياالساطعة CD56- / HLA-DR. تم استخدام CD56 و CD16 لتحديد مجموعات فرعية مختلفة من الخلايا القاتلة الطبيعية (CD56bright و CD56dim و CD56-). (ب) أمثلة على التعبير عن مستقبلات الخلايا القاتلة الطبيعية على الخلايا القاتلة الطبيعية من متبرع سليم واحد منقى عن طريق عزل الخرزة المغناطيسية. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4: بوابات لوحة الترابط والأداء. (أ) بوابات المجموعات الفرعية الرئيسية للخلايا المناعية من PBMCs المشتقة من متبرع سليم بعد التطبيع وإزالة حبة المعايرة وإزالة الباربار. (ب) التعبير عن الروابط لمستقبلات الخلايا القاتلة الطبيعية بالإضافة إلى العديد من العلامات النخاعية على PBMCs الحية. يظهر تلطيخ جميع الروابط باستثناء Nectin-1 و B7-H6 على PBMCs من مرضى حمى الضنك الحادة. يظهر تلطيخ Nectin-1 و B7-H6 على PBMCs من الأفراد المصابين بفيروس نقص المناعة البشرية الذين تم قمعهم فيروسيا. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
الشكل التكميلي 1: التحقق من استنساخ الأجسام المضادة للوحة الترابط على خطوط الخلايا. تم التحقق من صحة الأجسام المضادة ضد الروابط لمستقبلات الخلايا القاتلة الطبيعية التي يتم التعبير عنها بمستويات منخفضة على PBMCs السليمة عن طريق تلطيخ خطوط الخلايا. تم تلطيخ خلايا ابيضاض الدم النخاعي المزمن K562 بمضادات ICAM-1 ، ومضادة ل MICA / MICB ، ومضادة DR4 / DR5 ، ومضادة ل ULBP-1،2،5،6 ، ومضادة ل Nectin-2 ، ومضادة ل CD155 ، ومضادة ل B7-H6. تم تلطيخ خلايا ابيضاض الدم الليمفاوي الحاد NALM6 بمضادات LLT-1 والخلايا البائية سرطان الدم الليمفاوي الحاد للخلايا البائية ، وتم تلطيخ 697 خلية بمضادات النكتين -1. المخططات النقطية والرسوم البيانية التي تظهر تلطيخا على PBMCs الصحية باللون الأزرق. المخططات النقطية والرسوم البيانية التي تظهر تلطيخا على خط الخلية المعنية باللون الأحمر. يتم توفير النسبة المئوية لخلايا خط الخلية المعني الموجبة لعلامة معينة. الرجاء النقر هنا لتنزيل هذا الملف.
الشكل التكميلي 2: التحقق من صحة استنساخ الأجسام المضادة. (أ) تم اختبار استنساخ الأجسام المضادة المختلفة في متبرعين أصحاء لتحديد الاستنساخ بأفضل خصوصية. تظهر 2B4 و CXCR6 و KIR2DS4 و NKG2A و TIGIT على الخلايا القاتلة الطبيعية. يظهر CD56 و LILRB1 على الخلايا الحية. (ب) أظهر استنساخ الأجسام المضادة KIR2DS2 بقعة غير محددة بعد التجميد بالتجميد. يتم تقديم مثال على تلطيخ نفس المتبرع قبل وبعد التجميد بالتجميد. الرجاء النقر هنا لتنزيل هذا الملف.
الشكل التكميلي 3: تحسين أزواج الأجسام المضادة / المعادن. يظهر تلطيخ PBMCs من المتبرعين الأصحاء. (أ) تم اختبار أزواج الأجسام المضادة/المعدنية للوحة. (ب) أزواج الأجسام المضادة/المعادن المستخدمة في اللوحة. يظهر LILRB1 و PD1 على الخلايا الحية. تظهر جميع العلامات الأخرى على خلايا NK. الرجاء النقر هنا لتنزيل هذا الملف.
الشكل التكميلي 4: معايرة علامات الخلايا القاتلة الطبيعية المعبر عنه بشكل خافت والإيجابية في الغالب. تم تقييم عيار الأجسام المضادة ضد علامات الخلايا القاتلة الطبيعية التي لم تظهر مجموعة إيجابية وسلبية واضحة على كل من الخلايا القاتلة الطبيعية (الحمراء) وعلى الخلايا البائية (الزرقاء) أو PBMCs (الرمادية) من المتبرعين الأصحاء. تشير الأسهم إلى العيار المحدد لكل جسم مضاد. الرجاء النقر هنا لتنزيل هذا الملف.
الشكل التكميلي 5: تحسين بروتوكول الترميز الشريطي. تم اختبار استقرار الحاتمة قبل وبعد التثبيت باستخدام 2٪ بارافورمالدهيد على PBMCs من متبرع سليم. (أ) كان تلطيخ CD3 و CD14 و CD56 متشابها قبل التثبيت (الأحمر) وبعد (الأزرق) ، تأثر تلطيخ CD4 و CD16 بشكل كبير بالتثبيت. (ب) تأثرت العديد من علامات الخلايا القاتلة الطبيعية بالتثبيت ، بما في ذلك CD2 و CD38 و KIR3DL2 و CD62L و KIR2DS4 و NKp46 و NKG2C و NKp30 و NKG2D و KIR3DL1 و TIGIT و KIR2DL1 و KIR2DL3 و NTB-A. الرجاء النقر هنا لتنزيل هذا الملف.
الشكل التكميلي 6: تأكيد استقرار اللوحة بعد التجميد بالتجميد. تم تأكيد استقرار اقتران الأجسام المضادة الداخلية عن طريق تلطيخ PBMCs من نفس المتبرع ببنك الدم قبل التجميد (الأزرق) وبعد التجميد (الأحمر). تظهر بقع Anti-CD3 ، وanti-CD14 ، وanti-CD33 ، وanti-CD19 ، وAnti-PD-1 ، وAnti-CD56 على الخلايا الحية. يتم عرض Anti-CD4 و Anti-CD8 على خلايا CD3+ . تظهر عيارات الأجسام المضادة المتبقية على الخلايا القاتلة الطبيعية ، المسورة وفقا لمخطط البوابات الموضح في الشكل 1. والجدير بالذكر أن مضاد KIR2DS2 ملطخ بشكل غير محدد بعد التجميد وبالتالي لم يتم استخدامه في التحليلات اللاحقة. الرجاء النقر هنا لتنزيل هذا الملف.
الشكل التكميلي 7: تأكيد استقرار لوحة الترابط عند -80 درجة مئوية. تم تأكيد استقرار اقترانات الأجسام المضادة الداخلية عن طريق تلطيخ PBMCs الصحية من نفس المتبرع بمزيج رئيسي معد حديثا بالإضافة إلى نفس المزيج بعد التخزين عند -80 درجة مئوية أو في النيتروجين السائل. يظهر تلطيخ Anti-HLA-DR و anti-ICAM-1 و Anti-LFA-3 على خلايا CD3-CD7-. يظهر Anti-CD3 ، ومضاد HLA من الفئة I ، ومضاد CD7 ، ومضاد ل CD48 ، ومضاد ل LLT-1 ، ومضاد ل HLA-E ، ومضاد ل FasR ، ومضاد ل Nectin-1 ، ومضاد ل MICA / B ، ومضاد ل DR4 / 5 ، ومضاد ل ULBP-1،2،5،6 ، ومضاد ل Nectin-2 ، ومضاد ل CD155 ، ومضاد ل HLA-Bw4 ، ومضاد ل HLA-Bw6 ، ومضاد ل B7-H6 على الخلايا الحية. يظهر تلطيخ مضاد ل CD8 ومضاد CD4 على خلايا CD3 +. يظهر تلطيخ Anti-HLA-C و E و Anti-CCR2 و Anti-CD11b و Anti-CD33 على خلايا CD3-CD7-CD14 +. يظهر التلوين المضاد ل CD14 على خلايا CD3-CD7-CD33 + ويظهر التلوين المضاد ل CD56 على خلايا CD3-CD7 + CD14-HLA-DR-. الرسوم البيانية التي تظهر تلطيخا باللوحة المعدة حديثا باللون الأحمر. الرسوم البيانية التي تظهر تلطيخا باللوحة بعد التخزين عند -80 درجة مئوية لمدة شهرين تقريبا باللون الأزرق. الرسوم البيانية التي تظهر تلطيخا باللوحة بعد تخزينها في النيتروجين السائل (LN2) لمدة شهرين تقريبا باللون الأخضر. تم تلطيخ العينات وتشغيلها في أيام مختلفة. تم تطبيع الملفات وإزالة الخرز باستخدام حزمة premessa. الرجاء النقر هنا لتنزيل هذا الملف.
| خصوصيه | استنساخ | النظائر | قصد | السطح / داخل الخلايا |
| CD57 | HCD57 | 89Y | النضج / الذاكرة | سطح |
| سي دي 45 | مرحبا 30 | 102 ح.Pd ، 104Pd ، 106Pd ، 108Pd | الترميز الشريطي | سطح |
| HLA-DR | [تو36] | كيودوت 655 (112قرص مضغوط -114شمعة مضغوطة) | التنشيط / النسب | سطح |
| CD3 | UCHT | 115في | نسب الخلايا التائية | سطح |
| سي دي 38 | تاريخ الوصول 2 | 141علاقات عامه | علامة التنشيط | سطح |
| سي دي 69 | FN50 | 142Nd | علامة التنشيط | سطح |
| سي دي 33 | دبليو إم 53 | 143Nd | سلالة أحادية الخلية | سطح |
| CD14 | م 5 إي 5 | 143Nd | النسب النخاعي | سطح |
| CD2 | RPA-2.10 | 144Nd | التفعيل/الاستحقاق | سطح |
| ليلرب1 | MAB20172 | 145Nd | مستقبلات مثبطة | سطح |
| CD19 | HIB19 | 146Nd | نسب الخلايا البائية | سطح |
| CD8 | سك 1 | 147ن خ | نسب الخلايا التائية وتنشيط / نضج الخلايا القاتلة الطبيعية | سطح |
| إف سي آر جي | متعدد النسيلة | 148Nd | النضج / التكيف | داخل الخلايا |
| CD4 | سك 3 | 149ن خ | نسب الخلايا التائية | سطح |
| سيك | 4د10.2 | 150 حياNd | اشارات | داخل الخلايا |
| CD62L | DREG-56 | 151 ريالالاتحاد الأوروبي | التنشيط | سطح |
| كي -67 | كي -67 | 152 ريالن خ | انتشار | داخل الخلايا |
| KIR2DS4 | 179315 | 153الاتحاد الأوروبي | تنشيط المستقبلات | سطح |
| NKp46 | 9.00 إ +02 | 155جي دي | تنشيط المستقبلات | سطح |
| NKG2D | 1د11 | 156جي دي | تنشيط المستقبلات | سطح |
| تيجيت | 741182 | 157جي دي | مستقبلات مثبطة | سطح |
| 2ب4 | جيم1.7 | 158جي دي | تنشيط المستقبلات | سطح |
| DNAM-1 | دي اكس 11 | 159 ح.السل | تنشيط المستقبلات | سطح |
| فاس - ل | نوك -1 | 160 ح.جي دي | موت الخلايا المبرمج | سطح |
| NKp30 | ص 30-15 | 161دي | تنشيط المستقبلات | سطح |
| سيجليك -7 | الموسم7.7 | 162 حيادي | مستقبلات مثبطة | سطح |
| NKG2C | 134522 | 163دي | النضج / الذاكرة | سطح |
| NKp44 | ص 44-8 | 164دي | تنشيط المستقبلات | سطح |
| CD96 | NK92.39 | 165إتش أو | المستقبلات المشتركة NKG2 | سطح |
| KIR2DL1 / KIR2DS5 | 143211 | 166ايه | مستقبلات مثبطة | سطح |
| سي دي 94 | دي اكس 22 | 167ايه | تنشيط المستقبلات | سطح |
| CXCR6 | K041E5 | 168ايه | ذاكرة | سطح |
| الشعبة 1 | EH12.2H7 | 169تي إم | مستقبلات مثبطة | سطح |
| KIR2DL5 | التحديث الأعلى-R1 | 170ايه | مستقبلات مثبطة | سطح |
| NKG2A | 131411 | 171Yb | مستقبلات مثبطة | سطح |
| NTB-A | NT-7 | 172السل | تنشيط المستقبلات | سطح |
| KIR3DL1 | دي إكس -9 | 173Yb | مستقبلات مثبطة | سطح |
| CD56 | NCAM16.2 | 174Yb | نسب الخلايا القاتلة الطبيعية | سطح |
| KIR2DL3 | 180701 | 175لو | مستقبلات مثبطة | سطح |
| بيرفورين | ب-د48 | 176Yb | البروتين المحلل للخلايا | داخل الخلايا |
| الحمض النووي-1/الحمض النووي-2 | غير أ | 191[/193] [] | الخلايا المنواة | سطح |
| سيسبلاتين | غير أ | 194نقطة / 195نقطة | صلاحيه | سطح |
| CD16 | 3جي 8 | 209 ريالثنائيه | مستقبلات FcgRIII | سطح |
الجدول 1: لوحة NK. يتم ترتيب العلامات وفقا للكتلة النظيرية للمعدن الذي تم اقترانها به. 191Ir/193Ir هي الوفرة الطبيعية لمعيار الحمض النووي. 194Pt / 195Pt هي الوفرة الطبيعية للسيسبلاتين.
| خصوصيه | استنساخ | النظائر | قصد | السطح / داخل الخلايا |
| HLA-DR | L243 | 89Y | الخلايا العارضة للمستضد ، علامة التنشيط | سطح |
| سي دي 45 | مرحبا 30 | 102 ح.Pd ، 104Pd ، 106Pd ، 108Pd | الترميز الشريطي | سطح |
| CD19 | SJ25-C1 | كيودوت 655 (112قرص مضغوط -114شمعة مضغوطة) | النسب | سطح |
| CD3 | UCHT1 | 115في | النسب | سطح |
| عموم HLA الفئة الأولى | [ث6/32] | 143Nd | روابط KIR | سطح |
| CD7 | CD7-6B7 | 144Nd | النسب | سطح |
| CD8 | سك 1 | 145Nd | النسب | سطح |
| سي دي 48 | BJ40 | 146Nd | 2ب 4 ليجند | سطح |
| آي كام-1 | HA58 | 148Nd | LFA-1 ligand | سطح |
| LLT-1 | 402659 | 149ن خ | CD161 ligand | سطح |
| CD4 | OKT4 | 151 ريالالاتحاد الأوروبي | النسب | سطح |
| HLA-C ، E | DT9 | 153الاتحاد الأوروبي | روابط KIR | سطح |
| CCR2 | K036C2 | 154 ح.ن خ | علامة وظيفية أحادية الخلية | سطح |
| HLA-E | 3D12 | 155جي دي | NKG2A / CD94 و NKG2C / CD94 ligand | سطح |
| فاس (CD95) | DX2 | 156جي دي | مستقبلات FasL | سطح |
| نيكتين -1 | 1.302 ريال | 157جي دي | CD96 ligand | سطح |
| MICA/B | 159227/236511 | 158جي دي | روابط NKG2D | سطح |
| DR4 / 5 | DJR1 / DJR2-2 | 159 ح.السل | مستقبلات TRAIL | سطح |
| ULBP-1 / 2،5،6 | 170818/165903 | 161دي | روابط NKG2D | سطح |
| نيكتين -2 | TX31 | 164دي | ترابط DNAM-1 و TIGIT و CD96 | سطح |
| سي دي 155 | سكي.4 | 165إتش أو | ترابط DNAM-1 و TIGIT و CD96 | سطح |
| HLA-Bw4 | ريا274 | 166ايه | KIR3DL1 ligand | سطح |
| HLA-Bw6 | ريا143 | 168ايه | أليل KIR الفارغ | سطح |
| CD14 | م 5 إي 2 | 169تي إم | النسب | سطح |
| CD11b | 44 | 170ايه | النسب | سطح |
| LFA-3 | TS2 / 9 | 171Yb | ترابط CD2 | سطح |
| سي دي 33 | دبليو إم 53 | 172Yb | النسب | سطح |
| CD56 | NCAM16.2 | 174Yb | النسب | سطح |
| B7-H6 | 875001 | 176Yb | NKp30 ligand | سطح |
| الحمض النووي-1/الحمض النووي-2 | غير أ | 191[/193] [] | الخلايا المنواة | سطح |
| سيسبلاتين | غير أ | 194نقطة / 195نقطة | صلاحيه | سطح |
| CD16 | 3جي 8 | 209 ريالثنائيه | النسب | سطح |
الجدول 2: لوحة الترابط. يتم ترتيب العلامات وفقا للكتلة النظيرية للمعدن الذي تم اقترانها به. 191Ir/193Ir هي الوفرة الطبيعية لمعيار الحمض النووي. 194Pt / 195Pt هي الوفرة الطبيعية للسيسبلاتين.
| خصوصيه | استنساخ | بائع | رقم الكتالوج | السطح / داخل الخلايا | تلاحظ |
| 2ب4 | 2-69 | BD Biosciences | 550814 | سطح | تم التحقق من صحة استنساخ جديد مع تلطيخ محسن |
| CD56 | N901 | بيكمان كولتر | 6602705 | سطح | تم التحقق من صحة استنساخ جديد مع تلطيخ محسن |
| CXCR6 | 56811 | أنظمة البحث والتطوير | MAB699 | سطح | تم التحقق من صحة استنساخ جديد بتكلفة أقل |
| KIR2DS2 | متعدد النسيلة | أبكام | أب175486 | سطح | لوحظ تلطيخ غير محدد بعد التجميد - لا يستخدم للتحليلات |
| KIR2DS4 | فس172 | بيكمان كولتر | أ60796 | سطح | تم التحقق من صحة استنساخ جديد مع تلطيخ محسن / تكلفة أقل |
| ليلرب1 | جي إتش آي / 75 | بيوليجند | 333702 | سطح | تم التحقق من صحة استنساخ جديد مع تلطيخ محسن |
| NKG2A | Z199 | بيكمان كولتر | IM2750 | سطح | تم التحقق من صحة استنساخ جديد بتكلفة أقل |
| تيجيت | بكالوريوس الطب والأمبير 43 | ثيرمو فيشر العلمي | 16-9500-82 | سطح | تم التحقق من صحة استنساخ جديد |
الجدول التكميلي 1: الأجسام المضادة للوحة الخلايا القاتلة الطبيعية التي تم اختبارها ، ولكن لم يتم استخدامها.
| النظائر | خصوصيه | استنساخ | بائع | رقم الكتالوج | السطح / داخل الخلايا |
| 143Nd | NKG2C | 134522 | أنظمة البحث والتطوير | MAB1381 | سطح |
| 145Nd | سي دي 38 | تاريخ الوصول 2 | بيوليجند | 303502 | سطح |
| 146Nd | CD8 | سك 1 | بيوليجند | 344702 | سطح |
| 149ن خ | CD2 | RPA-2.10 | بيوليجند | 300202 | سطح |
| 151 ريالالاتحاد الأوروبي | سيجليك -7 | الموسم7.7 | بيوليجند | 347702 | سطح |
| 154 ح.ن خ | ليلرب1 | 292319 | أنظمة البحث والتطوير | MAB20172 | سطح |
| 163دي | KIR3DL1 | دي إكس -9 | BD العلوم البيولوجية | 555964 | سطح |
| 168ايه | CD62L | DREG-56 | بيوليجند | 304802 | سطح |
| 171Yb | الشعبة 1 | EH12.2H7 | بيوليجند | 329902 | سطح |
| 176Yb | سي دي 69 | EH12.2H7 | بيوليجند | 329902 | سطح |
الجدول التكميلي 2: الأجسام المضادة للوحة الخلايا القاتلة الطبيعية التي تم اختبارها مع اقتران مختلف بين الجسم المضاد / المعدن.
Discussion
نصف هنا تصميم وتطبيق لوحتين مجانيتين من CyTOF تهدف إلى تحديد ملامح ذخيرة مستقبلات الخلايا القاتلة الطبيعية. يتضمن هذا البروتوكول العديد من الخطوات الحاسمة للحصول على بيانات عالية الجودة. يستخدم CyTOF أيونات المعادن الثقيلة ، بدلا من الفلوروكرومات ، كمجسات تسمية للأجسامالمضادة 19. لذلك تخضع هذه التقنية لإشارات ملوثة محتملة من المعادن البيئية20. تشمل المصادر المحتملة للشوائب المعدنية صابون الأطباق المختبري (الباريوم) والمخازن المؤقتة في المختبر (الزئبق والرصاص والقصدير). لهذا السبب ، ينصح بتحضير جميع المخازن المؤقتة بماء عالي النقاء ، وأن يتم تخزين جميع الكواشف في عبوات بلاستيكية أو زجاجية لم يتم غسلها بالصابون مطلقا. خطوة أخرى حاسمة في هذا البروتوكول هي صبغة الجدوى ، والتي تستخدم طريقة قائمة على السيسبلاتين كما هو موضح من قبل Fienberg et al.21. تتضمن هذه الطريقة خطوة حضانة مدتها دقيقة واحدة ، يقوم خلالها سيسبلاتين بشكل تفضيلي بتسمية الخلايا غير القابلة للحياة. يجب إجراء تلطيخ سيسبلاتين في حالة عدم وجود FBS. وبالتالي ، يجب غسل الخلايا جيدا باستخدام CyPBS قبل تلطيخها. بالإضافة إلى ذلك ، لتجنب تلطيخ الخلايا القابلة للحياة بعيدا عن الهدف ، يجب إخماد بقعة السيسبلاتين باستخدام FBS بعد دقيقة واحدة بالضبط. تم تحسين هذا البروتوكول لتحقيق أقصى قدر من استعادة الخلايا وأداء تلطيخها. لذلك ، فإن خطوات التثبيت والنفاذية مهمة أيضا. العديد من كواشف التثبيت والنفاذية متوافقة مع CyTOF. ومع ذلك ، وجدنا أن التثبيت بنسبة 2٪ PFA ، متبوعا بالنفاذية مع مخزن مؤقت محدد للنفاذية مفصل في جدول المواد ، أدى إلى أقصى قدر من استعادة الخلايا. نظرا لأن هذه طريقة نفاذية عابرة ، يجب إجراء تلطيخ داخل الخلايا في المخزن المؤقت للنفاذية لضمان اختراق الأجسام المضادة الكافية. تحتاج الخلايا أيضا إلى غسلها جيدا باستخدام المخزن المؤقت للنفاذية بعد التلوين داخل الخلايا لإزالة الأجسام المضادة غير المرتبطة.
يسمح هذا البروتوكول بالعديد من التعديلات المحتملة. يمكن تخصيص لوحات CyTOF المفصلة هنا لتشمل علامات إضافية أو تحل محل اللوحات الموجودة. على وجه الخصوص ، تم تصميم لوحة الترابط بعدة قنوات مفتوحة للسماح بالمرونة في تصميم اللوحة. قد يتطلب أي تغيير أو إضافة إلى اللوحة استكشاف أخطاء إضافية وإصلاحها. وعلى وجه الخصوص، ينبغي التحقق بدقة من صحة أي زوج من الأجسام المضادة/النظائر المعدنية كما هو موضح أعلاه، لتجنب أي مشكلة تتعلق بامتداد الإشارة إلى القنوات القائمة. تم تصميم هذه اللوحات أيضا لتكون متوافقة مع ترميز الباريو. يقلل الترميز الشريطي من إمكانية تأثيرات الدفعات وترحيل عينة إلى عينة ، مع تقليل استهلاك الكاشف22. على الرغم من أن الترميز الشريطي يؤدي عادة إلى زيادة جودة البيانات بشكل عام ، إلا أن هذه الخطوة ليست ضرورية للحصول على بيانات CyTOF عالية الجودة ويمكن تخطيها تماما. وبالمثل ، على الرغم من أننا نوصي بتنقية الخلايا القاتلة الطبيعية قبل التلوين ، إلا أن لوحة الخلايا القاتلة الطبيعية متوافقة مع التنميط الظاهري لخلايا NK من PBMCs الكاملة.
هذه الطريقة لها بعض القيود. نظرا لطبيعة الإنتاجية المنخفضة بطبيعتها ل CyTOF ، فإن هذه الطريقة ليست مناسبة للعينات ذات عدد الخلايا المنخفض. من غير المرجح أن تسفر هذه العينات عن بيانات ذات جودة كافية للتحليل. بالإضافة إلى ذلك ، نظرا لأن هذه اللوحات مصممة خصيصا لاستجواب تفاعلات الخلايا المستهدفة للخلايا الطبيعية ، فهي محدودة في قدرتها على تقييم التفاعلات بين أنواع الخلايا الأخرى ، مثل خلايا CD8 + T والخلايا النخاعية وبالمثل ، تم تصميم هذه اللوحات للتنميط المناعي المباشر خارج الجسم الحي ولم يتم اختبارها أو التحقق من صحتها للاستخدام في ظل ظروف التنشيط ، مثل تحفيز السيتوكين. علاوة على ذلك ، على الرغم من أن هذه اللوحات تغطي قائمة شاملة بمستقبلات الخلايا القاتلة الطبيعية والروابط ، إلا أنها ليست شاملة تماما ، ولم يتم تضمين العديد من العلامات التي يحتمل أن تكون مهمة بسبب ضيق المساحة. تتضمن بعض هذه العلامات ، على سبيل المثال لا الحصر ، KLRG1 و CRACC و TIM-3 و LAIR-1 في لوحة NK و PD-L1 في لوحة الترابط. أخيرا ، هذه الطريقة غير مناسبة للاستخدام في العينات الثابتة ، نظرا لأن غالبية حواتم علامات الخلايا القاتلة الطبيعية تتأثر بالتثبيت.
البروتوكول الموصوف هنا له فوائد كبيرة مقارنة بالطرق الأخرى. وصفت مجموعات أخرى لوحات قياس التدفق الخلوي التي تهدف إلى دراسة الخلايا القاتلة الطبيعية3،4،5،6،7،8،23. بالمقارنة مع قياس التدفق الخلوي ، فإن استخدام CyTOF يزيل المشكلات المتعلقة بتعويض الفلوروفور ، مما يسمح بالكشف المتزامن عن عدد كبير من العلامات. على الرغم من أن آخرين قد طوروا أيضا لوحات CyTOF لدراسة الخلايا القاتلة الطبيعية9،10،11،12،13،14 ، فإننا نصف هنا استخدام لوحتين تكميليتين من CyTOF ، والتي تستجوب التعبير عن كل من مستقبلات الخلايا القاتلة الطبيعية وربطاتها ، وبالتالي توفر صورة أكثر تفصيلا لوظيفة الخلية القاتلة الطبيعية.
استخدمت مجموعتنا هذا البروتوكول وإحدى هذين اللوحين أو كليهما لتوصيف استجابة الخلايا القاتلة الطبيعية البشرية لدى المتبرعين الأصحاء ، وفي مجموعة متنوعة من البيئات المرضية بما في ذلك عدوى فيروس نقص المناعة البشرية وعدوى فيروس حمىالضنك 24،25،26،27،28. على الرغم من كونها مصممة لغرض دراسة الالتهابات الفيروسية ، إلا أن هذه اللوحات تصلح لدراسة خلايا NK في ظروف أخرى نظرا لتنفس البروتينات التي تغطيها. في الواقع ، استخدمت مجموعتنا أيضا هذه اللوحات لتوصيف ذخيرة مستقبلات الخلايا القاتلة الطبيعية في المرضى الذين يعانون من نقص المناعة والتصلب المتعدد25،27،29،30 ، وكذلك في الفئران المتوافقة مع البشر31،32. على هذا النحو ، يمكن توسيع استخدام هذه اللوحات ليشمل سياقات أخرى. على سبيل المثال ، يتم تضمين العديد من مستقبلات الخلايا القاتلة الطبيعية والروابط المماثلة المتورطة في وضع السرطان في هذه اللوحات ، مما يجعل هذه اللوحات أدوات ممتازة للدراسات المستقبلية حول دور الخلايا القاتلة الطبيعية في الاستجابة المضادة للورم. على نطاق أوسع ، يمكن تطبيق بروتوكولنا للإنتاج الضخم وتخزين لوحات CyTOF بالإضافة إلى المعالجة المتوازية للعينات على تنفيذ وتطبيق أي لوحة CyTOF.
Disclosures
المؤلفون ليس لديهم ما يكشفون عنه.
Acknowledgements
يود المؤلفون أن يشكروا جميع الأعضاء الحاليين والسابقين في مختبر بليش الذين ساهموا في هذه الجلسة. شكرا لمجموعة التجارب السريرية للإيدز وفريق ACTG A5321 وكذلك الدكتورة ساندرا لوبيز فيرجيس وديفيس بيلتران في معهد جورجاس التذكاري للدراسات الصحية لتنظيم العينات. أخيرا ، شكرا لمايكل ليبولد وهولدن مايكر ومركز ستانفورد لمراقبة المناعة البشرية لاستخدام آلات Helios الخاصة بهم. تم دعم هذا العمل من قبل المعاهد الوطنية للصحة U19AI057229 ، والمعاهد الوطنية للصحة R21 AI135287 ، والمعاهد الوطنية للصحة R21 AI130532 ، والمعاهد الوطنية للصحة DP1 DA046089 ، ومحققي صندوق بوروز ويلكوم في التسبب في الأمراض المعدية # 1016687 إلى CB ، وجائزة المعاهد الوطنية للصحة روث إل كيرششتاين لخدمة البحوث المؤسسية T32 AI007502 و TL1 TR001084 و NIH / NIAID K08 AI138640 إلى EV ، وزمالة أبحاث الدراسات العليا لمؤسسة العلوم الوطنية DGE-1656518 إلى JM ومنحة تدريب المعاهد الوطنية للصحة T32-الذكاء الاصطناعي-007290 (PI Olivia Martinez). تلقت دراسة ACTG دعما من الذكاء الاصطناعي-68634 (مركز إدارة البيانات والبيانات) و UM1-A1-26617 و الذكاء الاصطناعي-131798 و الذكاء الاصطناعي-68636 (ACTG). CB هو باحث في كلية تاشيا وجون مورجريدج في الطب الانتقالي للأطفال من معهد ستانفورد لأبحاث صحة الأم والطفل وباحث في Chan Zuckerberg Biohub.
Materials
| Name | Company | Catalog Number | Comments |
| 89Y | Sigma-Aldrich | 204919 | |
| 102-Palladium nitrate | Trace Sciences International | Special Order | |
| 104-Palladium nitrate | Trace Sciences International | Special Order | |
| 106-Palladium nitrate | Trace Sciences International | Special Order | |
| 108-Palladium nitrate | Trace Sciences International | Special Order | |
| 115In | Trace Sciences International | Special Order | |
| 141Pr | Fluidigm | 201141A | |
| 142Nd | Fluidigm | 201142A | |
| 143Nd | Fluidigm | 201143A | |
| 144Nd | Fluidigm | 201144A | |
| 145Nd | Fluidigm | 201145A | |
| 146Nd | Fluidigm | 201146A | |
| 147Sm | Fluidigm | 201147A | |
| 148Nd | Fluidigm | 201148A | |
| 149Sm | Fluidigm | 201149A | |
| 150Nd | Fluidigm | 201150A | |
| 151Eu | Fluidigm | 201151A | |
| 152Sm | Fluidigm | 201152A | |
| 153Eu | Fluidigm | 201153A | |
| 154Sm | Fluidigm | 201154A | |
| 155Gd | Fluidigm | 201155A | |
| 156Gd | Fluidigm | 201156A | |
| 157Gd | Trace Sciences International | N/A | |
| 158Gd | Fluidigm | 201158A | |
| 159Tb | Fluidigm | 201159A | |
| 160Gd | Fluidigm | 201160A | |
| 161Dy | Fluidigm | 201161A | |
| 162Dy | Fluidigm | 201162A | |
| 163Dy | Fluidigm | 201163A | |
| 164Dy | Fluidigm | 201164A | |
| 165Ho | Fluidigm | 201165A | |
| 166Er | Fluidigm | 201166A | |
| 167Er | Fluidigm | 201167A | |
| 168Er | Fluidigm | 201168A | |
| 169Tm | Fluidigm | 201169A | |
| 170Er | Fluidigm | 201170A | |
| 171Yb | Fluidigm | 201171A | |
| 172Yb | Fluidigm | 201172A | |
| 173Yb | Fluidigm | 201173A | |
| 174Yb | Fluidigm | 201174A | |
| 175Lu | Fluidigm | 201175A | |
| 176Yb | Fluidigm | 201176A | |
| 209Bi anti-CD16 | Fluidigm | 3209002B | Clone 3G8. Used at a 1:50 dilution. |
| 697 cells | Creative Bioarray | CSC-C0217 | |
| Amicon Ultra Centrifugal Filter Units 0.5 with Ultracel-30 Membrane, 30 kDa | Millipore | UFC503096 | |
| Anhydrous acetonitrile | Fisher Scientific | BP1165-50 | |
| anti-2B4 | Biolegend | 329502 | Clone C1.7. |
| anti-B7-H6 | R&D Systems | MAB7144 | Clone 875001. |
| anti-CCR2 | Biolegend | 357202 | Clone K036C2. |
| anti-CD2 | Biolegend | 300202 | Clone RPA-2.10. |
| anti-CD3 | Biolegend | 300402 | Clone UCHT1. |
| anti-CD4 | Biolegend | 317402 | Clone OKT4. |
| anti-CD4 | Biolegend | 344602 | Clone SK3. |
| anti-CD7 | Biolegend | 343102 | Clone CD7-6B7. |
| anti-CD8 | Biolegend | 344702 | Clone SK1. |
| anti-CD11b | Biolegend | 301302 | Clone ICRF44. |
| anti-CD14 | Biolegend | 301802 | Clone M5E2. |
| anti-CD19 | Biolegend | 302202 | Clone HIB19. |
| anti-CD33 | Biolegend | 303402 | Clone WM53. |
| anti-CD38 | Biolegend | 303502 | Clone HIT2. |
| anti-CD48 | Biolegend | 336702 | Clone BJ40. |
| anti-CD56 | BD Pharmingen | 559043 | Clone NCAM16.2. |
| anti-CD57 | Biolegend | 322302 | Clone HCD57. |
| anti-CD62L | Biolegend | 304802 | Clone DREG-56. |
| anti-CD69 | Biolegend | 310902 | Clone FN50. |
| anti-CD94 | Biolegend | 305502 | Clone DX22. |
| anti-CD95 | Biolegend | 305602 | Clone DX2. |
| anti-CD155 | Biolegend | 337602 | Clone SKII.4. |
| anti-CXCR6 | Biolegend | 356002 | Clone K041E5. |
| anti-DNAM-1 | BD Biosciences | 559787 | Clone DX11. |
| anti-DR4 | Biolegend | 307202 | Clone DJR1. |
| anti-DR5 | Biolegend | 307302 | Clone DJR2-2. |
| anti-FAS-L | Biolegend | 306402 | Clone NOK-1. |
| anti-FcRg | Millipore | 06-727 | Polyclonal antibody. |
| anti-HLA-C,E | Millipore | MABF233 | Clone DT9. |
| anti-HLA-Bw4 | Miltenyi Biotec | Special Order | Clone REA274. |
| anti-HLA-Bw6 | Miltenyi Biotec | 130-124-530 | Clone REA143. |
| anti-HLA-DR | Biolegend | 307602 | Clone L243. |
| anti-HLA-E | Biolegend | 342602 | Clone 3D12. |
| anti-ICAM-1 | Biolegend | 353102 | Clone HA58. |
| anti-Ki-67 | Biolegend | 350502 | Clone Ki-67. |
| anti-KIR2DL1/KIR2DS5 | R&D Systems | MAB1844 | Clone 143211. |
| anti-KIR2DL3 | R&D Systems | MAB2014 | Clone 180701. |
| anti-KIR2DL5 | Miltenyi Biotec | 130-096-200 | Clone UP-R1. |
| anti-KIR2DS4 | R&D Systems | MAB1847 | Clone 179315. |
| anti-KIR3DL1 | BD Biosciences | 555964 | Clone DX-9. |
| anti-LFA-3 | Biolegend | 330902 | Clone TS2/9. |
| anti-LILRB1 | R&D Systems | 292319 | Clone MAB20172. |
| anti-LLT-1 | R&D Systems | AF3480 | Clone 402659. |
| anti-MICA | R&D Systems | MAB1300-100 | Clone 159227. |
| anti-MICB | R&D Systems | MAB1599-100 | Clone 236511. |
| anti-Nectin-1 | Biolegend | 340402 | Clone R1.302. |
| anti-Nectin-2 | Biolegend | 337402 | Clone TX31. |
| anti-NKG2A | R&D Systems | MAB1059 | Clone 131411. |
| anti-NKG2C | R&D Systems | MAB1381 | Clone 134522. |
| anti-NKG2D | Biolegend | 320802 | Clone 1D11. |
| anti-NKp30 | Biolegend | 325202 | Clone P30-15. |
| anti-NKp44 | Biolegend | 325102 | Clone P44-8. |
| anti-NKp46 | Biolegend | 331902 | Clone 9E2. |
| anti-NTB-A | Biolegend | 317202 | Clone NT-7. |
| anti-Pan HLA class I | Biolegend | 311402 | Clone W6/32. |
| anti-PD1 | Biolegend | 329902 | Clone EH12.2H7. |
| anti-Perforin | Abcam | ab47225 | Clone B-D48. |
| anti-Siglec-7 | Biolegend | 347702 | Clone S7.7. |
| anti-Syk | Biolegend | 644302 | Clone 4D10.2. |
| anti-TACTILE | Biolegend | 338402 | Clone NK92.39. |
| anti-TIGIT | R&D Systems | MAB7898 | Clone 741182. |
| anti-ULBP-1 | R&D Systems | MAB1380-100 | Clone 170818. |
| anti-ULBP-2, 5, 6 | R&D Systems | MAB1298-100 | Clone 165903. |
| Antibody Stabilizer | Candor Bioscience | 131 050 | |
| Benzonase Nuclease | Millipore | 70664 | |
| Bond-Breaker TCEP Solution | Thermo Fisher Scientific | 77720 | |
| Bovine Serum Albumin solution | Sigma-Aldrich | A9576 | |
| Calcium chloride dihydrate (CaCl2+2H2O) | Sigma-Aldrich | 223506-25G | |
| Cis-Platinum(II)diamine dichloride (cisplatin) | Enzo Life Sciences | ALX-400-040-M250 | A 100 mM stock solution was prepared in DMSO and divided into 25 µL aliquots. Used at a 25 µM dilution for live/dead stain. Signal appears in 194Pt and 195Pt channels. |
| DMSO | Sigma-Aldrich | D2650 | |
| eBioscience Permeabilization Buffer | Thermo Fisher Scientific | 00-8333-56 | |
| EDTA (0.5 M) | Hoefer | GR123-100 | A double-concentrated HEPES buffer with EDTA was made according to the following recipe: 1.3 g NaCl (Thermo Fisher Scientific), 27 mg CaCl2+2H2O (Sigma-Aldrich), 23 mg MgCl2 (Sigma-Aldrich), 83.6 mg KH2PO4 (Thermo Fisher Scientific), 4 mL of 1M HEPES (Thermo Fisher Scientific), 2 mL of 0.5M EDTA (Hoefer, Holliston, MA, USA), and 100mL H2O. The pH of this double-concentrated HEPES buffer was adjusted to a pH of 7.3 using 1M HCl and 1M NaOH. |
| EQ Four Element Calibration Beads | Fluidigm | 201078 | |
| Fetal Bovine Serum | Thermo Fisher Scientific | N/A | |
| Helios mass cytometer | Fluidigm | N/A | |
| HEPES (1M) | Thermo Fisher Scientific | 15630080 | |
| HyClone Antibiotic/Antimycotic Solution (Pen/Strep/Fungiezone) solution | Fisher Scientific | SV3007901 | |
| Iridium - 191Ir/193Ir intercalator | DVS Sciences (Fluidigm) | 201192B | Used at a 1:10000 dilution. |
| Isothiocyanobenzyl-EDTA (ITCB-EDTA) | Dojindo Molecular Technologies, Inc. | M030-10 | Diluted to 1.25 mg/mL in anhydrous acetonitrile. |
| K562 cells | American Type Culture Collection (ATCC) | ATCC CCL-243 | |
| L-Glutamine (200 mM) | Thermo Fisher Scientific | SH30034 | |
| Magnesium chloride (MgCl2) | Sigma-Aldrich | 208337-100G | |
| Maxpar X8 Antibody Labeling Kits | Fluidigm | N/A | No catalog number as kits come with metals. |
| Millex-VV Syringe Filter Unit, 0.1 µm | Millipore | SLVV033RS | |
| Milli-Q Advantage A10 Water Purification System | Millipore | Z00Q0V0WW | |
| MS Columns | Miltenyi Biotec | ||
| NALM6 cells | American Type Culture Collection (ATCC) | ATCC CRL-3273 | |
| Nanosep Centrifugal Devices with Omega Membrane 3K | Pall Corporation | OD003C35 | |
| NK Cell Isolation Kit, human | Miltenyi Biotec | 130-092-657 | |
| Paraformaldehyde (16%) | Electron Microscopy Sciences | 15710 | |
| PBS | Thermo Fisher Scientific | 10010023 | |
| Potassium Phosphate Monobasic (KH2PO4) | Fisher Scientific | MP021954531 | |
| Qdot 655 anti-CD19 | Thermo Fisher Scientific | Q10179 | Clone SJ25-C1. Used at a 1:50 dilution. Signal appears in 112Cd-114Cd channels. |
| Qdot 655 anti-HLA-DR | Thermo Fisher Scientific | Q22158 | Clone Tü36. Used at a 1:200 dilution. |
| Rockland PBS | Rockland Immunochemicals, Inc. | MB-008 | Used to make CyPBS (10X Rockland PBS diluted to 1X in Milli-Q water) and CyFACS buffers (10X Rockland PBS diluted to 1X in Milli-Q water with 0.1% BSA and 0.05% sodium azide). Buffers were sterile-filtered through a 0.22 µM filter and sotred at 4°C in Stericup bottles. |
| RPMI 1640 | Thermo Fisher Scientific | 21870092 | |
| Sodium azide (NaN3) | Sigma-Aldrich | S2002 | |
| Sodium chloride (NaCl) | Fisher Scientific | S271-500 | |
| Stericup Quick Release-GP Sterile Vacuum Filtration System | Millipore Sigma | S2GPU10RE | |
| Tuning solution | Fluidigm | 201072 | |
| Washing solution | Fluidigm | 201070 |
References
- Shimasaki, N., Jain, A., Campana, D. NK cells for cancer immunotherapy. Nature Reviews. Drug Discovery. 19 (3), 200-218 (2020).
- Vivier, E., Tomasello, E., Baratin, M., Walzer, T., Ugolini, S. Functions of natural killer cells. Nature Immunology. 9 (5), 503-510 (2008).
- Eller, M. A., Currier, J. R. OMIP-007: phenotypic analysis of human natural killer cells. Cytometry. Part A: The Journal of the International Society for Analytical Cytology. 81 (6), 447-449 (2012).
- Mahnke, Y. D., Beddall, M. H., Roederer, M. OMIP-029: Human NK-cell phenotypization. Cytometry. Part A: The Journal of the International Society for Analytical Cytology. 87 (11), 986-988 (2015).
- Hammer, Q., Romagnani, C. OMIP-039: Detection and analysis of human adaptive NKG2C + natural killer cells : Detection of Human Adaptive NKG2C + NK Cells. Cytometry. 91 (10), 997-1000 (2017).
- Liechti, T., Roederer, M. OMIP-058: 30-Parameter flow cytometry panel to characterize iNKT, NK, unconventional and conventional T cells. Cytometry. 95 (9), 946-951 (2019).
- Béziat, V., et al. NK cell responses to cytomegalovirus infection lead to stable imprints in the human KIR repertoire and involve activating KIRs. Blood. 121 (14), 2678-2688 (2013).
- Pfefferle, A., et al. Intra-lineage plasticity and functional reprogramming maintain natural killer cell repertoire diversity. Cell Reports. 29 (8), 2284-2294 (2019).
- Barcenilla, H., Åkerman, L., Pihl, M., Ludvigsson, J., Casas, R. Mass cytometry identifies distinct subsets of regulatory T cells and Natural killer cells associated with high risk for Type 1 diabetes. Frontiers in Immunology. 10, 982(2019).
- Kurioka, A., et al. CD161 defines a functionally distinct subset of pro-inflammatory Natural killer cells. Frontiers in Immunology. 9, 486(2018).
- Romee, R., et al. Cytokine-induced memory-like natural killer cells exhibit enhanced responses against myeloid leukemia. Science Translational Medicine. 8 (357), (2016).
- Shinko, D., et al. Mass cytometry reveals a sustained reduction in CD16+ Natural killer cells following chemotherapy in colorectal cancer patients. Frontiers in Immunology. 10, 2584(2019).
- Pohlmeyer, C. W., et al. Identification of NK cell subpopulations that differentiate HIV-infected subject cohorts with diverse levels of virus control. Journal of Virology. 93 (7), 01790(2019).
- Palgen, J. -L., et al. NK cell immune responses differ after prime and boost vaccination. Journal of Leukocyte Biology. 105 (5), 1055-1073 (2019).
- Mei, H. E., Leipold, M. D., Schulz, A. R. Barcoding of live human peripheral blood mononuclear cells for multiplexed mass cytometry. The Journal of Immunology. 194 (4), 2022-2031 (2015).
- Takahashi, C., et al. Mass cytometry panel optimization through the designed distribution of signal interference. Cytometry. Part A: The Journal of the International Society for Analytical Cytology. 91 (1), 39-47 (2017).
- Baumgart, S., Peddinghaus, A., Schulte-Wrede, U., Mei, H. E., Grützkau, A. OMIP-034: Comprehensive immune phenotyping of human peripheral leukocytes by mass cytometry for monitoring immunomodulatory therapies. Cytometry. Part A: The Journal of the International Society for Analytical Cytology. 91 (1), 34-38 (2017).
- Leipold, M. D. Another step on the path to mass cytometry standardization. Cytometry. Part A: The Journal of the International Society for Analytical Cytology. 87 (5), 380-382 (2015).
- Bendall, S. C., et al. Single-cell mass cytometry of differential immune and drug responses across a human hematopoietic continuum. Science. 332 (6030), 687-696 (2011).
- Leipold, M. D., Newell, E. W., Maecker, H. T. Multiparameter phenotyping of human PBMCs using mass cytometry. Methods in Molecular Biology. 1343, 81-95 (2015).
- Fienberg, H. G., Simonds, E. F., Fantl, W. J., Nolan, G. P., Bodenmiller, B. A platinum-based covalent viability reagent for single-cell mass cytometry. Cytometry. Part A: The Journal of the International Society for Analytical Cytology. 81 (6), 467-475 (2012).
- Zivanovic, N., Jacobs, A., Bodenmiller, B. A practical guide to multiplexed mass cytometry. Current Topics in Microbiology and Immunology. 377, 95-109 (2014).
- Béziat, V., Hilton, H. G., Norman, P. J., Traherne, J. A. Deciphering the killer-cell immunoglobulin-like receptor system at super-resolution for natural killer and T-cell biology. Immunology. 150 (3), 248-264 (2017).
- Wilk, A. J., et al. Charge-altering releasable transporters enable specific phenotypic manipulation of resting primary natural killer cells. BioRxiv. , 970491(2020).
- Vendrame, E., et al. TIGIT is upregulated by HIV-1 infection and marks a highly functional adaptive and mature subset of natural killer cells. AIDS. 34 (6), 801-813 (2020).
- Zhao, N. Q., et al. Natural killer cell phenotype is altered in HIV-exposed seronegative women. PloS One. 15 (9), 0238347(2020).
- McKechnie, J. L., et al. HLA upregulation during dengue virus infection suppresses the natural killer cell response. Frontiers in Cellular and Infection Microbiology. 9, 268(2019).
- McKechnie, J. L., et al. Mass cytometry analysis of the NK cell receptor-ligand repertoire reveals unique differences between dengue-infected children and adults. ImmunoHorizons. 4 (10), 634-647 (2020).
- Ranganath, T., et al. Characterization of the impact of daclizumab beta on circulating natural killer cells by mass cytometry. Frontiers in immunology. 11, 714(2020).
- Fernandez, I. Z., et al. A novel human IL2RB mutation results in T and NK cell--driven immune dysregulation. The Journal of Experimental Medicine. 216 (6), 1255-1267 (2019).
- Herndler-Brandstetter, D., et al. Humanized mouse model supports development, function, and tissue residency of human natural killer cells. Proceedings of the National Academy of Sciences. 114 (45), 9626-9634 (2017).
- Nikzad, R., et al. Human natural killer cells mediate adaptive immunity to viral antigens. Science Immunology. 4 (35), (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved