Method Article
פרופיל של רפרטואר קולטני תאי הרג טבעיים אנושיים-ליגנד
* These authors contributed equally
In This Article
Summary
כאן אנו מתכננים שני פאנלים משלימים של ציטומטריית מסה (CyTOF) ומייעלים פרוטוקול צביעה של CyTOF במטרה ליצור פרופיל של קולטן תאי ההרג הטבעי ורפרטואר הליגנד בהקשר של זיהומים ויראליים.
Abstract
תאי הרג טבעיים (NK) הם בין המגיבים הראשונים לזיהומים נגיפיים. היכולת של תאי NK לזהות ולהרוג במהירות תאים נגועים בנגיף מווסתת על ידי ביטוים של קולטנים מעכבים ומפעילים מקודדים בקו הנבט. המעורבות של קולטנים אלה על ידי הליגנדים הקוגנטיים שלהם על תאי המטרה קובעת אם האינטראקציה הבין-תאית תביא להרג תאי NK. פרוטוקול זה מפרט את התכנון והאופטימיזציה של שני לוחות ציטומטריית מסה משלימה (CyTOF). פאנל אחד תוכנן לפנוטיפ של תאי NK על סמך ביטוי הקולטן. הפאנל השני תוכנן לחקור ביטוי של ליגנדים ידועים לקולטני תאי NK במספר תת-קבוצות של תאים חיסוניים. יחד, שני הפאנלים הללו מאפשרים פרופיל של רפרטואר הקולטן-ליגנד של תאי NK אנושיים. יתר על כן, פרוטוקול זה מפרט גם את התהליך שבו אנו מכתימים דגימות עבור CyTOF. תהליך זה עבר אופטימיזציה לשיפור יכולת השחזור והסטנדרטיזציה. היתרון של CyTOF הוא היכולת שלו למדוד למעלה מ-40 סמנים בכל פאנל, עם חפיפה מינימלית של אותות, מה שמאפשר לחוקרים ללכוד את רוחב הרפרטואר של קולטן-ליגנד של תאי NK. ברקוד פלדיום גם מפחית את השונות בין הדגימות, כמו גם את צריכת הריאגנטים, מה שמקל על צביעת דגימות עם כל פאנל במקביל. המגבלות של פרוטוקול זה כוללות את התפוקה הנמוכה יחסית של CyTOF וחוסר היכולת לשחזר תאים לאחר הניתוח. לוחות אלה תוכננו לניתוח דגימות קליניות מחולים הסובלים מזיהומים נגיפיים חריפים וכרוניים, כולל נגיף דנגי, נגיף הכשל החיסוני האנושי (HIV) ושפעת. עם זאת, ניתן להשתמש בהם בכל מסגרת כדי לחקור את רפרטואר הקולטן-ליגנד של תאי NK אנושיים. חשוב לציין, ניתן ליישם שיטות אלה באופן נרחב לתכנון וביצוע של לוחות CyTOF עתידיים.
Introduction
תאי הרג טבעיים (NK) הם תאי חיסון מולדים שתפקידם העיקרי הוא למקד ולהרוג תאים ממאירים, נגועים או סטרס אחר. באמצעות הפרשת ציטוקינים כגון IFNγ ו-TNFα, כמו גם פעילותם הציטוטוקסית, תאי NK יכולים גם לעצב את התגובה החיסונית הנרכשת לפתוגנים וממאירות. תגובת ה-NK מתווכת בחלקה על ידי איתות קומבינטורי של קולטנים מעכבים ומפעילים מקודדים בקו הנבט, הקושרים מספר עצום של ליגנדים המתבטאים בתאי מטרה פוטנציאליים. למספר קולטנים של תאי NK יש יותר מליגנד אחד עם זוגות קולטנים-ליגנדים חדשים המזוהים באופן קבוע.
יש עניין מיוחד בחקר תאי NK בהקשר של זיהומים ויראליים, כאשר יכולתם להגיב במהירות לתאי לחץ עשויה להגביל את התפשטות הנגיף או לקדם פיתוח אסטרטגיות התחמקות מתאי NK. עניין זה בביולוגיה של תאי NK משתרע על תחום האימונותרפיה של סרטן, שם חוקרים חוקרים את תפקידם של תאי NK במעקב חיסוני של גידול ובמיקרו-סביבת הגידול1. עם זאת, היכולת ליצור פרופיל של אינטראקציות בין תאי NK לתאי מטרה מסובכת בשל העובדה שתאי NK אנושיים יכולים לבטא למעלה מ-30 קולטנים אשר בתורם יכולים לקיים אינטראקציה עם למעלה מ-30 ליגנדים ידועים2. זיהוי בו-זמני של קולטני תאי NK מרובים והליגנדים הקוגנטיים שלהם הוא, אם כן, הכרחי כדי ללכוד את המורכבות של אינטראקציות הקולטן-ליגנד השולטות בתפקוד NK. כתוצאה מכך, פנינו לציטומטריית מסה (CyTOF), המאפשרת זיהוי בו זמנית של למעלה מ-40 סמנים ברמת התא הבודד. המטרה שלנו הייתה ליצור שני לוחות CyTOF כדי ליצור פרופיל של רפרטואר קולטן-ליגנד של תאי NK. רצינו גם לעצב פרוטוקול לעיבוד וצביעה יעילים של דגימות קליניות. דגימות אנושיות קליניות מספקות שפע של מידע על האופן שבו הגוף מגיב לזיהום ויראלי. לכן, פיתחנו פרוטוקול זה כדי לחקור את הביטוי של קולטני תאי NK והליגנדים הקוגנטיים שלהם במקביל לסטנדרטיזציה טובה יותר, התאוששות משופרת, צריכת ריאגנטים מופחתת והשפעות אצווה מוגבלות.
מספר לוחות ציטומטריית זרימה שנועדו לאפיין את הפנוטיפ של תאי NK אנושיים פורסמו בעבר 3,4,5,6,7,8. רוב הפאנלים הללו מוגבלים ביכולתם ללכוד את רוחב רפרטואר הקולטן-ליגנד, מה שמאפשר רק זיהוי של מבחר מוגבל של סמנים. יתר על כן, לוחות אלה מוגבלים על ידי חפיפת אותות בין פלואורוכרומים. CyTOF משתמש בנוגדנים מצומדים לאיזוטופים מתכתיים, הנקראים על ידי ספקטרומטריית מסה של זמן טיסה, ובכך מפחיתים באופן דרמטי את הזליגה בין הערוצים.
כמונו, חוקרים אחרים פנו ל-CyTOF כדי לחקור תאי NK 9,10,11,12,13,14, אם כי בדרך כלל עם פחות סמנים של תאי NK, מה שמפחית את עומק הפנוטיפ. בעוד שפרוטוקולי הצביעה הכלליים המשמשים את הקבוצות הללו דומים לשלנו, ישנם כמה הבדלים עיקריים. פרוטוקולים אחרים אינם כוללים בידוד תאי NK לפני הצביעה, למרות שהחוקרים מתעניינים רק בתת-קבוצה זו13,14. בהתחשב בכך שתאי NK מהווים רק 5-20% מהתאים החד-גרעיניים בדם ההיקפי (PBMCs), צביעת PBMCs שלמים במקום תאי NK מבודדים פירושה שרוב האירועים שנאספו לא יהיו תאי NK. זה מפחית את כמות הנתונים שנוצרים בתת-קבוצת העניין וגורם לניצול לא יעיל של זמן המכונה. בנוסף, בעוד שרבים מהפאנלים הללו חוקרים ביטוי של קולטני תאי NK כגון קולטנים דמויי Ig קטלניים (KIRs), NKG2A/C/D וקולטני הציטוטוקסיות הטבעיים (NKp30, NKp44 ו-NKp46), ביטוי סמנים אלה אינו מובא בהקשר רחב יותר בשל היעדר נתונים על ביטוי הליגנדים שלהם. כתוצאה מכך, בעוד ששיטות אלה שפורסמו בעבר לחקירת תאי NK באמצעות CyTOF מספיקות לפנוטיפ רחב של תאי NK, המשמשים בבידוד, הן אינן יכולות לספק תמונה מקיפה של פעילות תאי NK. זה מביא אותנו ליתרון העיקרי של השיטות המתוארות כאן, והוא שעד לנקודה זו לא פורסמו ציטומטריית זרימה או פאנלים של CyTOF המתמקדים בחקר הביטוי של ליגנדים לקולטני תאי NK. חשוב לציין, ללוח הליגנד שלנו יש מספר ערוצים פתוחים המאפשרים הוספת סמנים שיתאימו לצרכים הייחודיים של כל ניסוי.
בהתחשב בכך שאחת המגבלות העיקריות של CyTOF היא חוסר היכולת לשחזר את הדגימה לאחר הניתוח, ייתכן ששיטה זו לא תתאים לחוקרים שיש להם דגימות מוגבלות איתן הם מעוניינים לבצע ניסויים נוספים. בנוסף, אופי התפוקה הנמוך של CyTOF פירושו שהנתונים שנוצרו יהיו באיכות ירודה אם מספר התאים ההתחלתי נמוך. למעט שתי המגבלות הללו, שיטה זו תפעל היטב בכל סביבה כדי לחקור אינטראקציות קולטן-ליגנד בין תאי NK לתאי מטרה.
Protocol
PBMCs אנונימיים למבוגרים בריאים הושגו מתאי מערכת הפחתת לויקוגרפיה שנרכשו ממרכז הדם של סטנפורד. PBMCs מתורמי ילדים בריאים וחולי דנגי חריפה בילדים התקבלו ממכון גורגס ללימודי בריאות בפנמה סיטי, פנמה ובתי חולים השייכים למשרד הבריאות, מערכת הביטוח הלאומי בפנמה סיטי ואזורים פרבריים. פרוטוקול מחקר הדנגי אושר על ידי ה-IRB של בית החולים דל ניניו (CBIHN-M-0634), ולאחר מכן אושר על ידי הוועדות של ICGES, CSS, בית החולים סנטו תומאס ואוניברסיטת סטנפורד. PBMCs מחולים נגועים ב-HIV בטיפול אנטי-רטרו-ויראלי התקבלו ממחקר ACTG A5321.
1. תיוג נוגדנים, הכנת פאנל ואחסון
- תיוג נוגדנים עם איזוטופים מתכתיים
הערה: כדי להגביר את הסטנדרטיזציה הבין-ניסויית של צביעה, מומלץ לבצע צימודים מרובים עבור כל נוגדן ולאחר מכן לשלב את המוצרים לתערובת מאסטר אחת לאחסון לטווח ארוך כמתואר להלן.- קבע את הריכוז של כל נוגדן על ידי מדידת הספיגה ב-280 ננומטר לפני ההצמדה. נוגדנים המשמשים לפרוטוקול זה זמינים מסחרית ונרכשו מהספקים המפורטים בטבלת החומרים.
- סמן נוגדנים עם איזוטופים מתכתיים באמצעות ערכות תיוג נוגדנים זמינות מסחרית בהתאם להוראות היצרן. השתמש ב-100 מיקרוגרם נוגדן לכל תגובה.
- קבע את הריכוז הסופי של הנוגדן המוחזר על ידי מדידת הספיגה ב-280 ננומטר. אחסן נוגדנים לטווח קצר בטמפרטורה של 4 מעלות צלזיוס.
- טיטרציות נוגדנים
הערה: טכנולוגיית CyTOF רגישה מאוד לאותות מזהמים פוטנציאליים ממתכות סביבתיות. לכן, יש להכין את כל המאגרים/ריאגנטים המשמשים עם מים טהורים במיוחד ולאחסן במיכלי פלסטיק או זכוכית שמעולם לא נשטפו בסבון.- הכן צינורות צנטריפוגות לכל תורם המכילים 9 מ"ל RPMI חם ושלם (RPMI 1640, 10% FBS, 1% L-גלוטמין, 1% פניצילין/סטרפטומיצין) ו-20 מיקרוליטר בנזונאז לכל בקבוקון של PBMCs להפשרה. מפשירים את ה-PBMCs באמבט מים ומוסיפים לצינורות.
הערה: בנזונאז מפחית את הצמיגות והרקע מ-DNA חופשי מתאים ליזים. - צנטריפוגה בטמפרטורה של 300 x גרם בטמפרטורת החדר למשך 5 דקות. השעו מחדש את ה-PBMCs ב-5 מ"ל של מדיית RPMI מלאה וספירה.
- עבור כל טיטרציה של פאנל, צלח 2-4 מיליון PBMCs / באר ב -6 בארות של צלחת תחתונה עגולה של 96 בארות (באר אחת לכל טיטר ואחת ללא מוכתמים). צנטריפוגה את הצלחת בחום של 600 x גרם בטמפרטורת החדר למשך 3 דקות. יש להזיז את הצלחת כדי להסיר את הסופרנטנט. השעו מחדש כל באר ב-200 מיקרוליטר של CyPBS.
- בצע צביעת כדאיות ציספלטין כמתואר להלן.
הערה: ציספלטין משמש להבחנה בין תאים חיים לתאים מתים בציטומטריה המונית.- השעו מחדש תאים ב-100 מיקרוליטר של מלאי ציספלטין של 25 מיקרומטר. דוגרים בטמפרטורת החדר למשך דקה.
- להרוות את תגובת הציספלטין על ידי הוספת 100 מיקרוליטר FBS לכל באר וערבוב. צנטריפוגה והעיף את הצלחת.
הערה: בצע את כל שלבי הצנטריפוגה הבאים ב-4 מעלות צלזיוס. - שטפו תאים פעמיים עם 200 מיקרוליטר של CyFACS (1x PBS ללא מזהמי מתכות כבדות במים טהורים במיוחד עם 0.1% BSA, 0.05% נתרן אזיד). צנטריפוגה והעיף את הצלחת בכל פעם.
- יש לטטר את לוח הנוגדנים על פני השטח כמתואר להלן.
הערה: יש לבצע תערובות מאסטר נפרדות עבור לוח המשטח של NK ולוח הליגנד.- צור תערובת מאסטר של כל הנוגדנים על פני השטח בריכוז של 10 מיקרוגרם/מ"ל באמצעות CyFACS. כוון לנפח סופי של 150 מיקרוליטר. בצע דילולים סדרתיים של 1:2 באמצעות CyFACS, כדי להשיג את הריכוזים הבאים: 10, 5, 2.5, 1.25 ו-0.625 מיקרוגרם/מ"ל.
- סנן קוקטיילים של נוגדנים דרך יחידת סינון צנטריפוגלית (גודל נקבוביות של 0.1 מיקרומטר) ב-10,600 x גרם למשך 3 דקות לפני הצביעה.
- השעו מחדש את התאים המצופים ב-50 מיקרוליטר של קוקטייל הנוגדנים על פני השטח בטיטר המתאים. השעו מחדש את הבאר הלא מוכתמת ב-CyFACS. דגירה בטמפרטורה של 4 מעלות צלזיוס למשך 30 דקות.
- שטפו תאים עם 150 מיקרוליטר של CyFACS. צנטריפוגה והעיף את הצלחת.
- שטפו תאים עם 200 מיקרוליטר של CyFACS. צנטריפוגה והעיף את הצלחת.
- בצע קיבוע של תאים על ידי השעיה מחדש של כל באר ב-100 מיקרוליטר של 2% פרפורמלדהיד (PFA) ב-CyPBS. דגרו את הצלחת בטמפרטורת החדר בחושך למשך 20 דקות. שטפו תאים עם 100 מיקרוליטר של CyFACS. צנטריפוגה ב 700 x גרם למשך 5 דקות.
זהירות: PFA חשוד כגורם לפגמים גנטיים כמו גם לסרטן. בנוסף, הוא מזיק אם הוא בא במגע עם העיניים, העור או נשאפ. טפל כראוי על ידי הקפדה על אוורור טוב, פתיחת השקע בזהירות ומניעת היווצרות אירוסולים.
הערה: כל סיבובי הצנטריפוגות הבאים מבוצעים ב-700 x גרם למשך 5 דקות ב-4 מעלות צלזיוס. - לחדור תאים על ידי השעיה מחדש ב-200 מיקרוליטר של 1x מאגר פרמביליזציה (מאגר סלסול) מדולל במים טהורים במיוחד. צנטריפוגה והעיף את הצלחת. שטפו תאים עם 200 מיקרוליטר של מאגר פרם. צנטריפוגה והעיף את הצלחת.
הערה: אין צורך בדגירה במאגר Perm. - טיטרציה של פאנל נוגדנים תוך-תאיים
- הכינו תערובת מאסטר של כל הנוגדנים התוך-תאיים בריכוז של 10 מיקרוגרם/מ"ל באמצעות Perm Buffer. כוון לנפח סופי של 150 מיקרוליטר. בצע דילולים סדרתיים של 1:2 באמצעות Perm Buffer כדי להשיג את הריכוזים הבאים: 10, 5, 2.5, 1.25 ו-0.625 מיקרוגרם/מ"ל.
- סנן קוקטיילים של נוגדנים דרך יחידת סינון צנטריפוגלית (גודל נקבוביות של 0.1 מיקרומטר) ב-10,600 x גרם למשך 3 דקות לפני הצביעה.
- השעו מחדש את התאים המצופים ב-50 מיקרוליטר של קוקטייל הנוגדנים התוך תאי בטיטר המתאים. השעו מחדש את הבאר הלא מוכתמת במאגר פרם. יש לדגור בטמפרטורה של 4 מעלות צלזיוס למשך 45 דקות.
הערה: אם פאנל תוך-תאי לא הולך לעבור טיטרציה, השהה מחדש בארות ב-50 מיקרוליטר של מאגר פרם. - שטפו תאים עם 150 מיקרוליטר של מאגר פרם. צנטריפוגה והעיף את הצלחת.
- שטפו תאים עם 200 מיקרוליטר של מאגר פרם. צנטריפוגה והעיף את הצלחת.
- שטפו תאים פעמיים עם 200 מיקרוליטר של CyFACS. צנטריפוגה והעיף את הצלחת.
- צביעת אינטרקלטור DNA
הערה: אינטרקלטור נקשר לחומצת גרעין תאית ומשמש לזיהוי תאים גרעיניים בציטומטריית מסה.- השעיה מחדש של תאים ב-200 מיקרוליטר של אינטרקלטור מדולל 1:10,000 ב-CyPBS ו-2% PFA. דוגרים את הצלחת למשך הלילה בחום של 4 מעלות צלזיוס.
- יש לאחסן צלחות, במידת הצורך, בטמפרטורה של 4 מעלות צלזיוס מכוסות בניילון פרפין עד שבוע.
הערה: בצע את כל שלבי הצנטריפוגה הבאים ב-700 x g למשך 5 דקות ב-4 מעלות צלזיוס. - לפני הפעלת הדגימות ב-CyTOF, הסר את סרט הפרפין מהצלחת והצנטריפוגה ב-700 x גרם למשך 5 דקות ב-4 מעלות צלזיוס. החלק את הצלחת. שטפו תאים פעם אחת עם 200 מיקרוליטר של CyFACS. צנטריפוגה והעיף את הצלחת.
- שטפו תאים שלוש פעמים עם 200 מיקרוליטר מים טהורים במיוחד. צנטריפוגה והעיף את הצלחת. השעו מחדש תאים ב-200 מיקרוליטר של מים טהורים במיוחד. מיד לפני הפעלת הדגימה, התאם את הריכוז לכ-6 x 105 תאים/מ"ל בחרוזי נורמליזציה מדוללים לריכוז פי 1 במים טהורים במיוחד.
- הפעל את הדוגמאות ב-CyTOF.
- נתח נתונים ובחר טיטרים מתאימים לכל נוגדן על ידי בחירת טיטר הנוגדנים הנמוך ביותר שמביא לעוצמת האות הגבוהה ביותר ולהפרדה הטובה ביותר בין אוכלוסיות חיוביות ושליליות על סמך הערכה חזותית.
הערה: טיטרציות עבור לוחות NK וליגנד מוצגות באיור 1 ובאיור 2 בהתאמה. אם לא מזוהה הבחנה ברורה בין אוכלוסיות חיוביות ושליליות, ניתן להעריך טיטרים על סוגי תאים מרובים או על קווי תאים, כדי לאפשר זיהוי של אוכלוסיות תאים חיוביות ושליליות כאחד. - אחסון פאנל נוגדנים
- שלב נוגדנים עם טיטרציה לתערובת מאסטר וסנן דרך יחידת מסנן מזרק סטרילית של 0.1 מיקרומטר. יש לבצע תערובות מאסטר נפרדות עבור לוח המשטח של NK, הפאנל התוך-תאי של NK ולוח הליגנד.
- לאחסון לוחות לטווח הארוך, עקוב אחר אחת משתי האפשרויות המקובלות:
- שלח מיקס מאסטר לחברת צד שלישי לליופיליזציה. שיטה זו משמשת עבור החלונית NK. נוגדנים שאינם מצומדים בתוך הבית אינם ניתנים לליופיליזציה, בשל נוכחותו של מייצב נוגדנים, המפריע לתהליך הליופיליזציה. נוגדנים אלה מתווספים לפאנל ביום הצביעה.
- השתמש בפיפטה משחזרת כדי להכין 50 מיקרוליטר מכל תערובת מאסטר ולאחסן אותם בטמפרטורה של -80 מעלות צלזיוס.
- הכן צינורות צנטריפוגות לכל תורם המכילים 9 מ"ל RPMI חם ושלם (RPMI 1640, 10% FBS, 1% L-גלוטמין, 1% פניצילין/סטרפטומיצין) ו-20 מיקרוליטר בנזונאז לכל בקבוקון של PBMCs להפשרה. מפשירים את ה-PBMCs באמבט מים ומוסיפים לצינורות.
2. פרוטוקול מכתים
- להפשיר תאים חד-גרעיניים בדם היקפי (PBMCs) כמתואר בשלבים 1.2.1 ו-1.2.2. הקצו לפחות מיליון PBMCs לצביעה של פאנל ליגנד בצינור צנטריפוגה של 15 מ"ל. שמור את ה-PBMCs הללו על קרח במהלך בידוד תאי ה-NK.
- בידוד תאי NK
הערה: השלבים הבאים של בידוד תאי NK הם גרסה שונה של פרוטוקול של ספק ספציפי. עם זאת, כל ערכה או פרוטוקול המבצעים ברירה שלילית מבוססת מגנטית של תאי NK יהיו חלופה מתאימה. בנוסף, שלב זה הוא אופציונלי מכיוון שפרוטוקול זה מתאים גם לפנוטיפ של תאי NK מ-PBMCs שלמים.- סובב את ה-PBMCs הנותרים ב-450 x גרם למשך 5 דקות. השעו מחדש את כדור התא ב-40 מיקרוליטר של מאגר MACS (PBS, 0.5% BSA, 2 מ"מ EDTA) לכל 107 תאים בסך הכל.
- הוסף 10 מיקרוליטר של קוקטייל נוגדנים ביוטין של תאי NK לכל 107 תאים בסך הכל. מערבבים היטב ומדגרים 5 דקות על קרח.
- הוסף 30 מיקרוליטר של מאגר MACS לכל 107 תאים בסך הכל ו-20 מיקרוליטר של קוקטייל MicroBead של תא NK לכל 107 תאים בסך הכל. מערבבים היטב ומדגרים 10 דקות על קרח.
- הכן עמודות פליטה על ידי שטיפה עם 500 מיקרוליטר של מאגר MACS. הוסף 2 מ"ל של RPMI שלם קר לצינורות איסוף של 15 מ"ל.
- הוסף מאגר MACS לצינורות המכילים תאים כדי להביא את הנפח עד 500 מיקרוליטר. שוטפים את הצינור עם עוד 500 מיקרוליטר של מאגר MACS ומעבירים לעמודה.
- לאחר הפסקת הזרימה, שטפו את עמוד הפליטה עם מאגר MACS של 500 מיקרוליטר פעמיים. לאחר הפסקת הזרימה, ספור תאי NK.
- צלחת ושטיפה של תאים.
- צנטריפוגה בודדה תאי NK ו-PBMCs ב-300 x גרם בטמפרטורת החדר למשך 10 דקות. השעיית תאים בריכוז של 5 מיליון תאים/מ"ל ב-CyPBS (1x PBS ללא מזהמי מתכות כבדות במים טהורים במיוחד). תאי צלחת בצלחת U תחתונה, 96 בארות.
הערה: כל ציטוט של לוח התאים NK יכול לצבוע עד 3 מיליון תאים. אם שש דגימות תאי NK בודדות עוברות ברקוד ומאוגדות לפני הצביעה, המספר הכולל הכולל של תאי NK לא יעלה על 3 מיליון. לוח הליגנד יכול להכתים עד 6 מיליון PBMCs לכל דגימה. אם שש דגימות בודדות מקודדות ומאוגדות לפני הצביעה, המספר הכולל הכולל של PBMCs לא יעלה על 6 מיליון. - צלחת צנטריפוגה ב 600 x גרם בטמפרטורת החדר למשך 3 דקות. יש להזיז את הצלחת כדי להסיר את הנוזל העל.
הערה: בצע את כל סיבובי הצנטריפוגה הבאים ב-600 x גרם למשך 3 דקות עד לשלב 2.7. - השעו מחדש תאים ב-200 מיקרוליטר של CyPBS. צנטריפוגה והעיף את הצלחת.
- צנטריפוגה בודדה תאי NK ו-PBMCs ב-300 x גרם בטמפרטורת החדר למשך 10 דקות. השעיית תאים בריכוז של 5 מיליון תאים/מ"ל ב-CyPBS (1x PBS ללא מזהמי מתכות כבדות במים טהורים במיוחד). תאי צלחת בצלחת U תחתונה, 96 בארות.
- בצע צביעת כדאיות ציספלטין כמתואר בשלב 1.2.4.
- צביעת ברקוד
הערה: לוחות אלה משמשים בשילוב עם שיטת ברקוד מבוססת פלדיום ששתיים מתוך ארבע על תאים חיים לא קבועים כדי למזער את השפעות האצווה ולמקסם את התאוששות התאים15. עם זאת, שלב זה הוא אופציונלי מכיוון שברקוד אינו הכרחי כדי להשיג נתונים איכותיים.- השעו מחדש כל באר ב-50 מיקרוליטר של ברקוד מעורבב מראש בהתאמה ודגרו בטמפרטורה של 4 מעלות צלזיוס למשך 30 דקות. שטפו תאים עם 150 מיקרוליטר של CyFACS. צנטריפוגה והעיף את הצלחת.
- שטפו תאים פעמיים עם 200 מיקרוליטר של CyFACS. צנטריפוגה והעיף את הצלחת. השעו מחדש את כל הבארות ב-30 מיקרוליטר של CyFACS. שלבו עד שש בארות של תאים מוכתמים בברקודים ייחודיים לבאר אחת ובצעו צנטריפוגה והחלקה של הצלחת.
- מכתים על פני השטח
- ממיסים את הליוספירה של פאנל NK ב-50 מיקרוליטר של CyFACS עם נוגדנים נוספים על פני השטח (anti-CD16, anti-HLA-DR, anti-LILRB1). הפשירו פאנל ליגנד המאוחסן בטמפרטורה של -80 מעלות צלזיוס וסובבו את הצינור באמצעות מיני צנטריפוגה. ספייק בסמני משטח נוספים של לוח ליגנד (anti-CD16, anti-CD19).
הערה: יש לסנן כל קוקטייל נוגדנים שלא סונן בעבר (כלומר, לפני ליופיליזציה או הקפאה) דרך יחידת סינון צנטריפוגלית (גודל נקבוביות של 0.1 מיקרומטר) ב-10,600 x גרם למשך 3 דקות לפני הצביעה. - השעו מחדש כל באר ב -50 מיקרוליטר של הפאנל המתאים. דגירה בטמפרטורה של 4 מעלות צלזיוס למשך 30 דקות. שטפו תאים עם 150 מיקרוליטר של CyFACS. צנטריפוגה והעיף את הצלחת. שטפו שוב תאים עם 200 מיקרוליטר של CyFACS. צנטריפוגה והעיף את הצלחת.
- ממיסים את הליוספירה של פאנל NK ב-50 מיקרוליטר של CyFACS עם נוגדנים נוספים על פני השטח (anti-CD16, anti-HLA-DR, anti-LILRB1). הפשירו פאנל ליגנד המאוחסן בטמפרטורה של -80 מעלות צלזיוס וסובבו את הצינור באמצעות מיני צנטריפוגה. ספייק בסמני משטח נוספים של לוח ליגנד (anti-CD16, anti-CD19).
- תקן תאים כמתואר בשלב 1.2.6.
הערה: בצע את כל סיבובי הצנטריפוגות הבאים ב-700 x גרם למשך 5 דקות ב-4 מעלות צלזיוס. - לחדור תאים כמתואר בשלב 1.2.7.
- צביעה תוך-תאית
- ממיסים את הליוספירה התוך-תאית של פאנל NK ב-50 מיקרוליטר של מאגר פרם. הכן קוקטייל נוגדנים תוך תאי לדגימות PBMC אם תרצה.
הערה: יש לסנן כל קוקטייל נוגדנים שלא סונן בעבר (כלומר, לפני ליופיליזציה או הקפאה) דרך יחידת סינון צנטריפוגלית (גודל נקבוביות של 0.1 מיקרומטר) ב-10,600 x גרם למשך 3 דקות לפני הצביעה. - השעו בארות ב -50 מיקרוליטר מהפאנלים התוך-תאיים המתאימים. אם לא נעשה שימוש בפאנל תוך-תאי בשילוב עם לוח פני השטח של הליגנד, השהה מחדש בארות PBMC ב-50 מיקרוליטר של מאגר פרם. יש לדגור בטמפרטורה של 4 מעלות צלזיוס למשך 45 דקות.
- שטפו תאים עם 150 מיקרוליטר של מאגר פרם. צנטריפוגה וצלחת פליק. שטפו תאים עם 200 מיקרוליטר של מאגר פרם. צנטריפוגה והעיף את הצלחת.
- שטפו תאים פעמיים עם 200 מיקרוליטר של CyFACS. צנטריפוגה והעיף את הצלחת.
- ממיסים את הליוספירה התוך-תאית של פאנל NK ב-50 מיקרוליטר של מאגר פרם. הכן קוקטייל נוגדנים תוך תאי לדגימות PBMC אם תרצה.
- צביעת אינטרקלטור DNA. בצע צביעת אינטרקלטור DNA כמתואר בשלב 1.2.9.1. דגרו את הצלחת למשך הלילה בטמפרטורה של 4 מעלות צלזיוס.
הערה: אינטרקלטור נקשר לחומצת גרעין תאית ומשמש לזיהוי תאים גרעיניים בציטומטריית מסה. ניתן לאחסן צלחות מכוסות בניילון פרפין עד שבוע בטמפרטורה של 4 מעלות צלזיוס. - לפני הפעלת הדגימות ב-CyTOF, שטפו תאים כמתואר בשלבים 1.2.9.3 ו-1.2.9.4.
- הפעל דוגמאות ב-CyTOF.
תוצאות
נוגדנים הוצמדו לאיזוטופים מתכתיים באמצעות ערכות תיוג זמינות מסחרית, על פי הוראות היצרן. שיבוטי נוגדנים אומתו על ידי ציטומטריית זרימה וציטומטריית מסה לפני השימוש בפאנל זה. רשימה ראשונית של שיבוטים נבחרה על סמך סקירת הספרות וזמינות הנוגדנים. רמות הביטוי של ליגנדים מסוימים עבור קולטני תאי NK נמוכות או בלתי ניתנות לזיהוי ב-PBMCs בריאים. לכן, צביעה חיובית עבור נוגדנים מסוימים אומתה על ידי צביעת PBMCs בריאים, תאי לוקמיה מיאלואידית כרונית K562, תאי לוקמיה לימפובלסטית חריפה NALM6, או לוקמיה לימפובלסטית חריפה של תאי B 697 (איור משלים 1). שיבוטים שנבחרו עבור לוח התאים NK שלא ייצרו כתם הולם או שהיו יקרים מדי הוחלפו בשיבוטים שונים, כמפורט בטבלה משלימה 1 ומוצג באיור משלים 2.
זיווג איזוטופים מתכתיים עם נוגדנים עבור לוחות אלה בוצע תוך שימוש בעקרונות שהותוו על ידי Takahashi et al.16. סמני השושלת היו בעוצמה בינונית עד גבוהה. כתוצאה מכך, הם היו מצומדים בעיקר למסות בעלות רגישות נמוכה ובינונית, מה שהשאיר מסות רגישות גבוהות זמינות להצמדה לנוגדנים כנגד סמנים בעלי ביטוי עמום יותר. תוכנת מעצב פאנל זמינה לציבור שימשה לאיתור בעיות רגישות לשפע (M ± 1 bleed) או חמצון (M + 16 bleed) וזוגות נוגדנים-מתכת הוקצו מחדש בהתאם. בנוסף, מספר סמנים הוצמדו על מתכות שונות עם הבדלים מינימליים שצוינו בעוצמות האות (טבלה משלימה 2 ואיור משלים 3). זיווגי נוגדנים-מתכת ומידע על שיבוטים עבור לוחות NK וליגנד מפורטים בטבלה 1 ובטבלה 2 בהתאמה.
נוגדנים מצומדים פנימיים נבדקו על PBMCs בחמישה טיטרים שונים: 0.625, 1.25, 2.5, 5 ו-10 מיקרוגרם/מ"ל. טיטר הנוגדנים הנמוך ביותר שהביא לעוצמת האות הגבוהה ביותר ולהפרדה הטובה ביותר בין אוכלוסיות חיוביות ושליליות נבחר על סמך הערכה חזותית. טיטרציות עבור לוחות NK וליגנד מוצגות באיור 1 ובאיור 2 בהתאמה. עבור סמנים מסוימים, לא זוהתה הבחנה ברורה בין אוכלוסיות חיוביות ושליליות, מכיוון שהסמן היה מבוטא במעומעם או חיובי באופן אוניברסלי. כדי לקבוע את דילול העבודה המדויק ביותר עבור נוגדנים אלה, טיטרים הוערכו על סוגי תאים מרובים (PBMCs, תאי T, תאי B או תאי NK), או על קווי תאים, כדי לאפשר זיהוי של אוכלוסיות תאים חיוביים ושליליים כאחד (איור משלים 4). מדד הצביעה (SI) עבור כל סמן לא חושב מכיוון שמדד זה אינו ישים לנתוני CyTOF17,18.
הפאנלים המתוארים כאן תוכננו להיות תואמים לברקוד לדוגמה. ישנן מספר שיטות ברקוד זמינות עבור CyTOF. הנפוצים ביותר הם ערכה מבוססת פלדיום זמינה מסחרית, הדורשת קיבוע לפני קידוד, ושיטת הברקוד מבוססת CD45 שתוארה על ידי Mei et al.15, המאפשרת ברקוד של תאים חיים. כדי להעריך איזו שיטת ברקוד מתאימה ביותר לצרכים שלנו, בדקנו את היציבות של צביעת סמן תאי NK לאחר קיבוע בגרסה מוקדמת של פאנל תאי NK (איור משלים 5). מצאנו כי הביטוי של רוב סמני תאי NK הושפע מקיבוע. כתוצאה מכך, החלטנו להשתמש בשיטת ברקוד מותאמת של שניים מתוך ארבעה, מבוססת CD45 על תאים חיים15. שיטת ברקוד זו משתמשת ב-102Pd, 104Pd, 106Pd ו-108Pd, ושונה משיטת שלוש מתוך שש שתוארה במקור על ידי Mei et al., שהשתמשה ב-104Pd, 106Pd, 108Pd, 110Pd, 113אינץ' ו-115אינץ'. ערוצי אינדיום לא נכללו בסכימת הברקוד שלנו, מכיוון שהם הפריעו לאות מ-115In-CD3. 110Pd לא נכלל מכיוון שהוא הפריע לאות מה-HLA-DR Qdot וה-CD19 Qdot בתא NK ובלוחות הליגנד, בהתאמה.
למרות שאנו ממליצים על טיהור תאי NK לפני הצביעה, לוח תאי NK נועד לאפשר פנוטיפ של תאי NK מ-PBMCs שלמים. דוגמה לאסטרטגיית שער תאי NK שלנו מוצגת באיור 3A באמצעות PBMCs מתורם בריא. צביעה ושערים עבור כל אחד מסמני ה-NK מוצגים על תאי NK בריאים ומבודדים באיור 3B. פאנל הליגנד נועד לזהות את הביטוי של ליגנדים של תאי NK על PBMCs שלמים. איור 4A ממחיש את אסטרטגיית השער המשמשת לזיהוי תאי CD4+ T, תאי CD8+ T, תאי NK, מונוציטים ותאי CD19+ B ב-PBMCs מתורם בריא. דוגמאות צביעה מייצגות עבור כל ליגנד מוצגות באיור 4B באמצעות PBMCs מחולי דנגי חריפים ואנשים נגועים ב-HIV שדוכאו וירולוגית.
כדי להבטיח יציבות פאנל לאורך זמן, הפרוטוקול שלנו כולל שתי אפשרויות אפשריות: ליופיליזציה באמצעות חברת צד שלישי לחרוזים חד פעמיים או הקפאת אליקוטים מוכנים מראש ב-80 מעלות צלזיוס. עבור פרוטוקול זה, פאנל ה-NK עבר ליופיליזציה, ופאנל הליגנד הוקפא. שתי השיטות אומתו לפני השימוש בכל פאנל בדגימות קליניות.
הפקנו למעלה מ-700 תגובות של פאנל NK מתערובת מאסטר אחת על ידי ביצוע צימודים מרובים של כל נוגדן בפאנל. לאחר אימות וטיטרציה של כל נוגדן מצומד, הנוגדנים שולבו לתערובת מאסטר, סוננו דרך יחידת מסנן מזרק סטרילית של 0.1 מיקרומטר, ונשלחו לחברת צד שלישי לליופיליזציה. נוצרו שתי קבוצות של ליוספירות עם כתמים בודדים, אחת לצביעה על פני השטח ואחת לצביעה תוך-תאית. לא ניתן היה להוסיף נוגדנים שאינם מצומדים בתוך הבית (HLA-DR ו-CD16) לליאוספירה, בשל נוכחותו של מייצב נוגדנים, המפריע לתהליך הליופיליזציה. נוגדנים אלה מתווספים לפאנל ביום הצביעה. השוואה בין כתמים שהתקבלו לפני ואחרי הליופיליזציה מוצגת באיור משלים 6. השיבוט של נוגדן LILRB1 ששימש בתחילה בליוספרות לא יצר כתם חזק מספיק (טבלה משלימה 1 ואיור משלים 2). לאחר מכן זוהה שיבוט טוב יותר, צורף ונוסף ללוח ביום הצביעה (טבלה 1). הנוגדן הפוליקלונלי KIR2DS2 המשמש בליופשרים צוין כמייצר כתם לא ספציפי לאחר ליופיליזציה ואיננו ממליצים להשתמש בו לניתוחים הבאים (טבלה משלימה 1 ואיור משלים 2). רוב הכתמים התוך-תאיים עלו מעט בעוצמתם בעקבות ליופיליזציה (איור משלים 6).
לפני האחסון של תערובת מאסטר פאנל הליגנד ב-80 מעלות צלזיוס, בדקנו שני תנאי אחסון שונים. הכנו תערובת מאסטר קטנה יותר של פאנל זה ואחסנו כמויות בטמפרטורה של -80 מעלות צלזיוס ובחנקן נוזלי למשך כחודשיים. לאחר חודשיים הכתמנו PBMCs שלמים עם האליקוטים הקפואים. השווינו את הצביעה לזו של PBMCs מאותו תורם שהוכתם בפאנל הטרי שהוכן (איור משלים 7). מצאנו אחסון ב-80 מעלות צלזיוס ובחנקן נוזלי אינו משנה את עוצמת האות עבור רוב הסמנים. למעשה, עוצמת האות של אנטי-פאן HLA Class I, anti-CD7, anti-CD4, anti-HLA-BW4, anti-CD14, anti-CD11b ו-anti-LFA-3 גבוהה יותר בהקפאה, במיוחד במקרה של דגימות המאוחסנות ב-80 מעלות צלזיוס. לא יכולנו לקבוע אם עוצמות האותות של anti-LLT-1, anti-Nectin-1, anti-MICA/B, anti-DR4/5, anti-ULBP-1,2,5,6, anti-Nectin-2, anti-CD155 ו-anti-B7-H6 הושפעו מההקפאה, בשל העובדה ש-PBMCs בריאים אינם מבטאים רמות גבוהות של סמנים אלה. עם זאת, אימות סמנים אלה על קווי תאים (איור משלים 1) בוצע באמצעות נוגדנים מצומדים המאוחסנים ב-80 מעלות צלזיוס. כתוצאה מכך, היינו בטוחים שהקפאה לא גרמה לאובדן משמעותי של האות. עוצמת האות אכן ירדה עם ההקפאה עבור חמישה סמנים: anti-CD8, anti-ICAM-1, anti-CCR2, anti-CD33 ו-anti-CD56. עם זאת, בכל המקרים הללו נותרה ההפרדה הברורה בין האוכלוסייה החיובית לאוכלוסייה השלילית. בהתחשב בכך שנוגדנים מצומדים מתכת אינם יציבים ב-4 מעלות צלזיוס לפרקי זמן ארוכים, הקפאה הייתה הכרחית כדי לשמור על יציבות הפאנל לטווח ארוך, ולמרות ירידה בעוצמת הצביעה בתת-קבוצה של סמנים, הצלחנו לשמור על הפרדת צביעה מספקת. חשוב לציין, אובדן עוצמת האות של anti-CD8, anti-CCR2 ו-anti-CD56 היה גדול יותר בדגימות המאוחסנות בחנקן נוזלי בהשוואה לאלו המאוחסנות ב-80 מעלות צלזיוס. על סמך נתונים אלה, החלטנו לאחסן את הפאנל בטמפרטורה של -80 מעלות צלזיוס.
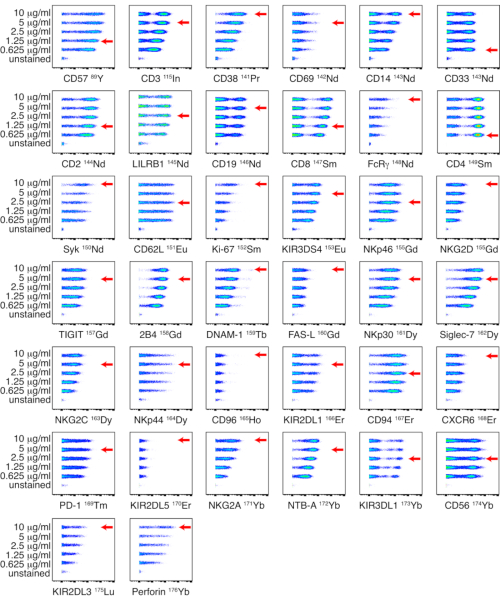
איור 1: טיטרציה של צימודי נוגדנים-מתכת מצומדים פנימיים עבור פאנל NK. טיטרציות של נוגדנים מצומדים פנימיים בוצעו על PBMCs מתורם בריא תוך שימוש בחמישה ריכוזים שונים: 0.625, 1.25, 2.5, 5 ו-10 מיקרוגרם/מ"ל. טיטרים לאנטי-CD3, אנטי-CD14, אנטי-CD33, אנטי-CD19, אנטי-PD-1 ואנטי-CD56 נקבעו על ידי שער על תאים חיים. טיטרים לאנטי-CD4 ואנטי-CD8 נקבעו על ידי שער על תאי T. טיטרים לנוגדנים הנותרים נקבעו על ידי שער על תאי NK. מכיוון ש-NKp44 אינו מתבטא בתאי NK במנוחה, נקבעו טיטרים על PBMCs מגורים עם IL-2 והוצגו בתאי NK. החצים האדומים מציינים את הטיטר שנבחר עבור כל נוגדן. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 2: טיטרציה של נוגדנים בפאנל ליגנד מצומד פנימי. טיטרציות של נוגדנים מצומדים פנימיים בוצעו על PBMCs מתורם בריא תוך שימוש בחמישה ריכוזים שונים: 0.625, 1.25, 2.5, 5 ו-10 מיקרוגרם/מ"ל. טיטרים לאנטי-HLA-DR, אנטי-ICAM-1, אנטי-CCR2, אנטי-CD14, אנטי-CD11b ואנטי-LFA-3 נקבעו על ידי שער על תאי CD3-CD7. טיטרים לאנטי-CD3, אנטי-HLA Class I, אנטי-CD7, אנטי-CD48, אנטי-LLT-1, אנטי-HLA-C,E, אנטי-HLA-E, אנטי-FasR, anti-Nectin-1, anti-MICA/MICB, anti-DR4/DR5, anti-ULBP-1,2,5,6, anti-Nectin-2, anti-CD155, anti-HLA-BW4, anti-HLA-BW6, anti-CD33, anti-CD56 ו-Anti-B7-H6 נקבעו על ידי שער על תאים חיים. טיטרים לאנטי-CD4 ואנטי-CD8 נקבעו על ידי שער על תאי CD3+. החצים האדומים מציינים את הטיטר שנבחר עבור כל נוגדן. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
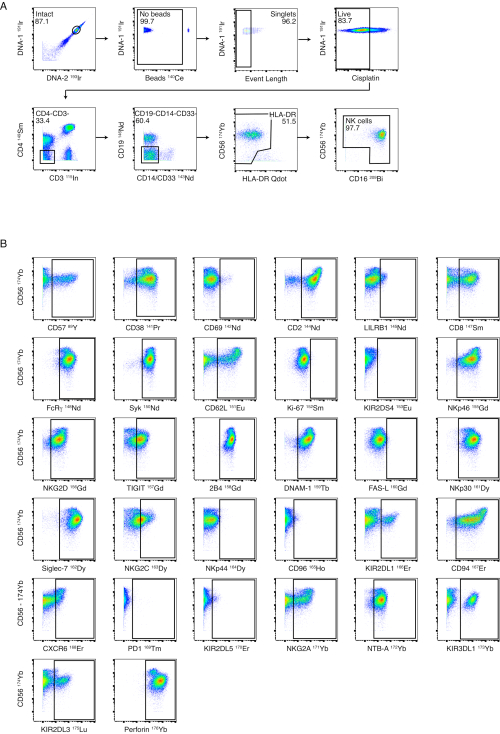
איור 3: אסטרטגיית שער פאנל NK וביצועים. (A) שער שלילי סדרתי מ-PBMCs שלמים לתאי NK מוצג בתורם בריא. שערים שלמים, חרוזים ואורך אירוע מבטיחים שער מוצלח לתאים בודדים. צביעת ציספלטין בוצעה ככתם חי/מת. תאי T ותאי B לא נכללו באמצעות CD3 ו-CD19. מונוציטים לא נכללו על ידי שער שלילי על CD4 ו-CD14/CD33 ועל ידי שער שלילי נוסף של תאיםבהירים CD56-/HLA-DR. CD56 ו-CD16 שימשו לזיהוי תת-קבוצות שונות של תאי NK (CD56בהיר, CD56עמום ו-CD56-). (B) דוגמאות לביטוי של קולטני תאי NK על תאי NK מתורם בריא אחד שמטוהר על ידי בידוד חרוזים מגנטיים. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 4: שער פאנל ליגנד וביצועים. (A) שער של תת-קבוצות תאי חיסון עיקריים מ-PBMCs שמקורם בתורם בריא לאחר נורמליזציה, הסרת חרוזי כיול והסרת קידוד. (B) ביטוי של ליגנדים לקולטני תאי NK כמו גם מספר סמנים מיאלואידים על PBMCs חיים. צביעה עבור כל הליגנדים למעט Nectin-1 ו-B7-H6 מוצגת ב-PBMCs מחולי דנגי חריפה. צביעה עבור Nectin-1 ו-B7-H6 מוצגת על PBMCs מאנשים נגועים ב-HIV שדוכאו וירולוגית. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
איור משלים 1: אימות שיבוטי נוגדנים עבור פאנל ליגנד על קווי תאים. נוגדנים נגד ליגנדים לקולטני תאי NK המתבטאים ברמות נמוכות ב-PBMCs בריאים אומתו על ידי צביעת קווי תאים. תאי לוקמיה מיאלואידית כרונית K562 נצבעו באנטי-ICAM-1, אנטי-MICA/MICB, אנטי-DR4/DR5, אנטי-ULBP-1,2,5,6, אנטי-נקטין-2, אנטי-CD155 ואנטי-B7-H6. תאי לוקמיה לימפובלסטית חריפה NALM6 נצבעו באנטי-LLT-1 ותאי לוקמיה לימפובלסטית חריפה של תאי B 697 נצבעו באנטי-נקטין-1. עלילות נקודות והיסטוגרמות המציגות כתמים על PBMCs בריאים הם בכחול. תרשימי נקודות והיסטוגרמות המראים צביעה על קו התא המתאים הם באדום. אחוז התאים של קו התאים המתאים החיוביים לסמן נתון מסופקים. אנא לחץ כאן להורדת קובץ זה.
איור משלים 2: אימות של שיבוטי נוגדנים. (A) שיבוטי נוגדנים שונים נבדקו בתורמים בריאים כדי לזהות את השיבוט עם הספציפיות הטובה ביותר. 2B4, CXCR6, KIR2DS4, NKG2A ו-TIGIT מוצגים בתאי NK. CD56 ו-LILRB1 מוצגים על תאים חיים. (B) שיבוט הנוגדנים KIR2DS2 הראה כתם לא ספציפי אחרי ליופיליזציה. דוגמה לצביעה על אותו תורם ניתנת לפני ואחרי הליופיליזציה. אנא לחץ כאן להורדת קובץ זה.
איור משלים 3: אופטימיזציה של זוגות נוגדנים/מתכות. מוצגים כתמים של PBMCs מתורמים בריאים. (א) זוגות נוגדנים/מתכת שנבדקו עבור הפאנל. (ב) זוגות נוגדנים/מתכת המשמשים בפאנל. LILRB1 ו-PD1 מוצגים על תאים חיים. כל שאר הסמנים מוצגים בתאי NK. אנא לחץ כאן להורדת קובץ זה.
איור משלים 4: טיטרציה של סמני תאי NK בעלי ביטוי עמום וחיובי ברובם. טיטרים לנוגדנים כנגד סמני תאי NK שלא הראו אוכלוסייה חיובית ושלילית ברורה הוערכו הן על תאי NK (אדום) והן על תאי B (כחול) או PBMCs (אפור) מתורמים בריאים. החצים מציינים את הטיטר שנבחר עבור כל נוגדן. אנא לחץ כאן להורדת קובץ זה.
איור משלים 5: אופטימיזציה של פרוטוקול ברקוד. יציבות האפיטופ נבדקה לפני ואחרי קיבוע עם 2% פרפורמלדהיד על PBMCs מתורם בריא. (A) צביעת CD3, CD14 ו-CD56 הייתה דומה לפני הקיבוע (האדום) ואחרי הקיבוע (הכחול), צביעת CD4 ו-CD16 הושפעה באופן משמעותי מהקיבוע. (B) סמנים רבים של תאי NK הושפעו מקיבוע, כולל CD2, CD38, KIR3DL2, CD62L, KIR2DS4, NKp46, NKG2C, NKp30, NKG2D, KIR3DL1, TIGIT, KIR2DL1, KIR2DL3 ו-NTB-A. אנא לחץ כאן להורדת קובץ זה.
איור משלים 6: אישור יציבות הפאנל לאחר ליופיליזציה. היציבות של צימודי נוגדנים פנימיים אושרה על ידי צביעת PBMCs מאותו תורם בנק דם לפני ליופיליזציה (כחול) ופוסט-ליופיליזציה (אדום). כתמים נגד CD3, אנטי-CD14, אנטי-CD33, אנטי-CD19, אנטי-PD-1, אנטי-CD56 מוצגים על תאים חיים. אנטי-CD4 ואנטי-CD8 מוצגים על תאי CD3+ . טיטרים עבור הנוגדנים הנותרים מוצגים על תאי NK, מגודרים בהתאם לסכימת השערים המוצגת באיור 1. יש לציין כי אנטי-KIR2DS2 מוכתם באופן לא ספציפי לאחר ליופיליזציה ולכן לא שימש לניתוחים הבאים. אנא לחץ כאן להורדת קובץ זה.
איור משלים 7: אישור יציבות לוח הליגנד ב-80 מעלות צלזיוס. היציבות של צימודי נוגדנים פנימיים אושרה על ידי צביעת PBMCs בריאים מאותו תורם בתערובת מאסטר טרייה שהוכנה וכן אותה תערובת לאחר אחסון ב-80 מעלות צלזיוס או בחנקן נוזלי. צביעה נגד HLA-DR, אנטי-ICAM-1 ואנטי-LFA-3 מוצגת על תאי CD3-CD7-. אנטי-CD3, אנטי-פאן HLA Class I, אנטי-CD7, אנטי-CD48, אנטי-LLT-1 אנטי-HLA-E, אנטי-FasR, אנטי-Nectin-1, אנטי-MICA/B, אנטי-DR4/5, אנטי-ULBP-1,2,5,6, אנטי-Nectin-2, אנטי-CD155, אנטי-HLA-BW4, אנטי-HLA-BW6 ואנטי-B7-H6 צביעה מוצגת על תאים חיים. צביעה נגד CD8 ואנטי CD4 מוצגת על תאי CD3+. צביעה נגד HLA-C,E, ANTI-CCR2, anti-CD11b ואנטי-CD33 מוצגת על תאי CD3-CD7-CD14+. צביעה נגד CD14 מוצגת בתאי CD3-CD7-CD33+ וצביעה נגד CD56 מוצגת בתאי CD3-CD7+CD14-HLA-DR. היסטוגרמות המציגות כתמים עם הפאנל הטרי שהוכן באדום. היסטוגרמות המציגות כתמים עם הפאנל לאחר אחסון ב-80 מעלות צלזיוס למשך כחודשיים הן בכחול. היסטוגרמות המציגות צביעה עם הפאנל לאחר אחסון בחנקן נוזלי (LN2) במשך כחודשיים הן בצבע ירוק. הדגימות היו מוכתמות והופעלו בימים שונים. הקבצים נורמלו וחרוזים הוסרו באמצעות חבילת premessa. אנא לחץ כאן להורדת קובץ זה.
| ספציפיות | שיבוט | איזוטופ | תכלית | משטח/תוך-תאי |
| CD57 | HCD57 | 89Y | בשלות/זיכרון | משטח |
| CD45 | היי30 | 102Pd, 104Pd, 106Pd, 108Pd | ברקוד | משטח |
| HLA-DR | Tü36 | Qdot 655 (112תקליטורים-114 תקליטורים) | הפעלה/שושלת | משטח |
| תקליטור 3 | UCHT | 115ב | שושלת תאי T | משטח |
| תקליטור 38 | היט 2 | 141יחסי ציבור | סמן הפעלה | משטח |
| תקליטור 69 | FN50 | 142Nd | סמן הפעלה | משטח |
| תקליטור 33 | WM53 | 143Nd | שושלת מונוציטים | משטח |
| תקליטור 14 | M5E5 | 143Nd | שושלת מיאלואידית | משטח |
| תקליטור 2 | RPA-2.10 | 144Nd | הפעלה/בשלות | משטח |
| LILRB1 | MAB20172 | 145Nd | קולטן מעכב | משטח |
| תקליטור 19 | HIB19 | 146Nd | שושלת תאי B | משטח |
| תקליטור 8 | SK1 | 147ס.מ. | שושלת תאי T והפעלה/בשלות של תאי NK | משטח |
| פ.ק.ר.ג | פוליקלונלי | 148Nd | בגרות/הסתגלות | תאיים |
| תקליטור 4 | SK3 | 149ס.מ. | שושלת תאי T | משטח |
| סיק | 4ד10.2 | 150Nd | איתות | תאיים |
| CD62L | DREG-56 | 151האיחוד האירופי | ההפעלה | משטח |
| קי-67 | קי-67 | 152ס.מ. | התפשטות | תאיים |
| KIR2DS4 | 179315 | 153האיחוד האירופי | הפעלת קולטן | משטח |
| NKp46 | 9.00ה+02 | 155אלוהים | הפעלת קולטן | משטח |
| NKG2D | 1D11 | 156אלוהים | הפעלת קולטן | משטח |
| טיגיט | 741182 | 157אלוהים | קולטן מעכב | משטח |
| 2ב4 | ג1.7 | 158אלוהים | הפעלת קולטן | משטח |
| דנאם-1 | DX11 | 159שחפת | הפעלת קולטן | משטח |
| FAS-L | NOK-1 | 160אלוהים | אפופטוזיס | משטח |
| NKp30 | עמ' 30-15 | 161די | הפעלת קולטן | משטח |
| סיגלק-7 | עונה 7.7 | 162די | קולטן מעכב | משטח |
| NKG2C | 134522 | 163די | בשלות/זיכרון | משטח |
| NKp44 | עמ' 44-8 | 164די | הפעלת קולטן | משטח |
| תקליטור 96 | NK92.39 | 165הו | קולטן NKG2 | משטח |
| KIR2DL1/KIR2DS5 | 143211 | 166Er | קולטן מעכב | משטח |
| תקליטור 94 | DX22 | 167Er | הפעלת קולטן | משטח |
| CXCR6 | K041E5 | 168Er | זכרון | משטח |
| PD1 | EH12.2H7 | 169תמ | קולטן מעכב | משטח |
| KIR2DL5 | UP-R1 | 170Er | קולטן מעכב | משטח |
| NKG2A | 131411 | 171יב | קולטן מעכב | משטח |
| NTB-A | NT-7 | 172שחפת | הפעלת קולטן | משטח |
| KIR3DL1 | DX-9 | 173יב | קולטן מעכב | משטח |
| CD56 | NCAM16.2 | 174יב | שושלת תאי NK | משטח |
| KIR2DL3 | 180701 | 175לו | קולטן מעכב | משטח |
| פרפורין | B-D48 | 176יב | חלבון ציטוליטי | תאיים |
| DNA-1/DNA-2 | נה | 191איר/193איר | תאים גרעיניים | משטח |
| ציספלטין | נה | 194נק/195נק' | כדאיות | משטח |
| תקליטור 16 | 3G8 | 209Bi | קולטן FcgRIII | משטח |
טבלה 1: פאנל NK. סמנים מסודרים על פי המסה האיזוטופית של המתכת שאליה הם היו מצומדים. 191Ir/193Ir הוא השפע הטבעי של אינטרקלטור חומצת הגרעין. 194Pt/195Pt הוא השפע הטבעי של ציספלטין.
| ספציפיות | שיבוט | איזוטופ | תכלית | משטח/תוך-תאי |
| HLA-DR | L243 | 89Y | תאים מציגים אנטיגן, סמן הפעלה | משטח |
| CD45 | היי30 | 102Pd, 104Pd, 106Pd, 108Pd | ברקוד | משטח |
| תקליטור 19 | SJ25-C1 | Qdot 655 (112תקליטורים-114 תקליטורים) | השושלת | משטח |
| תקליטור 3 | UCHT1 | 115ב | השושלת | משטח |
| פאן HLA מחלקה I | מ6/32 | 143Nd | ליגנדים של KIR | משטח |
| תקליטור 7 | CD7-6B7 | 144Nd | השושלת | משטח |
| תקליטור 8 | SK1 | 145Nd | השושלת | משטח |
| CD48 | BJ40 | 146Nd | ליגנד 2B4 | משטח |
| ICAM-1 | HA58 | 148Nd | ליגנד LFA-1 | משטח |
| LLT-1 | 402659 | 149ס.מ. | ליגנד CD161 | משטח |
| תקליטור 4 | אישור4 | 151האיחוד האירופי | השושלת | משטח |
| HLA-C,E | DT9 | 153האיחוד האירופי | ליגנדים של KIR | משטח |
| CCR2 | K036C2 | 154ס.מ. | סמן פונקציונלי מונוציטים | משטח |
| HLA-E | תלת מימד12 | 155אלוהים | ליגנד NKG2A/CD94 ו-NKG2C/CD94 | משטח |
| פאס (CD95) | DX2 | 156אלוהים | קולטן FasL | משטח |
| נקטין-1 | ₪302 | 157אלוהים | ליגנד CD96 | משטח |
| מיקה/ב | 159227/236511 | 158אלוהים | ליגנדים NKG2D | משטח |
| DR4/5 | DJR1/DJR2-2 | 159שחפת | קולטני TRAIL | משטח |
| ULBP-1/2,5,6 | 170818/165903 | 161די | ליגנדים NKG2D | משטח |
| נקטין-2 | TX31 | 164די | ליגנד DNAM-1, TIGIT ו-CD96 | משטח |
| תקליטור 155 | סקי.4 | 165הו | ליגנד DNAM-1, TIGIT ו-CD96 | משטח |
| HLA-BW4 | REA274 | 166Er | KIR3DL1 ligand | משטח |
| HLA-BW6 | REA143 | 168Er | אלל אפס KIR | משטח |
| תקליטור 14 | M5E2 | 169תמ | השושלת | משטח |
| CD11b | ICRF44 | 170Er | השושלת | משטח |
| LFA-3 | TS2/9 | 171יב | ליגנד CD2 | משטח |
| תקליטור 33 | WM53 | 172יב | השושלת | משטח |
| CD56 | NCAM16.2 | 174יב | השושלת | משטח |
| B7-H6 | 875001 | 176יב | ליגנד NKp30 | משטח |
| DNA-1/DNA-2 | נה | 191איר/193איר | תאים גרעיניים | משטח |
| ציספלטין | נה | 194נק/195נק' | כדאיות | משטח |
| תקליטור 16 | 3G8 | 209Bi | השושלת | משטח |
טבלה 2: לוח ליגנד. סמנים מסודרים על פי המסה האיזוטופית של המתכת שאליה הם היו מצומדים. 191Ir/193Ir הוא השפע הטבעי של אינטרקלטור חומצת הגרעין. 194Pt/195Pt הוא השפע הטבעי של ציספלטין.
| ספציפיות | שיבוט | ספק | מספר קטלוגי | משטח/ תוך-תאי | הערות |
| 2ב4 | 2-69 | BD Biosciences | 550814 | משטח | שיבוט חדש מאומת עם צביעה משופרת |
| CD56 | N901 | בקמן קולטר | 6602705 | משטח | שיבוט חדש מאומת עם צביעה משופרת |
| CXCR6 | 56811 | מערכות מו"פ | מב699 | משטח | שיבוט חדש מאומת בעלות נמוכה יותר |
| KIR2DS2 | פוליקלונלי | אבקם | ab175486 | משטח | צביעה לא ספציפית שצוינה לאחר ליופיליזציה - לא משמשת לאנליזות |
| KIR2DS4 | FES172 | בקמן קולטר | א60796 | משטח | שיבוט חדש מאומת עם צביעה משופרת/עלות נמוכה יותר |
| LILRB1 | ג'י/75 | ביולג'נד | 333702 | משטח | שיבוט חדש מאומת עם צביעה משופרת |
| NKG2A | Z199 | בקמן קולטר | IM2750 | משטח | שיבוט חדש מאומת בעלות נמוכה יותר |
| טיגיט | MBSA43 | תרמו פישר סיינטיפיק | 16-9500-82 | משטח | שיבוט חדש מאומת |
טבלה משלימה 1: נוגדנים לפאנל תאי NK שנבדקו, אך לא נעשה בהם שימוש.
| איזוטופ | ספציפיות | שיבוט | ספק | מספר קטלוגי | משטח/ תוך-תאי |
| 143Nd | NKG2C | 134522 | מערכות מו"פ | MAB1381 | משטח |
| 145Nd | תקליטור 38 | היט 2 | ביולג'נד | 303502 | משטח |
| 146Nd | תקליטור 8 | SK1 | ביולג'נד | 344702 | משטח |
| 149ס.מ. | תקליטור 2 | RPA-2.10 | ביולג'נד | 300202 | משטח |
| 151האיחוד האירופי | סיגלק-7 | עונה 7.7 | ביולג'נד | 347702 | משטח |
| 154ס.מ. | LILRB1 | 292319 | מערכות מו"פ | MAB20172 | משטח |
| 163די | KIR3DL1 | DX-9 | BD מדעי הביולוגיה | 555964 | משטח |
| 168Er | CD62L | DREG-56 | ביולג'נד | 304802 | משטח |
| 171יב | PD1 | EH12.2H7 | ביולג'נד | 329902 | משטח |
| 176יב | תקליטור 69 | EH12.2H7 | ביולג'נד | 329902 | משטח |
טבלה משלימה 2: נוגדנים לפאנל תאי NK שנבדקו עם זיווג נוגדן/מתכת שונה.
Discussion
כאן אנו מתארים את התכנון והיישום של שני לוחות CyTOF משלימים שמטרתם לאפיין את רפרטואר הקולטן-ליגנד של תאי NK. פרוטוקול זה כולל מספר שלבים שהם קריטיים להשגת נתונים איכותיים. CyTOF משתמש ביוני מתכות כבדות, ולא בפלואורוכרום, כבדיקות תווית לנוגדנים19. לכן טכנולוגיה זו נתונה לאותות מזהמים פוטנציאליים ממתכות סביבתיות20. מקורות פוטנציאליים לזיהומי מתכות כוללים סבון כלים במעבדה (בריום) ומאגרי מעבדה (כספית, עופרת, פח). מסיבה זו, מומלץ להכין את כל המאגרים עם מים טהורים במיוחד, ולאחסן את כל הריאגנטים במיכלי פלסטיק או זכוכית שמעולם לא נשטפו בסבון. שלב קריטי נוסף בפרוטוקול זה הוא כתם הכדאיות, המשתמש בשיטה מבוססת ציספלטין כפי שתוארה על ידי Fienberg et al.21. שיטה זו כוללת שלב דגירה של דקה, שבמהלכו ציספלטין מסמן באופן מועדף תאים שאינם ברי קיימא. יש לבצע צביעת ציספלטין בהיעדר FBS. כתוצאה מכך, יש לשטוף היטב את התאים עם CyPBS לפני הצביעה. בנוסף, כדי למנוע צביעה מחוץ למטרה של תאים ברי קיימא, יש להרוות את כתם הציספלטין עם FBS לאחר דקה אחת בדיוק. פרוטוקול זה עבר אופטימיזציה לשחזור תאים מקסימלי וביצועי צביעה. לכן, גם שלבי הקיבוע והחדירות הם משמעותיים. מספר ריאגנטים לקיבוע וחדירות תואמים ל-CyTOF. עם זאת, מצאנו כי קיבוע עם 2% PFA, ואחריו חדירות עם מאגר חדירות ספציפי המפורט בטבלת החומרים, הביא להתאוששות תאים מקסימלית. מכיוון שמדובר בשיטת חדירות חולפת, יש לבצע צביעה תוך תאית במאגר החדירות כדי להבטיח חדירת נוגדנים נאותה. כמו כן, יש לשטוף את התאים ביסודיות עם מאגר החדירות לאחר צביעה תוך-תאית כדי להסיר נוגדנים לא קשורים.
פרוטוקול זה מאפשר מספר שינויים אפשריים. ניתן להתאים את לוחות CyTOF המפורטים כאן כך שיכללו סמנים נוספים או יחליפו סמנים קיימים. בפרט, לוח הליגנד תוכנן עם מספר ערוצים פתוחים כדי לאפשר גמישות בעיצוב הפאנל. כל שינוי או תוספת ללוח עשויים לדרוש פתרון בעיות נוסף. בפרט, יש לאמת ביסודיות כל זוג איזוטופים של נוגדן/מתכת כמתואר לעיל, כדי למנוע כל בעיה של זליגת אות לערוצים הקיימים. לוחות אלה תוכננו גם כך שיהיו תואמים לברקוד לדוגמה. ברקוד מקטין את האפשרות של השפעות אצווה והעברת דגימה לדגימה, תוך מזעור צריכת ריאגנטים22. למרות שברקוד מביא בדרך כלל לאיכות נתונים מוגברת כוללת, שלב זה אינו הכרחי לרכישת נתוני CyTOF באיכות טובה וניתן לדלג עליו לחלוטין. באופן דומה, למרות שאנו ממליצים על טיהור תאי NK לפני הצביעה, לוח תאי ה-NK תואם לפנוטיפ של תאי NK מ-PBMCs שלמים.
לשיטה זו יש כמה מגבלות. בשל אופי התפוקה הנמוך מטבעו של CyTOF, שיטה זו אינה מתאימה לדגימות עם ספירת תאים נמוכה. דגימות כאלה לא צפויות להניב נתונים באיכות מספקת לניתוח. בנוסף, בהתחשב בכך שפאנלים אלה תוכננו במיוחד כדי לחקור אינטראקציות בין תא NK לתאי מטרה, הם מוגבלים ביכולתם להעריך אינטראקציות בין סוגי תאים אחרים, כגון תאי CD8+ T ותאים מיאלואידים. באופן דומה, לוחות אלה תוכננו לאימונופנוטיפ ישיר ex vivo ולא נבדקו או אומתו לשימוש בתנאים מפעילים, כגון גירוי ציטוקינים. יתר על כן, למרות שפאנלים אלה מכסים רשימה מקיפה של קולטנים וליגנדים של תאי NK, הם אינם ממצים לחלוטין, ומספר סמנים בעלי חשיבות פוטנציאלית לא נכללו בשל מגבלות מקום. חלק מהסמנים הללו כוללים, אך אינם מוגבלים ל-KLRG1, CRACC, TIM-3, LAIR-1 בפאנל NK ו-PD-L1 בלוח הליגנד. לבסוף, שיטה זו אינה מתאימה לשימוש בדגימות קבועות, בהתחשב בכך שרוב האפיטופים של סמני תאי NK מושפעים מקיבוע.
לפרוטוקול המתואר כאן יתרונות משמעותיים בהשוואה לשיטות אחרות. קבוצות אחרות תיארו פאנלים של זרימה ציטומטרית שמטרתם לחקור תאי NK 3,4,5,6,7,8,23. בהשוואה לזרימה ציטומטרית, השימוש ב-CyTOF מבטל בעיות הקשורות לפיצוי פלואורופור, ומאפשר זיהוי בו זמנית של מספר גבוה של סמנים. למרות שאחרים פיתחו גם לוחות CyTOF לחקר תאי NK 9,10,11,12,13,14, כאן אנו מתארים את השימוש בשני לוחות CyTOF משלימים, החוקרים את הביטוי של קולטני תאי NK והליגנדים שלהם, ובכך מספקים תמונה מפורטת יותר של תפקוד תאי NK.
הקבוצה שלנו השתמשה בפרוטוקול זה ובאחד מהפאנלים הללו או בשניהם כדי לאפיין את תגובת תאי ה-NK האנושיים בתורמים בריאים, ובמגוון מצבי מחלה כולל זיהום HIV וזיהום בנגיף דנגי 24,25,26,27,28. למרות שהם תוכננו למטרת חקר זיהומים נגיפיים, לוחות אלה מתאימים לחקר תאי NK במצבים אחרים בהתחשב בנשימת החלבונים שהם מכסים. למעשה, הקבוצה שלנו השתמשה בפאנלים אלה גם כדי לאפיין את רפרטואר הקולטן-ליגנד של תאי NK בחולים עם חסר חיסוני וטרשת נפוצה 25,27,29,30, כמו גם בעכברים אנושיים 31,32. ככזה, ניתן להרחיב את השימוש בפאנלים אלה להקשרים אחרים. לדוגמה, קולטנים רבים של תאי NK וליגנדים קוגנטיים המעורבים בהגדרת סרטן כלולים בפאנלים אלה, מה שהופך את הפאנלים הללו לכלים מצוינים למחקרים עתידיים על תפקידם של תאי NK בתגובה האנטי-גידולית. באופן רחב יותר, ניתן ליישם את הפרוטוקול שלנו לייצור ואחסון המוני של לוחות CyTOF כמו גם עיבוד מקביל של דגימות לביצוע ויישום של כל פאנל CyTOF.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
המחברים רוצים להודות לכל החברים הנוכחיים והקודמים במעבדת בליש שתרמו לפאנל זה. תודה לקבוצת הניסויים הקליניים של איידס ולצוות ACTG A5321 וכן לד"ר סנדרה לופז-ורג'ס ודייוויס בלטראן במכון גורגס למחקרי בריאות על אוצרות הדגימות. לבסוף, תודה למייקל לייפולד, הולדן מאקר והמרכז לניטור חיסוני אנושי בסטנפורד על השימוש במכונות הליוס שלהם. עבודה זו נתמכה על ידי NIH U19AI057229, NIH R21 AI135287, NIH R21 AI130532, NIH DP1 DA046089, וחוקרי קרן בורוז וולקאם בפתוגנזה של מחלות זיהומיות #1016687 ל-CB, NIH Ruth L. Kirschstein Institutional National Research Service Award T32 AI007502, TL1 TR001084 ו-NIH/NIAID K08 AI138640 ל-EV, מלגת מחקר לתארים מתקדמים של הקרן הלאומית למדע DGE-1656518 למענק הכשרה של JM ו-NIH T32-AI-007290 (PI אוליביה מרטינז). מחקר ACTG קיבל תמיכה במענקים מ-AI-68634 (מרכז סטטיסטיקה וניהול נתונים), UM1-A1-26617, AI-131798 ו-AI-68636 (ACTG). CB הוא חוקר הפקולטה לרפואה תרגומית לילדים ע"ש טאשיה וג'ון מורגרידג' ממכון המחקר לבריאות האם והילד בסטנפורד וחוקר של Chan Zuckerberg Biohub.
Materials
| Name | Company | Catalog Number | Comments |
| 89Y | Sigma-Aldrich | 204919 | |
| 102-Palladium nitrate | Trace Sciences International | Special Order | |
| 104-Palladium nitrate | Trace Sciences International | Special Order | |
| 106-Palladium nitrate | Trace Sciences International | Special Order | |
| 108-Palladium nitrate | Trace Sciences International | Special Order | |
| 115In | Trace Sciences International | Special Order | |
| 141Pr | Fluidigm | 201141A | |
| 142Nd | Fluidigm | 201142A | |
| 143Nd | Fluidigm | 201143A | |
| 144Nd | Fluidigm | 201144A | |
| 145Nd | Fluidigm | 201145A | |
| 146Nd | Fluidigm | 201146A | |
| 147Sm | Fluidigm | 201147A | |
| 148Nd | Fluidigm | 201148A | |
| 149Sm | Fluidigm | 201149A | |
| 150Nd | Fluidigm | 201150A | |
| 151Eu | Fluidigm | 201151A | |
| 152Sm | Fluidigm | 201152A | |
| 153Eu | Fluidigm | 201153A | |
| 154Sm | Fluidigm | 201154A | |
| 155Gd | Fluidigm | 201155A | |
| 156Gd | Fluidigm | 201156A | |
| 157Gd | Trace Sciences International | N/A | |
| 158Gd | Fluidigm | 201158A | |
| 159Tb | Fluidigm | 201159A | |
| 160Gd | Fluidigm | 201160A | |
| 161Dy | Fluidigm | 201161A | |
| 162Dy | Fluidigm | 201162A | |
| 163Dy | Fluidigm | 201163A | |
| 164Dy | Fluidigm | 201164A | |
| 165Ho | Fluidigm | 201165A | |
| 166Er | Fluidigm | 201166A | |
| 167Er | Fluidigm | 201167A | |
| 168Er | Fluidigm | 201168A | |
| 169Tm | Fluidigm | 201169A | |
| 170Er | Fluidigm | 201170A | |
| 171Yb | Fluidigm | 201171A | |
| 172Yb | Fluidigm | 201172A | |
| 173Yb | Fluidigm | 201173A | |
| 174Yb | Fluidigm | 201174A | |
| 175Lu | Fluidigm | 201175A | |
| 176Yb | Fluidigm | 201176A | |
| 209Bi anti-CD16 | Fluidigm | 3209002B | Clone 3G8. Used at a 1:50 dilution. |
| 697 cells | Creative Bioarray | CSC-C0217 | |
| Amicon Ultra Centrifugal Filter Units 0.5 with Ultracel-30 Membrane, 30 kDa | Millipore | UFC503096 | |
| Anhydrous acetonitrile | Fisher Scientific | BP1165-50 | |
| anti-2B4 | Biolegend | 329502 | Clone C1.7. |
| anti-B7-H6 | R&D Systems | MAB7144 | Clone 875001. |
| anti-CCR2 | Biolegend | 357202 | Clone K036C2. |
| anti-CD2 | Biolegend | 300202 | Clone RPA-2.10. |
| anti-CD3 | Biolegend | 300402 | Clone UCHT1. |
| anti-CD4 | Biolegend | 317402 | Clone OKT4. |
| anti-CD4 | Biolegend | 344602 | Clone SK3. |
| anti-CD7 | Biolegend | 343102 | Clone CD7-6B7. |
| anti-CD8 | Biolegend | 344702 | Clone SK1. |
| anti-CD11b | Biolegend | 301302 | Clone ICRF44. |
| anti-CD14 | Biolegend | 301802 | Clone M5E2. |
| anti-CD19 | Biolegend | 302202 | Clone HIB19. |
| anti-CD33 | Biolegend | 303402 | Clone WM53. |
| anti-CD38 | Biolegend | 303502 | Clone HIT2. |
| anti-CD48 | Biolegend | 336702 | Clone BJ40. |
| anti-CD56 | BD Pharmingen | 559043 | Clone NCAM16.2. |
| anti-CD57 | Biolegend | 322302 | Clone HCD57. |
| anti-CD62L | Biolegend | 304802 | Clone DREG-56. |
| anti-CD69 | Biolegend | 310902 | Clone FN50. |
| anti-CD94 | Biolegend | 305502 | Clone DX22. |
| anti-CD95 | Biolegend | 305602 | Clone DX2. |
| anti-CD155 | Biolegend | 337602 | Clone SKII.4. |
| anti-CXCR6 | Biolegend | 356002 | Clone K041E5. |
| anti-DNAM-1 | BD Biosciences | 559787 | Clone DX11. |
| anti-DR4 | Biolegend | 307202 | Clone DJR1. |
| anti-DR5 | Biolegend | 307302 | Clone DJR2-2. |
| anti-FAS-L | Biolegend | 306402 | Clone NOK-1. |
| anti-FcRg | Millipore | 06-727 | Polyclonal antibody. |
| anti-HLA-C,E | Millipore | MABF233 | Clone DT9. |
| anti-HLA-Bw4 | Miltenyi Biotec | Special Order | Clone REA274. |
| anti-HLA-Bw6 | Miltenyi Biotec | 130-124-530 | Clone REA143. |
| anti-HLA-DR | Biolegend | 307602 | Clone L243. |
| anti-HLA-E | Biolegend | 342602 | Clone 3D12. |
| anti-ICAM-1 | Biolegend | 353102 | Clone HA58. |
| anti-Ki-67 | Biolegend | 350502 | Clone Ki-67. |
| anti-KIR2DL1/KIR2DS5 | R&D Systems | MAB1844 | Clone 143211. |
| anti-KIR2DL3 | R&D Systems | MAB2014 | Clone 180701. |
| anti-KIR2DL5 | Miltenyi Biotec | 130-096-200 | Clone UP-R1. |
| anti-KIR2DS4 | R&D Systems | MAB1847 | Clone 179315. |
| anti-KIR3DL1 | BD Biosciences | 555964 | Clone DX-9. |
| anti-LFA-3 | Biolegend | 330902 | Clone TS2/9. |
| anti-LILRB1 | R&D Systems | 292319 | Clone MAB20172. |
| anti-LLT-1 | R&D Systems | AF3480 | Clone 402659. |
| anti-MICA | R&D Systems | MAB1300-100 | Clone 159227. |
| anti-MICB | R&D Systems | MAB1599-100 | Clone 236511. |
| anti-Nectin-1 | Biolegend | 340402 | Clone R1.302. |
| anti-Nectin-2 | Biolegend | 337402 | Clone TX31. |
| anti-NKG2A | R&D Systems | MAB1059 | Clone 131411. |
| anti-NKG2C | R&D Systems | MAB1381 | Clone 134522. |
| anti-NKG2D | Biolegend | 320802 | Clone 1D11. |
| anti-NKp30 | Biolegend | 325202 | Clone P30-15. |
| anti-NKp44 | Biolegend | 325102 | Clone P44-8. |
| anti-NKp46 | Biolegend | 331902 | Clone 9E2. |
| anti-NTB-A | Biolegend | 317202 | Clone NT-7. |
| anti-Pan HLA class I | Biolegend | 311402 | Clone W6/32. |
| anti-PD1 | Biolegend | 329902 | Clone EH12.2H7. |
| anti-Perforin | Abcam | ab47225 | Clone B-D48. |
| anti-Siglec-7 | Biolegend | 347702 | Clone S7.7. |
| anti-Syk | Biolegend | 644302 | Clone 4D10.2. |
| anti-TACTILE | Biolegend | 338402 | Clone NK92.39. |
| anti-TIGIT | R&D Systems | MAB7898 | Clone 741182. |
| anti-ULBP-1 | R&D Systems | MAB1380-100 | Clone 170818. |
| anti-ULBP-2, 5, 6 | R&D Systems | MAB1298-100 | Clone 165903. |
| Antibody Stabilizer | Candor Bioscience | 131 050 | |
| Benzonase Nuclease | Millipore | 70664 | |
| Bond-Breaker TCEP Solution | Thermo Fisher Scientific | 77720 | |
| Bovine Serum Albumin solution | Sigma-Aldrich | A9576 | |
| Calcium chloride dihydrate (CaCl2+2H2O) | Sigma-Aldrich | 223506-25G | |
| Cis-Platinum(II)diamine dichloride (cisplatin) | Enzo Life Sciences | ALX-400-040-M250 | A 100 mM stock solution was prepared in DMSO and divided into 25 µL aliquots. Used at a 25 µM dilution for live/dead stain. Signal appears in 194Pt and 195Pt channels. |
| DMSO | Sigma-Aldrich | D2650 | |
| eBioscience Permeabilization Buffer | Thermo Fisher Scientific | 00-8333-56 | |
| EDTA (0.5 M) | Hoefer | GR123-100 | A double-concentrated HEPES buffer with EDTA was made according to the following recipe: 1.3 g NaCl (Thermo Fisher Scientific), 27 mg CaCl2+2H2O (Sigma-Aldrich), 23 mg MgCl2 (Sigma-Aldrich), 83.6 mg KH2PO4 (Thermo Fisher Scientific), 4 mL of 1M HEPES (Thermo Fisher Scientific), 2 mL of 0.5M EDTA (Hoefer, Holliston, MA, USA), and 100mL H2O. The pH of this double-concentrated HEPES buffer was adjusted to a pH of 7.3 using 1M HCl and 1M NaOH. |
| EQ Four Element Calibration Beads | Fluidigm | 201078 | |
| Fetal Bovine Serum | Thermo Fisher Scientific | N/A | |
| Helios mass cytometer | Fluidigm | N/A | |
| HEPES (1M) | Thermo Fisher Scientific | 15630080 | |
| HyClone Antibiotic/Antimycotic Solution (Pen/Strep/Fungiezone) solution | Fisher Scientific | SV3007901 | |
| Iridium - 191Ir/193Ir intercalator | DVS Sciences (Fluidigm) | 201192B | Used at a 1:10000 dilution. |
| Isothiocyanobenzyl-EDTA (ITCB-EDTA) | Dojindo Molecular Technologies, Inc. | M030-10 | Diluted to 1.25 mg/mL in anhydrous acetonitrile. |
| K562 cells | American Type Culture Collection (ATCC) | ATCC CCL-243 | |
| L-Glutamine (200 mM) | Thermo Fisher Scientific | SH30034 | |
| Magnesium chloride (MgCl2) | Sigma-Aldrich | 208337-100G | |
| Maxpar X8 Antibody Labeling Kits | Fluidigm | N/A | No catalog number as kits come with metals. |
| Millex-VV Syringe Filter Unit, 0.1 µm | Millipore | SLVV033RS | |
| Milli-Q Advantage A10 Water Purification System | Millipore | Z00Q0V0WW | |
| MS Columns | Miltenyi Biotec | ||
| NALM6 cells | American Type Culture Collection (ATCC) | ATCC CRL-3273 | |
| Nanosep Centrifugal Devices with Omega Membrane 3K | Pall Corporation | OD003C35 | |
| NK Cell Isolation Kit, human | Miltenyi Biotec | 130-092-657 | |
| Paraformaldehyde (16%) | Electron Microscopy Sciences | 15710 | |
| PBS | Thermo Fisher Scientific | 10010023 | |
| Potassium Phosphate Monobasic (KH2PO4) | Fisher Scientific | MP021954531 | |
| Qdot 655 anti-CD19 | Thermo Fisher Scientific | Q10179 | Clone SJ25-C1. Used at a 1:50 dilution. Signal appears in 112Cd-114Cd channels. |
| Qdot 655 anti-HLA-DR | Thermo Fisher Scientific | Q22158 | Clone Tü36. Used at a 1:200 dilution. |
| Rockland PBS | Rockland Immunochemicals, Inc. | MB-008 | Used to make CyPBS (10X Rockland PBS diluted to 1X in Milli-Q water) and CyFACS buffers (10X Rockland PBS diluted to 1X in Milli-Q water with 0.1% BSA and 0.05% sodium azide). Buffers were sterile-filtered through a 0.22 µM filter and sotred at 4°C in Stericup bottles. |
| RPMI 1640 | Thermo Fisher Scientific | 21870092 | |
| Sodium azide (NaN3) | Sigma-Aldrich | S2002 | |
| Sodium chloride (NaCl) | Fisher Scientific | S271-500 | |
| Stericup Quick Release-GP Sterile Vacuum Filtration System | Millipore Sigma | S2GPU10RE | |
| Tuning solution | Fluidigm | 201072 | |
| Washing solution | Fluidigm | 201070 |
References
- Shimasaki, N., Jain, A., Campana, D. NK cells for cancer immunotherapy. Nature Reviews. Drug Discovery. 19 (3), 200-218 (2020).
- Vivier, E., Tomasello, E., Baratin, M., Walzer, T., Ugolini, S. Functions of natural killer cells. Nature Immunology. 9 (5), 503-510 (2008).
- Eller, M. A., Currier, J. R. OMIP-007: phenotypic analysis of human natural killer cells. Cytometry. Part A: The Journal of the International Society for Analytical Cytology. 81 (6), 447-449 (2012).
- Mahnke, Y. D., Beddall, M. H., Roederer, M. OMIP-029: Human NK-cell phenotypization. Cytometry. Part A: The Journal of the International Society for Analytical Cytology. 87 (11), 986-988 (2015).
- Hammer, Q., Romagnani, C. OMIP-039: Detection and analysis of human adaptive NKG2C + natural killer cells : Detection of Human Adaptive NKG2C + NK Cells. Cytometry. 91 (10), 997-1000 (2017).
- Liechti, T., Roederer, M. OMIP-058: 30-Parameter flow cytometry panel to characterize iNKT, NK, unconventional and conventional T cells. Cytometry. 95 (9), 946-951 (2019).
- Béziat, V., et al. NK cell responses to cytomegalovirus infection lead to stable imprints in the human KIR repertoire and involve activating KIRs. Blood. 121 (14), 2678-2688 (2013).
- Pfefferle, A., et al. Intra-lineage plasticity and functional reprogramming maintain natural killer cell repertoire diversity. Cell Reports. 29 (8), 2284-2294 (2019).
- Barcenilla, H., Åkerman, L., Pihl, M., Ludvigsson, J., Casas, R. Mass cytometry identifies distinct subsets of regulatory T cells and Natural killer cells associated with high risk for Type 1 diabetes. Frontiers in Immunology. 10, 982(2019).
- Kurioka, A., et al. CD161 defines a functionally distinct subset of pro-inflammatory Natural killer cells. Frontiers in Immunology. 9, 486(2018).
- Romee, R., et al. Cytokine-induced memory-like natural killer cells exhibit enhanced responses against myeloid leukemia. Science Translational Medicine. 8 (357), (2016).
- Shinko, D., et al. Mass cytometry reveals a sustained reduction in CD16+ Natural killer cells following chemotherapy in colorectal cancer patients. Frontiers in Immunology. 10, 2584(2019).
- Pohlmeyer, C. W., et al. Identification of NK cell subpopulations that differentiate HIV-infected subject cohorts with diverse levels of virus control. Journal of Virology. 93 (7), 01790(2019).
- Palgen, J. -L., et al. NK cell immune responses differ after prime and boost vaccination. Journal of Leukocyte Biology. 105 (5), 1055-1073 (2019).
- Mei, H. E., Leipold, M. D., Schulz, A. R. Barcoding of live human peripheral blood mononuclear cells for multiplexed mass cytometry. The Journal of Immunology. 194 (4), 2022-2031 (2015).
- Takahashi, C., et al. Mass cytometry panel optimization through the designed distribution of signal interference. Cytometry. Part A: The Journal of the International Society for Analytical Cytology. 91 (1), 39-47 (2017).
- Baumgart, S., Peddinghaus, A., Schulte-Wrede, U., Mei, H. E., Grützkau, A. OMIP-034: Comprehensive immune phenotyping of human peripheral leukocytes by mass cytometry for monitoring immunomodulatory therapies. Cytometry. Part A: The Journal of the International Society for Analytical Cytology. 91 (1), 34-38 (2017).
- Leipold, M. D. Another step on the path to mass cytometry standardization. Cytometry. Part A: The Journal of the International Society for Analytical Cytology. 87 (5), 380-382 (2015).
- Bendall, S. C., et al. Single-cell mass cytometry of differential immune and drug responses across a human hematopoietic continuum. Science. 332 (6030), 687-696 (2011).
- Leipold, M. D., Newell, E. W., Maecker, H. T. Multiparameter phenotyping of human PBMCs using mass cytometry. Methods in Molecular Biology. 1343, 81-95 (2015).
- Fienberg, H. G., Simonds, E. F., Fantl, W. J., Nolan, G. P., Bodenmiller, B. A platinum-based covalent viability reagent for single-cell mass cytometry. Cytometry. Part A: The Journal of the International Society for Analytical Cytology. 81 (6), 467-475 (2012).
- Zivanovic, N., Jacobs, A., Bodenmiller, B. A practical guide to multiplexed mass cytometry. Current Topics in Microbiology and Immunology. 377, 95-109 (2014).
- Béziat, V., Hilton, H. G., Norman, P. J., Traherne, J. A. Deciphering the killer-cell immunoglobulin-like receptor system at super-resolution for natural killer and T-cell biology. Immunology. 150 (3), 248-264 (2017).
- Wilk, A. J., et al. Charge-altering releasable transporters enable specific phenotypic manipulation of resting primary natural killer cells. BioRxiv. , 970491(2020).
- Vendrame, E., et al. TIGIT is upregulated by HIV-1 infection and marks a highly functional adaptive and mature subset of natural killer cells. AIDS. 34 (6), 801-813 (2020).
- Zhao, N. Q., et al. Natural killer cell phenotype is altered in HIV-exposed seronegative women. PloS One. 15 (9), 0238347(2020).
- McKechnie, J. L., et al. HLA upregulation during dengue virus infection suppresses the natural killer cell response. Frontiers in Cellular and Infection Microbiology. 9, 268(2019).
- McKechnie, J. L., et al. Mass cytometry analysis of the NK cell receptor-ligand repertoire reveals unique differences between dengue-infected children and adults. ImmunoHorizons. 4 (10), 634-647 (2020).
- Ranganath, T., et al. Characterization of the impact of daclizumab beta on circulating natural killer cells by mass cytometry. Frontiers in immunology. 11, 714(2020).
- Fernandez, I. Z., et al. A novel human IL2RB mutation results in T and NK cell--driven immune dysregulation. The Journal of Experimental Medicine. 216 (6), 1255-1267 (2019).
- Herndler-Brandstetter, D., et al. Humanized mouse model supports development, function, and tissue residency of human natural killer cells. Proceedings of the National Academy of Sciences. 114 (45), 9626-9634 (2017).
- Nikzad, R., et al. Human natural killer cells mediate adaptive immunity to viral antigens. Science Immunology. 4 (35), (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved