Method Article
Bakteriyel Kalıcılık Üzerindeki Etkilerini Aydınlatacak Kimyasal Bileşiklerin Yüksek Verimli Taranmasını
Bu Makalede
Özet
Bu yöntem makalesinde, bakteriyel kalıcılık üzerinde önemli bir etkisi olan ozmolitler gibi kimyasal bileşikleri tanımlamak için yüksek verimli bir tarama stratejisi sunuyoruz.
Özet
Bakteriyel kalıcılar, yüksek konsantrasyonlarda antibiyotikleri tolere etme yeteneğine sahip fenotipik varyantların küçük bir altopülasyonu olarak tanımlanır. Tekrarlayan kronik enfeksiyonlarla ilişkili oldukları için önemli bir sağlık sorunudur. Strese bağlı mekanizmaların stokastik ve deterministik dinamiklerinin kalıcılıkta önemli rol oynadığı bilinse de, kalıcılık durumuna/kalıcılıktan fenotipik geçişin altında kalan mekanizmalar tam olarak anlaşılamamıştır. Çevresel sinyallerin tetiklediği kalıcılık faktörleri (örneğin karbon, azot ve oksijen kaynaklarının tükenmesi) kapsamlı bir şekilde incelenmiş olsa da, ozmolitlerin kalıcılık üzerindeki etkileri henüz belirlenmemiştir. Mikroarraylar (yani, çeşitli kimyasallar içeren 96 kuyu plakası) kullanarak, çeşitli ozmolitlerin Escherichia coli kalıcılığı üzerindeki etkilerini yüksek verimde aydınlatacak bir yaklaşım tasarladık. Bu yaklaşım, ilaç panelleri ve gen nakavt kütüphaneleri gibi diğer tarama dizileri için kolayca uyarlanabilebileceği için dönüştürücüdür.
Giriş
Bakteri kültürleri, alışılmadık derecede yüksek antibiyotik seviyelerine geçici olarak hoşgörülü olan kalıcı hücrelerin küçük bir alt nüfusunu içerir. Persister hücreleri genetik olarak antibiyotiğe duyarlı kins ile aynıdır ve hayatta kalmaları geçici büyüme inhibisyonlarına bağlanmıştır1. Persister hücreleri ilk olarak Gladys Hobby2 tarafından keşfedildi, ancak bu terim ilk olarak Joseph Bigger tarafından penisilinle tedavi edilen Staphylococcus pyogenes kültürlerinde tanımlandığında kullanıldı3. Balaban ve ark.4 tarafından yayınlanan ufuk açıcı bir çalışma iki kalıcı tip keşfetti: öncelikle sabit fazdan geçişle oluşturulan tip I varyantları ve üstel büyüme sırasında sürekli olarak oluşturulan tip II varyantları. Kalıcılar, antibiyotik tedavileri sırasında çeşitli aralıklarla kültür örneklerinin alındığı, yıkandığı ve antibiyotik yokluğunda kolonileşebilen hayatta kalan hücreleri saymak için tipik bir büyüme ortamına kaplandığı klonojenik sağkalım tahlilleri ile tespit edilir. Bir hücre kültüründe kalıcıların varlığı, ilk üstel çürümenin antibiyotiğe duyarlı hücrelerin ölümünü gösterdiği bifazik öldürme eğrisi4,5 ile değerlendirilir. Bununla birlikte, öldürme eğilimi zamanla azalır ve sonunda hayatta kalan kalıcı hücreleri temsil eden bir plato bölgesine yol açmaktadır.
Kalıcı hücreler tüberküloz6, kistik fibrozis7,kandidiyazis8 ve idrar yolu enfeksiyonları9gibi çeşitli hastalıklarla ilişkilendirilmiştir. Şimdiye kadar test edilen hemen hemen tüm mikroorganizmaların, son derece patojenik Mycobacterium tuberculosis6, Staphylococcus aureus10, Pseudomonas aeruginosa7 ve Candida albicans8dahil olmak üzere kalıcı fenotipler ürettiği bulunmuştur. Son çalışmalar ayrıca kalıcı subpopulasyonlardan multidrug dirençli mutantların yükselişinin kanıtlarını salar11,12. Bu alandaki önemli çabalar, kalıcılık mekanizmalarının son derece karmaşık ve çeşitli olduğunu ortaya koydu; SOS yanıtı13 , 14, reaktif oksijen türleri (ROS)15,toksin/antitoksin (TA) sistemleri16,otofaji veya kendi kendine sindirim17ve ppGpp ile ilgili sıkı yanıt18 ile ilişkili stokastik ve deterministik faktörlerin kalıcı oluşumu kolaylaştırdığı bilinmektedir.
Kalıcılık fenotipini anlamada önemli ilerlemeye rağmen, ozmolitlerin bakteriyel kalıcılık üzerindeki etkileri tam olarak anlaşılamamıştır. Optimal ozmotik basıncın sürdürülmesi hücrelerin büyümesi, düzgün çalışması ve hayatta kalması için bir gereklilik olduğundan, ozmolitlerin derinlemesine incelenmesi anti-persister stratejiler için potansiyel hedeflere yol açabilir. Zahmetli, yüksek verimli tarama, kalıcılık fenotipinde çok önemli bir rol oynayan metabolitleri ve diğer kimyasalları tanımlamak için çok etkili bir yaklaşım olmasına rağmen19,20. Bu çalışmada, E. coli persistence'ı önemli ölçüde etkileyen ozmolitleri tanımlamak için çeşitli ozmolitler (örneğin sodyum klorür, üre, sodyum nitrit, sodyum nitrat, potasyum klorür) içeren 96 kuyu plakası gibi mikroarraylar kullandığımız yayınlanmış yöntem19'utartışacağız.
Protokol
1. Büyüme ortamının hazırlanması, ofloksasin çözeltisi ve E. coli hücre stokları
- Normal Luria-Bertani (LB) ortamı: Deiyonize (DI) suya 10 g/L tripon, 10 g/L sodyum klorür (NaCl) ve 5 g/L maya özü ekleyin. Otomatik kapatarak ortamı sterilize edin.
- LB agar plakaları: DI suyuna 10 g/L tripon, 10 g/L NaCl, 5 g/L maya özü ve 15 g/L agar ekleyin ve ortamı otomatik kapatarak sterilize edin. İstenilen sıcaklıkta (~55 °C), kare plakalara (10 x 10 cm) ~30 mL agar ortamı dökün. Plakaları kurutun ve 4 °C'de saklayın.
- Modifiye LB ortamı: DI suyuna 10 g/L tripton ve 5 g/L maya özü ekleyin. Otomatik kapatarak ortamı sterilize edin.
- Osmolyte dahil modifiye LB ortamı: 2x değiştirilmiş LB ortamını eşit hacimlerde 2x osmolyte çözeltisi ile karıştırın. 2x modifiye LB ortamı hazırlamak için DI suyuna 20 g/L tripton ve 10 g/L maya özü ekleyin ve otomatik olarak kapatarak sterilize edin. 2x osmolyte çözeltisini hazırlamak için, ilgi osmolytesini (2x miktarı) DI suyunda çözün ve ardından çözeltiyi filtreleyin.
NOT: İlgi osmolyte ve konsantrasyonları Fenotip Mikroarray tarama tahlillerinden belirlenebilir (bkz. Protokol 4). Bununla birlikte, test edilen ozmolit ve ilişkili 2x konsantrasyonu araştırmanın niteliğine bağlı olarak ayarlanabilir. Örneğin, 1 mM sodyum klorürün etkisini incelemek için, 2x osmolit çözeltisi 2 mM sodyum klorür çözeltisi olacaktır. - Ofloksasin stok çözeltisi (5 mg/mL): 1 mL DI suya 5 mgloksasin (OFX) tuzu ekleyin. OFX'in sudaki çözünürlüğünü artırmak için 10 μL 10 M sodyum hidroksit ekleyin ve ardından çözeltiyi filtreleyin. Aliquots hazırlayın ve -20 °C'de saklayın.
NOT: Ofloksasin, hem büyüyen hem de büyümeyen bakteri hücreleri için yaygın olarak kullanılan bir quinolone antibiyotiktir14,21. E. coli MG1655 hücreleri için OFX'in minimum inhibitör konsantrasyonu (MIC) 0.039–0.078 μg/mL19,20aralığındadır. Ayrıca ampisilin ve kanamycin gibi diğer antibiyotiklerin kalıcı araştırmalarda yaygın olarak kullanıldığını unutmayın. Antibiyotik seçimi çalışmanın doğasına bağlıdır. - E. coli MG1655 hücre stokları: 14 mL test tüpünde (snap-capped) tek bir koloni ile 2 mL normal LB ortamını aşılayın ve hücreleri 250 rpm ve 37 °C'de bir yörünge çalkalayıcıda kültürlendir. Hücreler sabit faza ulaştığında, hücre kültürünün 500 μL'sini kriyojenik bir şişede% 50 gliserol (steril) 500 μL ile karıştırın ve -80 ° C'de depolayın.
2. Önceden var olan kalıcıları ortadan kaldırmak için hücrelerin yayılması
- Bir gece kültürü hazırlamak için, steril bir pipet ucu ile donmuş bir hücre stoğundan az miktarda hücre kazıyın (gliserol hücre stoğunu çözmeyin) ve hücreleri 14 mL snap-capped test tüpünde 2 mL modifiye LB ortamında aşılayın. 250 rpm ve 37 °C'de 12 saat boyunca bir yörünge çalkalayıcıdaki hücreleri kültüre edin.
- İlk yayılma
- 12 saat sonra, steril bir alüminyum folyo ile kaplı 250 mL şaşkın bir şişede 250 μL geceleme kültürünü 25 mL taze modifiye LB ortamına aktarın.
- Hücreler orta üstel faza ulaşana kadar hücre kültürünü 250 rpm ve 37 °C'de bir yörünge çalkalayıcıda büyütün (OD600 = 0.5).
- Her 30 dakikada bir mikro plaka okuyucu kullanarak optik yoğunluğu600 nm(OD 600) olarak ölçün.
- İkinci yayılma
- OD600 = 0,5'te, ilk şişeden 250 μL hücre kültürünü 250 mL'lik şaşkın bir şişede 25 mL taze modifiye LB ortamına seyreltin.
- İkinci hücre kültürünü 250 rpm ve 37 °C'de OD600 =0.5'ekadar bir yörünge çalkalayıcıda büyütün.
- Optik yoğunluğu her 30 dakikada bir ölçün.
NOT: Bir gecede kültür önemli miktarda kalıcı hücreye sahip olabilir4,5,22. Yukarıda açıklanan seyreltme/büyüme döngüsü yöntemi5, hücreleri mikroarraylara aktarmadan önce bu önceden var olan kalıcıları ortadan kaldırmak için kullanılabilir. Bunların ortadan kaldırılması, Protokol 3'te açıklanan testle gece kültürlerinin kalıcı düzeyleri ölçülerek doğrulanabilir. Bu yöntem daha önceki bir çalışmada zaten doğrulanmıştır19.
3. Önceden var olan kalıcı hücrelerin ortadan kaldırılmasının doğrulenmesi
- İkinci yayılmadan sonra (bkz. adım 2.3), hücre kültürünün 250 μL'sini (OD600 = 0.5) 25 mL taze modifiye LB ortamında 250 mL şaşkın bir şişede seyreltin.
NOT: Kontroller için, 250 mL'lik bir şişede 25 mL taze modifiye LB ortamında 250 μL geceleme kültürünü seyreltin (bkz. adım 2.1). Hücreleri şişeye aktarmadan önce, geceleme kültürünün hücre yoğunluğu, OD600 = 0.5 elde etmek için taze modifiye LB ortamında ayarlanmalıdır. - Hücre süspansiyonuna 25 μL OFX stok çözeltisi (5 mg/mL) ekleyin ve tahlil kültürünü homojen hale getirmek için şişeyi hafifçe sallayın. OFX'in son konsantrasyonu tahlil kültüründe 5 μg/mL'dir.
- 250 rpm ve 37 °C'de bir yörünge çalkalayıcıda test kültürünü kuluçkaya yatırın.
- Tedavi sırasında her saat (0 saat dahil, OFX'i test kültürüne eklemeden önceki zaman noktası), tahlil kültürünün 1 mL'lik kısmını şişeden 1,5 mL mikrosantrifüj tüpüne aktarın.
- 3 dakika boyunca 17.000 x g'da mikrosantrifüj tüpündeki test kültürünü santrifüj edin.
- Hücre peletini bozmadan 950 μL'lik süpernatantını dikkatlice çıkarın.
- Mikrosantrifüj tüpüne 950 μL fosfat tamponlu salin (PBS) çözeltisi ekleyin.
- Antibiyotik konsantrasyonu minimum inhibitör konsantrasyonun (MIC) altında olana kadar toplam 3x için 3,5-3,7 yıkama adımlarını tekrarlayın.
- Son yıkamadan sonra, hücre peletini 100 μL PBS çözeltisinde yeniden kullanın, böylece 10x konsantre bir numune elde edin.
- Hücre süspansiyonunun 10 μL'sini alın ve 96 kuyu yuvarlak alt plaka kullanarak 90 μL PBS çözeltisinde altı kez seri olarak seyreltin.
- Antibiyotiksiz taze agar plakalarında 10 μL seyreltilmiş hücre süspansiyonu tespit edin. Algılama sınırını artırmak için, kalan 90 μL hücre süspansiyonu taze bir agar plakasına plakalayın.
- Agar plakalarını 37 °C'de 16 saat kuluçkaya yatırın ve ardından koloni oluşturan birimleri (CFO' lar) sayın. 1 mL tahlil kültüründeki toplam CFO sayısını hesaplarken seyreltme oranlarını hesaba katın. Öldürme eğrileri, logaritmik CFU değerlerinin antibiyotik tedavisinin süresine göre çizilerek oluşturulur.
NOT: E. coli hücreleri19,20için bifazik öldürme eğrisi elde etmek için 6 h OFX tedavisi yeterlidir. Yayılan hücrelerin kalıcı seviyesi (CFU sayıları ile 6 saat olarak ölçüldüğünde) gece kültürününkinden önemli ölçüde daha az olmalıdır. Protokol 2 ve 3'te açıklanan işlemler araştırma tasarımına bağlı olarak düzenli LB ile gerçekleştirilebilir.
4. Microarray plaka taramaları
- Mikroarray hücreli kültürlerin hazırlanması
- 250 μL üstel fazlı hücreleri 50 mL santrifüj tüpünde 25 mL taze modifiye LB ortamına aktarın. Hücre süspansiyonu homojen hale getirmek için hafifçe karıştırın.
NOT: Üstel fazlı hücreler (OD600 = 0.5) ikinci yayılma adımından elde edilir (bkz. adım 2.3). - Seyreltilmiş hücre süspansiyonu steril bir 50 mL rezervuara aktarın.
- Çok kanallı bir pipet kullanarak, hücre süspansiyonunun 150 μL'lik kısmını bir mikroarray kuyusuna, yani çeşitli ozmolitler içeren 96 kuyu plakasına aktarın.
NOT: Osmolytes olmayan kuyular kontrol görevi gösterir. - Mikroarray'ı gaz geçirgen sızdırmazlık zarı ile örtün.
- Plakayı 37 °C ve 250 rpm'de 24 saat boyunca yörüngesel bir çalkalayıcıda kuluçkaya yaslayın.
NOT: Bu deneylerde, çeşitli konsantrasyonlarda kurutulmuş halde çok çeşitli ozmolitler, pH tamponları ve diğer kimyasalları içeren Fenotip Mikroarrayları (PM-9 ve PM-10) gibi ticari olarak mevcut plakalar kullanılmıştır. Bu mikroarraylar yarım alan 96 kuyu plakası formatlarındadır. Kültür hacimleri, kullanılan plakaların türüne bağlı olarak ayarlanmalıdır. Mikroarraylar manuel olarak da oluşturulabilir (aşağıya bakın).
- 250 μL üstel fazlı hücreleri 50 mL santrifüj tüpünde 25 mL taze modifiye LB ortamına aktarın. Hücre süspansiyonu homojen hale getirmek için hafifçe karıştırın.
- Mikroarray plakalarının manuel hazırlanması
- 75 μL 2x osmolyte çözeltilerini yarım alanlı 96 kuyu plakasının kuyularına aktarın.
- 500 μL'lik üstel fazlı hücreleri 50 mL santrifüj tüpünde 25 mL modifiye LB ortamına aktarın. Hücre süspansiyonu homojen hale getirmek için hafifçe karıştırın.
NOT: Aşılama oranı 4.1'de açıklanan mikroarray tarama protokolü ile uyumlu olacak şekilde ayarlandı. - 2x ozmolit çözeltileri içeren yarım alanlı 96 kuyu plakasının her kuyusuna 75 μL hücre süspansiyonu ekleyin.
- Plakayı 37 °C ve 250 rpm'de 24 saat boyunca yörüngesel bir çalkalayıcıda kuluçkaya yaslayın.
- Kalıcı test plakaları hazırlanıyor
- 50 mL santrifüj tüpünde 5 μg/mL OFX içeren 25 mL modifiye LB ortamı hazırlayın ve bu ortamı steril bir rezervuara aktarın.
- OFX ile modifiye LB ortamının 190 μL'lik kısmını çok kanallı pipet kullanarak rezervuardan genel bir düz tabanlı 96 kuyu plakasının (persister-tahlil plakası) her kuyusuna aktarın.
- Mikroarray'ı çalkalayıcıdan çıkarın (24 saat kültlemeden sonra) ve 10 μL hücre kültürünü mikroarraydan OFX ile modifiye LB ortamı içeren kalıcı test plakasının kuyularına aktarın.
- Kalıcı test plakasından 10 μL hücre süspansiyonu alın ve yuvarlak tabanlı 96 kuyu plakası ve çok kanallı pipet kullanarak 290 μL PBS çözeltisinde üç kez seri olarak seyreltin.
- Seri seyreltmenin ardından, çok kanallı pipet kullanarak antibiyotik içermeyen taze agar plakalarında seri olarak seyreltilmiş tüm hücre süspansiyonlarının 10 μL'sini tespit edin.
- Israrlı test plakasını (adım 4.3.3'te hazırlanmış) 37 °C'de bir yörünge çalkalayıcıda ve 250 rpm'de 6 saat boyunca, plakayı gaz geçirgen sızdırmazlık zarı ile kapladıktan sonra kuluçkaya yaslayın.
- Bir çalkalayıcıda 6 saat inkübasyondan sonra, kalıcı test plakasını çıkarın ve 4.3.4-4.3.5 adımlarını tekrarlayın.
- Agar plakalarını 37 °C'de 16 saat kuluçkaya yatırın ve ardından CFO'ları sayın. Antibiyotik tedavisinden önceki ve sonraki 6 h'lik CFU seviyeleri, her kuyuda kalıcı fraksiyonun hesaplanmasını sağlar. OFX tedavisinden önce CFU sayar, osmolitlerin ve E. coli canlılığının etkilerini değerlendirmeye de yardımcıdır.
5. Belirlenen koşulların doğrulanmıştır
- Üstel faz hücrelerinin 250 μL'lik kısmını mikroarray taramasından tanımlanan ozmolit içeren taze modifiye LB ortamının Adım 2,3 ila 25 mL'sine aktarın (bkz. Protokol 4).
- Şişeyi 250 rpm ve 37 °C'de 24 saat boyunca bir yörünge çalkalayıcıda kuluçkaya yatırın.
- 24 saat sonra şişeyi çalkalayıcıdan çıkarın ve hücre kültürünün 250 μL'lik kısmını 250 mL'lik şaşkın bir şişede 25 mL taze modifiye LB ortamına aktarın.
- Hücre süspansiyonu içine 25 μL OFX stok çözeltisi (5 mg/mL) ekleyin ve tahlil kültürünü homojen hale getirmek için şişeyi hafifçe sallayın. Şişeyi 37 °C ve 250 rpm'de bir çalkalayıcıda kuluçkaya yatırın.
- Tedavi sırasında her saat, test kültürünün 1 mL'lik kısmını şişeden 1,5 mL mikrosantrifüj tüpüne aktarın.
- 3 dakika boyunca 17.000 x g'da mikrosantrifüj tüpündeki test kültürünü santrifüj edin.
- 950 μL süpernatant çıkarın ve 950 μL PBS ekleyin.
- 3x için 5.6 ve 5.7 yıkama adımlarını tekrarlayın.
- Son yıkamadan sonra, hücre peletini 100 μL PBS çözeltisinde yeniden kullanın.
- Hücre süspansiyonunun 10 μL'sini alın ve 96 kuyu yuvarlak alt plaka kullanarak 90 μL PBS çözeltisinde 6x'i seri olarak seyreltin.
- Seyreltilmiş hücre süspansiyonlarının 10 μL'sini antibiyotiksiz taze bir agar plakasında tespit edin. Algılama sınırını artırmak için, kalan 90 μL hücre süspansiyonu taze bir agar plakasına plakalayın.
- Agar plakasını 37 °C'de 16 saat kuluçkaya yatırın ve ardından CFO'ları sayın.
Sonuçlar
Şekil 1 deneysel protokolümüzü açıklar. Seyreltme/büyüme döngüsü deneyleri (bkz. Protokol 2), keren ve ark.5 tarafından gece kültürlerinden kaynaklanan kalıcıları ortadan kaldırmak için yapılan bir çalışmadan uyarlanmıştır. Şekil 2A, OFX tedavisinden önce ve sonra hücre kültürlerinin CFU seviyelerini belirlemek için kullanılan agar plakalarının temsili bir görüntüsüdür. Bu deneylerde hücreler, adım 4.2'de açıklandığı gibi yarım alan 96 kuyu plakalarında osmolitler ile modifiye LB ortamında kültürlenmiştir. Plakayı 24 saat boyunca yörüngesel bir çalkalayıcıda inkübe ettikten sonra, kalıcı test genel bir düz alt 96 kuyu plakası kullanılarak gerçekleştirildi (bkz. adım 4.3). Burada test edilen osmolitler ve konsantrasyon, farklı konsantrasyonlarda çeşitli ozmolitler içerenPM-9plakasını kullanarak 4.1 ve 4.3 adımlarını gerçekleştirdiğimiz önceki çalışmamız 19 'a göre seçildi (sodyum klorür, potasyum klorür, sodyum sülfat, etilen glikol, sodyum format, üre, sodyum laktat, sodyum fosfat, sodyum benzoat, amonyum sülfat, sodyum nitrit ve sodyum nitrat). Şekil 2A'daki ilk sütun, denetim grubunun CFU sayılarını gösterir. İkinci sütun, hücrelerin 100 mM sodyum nitratta kültürlendiği bir durumu temsil eder; bu durumun daha önce kalıcı seviyeleri biraz artırdığıbulunmuştur 19. Üçüncü sütun, hücrelerin 60 mM sodyum nitrit içinde kültürlendiği bir durumu temsil eder ve bu durumun daha önce 19 kontrollerine kıyasla kalıcı seviyeleri önemli ölçüde azalttığıbulunmuştur. Şekil 2B, agar plakalarından elde edilen CFU verilerinin grafiksel bir gösterimidir. Şekil 2C, 96 kuyu plakasında test edilen hücre kültürlerinin kalıcı fraksiyonlarını göstermektedir. Fraksiyonları hesaplamak için, kalıcı sayımlar antibiyotik tedavilerinden önce elde edilen hücre sayılarına normalleştirildi. Şekil 3, şaşkın şişelerde gerçekleştirilen tahlil kültürleri için sırasıyla bifazik öldürme eğrilerini ve kalıcı fraksiyonları göstermektedir. Bu deneylerde, hücreler ilk olarak 25 mL modifiye LB ortamında 24 saat boyunca 250 mL şaşkın şişelerde belirtilen osmolitlerle kültürlendi ve daha sonra hücreler Protokol 5'te açıklandığı gibi kalıcı numaralandırma için persister-test şişelerine aktarıldı.
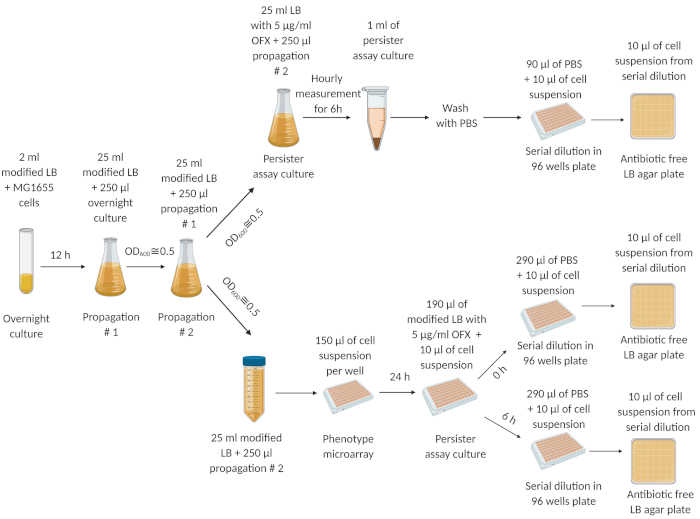
Şekil 1: Deneysel prosedür. Donmuş bir hücre stoğundan alınan hücreler bir gecede (12 saat) taze LB ortamında yetiştirildi. 12 saat içinde, geceleme kültürü 25 mL modifiye LB ortamında seyreltildi (1:100) ve OD600=0.5'e kadar yetiştirildi. Bu yayılma adımı iki kez tekrarlandı. Son yayılma adımından sonra, üstel faz hücreleri (OD600=0.5'te) sırasıyla 250 mL şaşkın bir şişe ve 50 mL santrifüj tüpünde taze modifiye LB ortamında seyreltildi (1:100). 250 mL şaşkın şişedeki hücre süspansiyonu, kalıcıları ölçmek için 5 μg / mL OFX ile tedavi edildi. 50 mL santrifüj tüpündeki hücre süspansiyonu mikroarraylara aktarıldı ve 250 rpm ve 37 °C'de bir yörünge çalkalayıcıda 24 saat kuluçkaya yatırıldı. Mikroarraylardan gelen hücreler daha sonra kalıcıları ölçmek için persister-test plakalarına aktarıldı. Bu rakam biorender.com kullanılarak oluşturulmuştur. Bu rakam önceki yayınımızdan değiştirilmiştir19. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: Mikroarray deneyleri. (A) Hücreler ilk olarak 24 saat boyunca yarım alan 96 kuyu plakasında belirtilen osmolitler ile veya belirtilmeden modifiye LB ortamında yetiştirildi. Hücreler daha sonra genel bir düz tabanlı 96 kuyu plakasına aktarıldı ve 6 saat boyunca 5 μg / mL OFX ile tedavi edildi. 6 saat işlemden önce ve sonra, hücreler PBS'de seri olarak seyreltildi, agar plakalarına kaplandı ve 16 saat boyunca 37 °C'de kuluçkaya yatırıldı. Her koşulun 8 teknik çoğaltması vardır. (B) Osmolitlerin hücre canlılığı ve kalıcılığı üzerindeki etkilerini değerlendirmek için sırasıyla CFU ölçümleri yapıldı. Düz çizgi algılama sınırını gösterir (600 CFO). (C) Grafik, OFX tedavisinden sonra ve öncesinde CFU sayımlarının oranı alınarak hesaplanan hücre kültürlerinin kalıcı fraksiyonlarını temsil eder. 60 mM sodyum nitrite sahip hücre kültürünün kalıcı fraksiyonu, kalıcı düzeyi algılama sınırının altında olduğu için hesaplanmamıştır. Her veri noktası, ortalama değer ± standart sapma ile gösterilir ve 8 teknik yinelemeden hesaplanır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
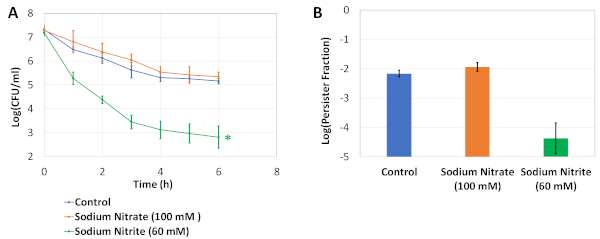
Şekil 3: Doğrulama denemeleri. (A) Üstel fazlı hücreler, 250 mL şaşkın şişelerde belirtilen osmolitlerle 25 mL taze modifiye LB ortamına aktarıldı ve 24 saat kültüre edildi. Daha sonra, hücreler 25 mL modifiye LB ortamı içeren 250 mL şaşkın şişelerde seyreltildi (1:100) ve 6 saat boyunca 5 μg / mL OFX ile tedavi edildi. Tahlil kültürlerindeki CFU sayıları bifazik öldürme eğrileri oluşturmak için saatlik olarak izlendi. * Osmolyte olmayan kontrollere kıyasla OFX kalıcı düzeylerini önemli ölçüde etkileyen durumu gösterir (iki kuyruklu eşit olmayan fark t testi, s<0.05). (B) Grafik, kültürlerin kalıcı kesirlerini temsil eder. Her veri noktası, ortalama değer ± standart sapma ile 3 biyolojik yinelemeden hesaplanan şekilde gösterilmiştir. Bu rakam önceki yayınımızdan değiştirilmiştir19. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Burada açıklanan yüksek verim kalıcı tahlili, çeşitli kimyasalların E. coli kalıcılığı üzerindeki etkilerini ortaya çıkarmak için geliştirilmiştir. Ticari PM plakalarına ek olarak, mikroarraylar adım 4.2'de açıklandığı gibi manuel olarak inşa edilebilir. Ayrıca, burada sunulan protokol esnektir ve 96 kuyu plakası formatında olan ilaç panelleri ve hücre kütüphaneleri gibi diğer mikroarrayları taramak için kullanılabilir. Büyüme evresi, aşılama oranı ve ortam dahil olmak üzere deneysel koşullar bu kütüphaneleri test etmek için ayarlanabilir. Örneğin, Keio E. coli nakavt koleksiyonu23gibi bir hücre kütüphanesini taramak istiyorsanız, ilk olarak çok kanallı bir pipet kullanarak kütüphanedeki suşları taze medya içeren 96 kuyu plakasına aktarabilirler. Hücreler istenen büyüme aşamasına (örneğin, üstel veya sabit faz) ulaştığında, hücreler daha sonra nakavt suşlarının kalıcı seviyelerini numaralandırmak için 4.3 adımında açıklandığı gibi kalıcı test plakalarına aktarılır. Benzer şekilde, bu strateji, antibiyotiklerle etkinleştirilen organizatörleri tanımlamak için E. coli Promoter collection24'ü (96 kuyu plakası formatında floresan muhabir suşları kütüphanesi) taramak için kullanılabilir. Bu organizatörler, antibiyotik tedavisi sırasında kalıcı test plakalarındaki suşların floresan sinyallerini ölçerek kolayca tespit edilebilir.
Deneylerimizde, mikroarrayların zaten çeşitli ozmolitlere sahip olduğunu göz önünde bulundurarak, NaCl'den kaynaklanabilecek herhangi bir ek etkiyi önlemek için değiştirilmiş bir LB (NaCl eksikliği) kullandık. Normal LB ortamındaki NaCl'in hücrelerin zar bütünlüğünü korumak için iyi olduğu bilinmesine rağmen, % 0-1 aralığındaki NaCl'in hücre büyümesi üzerinde minimum etkisi olduğu bildirilmiştir25. Ayrıca, önceki çalışmamızda propidium iyodür (PI) lekeleme ve kalıcı testlerden elde edilen sonuçlar, NaCl'in yokluğunun membran bütünlüğünü ve E. coli hücrelerinin kalıcılığını önemli ölçüde etkilemediğini göstermiştir19. Bu değişiklik özellikle çalışmamızdaki endişeleri gidermek için yapılmıştır ve araştırmanın niteliğine göre değiştirilebilir.
Ayrıca keren ve ark.5 tarafından geliştirilen bir yöntemi, mikroarraylara aşılamadan önce hücre kültürlerimizde önceden var olan kalıcıları ortadan kaldırmak için uyarladık. Tip I kalıcılarının sabit faz sırasında oluşturulduğu bilinmektedir; bu nedenle, hücrelerin gece kültürlerinden mikroarray plakalarına doğrudan aşılanmaları, osmolitlerin etkilerini engelleyebilecek önemli sayıda kalıcıyı aktaracaktır. Seyreltme/ büyüme döngüsü deneyleri ile (bkz. Protokol 2), gece kültürlerinden kaynaklanan bu önceden var olan kalıcıları önemli ölçüde azaltabildik19. Mikroarray plakalarındaki hücreleri 24 saat boyunca, osmolitlerin varlığında sabit faz sırasında oluşan tip I varyantları da dahil olmak üzere tüm kalıcıları sayabilmek için kültüre ettiğimizi not ediyoruz. Ancak, bu uyarlanmış teknikler çalışmanın niteliğine bağlı olarak her zaman değiştirilebilir.
Kalıcıları numaralandırmak için hücreleri mikroarraylarda 5 μg/mL OFX ile tedavi ettik. Antibiyotiği 96 numuneden çıkarmak için yıkama prosedürü çok emek yoğun olacağından, tedaviden sonraki hücreler pbs'de yıkamadan seri olarak seyreltildi (bkz. adım 4.2). Bu prosedür OFX konsantrasyonu 30 kat daha fazla seyreltildi. Seyreltilmiş hücre süspansiyonları daha sonra OFX'in daha da dağıldığı antibiyotik içermeyen agar plakalarına kaplandı. Bu deneyleri yıkamadan ve yıkamadan tekrarladığımız ön çalışmalarımız, bu seri seyreltme yönteminin kalıcı seviyeleri etkilemediğini doğruladı19.
96 kuyu plakasında çok kanallı pipetleme sırasında, homojen bir hücre dağılımını korumak için hücre süspansiyonlarını dikkatlice karıştırmak gerekir. Bunu yapmak için, çalışma hacmine bağlı olarak, çözümü homojen hale getirmek için gereken minimum pipetleme sayısını not etmek yararlı olacaktır. Bu amaçla, burada çalışılan koşullar altında PBS ve ortamda bir boya molekülünü dağıtarak pipetle (yukarı ve aşağı) izlediğimiz basit bir kontrol deneyi gerçekleştirdik. Ek olarak, pH tamponları gibi daha karmaşık ortamlarla çalışıyorsanız, hücre kültürü zaman içinde çok alkali (pH ≈ 8) olma eğiliminde olduğu için bir çalkalayıcıda inkübasyon öncesi ve sırasında hücre kültürünün pH'ını ölçmenizi öneririz. Bu, kullanılan tamponun kalitesinin yanı sıra pH aralığı hakkında da fikir verebilir. Ek olarak, yüksek verimli testlerden agar plakalarında sayısız CFO elde etmek için, mikroarrayları test etmeden önce hücre aşılama oranı, kültürlerin yaşı ve seri seyreltme parametreleri (PBS hacmi, seyreltme oranları ve seyreltme adımlarının sayısı vb.) gibi belirli koşullar optimize edilmelidir. Son olarak, mikroarraylardan elde edilen sonuçlar, kültürün hacmi, yüzey alanı ve 96 kuyu plakasındaki havalandırmanın gözlenen sonuçlar üzerinde ek etkileri olabileceği için şişelerde daha da doğrulanmalıdır.
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Orman Lab üyelerine bu çalışma sırasındaki değerli girdileri için teşekkür ederiz. Bu çalışma NIH/NIAID K22AI125468 kariyer geçiş ödülü ve Houston Üniversitesi başlangıç hibesi tarafından finanse edildi.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 14-ml test tube | Fisher Scientific | 14-959-1B | |
| E. coli strain MG1655 | Princeton University | Obtained from Brynildsen lab | |
| Flat-bottom 96-well plate | USA Scientific | 5665-5161 | |
| Gas permeable sealing membrane | VWR | 102097-058 | Sterilized by gamma irradiation and free of cytotoxins |
| Half-area flat-bottom 96-well plate | VWR | 82050-062 | |
| LB agar | Fisher Scientific | BP1425-2 | Molecular genetics grade |
| Ofloxacin salt | VWR | 103466-232 | HPLC ≥97.5 |
| Phenotype microarray (PM-9 and PM-10) | Biolog | N/A | PM-9 and PM-10 plates contained various osmolytes and buffers respectively |
| Round-bottom 96-well plate | USA Scientific | 5665-0161 | |
| Sodium chloride | Fisher Scientific | S271-500 | Certified ACS grade |
| Sodium nitrate | Fisher Scientific | AC424345000 | ACS reagent grade |
| Sodium nitrite | Fisher Scientific | AAA186680B | 98% purity |
| Square petri dish | Fisher Scientific | FB0875711A | |
| Tryptone | Fisher Scientific | BP1421-500 | Molecular genetics grade |
| Varioskan lux multi mode microplate reader | Thermo Fisher Scientific | VLBL00D0 | Used for optical density measurement at 600 nm |
| Yeast extract | Fisher Scientific | BP1422-100 | Molecular genetics grade |
Referanslar
- Lewis, K. Persister cells, dormancy and infectious disease. Nature Reviews Microbiology. 5 (1), 48-56 (2007).
- Hobby, G. L., Meyer, K., Chaffee, E. Observations on the Mechanism of Action of Penicillin. Experimental Biology and Medicine. 50 (2), 281-285 (1942).
- Bigger, J. Treatment of staphylococcal infections with penicillin by intermittent sterilisation. The Lancet. 244 (6320), 497-500 (1944).
- Balaban, N. Q., Merrin, J., Chait, R., Kowalik, L., Leibler, S. Bacterial persistence as a phenotypic switch. Science. 305 (5690), 1622-1625 (2004).
- Keren, I., Kaldalu, N., Spoering, A., Wang, Y., Lewis, K. Persister cells and tolerance to antimicrobials. FEMS Microbiology Letters. 230 (1), 13-18 (2004).
- Keren, I., Minami, S., Rubin, E., Lewis, K. Characterization and transcriptome analysis of mycobacterium tuberculosis persisters. mBio. 2 (3), (2011).
- Mulcahy, L. R., Burns, J. L., Lory, S., Lewis, K. Emergence of Pseudomonas aeruginosa Strains Producing High Levels of Persister Cells in Patients with Cystic Fibrosis. Journal of Bacteriology. 192 (23), 6191-6199 (2010).
- LaFleur, M. D., Kumamoto, C. A., Lewis, K. Candida albicans biofilms produce antifungal-tolerant persister cells. Antimicrobial Agents and Chemotherapy. 50 (11), 3839-3846 (2006).
- Allison, K. R., Brynildsen, M. P., Collins, J. J. Metabolite-enabled eradication of bacterial persisters by aminoglycosides. Nature. 473 (7346), 216-220 (2011).
- Lechner, S., Lewis, K., Bertram, R. Staphylococcus aureus persisters tolerant to bactericidal antibiotics. Journal of Molecular Microbiology and Biotechnology. 22 (4), 235-244 (2012).
- Barrett, T. C., Mok, W. W. K., Murawski, A. M., Brynildsen, M. P. Enhanced antibiotic resistance development from fluoroquinolone persisters after a single exposure to antibiotic. Nature Communications. 10 (1), 1177 (2019).
- Windels, E. M., et al. Bacterial persistence promotes the evolution of antibiotic resistance by increasing survival and mutation rates. ISME Journal. 13 (5), 1239-1251 (2019).
- Dörr, T., Lewis, K., Vulić, M. SOS response induces persistence to fluoroquinolones in Escherichia coli. PLoS Genetics. 5 (12), 1000760 (2009).
- Völzing, K. G., Brynildsen, M. P. Stationary-phase persisters to ofloxacin sustain DNA damage and require repair systems only during recovery. mBio. 6 (5), (2015).
- Grant, S. S., Kaufmann, B. B., Chand, N. S., Haseley, N., Hung, D. T. Eradication of bacterial persisters with antibiotic-generated hydroxyl radicals. Proceedings of the National Academy of Sciences. 109 (30), 12147-12152 (2012).
- Gerdes, K., Maisonneuve, E. Bacterial Persistence and Toxin-Antitoxin Loci. Annual Review of Microbiology. 66 (1), 103-123 (2012).
- Orman, M. A., Brynildsen, M. P. Inhibition of stationary phase respiration impairs persister formation in E. coli. Nature Communications. 6 (1), 7983 (2015).
- Korch, S. B., Henderson, T. A., Hill, T. M. Characterization of the hipA7 allele of Escherichia coli and evidence that high persistence is governed by (p)ppGpp synthesis. Molecular Microbiology. 50 (4), 1199-1213 (2003).
- Karki, P., Mohiuddin, S. G., Kavousi, P., Orman, M. A. Investigating the effects of osmolytes and environmental ph on bacterial persisters. Antimicrobial Agents and Chemotherapy. 64 (5), 02393 (2020).
- Mohiuddin, S. G., Hoang, T., Saba, A., Karki, P., Orman, M. A. Identifying Metabolic Inhibitors to Reduce Bacterial Persistence. Frontiers in Microbiology. 11, 472 (2020).
- Brooun, A., Liu, S., Lewis, K. A dose-response study of antibiotic resistance in Pseudomonas aeruginosa biofilms. Antimicrobial Agents and Chemotherapy. 44 (3), 640-646 (2000).
- Luidalepp, H., Jõers, A., Kaldalu, N., Tenson, T. Age of inoculum strongly influences persister frequency and can mask effects of mutations implicated in altered persistence. Journal of Bacteriology. 193 (14), 3598-3605 (2011).
- Baba, T., et al. Construction of Escherichia coli K-12 in-frame, single-gene knockout mutants: The Keio collection. Molecular Systems Biology. 2, 0008 (2006).
- Zaslaver, A., et al. A comprehensive library of fluorescent transcriptional reporters for Escherichia coli. Nature Methods. 3 (8), 623-628 (2006).
- Hajmeer, M., Ceylan, E., Marsden, J. L., Fung, D. Y. C. Impact of sodium chloride on Escherichia coli O157:H7 and Staphylococcus aureus analysed using transmission electron microscopy. Food Microbiology. 23 (5), 446-452 (2006).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır